Method Article
Cuantificación de la citotoxicidad de Staphyloccus aureus contra leucocitos polimorfonucleares humanos
En este artículo
Resumen
Este protocolo describe un método para la purificación de leucocitos polimorfonucleares de sangre humana entera y dos ensayos distintos que cuantifican la citotoxicidad de Staphylococcus aureus contra estas importantes células inmunitarias innatas.
Resumen
Staphylococcus aureus es capaz de secretar una amplia gama de leucocicinas que apuntan y perturban la integridad de la membrana de los leucocitos polimorfonucleares (PMN o neutrófilos). Este protocolo describe tanto la purificación de las PMN humanas como la cuantificación de S. aureus cytotoxicity contra las PMN en tres secciones diferentes. La Sección 1 detalla el aislamiento de las PMN y el suero de la sangre humana utilizando centrifugación de densidad. La sección 2 prueba la citotoxicidad de las proteínas extracelulares producidas por S. aureus contra estas PMN humanas purificadas. Estos procedimientos miden la interrupción de la integridad de la membrana plasmática de PMN por Parte de S. aureus leukocidins mediante el análisis de citometría de flujo de PMN tratadas con yoduro propidium, un fluoróforo de unión al ADN que es impermeable a la membrana celular. En conjunto, estos métodos tienen la ventaja de probar rápidamente S. aureus cytotoxicity contra las PMN humanas primarias y se pueden adaptar fácilmente para estudiar otros aspectos de las interacciones huésped-patógeno.
Introducción
Staphylococcus aureus es una bacteria Gram-positiva que causa un amplio espectro de enfermedades en los seres humanos. Este patógeno prominente produce numerosos factores de virulencia que contribuyen a diferentes aspectos de la infección. Estas incluyen moléculas superficiales que permiten a S. aureus adherirse a diferentes tipos de tejido huésped1, proteínas extracelulares que interfieren con la respuesta inmune del huésped2,y una serie de toxinas secretadas que se dirigen a diferentes tipos de células huésped3. En este informe, describimos un método que cuantifica la citotoxicidad de las proteínas extracelulares producidas por S. aureus contra leucocitos polimorfonucleares humanos (PMN o neutrófilos), células efectoras primarias de la respuesta inmune innata del huésped.
Las PMN son los leucocitos más abundantes en los mamíferos. Estas células inmunitarias circulantes se reclutan rápidamente en el sitio del insulto del tejido huésped en respuesta a las señales de peligro producidas por células residentes o por compuestos exclusivos de los microbios invasores. La entrada extracelular de estas moléculas y de los contactos directos con las células huésped residentes activadas durante la extravasación aumentan el estado de activación de las PMN en un proceso conocido como cebado4,5. Las PMN preparadas que han alcanzado tejido en dificultades ejecutan respuestas inmunitarias innatas importantes diseñadas para prevenir el establecimiento de una infección. Estos incluyen la unión e internalización, o fagocitosis, de microorganismos invasores que desencadena nacones de eventos intracelulares que se acumulan en la destrucción de microbios por una batería de potentes compuestos antimicrobianos5.
Las PMN desempeñan un papel esencial protegiendo a los seres humanos de los patógenos invasores y son particularmente importantes para prevenir la infección por S. aureus 4. Sin embargo, esta bacteria produce una amplia gama de genes de virulencia que impiden diferentes funciones de PMN. Estos incluyen proteínas extracelulares que bloquean el reconocimiento de moléculas de señalización, previenen la adhesión al tejido huésped, inhiben la producción de compuestos antimicrobianos y comprometen la integridad de la membrana plasmática4. S. aureus orquesta la expresión temporal de estos genes de virulencia a través de la entrada colectiva de múltiples sistemas sensoriales de dos componentes que reconocen señales ambientales específicas. El sistema de dos componentes SaeR/S es un importante regulador de la transcripción del gen S. aureus virulence durante la infección6,7,8,9,10,11. En particular, se ha demostrado que este sistema de dos componentes es crítico para la producción de leucocidinas bicomponentes que se dirigen específicamente a las PMN humanas12.
Este protocolo se divide en tres secciones diferentes. La primera sección describe la purificación de las PMN a partir de la sangre humana utilizando una centrifugación de gradiente de densidad utilizando un protocolo que ha sido adaptado de los métodos establecidos por el b-yum13 y el Nauseef14. La segunda y tercera secciones detallan dos técnicas diferentes para examinar la citotoxicidad de S. aureus; uno intoxica las PMN con proteínas extracelulares producidas por S. aureus mientras que la otra examina la capacidad de las bacterias vivas para dañar las PMN después de la fagocitosis. Estos procedimientos utilizan yoduro de propidium para medir la pérdida de integridad de la membrana plasmática PMN causada por toxinas formadoras de poros De S. aureus. El yoduro de Propidium es un fluoróforo que une el ADN y que normalmente es impermeable a la membrana celular, pero que puede cruzar membranas plasmáticas que han sido interrumpidas por toxinas S. aureus. El análisis de citometría de flujo permite la cuantificación rápida de las PMN positivas por yoduro propidium para medir la citotoxicidad relativa de las cepas de S. aureus. S. aureus resistente a la meticilina (MRSA) identificado como electroforesis de gel de campo pulsado tipo USA300 y un mutante de eliminación isogénica de saeR/S en esta cepa (USA300saeR/S)se han utilizado como modelos para demostrar cómo estos procedimientos pueden cuantificar la citotoxicidad de S. aureus contra LAS PMN humanas.
Protocolo
La sangre venosa heparinizada de donantes sanos fue recolectada de acuerdo con el protocolo aprobado por la Junta de Revisión Institucional para Sujetos Humanos de la Universidad Estatal de Montana. Todos los donantes disponía de su consentimiento por escrito para participar en este estudio.
1. Purificación de leucocitos polimorfonucleares humanos y aislamiento del suero humano
NOTA: Todos los reactivos deben comprobarse rutinariamente para detectar la presencia de endotoxina utilizando un kit de detección de endotoxinas disponible en el mercado y deben contener <25,0 pg/ml de endotoxina para evitar el cebado no deseado de las PMN.
- Traer 50 ml de 3% dextran-0.9% NaCl (p/v), 35 mL de 0.9% NaCl (p/v), 20 mL de 1.8% NaCl (p/v), 12 mL de solución degradada de densidad de 1.077 g/mL y 20 ml de agua inyectable o de riego a temperatura ambiente.
- Para aislar el suero humano, incubar 4 ml de sangre humana recién extraída sin anticoagulante a 37 oC en un tubo de vidrio de 15 ml durante 30 min. Después de la incubación, la muestra de centrífuga a 2.000–3.000 ág durante 10 min a temperatura ambiente. Transfiera la capa sérica superior a un tubo de centrífuga cónico fresco de 15 ml y colóquela sobre hielo.
- Combinar 25 ml de sangre humana entera heparinizada recién dibujada (1000 unidades/ml) con 25 ml de temperatura ambiente 3% dextran-0.9% NaCl (1:1 relación) en dos tubos de centrífuga cónicos de 50 ml de réplica (50 ml de volumen total por tubo). Mezcle balanceando suavemente cada tubo cónico de 50 ml y luego deje reposar a temperatura ambiente durante 30 min.
- Después de la incubación a temperatura ambiente, aparecerán dos capas separadas. Transfiera la capa superior de cada mezcla de sangre de descomunal en nuevos tubos cónicos de 50 ml y centrífuga a 450 x g durante 10 minutos a temperatura ambiente con frenos bajos o sin frenos.
- Aspirar cuidadosamente ambos sobrenantes y desechar sin molestar los pellets celulares. Resuspenda suavemente cada pellet celular en 2 ml de temperatura ambiente 0.9% NaCl, combine los pellets resuspendidos en un solo tubo cónico de 50 ml, luego agregue el 0.9% restante NaCl (volumen final de 35 ml).
- Subya cuidadosamente 10 ml de temperatura ambiente de 1.077 g/ml de solución degradada de densidad debajo de la suspensión celular utilizando una pipeta de mano. Gire a 450 x g durante 30 min a temperatura ambiente con frenos bajos o sin frenos. Aspirar suavemente el sobrenadante sin molestar el pellet celular. Supernadant contendrá células mononucleares de sangre periférica que se pueden recolectar como se describió anteriormente14.
- Lisiar los glóbulos rojos mediante la reanimación del pellet celular en 20 ml de agua a temperatura ambiente. Mezcle suavemente meciendo el tubo durante 30 s. La lisis de los glóbulos rojos irá acompañada de una clara disminución de la turbidez.
- Añadir inmediatamente 20 ml de 1,8% de NaCl (a temperatura ambiente [RT]) y la muestra de centrífuga a 450 og durante 10 min a temperatura ambiente.
NOTA: Es importante minimizar el tiempo que las PMN se dejan solos en agua después de la lisis de glóbulos rojos para maximizar el rendimiento de la PMN y prevenir la lisis y/o activación de la PMN. - Aspirar cuidadosamente el sobrenadante sin molestar el pellet celular. Resuspenda suavemente el pellet celular en 2 ml de RT RPMI 1640 mediano y colóquelo sobre hielo.
- Cuente las células usando un hemocaquítómetro. Resuspenda las PMN purificadas a una concentración de 1 x 107 células/ml con RPMI helada y manténgalas en hielo.
- Combine 100 l de PMN purificadas (1 x 106 células) con 300 l de solución salina con fosfato (DPBS) de Dulbecco en frío y helado que contiene 1 l de mancha de yoduro de propidio en dos tubos de citometría de flujo de réplica. Para un control positivo para el daño de la membrana plasmática, agregue 40 ml de solución de Triton X-100 al 0,5% en uno de los tubos de citometría de flujo y mezcle bien.
- Utilice la citometría de flujo para medir la dispersión hacia adelante, la dispersión lateral y la tinción de yoduro propidium (excitación/emisión máxima a 535/617 nm) de células purificadas(Figura 1).
NOTA: El análisis de dispersión hacia adelante y hacia adelante identificará poblaciones no deseadas de linfocitos y monocitos. No se deben utilizar células de yoduro de propidium con una membrana plasmática comprometida y PMN purificadas que hayan pronunciado poblaciones de células positivas de yoduro propidium. Para estos estudios, las PMN purificadas sólo se utilizaron si comprendieron >98% de las células purificadas y <5% manchadas positivas para yoduro propidio. - Preparar una placa de 96 pocillos para ensayos de citotoxicidad pmN mediante el recubrimiento de pozos individuales que se utilizarán en este ensayo con 100 s de suero humano aislado al 20% que se ha diluido con DPBS.
NOTA: La chapación de PMN directamente sobre plástico o vidrio provocará la activación de las células. Asegúrese de incluir al menos un pozo de control negativo que solo recibirá medios y al menos un pozo de control positivo que recibirá 0.05% Triton X-100. - Incubar la placa a 37oC durante 30 min. Después de la incubación, lave los pozos recubiertos dos veces con DPBS helado para eliminar cualquier exceso de suero. Toque suavemente la placa boca abajo para eliminar cualquier DPBS residual y colocarla sobre hielo.
- Agregue suavemente 100 l de PMN humanas purificadas a 1 x 107 celdas/ml a cada pozo recubierto (1 x 106 PMN/pozo). Permita que las PMN se asienten en pozos incubando la placa en hielo durante al menos 5 minutos. Mantener el nivel de la placa para permitir una distribución uniforme de las células en cada pozo y dejar en hielo para evitar la activación no deseada de las PMN.
2. Ensayo citotoxicidad de proteínas extracelulares de S. aureus contra leucocitos polimorfonucleares humanos
- Cultivo S. aureus durante la noche en caldo de soja tríptico (TSB) utilizando una incubadora de agitación a 37oC. Para estos estudios, se inocularon 20 ml de TSB en frascos erlenmeyer separados de 150 ml con cultivos congelados de cepas de S. aureus USA300 o USA300 oSaeR/S y se cultivaron durante aproximadamente 14 horas con temblores a 250 rpm.
- Subcultura S. aureus mediante la realización de una dilución 1:100 del cultivo bacteriano durante la noche con medios frescos. Incubar a 37 oC con temblores hasta que las bacterias lleguen a la fase de crecimiento estacionario temprano.
NOTA: Para estos experimentos, se inocularon 20 ml de caldo de soja tríptico en frascos Erlenmeyer de 150 ml con 200 ml de US300 osaeR/S cultivados durante la noche y se incubaron a 37 oC con temblores a 250 rpm durante 5 h. - Cuando las bacterias hayan alcanzado la fase de crecimiento estacionario temprano, transfiera 1 ml de S. aureus subcultivo a un tubo de microcentrífuga de 1,5 ml y centrífuga a 5.000 g durante 5 minutos a temperatura ambiente.
- Después de la centrifugación, transfiera el sobrenadante a una jeringa de 3 ml. Pasar los supernatantes a través de un filtro de 0,22 m y en un nuevo tubo de microcentrífuga de 1,5 ml sobre hielo.
- Realizar diluciones en serie de supernatantes con medios helados utilizados para la cultura S. aureus.
NOTA: Para los experimentos mostrados, los supernatantes de USA300 y USA300saeR/S se sometieron a cuatro diluciones consecutivas de 1/2 log con TSB helado. - Agregue suavemente muestras de sobrenadantes o medios solo (para controles negativos y positivos) a pozos individuales de placa de 96 pocillos que contienen PMN en hielo del paso 1.15. Para estos experimentos, se añadieron 10 oL de usa300 o muestras de supernadantessaeR/S usa300 o USA300. Plato de roca suave para distribuir los sobrenatantes en los pocillos e incubar a 37oC.
- En los momentos deseados, retire la placa de la incubadora y colóquela sobre hielo. Añadir 40 l de 0,5% De Tritón X-100 al pozo de control positivo.
- Pipetear suavemente las muestras hacia arriba y hacia abajo en cada pozo para extraer completamente todas las PMN adheridas a la placa, luego transfiera las muestras a tubos de citometría de flujo sobre hielo que contengan 300 ml de DPBS helado con 1 l de yoduro de propidum.
- Mida la proporción de PMN positivos con yoduro propidium utilizando citometría de flujo(Figura 2A). Cuando se une al ADN, el yoduro propidium tiene excitación/emisión a 535/617 nm.
3. Ensayo de citotoxicidad de S. aureus contra leucocitos polimorfonucleares humanos después de la fagocitosis
NOTA: Las curvas de crecimiento definidas por la densidad óptica a 600 nm (OD600)y la concentración de bacterias deben determinarse empíricamente para que las cepas de S. aureus se prueben antes de comenzar este ensayo. El éxito de estos experimentos requiere la cosecha constante de concentraciones iguales de cada cepa de S. aureus probada a mediados de la fase de crecimiento exponencial utilizando la OD600 de bacterias subcultivadas.
- Comience los cultivos nocturnos de cepas de S. aureus y bacterias subcultivos como se describe en los pasos 2.1.1 y 2.1.2.
- Cosecha subcultivada S. aureus cuando ha alcanzado un crecimiento medio exponencial mediante la transferencia de 1 ml de bacterias cultivadas a un tubo de microcentrífuga de 1,5 ml y centrifugación a 5.000 o g durante 5 minutos a temperatura ambiente.
NOTA: Bajo nuestras condiciones de crecimiento, USA300 y USA300saeR/S alcanzaron la fase de crecimiento medio exponencial después de aproximadamente 135 minutos de incubación6. - Lavar S. aureus después de la centrifugación mediante la aspiración del sobrenadante, resuspending las bacterias peletadas en 1 mL de DPBS, vórtice la muestra durante 30 s, y centrifugación a 5.000 á g durante 5 min a temperatura ambiente.
- Opsonize S. aureus mediante la reposición del pellet bacteriano en 1 ml de suero humano 20% diluido con DPBS e incubando a 37oC con agitación durante 15 min.
- Centrifugar bacterias opsonizadas a 5.000 x g durante 5 minutos a temperatura ambiente. Lave S. aureus después de la centrifugación aspirando el sobrenadante, resuspendingndo las bacterias peletizadas en 1 mL DPBS, luego vórtice la muestra hasta que el pellet bacteriano se rompa completamente más 30 segundos adicionales. Células centrífugas a 5.000 oG durante 5 min a temperatura ambiente.
- Resuspenda las cepas opsonizadas de S. aureus en 1 ml de RPMI, vórtice la muestra hasta que el pellet bacteriano se rompa por completo, y luego para otros 30 s. Colocar bacterias sobre hielo.
- Diluir las cepas opsonizadas de S. aureus a la concentración deseada con RPMI helada. Vórtice para 30 s y colocar sobre hielo.
- Confirmar la concentración de S. aureus inactivado mediante la chapado 1:10 diluciones en serie de bacterias en el agar de soja tríptico.
NOTA: Debido a que las diferencias en la concentración de bacterias utilizadas en este ensayo pueden tener un impacto importante en la permeabilidad posterior de la membrana plasmática PMN(Figura 3A),es muy importante que la concentración de cada cepa probada se determine para cada experimento y sea equivalente entre cepas. - Agregue suavemente 100 l/bien de cada cepa de S. aureus o RPMI (para controles positivos y negativos) a las PMN en la placa de 96 pocillos sobre hielo del paso 1.14. Plato de roca suave para distribuir S. aureus en pozos.
- Sincronizar la fagocitosis centrifugando la placa a 500 og durante 8 min a 4oC15. Incubar la placa a 37oC inmediatamente después de la centrifugación (T a 0).
- En los momentos deseados, retire la placa de la incubadora y colóquela sobre hielo. Añadir 40 l de 0,5% De Tritón X-100 al pozo de control positivo.
- Pipetear suavemente las muestras hacia arriba y hacia abajo en cada poca para extraer completamente todas las PMN adheridas a la placa, luego transfiera las muestras a tubos de citometría de flujo sobre hielo que contengan 200 ml de DPBS helado con 1 l de yoduro de propidum.
- Analizar las muestras para la tinción de yoduro propidium utilizando citometría de flujo como se describe en el paso 2.9.
Resultados
Hemos demostrado cómo los procedimientos descritos anteriormente se pueden utilizar para cuantificar relativamente la citotoxicidad de S. aureus contra las PMN humanas utilizando MRSA PFGE-tipo USA300 y un mutante de eliminación isogénica de saeR/S en esta cepa (USA300saeR/S) generada en estudios anteriores6. Las PMN aisladas mediante los procedimientos descritos en la sección 1 de este protocolo se teñiron con yoduro de propidium y se examinaron mediante citometría de flujo. Las gráficas de dispersión hacia delante y hacia los lados se utilizaron para ilustrar la contaminación de las PMN purificadas por monocitos o linfocitos(Figura 1A,B)y se determinó la integridad de la PMN utilizando la tinción de yoduro propidium(Figura 1C). El método descrito de purificación de PMN humano puede producir consistentemente 0.5 x 107 a 1 x 108 PMNque son >98% puros y son >95% propidium yoduro negativo.
La citotoxicidad de las proteínas extracelulares producidas por USA300 y USA300saeR/S se probó con las PMN purificadas(Figura 2) siguiendo los procedimientos descritos en la sección 2 de este protocolo. Estos experimentos demuestran un aumento dependiente de la concentración en la tinción de yoduro propidium de PMN purificadas después de 30 min de intoxicación con proteínas extracelulares producidas por USA300(Figura 2B). Estudios anteriores han demostrado que el sistema de dos componentes SaeR/S es importante para la expresión de numerosas leucocidinas bicomponentes que se dirigen a las PMN humanas6,10,11,16. Congruente con estos hallazgos anteriores, se detectaron muy pocas PMN con yoduro positivo propidum tras la exposición a proteínas extracelulares producidas por USA300saeR/S (Figura 2B). Otros experimentos demostraron un aumento constante en la proporción de PMN lysed después de la intoxicación por USA300 proteínas extracelulares que se estancaban después de aproximadamente 30 min(Figura 2C). La lisis mínima de las PMN humanas se observó en todos los puntos de tiempo después de la exposición a proteínas extracelulares producidas por USA300saeR/S. Estos resultados ilustran la utilidad de este ensayo para la cuantificación relativa de la citotoxicidad mediante proteínas extracelulares S. aureus contra las PMN humanas.
Probamos USA300 y USA300saeR/S utilizando el ensayo de citotoxicidad de S. aureus contra PMN humanos después de la fagocitosis que se describe en la sección 3 de este protocolo (Figura 3). Se observó un aumento dependiente de la concentración en la proporción de PMN positivas de yoduro propidium 90 min después de la fagocitosis de USA300(Figura 3A). Se observó una disminución significativa en la proporción de PMN que fueron dio positivo yoduro de propidium después de la fagocitosis de USA300saeR/S (Figura 3A),apoyando otros resultados que indican que el sistema de dos componentes SaeR/S es importante para la citotoxicidad de S. aureus contra las PMN humanas(Figura 2)7,11. Como se mencionó y demostró anteriormente en la Figura 3A, las diferencias en la concentración de S. aureus tienen un impacto pronunciado en la lisis PMN después de la fagocitosis. La enumeración del inóculo desaeR/S USA300 y USA300, utilizado en cada uno de estos experimentos, demostró que el contraste en citotoxicidad entre estas cepas no se debía a diferencias en la concentración de bacterias utilizadas(Figura 3B). Estos hallazgos muestran cómo el ensayo de citotoxicidad de S. aureus contra PMN humanos después de la fagocitosis se puede utilizar para evaluar la capacidad de diferentes cepas de S. aureus para comprometer la integridad de la membrana plasmática de PMN humana.

Figura 1: Análisis de citometría de flujo de PMN purificados. Gráficas representativas de puntos de citometría de flujo de (A) PMN humanas purificadas y(B)PMN que han sido contaminadas intencionalmente con células mononucleares de sangre periférica. (C) Histograma representativo de citometría de flujo que demuestra la tinción mínima de yoduro propidium (<1%) de PMN purificados (gris sombreado) en comparación con las PMN tratadas con 0.05% Triton X-100 (rojo sombreado). Haga clic aquí para ver una versión más grande de esta figura.
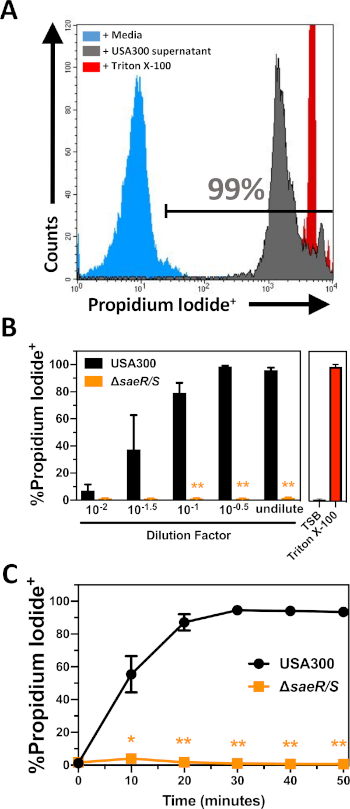
Figura 2: Análisis de citometría de flujo de PMN intoxicado con proteínas extracelulares producidas por S. aureus. (A) Histograma representativo de citometría de flujo de PMN manchado con yoduro propidium después de 30 minutos de incubación con control de medios (azul sombreado), sobrenadante USA300 filtrado a una concentración final de 1:110 (gris sombreado), o 0,05% Triton X-100 (rojo sombreado). (B) La proporción de PMN positivos de yoduro de propidium después de 30 min de incubación con diferentes concentraciones de supernatantes USA300 o USA300ssaeR/S. (C) La proporción de PMN positivos de yoduro de propidium a lo largo del tiempo después de la incubación con EL sobrenadante USA300 o USA300 o USA300o SaeR/S en una concentración final de 1:110. Los datos se presentan como medias de SEM de al menos 3 experimentos separados con * p a 0,05 y ** p a 0,005 según lo determinado por la prueba t de dos colas. Haga clic aquí para ver una versión más grande de esta figura.
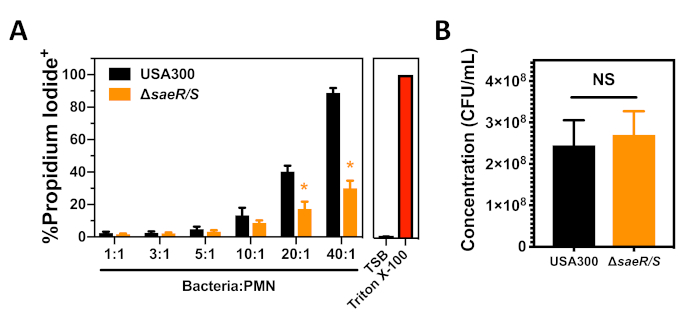
Figura 3: Análisis de citometría de flujo de PMN después de fagocitosis de S. aureus. (A) La proporción de PMN positivas de yoduro de propidium 90 min después de la fagocitosis de diferentes concentraciones de USA300 o USA300saeR/S. (B) Concentración de cepas opsonizadas de S. aureus utilizadas para los experimentos mostrados en el panel A. Los datos se presentan como media sSE de 4 experimentos separados con * p - 0.01 según lo determinado por dos t-test. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe la purificación de pmNs de sangre humana y dos ensayos distintos que utilizan yoduro propidium para cuantificar la citotoxicidad de S. aureus contra estas importantes células inmunitarias innatas. El éxito de estos procedimientos dependerá de la calidad de las PMN purificadas y de la preparación adecuada de S. aureus y proteínas extracelulares producidas por este patógeno. Para el aislamiento de PMN, es importante minimizar la activación de la PMN durante y después de la purificación mediante el uso de reactivos libres de contaminación por endotoxinas, el tratamiento suave de las preparaciones celulares y el mantenimiento de las células a la temperatura adecuada. Los signos que indican la activación de las PMN incluyen aglutinamiento de células durante la purificación y cuando más del 5% de las células aisladas manchan positivo para el yoduro de propidium. Debido a la vida relativamente corta de las PMN, estas células deben aislarse de la sangre humana y analizarse en el mismo día. Las PMN comenzarán a mostrar signos de apoptosis espontánea si se dejan en hielo durante más de 3 horas después de la purificación. Como se mencionó anteriormente, es muy importante que cada preparación de PMN se evalúe cuidadosamente mediante el análisis de citometría de flujo de dispersión hacia adelante y lateral, así como la tinción de yoduro propidium para garantizar la pureza e integridad de las células aisladas.
La expresión de leucocicidas bicomponente por S. aureus es responsable de la mayoría de la integridad comprometida de la membrana plasmática PMN que se observa utilizando los ensayos descritos en este protocolo. Variación en la expresión de estas toxinas y otros péptidos formadores de poros, como las modulinas solubles en fenol, entre cepas de S. aureus producirá diferencias en la citotoxicidad contra las PMN humanas. Además, la relación entre S. aureus y PMN en los ensayos de fagocitosis tiene un impacto importante en la permeabilidad posterior de la membrana plasmática de PMN(Figura 3A)y estos experimentos requieren la cosecha constante de concentraciones iguales de cada cepa de S. aureus probada a mitad de la fase de crecimiento exponencial utilizando laDo6 600 de bacterias subcultivadas. Teniendo en cuenta estas consideraciones, es muy importante definir las curvas de crecimiento para todas las cepas que se examinarán antes de iniciar los ensayos de citotoxicidad. No recomendamos estos métodos para analizar S. aureus cytotoxicity con cepas que exhiben diferencias de crecimiento significativas in vitro.
USA300 es un aislado virulento de MrsA que se sabe que es altamente citotóxico contra las PMN humanas15 y la pérdida de SaeR/S en esta cepa reduce drásticamente la transcripción de numerosas leucocicidas bicomponente que se dirigen a las PmN humanas6,12,haciendo que estas cepas sean modelos ideales para comparar citotoxicidad utilizando los ensayos descritos. Sin embargo, hay una amplia variación genética entre diferentes aislados de S. aureus y los parámetros detallados en estos protocolos pueden no dar lugar a cambios sustanciales en la citotoxicidad frente a las PMN humanas al probar otras cepas de S. aureus. Adaptar las condiciones de crecimiento, volúmenes de supernatantes añadidos, o la relación de bacterias a PMN puede ser necesario para el éxito con estos métodos utilizando otras cepas de S. aureus.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Subvenciones de Salud nidesiásteles 1R56AI135039-01A1, 1R21A128295-01, U54GM115371, así como fondos de la Estación Experimental de Agricultura de la Universidad Estatal de Montana, y una subvención de equipo de Murdock Charitable Trust .
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP, 500 mL VIAFLEX Plastic Container | Baxter | 2B1323Q | PMN purification |
| 1.5 mL micro-centrifuge tubes with Snap Caps | VWR | 89000-044 | Used in washing cells |
| 1.8% Sodium Chloride Solution | Sigma-Aldrich | S5150 | PMN purification |
| 12x75mm Culture tubes | VWR | 60818-430 | Used as flow cytometry tubes |
| 20% (w/w) Dextran | Sigma-Aldrich | D8802 | PMN purification |
| 3125 Hand Tally Counter | Traceable Products | 3125CC | For counting cells |
| 50 mL conical centrifuge tubes | VWR | 89039-656 | For dispensing media |
| Bacto Tryptic Soy Broth, Soybean-Casein Digest Medium | FischerScientific | 211823 | For growing cell cultures |
| BD Disposable Syringes with Luer-Lok Tips, 3 mL | FischerScientific | BD 309657 | For filtering supernatants |
| Bright-Line Hemocytometer | Sigma-Aldrich | Z359629 | Cell counting apparatus |
| DPBS, 1x (Dulbecco's Phosphate Buffered Saline) with calcium and magnesium | Corning | 21-030-CV | Used in washing cells |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | PMN purification |
| Fisherbrand Sterile Polystyrene Disposable Serological Pipets | FischerScientific | 13-678-11E | For aspirating liquid |
| Greiner CELLSTAR 96 well plates | Millipore Sigma | M0687 | Plate for holding experimental samples |
| OMICRON Syringe Filters | Omicron Scientific | SFPV13R | For filtering supernatants |
| Propidium iodide | ThermoFisher Scientific | P3566 | Membrane impermeable DNA stain |
| PYREX Brand 4980 Erlenmeyer Flasks | Cole-Parmer | EW-34503-24 | For growing cell cultures |
| RPMI 1640, 1X without L-glutamine, phenol red | Corning | 17-105-CV | Used in resuspending cells |
| Sterile Water for Irrigation, USP | Baxter | 2F7113 | PMN purification |
| The Pipette Pump | Bel-Art Products | F37898 | For aspirating liquid |
| Triton X-100 | Sigma-Aldrich | X100 | Membrane integrity positive control |
Referencias
- Foster, T. J., Geoghegan, J. A., Ganesh, V. K., Höök, M. Adhesion, invasion and evasion: The many functions of the surface proteins of Staphylococcus aureus. Nature Reviews Microbiology. , (2014).
- Thammavongsa, V., Kim, H. K., Missiakas, D., Schneewind, O. Staphylococcal manipulation of host immune responses. Nature Reviews Microbiology. 13 (9), 529-543 (2015).
- Otto, M. Staphylococcus aureus toxins. Current Opinion in Microbiology. , (2014).
- Guerra, F. E., Borgogna, T. R., Patel, D. M., Sward, E. W., Voyich, J. M. Epic Immune Battles of History: Neutrophils vs. Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 7, (2017).
- Nygaard, T., Malachowa, N., Kobayashi, S. D., DeLeo, F. R. Phagocytes. Management of Infections in the Immunocompromised Host. , 1-25 (2018).
- Nygaard, T. K., Pallister, K. B., Ruzevich, P., Griffith, S., Vuong, C., Voyich, J. M. SaeR Binds a Consensus Sequence within Virulence Gene Promoters to Advance USA300 Pathogenesis. The Journal of Infectious Diseases. 201 (2), 241-254 (2010).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. J Infect Dis. 199 (11), 1698-1706 (2009).
- Borgogna, T. R., et al. Secondary Bacterial Pneumonia by Staphylococcus aureus Following Influenza A Infection Is SaeR/S Dependent. The Journal of Infectious Diseases. , (2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100, 1-6 (2016).
- Zurek, O. W., et al. The role of innate immunity in promoting SaeR/S-mediated virulence in Staphylococcus aureus. J Innate Immun. 6 (1), 21-30 (2014).
- Nygaard, T. K., et al. Aspartic Acid Residue 51 of SaeR Is Essential for Staphylococcus aureus Virulence. Frontiers in Microbiology. 9, 3085 (2018).
- Spaan, A. N., Van Strijp, J. A. G., Torres, V. J. Leukocidins: Staphylococcal bi-component pore-forming toxins find their receptors. Nature Reviews Microbiology. , (2017).
- Bøyum, A. Isolation of mononuclear cells and granulocytes from human blood. Scandinavian Journal of Clinical and Laboratory. , (1968).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. , (2014).
- Voyich, J. M., et al. Insights into mechanisms used by Staphylococcus aureus to avoid destruction by human neutrophils. J Immunol. 175 (6), 3907-3919 (2005).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. The Journal of Infectious Diseases. 199 (11), 1698-1706 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados