Method Article
Quantifizierung der Zytotoxizität von Staphyloccus aureus gegen humane polymorphonukleare Leukozyten
In diesem Artikel
Erratum Notice
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur Reinigung polymorphonuklearer Leukozyten aus ganzem menschlichen Blut und zwei verschiedene Assays, die die Zytotoxizität von Staphylococcus aureus gegen diese wichtigen angeborenen Immunzellen quantifizieren.
Zusammenfassung
Staphylococcus aureus ist in der Lage, eine breite Palette von Leukoziden zu seften, die auf die Membranintegrität polymorphonukleanischer Leukozyten (PMNs oder Neutrophilen) abzielen und diese stören. Dieses Protokoll beschreibt sowohl die Reinigung menschlicher PMNs als auch die Quantifizierung der S. aureus-Zytotoxizität gegen PMNs in drei verschiedenen Abschnitten. Abschnitt 1 beschreibt die Isolierung von PMNs und Serum aus menschlichem Blut mittels Dichtezentrifugation. Abschnitt 2 testet die Zytotoxizität von extrazellulären Proteinen, die von S. aureus produziert werden, gegen diese gereinigten menschlichen PMNs. Abschnitt 3 misst die Zytotoxizität gegen humane PMNs nach der Phagozytose des lebenden S. aureus. Diese Verfahren messen die Störung der PMN-Plasmamembranintegrität durch S. aureus Leukocidine mithilfe der Durchflusszytometrieanalyse von PMNs, die mit Propidiumiodid behandelt werden, einem DNA-bindenden Fluorophor, das zellmembrane undurchlässig ist. Zusammengenommen haben diese Methoden den Vorteil, dass S. aureus Cytotoxizität schnell gegen primäre humane PMNs getestet wird und können leicht angepasst werden, um andere Aspekte von Wirt-Pathogen-Wechselwirkungen zu untersuchen.
Einleitung
Staphylococcus aureus ist ein grampositives Bakterium, das beim Menschen ein breites Spektrum an Krankheiten verursacht. Dieser prominente Erreger produziert zahlreiche Virulenzfaktoren, die zu verschiedenen Aspekten der Infektion beitragen. Dazu gehören Oberflächenmoleküle, die es S. aureus ermöglichen, an verschiedenen Arten von Wirtsgewebehaften 1, extrazelluläre Proteine, die mit der Wirtsimmunantwort stören2, und eine Reihe von abgesonderten Toxinen, die verschiedene Arten von Wirtszellen 3 . In diesem Bericht beschreiben wir eine Methode, die die Zytotoxizität von extrazellulären Proteinen quantifiziert, die von S. aureus gegen menschliche polymorphonukleare Leukozyten (PMNs oder Neutrophile), primäre Effektorzellen des Angeborenen der Immunantwort des Wirts, produziert werden.
PMNs sind die häufigsten Leukozyten bei Säugetieren. Diese zirkulierenden Immunzellen werden schnell an die Stelle der Wirtsgewebe Beleidigung als Reaktion auf Gefahrensignale von ansässigen Zellen oder von Verbindungen einzigartig für eindringende Mikroben rekrutiert. Die extrazelluläre Eingabe dieser Moleküle und aus direkten Kontakten mit aktivierten ansässigen Wirtszellen während der Extravasation erhöhen den Aktivierungszustand von PMNs in einem Prozess, der als Priming4,5bekannt ist. Primed PMNs, die beunruhigtes Gewebe erreicht haben, führen dann wichtige angeborene Immunantworten aus, die die Etablierung einer Infektion verhindern sollen. Dazu gehören die Bindung und Internalisierung, oder Phagozytose, von eindringenden Mikroorganismen, die eine Kaskade von intrazellulären Ereignissen auslösen, die in der Mikrobenzerstörung durch eine Batterie von potenten antimikrobiellen Verbindungen kumulieren5.
PMNs spielen eine wesentliche Rolle zum Schutz des Menschen vor eindringenden Krankheitserregern und sind besonders wichtig, um eine S. aureus-Infektion zu verhindern4. Dieses Bakterium produziert jedoch eine breite Palette von Virulenzgenen, die verschiedene PMN-Funktionen behindern. Dazu gehören extrazelluläre Proteine, die die Erkennung von Signalmolekülen blockieren, die Haftung an Wirtsgewebe verhindern, die Produktion antimikrobieller Verbindungen hemmen und die Integrität der Plasmamembran beeinträchtigen4. S. aureus orchestriert die zeitliche Expression dieser Virulenzgene durch den kollektiven Input mehrerer zweikomponentischer sensorischer Systeme, die spezifische Umwelthinweise erkennen. Das SaeR/S Zweikomponentensystem ist ein wichtiger Aufregulator der S. aureus Virulenz-Gentranskription während der Infektion6,7,8,9,10,11. Insbesondere hat sich dieses Zweikomponentensystem als entscheidend für die Herstellung von Zweikomponenten-Leukocidinen erwiesen, die speziell auf menschliche PMNsabzielen 12.
Dieses Protokoll ist in drei verschiedene Abschnitte unterteilt. Der erste Abschnitt beschreibt die Reinigung von PMNs aus menschlichem Blut mittels Dichtegradientenzentrifugation mit einem Protokoll, das an methoden angepasst wurde, die von B'yum13 und Nauseef14festgelegt wurden. Der zweite und dritte Abschnitt beschreiben zwei verschiedene Techniken zur Untersuchung der Zytotoxizität von S. aureus; eine berauscht PMNs mit extrazellulären Proteinen, die von S. aureus produziert werden, während der andere die Fähigkeit lebender Bakterien untersucht, PMNs nach Phagozytose zu schädigen. Bei diesen Verfahren wird Propidiumjodid verwendet, um den Verlust der PMN-Plasmamembranintegrität zu messen, der durch S. aureus porebildende Toxine verursacht wird. Propidiumiodid ist ein DNA-bindendes Fluorophor, das normalerweise zellmembranen undurchlässig ist, aber Plasmamembranen kreuzen kann, die durch S. aureus Toxine gestört wurden. Die Durchflusszytometrie-Analyse ermöglicht die schnelle Quantifizierung von propidiumiodid-positiven PMNs, um die relative Zytotoxizität von S. aureus-Stämmen zu messen. Methicillin-resistenter S. aureus (MRSA), der als gepulste Gelelektrophorese typ USA300 identifiziert wurde, und ein isogenes Deletionsmutant von saeR/S in diesem Stamm (USA300'saeR/S) wurden als Modelle verwendet, um zu demonstrieren, wie diese Verfahren die Zytotoxizität von S. aureus gegenüber menschlichen PMNs quantifizieren können.
Protokoll
Heparinisiertes venöses Blut von gesunden Spendern wurde gemäß dem vom Institutional Review Board for Human Subjects an der Montana State University genehmigten Protokoll gesammelt. Alle Spender gaben ihre schriftliche Zustimmung zur Teilnahme an dieser Studie ab.
1. Reinigung von humanen polymorphonuklearen Leukozyten und Isolierung des menschlichen Serums
HINWEIS: Alle Reagenzien sollten routinemäßig auf das Vorhandensein von Endotoxin mit einem handelsüblichen Endotoxin-Detektionskit überprüft werden und <25.0 pg/mL-Endotoxin enthalten, um unerwünschtes Priming von PMNs zu verhindern.
- Bringen Sie 50 ml von 3% dextran-0,9% NaCl (w/v), 35 ml von 0,9% NaCl (w/v), 20 ml von 1,8% NaCl (w/v), 12 ml mit 1,077 g/ml Dichtegradientenlösung und 20 ml Injektions- oder Bewässerungswasser auf Raumtemperatur.
- Um menschliches Serum zu isolieren, inkubieren Sie 4 ml frisch entnommenes menschliches Blut ohne Antikoagulans bei 37 °C in einem 15 ml Glasrohr für 30 min. Nach der Inkubation zentrifugieren Sie bei Raumtemperatur 10 min bei 2.000–3.000 g. Die obere Serumschicht in ein frisches 15 ml kegelförmiges Zentrifugenrohr geben und auf Eis legen.
- Kombinieren Sie 25 ml frisch gezogenes heparinisiertes (1000 Einheiten/ml) Vollmenschliches Blut mit 25 ml Raumtemperatur 3% dextran-0,9% NaCl (1:1 Verhältnis) in zwei replizieren 50 ml konische Zentrifugenrohre (50 ml Gesamtvolumen pro Tube). Mischen Sie durch sanftes Schaukeln jedes 50 ml konische Rohr und dann bei Raumtemperatur für 30 min stehen lassen.
- Nach der Inkubation bei Raumtemperatur werden zwei separate Schichten angezeigt. Übertragen Sie die deckgeschichtliche Schicht jedes Dextran-Blut-Gemischs in neue 50 ml konische Schläuche und Zentrifuge bei 450 x g für 10 min bei Raumtemperatur mit niedrigen oder keinen Bremsen.
- Sorgsam beide Überstande ansaugen und entsorgen, ohne die Zellpellets zu stören. Jedes Zellpellet vorsichtig in 2 ml Raumtemperatur 0,9% NaCl wieder aufhängen, die resuspendierten Pellets in einem einzigen 50 ml konischen Rohr kombinieren und dann die restlichen 0,9% NaCl (Endvolumen von 35 ml) hinzufügen.
- Unterlegen Sie mit einer Handpipette 10 ml Raumtemperatur von 1.077 g/ml Dichtegradientenlösung unter der Zellsuspension. Drehen Sie bei 450 x g für 30 min bei Raumtemperatur mit niedrigen oder keinen Bremsen. Den Überstand sanft ansaugen, ohne das Zellpellet zu stören. Supernatant wird periphere mononukleäre Blutzellen enthalten, die wie zuvor beschrieben14gesammelt werden können.
- Lyse die roten Blutkörperchen durch Wiederaufsetzen der Zelle Pellet in 20 ml Raumtemperatur Wasser. Mischen Sie sanft, indem Sie die Röhre für 30 s schaukeln. Die Lyse der roten Blutkörperchen wird von einer deutlichen Abnahme der Trübung begleitet werden.
- Sofort 20 ml 1,8% NaCl (bei Raumtemperatur [RT]) und Zentrifugenprobe bei 450 x g für 10 min bei Raumtemperatur hinzufügen.
HINWEIS: Es ist wichtig, die Zeit zu minimieren, die PMNs nach der Roten Blutkörperchenlyse allein im Wasser gelassen werden, um die PMN-Ausbeute zu maximieren und PMN-Lyse und/oder Aktivierung zu verhindern. - Den Überstand vorsichtig ansaugen, ohne das Zellpellet zu stören. Das Zellpellet vorsichtig in 2 ml RT RPMI 1640 Medium wieder aufhängen und auf Eis legen.
- Zählen Sie Zellen mit einem Hämozytometer. Gereinigte PMNs mit einer Konzentration von 1 x 107 Zellen/ml mit eiskaltem RPMI wieder aufsetzen und auf Eis halten.
- Kombinieren Sie 100 l gereinigte PMNs (1 x 106 Zellen) mit 300 l eiskalten Dulbecco-Phosphat-gepufferten Saline (DPBS), die 1 L Propidiumjodidfleck in zwei replizierenden Durchflusszytometrieröhren enthalten. Für eine positive Kontrolle von Plasmamembranschäden fügen Sie 40 L 0,5% Triton X-100 Lösung in eine der Durchflusszytometrieröhren und mischen gründlich.
- Verwenden Sie die Durchflusszytometrie, um die Vorwärtsstreuung, Seitenstreuung und Propidiumjodidfärbung (Erregungs-/Emissionsmaxima bei 535/617 nm) gereinigter Zellen zu messen (Abbildung 1).
HINWEIS: Die Vorwärts- und Seitenstreuungsanalyse identifiziert unerwünschte Populationen von Lymphozyten und Monozyten. Propidiumiodid wird nur Zellen mit einer kompromittierten Plasmamembran färben und gereinigte PMNs, die ausgeprägte Populationen von Propidiumjodid-positiven Zellen haben, sollten nicht verwendet werden. Für diese Studien wurden gereinigte PMNs nur verwendet, wenn sie >98% der gereinigten Zellen und <5% positiv für Propidiumjodid enthielten. - Bereiten Sie eine 96-Well-Platte für PMN-Zytotoxizitätstests vor, indem Sie einzelne Brunnen, die in diesem Test verwendet werden, mit 100 l isoliertem humanem Serum, das mit DPBS verdünnt wurde, beschichten.
HINWEIS: Das Plattieren von PMNs direkt auf Kunststoff oder Glas führt zur Aktivierung der Zellen. Achten Sie darauf, mindestens eine negative Kontrollgut, die nur Medien und mindestens eine positive Kontrolle gut, die 0,05% Triton X-100 erhalten erhalten. - Inkubieren Sie die Platte bei 37 °C für 30 min. Waschen Sie die beschichteten Brunnen nach der Inkubation zweimal mit eiskaltem DPBS, um überschüssiges Serum zu entfernen. Tippen Sie vorsichtig auf die Platte auf den Kopf, um eventuelle Rest-DPBS zu entfernen und auf Eis zu legen.
- Fügen Sie vorsichtig 100 l gereinigte menschliche PMNs bei 1 x 107 Zellen/ml zu jedem beschichteten Brunnen (1 x 106 PMNs/Well) hinzu. Lassen Sie PMNs in Brunnen absetzen, indem Sie die Platte mindestens 5 min auf Eis brüten. Halten Sie den Plattenstand, um eine gleichmäßige Verteilung der Zellen in jedem Brunnen zu ermöglichen, und lassen Sie sie auf Eis, um eine unerwünschte Aktivierung von PMNs zu vermeiden.
2. Zytotoxizitätstest von S. aureus extrazellulären Proteinen gegen humane polymorphonukleare Leukozyten
- Culture S. aureus über Nacht in tryptischer Sojabrühe (TSB) mit einem Schüttelinkubator bei 37 °C. Für diese Studien wurden 20 ml TSB in separaten 150 ml Erlenmeyerkolben mit gefrorenen Kulturen der S. aureus-Stämme USA300 oder USA300saeR/S geimpft und für ca. 14 h mit Schütteln bei 250 U/min angebaut.
- Subkultur S. aureus durch eine 1:100 Verdünnung der über Nacht bakteriellekultur mit frischen Medien. Bei 37 °C mit Schütteln bebrüten, bis die Bakterien eine frühe stationäre Wachstumsphase erreichen.
HINWEIS: Für diese Experimente wurden 20 ml tryptische Sojabrühe in 150 ml Erlenmeyerkolben mit 200 L der über Nacht kultivierten USA300 oder USA300saeR/S geimpft und bei 37 °C mit Schütteln bei 250 U/min für 5 h inkubiert. - Wenn Bakterien eine frühe stationäre Wachstumsphase erreicht haben, übertragen Sie 1 ml subkulturierten S. aureus in ein 1,5 ml Mikrozentrifugenrohr und zentrifugieren bei 5.000 g für 5 min bei Raumtemperatur.
- Nach der Zentrifugation überlagern Sie den Überstand in eine 3 ml Spritze. Überstand durch einen 0,22 m Filter und in ein neues 1,5 ml Mikrozentrifugenrohr auf Eis passieren.
- Führen Sie serielle Verdünnungen von Übertreibungen mit eiskalten Medien, die verwendet werden, um S. aureuszu kultur.
HINWEIS: Für die gezeigten Experimente wurden Überstandstoffe aus USA300 und USA300saeR/S vier aufeinander folgende 1/2-Log-Verdünnungen mit eiskaltem TSB unterzogen. - Fügen Sie allein (für negative und positive Kontrollen) vorsichtig überwasserstehende Proben oder Medien zu einzelnen Brunnen mit PMNs auf Eis ab Schritt 1.15 hinzu. Für diese Experimente wurden jedem Brunnen 10 L USA300 oderUSA300-SaeR/S-Überstandproben zugesetzt. Sanft Gesteinsplatte, um Überstand in Brunnen zu verteilen und bei 37 °C zu brüten.
- Zu den gewünschten Zeiten die Platte aus dem Inkubator entfernen und auf Eis legen. Fügen Sie 40 l von 0,5% Triton X-100 zur Positivkontrolle hinzu.
- Pipette die Proben in jedem Brunnen sanft nach oben und unten, um alle an der Platte haftenden PMNs vollständig abzuziehen, und dann die Proben in zytometrierische Rohre auf Eis übertragen, die 300 l eiskalteDPBS mit 1 L Propidiumjodid enthalten.
- Messen Sie den Anteil der Propidium-iodid-positiven PMNs mit Hilfe der Durchflusszytometrie (Abbildung 2A). Wenn propidium iodid an DNA gebunden ist, hat es eine Anregung/Emission bei 535/617 nm.
3. S. aureus Cytotoxizität ssay gegen humane polymorphonukleare Leukozyten nach Phagozytose
HINWEIS: Wachstumskurven, die durch die optische Dichte bei 600 nm (OD600) und die Konzentration von Bakterien definiert sind, müssen empirisch bestimmt werden, damit die S. aureus-Stämme vor Beginn dieses Tests getestet werden können. Der Erfolg dieser Experimente erfordert die konsistente Ernte gleicher Konzentrationen jedes S. aureus-Stamms, der in der mittleren exponentiellen Wachstumsphase mit dem OD600 subkultivierter Bakterien getestet wurde.
- Beginnen Sie die Nachtkulturen von S. aureus-Stämmen und Subkulturbakterien, wie in den Schritten 2.1.1 und 2.1.2 beschrieben.
- Ernten Sie subkultivierte S. aureus, wenn es mittelexponentielles Wachstum erreicht hat, indem 1 ml kultivierte Bakterien auf ein 1,5 ml Mikrozentrifugenrohr übertragen und zentrifugieren bei 5.000 g für 5 min bei Raumtemperatur.
HINWEIS: Unter unseren Wachstumsbedingungen erreichten DIE USA300 und DIE USA300saeR/S nach ca. 135 min Inkubation6. - Waschen Sie S. aureus nach der Zentrifugation, indem Sie den Überstand ansischmachen, die pelletierten Bakterien in 1 ml DPBS wieder aufhängen, die Probe für 30 s wirbeln lassen und bei 5 min bei Raumtemperatur zentrifugieren.
- Opsonize S. aureus durch Wiederaussetzung des bakteriellen Pellets in 1 ml von 20% menschlichem Serum mit DPBS verdünnt und bei 37 °C mit Agitation für 15 min inkubieren.
- Zentrifuge opsonisierte Bakterien bei 5.000 x g für 5 Minuten bei Raumtemperatur. Waschen Sie S. aureus nach der Zentrifugation, indem Sie den Überstand ansischmachen, die pelletierten Bakterien in 1 ml DPBS wieder aufhängen und dann die Probe wirbeln, bis das bakterielle Pellet vollständig auseinander gebrochen wird, plus weitere 30 Sekunden. Zentrifugenbakterien bei 5.000 g für 5 min bei Raumtemperatur.
- Resuspend opsonized S. aureus Stämme in 1 mL RPMI, Wirbel die Probe, bis bakterielle Pellet vollständig auseinander gebrochen ist, und dann für weitere 30 s. Legen Sie Bakterien auf Eis.
- Verdünnt opsonisierte S. aureus-Stämme mit eiskaltem RPMI auf die gewünschte Konzentration. Wirbel für 30 s und auf Eis legen.
- Bestätigen Sie die Konzentration von opsonisiertem S. aureus, indem Sie 1:10 serielle Verdünnungen von Bakterien auf tryptischen Soja-Agar.
HINWEIS: Da Unterschiede in der Konzentration der in diesem Test verwendeten Bakterien einen großen Einfluss auf die nachfolgende PMN-Plasmamembrandurchlässigkeit haben können (Abbildung 3A), ist es sehr wichtig, dass die Konzentration jedes getesteten Stammes für jedes Experiment bestimmt wird und zwischen den Stämmen gleichwertig ist. - Fügen Sie ab Schritt 100 l/Well jeder S. aureus-Sorte oder RPMI (für positive und negative Kontrollen) in der 96-Well-Platte auf Eis ab Schritt 1.14 vorsichtig zu PMNs hinzu. Sanft Rockplatte, um S. aureus in Brunnen zu verteilen.
- Phagozytose synchronisieren, indem Sie die Platte bei 500 x g für 8 min bei 4 °C15zentrieren. Inkubationsplatte bei 37 °C unmittelbar nach zentrifugieren (T = 0).
- Zu den gewünschten Zeiten die Platte aus dem Inkubator entfernen und auf Eis legen. Fügen Sie 40 l von 0,5% Triton X-100 zur Positivkontrolle hinzu.
- Pipette die Proben in jedem Brunnen sanft nach oben und unten, um alle an der Platte haftenden PMNs vollständig abzuziehen, und dann die Proben in zytometrierische Rohre auf Eis übertragen, die 200 l eiskalteS DPBS mit 1 L Propidiumjodid enthalten.
- Analysieren Sie Proben für Propidiumjodidfärbung mit Durchflusszytometrie, wie in Schritt 2.9 beschrieben.
Ergebnisse
Wir haben gezeigt, wie die oben beschriebenen Verfahren verwendet werden können, um die Zytotoxizität von S. aureus gegen humane PMNs mit MRSA PFGE-Typ USA300 und einer isogenen Deletionsmutante von saeR/S in diesem Stamm (USA300saeR/S) in früheren Studien6zu quantifizieren. PMNs, die mit den in Abschnitt 1 beschriebenen Verfahren isoliert wurden, wurden mit Propidiumjodid befleckt und mit Flusszytometrie untersucht. Vorwärts- und Seitenstreuungsdiagramme wurden verwendet, um die Kontamination gereinigter PMNs durch Monozyten oder Lymphozyten zu veranschaulichen (Abbildung 1A,B) und die PMN-Integrität wurde mittels Propidiumjodidfärbung bestimmt (Abbildung 1C). Die beschriebene Methode der humanen PMN-Reinigung kann konsistent 0,5 x 107 bis 1 x 108 PMNs ergeben, die >98% rein sind und >95% Propidiumjodid negativ sind.
Die Zytotoxizität von extrazellulären Proteinen, die von USA300 und USA300saeR/S produziert wurden, wurde anhand der in Abschnitt 2 dieses Protokolls beschriebenen Verfahren gegen gereinigte PMNs getestet (Abbildung 2). Diese Experimente zeigen eine konzentrationsabhängige Zunahme der Propidiumjodidfärbung von gereinigten PMNs nach 30 min Intoxikation mit extrazellulären Proteinen, die von USA300 produziert wurden (Abbildung 2B). Frühere Studien haben gezeigt, dass das SaeR/S Zweikomponentensystem wichtig für die Expression zahlreicher Zweikomponenten-Leukocidine ist, die auf humane PMNs6,10,11,16abzielen. In Übereinstimmung mit diesen bisherigen Befunden wurden nur sehr wenige propidiumiodid-positive PMNs nach der Exposition gegenüber extrazellulären Proteinen nachgewiesen, die von USA300-SaeR/S produziert wurden (Abbildung 2B). Weitere Experimente zeigten einen stetigen Anstieg des Anteils der lysierten PMNs nach einer Vergiftung durch USA300 extrazelluläre Proteine, die nach etwa 30 min plateauierten(Abbildung 2C). Eine minimale Lyse menschlicher PMNs wurde zu allen Zeitpunkten nach der Exposition gegenüber extrazellulären Proteinen festgestellt, die von USA300saeR/Sproduziert wurden. Diese Ergebnisse veranschaulichen den Nutzen dieses Assays für die relative Quantifizierung der Zytotoxizität durch extrazelluläre S. aureus-Proteine gegen humane PMNs.
Wir haben USA300 und USA300saeR/S mit dem S. aureus Cytotoxizitätstest gegen humane PMNs nach Phagozytose getestet, die in Abschnitt 3 dieses Protokolls beschrieben wird (Abbildung 3). Ein konzentrationsabhängiger Anstieg des Anteils der Propidiumiodid-positiven PMNs wurde 90 min nach der Phagozytose von USA300 beobachtet (Abbildung 3A). Ein signifikanter Rückgang des Anteils der PMNs, die nach der Phagozytose von USA300-SaeR/S(Abbildung 3A) propidium iodid positiv waren, wurde beobachtet, was andere Ergebnisse stützt, die darauf hindeuten, dass das SaeR/S-Zweikomponentensystem für die Zytotoxizität von S. aureus gegenüber menschlichen PMNs wichtig ist (Abbildung 2)7,11. Wie bereits erwähnt und in Abbildung 3Anachgewiesen, haben Unterschiede in der S. aureus-Konzentration einen ausgeprägten Einfluss auf die PMN-Lyse nach Phagozytose. Die Aufzählung des in jeder dieser Experimente verwendeten Inokulums USA300 und USA300saeR/S zeigte, dass der Kontrast in der Zytotoxizität zwischen diesen Stämmen nicht auf Unterschiede in der Konzentration der verwendeten Bakterien zurückzuführen war (Abbildung 3B). Diese Ergebnisse zeigen, wie der S. aureus Cytotoxizitätstest gegen humane PMNs nach Phagozytose verwendet werden kann, um die Fähigkeit verschiedener S. aureus-Stämme zu bewerten, die Integrität der menschlichen PMN-Plasmamembran zu beeinträchtigen.

Abbildung 1: Durchflusszytometrieanalyse von gereinigten PMNs. Repräsentative Durchflusszytometrie Dot Plots von (A) gereinigten menschlichen PMNs und (B) PMNs, die absichtlich mit peripheren mononukleären Blutzellen kontaminiert wurden. (C) Repräsentatives Durchflusszytometrie-Histogramm mit minimaler Propidiumjodidfärbung (<1%) von gereinigten PMNs (schattiert grau) im Vergleich zu PMNs, die mit 0,05% Triton X-100 (schattiert rot) behandelt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
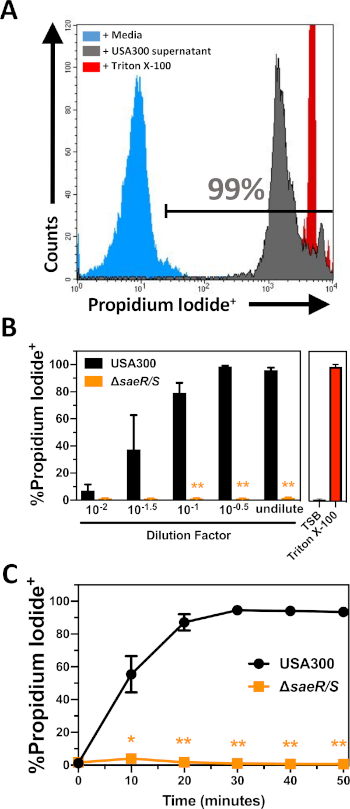
Abbildung 2: Durchflusszytometrie-Analyse von PMNs, die mit extrazellulären Proteinen von S. aureusberauscht sind. (A) Repräsentatives Durchflusszytometriehistogramm von PMNs, die nach 30 min Inkubation mit Mediensteuerung (blau schattiert), gefilterter USA300 Überstand in einer Endkonzentration von 1:110 (schattiert grau) oder 0,05% Triton X-100 (schattiert rot) mit Propidiumiodid befleckt sind. (B) Der Anteil der Propidiumjodid-positiven PMNs nach 30 min Inkubation mit unterschiedlichen Konzentrationen von USA300 oder USA300-SaeR/S-Überwachungsmitteln. (C) Der Anteil der Propidiumjodid-positiven PMNs im Laufe der Zeit nach der Inkubation mit USA300 oder USA300-SaeR/S-Überstand bei einer Endkonzentration von 1:110. Die Daten werden als Mittelwert von mindestens 3 separaten Experimenten mit * p 0,05 und ** p bis 0,005 dargestellt, wie durch zweibländigen t-Test bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
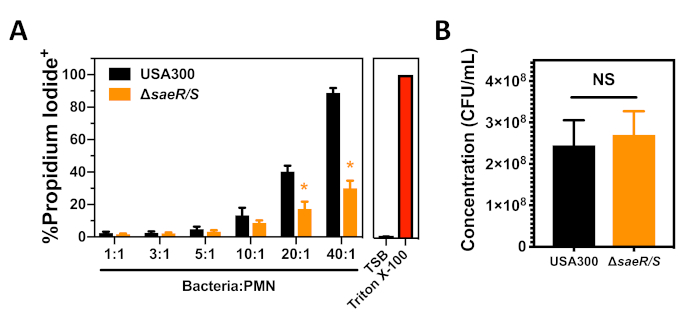
Abbildung 3: Durchflusszytometrie-Analyse von PMNs nach Phagozytose von S. aureus. (A) Der Anteil der Propidiumjodid-positiven PMNs 90 min nach der Phagozytose verschiedener Konzentrationen von USA300 oder USA300saeR/S. (B) Konzentration von opsonisierten S. aureus-Stämmen, die für die in Panel A gezeigten Experimente verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt die Reinigung von PMNs aus menschlichem Blut und zwei verschiedene Assays, die Propidiumjodid zur Quantifizierung der Zytotoxizität von S. aureus gegen diese wichtigen angeborenen Immunzellen verwenden. Der Erfolg dieser Verfahren hängt von der Qualität der gereinigten PMNs und der geeigneten Herstellung von S. aureus und extrazellulären Proteinen ab, die von diesem Erreger produziert werden. Für die Isolierung von PMNs ist es wichtig, die PMN-Aktivierung während und nach der Reinigung zu minimieren, indem Reagenzien frei von Endotoxinkontamination verwendet werden, Zellpräparate schonend behandelt und Zellen bei der entsprechenden Temperatur gehalten werden. Anzeichen, die auf die Aktivierung von PMNs hinweisen, sind das Verklumpen von Zellen während der Reinigung und wenn mehr als 5% der isolierten Zellen positiv für Propidiumjodid färben. Aufgrund der relativ kurzen Lebensdauer von PMNs müssen diese Zellen aus menschlichem Blut isoliert und am selben Tag getestet werden. PMNs werden beginnen, Anzeichen einer spontanen Apoptose zu zeigen, wenn sie nach der Reinigung mehr als 3 h auf Eis gelassen werden. Wie bereits erwähnt, ist es sehr wichtig, dass jedes PMN-Präparat sorgfältig mit der Durchflusszytometrieanalyse der Vorwärts- und Seitenstreuung sowie der Propidiumjodidfärbung bewertet wird, um die Reinheit und Integrität isolierter Zellen zu gewährleisten.
Die Expression von Zweikomponenten-Leukocidinen durch S. aureus ist verantwortlich für die Mehrheit der kompromittierten PMN-Plasmamembranintegrität, die mit den in diesem Protokoll beschriebenen Assays beobachtet wird. Variationen in der Expression dieser Toxine und anderer porenbildender Peptide, wie phenollösliche Module, zwischen S. aureus-Stämmen führen zu Unterschieden in der Zytotoxizität gegenüber menschlichen PMNs. Signifikante Abweichungen während des In-vitro-Wachstums zwischen S. aureus-Stämmen beeinflussen auch die Expression von porenbildenden Toxinen und die anschließende Zytotoxizität. Darüber hinaus hat das Verhältnis von S. aureus zu PMNs in phagozytose-Assays einen großen Einfluss auf die nachfolgende PMN-Plasmamembrandurchlässigkeit (Abbildung 3A), und diese Experimente erfordern die konsistente Ernte gleicher Konzentrationen jedes S. aureus-Stamms, der in der mittelexponentiellen Wachstumsphase mit den OD600 subkultivierter Bakterien getestet wurde. Angesichts dieser Überlegungen ist es sehr wichtig, Wachstumskurven für alle Stämme zu definieren, die vor Beginn der Zytotoxizitätstests untersucht werden. Wir empfehlen diese Methoden zur Analyse der S. aureus Zytotoxizität mit Stämmen, die signifikante Wachstumsunterschiede in vitro aufweisen.
USA300 ist ein virulentes MRSA-Isolat, das bekanntermaßen hochzytoxisch gegen humane PMNs15 ist, und der Verlust von SaeR/S in diesem Stamm reduziert die Transkription zahlreicher Bi-Komponenten-Leukocidine, die auf humane PMNs6,12abzielen, was diese Stämme zu idealen Modellen für den Vergleich der Zytotoxizität mit den beschriebenen Assays macht. Es gibt jedoch umfangreiche genetische Unterschiede zwischen verschiedenen S. aureus Isolaten und die in diesen Protokollen beschriebenen Parameter können bei der Prüfung anderer S. aureus-Stämme nicht zu wesentlichen Veränderungen der Zytotoxizität gegenüber menschlichen PMNführen führen. Die Anpassung der Wachstumsbedingungen, der zugesetzten Überstände oder des Verhältnisses von Bakterien zu PMNs kann für den Erfolg mit diesen Methoden mit anderen Stämmen von S. aureuserforderlich sein.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von den U.S. National Institutes of Health Grants NIH-1R56AI135039-01A1, 1R21A128295-01, U54GM115371 sowie Mitteln der Montana State University Agriculture Experiment Station und einem Ausrüstungsstipendium des Murdock Charitable Trust unterstützt. .
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP, 500 mL VIAFLEX Plastic Container | Baxter | 2B1323Q | PMN purification |
| 1.5 mL micro-centrifuge tubes with Snap Caps | VWR | 89000-044 | Used in washing cells |
| 1.8% Sodium Chloride Solution | Sigma-Aldrich | S5150 | PMN purification |
| 12x75mm Culture tubes | VWR | 60818-430 | Used as flow cytometry tubes |
| 20% (w/w) Dextran | Sigma-Aldrich | D8802 | PMN purification |
| 3125 Hand Tally Counter | Traceable Products | 3125CC | For counting cells |
| 50 mL conical centrifuge tubes | VWR | 89039-656 | For dispensing media |
| Bacto Tryptic Soy Broth, Soybean-Casein Digest Medium | FischerScientific | 211823 | For growing cell cultures |
| BD Disposable Syringes with Luer-Lok Tips, 3 mL | FischerScientific | BD 309657 | For filtering supernatants |
| Bright-Line Hemocytometer | Sigma-Aldrich | Z359629 | Cell counting apparatus |
| DPBS, 1x (Dulbecco's Phosphate Buffered Saline) with calcium and magnesium | Corning | 21-030-CV | Used in washing cells |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | PMN purification |
| Fisherbrand Sterile Polystyrene Disposable Serological Pipets | FischerScientific | 13-678-11E | For aspirating liquid |
| Greiner CELLSTAR 96 well plates | Millipore Sigma | M0687 | Plate for holding experimental samples |
| OMICRON Syringe Filters | Omicron Scientific | SFPV13R | For filtering supernatants |
| Propidium iodide | ThermoFisher Scientific | P3566 | Membrane impermeable DNA stain |
| PYREX Brand 4980 Erlenmeyer Flasks | Cole-Parmer | EW-34503-24 | For growing cell cultures |
| RPMI 1640, 1X without L-glutamine, phenol red | Corning | 17-105-CV | Used in resuspending cells |
| Sterile Water for Irrigation, USP | Baxter | 2F7113 | PMN purification |
| The Pipette Pump | Bel-Art Products | F37898 | For aspirating liquid |
| Triton X-100 | Sigma-Aldrich | X100 | Membrane integrity positive control |
Referenzen
- Foster, T. J., Geoghegan, J. A., Ganesh, V. K., Höök, M. Adhesion, invasion and evasion: The many functions of the surface proteins of Staphylococcus aureus. Nature Reviews Microbiology. , (2014).
- Thammavongsa, V., Kim, H. K., Missiakas, D., Schneewind, O. Staphylococcal manipulation of host immune responses. Nature Reviews Microbiology. 13 (9), 529-543 (2015).
- Otto, M. Staphylococcus aureus toxins. Current Opinion in Microbiology. , (2014).
- Guerra, F. E., Borgogna, T. R., Patel, D. M., Sward, E. W., Voyich, J. M. Epic Immune Battles of History: Neutrophils vs. Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 7, (2017).
- Nygaard, T., Malachowa, N., Kobayashi, S. D., DeLeo, F. R. Phagocytes. Management of Infections in the Immunocompromised Host. , 1-25 (2018).
- Nygaard, T. K., Pallister, K. B., Ruzevich, P., Griffith, S., Vuong, C., Voyich, J. M. SaeR Binds a Consensus Sequence within Virulence Gene Promoters to Advance USA300 Pathogenesis. The Journal of Infectious Diseases. 201 (2), 241-254 (2010).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. J Infect Dis. 199 (11), 1698-1706 (2009).
- Borgogna, T. R., et al. Secondary Bacterial Pneumonia by Staphylococcus aureus Following Influenza A Infection Is SaeR/S Dependent. The Journal of Infectious Diseases. , (2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100, 1-6 (2016).
- Zurek, O. W., et al. The role of innate immunity in promoting SaeR/S-mediated virulence in Staphylococcus aureus. J Innate Immun. 6 (1), 21-30 (2014).
- Nygaard, T. K., et al. Aspartic Acid Residue 51 of SaeR Is Essential for Staphylococcus aureus Virulence. Frontiers in Microbiology. 9, 3085 (2018).
- Spaan, A. N., Van Strijp, J. A. G., Torres, V. J. Leukocidins: Staphylococcal bi-component pore-forming toxins find their receptors. Nature Reviews Microbiology. , (2017).
- Bøyum, A. Isolation of mononuclear cells and granulocytes from human blood. Scandinavian Journal of Clinical and Laboratory. , (1968).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. , (2014).
- Voyich, J. M., et al. Insights into mechanisms used by Staphylococcus aureus to avoid destruction by human neutrophils. J Immunol. 175 (6), 3907-3919 (2005).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. The Journal of Infectious Diseases. 199 (11), 1698-1706 (2009).
Erratum
Formal Correction: Erratum: Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes
Posted by JoVE Editors on 6/10/2021. Citeable Link.
An erratum was issued for: Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes. The title was updated.
The title was updated from:
Quantifying the Cytotoxicity of Staphyloccus aureus Against Human Polymorphonuclear Leukocytes
to:
Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten