Method Article
Quantificando a citotoxicidade de Staphyloccus aureus contra os leukócitos polimorfóides humanos
Neste Artigo
Erratum Notice
Resumo
Este protocolo descreve um método para a purificação de leukócitos polimorfosnucleares de sangue humano inteiro e dois ensaios distintos que quantificam a citotoxicidade de Staphylococcus aureus contra essas importantes células imunes inatas.
Resumo
Staphylococcus aureus é capaz de secretar uma ampla gama de leukocinas que visam e interrompem a integridade da membrana dos leukócitos polimorfautornucleares (PMNs ou neutrófilos). Este protocolo descreve tanto a purificação de PMNs humanos quanto a quantificação da citotoxicidade de S. aureus contra PMNs em três seções diferentes. A seção 1 detalha o isolamento de PMNs e soro do sangue humano usando centrífuga de densidade. A Seção 2 testa a citotoxicidade de proteínas extracelulares produzidas por S. aureus contra esses PMNs humanos purificados. A Seção 3 mede a citotoxicidade contra PMNs humanos após a fagocitose de S. aureusvivos. Esses procedimentos medem a interrupção da integridade da membrana plasmática pmn por S. aureus leukocidins usando análise de citometria de fluxo de PMNs tratadas com iodeto propidium, um fluorofe de ligação de DNA que é membrana celular impermeável. Coletivamente, esses métodos têm a vantagem de testar rapidamente a citotoxicidade de S. aureus contra pmns humanos primários e podem ser facilmente adaptados para estudar outros aspectos das interações hospedógenas-patógenos.
Introdução
Staphylococcus aureus é uma bactéria gram-positiva que causa um amplo espectro de doenças em seres humanos. Este patógeno proeminente produz inúmeros fatores de virulência que contribuem para diferentes aspectos da infecção. Estes incluem moléculas de superfície que permitem que S. aureus adere a diferentes tipos de tecido hospedeiro1,proteínas extracelulares que interferem com a resposta imune hospedeira2,e uma matriz de toxinas secretadas que têm como alvo diferentes tipos de células hospedeiras3. Neste relatório, descrevemos um método que quantifica a citotoxicidade das proteínas extracelulares produzidas por S. aureus contra os leukócitos polimorfóides humanos (PMNs ou neutrófilos), células efetivos primárias da resposta imune inata do hospedeiro.
Pmns são os leukócitos mais abundantes em mamíferos. Estas células imunes circulantes são rapidamente recrutados para o local do insulto do tecido hospedeiro em resposta aos sinais de perigo produzidos por células residentes ou por compostos exclusivos para micróbios invasores. A entrada extracelular dessas moléculas e de contatos diretos com células hospedeiras residentes ativadas durante a extravasation aumentam o estado de ativação de PMNs em um processo conhecido como priming4,5. Pmns preparados que atingiram o tecido angustiado, em seguida, executar importantes respostas imunes inatas destinadas a prevenir o estabelecimento de infecção. Estes incluem a ligação e internalização, ou fagocitose, de microorganismos invasores que desencadeia uma cascata de eventos intracelulares cumulando na destruição do micróbio por uma bateria de potentes compostos antimicrobianos5.
Pmns desempenham um papel essencial proteger os seres humanos de patógenos invasores e são particularmente importantes para prevenir a infecção por S. aureus 4. No entanto, esta bactéria produz uma ampla gama de genes de virulência que impedem diferentes funções de PMN. Estes incluem proteínas extracelulares que bloqueiam o reconhecimento de moléculas de sinalização, impedem a adesão ao tecido hospedeiro, inibem a produção de compostos antimicrobianos e comprometem a integridade da membrana plasmática4. S. aureus orquestra a expressão temporal desses genes de virulência através da entrada coletiva de múltiplos sistemas sensoriais de dois componentes que reconhecem pistas ambientais específicas. O sistema de dois componentes SaeR/S é um grande up-regulador da transcrição do gene de viulência de S. aureus durante a infecção6,7,8,9,10,11. Em particular, este sistema de dois componentes tem se mostrado fundamental para a produção de leukocinas bicomponentes que visam especificamente pmns humanos12.
Este protocolo é dividido em três seções diferentes. A primeira seção descreve a purificação de PMNs do sangue humano usando a centrífuga do gradiente da densidade usando um protocolo que seja adaptado dos métodos estabelecidos por Bøyum13 e por Nauseef14. A segunda e terceira seções detalham duas técnicas diferentes para examinar a citotoxicidade de S. aureus; um intoxica PMNs com proteínas extracelulares produzidas por S. aureus, enquanto o outro examina a capacidade de bactérias vivas para danificar PMNs após a fagocitose. Esses procedimentos usam o iodeto propidium para medir a perda da integridade da membrana plasmática da PMN causada por toxinas formadoras por pelose de S. aureus. O iodeto de propídio é um fluorofofóbico de ligação ao DNA que normalmente é impermeável à membrana celular, mas pode atravessar membranas plasmáticas que foram interrompidas por toxinas de S. aureus. A análise de citometria de fluxo permite que a quantificação rápida de PMNs positivos para iodide propidium meça a citotoxicidade relativa das cepas de S. aureus. S. aureus resistente à meticilina (MRSA) identificado como eletroforese de gel de campo pulsado tipo USA300 e um mutante de deleção isogênica de saeR/S nesta cepa (USA300ΔsaeR/S)têm sido usados como modelos para demonstrar como esses procedimentos podem quantificar a citotoxicidade de S. aureus contra PMNs humanos.
Protocolo
O sangue venoso heparinizado de doadores saudáveis foi coletado de acordo com o protocolo aprovado pelo Institutional Review Board for Human Subjects da Montana State University. Todos os doadores forneceram consentimento por escrito para participar deste estudo.
1. Purificação de leukócitos polimorfóides humanos e isolamento do soro humano
NOTA: Todos os reagentes devem ser rotineiramente verificados para a presença de endotoxina usando um kit de detecção de endotoxina comercialmente disponível e devem conter endotoxina pg/mL de aproximadamente 25,0 pg/mL para evitar a preparação indesejada de PMNs.
- Traga 50 mL de 3% dextran-0,9% NaCl (w/v), 35 mL de 0,9% NaCl (w/v), 20 mL de 1,8% NaCl (w/v), 12 mL de 1,077 g/mL solução de gradiente de densidade, e 20 mL de injeção ou irrigação-grau de água à temperatura ambiente.
- Para isolar o soro humano, incubar 4 mL de sangue humano recém-retirado sem anti-coagulante a 37 °C em um tubo de vidro de 15 mL por 30 min. Após a incubação, a amostra de centrífuga em 2.000-3.000 × g por 10 min à temperatura ambiente. Transfira a camada do soro superior em um tubo de centrífuga cônico fresco de 15 mL e coloque no gelo.
- Combine 25 mL de sangue humano inteiro heparinizado recentemente extraído (1000 unidades/mL) com 25 mL de temperatura ambiente 3% dextran-0,9% NaCl (proporção de 1:1) em dois tubos de centrífuga cônicos de 50 mL (50 mL volume total por tubo). Misture balançando suavemente cada tubo cônico de 50 mL e, em seguida, deixe ficar em temperatura ambiente por 30 min.
- Após a incubação à temperatura ambiente, duas camadas separadas aparecerão. Transfira a camada superior de cada mistura de sangue dextran em novos tubos cônicos de 50 mL e centrífuga a 450 x g por 10 min à temperatura ambiente com freios baixos ou sem.
- Cuidadosamente aspirar tanto supernatants e descartar sem perturbar as pelotas celulares. Resuspende delicadamente cada pelota da pilha em 2 mL da temperatura ambiente 0.9% NaCl, combina as pelotas resuspended em um único tubo cónico de 50 mL, a seguir adicione o restante 0.9% NaCl (volume final de 35 mL).
- Cuidadosamente underlay 10 mL da temperatura ambiente de 1.077 g/mL solução de gradiente de densidade a suspensão celular usando uma pipeta de mão. Gire a 450 x g por 30 min à temperatura ambiente com freios baixos ou sem. Gentilmente aspirar o supernatant sem perturbar a pelota celular. Supernatant conterá células mononucleares periféricas do sangue que podem ser coletadas como descrito anteriormente14.
- Lyse os glóbulos vermelhos, resuspendendo a pelota de células em 20 mL de água à temperatura ambiente. Misture suavemente balançando o tubo por 30 s. A lise dos glóbulos vermelhos será acompanhada por uma diminuição distinta da turbidez.
- Adicione imediatamente 20 mL de 1,8% NaCl (à temperatura ambiente [RT]) e amostra de centrífuga em 450 × g para 10 min à temperatura ambiente.
NOTA: É importante minimizar o tempo em que as PMNs são deixadas na água sozinhas após a lise das células vermelhas do sangue para maximizar o rendimento da PMN e evitar a lise e/ou ativação da PMN. - Cuidadosamente aspirar o supernatant sem perturbar a pelota celular. Resuspenda delicadamente a pelota da pilha em 2 mL do meio de RT RPMI 1640 e coloc no gelo.
- Conte as células usando um hemocytometer. Resuspender pmns purificados em uma concentração de 1 x 107 células/mL com RPMI gelada e manter o gelo.
- Combine 100 μL de PMNs purificados (1 x 106 células) com 300 μL de solha sonistão amortecida de fosfato de Dulbecco gelado (DPBS) contendo 1 μL de mancha de iodeto propidium em dois tubos de citometria de fluxo de replicação. Para um controle positivo para danos na membrana plasmática, adicione 40 μL de 0,5% triton x-100 solução em um dos tubos de citometria de fluxo e misture completamente.
- Use citometria de fluxo para medir a dispersão para a frente, dispersão lateral e coloração de iodeto propidium (excitação/emissão maxima em 535/617 nm) de células purificadas (Figura 1).
NOTA: Análise de dispersão frontal e lateral identificará populações indesejadas de linfócitos e monócitos. O iodeto propidium só manchará células com uma membrana plasmática comprometida e PMNs purificados que têm populações pronunciadas de células positivas de iodeto propidium não devem ser usadas. Para esses estudos, pmns purificados só foram usados se compreendessem >98% das células purificadas e <5% manchado positivo para iodeto propidium. - Prepare uma placa de 96 poços para ensaios de citotoxicidade da PMN revestindo poços individuais que serão usados neste ensaio com 100 μL de 20% de soro humano isolado que foi diluído com DPBS.
NOTA: Chapeamento pmns diretamente em plástico ou vidro irá causar ativação das células. Certifique-se de incluir pelo menos um poço de controle negativo que só receberá mídia e pelo menos um poço de controle positivo que receberá 0,05% Triton X-100. - Incubar a placa a 37 °C por 30 min. Após a incubação, lave os poços revestidos duas vezes com DPBS gelado para remover todo o soro adicional. Bata delicadamente a placa de cabeça para baixo para remover qualquer DPBS residual e coloque no gelo.
- Adicione suavemente 100 μL de PMNs humanos purificados em 1 x 107 células/mL a cada poço revestido (1 x 106 PMNs/bem). Permita que pmns para se estabelecer em poços, incubando a placa no gelo por pelo menos 5 min. Manter o nível da placa para permitir até mesmo a distribuição de células em cada poço e deixar no gelo para evitar a ativação indesejada de PMNs.
2. Ensaio de citotoxicidade de proteínas extracelulares de S. aureus contra leukócitos polimorfóides humanos
- Cultura S. aureus durante a noite em caldo de soja tripptic (TSB) usando uma incubadora tremendo fixado em 37 °C. Para estes estudos, 20 mL de TSB em separado 150 mL Erlenmeyer frascos foram inoculados com culturas congeladas de cepas S. aureus EUA300 ou EUA300ΔsaeR / S e cultivadas por aproximadamente 14 h com agitação em 250 rpm.
- Subcultura S. aureus realizando uma diluição de 1:100 da cultura bacteriana durante a noite com novos meios de comunicação. Incubar a 37 °C com agitação até que a bactéria atinja fase de crescimento estacionário precoce.
NOTA: Para estes experimentos, 20 mL de caldo de soja téptico em 150 frascos mL Erlenmeyer foram inoculados com 200 μL de USA300 cultivado durante a noite ou EUA300ΔsaeR/S e incubados a 37 °C com agitação em 250 rpm por 5 h. - Quando as bactérias atingiram a fase de crescimento estacionário precoce, transferir 1 mL de subculturado S. aureus em um tubo de microcentrífuga de 1,5 mL e centrífuga em 5.000 × g para 5 min à temperatura ambiente.
- Após a centrífugação, transfira o supernatant em uma seringa de 3 mL. Passe os supernatantes através de um filtro de 0,22 μm e em um novo tubo de microcentrífuga de 1,5 mL no gelo.
- Realizar diluições em série de supernatants com mídia gelada usada para cultura S. aureus.
NOTA: Para os experimentos mostrados, supernatants de USA300 e EUA300ΔsaeR/S foram submetidos a quatro diluições consecutivas de 1/2 log com TSB gelado. - Adicione suavemente amostras supernatant ou mídia sozinho (para controles negativos e positivos) para poços individuais de placa de 96 poços contendo PMNs no gelo a partir do passo 1.15. Para estes experimentos, 10 μL de USA300 ou USA300ΔsaeR/S amostras supernatant foram adicionados a cada poço. Placa suavemente rock para distribuir supernatantes em poços e incubar a 37 °C.
- Nos horários desejados, retire a placa da incubadora e coloque no gelo. Adicione 40 μL de 0,5% Triton X-100 para o bem de controle positivo.
- Delicadamente pipeta as amostras para cima e para baixo em cada poço para retirar completamente todos os PMNs aderiu à placa, em seguida, transferir as amostras para fluir tubos de citometria no gelo que contêm 300 μL de Gelo-frio DPBS com 1 μL de iodeto propidium.
- Medir a proporção de PMNs iodeto-positivos propidium usando citometria de fluxo(Figura 2A). Quando ligado ao DNA, o iodeto propidium tem excitação/emissão a 535/617 nm.
3. S. aureus cytotoxicity ensaio contra leukócitos polimorfóides humanos após a fagocitose após a fagocitose
NOTA: Curvas de crescimento definidas pela densidade óptica em 600 nm (OD600)e concentração de bactérias devem ser determinadas empiricamente para as cepas de S. aureus a serem testadas antes de iniciar este ensaio. O sucesso desses experimentos requer a colheita consistente de concentrações iguais de cada cepa S. aureus testada em fase de crescimento exponencial, usando o OD600 de bactérias subcultivadas.
- Comece culturas durante a noite de cepas de S. aureus e bactérias subculturais, conforme descrito nos passos 2.1.1 e 2.1.2.
- Colheita subculturada S. aureus quando atingiu o crescimento mid-exponencial, transferindo 1 mL de bactérias cultivadas para um tubo de microcentrífuga de 1,5 mL e centrífuga em 5.000 × g para 5 min à temperatura ambiente.
NOTA: nossas condições de crescimento, EUA300 e USA300ΔsaeR/S atingiram a fase de crescimento mid-exponencial após aproximadamente 135 min de incubação6. - Lave S. aureus após a centrífuga aspirando o supernatant, resuspendendo as bactérias pelleted em 1 mL de DPBS, vortexing a amostra para 30 s, e centrífuga em 5.000 × g para 5 min na temperatura ambiente.
- Opsonize S. aureus resuspendendo a pelota bacteriana em 1 mL de 20% de soro humano diluído com DPBS e incubando a 37 °C com agitação por 15 min.
- Centrífuga opsonizou bactérias a 5.000 x g por 5 minutos à temperatura ambiente. Lave S. aureus após centrífuga, aspirando o supernatant, resuspendendo as bactérias pelleted em 1 mL DPBS, em seguida, vórtice a amostra até que a pelota bacteriana é completamente quebrado mais um adicional de 30 segundos. Bactérias centrífugas a 5.000 × g por 5 min à temperatura ambiente.
- Resuspender as cepas opsonizadas de S. aureus em 1 mL RPMI, vórtice a amostra até que a pelota bacteriana esteja completamente quebrada e, em seguida, por mais 30 s. Coloque as bactérias no gelo.
- Diluir cepas opsonizadas de S. aureus para a concentração desejada com RPMI gelada. Vórtice por 30 s e coloque no gelo.
- Confirme a concentração de S. aureus opsonizado por revestimento 1:10 diluições em série de bactérias em ágar de soja tripptic.
NOTA: Como as diferenças na concentração de bactérias utilizadas neste ensaio podem ter um grande impacto na permeabilidade subsequente da membrana plasmática pmn (Figura 3A),é muito importante que a concentração de cada cepa testada seja determinada para cada experimento e seja equivalente entre cepas. - Adicione suavemente 100 μL/bem de cada cepa S. aureus ou RPMI (para controles positivos e negativos) a PMNs na placa de 96 poços no gelo a partir do passo 1.14. Placa suavemente rock para distribuir S. aureus em poços.
- Sincronizar a fagocitose centrífuga com 500 × g por 8 min a 4 °C15. Placa incubada a 37 °C imediatamente após a centrifugação (T = 0).
- Nos horários desejados, retire a placa da incubadora e coloque no gelo. Adicione 40 μL de 0,5% Triton X-100 para o bem de controle positivo.
- Delicadamente pipeta as amostras para cima e para baixo em cada poço para retirar completamente todos os PMNs aderiram à placa, em seguida, transferir as amostras para fluir tubos de citometria no gelo contendo 200 μL de Gelo-frio DPBS com 1 μL de iodeto propidium.
- Analise amostras para coloração de iodeto propidium usando citometria de fluxo, conforme descrito no passo 2.9.
Resultados
Demonstramos como os procedimentos descritos acima podem ser usados para quantificar relativamente a citotoxicidade de S. aureus contra PMNs humanos usando MRSA PFGE-tipo USA300 e um mutante de exclusão isogênica de saeR/S nesta cepa (USA300ΔsaeR/S)gerado em estudos anteriores6. Pmns isolados usando os procedimentos descritos na seção 1 deste protocolo foram manchados com iodeto propidium e examinados usando citometria de fluxo. Parcelas de dispersão para a frente e laterais foram usadas para ilustrar a contaminação de PMNs purificados por monócitos ou linfócitos (Figura 1A,B)e integridade pmn foi determinada usando coloração de iodeto propídio (Figura 1C). O método descrito de purificação pmn humana pode consistentemente produzir 0,5 x 107 a 1 x 108 PMNs que são >98% puro e são >95% propidium iodeto negativo.
A citotoxicidade das proteínas extracelulares produzidas pelos EUA300 e USA300ΔsaeR/S foi testada contra PMNs purificados (Figura 2)seguindo os procedimentos descritos na seção 2 deste protocolo. Esses experimentos demonstram um aumento dependente de concentração na coloração de iodeto propidium de PMNs purificados após 30 min de intoxicação com proteínas extracelulares produzidas pela USA300 (Figura 2B). Estudos anteriores demonstraram que o sistema de dois componentes SaeR/S é importante para a expressão deinúmeros leukocinas bicomponentes que visam PMNs humanos6,10,11,16. Congruente com esses achados anteriores, muito poucos PMNs positivos propidium foram detectados após a exposição a proteínas extracelulares produzidas pelo USA300ΔsaeR/S (Figura 2B). Outros experimentos demonstraram um aumento constante na proporção de PMNs lysed após intoxicação por usa300 proteínas extracelulares que se estabilizou após cerca de 30 min (Figura 2C). A lise mínima de PMNs humanos foi anotada em todos os pontos de tempo que seguem a exposição às proteínas extracelulares produzidas por USA300ΔsaeR/S. Estes resultados ilustram a utilidade deste ensaio para a quantificação relativa da citotoxicidade por proteínas extracelulares de S. aureus de encontro aos PMNs humanos.
Testamos USA300 e USA300ΔsaeR/S usando o ensaio de citotoxicidade de S. aureus contra PMNs humanos após a fagocitose que é descrita na seção 3 deste protocolo (Figura 3). Observou-se 90 min um aumento dependente de concentração na proporção de PMNs positivos propidium iodide Observou-se uma diminuição significativa na proporção de PMNs que foram propidium iodede positivo após a fagocitose de USA300ΔsaeR/S (Figura 3A),apoiando outros resultados que indicam que o sistema de dois componentes saer/s é importante para a citotoxicidade de S. aureus contra PMNs humanos (Figura 2)7,11. Como mencionado anteriormente e demonstrado na Figura 3A,as diferenças na concentração de S. aureus têm um impacto pronunciado na lyse pmn após a falsina. A enumeração do USA300 e USA300ΔsaeR/S inoculum usado em cada um desses experimentos demonstrou que o contraste na citotoxicidade entre essas cepas não se deveu a diferenças na concentração de bactérias utilizadas (Figura 3B). Estes resultados mostram como o ensaio da citotoxicidade do S. aureus de encontro aos PMNs humanos que seguem o phagocytosis pode ser usado para avaliar a habilidade de tensões diferentes do S. aureus de comprometer a integridade humana da membrana do plasma de PMN.

Figura 1: Análise de citometria de fluxo de PMNs purificados. Parcelas representativas do bloco da citometria do fluxo de(A)PMNs humanos purificados e(B)PMNs que foram contaminados propositadamente com as pilhas mononuclear periféricas do sangue. (C)Histograma de citometria de fluxo representativo demonstrando manchas mínimas de iodeto propidium (<1%) de PMNs purificados (cinza sombreado) em comparação com PMNs tratados com 0,05% Triton X-100 (vermelho sombreado). Clique aqui para ver uma versão maior deste número.
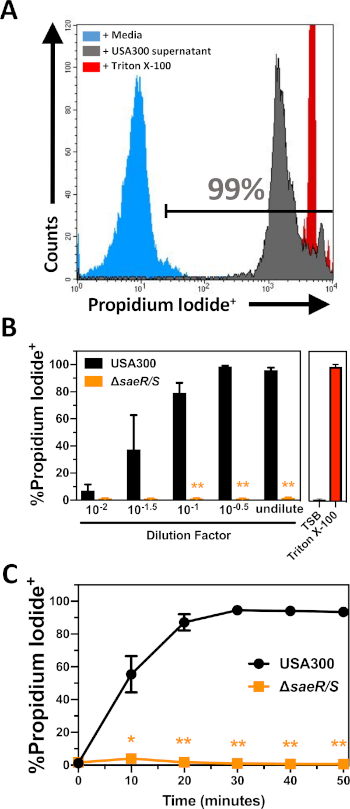
Figura 2: Análise de citometria de fluxo de PMNs intoxicadas com proteínas extracelulares produzidas por S. aureus. (A)Histograma de citometria de fluxo representativo de PMNs manchado com iodeto propidium após 30 min de incubação com controle de mídia (azul sombreado), filtrado supernatant EUA300 em uma concentração final de 1:110 (cinza sombreado), ou 0,05% Triton X-100 (vermelho sombreado). (B) A proporção de PMNs positivos propidium iodide após 30 min de incubação com diferentes concentrações de USA300 ou EUA300saeR/S supernatants. (C) A proporção de PMNs positivos propidium positivo ao longo do tempo após a incubação com EUA300 ou EUA300saeR / S supernatant em uma concentração final de 1:110. Os dados são apresentados como média ± SEM de pelo menos 3 experimentos separados com * p ≤ 0,05 e ** p ≤ 0,005 conforme determinado por t-test de duas caudas. Clique aqui para ver uma versão maior deste número.
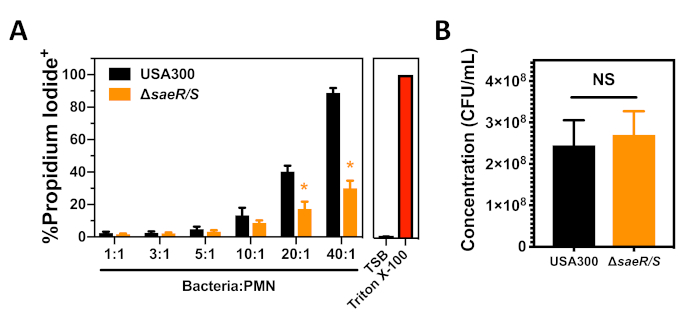
Figura 3: Análise de citometria de fluxo de PMNs após a fagocitose de S. aureus. (A) A proporção de PMNs positivos do iodeto do propidium 90 min após o phagocytosis de concentrações diferentes de EUA300 ou de USA300saeR/S. (B) Concentração de cepas opsonizadas de S. aureus usadas para os experimentos mostrados no painel A. Os dados são apresentados como média ± SEM de 4 experimentos separados com * p ≤ 0,01 conforme determinado pelo t-test de duas caudas. Clique aqui para ver uma versão maior deste número.
Discussão
Este protocolo descreve a purificação de PMNs do sangue humano e dois ensaios distintos que usam o iodeto do propídio para quantificar a citotoxicidade de S. aureus de encontro a estas pilhas imunes inatas importantes. O sucesso desses procedimentos dependerá da qualidade das PMNs purificadas e da preparação adequada de S. aureus e proteínas extracelulares produzidas por esse patógeno. Para o isolamento das PMNs, é importante minimizar a ativação da PMN durante e após a purificação usando reagentes livres de contaminação por endotoxinas, tratando as preparações celulares suavemente e mantendo as células na temperatura adequada. Sinais que indicam ativação de PMNs incluem aglomeração de células durante a purificação e quando mais de 5% das células isoladas mancham positivo para iodeto propídio. Devido à vida útil relativamente curta das PMNs, essas células devem ser isoladas do sangue humano e testadas no mesmo dia. Pmns começará a exibir sinais de apoptose espontânea se deixado no gelo por mais de 3 h após a purificação. Como mencionado anteriormente, é muito importante que cada preparação pmn é cuidadosamente avaliada usando análise de citometria de fluxo de dispersão para a frente e lateral, bem como coloração de iodeto propídio para garantir a pureza e integridade das células isoladas.
A expressão de leukocinas bicomponentes por S. aureus é responsável pela maioria da integridade comprometida da membrana plasmática pmn que é observada usando os ensaios descritos neste protocolo. A variação na expressão dessas toxinas e outros peptídeos formadores de poros, como modulinas solúveis fenóis, entre cepas de S. aureus produzirá diferenças na citotoxicidade contra PMNs humanos. Desvios significativos durante o crescimento in vitro entre cepas de S. aureus também influenciarão a expressão de toxinas formadoras de poros e citotoxicidade subsequente. Além disso, a proporção de S. aureus para PMNs em ensaios de fagocitose tem um grande impacto na permeabilidade subsequente da membrana plasmática pmn (Figura 3A)e esses experimentos exigem a colheita consistente de concentrações iguais de cada cepa S. aureus testada em fase de crescimento mid-exponencial usando o OD600 de bactérias subculturas. Dadas essas considerações, é muito importante definir curvas de crescimento para todas as cepas que serão examinadas antes de iniciar ensaios de citotoxicidade. Não recomendamos esses métodos para analisar a citotoxicidade de S. aureus com cepas que apresentam diferenças significativas de crescimento in vitro.
EUA300 é um isolado MRSA virulento que é conhecido por ser altamente citotóxico contra PMNs humanos15 ea perda de SaeR / S nesta estirpe reduz drasticamente a transcrição de inúmeros bi-componente leukocidins que visam PMNs humanos6,12, tornando essas cepas modelos ideais para comparar a citotoxicidade usando os ensaios descritos. No entanto, há uma extensa variação genética entre diferentes isolados de S. aureus e os parâmetros detalhados nesses protocolos podem não resultar em mudanças substanciais na citotoxicidade contra PMNs humanos ao testar outras cepas de S. aureus. Adaptação das condições de crescimento, volumes de supernatantes adicionados, ou proporção de bactérias para PMNs pode ser necessária para o sucesso com estes métodos usando outras cepas de S. aureus.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelos Institutos Nacionais de Bolsas de Saúde nih-1R56AI135039-01A1, 1R21A128295-01, U54GM115371, bem como fundos da Montana State University Agriculture Experiment Station, e uma concessão de equipamentos da Murdock Charitable Trust Trust .
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP, 500 mL VIAFLEX Plastic Container | Baxter | 2B1323Q | PMN purification |
| 1.5 mL micro-centrifuge tubes with Snap Caps | VWR | 89000-044 | Used in washing cells |
| 1.8% Sodium Chloride Solution | Sigma-Aldrich | S5150 | PMN purification |
| 12x75mm Culture tubes | VWR | 60818-430 | Used as flow cytometry tubes |
| 20% (w/w) Dextran | Sigma-Aldrich | D8802 | PMN purification |
| 3125 Hand Tally Counter | Traceable Products | 3125CC | For counting cells |
| 50 mL conical centrifuge tubes | VWR | 89039-656 | For dispensing media |
| Bacto Tryptic Soy Broth, Soybean-Casein Digest Medium | FischerScientific | 211823 | For growing cell cultures |
| BD Disposable Syringes with Luer-Lok Tips, 3 mL | FischerScientific | BD 309657 | For filtering supernatants |
| Bright-Line Hemocytometer | Sigma-Aldrich | Z359629 | Cell counting apparatus |
| DPBS, 1x (Dulbecco's Phosphate Buffered Saline) with calcium and magnesium | Corning | 21-030-CV | Used in washing cells |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | PMN purification |
| Fisherbrand Sterile Polystyrene Disposable Serological Pipets | FischerScientific | 13-678-11E | For aspirating liquid |
| Greiner CELLSTAR 96 well plates | Millipore Sigma | M0687 | Plate for holding experimental samples |
| OMICRON Syringe Filters | Omicron Scientific | SFPV13R | For filtering supernatants |
| Propidium iodide | ThermoFisher Scientific | P3566 | Membrane impermeable DNA stain |
| PYREX Brand 4980 Erlenmeyer Flasks | Cole-Parmer | EW-34503-24 | For growing cell cultures |
| RPMI 1640, 1X without L-glutamine, phenol red | Corning | 17-105-CV | Used in resuspending cells |
| Sterile Water for Irrigation, USP | Baxter | 2F7113 | PMN purification |
| The Pipette Pump | Bel-Art Products | F37898 | For aspirating liquid |
| Triton X-100 | Sigma-Aldrich | X100 | Membrane integrity positive control |
Referências
- Foster, T. J., Geoghegan, J. A., Ganesh, V. K., Höök, M. Adhesion, invasion and evasion: The many functions of the surface proteins of Staphylococcus aureus. Nature Reviews Microbiology. , (2014).
- Thammavongsa, V., Kim, H. K., Missiakas, D., Schneewind, O. Staphylococcal manipulation of host immune responses. Nature Reviews Microbiology. 13 (9), 529-543 (2015).
- Otto, M. Staphylococcus aureus toxins. Current Opinion in Microbiology. , (2014).
- Guerra, F. E., Borgogna, T. R., Patel, D. M., Sward, E. W., Voyich, J. M. Epic Immune Battles of History: Neutrophils vs. Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 7, (2017).
- Nygaard, T., Malachowa, N., Kobayashi, S. D., DeLeo, F. R. Phagocytes. Management of Infections in the Immunocompromised Host. , 1-25 (2018).
- Nygaard, T. K., Pallister, K. B., Ruzevich, P., Griffith, S., Vuong, C., Voyich, J. M. SaeR Binds a Consensus Sequence within Virulence Gene Promoters to Advance USA300 Pathogenesis. The Journal of Infectious Diseases. 201 (2), 241-254 (2010).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. J Infect Dis. 199 (11), 1698-1706 (2009).
- Borgogna, T. R., et al. Secondary Bacterial Pneumonia by Staphylococcus aureus Following Influenza A Infection Is SaeR/S Dependent. The Journal of Infectious Diseases. , (2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100, 1-6 (2016).
- Zurek, O. W., et al. The role of innate immunity in promoting SaeR/S-mediated virulence in Staphylococcus aureus. J Innate Immun. 6 (1), 21-30 (2014).
- Nygaard, T. K., et al. Aspartic Acid Residue 51 of SaeR Is Essential for Staphylococcus aureus Virulence. Frontiers in Microbiology. 9, 3085 (2018).
- Spaan, A. N., Van Strijp, J. A. G., Torres, V. J. Leukocidins: Staphylococcal bi-component pore-forming toxins find their receptors. Nature Reviews Microbiology. , (2017).
- Bøyum, A. Isolation of mononuclear cells and granulocytes from human blood. Scandinavian Journal of Clinical and Laboratory. , (1968).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. , (2014).
- Voyich, J. M., et al. Insights into mechanisms used by Staphylococcus aureus to avoid destruction by human neutrophils. J Immunol. 175 (6), 3907-3919 (2005).
- Voyich, J. M., et al. The SaeR/S gene regulatory system is essential for innate immune evasion by Staphylococcus aureus. The Journal of Infectious Diseases. 199 (11), 1698-1706 (2009).
Erratum
Formal Correction: Erratum: Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes
Posted by JoVE Editors on 6/10/2021. Citeable Link.
An erratum was issued for: Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes. The title was updated.
The title was updated from:
Quantifying the Cytotoxicity of Staphyloccus aureus Against Human Polymorphonuclear Leukocytes
to:
Quantifying the Cytotoxicity of Staphylococcus aureus Against Human Polymorphonuclear Leukocytes
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados