Method Article
Evaluación de la capacidad fagocítica específica por edad de los hemocitos de Drosophila melanogaster adultos utilizando un ensayo de fagocitosia In Vivo
En este artículo
Resumen
Este protocolo describe un ensayo in vivo de fagocitosis utilizado para evaluar y cuantificar la capacidad de los hemocitos de Drosophila melanogaster jóvenes y envejecidos a las bacterias fagocitosas..
Resumen
La fagocitosis es una función esencial de la respuesta inmunitaria innata. Este proceso se lleva a cabo por hemocitos fagocíticos cuya función principal es reconocer una amplia gama de partículas y destruir patógenos microbianos. A medida que los organismos envejecen, este proceso comienza a disminuir, pero poco se sabe sobre los mecanismos subyacentes o la base genética de la inmunosoncia. Aquí, un ensayo de fagocitosis in vivo basado en inyección se utiliza para evaluar los cambios relacionados con la edad en diferentes aspectos de la fagocitosis, como la unión, el engullido y la degradación de partículas internalizadas, cuantificando los eventos fagocíticos en los hemocitos en Drosophila adulta. Drosophila Por un solo lugar, muchos componentes genéticos y funciones de la respuesta inmunitaria innata, incluida la fagocitosis, se conservan evolutivamente entre Drosophila y los mamíferos. Debido a eso, los resultados obtenidos del uso de este protocolo son propensos a ser ampliamente relevantes para entender los cambios relacionados con la edad en la función inmune en una variedad de organismos. Además, observamos que este método proporciona estimaciones cuantitativas de la capacidad fagocítica de hemocitos, que podrían ser útiles para una variedad de temas de investigación, y no tienen por qué limitarse a estudios de envejecimiento.
Introducción
El sistema inmunitario innato, que consiste en barreras físicas y químicas a la infección, así como componentes celulares, es evolutivo conservado a través de organismos multicelulares1,2. Como primera línea de defensa, el sistema inmune innato desempeña un papel crítico en la lucha contra los patógenos invasores en todos los animales1,2,3. Los componentes de la respuesta inmunitaria innata incluyen una amplia gama de tipos celulares que se clasifican sobre la base de que carecen de especificidad y memoria inmunológica2,3,4. En los seres humanos, estos tipos de células incluyen monocitos fagocíticos y macrófagos, neutrófilos, y células asesinas naturales citotóxicas4,5. Si bien tener un sistema inmunitario funcional es imprescindible para la supervivencia del huésped, está claro que la función de las células inmunitarias disminuye con la edad, un fenómeno conocido como inmunosensia5,6. Ser capaz de evaluar los cambios relacionados con la edad en la respuesta inmune, incluyendo diferentes aspectos del proceso de fagocitosis, podría ayudar en nuestra comprensión de la inmunosidad. El procedimiento que describimos aquí proporciona un enfoque eficaz y repetible para evaluar y cuantificar eventos fagocíticos por hemocitos en Drosophila melanogaster.
Drosophila es un modelo ideal para estudiar la respuesta inmune por muchas razones. Por un ejemplo, hay un amplio conjunto de herramientas genéticas disponibles que permiten manipular fácilmente la expresión génica de una manera dependiente del tejido7. Estas herramientas incluyen una colección de mutantes, existencias de interferencia de ARN, existencias DE GAL4/UAS y el Panel de Referencia Genética de Drosophila que contiene 205 líneas endogámicas diferentes para las que se catalogan todas las secuencias del genoma8. El corto ciclo de vida de Drosophila y el gran número de individuos producidos permiten a los investigadores probar múltiples individuos en un entorno controlado, en un corto período de tiempo. Esto mejora en gran medida la capacidad de identificar diferencias sutiles en las respuestas inmunitarias a la infección entre genotipos, entre sexos o a través de edades. Es importante destacar que muchos componentes genéticos y funciones de la respuesta inmunitaria innata, incluida la fagocitosis, se conservan evolutivamente entre Drosophila y los mamíferos1,2.
En Drosophila, el proceso de fagocitosis que sigue a la infección se lleva a cabo por hemocitos fagocíticos llamados plasmatocitos, que son equivalentes a los macrófagos de mamíferos9. Los hemocitos son esenciales para reconocer una amplia gama de partículas y eliminar patógenos microbianos9,10,11,12,13. Estas células expresan una variedad de receptores que deben diferenciarse de sí mismos de los no propios, e iniciar eventos de señalización necesarios para llevar a cabo el proceso fagocítico10,,11,12,13,14,15. Una vez que una partícula está unida, comienza a ser interiorizada por reorganización del citoesqueleto de actina y remodelación de la membrana plasmática para expandirse alrededor de la partícula, formando una copa fagocítica11,12,13,14. Durante este proceso, otro conjunto de señales indica a la célula que internalice aún más la partícula cerrando la copa fagocítica, formando un fagosoma ligado a la membrana11,12,13,14,15. El fagosoma se somete entonces a un proceso de maduración, asociándose con diferentes proteínas y fusionándose con lisosomas, formando un fagosoma ácido11,12,13,14,15. En este punto, las partículas pueden ser eficientemente degradadas y eliminadas11,12,13,14,15. Los estudios de Drosophila han revelado que las moscas mayores (4 semanas de edad) tienen una capacidad reducida para eliminar una infección en comparación con las moscas más jóvenes (1 semana de edad), probablemente debido, al menos en parte, a una disminución en algunos aspectos de la fagocitosis16,,17.
El método descrito aquí utiliza dos partículas de E. coli de muerte por calor etiquetadas fluorescentemente separadas, una con un fluoróforo estándar y otra sensible al pH, para evaluar dos aspectos diferentes de la fagocitosis: el engullimiento inicial de las partículas y la degradación de las partículas en el fagosoma. En este ensayo, la fluorescencia fluoroparta-partícula es observable cuando las partículas están unidas y engullidas por hemocitos, mientras que las partículas sensibles al pH fluoresce sólo en las condiciones de pH bajo del fagosoma. Los eventos fluorescentes se pueden observar en hemocitos que se localizan a lo largo del vaso dorsal. Nos centramos en los hemocitos localizados en el vaso dorsal, que proporcionan un punto de referencia anatómico para localizar hemocitos que se sabe que contribuyen al aclaramiento bacteriano, y para aislarlos constantemente. Sin embargo, los hemocitos en otras partes del cuerpo y la hemolymph también son importantes para el aclaramiento. Aunque no hemos estudiado esta población celular, nuestro procedimiento general podría ser aplicable para los ensayos fagocíticos de estas células también. Una ventaja de nuestro enfoque es que podemos cuantificar eventos fagocíticos dentro de hemocitos individuales, lo que nos permite detectar variaciones sutiles en los procesos fagocíticos. Otros estudios que visualizan eventos fluorescentes a través de la cutícula18,,19 no tienen en cuenta las diferencias en el número de hemocitos presentes, lo que es especialmente importante a considerar en nuestro caso ya que se espera que el recuento total de hemocitos cambie con la edadde 17años.
Protocolo
1. Recoger y envejecer Drosophila
- Para generar las mismas moscas F1 envejecidas para analizar la fagocitosis, agregue 5-10 hembras vírgenes y 5 machos de los genotipos apropiados a un vial que contenga alimentos frescos para moscas. Utilizamos un alimento a base de melaza de harina de maíz20,pero el método debe funcionar independientemente del tipo de dieta en la que se crían las moscas. Para este experimento utilizamos Hemese (He)-GAL4; UAS-GFP vuela para etiquetar hemocitos genéticamente.
NOTA: Se pueden utilizar más moscas, pero algunas líneas de D. melanogaster pueden no aparearse o reproducirse bien cuando están superpobladas, y el hacinamiento puede tener efectos adversos en el desarrollo larvario21 y la fagocitosis. - Mantener las moscas bajo las condiciones experimentales deseadas. Para este experimento, mantenga He-GAL4; UAS-GFP vuela a 24oC. Permita que las moscas adultas se aparees durante una semana y luego retire a los adultos. Las moscas F1 se recogerán de estos viales después de la eclosión para uso experimental.
- Recoger moscas vírgenes durante toda la semana, o hasta que se recoja el número deseado de moscas. Las vírgenes no son necesarias; sin embargo, el apareamiento puede afectar la respuesta inmune. Si las moscas F1 deben ser probadas como vírgenes, separe a los machos y a las hembras dentro de las 8 horas posteriores a la eclosión y mantengadas en viales separados para evitar el apareamiento. Recoger suficientes moscas para permitir la evaluación de la fagocitosis en al menos 10 moscas por genotipo/tratamiento/sexo por edad.
- Si envejece las moscas a una semana, recoja al menos 50 moscas en total, o 20 moscas por condición de tratamiento para cada partícula, ya sea partículas fluoroelédicas o partículas sensibles al pH, que se inyectarán. Esto asegurará un mínimo de 10 moscas para ensayar en el momento del experimento.
- Si el envejecimiento vuela a más de 3 semanas, recoja al menos 100-150 moscas en total, o 50-75 moscas por condición de tratamiento para asegurarse de que hay suficientes moscas disponibles para medir la fagocitosis. Cuando envejece vuela en el laboratorio, normalmente usamos jaulas de insectos mantenidas a 24 oC en 12:12 L:D condiciones, y cambiar la comida cada dos días. Si se utilizan viales en lugar de jaulas, la punta vuela en viales nuevos cada 3-5 días, dependiendo del estado de los alimentos en el vial. El número de moscas necesarias dependerá de la tardación en la edad en que se analice la fagocitosis, y de las tasas de supervivencia específicas de la edad de ese genotipo en una condición ambiental determinada.
- Si se evaluarán las moscas jóvenes y envejecidas, planifique en consecuencia para que las moscas de 1 semana de edad y envejecidas se inyecten el mismo día. Esto minimizará las variaciones en la concentración de partículas entre experimentos y asegurará que el efecto de la edad en la medición fagocítica no se confunda con el efecto del día en que se realizó el ensayo.
- Casa las moscas recogidas a 24 oC hasta que tengan 5-7 días de edad, o mantener las moscas a la edad deseada.
2. Preparar partículas con etiqueta fluorescente
- Reconstituir las partículas de E. coli o partículas de E. coli sensibles al pH a una concentración de 20 mg/ml o 1 mg/ml, respectivamente. Otras bacterias están disponibles para su uso que pueden ser más adecuados para ciertos experimentos, pero consulte las instrucciones del fabricante para las concentraciones de stock adecuadas.
- En el sentido de las partículas fluoradas, añada 990 l de 1x PBS (pH 7.4) o tampón preferido y 10 l de 2 mM (20%) azida sódica. Vórtice para mezclar.
NOTA: El azida sódica es un conservante que puede omitirse; sin embargo, las partículas preparadas sin azida sódica no duran tanto. Las partículas fluoroelécticas deben utilizarse en un plazo de 24 horas y las partículas sensibles al pH deben utilizarse en un plazo de 7 días. - Para partículas sensibles al pH, añada 1.980 ml de 1x PBS (pH 7.4) o tampón preferido y 20 ml de 2 mM (20%) azida sódica. Vórtice para mezclar.
- Haga múltiples alícuotas de un solo uso de 20 ml en tubos de microcentrífuga de 1,5 ml. Almacene las partículas fluoro a -20 oC durante un año, y las partículas sensibles al pH a 4 oC durante un máximo de 6 meses, protegidas de la luz.
- En el sentido de las partículas fluoradas, añada 990 l de 1x PBS (pH 7.4) o tampón preferido y 10 l de 2 mM (20%) azida sódica. Vórtice para mezclar.
- El día de las inyecciones, retire el azida sódica de las partículas antes de su uso. Para ello, centrifugar las partículas durante 5 min a 15.000 x g a temperatura ambiente.
- Retire el sobrenadante y lave las partículas dos veces resuspendiendo en 50 l de 1x PBS o tampón preferido, y centrífuga durante 5 min a 15.000 x g.
- Después del segundo lavado, retire las partículas sobrenadantes y resuspendidas en 100 l de 1x PBS o tampón preferido. Mantenga la solución en el tubo y minimice la exposición a la luz durante todo el experimento. Una vez que se elimina el azida sódica, utilice fluoropartas en un plazo de 24 h y utilice partículas sensibles al pH utilizadas en un plazo de 5-7 días.
NOTA: En nuestros experimentos anteriores, descubrimos que esta concentración de partículas proporcionaba un número contable de eventos fagocíticos y que el número de partículas disponibles para la fagocitosis por los hemocitos no limitaba17. Sin embargo, los usuarios de este protocolo pueden querer comparar los resultados utilizando otras concentraciones para asegurarse de que hay un número adecuado de partículas disponibles para la fagocitosis por hemocitos en las condiciones de sus experimentos.- Si se omitió el azida sódica, diluya las partículas 1:5 en el mismo tampón con el que se prepararon las partículas, para las inyecciones.
- Agregue una gota de colorante de alimentos verdes a las partículas. Esto hace que sea más fácil asegurarse de que las moscas se han inyectado.
3. Inyecte las moscas
- Prepare agujas de vidrio para inyecciones.
- Tire de las agujas de vidrio con un tirador de pipetas. Ajuste el calentador del tirador de pipeta a 55 oC y el solenoide a 45. Utilice únicamente las agujas provistas con el inyector, ya que no se garantiza que otras agujas funcionen con la misma precisión.
- Llene una jeringa estéril de 1 ml con aceite mineral y adjunte la aguja hipodérmica (G) del calibre 30, provista del nanoinyector.
- Rellene la aguja capilar tirada insertando la aguja de 30 G en el extremo romo de la aguja de vidrio tirado y llene con aceite mineral. Retire lentamente la aguja de 30 G, asegurándose de que no haya burbujas de aire en toda la aguja, ya que esto puede causar volúmenes de inyección inexactos. El inyector no funcionará correctamente sin rellenar la aguja.
- Con fórceps, rompa la punta de la aguja para crear una abertura que permita la expulsión de la solución.
- Montar el nano-inyector.
NOTA: Se pueden utilizar otros inyectores. El método descrito a continuación se aplica al nanoinyector. Para otros inyectores, consulte el manual del usuario para obtener instrucciones.- Ajuste el inyector al volumen deseado (entre 46 nL y 69 nL).
- Retire el collet y coloque la junta tórica de sellado, el espaciador blanco con la sangría hacia arriba para recibir el extremo posterior de la aguja, y la junta tórica más grande en el émbolo de metal, en ese orden. Vuelva a colocar la pinza sin apretarla.
- Inserte el émbolo metálico en el extremo romo de la aguja de vidrio llena de aceite. Empuje suavemente la aguja hacia abajo, insertándola en la junta tórica más grande. Apriete la pinza hasta que esté segura.
NOTA: Si el émbolo metálico no se extiende más allá de la pinza, mantenga pulsado 'EMPTY' hasta que el émbolo esté visible. Esto facilita la inserción del émbolo en la aguja. - Mantenga pulsado 'EMPTY' hasta que el inyector sue un pitido. Esto expulsa la mayor parte del aceite mineral de la aguja, dejando un pequeño volumen de aceite para actuar como una barrera entre los dos líquidos, así como elimina las burbujas de aire.
- Llene la aguja con partículas fluoropartas o partículas sensibles al pH insertando la punta de la aguja de vidrio en el tubo de microcentrífuga que contiene las partículas preparadas.
- Mantenga pulsado 'FILL' hasta que el inyector sue un pitido.
- Inyecciones
- Transfiera las moscas que se van a inyectar en un vial vacío. Inmovilizar las moscas colocando el vial en hielo. El CO2 también se puede utilizar para inmovilizar a las moscas. Sin embargo, tenga en cuenta que, cuando se utilizan partículas sensibles al pH, los niveles elevados deCO2 pueden acidificar artificialmente cualquier búfer que se utilice y puede elevar la fluorescencia de fondo.
- Inyectar las moscas en la placa esteropleural del tórax (Figura 1A). La inyección es exitosa si se ve tinte verde entrando en la marcha(Figura 1B). Si la mosca no se vuelve verde, asegúrese de que la aguja no esté obstruida.
NOTA: Alternativamente, las moscas se pueden inyectar en el abdomen, pero mantener el lugar de inyección consistente en todos los experimentos. - Coloque las moscas inyectadas en un vial de alimentos nuevo, observando el momento en que se inyectó la primera y la última mosca. Para minimizar el error experimental debido a la cantidad de tiempo que se tarda en completar las inyecciones, inyecciones completas de manera oportuna. Con la práctica, no debe tomar más de 10 minutos para inyectar un conjunto de moscas. Colocar el vial de lado hasta que todas las moscas se hayan recuperado, para evitar que las moscas se atasquen en el alimento.
- Permita que las moscas se recuperen durante 60-90 min, dependiendo de las condiciones experimentales. Aquí, se utilizó un tiempo de recuperación de 60 minutos. Tenga en cuenta que este intervalo de tiempo de recuperación fue óptimo para contar eventos fagocíticos en las condiciones experimentales en el estudio Horn et al.17. Sin embargo, en algunas condiciones, esto puede ser demasiado largo para detectar diferencias sutiles en la fagocitosis entre los grupos de tratamiento. Puede ser útil llevar a cabo experimentos de curso de tiempo como se hizo anteriormente17 para determinar el tiempo de recuperación que revelará las diferencias máximas entre el control y los resultados experimentales. Sea cual sea el tiempo de recuperación elegido, mantenga esto consistente en todos los tratamientos experimentales.
- Si se inyecta con partículas fluoropartas y partículas sensibles al pH el mismo día, utilice una aguja nueva para cada solución. No inyecte moscas individuales con ambas partículas si ambas fluoresce rojo, ya que el resultado no diferenciaría entre los dos aspectos de la fagocitosis, la unión/engullimiento de partículas frente a la inclusión de partículas en el fagoso.
4. Disección del vaso dorsal
- Después de que las moscas se hayan recuperado durante 60-90 minutos, transfiera todas las moscas vivas a un vial vacío e inmovilice sobre hielo.
- Transfiera una mosca a la vez a una placa de disección de elastómero de silicona.
NOTA: Prepare las placas de disección al menos 1 semana antes de su uso, si se cura a temperatura ambiente. Para ello, prepara el elastómero y vierte en un plato Petri de 33 mm x 10 mm, llenando el plato a mitad de camino. Toque suavemente el plato sobre una superficie plana para minimizar las burbujas de aire. Deje que los platos se sienten a temperatura ambiente, sin perturbaciones, durante al menos una semana.- Bajo un microscopio estéreo diseccionado, oriente el lado ventral de la mosca hacia arriba.
- Usando alfileres de insectos, fijar la mosca en la placa insertando un alfiler a través del tórax y otro alfiler a través del extremo más posterior del abdomen, cerca de los genitales (Figura 2A). Puede ser útil cortar los pasadores por la mitad antes de fijar la muestra para no obstruir la disección. Repita con hasta 10 moscas por placa de disección.
NOTA: Opcional: Retire las alas y las patas antes de fijar la mosca a la placa. Esto ayudará a evitar que se forme una burbuja alrededor de la mosca cuando se agregan medios. - Una vez que todas las moscas han sido fijadas a la placa, agregue suficiente medio de disección para cubrir las moscas (1 ml) usando una pipeta de transferencia.
- Con fórceps o tijeras de cutícula, retire la cabeza.
- Usando tijeras de cutícula, haga dos incisiones horizontales: una directamente por encima del pasador posterior en el abdomen, y otra en el extremo más anterior del abdomen, donde el tórax y el abdomen se encuentran(Figura 2B, C). En la Figura 2,la cabeza se dejó intacta para aclarar la orientación.
- Haga una incisión vertical, conectando las dos incisiones horizontales (los tres cortes se asemejan a la letra I). Esto abrirá la cavidad abdominal(Figura 2D).
- Usando fórceps, retire los órganos internos y el tejido, evitando el vaso dorsal. Si no se perturba, el vaso dorsal transparente a menudo se puede ver pulsando cerca del extremo anterior del abdomen. Se pueden utilizar pasadores adicionales para fijar los extremos de corte recién cortados de la cutícula(Figura 2E, F).
- Con tijeras de cutícula, retire el tórax. Alternativamente, el tórax se puede quitar antes de montar las cutículas diseccionadas y el vaso dorsal en un portaobjetos del microscopio.
- Repita con las moscas restantes. diseccionar vuela de manera oportuna, para minimizar las posibles variaciones en la tasa fagocítica. Una vez que todas las moscas han sido diseccionadas, deje las cutículas con el vaso dorsal adjunto fijado a la placa. Todo el paso 5 se llevará a cabo en la placa de disección. Esto evitará dañar o descartar accidentalmente las cutículas entre pasos.
5. Fijación y tinción
- Fijar cutículas diseccionadas con vaso dorsal adjunto en 4% de paraformaldehído (PFA).
- Usando una nueva pipeta de transferencia desechable para cada paso, deseche el medio de disección y sustitúyalo con 1 ml de 4% de PFA. A lo largo de la fijación y tinción, mantenga las disecciones protegidas de la luz tanto como sea posible.
- Incubar a temperatura ambiente durante 15 min con balanceo a 20 rpm. No permita que las disecciones se sienten en fijador durante más de 20 minutos, ya que esto podría comenzar a dañar el tejido.
- Lavar las cutículas 2x en 1x PBS + 0.1% Tween (PBST).
- Retire el fijador y sustitúyalo con 1 ml de 1x PBST.
- Lavar a temperatura ambiente durante 15 minutos con balanceo.
- Repita 1x.
NOTA: El tejido fijo diseccionado se puede almacenar a 4 oC, durante un máximo de 3 días, protegido de la luz, después del primer lavado reemplazando el lavado por PBST fresco. No almacene tejido fijo si se utilizarán anticuerpos. Los anticuerpos se deben utilizar con tejido fresco para obtener mejores resultados.
- Opcional: Tinción de anticuerpos. Los anticuerpos se pueden utilizar para visualizar claramente el vaso dorsal(Figura 3),o para detectar marcadores específicos de hemocitos. Esto puede asegurar que sólo se cuenten las células a lo largo del vaso dorsal o para marcar la membrana de los hemocitos.
- Retire el segundo lavado, agregue el anticuerpo primario a la dilución adecuada. Incubar durante la noche a 4oC, balanceándose.
- Retire el anticuerpo primario y lave dos veces con PBST durante 15 minutos con balanceo.
- Añadir anticuerpo secundario fluorescente. Recomendamos un anticuerpo verde-fluorescente para que no oscurezca las partículas fluorescentes. Incubar a temperatura ambiente durante 2 h, con balanceo.
- Retire el anticuerpo secundario, lave dos veces durante 15 minutos cada uno con PBST.
- Mancha con DAPI.
- Retire el lavado final y sustitúyalo con 1 ml de DAPI diluido en PBST (1:1000).
- Mancha durante 20 min con balanceo a temperatura ambiente.
- Retire DAPI y lávelo 2x (repita el paso 5.2).
- Sustituya el lavado final por PBST 1x fresco.
NOTA: Las moscas se pueden almacenar a 4 oC, durante un máximo de 3 días, protegidas de la luz, después del primer lavado reemplazando el lavado por PBST fresco.
6. Montaje de cutículas en diapositivas de microscopio e imágenes
- Prepare las cutículas diseccionadas.
- Bajo el estereomicroscopio diseccionando, corte el exceso de cutícula que podría interferir con la toma de imágenes.
- Usando fórceps, transfiera las cutículas con recipiente dorsal adjunto a un tubo de microcentrífuga de 1,5 ml que contenga 70% de glicerol. Colocar las cutículas en glicerol ayudará a eliminar PBST y permite una imagen más clara durante la toma de imágenes.
- Monte las cutículas en el portaobjetos del microscopio.
- Añadir unas gotas de 70% de glicerol a un portaobjetos.
- Con fórceps, retire las cutículas del tubo de glicerol y colóquelo en el portaobjetos.
- Bajo el microscopio estéreo diseccionante, utilice fórceps para orientar las cutículas del lado ventral hacia arriba, asegurando que el vaso dorsal sea visible. El pigmento más oscuro de la cutícula estará boca abajo.
- Agregue una gota adicional de glicerol, si es necesario. Esto ayuda a prevenir las burbujas de aire y permite una imagen más clara.
- Coloque suavemente un cubreobjetos sobre las cutículas y los bordes del sello con esmalte de uñas. Dejar secar durante 10-15 minutos antes de proceder. Imágenes de las moscas inmediatamente o guárdase en una caja a prueba de luz a 4 oC.
- Imagen del vaso dorsal.
- Usando un microscopio fluorescente, utilice el sistema de interferencia estructural para generar secciones ópticas del recipiente dorsal. Alternativamente, se puede utilizar un microscopio confocal que puede proporcionar precisión adicional. Obtenga imágenes de la pila Z del recipiente dorsal utilizando un software de imagen objetivo 20x y preferido. Agregue una barra de escala de 10 mm y etiquete y guarde correctamente las imágenes como archivos tiff (Figura 4) o el formato deseado.
NOTA: El número de imágenes de la pila Z obtenidas puede variar entre las disecciones y depende de qué tan bien se diseccionó el recipiente dorsal, y del tamaño de paso deseado entre las imágenes. Aquí, el tamaño del paso se estableció en 0,49 mm. Ese número puede variar entre 3 y 40 imágenes por pila en nuestra experiencia.
- Usando un microscopio fluorescente, utilice el sistema de interferencia estructural para generar secciones ópticas del recipiente dorsal. Alternativamente, se puede utilizar un microscopio confocal que puede proporcionar precisión adicional. Obtenga imágenes de la pila Z del recipiente dorsal utilizando un software de imagen objetivo 20x y preferido. Agregue una barra de escala de 10 mm y etiquete y guarde correctamente las imágenes como archivos tiff (Figura 4) o el formato deseado.
7. Analizar imágenes
- Cuantifique los eventos fluorescentes con ImageJ.
- Abra las imágenes y apil á: Imagen , Pilas, à Imágenes a la pila.
- Cuente sólo las señales fluorescentes de 1 mm de tamaño dentro de un diámetro de 10 mm centrado en un núcleo daPI positivo haciendo clic en cada evento de al menosFigure 5A10 células por mosca, de al menos 10 moscas por edad por tipo de partícula inyectado: Plugins . à La herramienta de aviso de contador de celdas asigna un color diferente a cada celda rastreada, con un punto de color que corresponde a cada evento fluorescente en el que se hace clic dentro de esa celda.
- Para enumerar el contador y la posición de la pila asociadas a cada punto, pulse 'm' o seleccione Medir en la pestaña Analizar, o para mostrar el número de eventos contados en cada celda en una tabla de resultados, presione 'alt +y' (Figura 5B).
- Transfiera los recuentos de celdas a una hoja de cálculo que se utilizará para el análisis estadístico.
- Realizar análisis estadísticos.
- Analice las diferencias en los eventos fagocíticos utilizando ANOVA de efectos fijos o ANOVA anidado de modelo mixto. Los modelos mixtos se pueden utilizar para probar los principales efectos fijos de la edad y el genotipo y el efecto aleatorio de los individuos anidados dentro de cada genotipo17.
NOTA: Los investigadores deben ser rigurosos al probar los supuestos de cualquier procedimiento estadístico utilizado para analizar los datos.
- Analice las diferencias en los eventos fagocíticos utilizando ANOVA de efectos fijos o ANOVA anidado de modelo mixto. Los modelos mixtos se pueden utilizar para probar los principales efectos fijos de la edad y el genotipo y el efecto aleatorio de los individuos anidados dentro de cada genotipo17.
Resultados
Para ilustrar los métodos de inyección descritos, la Figura 1A muestra el lugar de inyección en Drosophila melanogaster, así como cómo el tinte alimentario permite una confirmación visual de que se inyectó la mosca (Figura 1B). La adición de tinte alimenticio también ayuda en el reconocimiento de una aguja obstruida. Las inyecciones se pueden realizar en el abdomen, pero mantener el lugar de inyección consistente en todos los experimentos. Esto ayudará a minimizar las posibles variaciones entre cada experimento.
Para visualizar las partículas etiquetadas fluorescentemente dentro de los hemocitos residentes a lo largo del vaso dorsal, diseccionamos el vaso dorsal y adjuntamos la cutícula abdominal. La Figura 2A-F describe los métodos de disección.
Para evaluar la capacidad específica de la edad de las moscas jóvenes y envejecidas para llevar a cabo la fagocitosis, los hemocitos a lo largo del vaso dorsal se visualizan mediante un microscopio fluorescente. Para asegurarse de que sólo se cuentan las células a lo largo del vaso dorsal, se pueden utilizar anticuerpos o genes con etiqueta GFP para determinados marcadores de células sanguíneas o colágeno específico del corazón, como Hemese y Hemolectin, o Pericardin (Figura 3), respectivamente,22,,23,,24. Las partículas de E. coli con etiqueta fluorescente mientras que las partículas de E. coli son de 1 mm de longitud, mientras que los hemocitos tienen 10 mm de diámetro17. Sólo se cuentan los eventos fluorescentes situados dentro de un diámetro de 10 mm centrados en un núcleo DAPI positivo(Figura 4). Para cuantificar eventos fluorescentes, se utiliza el software ImageJ (Figura 5).

Figura 1: Sitio de inyección y verificación visual. (A) El lado lateral del tórax está perforado con una aguja capilar tirada. (B) Las inyecciones se verifican visualmente añadiendo tinte alimentario verde a la solución de partículas. Haga clic aquí para ver una versión más grande de esta figura.
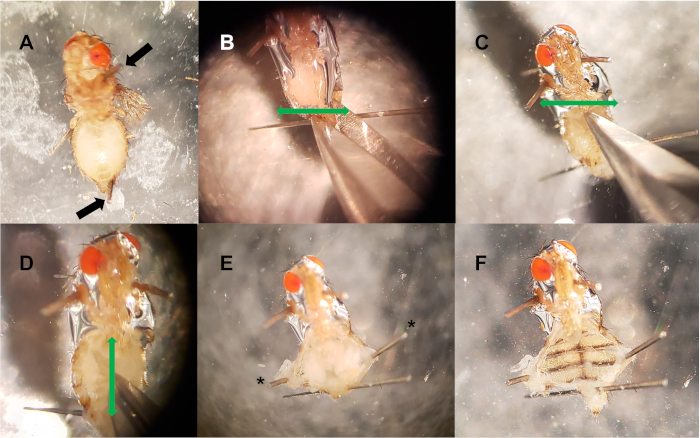
Figura 2: Disección del vaso dorsal. (A) Los pines se colocan en el tórax y el abdomen posterior (flechas negras). (B-C) Se realizan dos incisiones horizontales (flechas verdes) en el extremo posterior del abdomen(B)y en el extremo anterior (C). (D) Se realiza una incisión vertical (flecha verde) en el centro del abdomen, conectando los dos cortes horizontales. (E) Los pines opcionales (*) se utilizan para abrir la cavidad abdominal, exponiendo el tejido interno. (F) Se extrae el tejido interno (cultivo, intestino, útero, ovarios, cuerpos de grasa), exponiendo el vaso dorsal. Haga clic aquí para ver una versión más grande de esta figura.
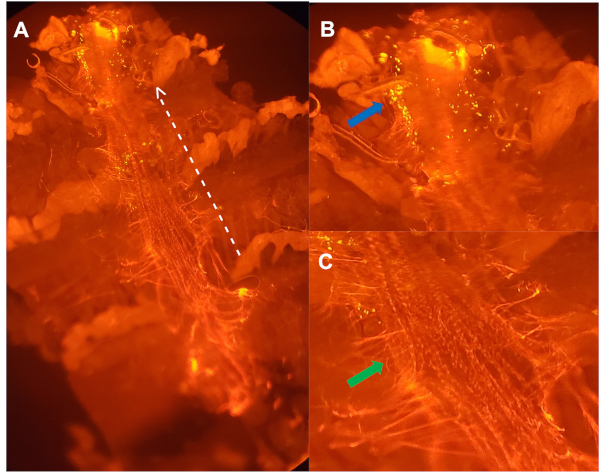
Figura 3: Vista ventral de un vaso dorsal diseccionado de una hembra de 5 semanas de edad inyectada con partículas sensibles al pH, manchada con anticuerpos dirigidos contra Pericardina (A). La línea blanca punteada delinea el lado lateral del vaso dorsal, con flecha apuntando hacia la región anterior. (B) Imagen ampliada de (A): racimos de hemocitos (flecha azul) que estaban degradando activamente las bacterias, dentro de la primera cámara aórtica del vaso dorsal. (C) Imagen ampliada de (A) que describe la matriz extracelular (ECM) de proteína similar al colágeno, Pericardin (flecha verde), que mantiene el vaso dorsal en el lugar24. Haga clic aquí para ver una versión más grande de esta figura.
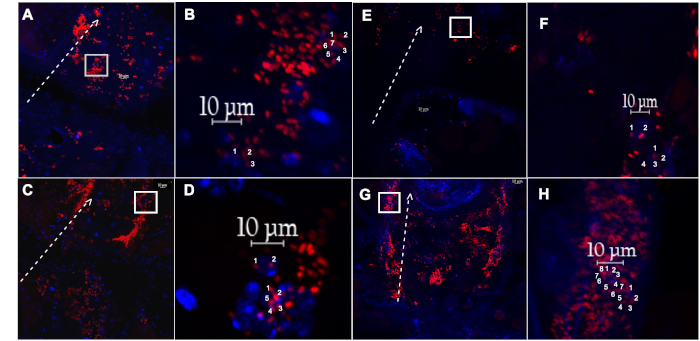
Figura 4: Vaso dorsal diseccionado y hemocitos asociados de una mosca hembra inyectada con partículas sensibles al pH, o partículas fluoro. (A) El vaso dorsal y los hemocitos asociados con pH engullido sensible-etiquetada E. coli partículas (rojo), o (E) fluoro-etiquetado E. coli partículas (rojo), aislados de una mosca vieja de 1 semana, después de recuperarse durante 60 min. (B,F) Inserción magnificada de (A) y (E) (caja blanca), respectivamente, mostrando dos hemocitos individuales con eventos conteos. (C) El vaso dorsal y los hemocitos asociados con pH engullido sensible-etiquetado E. coli partículas (rojo), o ( G) fluorado-etiquetado E. coli partículas (rojo), aislados de una mosca de 5 semanas de edad, después de recuperarse durante 60 min. (D,H) Inserción magnificada de (C) y (G) (caja blanca), respectivamente, mostrando dos hemocitos individuales con eventos conteos. La línea blanca punteada delinea el lado lateral del vaso dorsal, con flecha apuntando hacia la región anterior. Núcleos manchados con DAPI (azul). Haga clic aquí para ver una versión más grande de esta figura.
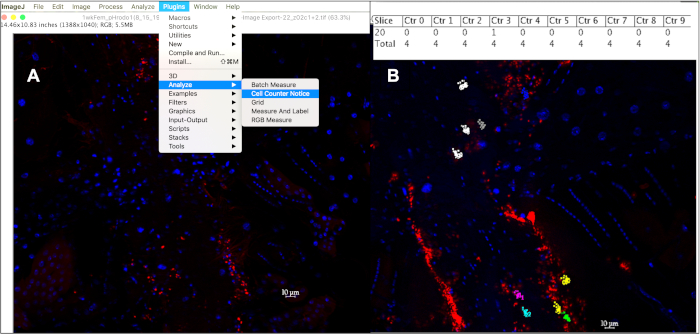
Figura 5: Cuantificar eventos fagocíticos dentro de un hemocitos de 10 mm utilizando el contador de celdas en ImageJ. (A) Después de abrir las imágenes en ImageJ, la herramienta Aviso de contador de celdas se puede utilizar para realizar un seguimiento de los eventos fagocíticos por celda. (B) Esta herramienta asignará un color diferente a cada celda seleccionada para ser contada, con cada punto correspondiente a un evento fluorescente dentro de esacelda. Al pulsar 'alt+y' se mostrará una tabla que muestra el número de eventos contados por celda. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito aquí es una forma fiable de cuantificar diferentes aspectos de la fagocitosis, en condiciones experimentales controladas. Observamos que sólo hemos probado este procedimiento con partículas bacterianas gram negativas y los resultados pueden diferir si se utilizan partículas bacterianas gram positivas. De hecho, sería interesante comparar las respuestas fagocíticas con bacterias gram negativas y gram positivas en diferentes condiciones experimentales. El uso de un nano-inyector permite un control preciso sobre los volúmenes de inyección, asegurando que cada mosca se inyecta con el mismo volumen de partículas. Una limitación al protocolo proviene de incoherencias en los preparativos de partículas. Las partículas se agregarán una vez congeladas, por lo que pequeñas variaciones en los volúmenes de dilución, o la falta de vórtice, pueden afectar la concentración de partículas entre experimentos. Para minimizar las posibles variaciones en las concentraciones de partículas entre edades, es beneficioso inyectar moscas viejas de 1 y 5 semanas el mismo día, utilizando la misma aguja y solución de partículas. Otro inconveniente potencial es que durante las disecciones, el vaso dorsal y / o cutícula puede dañarse fácilmente si los pines no se manejan correctamente. Para evitar interrumpir el vaso dorsal, minimice el número de pasadores utilizados por disección. La ventaja de este método de disección es que todos los pasos de fijación, lavado y tinción se pueden realizar en la placa de disección. Debido a que las cutículas están ancladas hacia abajo, esto evita que las cutículas se pierdan entre pasos.
En comparación con los métodos existentes18,19,25,26,27,28,29, el protocolo descrito tiene sus ventajas y limitaciones. Al diseccionar el vaso dorsal, somos capaces de visualizar y cuantificar hemocitos individuales en este lugar. Esto permite detectar variaciones sutiles en la actividad fagocítica entre grupos experimentales. Otros métodos visualizan partículas etiquetadas fluorescentemente mediante la recolección de hemocitos utilizando un ensayo de sangrado/raspado19,25,26,27, o a través de una cutícula ventral intacta18,19,28,29; sin embargo, los hemocitos individuales no se pueden evaluar cuando se visualizan a través de la cutícula dorsal. La ventaja de este protocolo, en comparación con el método Bleed/Scrape es que nuestro método nos permite evaluar sólo aquellos hemocitos asociados con el vaso dorsal, y tiene en cuenta las células circulantes o las que a lo largo de la pared del cuerpo, que pueden ser funcionalmente diferentes. La disección del recipiente dorsal también elimina la necesidad de incluir una segunda ronda de inyecciones con un quencher de fluorescencia, como Trypan azul19,26. Esto se debe a que las partículas no enlazadas o engullidas por una célula se lavarán durante los pasos de lavado. Por el contrario, los métodos alternativos pueden ser más fáciles de realizar porque no requieren disecciones. Mientras que diseccionar el recipiente dorsal es fácil de aprender, este paso añade un nivel de complejidad que puede no ser factible en algunos diseños experimentales.
Aunque el uso descrito de este ensayo de fagocitosis in vivo es evaluar y cuantificar eventos fagocíticos entre diferentes edades, este protocolo es altamente adaptable y se puede utilizar para analizar diferentes aspectos de la fagocitosis entre el genotipo, el sexo o el tipo de tejido. Dado que la fagocitosis es de importancia central para la mayoría de los animales multicelulares, entender cómo este proceso disminuye con la edad podría conducir a mejores tratamientos terapéuticos para el envejecimiento de la población. Este enfoque ofrece un potencial a largo plazo para esclarecer aspectos de los cambios relacionados con la edad en la respuesta inmune, con especial atención a la fagocitosis.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud R03 AG061484-02 y el UMBC College of Natural and Mathematical Sciences Becton Dickinson Faculty Research Fund.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.10 mm Insect pins | Fine Science Tools | 26002-10 | Here: pins are cut in half, and the sharp end is used |
| 1 mL sterile syringes | Becton Dickinson | 309602 | Filled with mineral oil to load needle |
| 15% Fetal Bovine Serum (FBS) | Gibco | 16000-044 | for dissection media |
| 16 % Paraformaldehyde | Electron Microscopy Sciences | 15710 | EM-grade, 4% working, diluted in 1X PBS |
| 1x Phosphate buffered saline (PBS) | Sigma | P3813 | |
| 3 mL Trasnfer Pipet | Falcon | 357524 | |
| 3.5" Glass Capillaries | Drummond | 3-000-203-G/X | 1.14mm O.D X 3.5" length X 0.53" I.D |
| 35x10 mm Petri dishes | Becton Dickinson | 351008 | Used as dissection plate, filled half way with Sylgard |
| 6x penicillin/streptomycin | Life Technologies | 15140-122 | for dissection media |
| 70% Glycerol | Sigma | G9012 | |
| Analog Vortex mixer | VWR | 58816-121 | |
| Biological point forceps, Dumont No. 5 | Fine Science Tools | 11295-10 | |
| DAPI (4',6-diamidino-2-phenylindole) | Life Technologies | D1306 | Diluted 1:1000 in 1x PBST |
| Drosophila strain | w[*]; P{w[+mC]=He-GAL4.Z}85, P{w[+mC]=UAS-GFP.nls}8 | ||
| E. coli (K-12 strain) BioParticles™, Alexa Fluor™ 594 conjugate | Life Technologies | E23370 | |
| Glass slides | Premiere | D17026102 | |
| Live cell imaging solution | Life Technologies | A14291DJ | preferred buffer for particle preparation and dilutions |
| Mineral oil | Mpbio | 194836 | |
| Nanoject II automatic nanoliter injector | Drummond | 3-000-204 | |
| Narrow Polystyrene Super Bulk Drosophila Vials | Genesee | 32-116SB | Size: 25 X 95 mm |
| Nutating Mixer | Fisher Scientific | 88-861-043 | Speed used: 20 rpm |
| pHrodo™ Red E. coli BioParticles™ Conjugate for Phagocytosis | Life Technologies | P35361 | |
| Schneider's Drosophila cell culture media (1x) | Gibco | 21720-024 | Dissection media, combine: Schneiders, FBS, and pen/strep; filter sterilize |
| Sodium azide | Sigma-Aldrich | S2002 | 2mM (or 20%) working |
| Spring scissors | Fine Science Tools | 15000-00 | |
| Sylgard 184 Silicone elastomer | Electron Microscopy Sciences | 24236-10 | Prepare according to provided protocol |
| Tween 20 | Sigma | P1379 | For PBS + 0.1% tween |
| Vertical Pipette Puller Model 700C | David Kopf Instruments | 812368 | Heater: 55? Solenoid: 45 |
| Zeiss AxioImager.Z1 fluorescent microscope | Zeiss | Here: Apotome structural interference system with Zeiss Zen imaging software |
Referencias
- Abhyankar, V., Kaduskar, B., Kamat, S. S., Deobagkar, D., Ratnaparkhi, G. S. Drosophila DNA/RNA methyltransferase contributes to robust host defense in ageing animals by regulating sphingolipid metabolism. The Journal of Experimental Biology. 221, (2018).
- DeVeale, B., Brummel, T., Seroude, L. Immunity and aging: the enemy within. Aging Cell. 3 (4), 195-208 (2004).
- Gomez, C. R., Nomellini, V., Faunce, D. E., Kovacs, E. J. Innate immunity and aging. Experimental Gerontology. 43 (8), 718-728 (2008).
- Panda, A., et al. Human innate immunosenescence: causes and consequences for immunity in old age. Trends in Immunology. 30 (7), 325-333 (2009).
- Aw, D., Silva, A. B., Palmer, D. B. Immunosenescence: emerging challenges for an ageing population. Immunology. 120 (4), 435-446 (2007).
- Min, K. -. J., Tatar, M. Unraveling the molecular mechanism of immunosenescence in Drosophila. International Journal of Molecular Sciences. 19 (9), 2472 (2018).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the fly: a primer on the Drosophila model system. Genetics. 201 (3), 815-842 (2015).
- Banerjee, U., Girard, J. R., Goins, L. M., Spratford, C. M. Drosophila as a genetic model for hematopoiesis. Genetics. 211 (2), 367-417 (2019).
- Rämet, M., Manfruelli, P., Pearson, A., Mathey-Prevot, B., Ezekowitz, R. A. B. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Garschall, K., Flatt, T. The interplay between immunity and aging in Drosophila. F1000Research. 7, (2018).
- Brennan, C. A., Anderson, K. V. Drosophila: The genetics of innate immune recognition and response. Annual Review of Immunology. 22 (1), 457-483 (2004).
- Rosales, C., Uribe-Querol, E. Phagocytosis: a fundamental process in immunity. BioMed Research International. 9042851, (2017).
- Kinchen, J. M., Ravichandran, K. S. Phagosome maturation: going through the acid test. Nature Reviews. Molecular Cell Biology. 9 (10), 781-795 (2008).
- Stuart, L., et al. A systems biology analysis of the Drosophila phagosome. Nature. 445 (7123), 95-101 (2007).
- Mackenzie, D. K., Bussière, L. F., Tinsley, M. C. Senescence of the cellular immune response in Drosophila melanogaster. Experimental Gerontology. 46 (11), 853-859 (2011).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Elrod-Erickson, M., Mishra, S., Schneider, D. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10 (13), 781-784 (2000).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- . Bloomington Drosophila Stock Center: Indiana University Bloomington Available from: https://bdsc.indiana.edu/innformation/recipes/molassesfood.html (2019)
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular Ecology. 19 (7), 1462-1468 (2010).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 100 (5), 2622-2627 (2003).
- Goto, A., et al. A Drosophila haemocyte-specific protein, hemolectin, similar to human von Willebrand factor. Biochemical Journal. 359, 99-108 (2001).
- Cevik, D., Acker, M., Michalski, C., Jacobs, J. R. Pericardin, a Drosophila collagen, facilitates accumulation of hemocytes at the heart. Developmental Biology. 454 (1), 52-65 (2019).
- Ghosh, S., Mandal, S., Mandal, L. Detecting proliferation of adult hemocytes in Drosophila by BrdU incorporation and PH3 expression in response to bacterial infection. Wellcome Open Research. 3, (2018).
- Hao, Y., Yu, S., Luo, F., Jin, L. H. Jumu is required for circulating hemocyte differentiation and phagocytosis in Drosophila. Cell Communication and Signaling. 16 (1), 95 (2018).
- Petraki, S., Alexander, B., Brückner, K. Assaying blood cell populations of the Drosophila melanogaster larva. Journal of Visualized Experiments. (105), (2015).
- Gyoergy, A., et al. Tools allowing independent visualization and genetic manipulation of Drosophila melanogaster macrophages and surrounding Tissues. G3: Genes, Genomes, Genetics. 8 (3), 845-857 (2018).
- Bosch, P. S., et al. Blood cells of adult Drosophila do not expand, but control survival after bacterial infection by induction of Drosocin around their reservoir at the respiratory epithelia. BioRxiv. 578864, (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados