A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل ومواصفات توزيعات حجم حبيبات النشا
In This Article
Summary
يُعرض هنا إجراء لتحديدات قابلة للاستنساخ وصحيحة إحصائياً لتوزيعات حجم حبيبات النشا، ولتحديد توزيعات حجم اللوغاريتم الحبيبي المحدد باستخدام نموذج مضاعف من معلمتين. وهو ينطبق على جميع تحاليل التحجيم الحبيبية لعينات النشا على نطاق الجرام لأبحاث علوم النبات والغذاء.
Abstract
تتكون النشا من جميع المصادر النباتية من حبيبات في مجموعة من الأحجام والأشكال التي لها ترددات مختلفة ، أي تعرض حجمًا وتوزيعًا علىالشكل. 12- وغالباً ما تكون بيانات حجم حبيبات النشا التي تحدد باستخدام عدة أنواع من تقنيات التحجيم الجسيمات إشكالية بسبب ضعف إمكانية التكاثر أو عدم وجود أهمية إحصائية ناتجة عن بعض الأخطاء المنهجية التي لا يمكن التغلب عليها، بما في ذلك الحساسية لأشكال الحبيبات وحدود أحجام العينات الحبيبية. وقد حددنا إجراءً لتحديدات قابلة للاستنساخ وصالحة إحصائياً لتوزيعات حجم حبيبات النشا باستخدام تقنية منطقة الاستشعار الكهربائي، ولتحديد توزيعات حجم اللوغاريتمي الحبيبي المحدد باستخدام نموذج مضاعف من معلمتين معتمدين مع دقة أفضل وقابلية للمقارنة. وهو ينطبق على جميع تحليلات التحجيم الحبيبية لعينات النشا على نطاق الجرام، وبالتالي، يمكن أن تسهل الدراسات حول كيفية تشكيل أحجام حبيبات النشا بواسطة جهاز وآليات التركيب الحيوي للنشا؛ وكيف تؤثر على خصائص ووظائف النشويات للاستخدامات الغذائية والصناعية. وتقدم النتائج التمثيلية من تحاليل تكرار توزيعات حجم الحبيبات لعينات النشا سويتبوتاتو باستخدام الإجراء المبين. ناقشنا كذلك العديد من الجوانب التقنية الرئيسية للإجراء ، وخاصة ، المواصفات المضاعفة لتوزيعات حجم اللوغاريتمي الحبيبية وبعض الوسائل التقنية للتغلب على انسداد الفتحة المتكررة بواسطة مجاميع الحبيبية.
Introduction
حبيبات النشا هي الهيكل المادي الذي اثنين من البوليمرات الاحتياطي الرئيسي homoglucan في التمثيل الضوئي النباتي والأنسجة التخزينية، والأميلوز الخطي أو المتفرعة بشكل ضئيل واميللوبيكتين متفرعة للغاية، هي معبأة بشكل منظم جنبا إلى جنب مع بعض المكونات الثانوية، بما في ذلك الدهون والبروتينات. حبيبات النشا من مختلف أنواع النباتات عرض العديد من الأشكال ثلاثية الأبعاد (3D) (استعرضت في المرجع1،2) ، بما في ذلك المجالات ، الإهليلجيات ، متعدد الوهيدونات ، الصفائح الدموية ، مكعبات ، التكعيب ، والبيبات غير النظامية. حتى تلك من الأنسجة نفسها أو أنسجة مختلفة من نفس الأنواع النباتية يمكن أن يكون لها مجموعة من الأشكال مع ترددات مختلفة الحدوث. وبعبارة أخرى، قد يكون حبيبات النشا من نوع نباتي توزيعاً إحصائياً مميزًا، بدلاً من شكل محدد. الأشكال غير الموحدة وغير الكروية حبيبات تجعل من الصعب قياس وتحديد أحجام حبيبات النشا بشكل صحيح. بالإضافة إلى ذلك، حبيبات النشا من نفس أنسجة الأنواع النباتية هي من مجموعة من الأحجام بنسب مختلفة، أي عرض توزيع حجم مميز. هذا التوزيع حجم يزيد من تعقيد تحليل ووصف أحجام حبيبات النشا.
وقد تم تحليل أحجام حبيبات النشا باستخدام عدة فئات من تقنيات تحجيم الجسيمات (استعرضت في المرجع3)،بما في ذلك المجهر، الترسب/ تجزئة تدفق الحقل (Sd/StFFF)، حيود الليزر ومنطقة الاستشعار الكهربائي (ESZ). ومع ذلك، هذه التقنيات ليست مناسبة على قدم المساواة لتحديد أحجام حبيبات النشا في وجود شكل حبيبة وتوزيع الحجم. المجهر، بما في ذلك المجهر الإلكتروني الخفيف والخلطي والمسح الضوئي، ممتاز لدراسات المورفولوجيا4،5،6،7،هيكل8،9 والتطوير10،11 من حبيبات النشا، ولكن لا يكاد يصلح لتحديد توزيعات حجمها بسبب بعض أوجه القصور الكامنة. القياسات المباشرة لصور الحبيبات المجهرية أو تحليل الصور بمساعدة البرامجية لبيانات المجهر البصرية (IAOM) ، والتي استخدمت لتحديد أحجام الحبيبات من النشويات من عدة أنواع ، بما في ذلك الذرة12، القمح13،14، البطاطا15 والشعير16، يمكن قياس فقط 1D (عادة أقصى طول) أو 2D (مساحة السطح) أحجام من أعداد محدودة جدا (عشرات إلى بضعة آلاف) من صور حبيبات النشا. نادراً ما تكون أحجام أخذ العينات الحبيبية الصغيرة المقيدة بطبيعتها بواسطة التقنيات تمثيلية إحصائياً، بالنظر إلى أعداد الحبيبات الهائلة لكل وحدة وزن من النشا (~ 120 × 106 لكل غرام، على افتراض أن جميع 10 ميكرومتر في كثافة 1.5 غرام/سم مكعب)، وبالتالي، يمكن أن تؤدي إلى سوء تكرار النتائج. قد يكون لتقنية SD/StFFF سرعة عالية ودقة عالية، وأحجام ضيقة من حبيبات النشا17، ولكن نادراً ما استخدمت بسبب أن دقتها قد تتأثر بشدة بالضرر والأشكال المختلفة وكثافة حبيبات النشا. تقنية الانعراج بالليزر هي الأكثر استخداماً، وقد تم تطبيقها على تحليلات حجم حبيبات النشا لجميع أنواع المحاصيل الرئيسية3،14،16. على الرغم من أن هذه التقنية لها العديد من المزايا، إلا أنها في الواقع غير مناسبة لتحديد أحجام حبيبات النشا في وجود توزيع شكل حبيبات. تعتمد معظم أدوات الانعراج بالليزر المتزامنة على نظرية Mie-scattering18 للجسيمات الكروية الموحدة ونظرية ميالمعدلة 18 لبعض الأشكال الأخرى من التوحيد. هذه التقنية هي ، بالتالي ، بطبيعتها حساسة جدا لأشكال الجسيمات ، وليس مناسبة تماما حتى بالنسبة لبعض الأشكال من التوحيد19، ناهيك عن حبيبات النشا وجود مجموعة من الأشكال ذات أبعاد متفاوتة. تقيس تقنية ESZ اضطراب الحقل الكهربائي بما يتناسب مع حجم الجسيمات التي تمر عبر فتحة. ويوفر حجم الحبيبات، فضلا عن عدد وحجم المعلومات التوزيع، وما إلى ذلك، في دقة عالية. وبما أن تقنية ESZ مستقلة عن أي خصائص بصرية للجسيمات بما في ذلك اللون أو الشكل أو التركيب أو مؤشر الانكسار ، والنتائج قابلة للاستنساخ للغاية ، فهي مناسبة بشكل خاص لتحديد توزيعات الحجم من حبيبات النشا التي لها مجموعة من الأشكال.
كما تم تحديد أحجام حبيبات النشا باستخدام العديد من المعلمات. وكثيرا ما وصفت مبسطة من قبل متوسط أقطار، والتي كانت في بعض الحالات وسيلة الحسابية لقياس مجهري أطوال القصوى من الصور 2D12،20، أو متوسطات من أقطار الكرة ما يعادل3. في حالات أخرى، تم تحديد توزيعات حجم الحبيبات باستخدام نطاقات الحجم21،22، متوسط حجم التوزيع أو متوسط القطر (مكافئ الكرة ، مرجحًا بالرقم أو الحجم أو المساحة السطحية) على افتراض التوزيع العادي14،23،24،25،26. هذه الأوصاف من أحجام حبيبات النشا من مختلف التحليلات هي ذات طبيعة مختلفة إلى حد كبير، وليس قابلة للمقارنة بدقة. قد يكون مضللا جدا إذا كانت هذه "الأحجام" من حبيبات النشا من أنواع مختلفة أو حتى نفس الأنسجة من نفس النوع مقارنة مباشرة. وعلاوة على ذلك، تم تجاهل معلمة انتشار (أو شكل) التوزيعات العادية المفترضة، أي الانحراف المعياري σ (أو الانحراف المعياري البياني σg)لقياس عرض التوزيع (أي انتشار الأحجام)، في معظم الدراسات.
لحل القضايا الحرجة المذكورة أعلاه التي تواجه تحليلات التحجيم حبيبات النشا، حددنا إجراء لتحديد قابلة للاستنساخ وصالحة إحصائيا من توزيعات حجم الحبيبات من عينات النشا باستخدام تقنية ESZ، وتحديد بشكل صحيح توزيعات حجم اللوغاريتم الحبيبي المحدد باستخدام نموذج مضاعف27 معلمة معتمدة مع تحسين الدقة وقابلية المقارنة. للتحقق من صحة وبيان، قمنا بإجراء تحليل تحجيم حبيبات تكرار عينات النشا sweetpotato باستخدام الإجراء، وحددت اللوغاريتمي التفاضلي حجم النسبة المئوية حجم ما يعادل المجال توزيعات قطر باستخدام وسائلها الهندسية الرسم 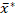 والانحرافات المعيارية تضاعف s* في
والانحرافات المعيارية تضاعف s* في 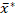 س/ (ضرب وتقسيم) s* النموذج.
س/ (ضرب وتقسيم) s* النموذج.
Protocol
1. إعداد عينات النشا
- إعداد اثنين (أو ثلاثة) عينات النشا على نطاق الغرام تكرار من الأنسجة تراكم النشا من مختلف أنواع النباتات اتباع الإجراءات المعمول بها (على سبيل المثال، البطاطس15، sweetpotatoes28، الحبوب القمح13،29، وحبات الذرة30، الخ).
- غسل عينات النشا جيدا مع الأسيتون أو التولوين 3-4x لتقليل المجاميع الحبيبية وتجفيفها تماما.
ملاحظة: استخدم إجراءات الاستخراج التي تنتج أكثر من 1 غرام من النشا في كل إعداد. واحد أو اثنين من aliquots 0.5 ز من كل من ثلاثة أو اثنين من مقتطفات تكرار، على التوالي، يتم أخذ عينات لتحليل التحجيم الحبيبية من مستخلص نشا واحد.
2. إعداد المنحل بالكهرباء
- إعداد 500 مل من 50 غرام / لتر كلوريد الليثيوم في الميثانول لأربعة أشواط التحجيم لعينات النشا النسخ المتماثل (100 مل لكل تشغيل بالإضافة إلى 100 مل إضافية). ويفضل أن يكون الإلكتروليت في دفعات كبيرة الحجم، على سبيل المثال، 4 إلى 8 لتر في وقت، لتقليل الاختلاف في التركيز.
- تبريد الحاوية على الجليد أو في مجلس الوزراء 4 °C لتسريع حل كلوريد الليثيوم.
3. إعداد محلل
- اختيار أنبوب الفتحة مع نطاق قطر الجسيمات التي تغطي المعروفة (في الأدب أو من خلال أشواط المحاكمة) مجموعة حجم الحبيبية من عينات النشا لتحليلها، على سبيل المثال، فتحة 100 ميكرومتر للنشويات الحلوة. بالنسبة لعينات النشا من نطاق حجم حبيبات غير معروف، حدد فتحة مناسبة من خلال تشغيل التجربة باستخدام عدة أنابيب فتحة ذات نطاقات متداخلة من قطر الجسيمات.
ملاحظة: نطاق قطر الجسيمات من أنبوب الفتحة هو نطاقها التحجيم دقيقة بين 2 إلى 60٪ من، ومع نطاق تحجيم موسعة إلى 80٪ من قطر الفوهة. 10- يسرد الجدول 1 خصائص ثلاثة أنابيب ذات فتحة مفيدة لتحجيم حبيبات نشويات المحاصيل الرئيسية. إذا كان نطاق حجم الحبيبات لعينة النشا أوسع من نطاق التحجيم في أنبوب واحد فتحة، قم بإجراء تحليل تداخل متعدد الأنابيب يجمع ما يصل إلى خمسة توزيعات حجم الجسيمات تقاس بفتحات ذات أحجام مختلفة. كل فتحة قابلة للتحديد من قبل قطرها ورقم جزء المسمى على الأنبوب. يمكن مسح القطر والرقم التسلسلي الوارد في الباركود على الأنبوب في برنامج المحلل باستخدام قارئ الرمز الشريطي على لوحة التحكم في المحلل. - اختار 100 أو 200 مل الكوابر التحليلية (أكثر من cuvettes) لتحديد أحجام حبيبات النشا، واقامة التحريك التلقائي (أدناه) للحفاظ على تعليق حبيبة جيدة أثناء القياس.
- إنشاء أسلوب التشغيل القياسي (SOM) لتحديد إعدادات التشغيل، وملف تفضيلات لتحليل النتائج وعرضها وطباعتها. دمج ملف SOM و Preferences في إجراء تشغيل قياسي (SOP) حسب الحاجة.
ملاحظة: بالنسبة للتحليلات غير القياسية، استخدم SOM لتشغيل التحليلات، وضبط إعدادات SOM بين عمليات التشغيل من خلال تحرير نافذة SOM (انظر أدناه) حسب الحاجة. بعد الانتهاء من التشغيل، قم بتحليل نتائج التشغيل وعرضها وطباعتها عن طريق تغيير التفضيلات حسب الرغبة. بالنسبة لتحليلات التحجيم الحبيبية الموحدة، استخدم إجراءًا تشغيليًا لتشغيل التحليلات.- بدء تشغيل برنامج محلل. على مانو الرئيسي، انقر فوق SOP | إنشاء معالج SOM أو تحرير SOMأو على لوحة الحالة، انقر فوق تحرير SOM. استخدم المعالج أو تحرير نافذة SOM لتحديد إعدادات SOM. تتلخص الإعدادات التي تستخدم عادةً في تحجيم حبيبات عينات النشا سويتبوتاتو في الجدول 2.
- حفظ SOM المنشأة إلى ملف في الإطار "ملخص معالج SOM" للإعدادات أو في إطار تحرير SOM.
- على مانو الرئيسي، انقر فوق | SOP إنشاء معالج تفضيلات أو تحرير تفضيلات. استخدم المعالج أو علامات التبويب في إطار تحرير التفضيلات لتحديد إعدادات التفضيلات كتلك الموجودة في الجدول 3 أو في الآخرين حسب الرغبة.
- حفظ التفضيلات المحددة إلى ملف في إطار "ملخص معالج إنشاء تفضيلات" للإعدادات أو في إطار تحرير التفضيلات.
- في القائمة الرئيسية، انقر فوق SOP | إنشاء معالج SOP. بعد الدليل خطوة بخطوة من المعالج، أدخل وصفاً، حدد SOM و تفضيلات الملف لإنشاء وحفظ SOP.
4. حبيبات تحجيم التحليلات من عينات النشا
- تحضير المحلل
- قم بتشغيل المحلل، وافتح البرنامج في الكمبيوتر وتحقق من حالة "جاهز" في أعلى لوحة الحالة بعد اتصالها التلقائي بالمحلل.
- ملء جرة المنحل بالكهرباء، إفراغ جرة النفايات إذا لزم الأمر.
- تثبيت وتأمين الأنبوب الفتحة المختارة بشكل صحيح بعد الدليل في دليل المستخدم. للحصول على أنبوب فتحة جديدة غير معايرة، معايرة بعد دليل خطوة بخطوة تحت معايرة | معايرة الفتحة على القائمة الرئيسية. بالنسبة إلى أنبوب الفتحة معايرة، تحقق من المعايرة التالية دليل خطوة بخطوة من معالج أنبوب الفتحة التغيير تحت تشغيل أو معايرة | تحقق من معايرة الفتحة في القائمة الرئيسية.
- فتح منصة فحص عن طريق دفع مقطع قفل الإفراج (على الجبهة الوسطى من الجدار المقصورة عينة اليسار) وخفض يدويا من المنصة إلى أسفل. ضع الكوابر التحليلية التي تحتوي على 100 مل من المنحل بالكهرباء على المنصة، ونقل المحرك إلى موقف التحريك، ورفع يدويا المنصة إلى الوضع العلوي الذاتي قفل لتزج أنبوب الفتحة وتحريك في المنحل بالكهرباء.
- انقر فوق تعبئة على شريط الأدوات أداة أسفل أن يكون المحلل تلقائيا ملء النظام مع المنحل بالكهرباء وانقر فوق تدفق أن يكون المحلل تلقائيا مسح النظام.
- قم بتحميل SOM بالنقر فوق SOP | تحميل SOM على القائمة الرئيسية، واستخدم SOM لتشغيل تحليل بدون ملف تفضيلات. بدلاً من ذلك، قم بتحميل SOP بالنقر فوق | قم بتحميل إجراء تشغيل تشغيلي على القائمة الرئيسية أو تحميل SOP على لوحة الحالة، واستخدم SOP لتشغيل تحليل.
- إذا كنت تستخدم SOP، انقر فوق SOP | SOM Info أو معلومات التفضيل في القائمة الرئيسية للتحقق من إعدادات SOM و Preference. انقر فوق نموذج | أدخل معلومات عينة في القائمة الرئيسية أو تحرير معلومات على لوحة الحالة لإدخال معلومات العينة للتشغيل.
- إعداد عينة النشا والميثانول وتعليق الحجم
- تزن اثنين أو واحد 0.5 عينة ز من كل من اثنين أو ثلاثة مقتطفات النشا المتماثل, على التوالي.
- إضافة كل من 0.5 ج النشا aliquots إلى 5 مل الميثانول في أنبوب جهاز طرد مركزي مخروطي 50 مل, وتفريق تماما حبيبات النشا باستخدام عدة نبضات من الموجات فوق الصوتية منخفضة الكثافة (12-24 W/cm2) من معالج بالموجات فوق الصوتية.
- باستخدام ماصة نقل المتاح، وتطبيق قطرة صغيرة واحدة من تعليق النشا الميثانول (~ 0.2 مل) إلى 100 مل من 50 غرام/لتر LiCl الميثانول المنحل بالكهرباء تحت تحريك مستمر في الكأس. أغلق باب حجرة العينة.
- تنفيذ تشغيل تغيير حجم
- انقر فوق معاينة في شريط الأدوات أسفل الأدوات لبدء تشغيل معاينة. في لوحة الحالة، تحقق من أن شريط التركيز المعروض ديناميكيًا باللون الأخضر، ويظهر نطاق تركيز اسمي من 5 إلى 8٪ للتعليق.
- انقر فوق إيقاف على شريط الأدوات السفلي لإيقاف تشغيل المعاينة. إذا لزم الأمر، تمييع تعليق النشا المنحل بالكهرباء عن طريق استبدال aliquot من التعليق مع المنحل بالكهرباء، ثم كرر تشغيل معاينة.
ملاحظة: إن نطاق التركيز الاسمي من 5٪ إلى 8٪ من التعليق أمر بالغ الأهمية لإكمال تشغيل بدون توقف بسبب انسداد الفتحة بواسطة حبيبات مجمعة. إذا لزم الأمر، ضبط حجم عينة قطرة، و / أو تركيز تعليق النشا الميثانول لجعل تعليق جديد النشا المنحل بالكهرباء وجود تركيز الاسمية في النطاق الأمثل. - بعد التحقق، انقر فوق ابدأ في شريط الأدوات السفلي لبدء التشغيل. يقوم المحلل بإكمال المدى تلقائياً بمجرد أن يصل إجمالي عدد الحبيبات الحجمية، التي يتم عرضها مع وقت التشغيل على لوحة الحالة في تشغيل، إلى العدد الإجمالي المحدد (125,000 أو 250,000) بواسطة وضع التحكم في SOM. اعتمادا على تركيز التعليق (ضمن نطاق 5-8٪ أو أقل)، وشوط واحد يأخذ 2 إلى 5 دقيقة أو أكثر.
ملاحظة: عندما يكتشف المحلل تلقائياً انسداد فتحة لكل إعدادات الكشف عن انسداد SOM، فإنه سيتم إحباط تشغيل، تدفق لإلغاء حظر الفتحة وبدء تشغيل جديد. يتم تعيين هذا الإجراء الانسداد لتكرار أقصى أربع مرات قبل أن يقوم المحلل بإلغاء عملية التشغيل. يمكن التغلب على مشكلة إيقاف إيقاف التشغيل هذه باستخدام طريقتين تقنيتين كما هو مذكور في الجدول 2 ومفصلة في المناقشة. - إذا لزم الأمر، قم بإجراء تشغيل تكرار تقني (راجع الجدول 2 ومفصلة في المناقشة) باستخدام نفس تعليق النشا المنحل بالكهرباء بمجرد النقر فوق ابدأ أو تكرار على شريط الأدوات السفلي.
- بعد الانتهاء من تشغيل أو تكرار أشواط، وإفراغ الكأس، وشطفه بالميثانول، وإعادة تعبئته مع 100 مل حل المنحل بالكهرباء الطازجة لتشغيل المقبل.
- أثناء تشغيل، إذا ظهر مربع حوار إعلام نطاق الحجم الموسع عندما يتجاوز عدد الحبيبات أكبر من 60 ميكرومتر 0.1٪ من إجمالي العدد (لكل إعداد SOM)، انقر فوق تشغيل 60٪ إلى 80٪ لتشغيل نطاق تغيير حجم ديناميكي موسع إلى 80٪ من قطر الفتحة.
ملاحظة: يتحكم إعداد نطاق الحجم الموسع في إجراءات حبيبات أكبر من 60٪ من قطر الفتحة (100 ميكرومتر، في هذه الحالة). يحدد الإعداد في SOM إدراج حبيبات النشا أكبر من 60 ميكرومتر عندما تصل أعدادها إلى أكثر من 0.1٪ من إجمالي العدد. لا يزال يتم التحكم في إكمال المدى من قبل العدد الإجمالي ، وقد يستغرق وقتًا أقل قليلاً من خلاف ذلك دون إدراج حبيبات أكبر يبلغ مجموعها أقل من 0.1٪ (كمية غير ذات أهمية ثابتة مفترضة) من إجمالي العد.
- تحليل نتائج التشغيل
- إذا تم استخدام SOM للتحكم في التشغيل، حدد إعدادات التفضيلات حسب الرغبة في عرض وطباعة و التحليلات الإحصائية للنتائج باستخدام معالج إنشاء تفضيلات أو تحرير التفضيلات ضمن SOP في القائمة الرئيسية.
- نتائج التراكب من عدة عمليات تشغيل على رسم بياني واحد للمقارنة.
- انقر فوق تراكب على شريط الأدوات الرئيسي أو | تراكب على القائمة الرئيسية للوصول إلى إطار التراكب. انتقل إلى وحدد ملفات النتائج المرغوبة المتعددة في المربع الملفات، وانقر فوق إضافة لنقلها إلى المربع الملفات المحددة، ثم انقر فوق موافق لتضبّل النتائج المحددة على رسم بياني واحد.
- لإضافة ملف إلى تراكب مفتوح، انقر فوق RunFile | افتح لـ Overlay على قائمة التشغيل للوصول إلى إطار التراكب، وانتقل إلى الملف المطلوب، وانقر لإضافة.
- متوسط النتائج من التحاليل المتماثلة (مستخرجان x 2 عينات من النشا أو 3 مقتطفات x 1 نمشاً)، وعرض أو طباعة متوسط توزيع حجم الحبيبات والإحصاءات في قائمة أو رسم بياني.
- في القائمة الرئيسية، انقر فوق ملف | fileTool | متوسط لفتح إطار المتوسط. انتقل إلى وحدد عدة ملفات نتائج مرغوبة في المربع الملفات، وانقر فوق إضافة لنقلها إلى المربع الملفات المحددة، ثم انقر فوق موافق لمتوسط النتائج المحددة وعرض المتوسط على رسم بياني واحد.
- لتضمين ملف نتيجة إضافية في توزيع متوسط، في قائمة التشغيل، انقر فوق RunFile | فتح وإضافة إلى المتوسط لفتح إطار إضافة إلى متوسط، انتقل إلى الملف وإضافته. يظهر المتوسط الجديد على الرسم البياني في إطار تشغيل (نتيجة) أو إدخال قائمة.
5- تحديد متوسط التوزيع
- في إطار "قائمة التشغيل" عرض التوزيع المتوسط انقر فوق حساب | متوسط الإحصائيات في قائمة التشغيل لفتح إطار ملخص الإحصائيات، الذي يعرض متوسط الإحصائيات في الصفوف، وإحصائيات الرسم البياني لتوزيع متوسط في الأعمدة.
- استخدم الوسط الهندسي الرسمي
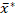 () و S.D.(s*)في عمود إحصائيات الرسم البياني لتحديد متوسط التوزيع في النموذج
() و S.D.(s*)في عمود إحصائيات الرسم البياني لتحديد متوسط التوزيع في النموذج 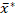 س/ s* . حساب التغيرات في قياس السيرة الذاتية بين متوسط توزيعات التكرار بتقسيم متوسط (μ، نفس
س/ s* . حساب التغيرات في قياس السيرة الذاتية بين متوسط توزيعات التكرار بتقسيم متوسط (μ، نفس 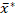 متوسط التوزيع) من الوسائل الهندسية لتوزيع متوسط S.D. (σ) المدرجة في صف الإحصاءات المتوسط.
متوسط التوزيع) من الوسائل الهندسية لتوزيع متوسط S.D. (σ) المدرجة في صف الإحصاءات المتوسط.
ملاحظة: متوسط S.D. (على سبيل μ) تقييم الاختلافات بين وسائل توزيعات النسخ المتماثل يختلف عن الرسم الهندسي S.D.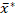 (ل) قياس انتشار التوزيع المتوسط.
(ل) قياس انتشار التوزيع المتوسط.
النتائج
للتحقق من صحة الإجراء، وإظهار إعادة إنتاج توزيع حجم الحبيبات المحددة، قمنا بإجراء تحليل تحجيم متماثل لعينات النشا سويتبوتاتو. أعددنا تكرار (S1 و S2) عينات النشا من sweetpotatoes الحقول نمت من خط تربية SC1149-19 في سن النمو مماثلة باستخدام الإجراء الموصوف سابقا28. من كل استخراج النشا، اثنين...
Discussion
وقد حل الإجراء المبين بعض القضايا الحرجة في العديد من الطرق القائمة لتحليل حجم حبيبات النشا، بما في ذلك غير ملائمة 1D أو 2D التحجيم حبيبات 3D، تشويه القياسات التحجيم بسبب الأشكال غير موحدة حبيبات، وسوء استنساخ وصحة إحصائية مشكوك فيها بسبب أحجام عينات الحبيبية محدودة، مواصفات غير دقيقة أو غي...
Disclosures
أصحاب البلاغ ليس لديهم ما يكشفونه
Acknowledgements
ويدعم هذا العمل جزئياً مركز البحوث الزراعية التعاونية، ومركز أبحاث الأمن الغذائي المتكامل التابع لكلية الزراعة والعلوم الإنسانية، جامعة برايري فيو إيه أند إم. نشكر هوا تيان على دعمه الفني.
Materials
| Name | Company | Catalog Number | Comments |
| Analytical beaker | Beckman Coulter Life Sciences | A35595 | Smart-Technology (ST) beaker |
| Aperture tube, 100 µm | Beckman Coulter Life Sciences | A36394 | For the MS4E |
| Disposable transfer pipettor, | Fisher Scientific (Fishersci.com) | 13-711-9AM | Other disposable transfer pipettors with similar orifice can also be used. |
| Fisherbrand Conical Polypropylene Centrifuge Tubes, 50 ml | Fisher Scientific (Fishersci.com) | 05-539-13 | Any other similar types of tubes can be used. |
| Glass beakers, 150 to 250 ml | Fisher Scientific (Fishersci.com) | 02-540K | These beakers are used to contain methanol for washing the aperture tube and stirrer between runs. |
| LiCl | Fisher Chemical | L121-100 | |
| Methanol | Fisher Chemical | A412-500 | Buy in bulk as the analysis uses a large quantity of methanol. |
| Mettler Toledo ML-T Precision Balances | Mettler Toledo | 30243412 | Any other precision balance with a readability 0.01 g to 1 mg will work. |
| Multisizer 4e Coulter Counter | Beckman Coulter Life Sciences | B23005 | The old model, Multisizer 3 can also be used with slight adjustment of parameters. The 4e model comes with a 100 μm aperture tube. Other aperture tubes of different diameter can be purchased separately from the company. |
| Ultrasonic processor UP50H | Hielscher Ultrasound Technology | UP50H | Other laboratory sonicator having a low-power (<50 Watt) output can be also used. Both MS1 and MS2 sonotrodes for the particular sonicator can be used to disperse starch granules in 5 ml methanol. Always use the lowest setting first, 20% amplitude and 0.1 or 0.2 cycle, and raise the setting if aggregates persist in suspension. |
References
- Shannon, J. C., Garwood, D. L., Boyer, C. D., BeMiller, J., Whistler, R. . Starch:Chemistry and Technology Food Science and Technology. , 23-82 (2009).
- Singh, N., Singh, J., Kaur, L., Singh Sodhi, N., Singh Gill, B. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chemistry. 81 (2), 219-231 (2003).
- Lindeboom, N., Chang, P. R., Tyler, R. T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: a review. Starch - Stärke. 56 (34), 89-99 (2004).
- Baldwin, P. M., Davies, M. C., Melia, C. D. Starch granule surface imaging using low-voltage scanning electron microscopy and atomic force microscopy. International Journal of Biological Macromolecules. 21 (1-2), 103-107 (1997).
- Jane, J. L., Kasemsuwan, T., Leas, S., Zobel, H., Robyt, J. F. Anthology of starch granule morphology by scanning electron microscopy. Starch-Stärke. 46 (4), 121-129 (1994).
- Matsushima, R., Nakamura, Y. . Starch: Metabolism and Structure. , 425-441 (2015).
- Wang, S. -. q., Wanf, L. -. l., Fan, W. -. h., Cao, H., Cao, B. -. s. Morphological analysis of common edible starch granules by scanning electron microscopy. Food Science. 32 (15), 74-79 (2011).
- Baldwin, P. M., Adler, J., Davies, M. C., Melia, C. D. Holes in starch granules: confocal, SEM and light microscopy studies of starch granule structure. Starch-Stärke. 46 (9), 341-346 (1994).
- Chakraborty, I., Pallen, S., Shetty, Y., Roy, N., Mazumder, N. Advanced microscopy techniques for revealing molecular structure of starch granules. Biophysical Reviews. 12 (1), 105-122 (2020).
- Bechtel, D. B., Wilson, J. D. Amyloplast formation and starch granule development in hard red winter wheat. Cereal Chemistry. 80 (2), 175-183 (2003).
- Evers, A. Scanning electron microscopy of wheat starch. III. Granule development in the endosperm. Starch-Stärke. 23 (5), 157-162 (1971).
- Wang, Y. J., White, P., Pollak, L., Jane, J. L. Characterization of starch structures of 17 maize endosperm mutant genotypes with Oh43 inbred line background. Cereal Chemistry. 70, 171-179 (1993).
- Peng, M., Gao, M., Abdel-Aal, E. S. M., Hucl, P., Chibbar, R. N. Separation and characterization of A-and B-type starch granules in wheat endosperm. Cereal Chemistry. 76, 375-379 (1999).
- Wilson, J. D., Bechtel, D. B., Todd, T. C., Seib, P. A. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology. Cereal Chemistry. 83 (3), 259-268 (2006).
- Liu, Q., Weber, E., Currie, V., Yada, R. Physicochemical properties of starches during potato growth. Carbohydrate Polymers. 51 (2), 213-221 (2003).
- Chmelik, J., et al. Comparison of size characterization of barley starch granules determined by electron and optical microscopy, low angle laser light scattering and gravitational field-flow fractionation. Journal of the Institute of Brewing. 107 (1), 11-17 (2001).
- Moon, M. H., Giddings, J. C. Rapid separation and measurement of particle size distribution of starch granules by sedimentation/steric field-flow fractionation. Journal of Food Science. 58 (5), 1166-1171 (1993).
- Wriedt, T., Wolfram, H., Wriedt, T. . The Mie Theory: Basics and Applications. , 53-71 (2012).
- Schuerman, D. W., Wang, R. T., Gustafson, B. &. #. 1. 9. 7. ;. S., Schaefer, R. W. Systematic studies of light scattering. 1: Particle shape. Applied Optics. 20 (23), 4039-4050 (1981).
- Goering, K. J., Fritts, D. H., Eslick, R. F. A study of starch granule size and distribution in 29 barley varieties. Starch-Stärke. 25 (9), 297-302 (1973).
- Chen, Z., Schols, H. A., Voragen, A. G. J. Starch granule size strongly determines starch noodle processing and noodle quality. Journal of Food Sciences. 68 (5), 1584-1589 (2003).
- Dai, Z. M. Starch granule size distribution in grains at different positions on the spike of wheat (Triticum aestivum L.). Starch-Starke. 61 (10), 582-589 (2009).
- Edwards, M. A., Osborne, B. G., Henry, R. J. Effect of endosperm starch granule size distribution on milling yield in hard wheat. Journal of Cereal Science. 48 (1), 180-192 (2008).
- Karlsson, R., Olered, R., Eliasson, A. C. Changes in starch granule size distribution and starch gelatinization properties during development and maturation of wheat, barley and rye. Starch - Starke. 35 (10), 335-340 (1983).
- Li, W. -. Y., et al. Comparison of starch granule size distribution between hard and soft wheat cultivars in Eastern China. Agricultural Sciences China. 7 (8), 907-914 (2008).
- Park, S. H., Wilson, J. D., Seabourn, B. W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and breadmaking quality. Journal of Cereal Science. 49 (1), 98-105 (2009).
- Limpert, E., Stahel, W. A., Abbt, M. Log-normal distributions across the sciences: keys and clues. Bioscience. 51 (5), 341-352 (2001).
- Gao, M., et al. Self-preserving lognormal volume-size distributions of starch granules in developing sweetpotatoes and modulation of their scale parameters by a starch synthase II (SSII). Acta Physiologiae Plantarum. 38 (11), 259 (2016).
- Wattebled, F., et al. STA11, a Chlamydomonas reinhardtii locus required for normal starch granule biogenesis, encodes disproportionating enzyme. Further evidence for a function of alpha-1,4 glucanotransferases during starch granule biosynthesis in green algae. Plant Physiology. 132 (1), 137-145 (2003).
- Ji, Y., Seetharaman, K., White, P. J. Optimizing a Small-Scale Corn-Starch Extraction Method for Use in the Laboratory. Cereal Chemistry. 81 (1), 55-58 (2004).
- Halloy, S., Whigham, P. The lognormal as universal descriptor of unconstrained complex systems: a unifying theory for complexity. Proceedings of the 7th Asia-Pacific Complex Systems Conference. , 309-320 (2004).
- Furusawa, C., Suzuki, T., Kashiwagi, A., Yomo, T., Kaneko, K. Ubiquity of log-normal distributions in intra-cellular reaction dynamics. Biophysics (Nagoya-shi). 1, 25-31 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved