Method Article
フラグメントベースのリード発見におけるスクリーニングのためのナノ差動走査フルオリメトリー
要約
標的タンパク質の溶融温度の変化をモニタリングする(すなわち、熱シフトアッセイ、TSA)は、数百化合物の断片ライブラリーをスクリーニングするための効率的な方法である。フラグメントスクリーニング用の固有トリプトファン蛍光と光逆散乱をモニタリングするためのロボット工学支援ナノ微分走査蛍光測定(nano-DSF)を実装するTSAプロトコルを発表する。
要約
熱シフトアッセイ(TSA)は、その環境(例えば、緩衝液組成)の変化に応じて、標的タンパク質の融解温度(Tm)がどのように変化するかを調べる。TSAの有用性、および特にナノ差動走査蛍光測定(nano-DSf)の有用性は、特定のタンパク質を安定化するのに役立つ条件を見つけ、また、見かけのTmの変化をモニタリングしてリガンド結合を見るための、長年にわたって確立されてきた。本論文では、ナノDSFを用いたダイヤモンド-SGC-iNEXTポイズド(DSi-ポイズド)フラグメントライブラリー(768化合物)の効率的なスクリーニングを提示し、Tmをモニタリングして潜在的な断片結合を同定する。ナノDSF実験を行うためのタンパク質の品質と濃度に関する前提条件は、構造生物学研究所で一般的に使用されるナノリットルロボットディスペンサーを使用して96ウェルプレートで必要なサンプルを調製するステップバイステッププロトコルを次に簡単に概説しています。プロトコルは、試薬混合物がナノDSF測定に必要な毛細血管に転送される方法を記述します。さらに、熱変性(本来のトリプトファン蛍光を監視する)と凝集(光の逆散乱を監視する)とデータ転送と分析の後続のステップを測定するためのプロトコルを提供します。最後に、3つの異なるタンパク質標的を用いたスクリーニング実験について議論し、リード発見キャンペーンの文脈におけるこの手順の使用を説明する。説明する方法の全体的な原則は、他のフラグメントライブラリに簡単に転送したり、他の機器に適応させることができます。
概要
創薬プログラムは、多くの場合、薬物標的(最も頻繁にタンパク質)と相互作用および/または機能を変更する能力について化学化合物をスクリーニングすることから始まります。このような画面に見られるいわゆる「ヒット」は、新しいリードと開発候補の発見の基礎を築き、最近ライセンスされている新薬のほとんどに基づいています。したがって、ハイスループットメソッドの可用性は、膨大な数の異なる化合物を含む膨大な数の利用可能なターゲットをスクリーニングして、その緊密な結合またはターゲットの特定の機能を調節する能力を迅速に特定するために不可欠です。ヒットが特定された後、最も有望なヒットターゲットの組み合わせは、「構造活動関係」(SAR)を理解するために、他の、しばしば高価で時間のかかる技術を使用して広範な医薬品開発パイプラインに押し込まれます。
EU出資のアクセスプログラム「トランスレーショナルリサーチのためのインフラ」や現在の後継iNEXT-Discovery(iNEXT)や現在の後継的なiNEXT-Discoveryが提供する構造生物学のアプローチは、多くの場合、合成化学の数ラウンドによって初期ヒットの親和性および薬理学的特性を改善しながら、非常に詳細に多数の化合物の相互作用を研究するために使用されます。これらの「ヒットからリードへ」キャンペーンから出現する鉛化合物は、開発候補となり、前臨床試験に入ります。よく開発された分子スクリーニング方法は、リガンドベースのリード発見(LBLD)とフラグメントベースのリード発見(FBLD)の2つのアプローチに大別することができます。LBLDキャンペーンでは、タンパク質受容体は、数千個の手摘みリガンド(天然リガンドの構造または標的の構造に基づく)、または化学空間の大部分をカバーする薬物様リガンドライブラリ内の何万もの化合物のいずれかでスクリーニングされます。
通常、化合物は、活性アッセイにおいてそれらの阻害活性について試験され、典型的には酵素機能を監視する。しかし、FBLDキャンペーンでは、一般的に薬物(100-200ダルトン)よりも小さい何百もの化合物が、活性アッセイを使用せずに標的を直接結合する能力についてテストされる。この結合は標的活性を妨げる可能性があり、標的に結合する断片の能力を直接報告する多くの生物物理学的方法、またはX線結晶学6や核磁気共鳴分光法7などの構造方法によって、さらに最近では、クライオ電子顕微鏡法によって測定することができる。断片がタンパク質上で互いに近接する異なる場所で結合する場合、異なる、通常低親和性結合フラグメントを合理的に化学的に結合して、より詳細に研究できる少数のリードを作成することができる。これは、より高い親和性、より強力な化合物を頻繁に生じ、この方法論は、臨床的可能性を有する重要な分子を生み出し始めている。化学群を効率的に利用する「理想」の断片ライブラリの選択は、長年にわたり8、9、10の研究分野として活発に行われてきました。
最初は完全な化学空間をカバーすることに重点を置いていたが、その後の注意は、リード化合物を生成するために断片ヒットの下流の化学的組み合わせを可能にすることに焦点を当てた。このような研究は、いわゆる「準備された」図書館につながっています。これらはSARの研究の効率上の進歩のための急速な、安価なフォローアップ合成化学を可能にする少なくとも1つの官能基を有する断片を含んでいる。iNEXTが触媒した活動の一つは、ダイヤモンド光源と構造ゲノミクスコンソーシアムの研究者によって開発された準備された図書館を更新することであった。この組み合わせの努力は、iNEXT12内で検証された DSi-Poised ライブラリー11に生じ、その後、このライブラリは、スクリーニングのためのビルディングブロックと複合ライブラリの大規模なコレクションの化学研究組織と生産者であるEnamine Ltd.のREALデータベースで化合物の入手可能性に合わせて調整されました。DSi-Poisedは、誰でも購入できますが、サポートされているフラグメントスクリーニングプロジェクトのための多くのiNEXT-Discoveryパートナーラボでも利用できます。
ハイエンドのX線結晶学とNMR構造生物学の技術は、FBLDの長所と短所の両方があります。どちらも分離されたターゲットサンプルを必要とし、FBLDに必要な高解像度の原子詳細を生成します。しかし、X線結晶学には結晶が必要であり、断片は三次元結晶格子の構築に関与していない整えられたタンパク質領域の空洞に結合する。NMRは、結晶環境の影響を受けず、部分的に順序付けられたタンパク質領域でも結合を検出する上で良好であるため、しばしばX線結晶学とは異なるヒットを生み出します。しかし、リガンドベースのNMR実験は比較的速いですが、まだかなりの時間と材料を必要とし、比較的小さなタンパク質ターゲットまたはドメインに対してのみ日常的に行うことができます。結晶学またはNMR実験のための化合物の優先順位付けの目的のために、生物物理学的アプローチは13、14、15を使用されてきた。
近年の計測・計算プロトコルは、構造を決定し、1,000個の断片を非常に効率的に分析することで、FBLDの効率的な結晶学的スクリーニングを可能にするものであり、この優先順位付けはX線ベースの研究においてあまり重要でなくなっています。しかし、NMRの場合、ライブラリスクリーニングを優先し、最高端の機器の機器時間を節約するために、より安価で迅速な実験を使用することが望ましいままです。同時に、本質的に異なる技術の組み合わせを使用すると、結合イベントの独立した確認、あるいは結晶学またはNMR法のみを採用することによって拾われない追加のヒットを提供することができます。結晶学とNMRの技術は両方とも非常に高価な機器を必要とし、多くの場合、地元の高度に熟練した専門家の助けを借りて専用の外部施設でのみ行うことができます。また、結果の適切な分析には高い専門知識も必要です。iNEXTやiNEXT-Discoveryなどのプログラムは、このような施設へのアクセスを民主化していますが、他の方法による安価で高速でハイスループットのFBLDスクリーニングは、より広い範囲の実験室での薬物スクリーニングプログラムを奨励することができると認識されています。このような結果は、薬効化学者とのコラボレーションを構築し、NMRおよび結晶学施設がスクリーニング可能な化合物の数に制限を課す場合、最も有望な化合物に最も高価なスクリーニング実験を優先する指標として使用することができます。
TSAは、FBLDスクリーニングに使用できる迅速で効率的で比較的安価でアクセス可能な生物物理学的方法17 を形成する。これは、結晶化試験18のための安定したタンパク質条件を見つける支援から、細胞19内の特定の標的に結合する化合物を見つけるために、複数の設定で使用されてきた。TSAは、リガンド結合性標的タンパク質の解離定数を測定するためにも使用されており、リガンド結合は熱安定性の変化をもたらすことが多い。すべてのTSAにおいて、タンパク質の変性温度の変化(その安定性)は、温度上昇の遅い関数として測定される。加熱時にタンパク質変性を追う効率的な方法は、DSFまたはサーモフルターによるもので、温度上昇により展開するタンパク質の露出した疎水性領域との相互作用時に疎水性色素(典型的にはSypro Orange)の蛍光消光を定量化します。
ナノDSFは、典型的には、外部染料の不在時のタンパク質の熱安定性の測定をいう。この可能性を提供した最初の機器の1つは、サンプルの光の拡散だけでなく、光の強度の広いスペクトルを測定するOPTIM1000でした。この機械は、タンパク質の展開(典型的にはトリプトファン蛍光)とタンパク質凝集(形成されたナノ粒子として〜400nmで光散乱の増加をもたらす)の同時測定を可能にした。その後、プロメテウスは、蛍光シグナルの凝集および高感度検出を測定するためのバック反射の使用を導入し、良好な感度20で低タンパク質濃度のスクリーニングを可能にする。次のセクションでは、プロメテウスを使用して、異なるタンパク質標的のヒットを検出するためのフラグメントスクリーニングプロトコルを実証する方法について説明します。予測されるタンパク質の質と量について簡単に説明した後、フラグメントスクリーニング実験を準備、実行、分析するためのステップバイステップのプロトコルが続きます。3つのタンパク質のスクリーニング結果は、iNEXT-Discoveryコラボレーションの一環として得られたサンプルデータとして示されています。
プロトコル
注:ナノDSF実験で使用されるタンパク質は、ドデシルスルフェート-ポリアクリルアミドゲル電気泳動で判断される純粋(>95%)と均質である必要があります。フラグメントスクリーンを実施する前に、タンパク質の安定性は、種々の緩衝条件で決定されるべきである。低イオン強度、タンパク質との干渉を最小限にする低塩バッファーは、断片との直接的な相互作用に影響を与えないように使用する必要があります。このプロトコルで通常、安定性をチェックするために使用されるバッファは 補足表 S1に示されています。この実験に使用する必要のあるタンパク質の濃度は、通常0.2 mg mL-1です。DSi-Poisedライブラリー全体(768化合物)をスクリーニングするためには、その濃度の合計〜12mLのタンパク質、合計〜2.5mgが必要です。これらの実験で使用されたDSi-Poisedライブラリは96ウェル形式で提供された(図1)。フラグメントの濃度は、20%v/vジメチルスルホキシド(DMSO)で100mMに調整した。ここで説明する混合プロトコルは、0.4%v/vの低い最終DMSO濃度をもたらすことに留意すべきです。これはタンパク質の安定性に影響を与える可能性は非常に低いが、DMSOの効果は、新しいタンパク質ごとにチェックする必要があります。

図1: これらの実験に使用するプレートの種類( A) U-底板(B)96ウェルプレート。(C) サブウェル 1 を示す 96 ウェルプレートのクローズアップビュー。 この図の大きなバージョンを表示するには、ここをクリックしてください。
1. プレートの準備
- 20°C/-80°Cの冷凍庫からフラグメントプレートを取り出し、ベンチトップシェーカーで穏やかに揺れながら室温で解凍させます。プレートを30×gで遠心し、ウェルの側面に付着した滴を集める。
メモ:フラグメントライブラリはDMSO-d6( 融点19°C)に溶解可能であるため、各化合物が完全に解凍され、可溶化されていることを確認することが不可欠です。 - MRC 2ウェル結晶化プレート(図1A)、ピペット14.7μLのタンパク質ストック溶液を各サブウェルに取り込みます。これを時間効率の高い方法で行うには、タンパク質を試薬貯蔵所(材料表)に保管し、マルチチャンネルピペットを使用して分配します(図2A、B)。
注:DSi-Poisedライブラリの場合、フォーマットに応じて、96ウェルプレートのすべての井戸に化合物が含まれているわけではありません。通常、行 A、H、および列 1, 12 は DMSO で埋められます。したがって、行A、H、および列1,12はタンパク質で満たされないため、次のステップの最後に断片が含まれていません。DMSO のみがロボットによってそこに転送されます。空の行と列は、いくつかのプレートで異なっていますのでご注意ください。

図2:フラグメントスクリーニング手順の概要(A)多チャネルピペットと試薬リザーバを用いてタンパク質を分配する。(B) 96ウェルプレートにタンパク質を分配する。(C)ディスペンサーロボットによるフラグメント分配。(D) 毛細血管へのタンパク質の負荷。(E)キャピラリーホルダーを示す引き出し。(F)毛細管ホルダーのクローズアップビュー。この図の大きなバージョンを表示するには、ここをクリックしてください。
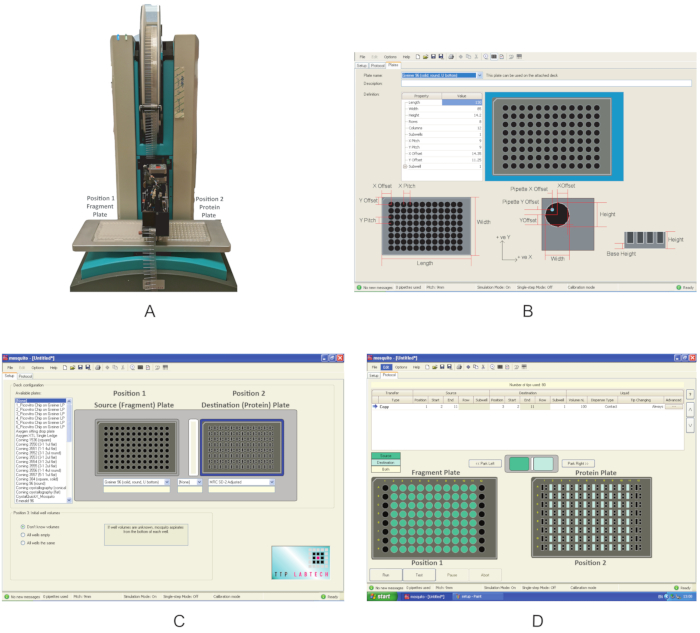
図3:これらの実験で使用される装置の概要( A)フラグメント塗布に用いられるナノディスペンサーロボットプレート位置が示されます。(B) 新しいプレートを定義するためのプログラムインタフェース。(C)ディスペンスプログラムのインターフェース。(D) 断片を分配するために使用される調剤プログラム。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. モスキートロボットによるフラグメントナノ分配
- フラグメントが供給されているプレートの種類を確認してください (材料表)。
- 蚊の断片とタンパク質プレートの定義を確認してください。
- ナノディスペンサーのスイッチを入します(図3A)。移動するコンポーネントの周囲に障害物がないことを確認します。
- グラフィカルユーザーインターフェイスを開き、[ 設定 ]タブをクリックし、[ デッキ構成]で、コンパウンドが供給されているプレートの種類と、セクション1でタンパク質が転送されたプレートが 利用可能なプレートのリストにすでに存在するかどうかを確認します。表示されていない場合は、[オプション] をクリックします |プレート を作成し、 プロパティ タイプの正しい値を入力して新しいプレート定義を作成します (図 3B)。
注: この実験で使用した MRC 2 ウェル プレートと 96 ウェル プレートのこれらの値は、それぞれ 補足表 S2 および 補足表 S3に示されています。
- ディスペンスプログラム
- [ 設定 ]タブで、[ デッキ設定]の下でプレートの位置を指定します。
注:この実験で使用される蚊は、デッキ上に2つのプレート位置を持っています。 位置 1 は ソース プレートとして定義され、位置 2 は 終点プレートです。 - ドロップダウン メニューを使用して、位置 2 (図 2C)の位置 1とMRC 2-well プレートのGreiner U 底プレートを選択します。プロトコルを保存します。
- [ 設定 ]タブで、[ デッキ設定]の下でプレートの位置を指定します。
- フラグメント塗布
- フラグメントプレートを位置1に置き、プロテインプレートをデッキの位置2に配置します(図3A)。
- [ プロトコル ] タブ (図 3D)で [ファイル ] をクリックし、セクション 2.3 に保存されているプロトコルを選択して、断片を分配します。分配する断片の体積を定義します。0.3 μL を使用してください。列 1 と 12 にフラグメントが含まれていない一般的なプレートの場合は、列 2 の 開始 位置と列 11 までの 終了 位置を定義します。プレートによっては、列 2 または 11 が空の場合、列 3 と 10 をそれぞれ開始値と終了値として使用します。
注: Mosquito の設定により、列のみをスキップでき、行はスキップできません。行の場合、蚊はDMSOをピペットします。フラグメントライブラリを交差しないように、[ チップ変更 ] オプションが [常に]に選択されていることを確認します。 - [実行] をクリックしてプログラムを起動します。約2分かかる塗布が完了した後、ロボットからタンパク質とフラグメントプレートを取り出し、接着シールフィルムで密封します。タンパク質プレート(500×g、30 s)を簡単に遠心分離し、次のステップに進む前にウェルの側面に付着した任意の滴を収集します。
3. ナノDSFの測定
メモ: プロメテウス NT.48 を使用した TSA の実行に関する詳細な説明は、20以前に公開されています。フラグメントスクリーニングの文脈における重要な点をここに挙げることができる。
- 測定前のプレート検査
- タンパク質プレートのウェルを、断片の添加によって発生した可能性のある沈殿物を視覚的に検査します。沈殿が多くのウェルで観察される場合は、断片の濃度を下げ、実験を繰り返す。
注:タンパク質プレートを室温に保つことをお勧めします。断片は、より低い温度で不溶になる傾向がある。
- タンパク質プレートのウェルを、断片の添加によって発生した可能性のある沈殿物を視覚的に検査します。沈殿が多くのウェルで観察される場合は、断片の濃度を下げ、実験を繰り返す。
- プロメテウスの準備
- プロメテウスの楽器のスイッチを入れて下さい。タッチスクリーンで、 引き出しを開いて 器具のキャピラリーローディングモジュールにアクセスします。ローディングモジュールから磁気ストリップを取り出し、ミラーをエタノールで洗浄して、ほこりを取り除きます。
- タンパク質断片プレートから毛細血管への転写
注:このステップは、プロテインプレートの各ウェルからプロメテウスで使用するために毛細血管に混合タンパク質/フラグメントサンプルを移すことを含みます。このため、標準毛細管型が典型的に使用されるが、非常に低いタンパク質濃度に対して高感度毛細血管を使用することができる。- タンパク質プレートとキャピラリを器具の隣に置き、キャピラリーローディングモジュールに簡単にアクセスできます。
- 1つの毛細管を取り、一方の端でそれを保持し、毛細血管の遠端でタンパク質プレート内の溶液をタッチし、毛細血管作用によってサンプルを転送します。手袋を着用し、手袋からの不純物(例えば、ほこり粒子)が測定に影響を与えるため、真ん中に毛細血管に触れないようにしてください。
- キャピラリーをホルダーの指定位置に配置し、正しく位置合わせおよび中央に配置されていることを確認します。
- ステップ 3.3.2 と 3.3.3 を繰り返し、荷重モジュール内のすべての位置を埋めます。測定に必要なすべての毛細血管をロードします。
注: 1 回の実行では、最大 48 個のキャピラリをロードできます。 - 最後に、キャピラリーの上に磁気ストリップを置いて所定の位置に保持し、[ 引き出しを閉じる] を押して実験を開始します。
- ナノDSF実験を行う
- 蛍光スキャン
- プロメテウスアプリケーションPRを開きます。ThermControlをクリックし、新しいプロジェクトを作成するには、ProteinName_ScreenName_PlateNumber名前を使用して新しいセッションを開始します。まず、検出スキャンを実行してサンプルの蛍光を検出します。
注:蛍光レベルは、各サンプルの3,000カウントを超える理想的なはずです。蛍光が器具の飽和限界(20,000カウント)を超えるサンプルは測定されません。 - レーザーの励起力を調整してサンプルの蛍光信号を変化させる(図4)。
- プロメテウスアプリケーションPRを開きます。ThermControlをクリックし、新しいプロジェクトを作成するには、ProteinName_ScreenName_PlateNumber名前を使用して新しいセッションを開始します。まず、検出スキャンを実行してサンプルの蛍光を検出します。
- 熱変性
- [ 溶融スキャン ]タブをクリックします。実験を行う場合は、 開始温度 を20°C、 終了温度 を95 °Cに、温度勾配を1 °Cmin-1に設定します。[ 計測の開始] をクリックします。
- 実験に対するアコード
- 実験が開始されたら、[注釈] タブと [結果 ] タブをクリックします。ユニークなプレートと十分な数を与えることによって、各毛細管にアナティブ。
注:例えば、毛管 1B2 はプレート1とウェルB2に対応します。このタブでは、実験のために余分なカラムを追加することができます, 例えば,タンパク質名,バッファー,タンパク質濃度.実験が終了すると、結果もこのタブに表示されます。これは、一日の終わりに一時停止する良い時間です。実験は一晩行われ、結果は翌日に収集することができます。
- 実験が開始されたら、[注釈] タブと [結果 ] タブをクリックします。ユニークなプレートと十分な数を与えることによって、各毛細管にアナティブ。
- データの視覚化とエクスポート
- 実験が完了したら、[ 溶融スキャン ]タブをクリックして、サンプルの融解と散乱曲線を表示します。結果をスプレッドシートにエクスポートするには、[ 溶解スキャン ] タブをクリックし、[ エクスポート] をクリックして、ドロップダウン メニューから [処理済みデータのエクスポート ] を選択します。
- 蛍光スキャン
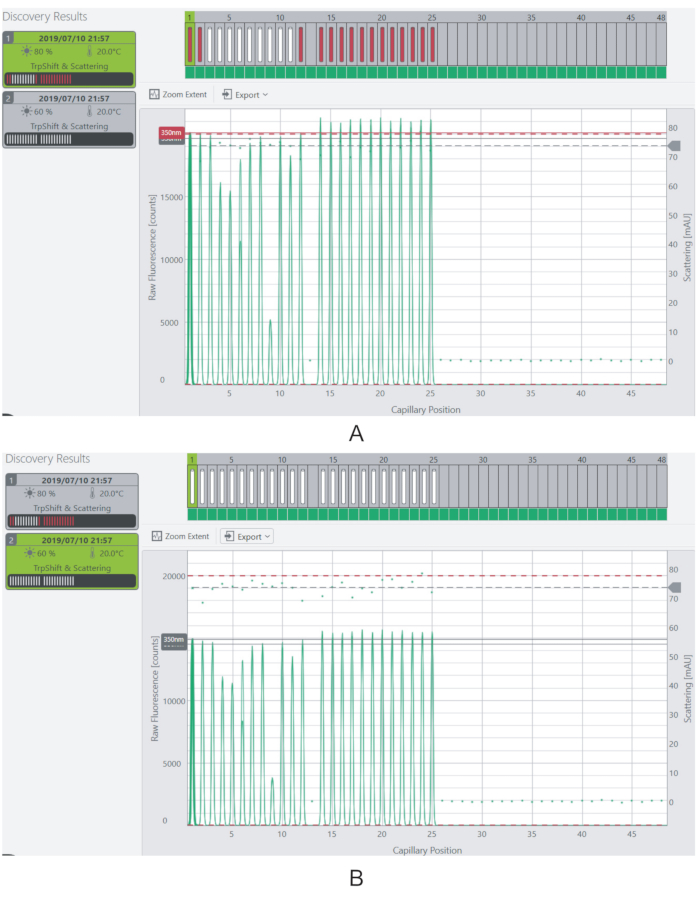
図4:励起力と蛍光信号を調整する(A)80%の励起力で、ほとんどのサンプルの蛍光信号は飽和限界を超えています。(B)蛍光シグナルは、励起力を60%まで下げることで測定可能なレベルにまで低下する。この図の大きなバージョンを表示するには、ここをクリックしてください。
4. イテレーション
- 手順 1 ~ 3 を繰り返して、768 化合物の Enamine ライブラリ全体で 16 回の実行を実行します (16 × 48 = 768)。
- 各プレートの測定が完了するまでに約1.5時間かかるので、注釈(3.4.3)を完了し、セクション1と2のステップを繰り返して次のタンパク質断片プレートを準備します。
注:一般的な作業日には、経験に応じて4〜6プレートを測定することができます。DSiライブラリー全体のスクリーニングは合計3~4日間で終了できます。
5. データ分析
- 生成されたデータの検査
- 各実行が完了したら、[注釈と結果]タブをクリックして結果を表示します。各サンプルについて、この概要で最も重要な 2 つの計算値に焦点を当てます: 1) 散乱開始温度 (散乱の場合は Onset #1) サンプルスキャッタリング イベントの開始時の温度を示し、集計の特性です。2)Tm(比の変曲点#1)値は、環境変化時のトリプトファン蛍光の最大変化に典型的に対応する330nm-valueにおける蛍光イベント間の比から抽出される。
- [ 融解スキャン ]タブで、各キャピラリーの散乱と融解曲線を確認し、これらの値が信頼できることを確認してください。
- スプレッドシートへのエクスポートと検査
- 3.4.4 で説明したように、すべての異なる実行からデータをスプレッドシート ソフトウェアにエクスポートし、概要テーブルとプロットを作成します。スプレッドシート ファイル内の各種シートをクリックして、各シートの情報をメモします。
- 概要シート では 、各行が 1 つの実験に対応していることに注意してください。パラメータの概要(例えば、開始温度と終了温度)に沿って、Tm と散乱発症の計算値を観察します(名前と説明については上記5.1、 補足ファイル1と2 を参照)。一部のサンプルについて 2 つ以上の Tm 値 (変曲点 #1 と比の #2) が計算される場合、融解曲線を調べて Tm 値のどれが正しいかを判断します。
- [比率]シートでは、各列がサンプルに対応し、各行が各温度ステップで読み取られたデータに対応していることに注意してください。各温度ステップに対応する蛍光数値を観察し、特定のサンプルの融解曲線をプロットするために使用し、蛍光カウント列に対して温度列をプロットします。なお、比率(第1誘導体)のデータは、330nm、330nm(第1誘導体)、350nm、350nm(第1微分)の比率とその第1微分(最大変化率で最大を有する)を同様の形式で計算するために使用される。
- 散乱シートでのスキャタリングの類似データ を 観察します。温度列を散布カラムに対してプロットして、サンプルごとに散乱曲線を生成します。散乱第1微分のシートを探します。
- 3.4.4 で説明したように、すべての異なる実行からデータをスプレッドシート ソフトウェアにエクスポートし、概要テーブルとプロットを作成します。スプレッドシート ファイル内の各種シートをクリックして、各シートの情報をメモします。
- すべてのフラグメントのグローバル概要の作成と検証
- フラグメントの正しい Tm値を確認した後、すべての実行から 330/350 nm の比率 (Tm)の列のサンプル IDと変曲点を組み合わせて、各実行からこれらの列をコピーします。
- ネイティブタンパク質の平均Tm 値(通常は10回にわたって計算)を使用し、各サンプルのTm 値から差し引いてΔTmを得る。結果を ΔTm を降順にソートし、最大シフトの結果となるサンプルを識別します。
- ΔTm シフトに応じてフラグメントをビンに分割し、各ビンのΔTm をフラグメント数に対してプロットしてライブラリ全体の周波数テーブルを生成する(図5)。便宜上、ログスケールのフラグメント数を表す軸を表示します。サンプルを ΔTm ±1 でビンに入れ、他のビンを各実行に適合させ、外れ値の数を経験的に調整します。
結果
DSi-Poisedライブラリ(768個の断片)の全画面を、医療目的の3つのタンパク質に対して行いました。 すなわち、癌1タンパク質(Hec1、またはNdc80)において高発現した外キネコア、単極スピンドルキナーゼ1(Mps1)の調節テトラリコペプチド反復(TPR)ドメイン、およびSARS-CoV-2 3C様プロテアーゼNsp5は、11部位でポリタンパク質のC末語を切断する。各タンパク質に対して選択された緩衝条件は、タンパク質濃度およびTm のタンパク質濃度と同様に、 補足表S4に示されている。
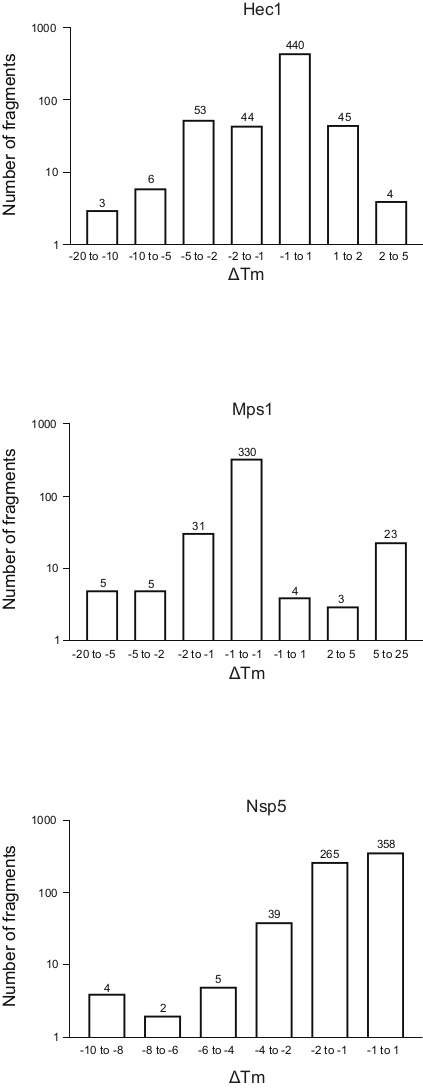
図5:この研究で代表的な結果として示した3つのタンパク質Hec1,Mps1,Nsp5に対する融解温度変化の周波数分布(ΔTm)を示す。 略語: Hec1 = 癌 1 タンパク質で高発現;Mps1 = 単極スピンドルキナーゼ 1;Nsp5 = SARS-CoV-2 3C様プロテアーゼ この図の大きなバージョンを表示するには、ここをクリックしてください。
上記のプロトコルを用いた3つのスクリーニングの結果は、Tm の変化とフラグメント数の周波数分布として表示され、 図5に示されている。これらのプロットは、プロトコルのセクション5.3に記載されているように生成されており、Tmで観察された変化の頻度をプロットしている。シフトの重要性は、以下の説明セクションで説明するように、各プロジェクトの主観的な方法で定義する必要があります。負の値は、フラグメント存在下での溶融温度の低下を示し、Tmの増加を正の値とします。このようなプロットから、Nsp5では全ての断片が不安定な効果を有し、Hec1とMps1の場合は、安定と不安定性の両方のヒットが観察されることを容易に観察できる。これは期待でき、議論されるでしょう。
ディスカッション
このプロトコルは、一般的なロボット工学や計測機器を使用してフラグメントライブラリをスクリーニングするための中~高スループットの方法を説明します。このプロトコルで説明されているような画面は、アムステルダムのNKIタンパク質ファシリティによって日常的に実行することができます, 例えばiNEXT-Discoveryサービスとして, 多くの場合、提案アプリケーションやピアレビュー後にユーザーのために無料で.このような場合、DSi-Poised ライブラリは、この機能によって提供されますが、他のライブラリの使用についても、異なるユーザー アプリケーションとサービス契約のコンテキストで説明できます。このプロトコルの器械の選択は多くの実験室のための実用的な解決を表すが、金の標準として考慮されるべきではない。標識のない方法は、逆転写ポリメラーゼ連鎖反応サーモサイクラーでの展開を検出するために環境に敏感なラベルを使用する方法ではなく、フラグメントスクリーニングのために標的タンパク質の熱安定性を測定するために推奨されます。
プロメテウスの器具を使用してここに示すようなラベルフリーの方法には、いくつかの利点があります:彼らはタンパク質の量が少なく、多くの場合、桁数の数桁を使用します。これらは、同時にサンプルの散乱を測定し、したがって凝集するために使用することができます。他のアプローチで展開を検出するために使用されるラベルは、各フラグメントと異なる相互作用を行い、測定アーティファクトを生じる可能性があります。このプロトコルは、手動で行うことができないサンプルの非常に少量(0.3 μL)のピペットを可能にするモスキートロボットのコンテキストで説明されています。モスキートは、構造生物学や創薬プロジェクトに取り組んでいる多くの研究室に存在する人気のロボットです。ただし、このプロトコルは、少量のピペット処理に代替アプローチを使用できます。
フラグメントライブラリには、DMSOに溶解した化合物が含まれています。初期の課題の1つは、タンパク質が安定したままで、化合物が可溶性のままである最適なDMSO濃度を見つけることです。これは、スクリーニングのための最適な条件を決定するために、様々なDMSO濃度で測定を行うことを含みます。ここで使用される希釈をフラグメント化するタンパク質は、DMSO濃度が0.2%になります。ほとんどのタンパク質は、これらの条件でかなり安定しています。768-化合物ライブラリーのスクリーニングを行う際に必要なタンパク質の量は、測定が一般的に低タンパク質濃度(0.2 mgmL-1)で行われるため、合計で〜2〜3mgである。このような比較的低いタンパク質濃度で作業すると、タンパク質の生産コストが削減されるだけでなく、タンパク質の沈殿の可能性も低下します。低タンパク質濃度はフラグメント結合の検出に影響を及ぼさず、実験中の断片の濃度が〜2mMであるため、弱い結合剤も同定できる。
これらの実験における融解遷移検出は蛍光強度に基づいているため、重要な側面は、測定を行うレーザーの励起力を決定することです。タンパク質との化合物の相互作用は、(i)その固有の蛍光に影響を及ぼさない、(ii)クエンチ、または(iii)その固有蛍光を増加させる。これに加えて、低タンパク質濃度での作業は、天然タンパク質の蛍光数が低いことを意味します。したがって、励起力は、ほとんどのサンプルを測定できるように調整する必要があります。各実行のスキャッタリング プロファイルは、フラグメントの追加によってトリガーされる可能性のある集約効果に関する重要な情報を提供します。また、化合物の溶解性に対する温度の影響は、散乱プロファイルにも見られる。
予想外に、多くの化合物に対して、温度上昇に伴って実際に散乱が減少することが観察された(図6)。したがって、融解遷移曲線とそれに付随する散乱プロファイルの両方を見て、各実験の信頼性について決定することが重要であり、特にX線結晶学またはNMR分光法によるより厳しい測定の候補と考えられている断片、あるいはフォローアップ化学のヒットと見なされる断片についても決定することが重要です。フラグメントスクリーニングの目的での方法の1つの特定の制限は、DSi-Poisedライブラリ内の多くの断片が、時には検出器の飽和限界を超えても、顕著な固有蛍光を有し、したがって、これらは低励磁力であっても標的結合のために適切にスクリーニングすることができないということです。この方法で注意すべきもう一つのポイントは、トリプトファン残基を含むタンパク質としか使用できないということです。
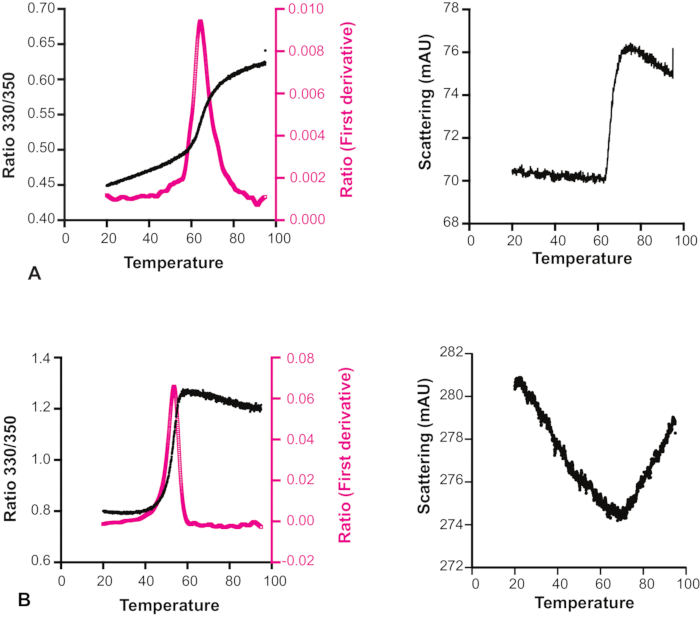
図6:化合物溶解度に対する温度の影響 2つの異なる化合物を有するHec1の融解遷移曲線および散乱プロファイル。(A)散乱プロファイルは、このサンプルの溶解度が温度の影響を受けないことを示しています。(B)散乱プロファイルは、温度上昇に伴ってこのサンプルの溶解度が高くなることを示している。したがって、この場合の融解遷移曲線は信頼できません。 この図の大きなバージョンを表示するには、ここをクリックしてください。
オープンな質問は、数学的な観点からではなく、実用的な観点から、Tmの有意な変化として考慮されるべきものである:Tm の変化は、タンパク質へのリガンドの結合を示すものとして考慮することが重要ですか?これらの例では、結合Hec1の断片の74%、Mps1の66%、Nsp5の53%に対して1°C未満のシフトが見られ、1°Cを「有意な変化」と考えると、フォローアップ化学によって追求するのに値するヒットはほとんど得られません。概観図(図5)では、1、2、5、または5度以上のTm シフトのビン(正または負のいずれか)が考慮された。これには、適切な概要を示し、情報に基づいた意思決定を可能にし、次のステップを決定するために、各特定のケースに応じた変更が必要です。特に、一部のタンパク質について、標的の安定化および脱安定化の両方が、考慮された断片に応じて観察された。両方のイベントは、両方のフラグメント結合の結果であり、両方ともタンパク質の挙動を操作するための良好なフォローアップ分子につながる可能性がありますので、興味深いです。
最後の質問は、「何が有用なヒットを定義するのか」というものです。実際、答えは特定の状況によって異なります。例えばHec1の場合、タンパク質を2度以上安定させたり、5度以上不安定化させたりするすべての断片は、これらのヒットに基づいて新しい分子を設計した化学の共同研究者に伝えられました。しかし、Nsp5の場合、最も安定解除ヒットはNMRの共同研究者に伝え、NMR実験でnanoDSF由来のヒットを確認しました。つまり、このプロトコルから得られたスクリーニング結果は、特定の質問と周囲の方法論に基づいて情報に基づいた意思決定を行い、注意してコンテキスト依存的な方法で分析する必要があります。いずれにしても、ここで説明する方法は、X線やNMRベースのスクリーニングなどの既存の方法論に対する補完的なアプローチであり、化学キャンペーンの確認、優先順位付け、新しいアイデアの提供を目指すことができます。
補足表S1:タンパク質のスクリーニングに使用されるバッファーのリスト。 略語: HEPES = 4-(2-ヒドロキイェチル)-1-ピペラジンタンスルホン酸;DTT = ジチオスレイトール;MOBS = 4-(Nモルフォリノ)ブタンレスルホン酸。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表S2:ナノディスペンサーロボットで使用するためのMRC 2ウェルプレートの特性。
補足表S3:ナノディスペンサーロボットで使用するための96ウェルVボトムプレートの特性。このテーブルをダウンロードするには、ここをクリックしてください。
補足表S4:代表的な結果で考察したタンパク質の緩衝、タンパク質濃度、およびTm。略語: DTT = ジチオスレイトール;Hec1 = 癌 1 タンパク質で高発現;Mps1 = 単極スピンドルキナーゼ 1;Nsp5 = SARS-CoV-2 3C様プロテアーゼこのテーブルをダウンロードするには、ここをクリックしてください。
補足ファイル 2: 406 フラグメントサンプルデータの Tmおよび ΔTm値。このファイルをダウンロードするには、ここをクリックしてください。
開示事項
開示はありません。
謝辞
「この研究は、NKIタンパク質施設、教示エリックセンターへのアクセスの恩恵を受けました。iNEXT、プロジェクト番号653706、プロジェクト番号871037 iNEXT-Discoveryによって資金援助が提供されており、欧州委員会のHorizon 2020プログラムが資金を提供しています。
資料
| Name | Company | Catalog Number | Comments |
| ClearVue Sheets | Molecular Dimensions | adhesive sealing film for protein plate | |
| CORNING 6570 Aluminium Sealing Tape | CORNING | adhesive sealing film for fragment plate | |
| DSi poised library | Enamine | Fragment library containing 768 compounds used in this study | |
| Elisa Reagent Reservior | ThermoFisher Scientific | 15075 | Reagent reservior used for pipetting the protein |
| Greiner round (U) bottom plates | Cat. No. 650201 | Fragments supplied in these plates | |
| Mosquito type X1 | sptlabtech | Part nr- 3019-0003 | Nanolitre dispenser |
| MRC 2-well crystallization plate | MRC96T-PS | ||
| Pierce ELISA Reagent Reservoirs | Pierce | ||
| Prometheus High Sensitivity capillaries | Catalog PR-C006 | ||
| Prometheus NT.48 nanoDSF | Nanotemper | Catalog nr PR001 (+ Aggregation Detection Optics, catalog nr PR-AGO) | nanoDSF and light back scattering |
| Prometheus Standard capillary type | Catalog PR-C002 | ||
| TX-1000 | Thermoscientific | Centrifuge for plates |
参考文献
- Hoffer, L., Muller, C., Roche, P., Morelli, X. Chemistry-driven hit-to-lead optimization guided by structure-based approaches. Molecular Informatics. 37 (9-10), 1800059 (2018).
- Lamoree, B., Hubbard, R. E. Current perspectives in fragment-based lead discovery (FBLD). Essays in Biochemistry. 61 (5), 453-464 (2017).
- Ress, D. C., Congreve, M., Murray, C. W., Carr, R. Fragment-based lead discovery. Nature Reviews Drug Discovery. 3 (8), 660-672 (2004).
- Carr, R. A. E., Congreve, M., Murray, C. W., Rees, D. C. Fragment-based lead discovery: Leads by design. Drug Discovery Today. 10 (14), 987-992 (2005).
- Bradley, A. R., et al. The SGC beyond structural genomics: Redefining the role of 3D structures by coupling genomic stratification with fragment-based discovery. Essays in Biochemistry. 61 (5), 495-503 (2017).
- Davies, T. G., Tickle, I. J. Fragment screening using X-ray crystallography. Topics in Current Chemistry. 317, 33-59 (2012).
- Ma, R., Wang, P., Wu, J., Ruan, K. Process of fragment-based lead discovery - A perspective from NMR. Molecules. 21 (7), 854 (2016).
- Troelsen, N. S., Clausen, M. H. Library design strategies to accelerate fragment-based drug discovery. Chemistry. 26 (50), 11391-11403 (2020).
- Shi, Y., von Itzstein, M. How size matters: Diversity for fragment library design. Molecules. 24 (15), 2838 (2019).
- Taylor, A., Doak, B. C., Scanlon, M. J. Design of a fragment-screening library. Methods in Enzymology. 610, 97-115 (2018).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. 74 (10-11), 555-563 (2020).
- Pfaff, S. J., Chimenti, M. S., Kelly, M. J. S., Arkin, M. R. Biophysical methods for identifying fragment-based inhibitors of protein-protein interactions. Methods in Molecular Biology. 1278, 587-613 (2015).
- Fattori, D., Squarcia, A., Bartoli, S. Fragment-based approach to drug lead discovery: Overview and advances in various techniques. Drugs in R & D. 9 (4), 217-227 (2008).
- Winter, A., et al. Biophysical and computational fragment-based approaches to targeting protein-protein interactions: Applications in structure-guided drug discovery. Quarterly Reviews of Biophysics. 45 (4), 383-426 (2012).
- Boelens, R., et al. iNEXT: a European facility network to stimulate translational structural biology. FEBS Letters. 592 (12), 1909-1917 (2018).
- Zhang, R., Monsma, F. Fluorescence-based thermal shift assays. Current Opinion in Drug Discovery and Development. 13 (4), 389-402 (2010).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Martinez Molina, D., Nordlund, P. The cellular thermal shift assay: a novel biophysical assay for in situ drug target engagement and mechanistic biomarker studies. Annual Review of Pharmacology and Toxicology. 56, 141-161 (2016).
- Bruce, D., Cardew, E., Freitag-Pohl, S., Pohl, E. How to stabilize protein: stability screens for thermal shift assays and nano differential scanning fluorimetry in the Virus-X Project. Journal of Visualized Experiments JoVE. (144), e58666 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved