Method Article
纳米微分扫描荧光仪,用于在基于碎片的铅发现中筛选
摘要
监测目标蛋白(即热移位检测、TSA)融化温度的变化是筛选几百种化合物片段库的有效方法。我们提出了一个TSA协议,实施机器人辅助纳米微分扫描荧光仪(nano-DSF),用于监测内在色氨酸荧光和光反散射,用于碎片筛选。
摘要
热移位测定 (TSAs) 检查目标蛋白质的熔化温度 (Tm)如何因环境变化而变化(例如缓冲成分)。TSA的效用,特别是纳米微分扫描氟学(纳米-DSF)的效用,多年来已经建立,既有助于找到有助于稳定特定蛋白质的条件,也用于通过监测表面Tm的变化来观察配体结合。本文通过使用纳米DSF、监测Tm 来识别潜在的碎片结合,对钻石-SGC-iNEXT 推架(DSI-波斯特)碎片库(768 化合物)进行了有效的筛选。对进行纳米DSF实验的蛋白质质量和浓度的先决条件进行了简要概述,随后是一个分步协议,使用结构生物学实验室中常用的纳米升机器人分配器在96井板中准备所需的样品。该协议描述了试剂混合物如何转移到纳米DSF测量所需的毛细血管中。此外,本文还提供了测量热变性(监测内在色氨酸荧光)和聚合(监测光反散射)以及数据传输和分析的后续步骤的协议。最后,讨论了三种不同蛋白质靶点的筛选实验,以说明在铅发现运动中使用这一程序的情况。所述方法的总体原理可以轻松地转移到其他片段库或适应其他仪器。
引言
药物发现计划通常从筛选化合物开始,以增强它们与药物靶点(最常见的是蛋白质)相互作用和/或改变其功能的能力。在这类屏幕上找到的所谓"命中",为发现新的线索和发展候选者,以及目前获得许可的大多数新药奠定了基础。因此,高通量方法的可用性对于筛选大量具有大量不同化合物的可用目标至关重要,以便快速识别其紧密结合或调节目标特定功能的能力。在确定命中后,最有希望的命中目标组合被推入广泛的药物开发管道,使用其他通常昂贵且耗时的技术来理解"结构-活动关系"(SAR)。
结构生物学方法,如欧盟资助的"NMR基础设施、EM和X射线转化研究"(iNEXT)及其目前的后续iNEXT-Discovery项目提供的方法,通常用于研究许多化合物的相互作用,同时通过通常几轮合成化学1来改善初始命中的亲和力和药理特性。从这些"从命中到领先"运动中产生的铅化合物成为发展候选者,并进入临床前研究。发达的分子筛选方法大致可分为两种方法,即基于配体的铅发现 (LBLD) 和基于碎片的铅发现 (FBLD)。在 LBLD 运动中,蛋白质受体使用几千个精心挑选的配体(基于自然配体的结构或目标结构)进行筛选,或者在药物状配体库中筛选出数以万计的化合物,这些配体覆盖了大部分化学空间。
通常,在活动检测中测试化合物的抑制活性,通常监测酶功能。然而,在FBLD运动2,3,4,5中,一些通常比药物(100-200道尔顿)小的化合物被测试为能够直接绑定目标,而无需使用活性检测。这种结合可能干扰目标活动,可以通过许多生物物理方法进行测量,这些方法直接报告碎片与目标结合的能力,或者通过结构方法,如X射线晶体学6和核磁共振光谱7,以及最近,还通过低温电子显微镜测量。当片段在蛋白质上彼此接近的不同位置结合时,不同的、通常低亲和力结合的片段可以合理地在化学上结合,从而产生一小组线索,可以更详细地研究。这经常导致高亲和力,更有力的化合物,这种方法已经开始产生具有临床潜力的重要分子。选择一个"理想"的片段库,有效地利用化学组一直是一个活跃的研究领域多年8,9,10。
虽然最初的重点是覆盖全部化学空间,但随后的注意力集中在使碎片击中的下游化学组合产生铅化合物。这种研究导致了所谓的"稳重"图书馆。这些片段包含至少一个功能组的片段,允许快速、廉价的后续合成化学,以便在研究SAR方面取得有效进展。iNEXT 催化的活动之一是更新钻石光源和结构基因组学联盟研究人员开发的稳重库。这一共同努力导致DSi-波斯特图书馆11,这也已验证在iNEXT12。后来,该图书馆与Enamine有限公司的REAL数据库中的化合物供应情况一致,Enamine Ltd.是一个化学研究机构,也是大型积木和化合物库的生产商,用于筛选。DSi-波斯特现在可供任何人购买,但也可在许多 iNEXT-Discovery 合作伙伴实验室中用于支持的片段筛选项目。
高端X射线晶体学和NMR结构生物学技术对FBLD都有其优点和劣势。两者都需要孤立的目标样品,并产生 FBLD 所需的高分辨率原子细节。然而,晶体对于X射线晶体学是必要的,这些片段与有序蛋白质区域的腔结合,这些细胞没有参与三维晶体晶格的构建。解决方案 NMR 通常产生与 X 射线晶体学不同的点击率,因为它不受晶体环境的影响,并且善于在部分有序的蛋白质区域检测结合。然而,虽然基于配体的NMR实验相对较快,但它们仍然需要大量的时间和材料,并且通常只能针对相对较小的蛋白质靶点或领域进行。为了优先考虑晶体学或NMR实验的化合物,生物物理方法已经使用了13,14,15。
由于最近的仪器和计算协议通过非常有效地确定结构和分析 +1,000 片段,允许对 FBLD 进行高效的晶体筛选,因此这种优先级在基于 X 射线的研究中已变得不那么重要。然而,对于 NMR 来说,最好使用更便宜、更快的实验来优先进行库室筛选,并节省仪器在高端设备上的时间。同时,使用基本不同的技术组合可以提供绑定事件的独立确认,甚至仅使用晶体学或 NMR 方法无法接收的其他命中。晶体学和核不月素技术都需要非常昂贵的设备,而且通常只能在当地高技能专家的帮助下在专门的外部设施中完成。此外,对结果的适当分析也需要高度的专业知识。虽然像iNEXT和iNEXT-Discovery这样的项目正在使获得此类设施的机会民主化,但人们已经认识到,通过其他方法进行廉价、快速和高通量的FBLD筛查可以鼓励在更广泛的实验室中实施药物筛查计划。然后,如果NMR和晶体学设施对可筛选的化合物数量施加限制,则这些结果可用作与药用化学家建立合作关系的指示,并将最昂贵的筛选实验优先用于最有前途的化合物。
TSA 形成了一种快速、高效、相对便宜且易于访问的生物物理方法17, 可用于 FBLD 筛查。它已被用于多个设置,从帮助找到稳定的蛋白质条件结晶试验18,到寻找化合物,结合到特定目标的细胞19。TSA还用于测量配体结合目标蛋白的分离常数,因为配体结合通常会导致热稳定性的改变。在所有 TSA 中,蛋白质的变性温度变化(其稳定性)被测量为缓慢温度升高的函数。加热时蛋白质变性的有效方法是DSF或热流,它量化疏水染料(通常是Sypro Orange)在与因温度升高而展开的蛋白质暴露的疏水区域相互作用时的荧光淬火。
Nano-DSF 通常是指在没有外部染料的情况下测量蛋白质的热稳定性。提供这种可能性的第一批仪器之一是 OPTIM1000,它测量了广谱的光强度以及样品的光散射。这台机器允许同时测量蛋白质展开(通常在色氨酸荧光之后)和蛋白质聚合(形成纳米粒子导致光散射增加至+400 nm)。后来,普罗米修斯公司引进了利用反光测量荧光信号的聚合和灵敏检测,允许筛选具有良好灵敏度的低蛋白质浓度20。以下部分描述了普罗米修斯如何用于演示用于检测不同蛋白质目标命中的片段筛选协议。简要介绍预期蛋白质的质量和数量,然后逐步制定、执行和分析片段筛选实验的协议。三种蛋白质的筛选结果已作为作为 iNEXT-Discovery 协作的一部分获得的示例数据显示。
研究方案
注:纳米DSF实验中使用的蛋白质应是纯的(>95%),并且与多乙硫化钠-聚丙烯酰胺凝胶电泳所判断的蛋白质相同。在执行片段筛选之前,蛋白质的稳定性应在各种缓冲条件下确定。应使用低离子强度、低盐缓冲器,以尽量减少对蛋白质的干扰,以免影响其与片段的直接相互作用。此协议中用于检查稳定性的缓冲器显示在 补充表 S1中。需要用作这个实验的蛋白质作为库存溶液的浓度通常是0.2毫克mL-1。为了筛选整个DSi-诗库(768化合物),需要总共12毫克浓度的蛋白质,总共2.5毫克。这些实验中使用的DSi-诗库以96井格式提供(图1)。碎片的浓度调整为100mM,20%v/v 二甲基硫化物(DMSO)。应当指出,此处描述的混合协议导致最终 DMSO 浓度低 0.4% v/v:虽然这不太可能影响蛋白质的稳定性,但应检查每种新蛋白质的DMSO效果。

图1:用于这些实验的板块类型。 (A) U底板。(B) 96井板。(C) 96 井板的特写视图,显示井下 1。 请单击此处查看此图的较大版本。
1. 板材制备
- 从 -20 °C/-80 °C 冰柜中取出一块碎板,让它在室温下解冻,在台面摇床上轻轻摇晃。将板离心在 500 × 克 30s 收集任何滴粘在井边。
注:由于碎片库可溶解在 DMSO-d6( 熔点 19 °C)中,因此必须确保每个化合物完全解冻和溶解。 - 取一个MC 2井结晶板(图1A),和移液器14.7微升的蛋白质库存溶液到每个子井。为了以省时的方式做到这一点,将蛋白质保存在试剂储液库(材料表),并使用多通道移液器进行配药(图2A,B)。
注:对于 DSi-诗库,根据格式,并非所有 96 井板的油井都含有化合物。通常,A 行、H 行和列 1、12 充满 DMSO。因此,A行、H排和1列、12列不含蛋白质,因为这些井在下一步结束时不会包含任何碎片:只有 DMSO 将由机器人转移到那里。请注意,空行和列在某些板中确实不同。

图2:片段筛选程序大纲。(A ) 使用多通道移液器和试剂储液池分配蛋白质。(B) 在96井板中分配蛋白质。(C) 分配器机器人的碎片分配。(D) 将蛋白质加载到毛细血管中。(E) 抽屉显示毛细支架。(F) 毛细小的支架的特写视图。请单击此处查看此图的较大版本。
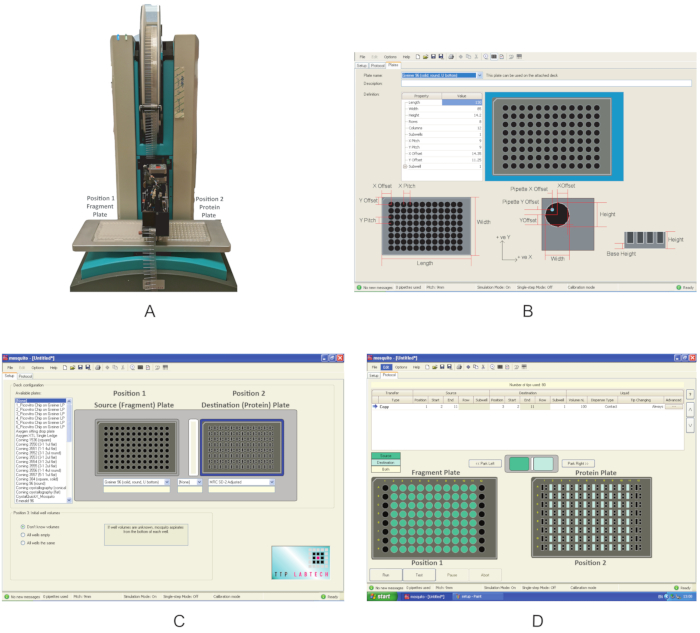
图3:这些实验中使用的设备概述。 (A) 用于碎片分配的纳米分配器机器人。指示板位置。(B) 定义新板的程序界面。(C) 分配程序的界面。(D) 用于分配碎片的分配程序。 请单击此处查看此图的较大版本。
2. 蚊子机器人的碎片纳米分配
- 检查提供碎片的板材类型(材料表)。
- 检查蚊子的片段和蛋白质板定义。
- 打开纳米分配器(图3A)。确保移动组件周围没有障碍物。
- 打开图形用户界面,单击 "设置 "选项卡,在 "甲板配置"下,检查提供化合物的板的类型以及第 1 节中蛋白质转移的板的类型是否已经出现在 可用板的列表中。如果没有,请单击 选项|板 ,并通过填写 正确的 属性类型值(图3B)创建一个新的板定义。
注:本实验中使用的MC 2井板和96井板的这些值分别显示在 补充表S2 和 补充表S3中。
- 分配程序
- 在 设置 选项卡下,指定 甲板配置下的板位置。
注:本实验中使用的蚊子在甲板上有两个板位。 位置 1 定义为 源板, 位置 2 是 目标板。 - 使用下拉菜单,选择 Greiner U 底 板用于 位置 1 和 MRC 2井板,用于 位置 2 (图 2C)。保存协议。
- 在 设置 选项卡下,指定 甲板配置下的板位置。
- 碎片分配
- 将碎片板放在1号位置,蛋白质板放在甲板的第2位(图3A)。
- 在 协议 选项卡(图 3D)上,单击 "文件" 并选择保存在第 2.3 节中的协议以分配片段。定义要分配的片段的体积;使用 0.3 μL。对于典型的板,其中列 1 和 12 不包含片段,定义 开始 位置到列 2 和 结束 位置到列 11。在某些板中,如果列 2 或 11 是空的,则分别使用列 3 和 10 作为开始值和结束值。
注:由于蚊子设置,只能跳过柱子,不能跳过行:对于行, 蚊子将移液器 Dmso 。确保 提示更改 选项选择为 "始终",以免交叉污染片段库。 - 单击 "运行" 以启动程序。配药完成后,需要 +2 分钟,从机器人中取出蛋白质和碎片板,然后用胶粘膜密封回来。在进入下一步之前,将蛋白质板(500 × 克,30s)短暂离心,以收集粘在油井两侧的任何水滴。
3. 纳米DSF测量
注:关于使用普罗米修斯NT.48执行 TSA 的详细描述已于20日公布。这里提到了片段筛选中的重要要点。
- 测量前的板检查
- 目视检查蛋白质板的井是否有因添加片段而可能发生的降水。如果在许多油井中观察到降水,则降低碎片的浓度,并重复实验。
注意:建议将蛋白板保持在室温下:碎片往往在较低的温度下变得无法溶解。
- 目视检查蛋白质板的井是否有因添加片段而可能发生的降水。如果在许多油井中观察到降水,则降低碎片的浓度,并重复实验。
- 准备普罗米修斯
- 打开普罗米修斯仪器。在触摸屏上,按 开抽屉 以访问仪器的毛细丝加载模块。从装载模块中取出磁条,用乙醇清洁镜子以去除任何灰尘颗粒。
- 从蛋白质片段板转移到毛细血管
注:此步骤涉及将混合蛋白质/片段样本从蛋白质板中的每口井转移到毛细血管,以便与普罗米修斯一起使用。为此,虽然通常使用标准毛细血管类型,但使用高灵敏度毛细血管可以降低蛋白质浓度。- 将蛋白质板和毛细血管放在仪器旁边,以便轻松进入毛细血管加载模块。
- 取一个毛细圈,将其抱在一端,用毛细细圈的远端触摸蛋白质板中的溶液,通过毛细细分作用转移样品。始终戴手套,并确保不要触摸中间的毛细细发,因为手套中的杂质(例如灰尘颗粒)会影响测量。
- 将毛细细丝放在支架的指定位置,确保毛细丝正确对齐和居中。
- 重复步骤 3.3.2 和 3.3.3,从而填满装载模块中的所有位置。装载测量所需的所有毛细血管。
注:对于单次运行,最多可装载 48 个毛细血管。 - 最后,将磁条放在毛细血管顶部,将毛细血管放在原位,并按 紧抽屉 开始实验。
- 执行纳米DSF实验
- 荧光扫描
- 打开 普罗米修斯 应用程序 公关。通过点击" 启动新会话 "的名称 ProteinName_ScreenName_PlateNumber创建新项目。首先,进行 发现扫描 以检测样品的荧光。
注:理想情况下,每个样本的荧光水平应高于 3,000 计数。不会测量荧光超过仪器饱和极限(20,000 计数)的样品。 - 通过调整激光的激发功率来改变样品的荧光信号(图4)。
- 打开 普罗米修斯 应用程序 公关。通过点击" 启动新会话 "的名称 ProteinName_ScreenName_PlateNumber创建新项目。首先,进行 发现扫描 以检测样品的荧光。
- 热变性
- 单击 "融化扫描 "选项卡。要执行实验,将 起始温度 设置为 20 °C, 将结束温度 设置为 95 °C,将温度坡度设置为 1 °C 最小-1。单击 "开始测量"。
- 对实验进行注释
- 实验开始后,单击 注释和结果 选项卡。给每个毛细细分做注释,给它一个独特的板和良好的数字。
注:例如,毛细细丝 1B2 将对应于板 1 和井 B2。在此选项卡中,可以为实验添加额外的列, 例如蛋白质名称、缓冲器、蛋白质浓度。实验完成后,结果也将显示在此选项卡中。这是一天结束的时候暂停的好时机:实验在一夜之间进行,结果可以在第二天收集。
- 实验开始后,单击 注释和结果 选项卡。给每个毛细细分做注释,给它一个独特的板和良好的数字。
- 数据可视化和导出
- 实验完成后,单击 熔化扫描 选项卡查看样品的熔化和散射曲线。要在电子表格中导出结果,请单击 熔化扫描 选项卡,单击 "导出",并从下拉菜单中选择 "导出处理数据 "。
- 荧光扫描
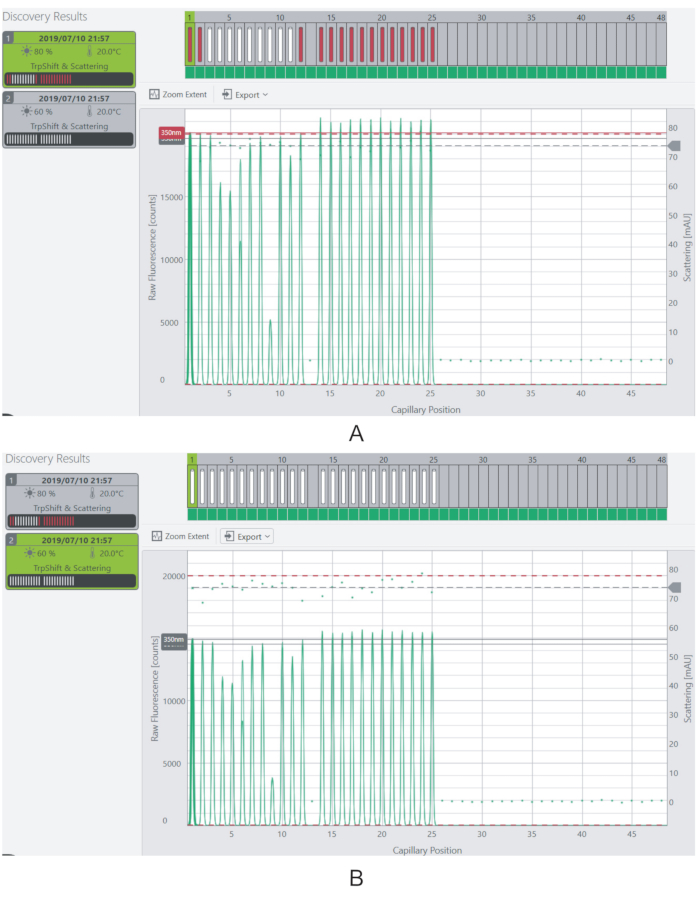
图4:调整激发功率和荧光信号。(A)在80%的激发功率下,大部分样品的荧光信号超过饱和极限。(B) 荧光信号通过将激发功率降低到60%而降低到可测量水平。请单击此处查看此图的较大版本。
4. 迭代
- 重复步骤 1-3,在 768 种化合物的整个 Enamine 库(16 × 48 = 768)上执行 16 次运行。
- 由于每个板的测量需要 +1.5 h 才能完成,因此需要完成注释 (3.4.3),并通过在第 1 节和第 2 节中重复步骤来准备下一个蛋白质片段板。
注意:在典型的工作日,可以根据经验测量 4-6 个板。整个 DSi 库的筛选工作总共可在 3-4 天内完成。
5. 数据分析
- 检查生成的数据
- 每次运行完成后,单击注释和结果选项卡以显示结果。对于每个示例,重点是本概述中最重要的两个计算值:1) 散射开始温度(散射开始 #1),表示样品散射事件开始时的温度,并且是聚合的特征:2) Tm(拐点 #1 表示比率)值从 330 和 350 nm 值的荧光事件比率中提取,通常对应色氨酸荧光在其环境中变化时的最大变化。
- 请务必检查熔化扫描选项卡中每个毛细细的散射和 熔 化曲线,以确保这些值是可靠的。
- 电子表格的导出和检查
- 将所有不同运行的数据导出以用于检查电子表格软件(如 3.4.4 所述)并创建概述表和图。单击电子表格文件中的各种表来记录每个表中的信息。
- 在 概述 表中,请注意,每行对应于一个实验。沿着参数概述(例如,开始和结束温度),观察 Tm 和散射发作的计算值(请参阅上面的 5.1 的名称和解释,以及 补充文件 1 和 2 示例)。当软件计算某些样本的两个或两个以上的 Tm 值(拐点 #1 和 #2 表示比率)时,请查看熔化过渡曲线以确定哪些 Tm 值是正确的。
- 在 比率 表中,请注意,每个列对应于示例,并且每行对应每个温度步骤读取的数据。观察与每个温度步骤对应的荧光计数值,并用它们绘制特定样品的熔化曲线,绘制荧光计数柱上的温度柱。请注意,比率(第一个衍生物)、330 nm、330 nm(第一个衍生物)、350 nm、350 nm(第一个衍生物)中的数据用于以类似的格式计算比率及其第一个衍生物(最大变化速率)。
- 观察散 射表中 散射的类似数据。通过将温度柱绘制到散射柱上,生成每个样品的散射曲线。寻找分散的第一个衍生物的表。
- 将所有不同运行的数据导出以用于检查电子表格软件(如 3.4.4 所述)并创建概述表和图。单击电子表格文件中的各种表来记录每个表中的信息。
- 创建并验证所有片段的全球概述
- 在验证片段的正确 Tm值后,将列示例 ID和 330/350 nm 比率 (Tm)的拐点从单个新结果文件中的所有运行中合并,从每个运行中复制这些列。
- 使用原生蛋白质的平均Tm 值(通常计算超过10次运行),并从每个样本的Tm 值减去它,以获得+Tm。按降序顺序对结果进行在 +Tm 上的排序,以确定导致最大移位的样本。
- 根据 +Tm 移位将碎片分成垃圾箱,并通过根据碎片数量绘制每个垃圾箱的 +Tm 来生成整个库的频率表(图 5)。为了方便起见,请显示表示日志刻度中碎片数的轴。将样品与 +Tm ±1 一起装箱,并根据每个运行情况调整其他垃圾箱,以根据经验调整离群值数。
结果
DSi-波斯特库(768个片段)的全屏对三种医学感兴趣的蛋白质进行了研究, 即,在癌症1蛋白(Hec1,或Ndc80)中高度表达的外基诺乔雷,单极主轴激酶1(Mps1)的监管四氯肽重复(TPR)领域,以及SARS-CoV-2 3C样蛋白酶Nsp5,它切断了11个部位复制多蛋白的C-终点。为每种蛋白质选择的缓冲条件,以及蛋白质的蛋白质浓度和Tm, 显示在 补充表S4中。
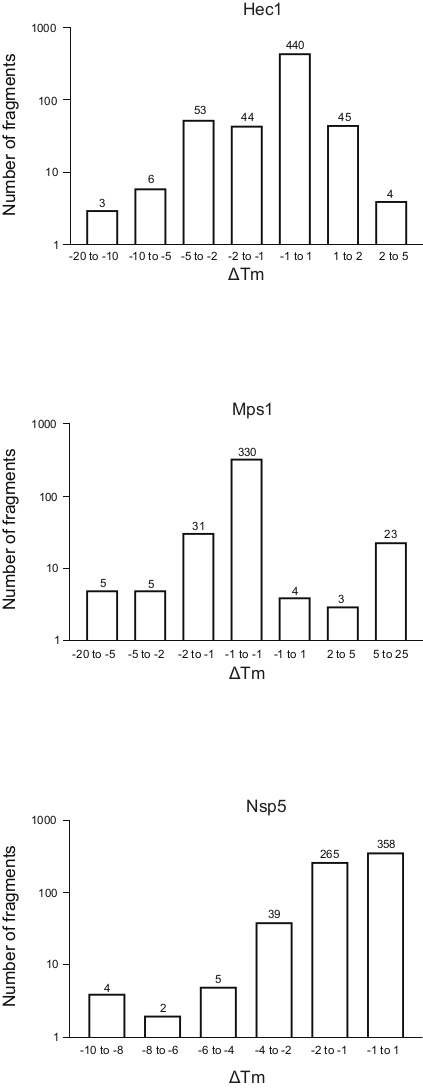
图5:在这项研究中,Hec1、Mps1和Nsp5三种蛋白质熔化温度变化的频率分布,作为具有代表性的结果。缩写: Hec1 = 癌症 1 蛋白中高度表达;Mps1 = 单极主轴激酶 1;Nsp5 = SARS-CoV-2 3C 样蛋白酶。请单击此处查看此图的较大版本。
使用上述协议的三次筛选结果(显示为 Tm 变化的频率分布与片段数)显示在 图 5中。这些图段已生成,如协议第 5.3 节所述,绘制了在 Tm中观察到的变化频率。需要以主观的方式界定这种转变对每一个不同项目的意义,如下讨论部分所述。负值表示在存在碎片时熔化温度降低,正值增加 Tm。从这些情节中,很容易看出,对于 Nsp5 来说,所有的碎片都有破坏稳定的作用,而对于 Hec1 和 Mps1 来说,观察到稳定和破坏稳定的命中率。这是可以预料到的,并将予以讨论。
讨论
该协议描述了使用一些常见的机器人和测量仪器筛选碎片库的中到高吞吐量方法。像本协议中描述的屏幕通常由阿姆斯特丹的 NKI 蛋白质设施执行,例如作为 iNEXT-Discovery 服务,通常甚至在建议申请和同行评审后对用户免费。在这种情况下,DSi-诗像库可以由设施提供,但其他图书馆的使用也可以在每个不同的用户应用程序和服务协议的背景下讨论。本议定书中仪器的选择代表了许多实验室的实际解决方案,但不应被视为金本位制。建议使用无标签的方法测量目标蛋白的热稳定性以进行片段筛选,而不是使用环境敏感标签检测反转录聚合酶链式反应热循环器中展开的方法。
无标签的方法,如使用普罗米修斯仪器在这里提出的方法,有一些优点:他们使用的蛋白质含量低,通常少几个数量级:它们可用于同时测量样品的散射,从而聚合:用于检测其他方法展开的标签可以与每个片段进行不同的交互,从而产生测量伪影。此协议在蚊子机器人的上下文中进行了描述,该机器人允许手动操作的非常小体积的样品(0.3 μL)的管道。蚊子是一种流行的机器人,存在于许多实验室从事结构生物学和药物发现项目;但是,该协议可以清楚地使用替代方法进行小容量管道处理。
碎片库包含溶解在 DMSO 中的化合物。最初的挑战之一是找到蛋白质保持稳定、化合物保持可溶性的最佳DMSO浓度。这涉及到在各种 DMSO 浓度下执行测量,以确定筛查的最佳条件。此处使用的蛋白质片段稀释导致 DMSO 浓度为 0.2%:大多数蛋白质在这些条件下是相当稳定的。对768复合库进行筛选所需的蛋白质量为±2-3毫克,因为测量通常以低蛋白质浓度(0.2毫克mL-1)进行。使用这种相对较低的蛋白质浓度不仅降低了蛋白质的生产成本,而且减少了蛋白质沉淀的机会。蛋白质浓度低不会影响片段结合的检测,因为实验中片段的浓度为 ±2 mM,因此还可以识别弱粘合剂。
由于这些实验中的熔化过渡检测基于荧光强度,因此一个关键方面是确定激光的激发能力,从而进行测量。化合物与蛋白质的相互作用(i)对其内在荧光没有影响,(ii) 导致淬火,或(iii) 增加其内在荧光。除此之外,低蛋白质浓度的工作意味着本地蛋白质的荧光计数会很低。因此,必须调整激发能力,以便测量大多数样本。每个运行的散射配置文件提供了有关添加任何片段可能触发的聚合效应的重要信息。此外,温度对复合溶质的影响也可以看到散射剖面。
出人意料的是,对于许多化合物,人们观察到散射实际上随着温度的升高而减少(图6)。因此,必须同时查看熔化过渡曲线和随附的散射剖面,以决定每个实验的可靠性,特别是对于那些通过 X 射线晶体学或 NMR 光谱法被认为是测量要求更高的片段,甚至被视为后续化学的热门片段。用于碎片筛选方法的一个具体限制是,DSI-诗像库中的许多片段具有显著的内在荧光,有时甚至超过探测器的饱和度限制,因此即使具有低激发功率,也无法正确筛选这些片段以实现目标绑定。该方法需要注意的另一点是,它只能与含有色氨酸残留物的蛋白质一起使用。
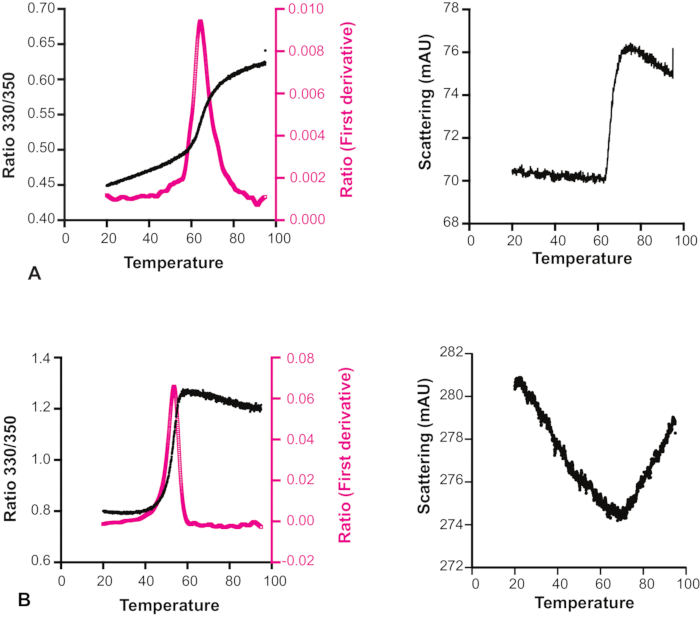
图6:温度对复合溶血性的影响。 熔化过渡曲线和散射配置文件的 Hec1 与两种不同的化合物。(A) 散射剖面显示,对于此样本,溶质不受温度影响。(B) 散射剖面显示,此样品的溶质随温度升高而增加。因此,在这种情况下,熔化过渡曲线是不可靠的。 请单击此处查看此图的较大版本。
一个悬而未决的问题是,Tm应该被视为什么的重大变化,不是从数学角度,而是从实际的角度来看:Tm 的什么变化很重要,作为配体与蛋白质结合的指示?在这些示例中,74% 的片段用于绑定 Hec1,66% 用于 Mps1,53% 用于 Nsp5。在概述图(图5)中,考虑了1、2、5或超过5度的Tm 移位,无论是正变还是负移。这需要根据每个具体案例进行修改,以便给出良好的概述,并允许知情决策,确定下一步。值得注意的是,对于某些蛋白质,根据所考虑的片段观察到目标的稳定性和去稳定性。这两个事件都很有趣,因为两者都可以是片段结合的结果,并且两者都可能导致一个良好的后续分子来操纵蛋白质行为。
最后一个问题仍然存在,即"什么定义了有用的打击?事实上,答案取决于具体情况。例如,对于 Hec1,所有使蛋白质稳定在 2 度以上或破坏蛋白质稳定 5 度以上的片段都传达给我们的化学合作者,他们根据这些命中设计了新的分子。然而,对于 Nsp5 来说,最不稳定的命中被传达给我们的 NMR 合作者,以确认 NMR 实验中纳米DSF 衍生的命中。换言之,应谨慎分析从本协议中获得的筛选结果,并以基于上下文的方式,根据具体问题和周围方法做出明智的决定。无论如何,这里描述的方法是对现有方法的补充方法,如X射线和基于NMR的筛查,它可以旨在确认,确定优先级,或为化学运动提供新的想法。
补充表S1:用于筛选蛋白质的缓冲剂列表。 缩写: HEPES = 4-(2-羟基乙基)-1-管道拉齐尼乙硫酸;DTT = 二甲二醇;生物 - 4 - (N - 形态) 丁烷磺酸。 请点击这里下载此表。
补充表S2:MRC 2井板的属性,用于纳米分配器机器人。请点击这里下载此表。
补充表S3:96井V底板的性能,用于纳米分配器机器人。请点击这里下载此表。
补充表S4:在具有代表性的结果中讨论的蛋白质的缓冲、蛋白质浓度和Tm。缩写: DTT = 二甲二醇;Hec1 = 癌症1蛋白中高度表达;Mps1 = 单极主轴激酶 1;Nsp5 = SARS-CoV-2 3C 样蛋白酶。请点击这里下载此表。
补充文件 1: 概述参数-示例数据。请单击此处下载此文件。
补充文件 2:406 个片段示例数据的 T m 值和 +Tm值。 请点击这里下载此文件。
披露声明
没有披露。
致谢
"这项工作得益于获得NKI蛋白设施,这是一个指导性ERIC中心。资金支持由iNEXT、项目编号653706和iNEXT-发现项目编号871037提供,该项目编号由欧盟委员会的Horizho 2020项目资助"。
材料
| Name | Company | Catalog Number | Comments |
| ClearVue Sheets | Molecular Dimensions | adhesive sealing film for protein plate | |
| CORNING 6570 Aluminium Sealing Tape | CORNING | adhesive sealing film for fragment plate | |
| DSi poised library | Enamine | Fragment library containing 768 compounds used in this study | |
| Elisa Reagent Reservior | ThermoFisher Scientific | 15075 | Reagent reservior used for pipetting the protein |
| Greiner round (U) bottom plates | Cat. No. 650201 | Fragments supplied in these plates | |
| Mosquito type X1 | sptlabtech | Part nr- 3019-0003 | Nanolitre dispenser |
| MRC 2-well crystallization plate | MRC96T-PS | ||
| Pierce ELISA Reagent Reservoirs | Pierce | ||
| Prometheus High Sensitivity capillaries | Catalog PR-C006 | ||
| Prometheus NT.48 nanoDSF | Nanotemper | Catalog nr PR001 (+ Aggregation Detection Optics, catalog nr PR-AGO) | nanoDSF and light back scattering |
| Prometheus Standard capillary type | Catalog PR-C002 | ||
| TX-1000 | Thermoscientific | Centrifuge for plates |
参考文献
- Hoffer, L., Muller, C., Roche, P., Morelli, X. Chemistry-driven hit-to-lead optimization guided by structure-based approaches. Molecular Informatics. 37 (9-10), 1800059(2018).
- Lamoree, B., Hubbard, R. E. Current perspectives in fragment-based lead discovery (FBLD). Essays in Biochemistry. 61 (5), 453-464 (2017).
- Ress, D. C., Congreve, M., Murray, C. W., Carr, R. Fragment-based lead discovery. Nature Reviews Drug Discovery. 3 (8), 660-672 (2004).
- Carr, R. A. E., Congreve, M., Murray, C. W., Rees, D. C. Fragment-based lead discovery: Leads by design. Drug Discovery Today. 10 (14), 987-992 (2005).
- Bradley, A. R., et al. The SGC beyond structural genomics: Redefining the role of 3D structures by coupling genomic stratification with fragment-based discovery. Essays in Biochemistry. 61 (5), 495-503 (2017).
- Davies, T. G., Tickle, I. J. Fragment screening using X-ray crystallography. Topics in Current Chemistry. 317, 33-59 (2012).
- Ma, R., Wang, P., Wu, J., Ruan, K. Process of fragment-based lead discovery - A perspective from NMR. Molecules. 21 (7), 854(2016).
- Troelsen, N. S., Clausen, M. H. Library design strategies to accelerate fragment-based drug discovery. Chemistry. 26 (50), 11391-11403 (2020).
- Shi, Y., von Itzstein, M. How size matters: Diversity for fragment library design. Molecules. 24 (15), 2838(2019).
- Taylor, A., Doak, B. C., Scanlon, M. J. Design of a fragment-screening library. Methods in Enzymology. 610, 97-115 (2018).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. 74 (10-11), 555-563 (2020).
- Pfaff, S. J., Chimenti, M. S., Kelly, M. J. S., Arkin, M. R. Biophysical methods for identifying fragment-based inhibitors of protein-protein interactions. Methods in Molecular Biology. 1278, 587-613 (2015).
- Fattori, D., Squarcia, A., Bartoli, S. Fragment-based approach to drug lead discovery: Overview and advances in various techniques. Drugs in R & D. 9 (4), 217-227 (2008).
- Winter, A., et al. Biophysical and computational fragment-based approaches to targeting protein-protein interactions: Applications in structure-guided drug discovery. Quarterly Reviews of Biophysics. 45 (4), 383-426 (2012).
- Boelens, R., et al. iNEXT: a European facility network to stimulate translational structural biology. FEBS Letters. 592 (12), 1909-1917 (2018).
- Zhang, R., Monsma, F. Fluorescence-based thermal shift assays. Current Opinion in Drug Discovery and Development. 13 (4), 389-402 (2010).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Martinez Molina, D., Nordlund, P. The cellular thermal shift assay: a novel biophysical assay for in situ drug target engagement and mechanistic biomarker studies. Annual Review of Pharmacology and Toxicology. 56, 141-161 (2016).
- Bruce, D., Cardew, E., Freitag-Pohl, S., Pohl, E. How to stabilize protein: stability screens for thermal shift assays and nano differential scanning fluorimetry in the Virus-X Project. Journal of Visualized Experiments JoVE. (144), e58666(2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。