Method Article
단편 기반 리드 디스커버리에서 스크리닝을 위한 나노 차분 스캔 형광
요약
표적단백질(즉,열시프트 분석, TSA)의 용융 온도의 변화를 모니터링하는 것은 수백 개의 화합물의 단편 라이브러리를 선별하는 효율적인 방법입니다. 당사는 본질적인 트립토판 형광 및 단편 스크리닝을 위한 가벼운 백 산란을 모니터링하기 위한 로봇 보조 나노 차분 스캐닝 플루오리미터(나노 DSF)를 구현하는 TSA 프로토콜을 제시합니다.
초록
열 변화 소세(TSA)는 환경의변화에 반응하여 표적 단백질의 용융 온도(Tm)가 어떻게 변화하는지 검사한다(예를들어,완충 조성). TSA의 유용성, 특히 나노 차등 스캐닝 형광량(nano-DSF)의 유용성은 수년에 걸쳐 확립되어 특정 단백질을 안정화시키는 데 도움이 되는 조건을 찾고 명백한Tm의변화를 모니터링하여 리간드 결합을 보고 있다. 이 논문은 나노 DSF의 사용에 의해 다이아몬드-SGC-iNEXT 태세(DSi-자세) 단편 라이브러리(768 화합물)의 효율적인 스크리닝을 제시하며, Tm을 모니터링하여 잠재적인 단편 결합을 식별합니다. 나노 DSF 실험을 수행하기 위한 단백질 품질 및 농도에 관한 전제 조건은 96웰 플레이트에서 필요한 샘플을 준비하기 위해 구조 생물학 실험실에서 일반적으로 사용되는 나노 리터 로봇 디스펜서를 사용하는 단계별 프로토콜에 따라 간략하게 설명되어 있습니다. 이 프로토콜은 시약 혼합물이 나노 DSF 측정에 필요한 모세 혈관으로 전달되는 방법을 설명합니다. 또한 이 백서는 열 성열(본질적인 트립토판 형광 모니터링) 및 집계(광 백 산란 모니터링) 및 데이터 전송 및 분석을 위한 후속 단계를 측정하는 프로토콜을 제공합니다. 마지막으로, 3개의 다른 단백질 표적으로 검열 실험은 지도 발견 캠페인의 맥락에서 이 절차의 사용을 설명하기 위하여 토론됩니다. 설명된 메서드의 전체 원리는 다른 조각 라이브러리로 쉽게 전송되거나 다른 계측에 적응할 수 있습니다.
서문
약물 발견 프로그램은 종종 약물 표적의 기능을 상호 작용 및 / 또는 수정하는 능력에 대한 화학 화합물을 선별하는 것으로 시작됩니다. 이러한 화면에서 발견되는 소위 "안타"는 새로운 리드와 개발 후보자의 발견의 기초를 마련하고, 요즘 허가되는 대부분의 신약에 대한 기초를 마련합니다. 따라서 고처리량 방법의 가용성은 거대한 수의 다른 화합물을 가진 사용 가능한 대상을 신속하게 식별하여 단단한 결합 또는 대상의 특정 기능을 조절하는 능력을 검사하는 데 필수적입니다. 안타가 확인된 후, 가장 유망한 히트 타겟 조합은 "구조 활동 관계"(SAR)를 이해하기 위해 종종 비용이 많이 들고 시간이 많이 소요되는 다른 기술을 사용하여 광범위한 약물 개발 파이프라인으로 밀려나고 있습니다.
유럽 연합 (EU)의 자금 액세스 프로그램 "NMR, EM 및 번역 연구를위한 X 선 인프라"(iNEXT)와 현재 의 후계자 iNEXT-Discovery에서 제공하는 것과 같은 구조 생물학 접근법은 일반적으로 합성 화학1의 여러 라운드에 의해 초기 안타의 친화력 및 약리학적 특성을 개선하면서 매우 자세하게 수많은 화합물의 상호 작용을 연구하는 데 자주 사용됩니다. 이러한 "히트에서 리드"캠페인에서 나오는 납 화합물은 개발 후보가되고 전임상 연구에 진입합니다. 잘 발달된 분자 스크리닝 방법론은 리간드 기반 리드 발견(LBLD) 및 단편 계 납 발견(FBLD)이라는 두 가지 접근법으로 대략 분류될 수 있다. LBLD 캠페인에서 단백질 수용체는 수천 개의 손으로 수확한 리간드(천연 리간드 또는 표적 구조의 구조에 따라) 또는 화학 공간의 상당 부분을 커버하는 약물 과 같은 리간드 라이브러리에 있는 수만 개의 화합물로 선별됩니다.
일반적으로 화합물은 활동 분석에서 억제 활성을 테스트하며, 일반적으로 효소 기능을 모니터링합니다. FBLD 캠페인2,3,4,5,그러나, 일반적으로 약물(100-200 Dalton)보다 작은 화합물의 일부 수백은 활동 분석의 사용 없이 대상을 직접 결합하는 능력에 대해 테스트된다. 이러한 결합은 표적 활성을 방해할 수 있으며, 표적에 결합하는 단편의 능력에 직접 보고하는 많은 생체 물리학 적 방법, 또는 X 선 결정학6 및 핵 자기 공명 분광검사7과같은 구조적 방법에 의해 측정될 수 있으며, 최근에는 또한 저온 전자 현미경 검사법을 측정할 수 있다. 단편이 단백질상 서로 가까이 있는 다른 위치에 결합할 때, 상이하고, 일반적으로 낮은 친화성 결합 단편은 합리적으로 화학적으로 결합되어 더 자세히 연구할 수 있는 작은 리드 세트를 만들 수 있다. 이 자주 높은 친화성 결과, 더 강력한 화합물, 그리고이 방법론은 임상 잠재력을 가진 중요 한 분자를 산출 하기 시작 했다. 화학 그룹을 효율적으로 활용하는 "이상적인"단편 라이브러리의 선택은 수년 동안 연구의 활성 영역이었다8,9,10.
초기 강조는 전체 화학 공간을 커버에 있었다 동안, 후속 관심은 리드 화합물을 생산하는 파편 안타의 하류 화학 조합을 가능하게에 초점을 맞추고 있었다. 이러한 연구는 소위 "자세"라이브러리로 이어졌다. 이들은 SAR공부에 있는 능률적인 진전을 위해 신속하고 저렴한 후속 합성 화학을 허용하는 적어도 하나의 기능성 단을 가진 단편을 포함합니다. iNEXT가 촉매한 활동 중 하나는 다이아몬드 광원 및 구조 유전체학 컨소시엄의 연구원들이 개발한 자세있는 도서관을 업데이트하는 것이었습니다. 이러한 결합된 노력으로 DSi-태세 라이브러리11이발생했으며, iNEXT12내에서도 검증되었습니다. 나중에,이 라이브러리는 Enamine Ltd.의 REAL 데이터베이스에서 화합물의 가용성과 일치했다, 화학 연구 조직 및 스크리닝을위한 빌딩 블록 및 복합 라이브러리의 큰 컬렉션의 생산자. DSi-자세는 이제 누구나 구매할 수 있지만 지원되는 단편 검사 프로젝트를 위한 많은 iNEXT-Discovery 파트너 실험실에서도 사용할 수 있습니다.
하이 엔드 X 선 결정학 및 NMR 구조 생물학 기술은 모두 FBLD에 대한 장점과 단점을 가지고 있습니다. 둘 다 격리된 대상 샘플을 필요로 하며 FBLD에 필요한 고해상도 원자 세부 정보를 산출합니다. 그러나, 결정은 엑스레이 결정학을 위해 필요하고, 단편은 3차원 결정 격자를 건축에 관여하지 않는 잘 정렬된 단백질 지구에 있는 충치에 묶습니다. 솔루션 NMR은 종종 X 선 결정학에서 다른 안타를 산출, 그것은 결정 환경에 의해 영향을받지 않으며 부분적으로 정렬 된 단백질 영역에서 또한 바인딩을 검출에 좋다. 그러나, 리간드 기지를 둔 NMR 실험은 상대적으로 빠르더라도, 그(것)들은 아직도 시간과 물질의 상당한 양을 요구하고 상대적으로 작은 단백질 표적 또는 도메인을 위해서만 일상적으로 행해질 수 있습니다. 결정화 또는 NMR 실험을 위한 화합물의 우선 순위를 지정하기 위해, 생체 물리학 접근법은13,14,15를사용하였다.
최근 계측 및 계산 프로토콜이 구조를 결정하고 ~1,000개의 단편을 매우 효율적으로 분석하여 FBLD에 대한 효율적인 결정학적 검사를 가능하게 됨에 따라 이 우선 순위는 X선 기반 연구에서 덜 필수적입니다. 그러나 NMR의 경우 라이브러리 스크리닝의 우선 순위를 지정하고 최고급 장비의 계측기 시간을 절약하기 위해 더 저렴하고 빠른 실험을 사용하는 것이 바람직합니다. 동시에 본질적으로 다른 기술의 조합을 사용하면 결정학 또는 NMR 방법만 사용하여 포착되지 않은 바인딩 이벤트의 독립적 인 확인 또는 추가 안타를 제공 할 수 있습니다. 결정및 NMR 기술은 모두 매우 비싼 장비를 필요로하며 종종 지역 고도로 숙련 된 전문가의 도움으로 전용 외부 시설에서만 수행 할 수 있습니다. 또한, 결과의 적절한 분석은 또한 높은 전문 지식을 요구한다. iNEXT 및 iNEXT-Discovery와 같은 프로그램은 이러한시설에대한 접근성을 민주화하고 있지만, 다른 방법으로 저렴하고 빠르며 고처리량 FBLD 스크리닝을 통해 훨씬 더 넓은 범위의 실험실에서 약물 선별 프로그램을 장려할 수 있다는 것이 인식되고 있다. 이러한 결과는 다음 약용 화학자와 협력을 구축 하는 표시로 사용할 수 있습니다., 그리고 가장 유망한 화합물에 가장 비싼 선별 실험 우선 순위를 NMR 및 결정학 시설 스크리닝 수에 제한을 부과 하는 경우 선별될 수 있는 화합물의 수에 제한을 부과.
TSA는 FBLD 스크리닝에 사용할 수 있는 빠르고 효율적이며 비교적 저렴하고 접근 가능한 생물 물리학방법(17)을 형성합니다. 결정화 예심18을위한 안정적인 단백질 조건을 찾는 데 도움을 주는 것에서부터세포(19)의특정 표적에 결합하는 화합물을 찾는 것까지 여러 설정에서 사용되어 왔다. TSA는 또한 리간드 결합 대상 단백질에 대한 해리 상수를 측정하는 데 사용되어 왔으며, 리간드 결합은 종종 열 안정성의 변경으로 이어집니다. 모든 TSA에서 단백질의 데니션 온도의 변화(안정성)는 느린 온도 증가의 함수로 측정됩니다. 가열 시 단백질 분해를 따르는 효율적인 방법은 온도 상승으로 인해 전개되는 단백질의 노출 소수성 영역과의 상호 작용 시 소수성 염료(일반적으로 Sypro Orange)의 형광 담금질을 정량화하는 DSF 또는 Thermofluor에 의해 수행됩니다.
나노-DSF는 전형적으로 외부 염료가 없는 경우 단백질의 열 안정성 측정을 말한다. 이러한 가능성을 제시한 첫 번째 계측기 중 하나는 샘플의 광 산란뿐만 아니라 광 강도의 넓은 스펙트럼을 측정하는 OPTIM1000이었습니다. 이 기계는 단백질 전개(전형적으로 트립토판 형광에 따른) 및 단백질 응집(형성된 나노입자로 인해 ~400nm의 빛이 산란되는 것을 초래함)의 동시 측정을 허용했습니다. 나중에, Prometheus는 형광 신호의 응집 및 민감한 검출을 측정하기 위한 백 반사의 사용을 소개하여, 좋은 감도20을가진 낮은 단백질 농도의 검열을 허용하. 다음 섹션에서는 Prometheus가 다른 단백질 표적에 대한 안타를 검출하기 위한 단편 스크리닝 프로토콜을 시연하는 데 어떻게 사용되었는지 설명합니다. 예상 단백질 품질 및 양에 대한 간략한 소개는 단편 스크리닝 실험을 준비, 수행 및 분석하기 위한 단계별 프로토콜이 뒤따릅니다. 3개의 단백질을 위한 검열 결과는 iNEXT-Discovery 협력의 한 부분으로 얻어진 보기 데이터로 표시되었습니다.
프로토콜
참고: 나노 DSF 실험에 사용되는 단백질은 순수(>95%)이어야 하며, 도데킬설페이트-폴리아크라이알라미드 젤 전기포광나트륨에 의해 판단되는 균질성이어야 한다. 단편 화면을 수행하기 전에, 단백질의 안정성은 다양한 완충 조건에서 결정되어야한다. 단백질을 최소한으로 방해하는 낮은 이온 강도, 낮은 염분 완충제는 단편과의 직접적인 상호 작용에 영향을 미치지 않도록 사용해야 합니다. 안정성을 확인하기 위해 이 프로토콜에 일반적으로 사용되는 버퍼는 보충 표 S1에표시됩니다. 이러한 실험을 위해 재고 용액으로 사용해야 하는 단백질의 농도는 전형적으로 0.2 mgmL-1이다. 전체 DSi-자세 라이브러리(768화합물)를 스크리닝하기 위해서는 총 ~12mL의 단백질을 총 ~2.5 mg에 필요로 한다. 이러한 실험에 사용된 DSi-자세 라이브러리는 96웰 형식으로공급되었다(그림 1). 파편의 농도는 20% v/v 디메틸설플옥사이드(DMSO)에서 100mMM로 조정되었다. 여기에 설명된 혼합 프로토콜은 0.4% v/v의 낮은 최종 DMSO 농도를 초래한다는 점에 유의해야 한다; 이것은 단백질의 안정성에 영향을 미칠 가능성이 매우 낮지만, DMSO의 효과는 각각의 새로운 단백질에 대해 검사해야합니다.

그림 1: 이러한 실험에 사용되는 플레이트의 종류. (A)U-바닥 플레이트. (B)96웰 플레이트. (C)서브웰 1을 나타내는 96웰 플레이트의 클로즈업 뷰. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 플레이트 준비
- -20°C/-80°C 냉동고에서 조각판을 꺼내 벤치탑 셰이커에 부드럽게 흔들리면서 실온에서 해동시키십시오. 500 g의 플레이트를 30초 ×동안 원심분리하여 우물 측면에 달라붙는 방울을 수집합니다.
참고: 단편 라이브러리가 DMSO-d6(융점 19°C)에 용해되어 있으므로 각 화합물이 완전히 해동되고 용해되었는지 확인하는 것이 필수적입니다. - 각 서브웰에 단백질 스톡 용액의 MRC 2웰 결정화플레이트(도 1A)와파이펫 14.7 μL을 섭취하십시오. 시간 효율적인 방식으로 이를 수행하려면 단백질을 시약저장소(재료 표)에보관하고 디스펜싱을 위한 멀티채널 파이펫(도2A,B)을사용합니다.
참고: DSi-자세 라이브러리의 경우 형식에 따라 96웰 플레이트의 모든 우물에 화합물이 포함되어 있지 는 않습니다. 일반적으로 행 A, H 및 열 1, 12는 DMSO로 채워져 있습니다. 따라서, 행 A, H 및 열 1, 12는 단백질로 채워지지 않으며, 이러한 우물은 다음 단계의 끝에 어떤 파편도 포함하지 않을 것이다; 오직 DMSO만이 로봇에 의해 이송됩니다. 빈 행과 열은 일부 플레이트마다 다릅니다.

도 2: 단편 스크리닝 절차의 개요. (A)멀티채널 파이펫 및 시약 저장소를 사용하여 단백질을 분배한다. (B)96웰 플레이트에 단백질을 분배한다. (C)디스펜서 로봇에 의한 조각 분배. (D)단백질을 모세혈관에 적재합니다. (E)모세관 홀더를 보여주는 서랍. (F)모세관 홀더의 클로즈업 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
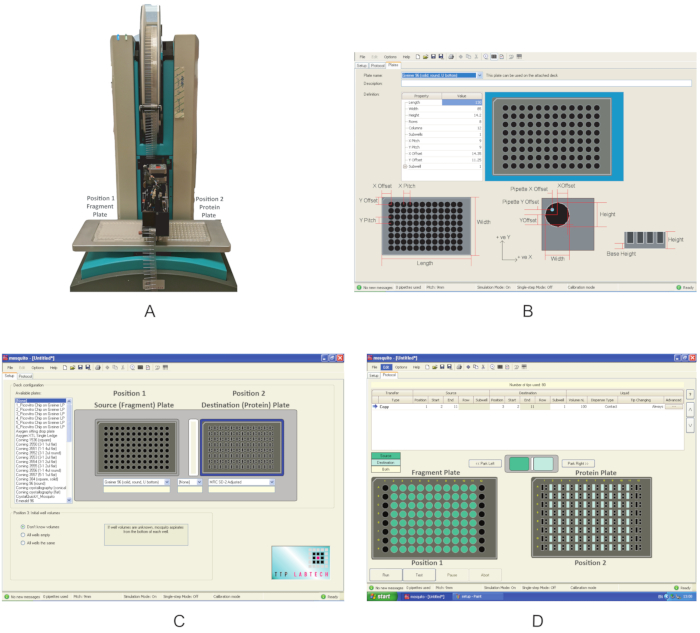
그림 3: 이러한 실험에 사용되는 장비의 개요. (A)나노 디스펜더 로봇은 단편 분배에 사용됩니다. 플레이트 위치가 표시됩니다. (B)새 플레이트를 정의하는 프로그램 인터페이스. (C)디스펜싱 프로그램의 인터페이스. (D)조각을 분배하는 데 사용되는 디스펜싱 프로그램. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 모기 로봇에 의한 나노 분배 단편
- 조각이 공급되는 플레이트의 유형을확인합니다(재료표).
- 모기에 단편 및 단백질 플레이트 정의를 확인합니다.
- 나노 디스펜서(그림 3A)를켭니다. 움직이는 구성 요소 주위에 장애물이 없는지 확인합니다.
- 그래픽 사용자 인터페이스를 열고, 설치 탭을 클릭하고, 데크 구성아래에서 화합물이 공급되는 플레이트의 종류와 제1항에서 단백질이 전달된 플레이트의 종류가 사용 가능한 플레이트목록에 이미 존재하는지 확인한다. 그렇지 않은 경우 옵션을 클릭합니다| 속성 유형(그림3B)에대한 올바른 값을 채우면 플레이트 및 새 플레이트 정의를 만듭니다.
참고: 이 실험에 사용되는 MRC 2웰 플레이트 및 96웰 플레이트에 대한 이러한 값은 각각 보충 표 S2 및 보충 표 S3에도시되어 있다.
- 디스펜싱 프로그램
- 설치 탭에서 데크 구성 아래에 플레이트 위치를 지정합니다.
참고 : 이 실험에 사용되는 모기는 갑판에 두 개의 플레이트 위치가 있습니다. 위치 1은 소스 플레이트로정의되고 위치 2는 대상 플레이트입니다. - 드롭다운 메뉴를 사용하여 위치 1 및 MRC 2-웰플레이트에 대한 Greiner U 하단 플레이트를 선택합니다(그림 2C). 프로토콜을 저장합니다.
- 설치 탭에서 데크 구성 아래에 플레이트 위치를 지정합니다.
- 조각 분배
- 조각판을 데크의 위치 2에 배치 1 및 단백질 플레이트(도3A)에놓습니다.
- 프로토콜 탭(그림 3D)에서 파일을 클릭하고 조각을 분배하기 위해 섹션 2.3에 저장된 프로토콜을 선택합니다. 분배할 조각의 볼륨을 정의합니다. 0.3 μL을 사용합니다. 열 1과 12에 조각이 없는 일반적인 플레이트의 경우 시작 위치를 열 2로 정의하고 끝 위치는 열(11)로 정의합니다. 일부 플레이트에서는 열 2 또는 11이 비어 있는 경우 열을 3과 10을 각각 시작 및 끝 값으로 사용합니다.
참고: 모기 설정으로 인해 열만 건너뛸 수 있으며 행이 아닌 열만 건너뛸 수 있습니다. 행의 경우 모기는 DMSO를 피펫합니다. 조각 라이브러리를 교차 오염시키지 않도록 팁 변경 옵션이 항상선택되었는지 확인합니다. - 프로그램을 시작하려면 실행을 클릭합니다. ~2분 이내의 디스펜싱 후, 로봇에서 단백질과 조각판을 제거하고 접착제 밀봉 필름으로 다시 밀봉한다. 단백질 플레이트(500 × g,30s)를 간단히 원심분리하여 다음 단계로 진행하기 전에 우물의 측면에 달라붙는 방울을 수집합니다.
3. 나노 DSF의 측정
참고: Prometheus NT.48을 사용하여 TSA 수행에 대한 자세한 설명은 이전에20에게시되었습니다. 단편 검사의 맥락에서 중요한 점은 여기에 언급되어 있습니다.
- 측정 전에 플레이트 검사
- 단편의 첨가로 인해 발생할 수 있는 강수량에 대한 단백질 플레이트의 우물을 육안으로 검사합니다. 많은 우물에서 강수량이 관찰되면 조각의 농도를 줄이고 실험을 반복하십시오.
참고 : 단백질 플레이트를 실온에서 유지하는 것이 좋습니다. 파편은 낮은 온도에서 용해되는 경향이있다.
- 단편의 첨가로 인해 발생할 수 있는 강수량에 대한 단백질 플레이트의 우물을 육안으로 검사합니다. 많은 우물에서 강수량이 관찰되면 조각의 농도를 줄이고 실험을 반복하십시오.
- 프로메테우스 준비
- 프로메테우스 기기를 켭다. 터치 스크린에서 오픈 서랍을 눌러 계측기의 모세관 적재 모듈에 액세스합니다. 로딩 모듈에서 마그네틱 스트립을 제거하고 에탄올로 미러를 청소하여 먼지 입자를 제거합니다.
- 단백질 단편 플레이트에서 모세 혈관으로 이송
참고: 이 단계는 단백질 플레이트의 각 우물에서 프로메테우스와 함께 사용하기 위한 모세혈관으로 혼합 단백질/단편 샘플을 전달하는 것을 포함합니다. 이를 위해, 표준 모세관 유형은 전형적으로 사용되지만, 매우 낮은 단백질 농도에 고감도 모세 혈관을 사용할 수 있다.- 단백질 플레이트와 모세혈관을 계측기 옆에 두어 모세관 로딩 모듈에 쉽게 접근할 수 있습니다.
- 한 모세관을 취하고 한쪽 끝에서 잡고 모세관의 맨 끝으로 단백질 플레이트의 용액을 만져 모세관 작용에 의해 샘플을 전달합니다. 장갑을 착용하고 장갑의 불순물(예 :먼지 입자)이 측정에 영향을 미치기 때문에 항상 장갑을 착용하고 중간에 모세관을 만지지 않도록하십시오.
- 모세관을 홀더의 지정된 위치에 배치하여 올바르게 정렬되고 중앙에 배치합니다.
- 3.3.2 및 3.3.3 단계를 반복하여 로딩 모듈의 모든 위치를 채웁니다. 측정에 필요한 모든 모세 혈관을 로드합니다.
참고: 한 번의 실행의 경우 최대 48개의 모세혈관을 로드할 수 있습니다. - 마지막에, 모세 혈관 의 상단에 자기 스트립을 배치하여 제자리에 고정하고, 실험을 시작하기 위해 닫기 서랍을 누릅니다.
- 나노 DSF 실험 수행
- 형광 스캔
- 프로메테우스 응용 프로그램 PR을 엽니다. thermControl,그리고 이름을 사용하여 새 세션 시작을 클릭하여 새 프로젝트를 만들 ProteinName_ScreenName_PlateNumber. 먼저 디스커버리 스캔을 수행하여 샘플의 형광을 감지합니다.
참고: 형광 수준은 이상적으로 각 샘플에 대해 3,000 개 이상의 카운트여야합니다. 계측기(20,000개)의 포화 한계보다 형광이 있는 시료는 측정되지 않습니다. - 레이저의 흥분력을 조정하여 시료의 형광 신호를변경(도 4).
- 프로메테우스 응용 프로그램 PR을 엽니다. thermControl,그리고 이름을 사용하여 새 세션 시작을 클릭하여 새 프로젝트를 만들 ProteinName_ScreenName_PlateNumber. 먼저 디스커버리 스캔을 수행하여 샘플의 형광을 감지합니다.
- 열 성하
- 용융 스캔 탭을 클릭합니다. 실험을 수행하기 위해 시작 온도를 20°C로 설정하고, 최종 온도를 95°C로 설정하고 온도 경사를 1°C분-1로설정합니다. 시작 측정을클릭합니다.
- 실험 에 대한 노칭
- 실험이 시작된 후 에노트 및 결과 탭을 클릭합니다. 각 모세관에 독특한 플레이트와 잘 번호를 부여하여 노를 테고.
참고: 예를 들어, 모세관 1B2는 플레이트 1 및 웰 B2에 해당합니다. 이 탭에서, 추가 컬럼은 예를 들어 단백질 이름, 완충, 단백질 농도와 같은실험을 위해 첨가될 수 있다. 실험이 완료되면 이 탭에도 결과가 표시됩니다. 이것은 하루의 끝에 일시 중지 하는 좋은 시간; 실험은 하룻밤 사이에 이루어지며, 결과는 다음날 수집될 수 있다.
- 실험이 시작된 후 에노트 및 결과 탭을 클릭합니다. 각 모세관에 독특한 플레이트와 잘 번호를 부여하여 노를 테고.
- 데이터 시각화 및 내보내기
- 실험이 완료되면 용융 스캔 탭을 클릭하여 샘플의 용융 및 산란 곡선을 확인합니다. 스프레드시트에서 결과를 내보내려면 용융 스캔 탭을 클릭하고 내보내기를클릭하고 드롭다운 메뉴에서 처리된 데이터 내보내기를 선택합니다.
- 형광 스캔
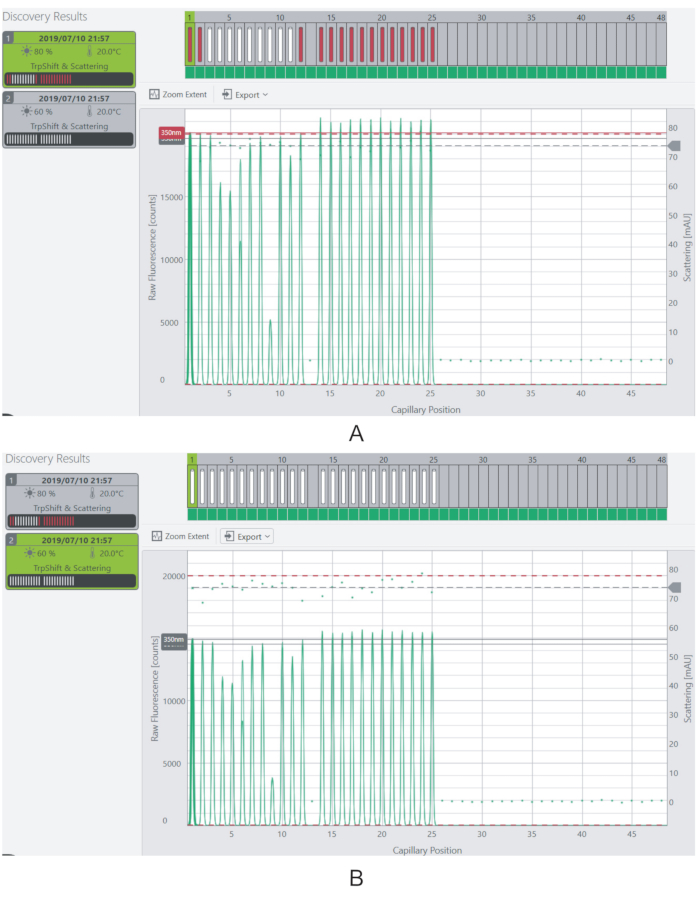
그림 4: 내분력 및 형광 신호를 조정합니다. (A)80%의 흥분력에서 대부분의 시료에 대한 형광 신호는 포화 한계를 초과한다. (B)형광 신호는 흥분력을 60%로 감소시킴으로써 측정 가능한 수준으로 감소된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 반복
- 768 화합물의 전체 Enamine 라이브러리에서 16 실행을 수행하기 위해 1-3 단계를 반복 (16 × 48 = 768).
- 각 플레이트의 측정이 완료하려면 ~1.5h가 걸리므로, 음부(3.4.3)를 완료하고, 섹션 1과 2에서 단계를 반복하여 다음 단백질 단편 판을 준비한다.
참고: 일반적인 근무일에는 경험에 따라 4-6 플레이트를 측정할 수 있습니다. 전체 DSi 라이브러리의 심사는 총 3-4일 이내에 완료될 수 있습니다.
5. 데이터 분석
- 생성된 데이터 검사
- 각 실행이 완료되면 주석 및 결과 탭을 클릭하여 결과를 표시합니다. 각 샘플에 대해, 이 개요에서 가장 중요한 두 개의 계산된 값에 초점을 맞추십시오: 1) 산란 개시온도(산란을 위한 개시 #1),이는 증가된 샘플 산란 이벤트의 시작 시 온도를 나타내고 집계의 특징입니다. 2) T m(변곡점 #1 비율)형광 이벤트 사이의 비율에서 추출된 값은 일반적으로 환경의 변화에 따라 트립토판 형광의 최대 변화에 대응하는 330 nm 값에서 추출된다.
- 이러한 값이 신뢰할 수 있는지 확인하려면 용융 스캔 탭의 각 모세관에 대한 산란 및 용융 곡선을 확인하십시오.
- 스프레드시트내보내기 및 검사
- 검사를 위해 모든 다른 실행에서 스프레드시트 소프트웨어로 데이터를 내보내고 3.4.4에 설명된 대로 개요 테이블과 플롯을 만듭니다. 스프레드시트 파일의 다양한 시트를 클릭하여 각 시트의 정보를 기록합니다.
- 개요 시트에서 각 행은 하나의 실험에 해당합니다. 매개변수(예:시작 및 종료 온도)에 대한 개요를 따라 Tm 및 산란 개시에 대한 계산된 값을 관찰합니다(예: 이름과 설명의 경우 위의 5.1 참조, 보충 파일 1 및 2). 소프트웨어가 일부 샘플에 대해 두 개 이상의Tm 값(변곡점 #1 및 비율에 대한 #2)을 계산할 때 용융 전환 곡선을 참조하여 Tm 값이 올바른지 확인합니다.
- 비율 시트에서 각 열은 샘플에 해당하며 각 행은 각 온도 단계에서 읽은 데이터에 해당합니다. 각 온도 단계에 해당하는 형광 수 값을 관찰하고 이를 사용하여 특정 샘플에 대한 용융 곡선을 플롯하여 형광 수 컬럼에 대한 온도 컬럼을 플로팅합니다. 비율(첫 번째 유도체), 330nm, 330nm(첫 번째 유도체), 350nm, 350nm(첫 번째 유도체)의 데이터는 유사한 형식으로 비율및 첫 번째 유도체(최대 변화율로 최대)를 계산하는 데 사용된다.
- 산란 시트에 산란에 대해 유사한 데이터를 관찰합니다. 온도 열을 산란 열에 대해 플로팅하여 각 샘플에 대한 산란 곡선을 생성합니다. 산란 첫 번째 유도체에 대한 시트를 찾습니다.
- 검사를 위해 모든 다른 실행에서 스프레드시트 소프트웨어로 데이터를 내보내고 3.4.4에 설명된 대로 개요 테이블과 플롯을 만듭니다. 스프레드시트 파일의 다양한 시트를 클릭하여 각 시트의 정보를 기록합니다.
- 모든 조각에 대한 전역 개요 작성 및 유효성 검사
- 조각에 대한 올바른 Tm 값을 확인한 후 단일 새 결과 파일의 모든 실행에서 330/350 nm 비율(Tm)의열 샘플 ID 및 변곡점을 결합하여 각 실행에서 이러한 열을 복사합니다.
- 네이티브 단백질의 평균 Tm 값(일반적으로 10회 이상 계산)을 사용하고 각 샘플의 Tm 값에서 빼내 ΔTm을가져옵니다. 내림차순으로 ΔTm을 통해 결과를 정렬하여 가장 큰 시프트를 초래하는 샘플을 식별합니다.
- ΔTm 시프트에 따라 조각을 빈으로 나누고 각 저장소에 대한 ΔTm을 조각 수에 대해 플롯하여 전체 라이브러리에 대한 주파수 테이블을 생성합니다(그림5). 편의를 위해 로그 축의 조각 수를 나타내는 축을 표시합니다. ΔTm ±1로 샘플을 비닝하고 다른 저장소를 각 런에 적용하여 이상치 수를 경험적으로 조정합니다.
결과
DSi-자세 라이브러리(768개 단편)의 전체 화면은 의학적 관심의 3가지 단백질로 수행되었으며, 즉, 외장 키네토초레는 암 1 단백질(Hec1 또는 Ndc80)에서 높게 발현되고, 단극성 스핀들 키나아제 1(Mps1)의 조절테트라리코펩티드 반복(TPR) 도메인, 및 SARS-CoV-2 3C 와 같은 프로테아제, Nsp5는 11개의 폴리단백질 부위에서 C-terminin을 차단한다. 단백질의 단백질 농도 및Tm뿐만 아니라 각 단백질에 대해 선택된 완충 조건은 보충 표 S4에도시된다.
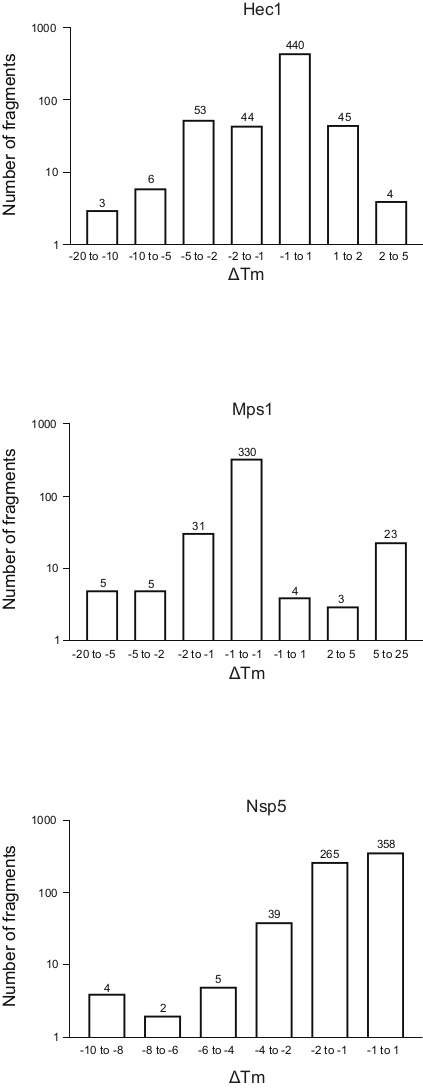
그림 5: 3개의 단백질, Hec1, Mps1 및 Nsp5에 대한 용융 온도(ΔTm)의변화의 주파수 분포가 대표적인 결과로 이 연구에서 제시된다. 약어: Hec1 = 암 1 단백질에서 높게 발현; Mps1 = 모노폴라 스핀들 키나아제 1; Nsp5 = SARS-CoV-2 3C 와 같은 프로테아이즈. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
전술한 프로토콜을 이용한 3개의 스크리닝의 결과는,Tm의 변화분포와 단편의 수에 대한 주파수 분포로 표시되고, 도 5에도시된다. 이러한 플롯은 프로토콜의 섹션 5.3에 설명된 대로 생성되어Tm에서관찰된 변경 빈도를 플로팅합니다. 아래 토론 섹션에서 설명한 바와 같이 교대의 중요성을 모든 다른 프로젝트에 대한 주관적인 방식으로 정의해야 합니다. 음수 값은 단편이 있는 동안 용융 온도가 감소함을 나타내며, 양수값은Tm의증가입니다. 이러한 플롯에서, 그것은 Nsp5에 대 한, 모든 조각 불안정 효과 관찰 하기 쉬운, 반면 Hec1 및 Mps1에 대 한, 안정화 하 고 불안정 히트 관찰. 이를 예상할 수 있으며 논의될 것입니다.
토론
이 프로토콜은 몇 가지 일반적인 로봇 공학 및 측정 계측기를 사용하여 단편 라이브러리를 선별하기 위한 중간-고처리량 방법을 설명합니다. 이 프로토콜에 설명 된 것과 같은 화면은 암스테르담의 NKI 단백질 시설에 의해 정기적으로 수행 될 수 있습니다, 예를 들어 iNEXT-Discovery 서비스로, 종종 제안 응용 프로그램 및 동료 검토 후 사용자를위한 무료. 이러한 경우 DSi-자세 라이브러리는 시설에서 제공할 수 있지만 다른 라이브러리의 사용은 각 사용자 응용 프로그램 및 서비스 계약의 컨텍스트에서 논의할 수도 있습니다. 이 프로토콜에서 계측기의 선택은 많은 실험실에 대한 실용적인 솔루션을 나타내지만 금 본위제로 간주되어서는 안됩니다. 역전사 폴리머라제 연쇄 반응 열사이클러에서 전개되는 것을 검출하기 위해 환경적으로 민감한 라벨을 사용하는 방법보다는 단편 스크리닝을 위한 표적 단백질의 열 안정성을 측정하는 데 라벨이 없는 방법이 권장됩니다.
Prometheus 악기를 사용하여 여기에 제시 된 것과 같은 라벨이없는 방법은 몇 가지 장점이 있습니다 : 그들은 낮은 양의 단백질을 사용하며 종종 몇 가지 크기의 주문을 적게 사용합니다. 샘플의 산란을 동시에 측정하여 집계하는 데 사용할 수 있습니다. 다른 접근 방식에서 전개되는 것을 감지하는 데 사용되는 라벨은 각 조각과 다르게 상호 작용하여 측정 아티팩트를 생성할 수 있습니다. 이 프로토콜은 모기 로봇의 맥락에서 설명되어 있어 수동으로 수행 할 수없는 매우 작은 양의 샘플 (0.3 μL)을 피펫팅 할 수 있습니다. 모기는 구조 생물학 및 약물 발견 프로젝트에 종사하는 많은 실험실에서 존재하는 인기있는 로봇입니다. 그러나 이 프로토콜은 저용량 파이펫팅에 대한 대체 접근 방식을 명확하게 사용할 수 있습니다.
조각 라이브러리에는 DMSO에 용해된 화합물이 포함되어 있습니다. 초기 과제 중 하나는 단백질이 안정적으로 유지되는 최적의 DMSO 농도를 찾고 화합물이 용해상태로 유지되는 것입니다. 이것은 검열을 위한 최적 조건을 결정하기 위하여 각종 DMSO 사격량에서 측정을 능력을 발휘하는 관련시킵니다. 여기서 사용되는 분화 희석을 단편화하는 단백질은 0.2%의 DMSO 농도를 초래한다; 대부분의 단백질은 이러한 조건에서 상당히 안정적입니다. 768-화합물 라이브러리에 대한 스크리닝을 수행하는 데 필요한 단백질의 양은 총 ~2-3 mg이며, 측정은 전형적으로 낮은 단백질 농도(0.2 mgmL-1)에서수행된다. 이러한 비교적 낮은 단백질 농도로 작업하면 단백질 생산 비용을 줄일 뿐만 아니라 단백질 강수량의 가능성을 줄입니다. 저단백질 농도는 실험에서 단편의 농도가 ~2mM이기 때문에 단편 결합의 검출에 영향을 미치지 않으며, 또한 약한 바인더를 식별할 수 있게 한다.
이러한 실험에서의 용융 전이 검출은 형광 강도를 기반으로 하므로, 중요한 측면은 측정을 수행하는 레이저의 흥분 력을 결정하는 것이다. 단백질과의 화합물의 상호 작용은 (i) 본질적인 형광에 영향을 미치지 않으며, (ii) 담금질의 결과, 또는 (iii) 본질적인 형광을 증가시다. 이 외에도 낮은 단백질 농도로 작업한다는 것은 토착 단백질의 형광 수가 낮다는 것을 의미합니다. 따라서 흥분력은 대부분의 샘플을 측정할 수 있는 방식으로 조정되어야 합니다. 모든 실행의 산란 프로파일은 조각의 추가로 트리거될 수 있는 집계 효과에 대한 중요한 정보를 제공합니다. 또한, 화합물 용해도에 대한 온도의 영향은 또한 산란 프로파일에서 볼 수 있다.
예기치 않게, 많은 화합물에 대 한 산란 실제로 증가 온도와 함께 감소 관찰 되었다(도 6). 따라서 용융 전이 곡선과 동반산란 프로파일을 모두 살펴보면 각 실험의 신뢰성에 대해 결정하는 것이 중요하며, 특히 X선 결정학 또는 NMR 분광법에 의한 더 까다로운 측정 후보로 간주되는 단편또는 후속 화학에 대한 안타로 간주되는 조각에 대해 서도 결정됩니다. 단편 스크리닝 을 위한 방법의 한 가지 특정 제한은 DSi-자세 라이브러리의 많은 단편이 검출기의 포화 한계를 넘어서도 상당한 본질형 형광을 가지고 있으므로 낮은 흥분 전력에서도 대상 바인딩을 위해 제대로 선별할 수 없다는 것입니다. 이 방법에 대 한 또 다른 참고 는 트립토판 잔류물을 포함 하는 단백질과 함께 사용할 수 있습니다.
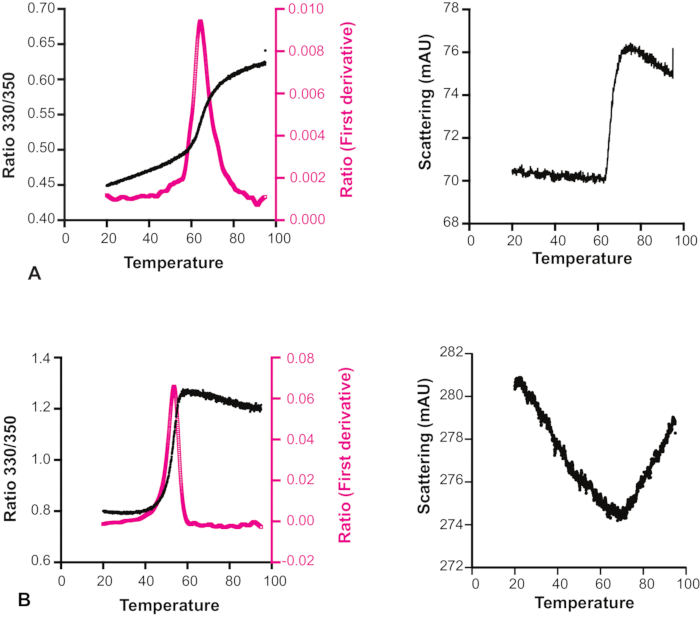
그림 6: 화합물 용해도에 대한 온도의 효과. 두 개의 서로 다른 화합물을 가진 Hec1의 용융 전이 곡선 및 산란 프로파일. (A)산란 프로파일은 이 샘플의 경우 용해도가 온도에 의해 영향을 받지 않는다는 것을 보여줍니다. (B)산란 프로파일은 이 샘플의 용해도가 온도상승에 따라 증가한다는 것을 보여준다. 따라서 이 경우 용융 전환 곡선은 신뢰할 수 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
열린 질문은Tm의중요한 변화로 간주되어야한다, 수학 관점에서, 하지만 실용적인 관점에서: Tm의 변화는 단백질에 리간드의 바인딩의 표시로 고려하는 것이 중요하다? 이러한 예에서, 1°C 미만의 변화는 Hec1을 결합하기 위한 단편의 74%, Mps1의 경우 66%, Nsp5의 경우 53%로 보입니다. 개요그래프(그림 5)에서1, 2, 5 또는 5도 이상의Tm 시프트의 빈이 양수 또는 음수로 고려되었다. 이를 위해서는 각 특정 사례에 따라 수정하여 좋은 개요를 제공하고 정보에 입각한 의사 결정을 허용하여 다음 단계를 결정해야 합니다. 특히, 일부 단백질의 경우, 표적의 안정화 및 안정화 모두 고려된 단편에 따라 관찰되었다. 두 사건 모두 단편 결합의 결과일 수 있으며 둘 다 단백질 거동을 조작하는 좋은 후속 분자로 이어질 수 있기 때문에 흥미롭습니다.
마지막 질문은 "유용한 히트를 정의하는 것"으로 남아 있습니다. 사실, 대답은 특정 상황에 따라 달라집니다. 예를 들어 Hec1의 경우 단백질을 2도 이상 안정화하거나 5도 이상 불안정하게 하는 모든 단편이 이러한 안타에 따라 새로운 분자를 설계한 화학 협력자에게 전달되었습니다. 그러나 Nsp5의 경우, 가장 안정화되지 는 NMR 협력사에게 전달되어 NMR 실험을 통해 나노DSF 에서 파생된 안타를 확인했습니다. 즉, 이 프로토콜에서 얻은 선별 결과는 특정 질문 및 주변 방법론에 따라 정보에 입각한 결정을 내리는 상황에 따라 주의깊게 분석되어야 합니다. 어쨌든 여기에 설명된 방법은 X선 및 NMR 기반 스크리닝과 같은 기존 방법론에 대한 보완적인 접근 법으로, 화학 캠페인을 확인, 우선 순위 지정 또는 새로운 아이디어를 제공하는 것을 목표로 할 수 있습니다.
보충 표 S1: 단백질 의 선별에 사용되는 버퍼 목록. 약어: HEPES = 4-(2-하이드록세틸)-1-파이프라진에탄황포닉산; DTT = 디티오스리톨; MOBS = 4-(N-모르폴리노)부탄술포닉 산. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 표 S2: 나노 디스펜더 로봇과 함께 사용하기 위한 MRC 2 웰 플레이트의 특성.
보조 표 S3: 나노 디스펜더 로봇과 함께 사용할 96웰 V-하단 플레이트에 대한 특성. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 표 S4: 대표적인 결과에서 논의된 단백질의 완충, 단백질 농도 및 Tm. 약어: DTT = 디티오스레이톨; Hec1 = 암 1 단백질에서 고도로 발현; Mps1 = 모노폴라 스핀들 키나아제 1; Nsp5 = SARS-CoV-2 3C 와 같은 프로테아이즈. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
추가 파일 1: 개요 매개 변수-예제 데이터. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 406 개의 조각 예제 데이터에 대한 Tm 및 ΔTm 값입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
공개
공개는 없습니다.
감사의 말
"이 작품은 NKI 단백질 시설, 지시-에릭 센터에 대한 액세스의 혜택을 누렸습니다. 재정 지원은 iNEXT, 프로젝트 번호 653706, iNEXT-Discovery, 프로젝트 번호 871037, 유럽 위원회의 Horizon 2020 프로그램에 의해 투자에 의해 제공되었습니다"
자료
| Name | Company | Catalog Number | Comments |
| ClearVue Sheets | Molecular Dimensions | adhesive sealing film for protein plate | |
| CORNING 6570 Aluminium Sealing Tape | CORNING | adhesive sealing film for fragment plate | |
| DSi poised library | Enamine | Fragment library containing 768 compounds used in this study | |
| Elisa Reagent Reservior | ThermoFisher Scientific | 15075 | Reagent reservior used for pipetting the protein |
| Greiner round (U) bottom plates | Cat. No. 650201 | Fragments supplied in these plates | |
| Mosquito type X1 | sptlabtech | Part nr- 3019-0003 | Nanolitre dispenser |
| MRC 2-well crystallization plate | MRC96T-PS | ||
| Pierce ELISA Reagent Reservoirs | Pierce | ||
| Prometheus High Sensitivity capillaries | Catalog PR-C006 | ||
| Prometheus NT.48 nanoDSF | Nanotemper | Catalog nr PR001 (+ Aggregation Detection Optics, catalog nr PR-AGO) | nanoDSF and light back scattering |
| Prometheus Standard capillary type | Catalog PR-C002 | ||
| TX-1000 | Thermoscientific | Centrifuge for plates |
참고문헌
- Hoffer, L., Muller, C., Roche, P., Morelli, X. Chemistry-driven hit-to-lead optimization guided by structure-based approaches. Molecular Informatics. 37 (9-10), 1800059(2018).
- Lamoree, B., Hubbard, R. E. Current perspectives in fragment-based lead discovery (FBLD). Essays in Biochemistry. 61 (5), 453-464 (2017).
- Ress, D. C., Congreve, M., Murray, C. W., Carr, R. Fragment-based lead discovery. Nature Reviews Drug Discovery. 3 (8), 660-672 (2004).
- Carr, R. A. E., Congreve, M., Murray, C. W., Rees, D. C. Fragment-based lead discovery: Leads by design. Drug Discovery Today. 10 (14), 987-992 (2005).
- Bradley, A. R., et al. The SGC beyond structural genomics: Redefining the role of 3D structures by coupling genomic stratification with fragment-based discovery. Essays in Biochemistry. 61 (5), 495-503 (2017).
- Davies, T. G., Tickle, I. J. Fragment screening using X-ray crystallography. Topics in Current Chemistry. 317, 33-59 (2012).
- Ma, R., Wang, P., Wu, J., Ruan, K. Process of fragment-based lead discovery - A perspective from NMR. Molecules. 21 (7), 854(2016).
- Troelsen, N. S., Clausen, M. H. Library design strategies to accelerate fragment-based drug discovery. Chemistry. 26 (50), 11391-11403 (2020).
- Shi, Y., von Itzstein, M. How size matters: Diversity for fragment library design. Molecules. 24 (15), 2838(2019).
- Taylor, A., Doak, B. C., Scanlon, M. J. Design of a fragment-screening library. Methods in Enzymology. 610, 97-115 (2018).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. 74 (10-11), 555-563 (2020).
- Pfaff, S. J., Chimenti, M. S., Kelly, M. J. S., Arkin, M. R. Biophysical methods for identifying fragment-based inhibitors of protein-protein interactions. Methods in Molecular Biology. 1278, 587-613 (2015).
- Fattori, D., Squarcia, A., Bartoli, S. Fragment-based approach to drug lead discovery: Overview and advances in various techniques. Drugs in R & D. 9 (4), 217-227 (2008).
- Winter, A., et al. Biophysical and computational fragment-based approaches to targeting protein-protein interactions: Applications in structure-guided drug discovery. Quarterly Reviews of Biophysics. 45 (4), 383-426 (2012).
- Boelens, R., et al. iNEXT: a European facility network to stimulate translational structural biology. FEBS Letters. 592 (12), 1909-1917 (2018).
- Zhang, R., Monsma, F. Fluorescence-based thermal shift assays. Current Opinion in Drug Discovery and Development. 13 (4), 389-402 (2010).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Martinez Molina, D., Nordlund, P. The cellular thermal shift assay: a novel biophysical assay for in situ drug target engagement and mechanistic biomarker studies. Annual Review of Pharmacology and Toxicology. 56, 141-161 (2016).
- Bruce, D., Cardew, E., Freitag-Pohl, S., Pohl, E. How to stabilize protein: stability screens for thermal shift assays and nano differential scanning fluorimetry in the Virus-X Project. Journal of Visualized Experiments JoVE. (144), e58666(2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유