Method Article
Isolamento dei neutrofili umani da Whole Blood e Buffy Coats
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per l'isolamento dei neutrofili dal sangue intero, dai cappotti buffy o dalle membrane di leucaferesi, ottenendo una buona resa, un'elevata purezza e un'attivazione cellulare minima. Utilizziamo la purificazione a gradiente, la sedimentazione dei globuli rossi (RBC) e la lisi dei globuli rossi per ottenere una preparazione neutrofila di alta qualità / purezza.
Abstract
I neutrofili (PMN) sono i leucociti più abbondanti nella circolazione umana, che vanno dal 40 al 70% dei leucociti del sangue totale. Sono le prime cellule reclutate nel sito di infiammazione attraverso un rapido stravaso attraverso i vasi. Lì, i neutrofili svolgono una serie di funzioni per uccidere gli agenti patogeni invasori e mediare la segnalazione immunitaria. I neutrofili appena purificati dal sangue umano sono il modello di scelta per lo studio, poiché nessuna linea cellulare replica completamente le funzioni PMN e la biologia. Tuttavia, i neutrofili sono cellule differenziate terminalmente di breve durata e sono altamente suscettibili all'attivazione in risposta a stimoli fisici (temperatura, velocità di centrifugazione) e biologici (endotossina, chemio e citochine). Pertanto, è fondamentale seguire un metodo standardizzato, affidabile e veloce per ottenere cellule pure e non attivate. Questo protocollo presenta un protocollo aggiornato che combina la centrifugazione a gradiente di densità, la sedimentazione dei globuli rossi (RBC) e la lisi dei globuli rossi per ottenere un'elevata purezza PMN e ridurre al minimo l'attivazione cellulare. Inoltre, vengono discussi anche i metodi per valutare la qualità, la vitalità e la purezza dell'isolamento dei neutrofili.
Introduzione
Il sistema immunitario innato è composto da molti tipi di cellule che mantengono l'omeostasi immunitaria e la clearance dei patogeni insieme a molte altre funzioni fisiologiche. I neutrofili comprendono il più grande pool di globuli bianchi nella circolazione umana1. La maggior parte dei neutrofili maturi sono immagazzinati nel midollo osseo, che è il sito di generazione di nuovi neutrofili, chiamato anche granulopoiesi. Nel midollo osseo, i progenitori dei granulociti escono dal ciclo cellulare e si differenziano terminalmente, acquisendo i loro caratteristici nuclei e granuli segmentati2. In condizioni infiammatorie, in risposta a chemochine, citochine e modelli molecolari associati a danni e agenti patogeni, i neutrofili vengono mobilitati dal flusso sanguigno e fuori dal midollo osseo per svolgere una vasta gamma di funzioni. Questi includono la secrezione di citochine, la fagocitosi diretta dell'agente patogeno, il rilascio di specie reattive dell'ossigeno, la degranulazione di proteine antimicrobiche e la formazione di trappole extracellulari dei neutrofili.
Le molecole utilizzate dai neutrofili per combattere le infezioni sono tossiche per i microbi e l'ospite. Pertanto, la durata della vita e la corretta rimozione dei neutrofili che invecchiano / muoiono sono altamente regolati e hanno una durata limitata della vita in circolazione (<48 h)3. A causa di questa breve sopravvivenza, il corpo umano produce in media 100 miliardi di nuovi neutrofili ogni giorno per mantenere l'omeostasi della popolazione4. La granulopoiesi di emergenza può aumentare ulteriormente il rilascio di neutrofili, sia maturi che immaturi, nel sangue durante l'infiammazione e l'infezione5. L'importanza dei neutrofili nella risposta immunitaria innata è evidenziata dai pazienti con neutropenia acquisita o congenita, che sono suscettibili alle infezioni batteriche e fungine6.
Molte sfide sorgono quando si studia la biologia dei neutrofili e il loro ruolo nella risposta immunitaria a causa della loro natura, compresa la loro breve sopravvivenza e il contenuto citotossico. Le linee cellulari neutrofile sono state comunemente differenziate dalle cellule HL-60 della leucemia promielocitica umana e dalle cellule PLB-9857,8. Sebbene possano mostrare una morfologia simile a quella dei neutrofili ed eseguire la chemiotassi, queste linee cellulari non possono ricapitolare completamente la biologia dei neutrofili. Anche i saggi in vitro che utilizzano queste linee cellulari non sono in grado di ricapitolare esperimenti in vivo. Inoltre, la differenziazione di queste cellule deve essere indotta e potrebbe essere influenzata negativamente dalla manipolazione genica prima della differenziazione.
Recentemente, sono stati sviluppati metodi per aggirare questi problemi utilizzando promotori inducibili per modulare l'espressione genica post differenziazione nelle cellule HL-609. Anche con tali strumenti, i PMN umani primari sono necessari per convalidare i bersagli utilizzando approcci farmacologici. Pertanto, è imperativo ottenere neutrofili puri e inattivati isolati dal sangue per convalidare i risultati della linea cellulare e dei modelli animali. Questo documento presenta un protocollo di isolamento PMN rivisto in cui sono stati valutati i pro ei contro dei metodi attuali10. È stata ideata una combinazione composta da centrifugazione a gradiente per separare i PMN da altre cellule immunitarie, breve sedimentazione a base di destrano per rimuovere la maggior parte dei globuli rossi, rapida lisi residua dei globuli rossi tramite pressione osmotica e centrifugazione a bassa velocità per rimuovere la contaminazione piastrinica.
Protocollo
NOTA: I neutrofili umani sono stati isolati dal sangue venoso dai filtri dei globuli bianchi scartati ottenuti dal Blood Bank Lab del Boston Children's Hospital. I donatori di sangue non erano identificabili e non vi era alcuna interazione con individui viventi o conoscenza di informazioni personali identificabili. Pertanto, questo lavoro non è classificato come ricerca di soggetti umani ai sensi dei regolamenti HHS sui soggetti umani (45 CFR Part 46). Il Boston Children's Hospital Institutional Review Board (IRB) ha approvato il protocollo.
1. Stratificazione del gradiente
- Dopo aver sterilizzato il buffy coat o l'imballaggio di sangue intero e il cappuccio laminare, dividere il sangue in tubi da 50 ml con 10 ml di sangue in ciascun tubo.
- Portare il volume fino a 35 ml con siero bovino fetale al 5% (FBS)/Hank's Balanced Salt Solution (HBSS) per diluire il sangue per un gradiente più pulito.
NOTA: quando si utilizza una membrana di leucoaferesi, le cellule possono essere espulse utilizzando una siringa da 60 mL e 30 mL di FBS/HBSS al 5% per filtro. La diluizione non è necessaria quando si lavora con sangue intero appena prelevato. - Chiudere il coperchio del tubo da 50 ml, mescolarlo più volte per inversione e tenerlo capovolto per avere il fondo privo di globuli rossi.
- Aggiungere 10 ml di gradiente di densità medio (vedere la tabella dei materiali)direttamente sotto il sangue. Assicurarsi che il mezzo e il sangue non si mescolino e che l'interfaccia sia nitida (Figura 1A).
NOTA: questo passaggio è fondamentale. Assicurarsi che la soluzione del gradiente di densità sia a temperatura ambiente (RT) e ben miscelata prima di ogni gradiente. Il primo millilitro del mezzo gradiente di densità deve essere accuratamente e costantemente stratificato il più lentamente possibile. Si consiglia di impostare la velocità della pipetta elettronica su bassa. - Posizionare delicatamente il tubo in una centrifuga senza disturbare la pendenza e girare a 400 × g per 30 minuti a RT, assicurandosi di disabilitare il freno. Osservare come il gradiente filato si separa in uno strato di siero / plasma superiore, un anello bianco medio di cellule mononucleate del sangue periferico (PBMC), uno strato medio gradiente di densità nuvolosa e un pellet inferiore costituito da una banda neutrofila bianca e sottile sopra i globuli rossi (Figura 1B).
NOTA: Un lato torbido o opaco del tubo dopo la centrifugazione può suggerire che le cellule (neutrofili) sono attivate e potrebbero non essere adatte all'uso. - Rimuovere prima i PBMC facendo emergere la pipetta di aspirazione direttamente nello strato PBMC. Assicurati di aspirarlo completamente mentre lo strato di siero / plasma diminuisce man mano che l'anello viene rimosso. Raschiare il lato del tubo in cui le celle sono pellettate con la pipetta di aspirazione per massimizzare la rimozione del PMBC. Rimuovere con attenzione lo strato medio del gradiente di densità nuvoloso tra l'anello PBMC e il pellet neutrofilo/RBC.
NOTA: Raschiando le celle pellettate sul lato del tubo aumenta notevolmente la purezza dell'isolamento. Fare attenzione a non aspirare il pellet, poiché la maggior parte dei neutrofili si trova direttamente sopra i globuli rossi.
2. Sedimentazione degli eritrociti (RBC)
- Utilizzando una pipetta da 10 ml, trasferire il pellet neutrofilo/RBC in un tubo pulito. Non pipettare su e giù. Aggiungere il 5% fbs/HBSS a un volume finale di 25 ml. Mescolare delicatamente per inversione.
NOTA: l'esecuzione della sedimentazione RBC dopo la rimozione PBMC migliora la resa e diminuisce l'attivazione10. - Aggiungere direttamente 25 mL di dextran preriscaldato (37 °C) 3% /0,9% NaCl/H2O nel tubo contenente il pellet neutrofilo/RBC diluito e mescolare delicatamente per inversione. Posizionare il tubo su una superficie piana e non vibrante per 15 minuti (Figura 1C).
NOTA: una sedimentazione più lunga riduce la contaminazione da globuli rBC ma diminuisce anche la resa. Inoltre, l'esposizione prolungata al destrano può portare all'attivazione dei neutrofili o alla morte cellulare11. - Riportare delicatamente il tubo nella cappa (per un isolamento sterile). Immergendo solo leggermente la pipetta nel liquido, raccogliere lo strato superiore (~ 30 ml) seguendo la superficie del liquido verso il basso.
NOTA: Se la sedimentazione produce un'interfaccia nitida tra il mezzo e i globuli rossi, il pellet RBC è più piccolo o, se si desidera una resa maggiore, raccogliere fino a 35 ml. - Ruotare il tubo (400 × g,10 min, RT, utilizzando il freno basso (3)), ottenendo un pellet rosso senza particelle che galleggiano nel mezzo.
3. Lisi dei globuli rossi residui
- Aspirare delicatamente il surnatante senza interrompere il pellet.
- Aggiungere 25 ml di acqua ultrapura sterile direttamente nel tubo e mescolare delicatamente invertendo per 28 s per lisi i globuli rossi. Non utilizzare un pipetto per ricaspendare il pellet.
NOTA: Non superare i 30 s in quanto condizioni ipotoniche prolungate possono attivarsi e portare alla morte dei neutrofili12. - Aggiungere immediatamente 25 mL di NaCl/H 2 O sterileall'1,8%nel tubo e mescolare delicatamente invertendo per riportare la soluzione alle condizioni isotoniche.
NOTA: la soluzione deve essere rossa ma senza torbidità. - Spin down a 200 × g per 3-5 min con freno basso (livello 3) per ridurre al minimo i globuli rossi e la sedimentazione piastrinica insieme ai neutrofili (Figura 1D e Figura 2)13,14.
NOTA: Il pellet deve essere bianco con uno strato minimo di RBC sulla parte superiore, che può essere rimosso delicatamente mentre il surnatante viene aspirato. - Sospendare i neutrofili pipettando il terreno di coltura (10% FBS/RPMI1640) direttamente sul pellet, ma non pipettare su e giù. Oscillare il tubo orizzontalmente da un lato all'altro per ridurre al minimo l'attivazione della cella.
NOTA: Le cellule devono essere mantenute ad una concentrazione di ~ 2 × 106 cellule / mL, poiché una maggiore densità porterà ad un aumento dell'attivazione / morte cellulare15. Per lo stesso motivo, il pellet cellulare dovrebbe essere riconsosciato il prima possibile. - Se si osserva aggregazione o aggregazione cellulare, filtrare la sospensione cellulare utilizzando una rete da 70 μm per scartare i neutrofili raggruppati.
4. Determinazione della qualità dell'isolamento dei neutrofili
- Colora le cellule con marcatori specifici per neutrofili (CD66b, CD11b), eosinofili (CD193) (Figura 3) e un marcatore di attivazione come CD62L (Figura 4). Acquisire 20.000 cellule mediante citometria a flusso. Analizzare la purezza e l'attivazione delle cellule utilizzando le strategie di gating proposte in Figura 3 e Figura 4.
NOTA: La qualità del preparato neutrofilo può essere valutata utilizzando una soluzione blu di acido acetico-metilene al 3% per visualizzare l'unico nucleo lobato dei neutrofili. - Determinare la vitalità cellulare utilizzando l'allegatina V/ioduro di propidio (PI) (Figura 5).
NOTA: la colorazione blu Trypan può essere utilizzata per valutare la vitalità cellulare.
Risultati
Quando si utilizza il gradiente di densità per purificare i neutrofili, è fondamentale che l'interfaccia tra il sangue e il mezzo del gradiente di densità sia il più nitida possibile e che rimanga una separazione netta dello strato dopo la centrifugazione (fase 1.4). Dopo la lisi dei globuli rossi, il tampone deve essere di colore rosso chiaro e non torbido (punto 3.3). Se la preparazione è torbide, può essere necessario un secondo ciclo di lisi (fase 3), sebbene ciò possa influire sulla sopravvivenza dei neutrofili (Figura 1). Dopo la lisi, la centrifugazione a bassa velocità (200 × g)è raccomandata quando si privilegia la purezza, in quanto riduce notevolmente la contaminazione piastrinica. Tuttavia, la centrifugazione ad alta velocità (400 × g)aumenta la resa a scapito della purezza (fase 3.4, Figura 2). Dopo l'isolamento dei neutrofili, lo smistamento cellulare attivato dalla fluorescenza può essere utilizzato per valutare la purezza dell'isolamento (fase 4.1) e deve essere scelto rispetto alla microscopia. Sebbene la distribuzione FSC/SSC delle cellule da sola fornisca una stima della qualità dell'isolamento cellulare(Figura 3A),l'uso di marcatori cellulari specifici dovrebbe essere preferito. In questo caso, le popolazioni cellulari contaminanti più comuni vengono colorate con anticorpi specifici insieme a CD66b, specificamente espressi sui granulociti. La colorazione CD45 viene utilizzata per distinguere i leucociti (CD45+) e i globuli rossi e le piastrine (CD45-).
Altri contaminanti includono linfociti (CD3+ o CD19+, Figura 3F),monociti (CD14+, Figura 3D)ed eosinofili (CD193+, Figura 3G). CD11b è un'integrina espressa sulla linea mieloide; neutrofili e monociti sono CD11b+, mentre i linfociti sono CD11b- (Figura 3C). Poiché l'attivazione dei neutrofili può influenzare gli esperimenti a valle, deve essere valutata l'espressione di CD62L; i neutrofili diventano CD62L- una volta attivati (passo 4.1). Il peptide fMLP può essere utilizzato come controllo positivo per lo spargimento di CD62L (Figura 4). È anche importante valutare la salute dei neutrofili prima di eseguire i test; i neutrofili hanno un'emivita relativamente breve e l'attivazione può ulteriormente accorciarla (passo 4.2). Una colorazione standard dell'allegato V e della PI può fornire informazioni sullo stato di vita/morte della coltura di neutrofili in momenti designati (Figura 5).

Figura 1: Separazione mediadei granulociti con gradiente di densità. (A) Prima e (B) dopo la centrifugazione. Si noti l'interfaccia nitida tra il sangue e gli strati medi del gradiente di densità. (C) Sedimentazione del pellet in B spese (1:1) in 5% FBS/HBSS e 3% Destrano-0,9% NaCl. (D) pellet PMN dopo lisi dei globuli rossi residui nel surnatante di (C) con H2O. Abbreviazioni: PBMC = cellula mononucleare periferica del sangue; PMN = neutrofilo; RBC = globuli rossi; FBS = siero bovino fetale; HBSS = Hank's Balanced Salt Solution. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: La rotazione a velocità inferiori dopo la lisi dei globuli RBC ha ridotto la contaminazione piastrinica. Dopo la lisi dei globuli rossi con H2O, le cellule sono state filate verso il basso a 200 × g (A) o 400 × g (B). I neutrofili sono stati colorati ed è stata eseguita l'analisi della citometria a flusso, come descritto nella Figura 3,con l'aggiunta di anti-CD41 per etichettare le piastrine. Abbreviazioni: RBC = globuli rossi; CD41 = cluster di differenziazione 41; SSC-A = area di dispersione laterale. Fare clic qui per visualizzare una versione più grande di questa figura.
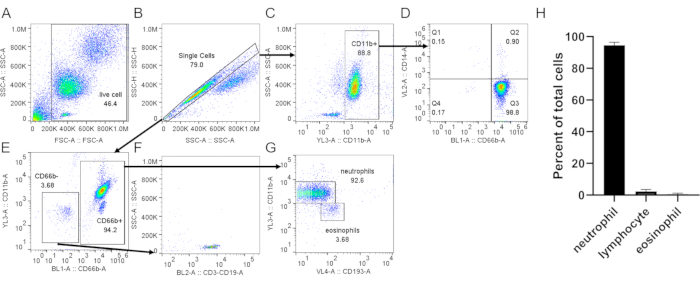
Figura 3: Valutazione dei neutrofili isolati dal buffy coat. I neutrofili isolati sono stati colorati con anti-CD66b, anti-CD11b, anti-CD14 e anti-CD193 seguendo un protocollo standard. Le celle singole (B) sono state recintate dalle celle totali (A). (C) Le cellule CD11b+ sono state gated da singole celle. (D) Dot plot che mostra neutrofili (CD66b+, CD14 basso /-) e una contaminazione monocitaria molto bassa (CD66b-, CD14+, Q1). (E) LE celle CD66b- e CD66b+ sono state gated. (F) CD66b- le cellule sono risultate positive per i marcatori linfocicitari (CD3, CD19). (G) Espressione di CD11b e CD193 in cellule CD66b+, che mostrano distinte popolazioni di neutrofili (CD66b+, CD11b+, CD193-) ed eosinofili (CD66b+, CD11b-, CD193+). Nel risultato rappresentativo mostrato qui, la purezza dei neutrofili è ~ 93% con ~ 3,7% di contaminazione da linfociti e ~ 3,7% di eosinofili. (H) Quantificazione della purezza dei neutrofili dopo la purificazione. I dati sono compilati da 5 studi individuali e presentati come ± SD. Abbreviazioni: CD = cluster di differenziazione; SSC-A = SSC-A = area di dispersione laterale; FSC-A = forward scatter-Area. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: La purificazione del gradiente non ha causato lo spargimento di CD62L. (A-B) I neutrofili stimolati da fMLP (B) (1 mM fMLP per 15 minuti a 37 °C) sono stati colorati con marcatori neutrofili e CD62L. (C) L'intensità media fluorescente per CD62L è diminuita nelle cellule trattate con fMLP, indicando lo spargimento di CD62L e l'attivazione dei neutrofili. Abbreviazioni: CD26L = L-selectin; fMLP = N-formilmetionil-leucil-fenilalanina; SSC-A = SSC-A = area di dispersione laterale; FSC-A = area di dispersione in avanti; PE = ficoeritrina. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Morte spontanea di neutrofili purificati dal gradiente di densità o dal kit di isolamento dei neutrofili. I neutrofili sono stati purificati con gradiente di densità (A e B) o microsfere commerciali (C e D) e coltivati per 0 h (A e C) o 24 h (B e D) in RPMI-10% FCS. Le cellule sono state colorate utilizzando Annexin V e PI nei rispettivi punti temporali seguendo un protocollo standard. (E) Quantificazione della morte spontanea dei neutrofili purificati. n=5, media ± SD. Abbreviazioni: SSC-A = SSC-A = side scatter-Area; FSC-A = area di dispersione in avanti; PI = ioduro di propidio; FCS = siero fetale del vitello; FITC = isotiocianato di fluoresceina; AV5 = Annexin V. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
A causa della breve durata della vita, dello stato di differenziazione terminale e del contenuto litico dei neutrofili, lo studio di queste cellule è sempre stata una sfida. Oltre a utilizzare modelli murini o cellule di coorti di pazienti, le linee cellulari sono strumenti utili per aiutare a studiare la biologia dei neutrofili16. Tuttavia, le linee cellulari simili ai neutrofili non possono reiterare completamente tutti gli aspetti della biologia dei neutrofili, aggiungendo un ulteriore livello di difficoltà nello studio di queste cellule. Il modello in vitro più comunemente usato è la linea cellulare HL-60, che può essere differenziata in cellule neutrofile mediante trattamento con dimetilsolfossido o acido retinoico17,18. Sebbene queste cellule siano utili nello studio della migrazione e dello scoppio respiratorio, non sono adatte per studiare l'attività microbiocida dei neutrofili. Esistono altre linee cellulari (PLB-98, NB4) e sono anche associate al loro insieme di limitazioni19.
È fondamentale convalidare con i neutrofili umani primari le osservazioni fatte con modelli di malattie murine e linee cellulari. I neutrofili non possono essere crioconservati in modo efficiente e quindi sono spesso isolati dal sangue intero o dai cappotti buffy ottenuti dai donatori e immediatamente elaborati. Una volta isolate, le cellule iniziano a subire una forma complessa di morte spontanea, regolata dall'ossidazione, dalle caspasi citoplasmatiche e dalle proteasi presenti nei granuli neutrofili20,21. Metodi o tecniche di isolamento impropri possono portare all'attivazione dei neutrofili, accelerando solo la morte cellulare. È imperativo avere un metodo affidabile e coerente per ottenere neutrofili puri e di alta qualità dai donatori.
Ci sono stati molti metodi pubblicati sull'isolamento dei neutrofili umani10,22. Si dividono principalmente in due categorie, con alcune strategie condivise. La prima categoria è basata sugli anticorpi, essendo attraverso la selezione positiva o negativa. La selezione positiva etichetterebbe direttamente i neutrofili, fornendo quindi una popolazione cellulare altamente pura, sebbene porti anche a una rapida attivazione cellulare, morte cellulare e marcatura indesiderata dei neutrofili23. La selezione negativa, pur lasciando le cellule non etichettate e dando una popolazione molto pura, ha accelerato la morte dei neutrofili, sebbene il meccanismo preciso sia sconosciuto (Figura 5). Se anche l'espressione genica o proteica è alterata dopo una selezione positiva o negativa deve essere ulteriormente studiata. Inoltre, a causa della quantità di anticorpi necessari per esaurire gli altri tipi di cellule, questi metodi non possono produrre grandi quantità di neutrofili. Tuttavia, i saggi basati su anticorpi possono ancora essere utilizzati per colture a breve termine ed esperimenti su scala più piccola e sono metodi di scelta per esperimenti che richiedono una purezza cellulare molto elevata, come studi sull'espressione genica e proteica.
Il secondo tipo di metodo di isolamento è basato sul gradiente e sulla densità. Di solito coinvolge Percoll, Ficoll-Paque o altri componenti polisaccaridi / polivinilpirrolidone e utilizza la forza di centrifugazione per separare diversi tipi di cellule del sangue in base alla densità cellulare. Questi metodi sono spesso integrati con la sedimentazione dei globuli rossi da parte del destrano. Questi metodi possono gestire scale più grandi di materiale di partenza e possono anche raggiungere un'elevata purezza. Un avvertimento dell'isolamento basato sulla densità è la separazione inefficiente di altri granulociti molto meno abbondanti (per lo più eosinofili) dai neutrofili, ed è, quindi, il principale limite del protocollo presentato, poiché anche la presenza di contaminazione di piccole cellule può influenzare la risposta dei neutrofili24.
Qui viene presentato un metodo riassuntiva basato sull'isolamento del gradiente, perfezionando i metodi precedenti10,22. Utilizziamo l'attuale sottovalutazione delle specificità dei neutrofili per isolare in modo affidabile neutrofili umani puri con piastrine residue e globuli rossi limitati, prevenendo l'attivazione dei neutrofili e la morte accelerata. Il passo più cruciale è la stratificazione del gradiente, che si ottiene molto più efficacemente aggiungendo il gradiente di densità medio sotto il sangue per ottenere un'interfaccia nitida. Un rapido esame dell'anello PBMC e del gradiente dopo la centrifugazione può rivelare possibili contaminazioni, attivazioni e basse rese. Quando si lavora con una membrana di leucoaferesi o un buffy coat, la diluizione del sangue è importante in quanto un'eccessiva densità cellulare porterebbe all'aggregazione cellulare, portando a impurità e attivazione cellulare.
Questo protocollo deve essere completato entro 2 ore per garantire la freschezza delle cellule e le fasi che coinvolgono il mezzo gradiente di densità, il destrano e la lisi devono essere eseguite immediatamente, poiché l'esposizione a queste soluzioni può alterare i neutrofili. Con questo protocollo, la resa attesa dei neutrofili è di almeno ~ 10 milioni / 10 ml di sangue intero e almeno ~ 60 milioni / 10 mL di buffy coat. La valutazione della qualità dell'isolamento deve essere effettuata come segue: i neutrofili attivati devono essere inferiori al 10%, la contaminazione dei linfociti inferiore al 5%, l'eosinofilo minimo (stessa dispersione laterale ma una popolazione di dispersione in avanti inferiore) e la vitalità cellulare deve essere superiore al 90%. Una purezza inferiore può derivare da una stratificazione o conservazione impropria del mezzo gradiente di densità o a causa della qualità e della freschezza del prodotto sanguigno di partenza.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi conflitto di interessi.
Riconoscimenti
Questo progetto è stato supportato da P01HL095489. A.Y.H è stato supportato da T32HL066987.
Materiali
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
Riferimenti
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon