Method Article
Isolamento de neutrófilos humanos de whole blood e buffy coats
Neste Artigo
Resumo
Este protocolo detalha um método para o isolamento de neutrófilos de sangue inteiro, casacos de buffy ou membranas de leucemia, alcançando bom rendimento, alta pureza e ativação celular mínima. Utilizamos purificação de gradiente, sedimentação de glóbulos vermelhos (RBC) e lise RBC para obter uma preparação de neutrófilo de alta qualidade/pureza.
Resumo
Os neutrófilos (PMNs) são os leucócitos mais abundantes na circulação humana, variando de 40 a 70% do total de leucócitos sanguíneos. São as primeiras células recrutadas no local da inflamação através de extravasões rápidas através de vasos. Lá, os neutrófilos executam uma série de funções para matar patógenos invasores e mediar a sinalização imunológica. Neutrófilos recém-purificados do sangue humano são o modelo de escolha para o estudo, já que nenhuma linha celular replica totalmente as funções do PMN e a biologia. No entanto, os neutrófilos são células de curta duração, terminatavelmente diferenciadas e são altamente suscetíveis à ativação em resposta a estímulos físicos (temperatura, centrifugação) e biológicos (endotoxinas, quimioterapia e citocinas). Portanto, é crucial seguir um método padronizado, confiável e rápido para obter células puras e não ativadas. Este protocolo apresenta um protocolo atualizado combinando centrifugação de gradiente de densidade, sedimentação de glóbulos vermelhos (RBC) e lise RBC para obter alta pureza pmn e minimizar a ativação celular. Além disso, também são discutidos métodos para avaliar a qualidade, a viabilidade e a pureza do nêutrons.
Introdução
O sistema imunológico inato é composto por muitos tipos de células que mantêm a homeostase imunológica e o desembaraço do patógeno, juntamente com muitas outras funções fisiológicas. Os neutrófilos compõem a maior poça de glóbulos brancos em circulação humana1. A maioria dos neutrófilos maduros são armazenados na medula óssea, que é o local de geração de novos neutrófilos, também chamados de granulopoiesis. Na medula óssea, os progenitores granulocitos saem do ciclo celular e se diferenciam terminalmente, adquirindo seus núcleos segmentados característicos e grânulos2. Sob condições inflamatórias, em resposta a quimiocinas, citocinas e padrões moleculares associados a danos e patogênicos, os neutrófilos são mobilizados da corrente sanguínea e da medula óssea para executar uma ampla gama de funções. Estes incluem secreção de citocinas, fagocitose direta do patógeno, liberação de espécies reativas de oxigênio, degranulação de proteínas antimicrobianas e formação de armadilhas extracelulares de neutrófilos.
As moléculas usadas por neutrófilos para combater a infecção são tóxicas para os micróbios e para o hospedeiro. Assim, o tempo de vida e a remoção adequada de neutrófilos envelhecidos/moribundos são altamente regulados, e têm uma vida útil limitada em circulação (<48 h)3. Devido a essa curta sobrevida, o corpo humano produz, em média, 100 bilhões de novos neutrófilos todos os dias para manter a homeostasepopulacional 4. A granulopoiese de emergência pode aumentar ainda mais a liberação de neutrófilos, maduros e imaturos, no sangue durante inflamação e infecção5. A importância dos neutrófilos na resposta imune inata é destacada por pacientes com neutropenia adquirida ou congênita, suscetíveis a infecções bacterianas e fúngicas6.
Muitos desafios surgem ao estudar biologia neutrófila e seus papéis na resposta imune devido à sua natureza, incluindo sua curta sobrevivência e conteúdo citotóxico. As linhas celulares semelhantes a neutrófilos têm sido comumente diferenciadas das células de leucemia promieelocítica humana HL-60 e células PLB-9857,8. Embora possam exibir morfologia semelhante a neutrófilos e realizar quimotaxis, essas linhas celulares não podem recapitular totalmente a biologia dos neutrófilos. Ensaios in vitro usando essas linhas de célula também são incapazes de recapitular experimentos in vivo. Além disso, a diferenciação dessas células precisa ser induzida e pode ser afetada adversamente pela manipulação genética antes da diferenciação.
Recentemente, foram desenvolvidos métodos para contornar essas questões usando promotores induíveis para modular a expressão genética pós diferenciação nas células HL-609. Mesmo com essas ferramentas, pmns humanos primários são necessários para validar alvos usando abordagens farmacológicas. Assim, é imprescindível obter neutrófilos puros e inativados isolados do sangue para validar os achados de modelos de linha celular e animais. Este artigo apresenta um protocolo de isolamento pmn revisado no qual os prós e contras dos métodos atuais foram avaliados10. Uma combinação foi concebida consistindo de centrífuga gradiente para separar pmns de outras células imunes, sedimentação à base de dextran para remover a maior parte das RBCs, lise RBC residual rápida através de pressão osmótica e centrifugação de baixa velocidade para remover a contaminação plaquetária.
Protocolo
NOTA: Os neutrófilos humanos foram isolados do sangue venoso de filtros de glóbulos brancos descartados obtidos no Laboratório do Banco de Sangue do Hospital Infantil de Boston. Os doadores de sangue eram identificáveis, não houve interação com indivíduos vivos ou conhecimento de informações pessoais identificáveis. Portanto, este trabalho não é classificado como pesquisa de sujeitos humanos sob o regulamento de sujeitos humanos do HHS (45 CFR Parte 46). O Conselho de Revisão Institucional do Hospital Infantil de Boston (IRB) aprovou o protocolo.
1. Camadas do gradiente
- Depois de esterilizar o casaco buffy ou a embalagem sanguínea inteira e o capô laminar, divida o sangue em tubos de 50 mL com 10 mL de sangue em cada tubo.
- Leve o volume até 35 mL com 5% de soro bovino fetal (FBS)/Hank's Balanced Salt Solution (HBSS) para diluir o sangue para um gradiente mais limpo.
NOTA: Ao usar uma membrana de leucemia, as células podem ser liberadas usando uma seringa de 60 mL e 30 mL de 5% FBS/HBSS por filtro. A diluição é desnecessária quando se trabalha com sangue inteiro recém-extraído. - Feche a tampa do tubo de 50 mL, misture-a várias vezes por inversão e mantenha-a de cabeça para baixo para ter o fundo desprovido de RBCs.
- Adicione 10 mL de gradiente de densidade (ver a Tabela de Materiais) diretamente abaixo do sangue. Certifique-se de que o meio e o sangue não se misturam e que a interface está afiada(Figura 1A).
NOTA: Este passo é crucial. Certifique-se de que a solução de gradiente de densidade esteja à temperatura ambiente (RT) e bem misturada antes de cada gradiente. O primeiro mililitro do gradiente de densidade precisa ser cuidadosamente e constantemente em camadas o mais lentamente possível. Recomenda-se ter a velocidade eletrônica da pipeta definida para baixo. - Coloque suavemente o tubo em uma centrífuga sem perturbar o gradiente e gire a 400 × g por 30 min no RT, certificando-se de desativar o freio. Observe como o gradiente girado se separa em uma camada superior de soro/plasma, um anel branco médio de células mononucleares de sangue periférico (PBMCs), uma camada média de gradiente de densidade nublada e uma pelota inferior consistindo de uma faixa de neutrófilo branco e fina em cima dos RBCs(Figura 1B).
NOTA: Um lado nublado ou opaco do tubo após a centrifugação pode sugerir que as células (neutrófilos) estão ativadas e podem não ser adequadas para uso. - Remova os PBMCs primeiro, emergindo a pipeta de sucção diretamente na camada PBMC. Certifique-se de aspirar completamente enquanto a camada sérico/plasma diminui à medida que o anel é removido. Raspe o lado do tubo onde as células pelotas com a pipeta de sucção para maximizar a remoção do PMBC. Remova cuidadosamente a camada média de gradiente de densidade nublada entre o anel PBMC e a pelota de neutrófilo/RBC.
NOTA: Raspar as células pelleted na lateral do tubo aumenta consideravelmente a pureza do isolamento. Tenha cuidado para não aspirar a pelota, pois a maioria dos neutrófilos estão sentados diretamente em cima dos RBCs.
2. Sedimentação de eritrócitos (RBCs)
- Usando uma pipeta de 10 mL, transfira a pelota de neutrófilo/RBC para um tubo limpo. Não encobrindo para cima e para baixo. Adicione 5% de FBS/HBSS a um volume final de 25 mL. Misture suavemente por inversão.
NOTA: Realizar a sedimentação de RBC após a remoção do PBMC melhora o rendimento e diminui a ativação10. - Adicione diretamente 25 mL de prewarmed (37 °C) 3% Dextran/0,9% NaCl/H2O no tubo contendo a pelota de neutrófilo/RBC diluída e misture suavemente por inversão. Coloque o tubo em uma superfície nivelada e não vibrante por 15 min(Figura 1C).
NOTA: A sedimentação mais longa reduz a contaminação por RBC, mas também diminui o rendimento. Além disso, a exposição prolongada ao Dextran pode levar à ativação de neutrófilos ou mortecelular 11. - Leve o tubo de volta para o capô (para isolamento estéril). Ao imergir ligeiramente a pipeta no líquido, colete a camada superior (~30 mL) seguindo a superfície líquida para baixo.
NOTA: Se a sedimentação produzir uma interface afiada entre o meio e os RBCs, a pelota RBC é menor, ou se um rendimento maior for desejado, colete até 35 mL. - Gire o tubo (400 × g, 10 min, RT, usando freio baixo (3)), resultando em uma pelota vermelha sem partículas flutuando na mídia.
3. Lysis dos RBCs residuais
- Aspire suavemente o supernasce sem interromper a pelota.
- Adicione 25 mL de água ultrapura estéril diretamente no tubo e misture suavemente invertendo por 28 s para lise os RBCs. Não use um pipet para resuspensar a pelota.
NOTA: Não exceda os 30 anos, pois as condições hipotônicas prolongadas podem ser ativadas e levar à morte de neutrófilo12. - Adicione imediatamente 25 mL de NaCl/H2O e misture suavemente invertendo para trazer a solução de volta às condições isotônicas.
NOTA: A solução deve ser vermelha, mas sem turbidez. - Gire a 200 × g para 3-5 min com freio baixo (nível 3) para minimizar os RBCs e a sedimentação plaquetlet juntamente com os neutrófilos(Figura 1D e Figura 2)13,14.
NOTA: A pelota deve ser branca com uma camada RBC mínima na parte superior, que pode ser removida suavemente enquanto o supernatante é aspirado. - Resuspend neutrófilos ao pipetar o meio de cultura (10% FBS/RPMI1640) diretamente na pelota, mas não pipeta para cima e para baixo. Balance o tubo horizontalmente de um lado para o outro para minimizar a ativação celular.
NOTA: As células devem ser mantidas em uma concentração de ~2 × 106 células/mL, uma vez que a maior densidade levará ao aumento da ativação celular/morte15. Pela mesma razão, a pelota celular deve ser resuspendecida o mais rápido possível. - Se for observada a agregação celular ou a clumping, filtre a suspensão celular usando uma malha de 70 μm para descartar neutrófilos desajeitados.
4. Determinando a qualidade do isolamento de neutrófilos
- Colorique as células com marcadores específicos para neutrófilos (CD66b, CD11b), eosinófilos (CD193)(Figura 3),e um marcador de ativação como CD62L(Figura 4). Adquira 20.000 células por citometria de fluxo. Analisar a pureza e ativação celular utilizando as estratégias de gating propostas nas Figuras 3 e Figura 4.
NOTA: A qualidade da preparação do neutrófilo pode ser avaliada usando uma solução azul ácido-metileno acético de 3% para visualizar o núcleo único de neutrófilos. - Determine a viabilidade celular utilizando o iodeto de anexo V/propidium (PI) (Figura 5).
NOTA: A coloração azul trypan pode ser usada para avaliar a viabilidade celular.
Resultados
Ao usar gradiente de densidade para purificar neutrófilos, é fundamental que a interface entre o sangue e o meio gradiente de densidade seja o mais nítida possível, e que uma separação de camada distinta permaneça após a centrifugação (passo 1.4). Após a lise RBC, o tampão deve ser um vermelho claro e não turvo (passo 3.3). Se a preparação for nublada, pode ser necessária uma segunda rodada de lise (etapa 3), embora isso possa afetar a sobrevida de neutrófilo(Figura 1). Na sequência da lise, a centrifugação de baixa velocidade (200 × g) é recomendada quando a pureza é priorizada, pois reduz consideravelmente a contaminação por plaquetas. No entanto, a centrifugação de alta velocidade (400 × g) aumenta o rendimento em detrimento da pureza (etapa 3.4, Figura 2). Após o isolamento do neutrófilo, a triagem celular ativada pela fluorescência pode ser usada para avaliar a pureza do isolamento (etapa 4.1) e deve ser escolhida em vez de microscopia. Embora a distribuição FSC/SSC das células por si só forneça uma estimativa da qualidade de isolamento celular(Figura 3A),o uso de marcadores celulares específicos deve ser preferido. Neste caso, as populações celulares contaminantes mais comuns estão manchadas com anticorpos específicos, juntamente com o CD66b, expresso especificamente em granulócitos. A coloração CD45 é usada para distinguir leucócitos (CD45+) e glóbulos vermelhos e plaquetas (CD45-).
Outros contaminantes incluem linfócitos (CD3+ ou CD19+, Figura 3F),monócitos (CD14+, Figura 3D)e eosinófilos (CD193+, Figura 3G). CD11b é um integrin expresso sobre a linhagem mieloide; neutrófilos e monócitos são CD11b+, enquanto os linfócitos são CD11b- (Figura 3C). Como a ativação de neutrófilos pode afetar experimentos a jusante, a expressão do CD62L deve ser avaliada; os neutrófilos tornam-se CD62L- uma vez ativados (passo 4.1). O peptídeo fMLP pode ser usado como um controle positivo para derramamento de CD62L(Figura 4). Também é importante avaliar a saúde dos neutrófilos antes de realizar ensaios; os neutrófilos têm uma meia-vida relativamente curta, e a ativação pode encurtá-la ainda mais (passo 4.2). Uma mancha padrão de Anexo V e PI pode dar informações sobre o status vivo/morto da cultura neutrófila nos horários designados(Figura 5).

Figura 1: Separação média do gradiente de densidade de granulócitos. (A) Antes e (B) após centrifugação. Observe a interface afiada entre o sangue e as camadas médias gradientes de densidade. (C) Sedimentação da pelota em B resuspended (1:1) em 5% FBS/HBSS e 3% Dextran-0,9% NaCl. (D) Pelota pmn após lise dos RBCs residuais no supernatante de (C) com H2O. Abreviaturas: PBMC = célula mononuclear de sangue periférico; PMN = neutrófilo; RBC = glóbulo vermelho; FBS = soro bovino fetal; HBSS = Solução de Sal Balanceado da Hank. Clique aqui para ver uma versão maior desta figura.

Figura 2: Girar em velocidades mais baixas após a rbc lysis diminuir a contaminação plaqueta. Após a lise de RBCs com H2O, as células foram giradas a 200 × g (A) ou 400 × g (B). Os neutrófilos foram manchados, e a análise da citometria de fluxo foi realizada, conforme descrito na Figura 3,com a adição de anti-CD41 para rotular as plaquetas. Abreviaturas: RBC = glóbulos vermelhos; CD41 = cluster de diferenciação 41; SSC-A = área de dispersão lateral. Clique aqui para ver uma versão maior desta figura.
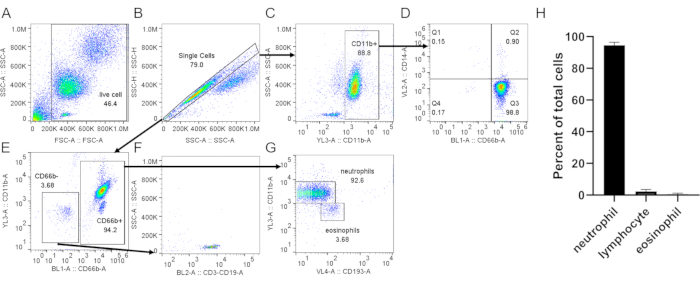
Figura 3: Avaliação de neutrófilos isolados da camada buffy. Neutrófilos isolados foram manchados com anti-CD66b, anti-CD11b, anti-CD14 e anti-CD193 seguindo um protocolo padrão. As células únicas(B)foram fechadas a partir de células totais(A). (C) As células CD11b+ foram fechadas a partir de células únicas. (D) Gráfico de pontos mostrando neutrófilos (CD66b+, CD14 baixo/-) e uma contaminação monócito muito baixa (CD66b-, CD14+, Q1). (E) CD66b- e células CD66b+ foram fechadas. (F) CD66b- as células foram positivas para marcadores de linfócitos (CD3, CD19). (G) Expressão do CD11b e CD193 em células CD66b+, mostrando populações distintas de neutrófilo (CD66b+, CD11b+, CD193-) e eosinófilo (CD66b+, CD11b-CD193+) populações. No resultado representativo mostrado aqui, a pureza de neutrófilo é ~93% com ~3,7% de linfócito e ~3,7% de contaminação por eosinófilo. (H) Quantificação da pureza do neutrófilo após a purificação. Os dados são compilados a partir de 5 ensaios individuais e apresentados como média ± abreviaturas de SD. CD = cluster de diferenciação; SSC-A = SSC-A = área de dispersão lateral; FSC-A = dispersão para a frente. Clique aqui para ver uma versão maior desta figura.

Figura 4: A purificação do gradiente não causou derramamento de CD62L. (A-B) Controle (A) ou neutrófilos estimulados por fMLP(B) (1 mM fMLP para 15 min a 37 °C) foram manchados com marcadores de neutrófilos e CD62L. (C) A intensidade média fluorescente para CD62L é diminuída nas células tratadas com fMLP, indicando derramamento de CD62L e ativação de neutrófilos. Abreviaturas: CD26L = L-selectin; fMLP = N-Formylmethionyl-leucyl-phenylalanine; SSC-A = SSC-A = área de dispersão lateral; FSC-A = dispersão para a frente; PE = ficoerthrin. Clique aqui para ver uma versão maior desta figura.

Figura 5: Morte espontânea de neutrófilos purificado por gradiente de densidade ou kit de isolamento de neutrófilo. Os neutrófilos foram purificados com gradiente de densidade(A e B) ou micróbios comerciais(C e D) e cultivados por 0 h(A e C) ou 24 h(B e D) em RPMI-10% FCS. As células foram manchadas usando anexos V e PI em respectivos pontos de tempo seguindo um protocolo padrão. (E) Quantificação da morte espontânea de neutrófilo purificado. n=5, abreviaturas médias ± SD. Abreviaturas: SSC-A = SSC-A = dispersão lateral-Área; FSC-A = dispersão para a frente; PI = iodeto de propidium; FCS = soro do bezerro fetal; FITC = isocitonato de fluoresceína; AV5 = Anexo V. Clique aqui para ver uma versão maior desta figura.
Discussão
Devido ao curto tempo de vida, ao status de diferenciação terminal e ao conteúdo lítico dos neutrófilos, estudar essas células sempre foi um desafio. Além de utilizar modelos ou células de camundongos de coortes de pacientes, as linhas celulares são ferramentas úteis para ajudar a estudar a biologia neutrófila16. No entanto, as linhas celulares semelhantes a neutrófilos não podem reiterar completamente todos os aspectos da biologia neutrófila, adicionando uma camada extra de dificuldade em estudar essas células. O modelo in vitro mais usado é a linha celular HL-60, que pode ser diferenciada em células semelhantes a neutrófilos por tratamento com dimetilsulfoxida ou ácido retinóico17,18. Embora essas células sejam úteis no estudo da migração e da ruptura respiratória, elas não são adequadas para estudar a atividade microbiocida de neutrófilos. Existem outras linhas celulares (PLB-98, NB4), e também estão associadas ao seu conjunto de limitações19.
É fundamental validar com observações primárias de neutrófilos humanos feitas com modelos de doenças de camundongos e linhas celulares. Os neutrófilos não podem ser criopreservados de forma eficiente e, portanto, muitas vezes são recentemente isolados de sangue inteiro ou casacos buffy obtidos de doadores e imediatamente processados. Uma vez isoladas, as células passam a sofrer uma forma complexa de morte espontânea, regulada por oxidação, caspases citoplasmáticas e proteases encontradas nos grânulos de neutrófilos20,21. Métodos ou técnicas de isolamento inadequados podem levar à ativação de neutrófilos, apenas acelerando a morte celular. É imprescindível ter um método confiável e consistente para obter neutrófilos puros e de alta qualidade de doadores.
Foram publicados muitos métodos sobre o isolamento de neutrófiloshumanos 10,22. Eles se enquadram principalmente em duas categorias, com algumas estratégias compartilhadas. A primeira categoria é baseada em anticorpos, seja através de seleção positiva ou negativa. A seleção positiva rotularia diretamente os neutrófilos, fornecendo uma população celular altamente pura, embora também leve à ativação celular rápida, morte celular, bem como marcação indesejada de neutrófilos23. Seleção negativa, embora deixando as células sem rótulo e dando uma população muito pura, acelerou a morte de neutrófilo, embora o mecanismo preciso seja desconhecido(Figura 5). Se a expressão genética ou proteica também é alterada após a seleção positiva ou negativa precisa ser mais investigada. Além disso, devido à quantidade de anticorpos necessários para esgotar os outros tipos de células, esses métodos não podem produzir grandes quantidades de neutrófilos. No entanto, ensaios baseados em anticorpos ainda podem ser usados para cultura de curto prazo e experimentos em menor escala e são métodos de escolha para experimentos que requerem pureza celular muito alta, como estudos de expressão genética e proteica.
O segundo tipo de método de isolamento é baseado em gradiente e densidade. Geralmente envolve percoll, Ficoll-Paque, ou outros componentes de polissacarídeo/polivinylpyrrolidone e utiliza a força de centrifugação para separar diferentes tipos de células sanguíneas com base na densidade celular. Esses métodos são frequentemente complementados com a sedimentação de glóbulos vermelhos pelo dextran. Esses métodos podem lidar com escalas maiores de material inicial e podem alcançar alta pureza também. Uma ressalva do isolamento baseado em densidade é a separação ineficiente de outros granulócitos muito menos abundantes (principalmente eosinófilos) de neutrófilos, e é, portanto, a maior limitação do protocolo apresentado, pois mesmo a presença de contaminação de pequenas células pode afetar a resposta de neutrófilos24.
Apresentado aqui é um método resumido baseado no isolamento gradiente, refinando métodos anteriores10,22. Utilizamos a subestitução atual de especificidades de neutrófilos para isolar de forma confiável nêutrons humanos puros com plaquetas residuais limitadas e RBCs, impedindo a ativação de neutrófilos e morte acelerada. O passo mais crucial é a camada do gradiente, que é muito mais eficazmente obtida adicionando o meio gradiente de densidade sob o sangue para obter uma interface afiada. Um exame rápido do anel PBMC e do gradiente após a centrifugação pode revelar possível contaminação, ativação e baixo rendimento. Ao trabalhar com uma membrana de leucemia ou casaco buffy, diluir o sangue é importante, pois a densidade celular excessiva levaria à agregação celular, levando a impurezas e ativação celular.
Este protocolo deve ser concluído dentro de 2h para garantir o frescor celular, e etapas envolvendo o gradiente de densidade médio, dextran e lise devem ser feitas imediatamente, pois a exposição a essas soluções pode alterar os neutrófilos. Com este protocolo, o rendimento esperado de neutrófilos é de pelo menos ~10 milhões/10 mL de sangue inteiro e pelo menos ~60 milhões/10 mL de casaco buffy. A avaliação da qualidade do isolamento deve ser feita da seguinte forma: os neutrófilos ativados devem ser inferiores a 10%, a contaminação por linfócitos inferior a 5%, o eosinófilo mínimo (mesmo dispersão lateral, mas menor população de dispersão para a frente), e a viabilidade celular deve ser superior a 90%. A menor pureza pode resultar de camadas inadequadas ou armazenamento do gradiente de densidade médio ou devido à qualidade e frescor do produto sanguíneo inicial.
Divulgações
Os autores declaram que a pesquisa foi realizada na ausência de qualquer conflito de interesses.
Agradecimentos
Este Projeto foi apoiado pelo P01HL095489. A.Y.H foi apoiada pela T32HL066987.
Materiais
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
Referências
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados