Method Article
アセチルコリン受容体アゴニストレバミゾールに対する Caenorhabditisエレガン ス感受性の測定
要約
本プロトコールは、アセチルコリン受容体の1つのクラスの Caenorhabditisエレガン スの薬理学的アゴニストであるレバミゾールに対する応答を決定するアッセイを記載する。この液体レバミゾール水泳アッセイでは、研究者は24ウェルプレートで栽培された動物の時間依存性麻痺を視覚的に観察し、定量化します。
要約
神経筋接合部(NMJ)において、興奮性神経伝達物質アセチルコリン(ACh)のシナプス後受容体への結合は、筋肉収縮をもたらす。脊椎動物の骨格筋と同様に、モデル生物 Caenorhabditis elegans の体壁筋におけるコリン作動性シグナル伝達は、移動運動に必要である。体壁筋上のACh受容体の1つのクラスの薬理学的アゴニストであるレバミゾールへの曝露は、野生型動物の時間依存性麻痺を引き起こす。レバミゾールに対する感受性の変化は、NMJまたは筋肉機能におけるシグナル伝達の欠陥を示唆している。ここでは、24ウェルプレートで増殖させた C.エレガンス に対して実施した液体レバミゾールアッセイのプロトコールを提示する。液体中の動物の活発な遊泳は、物理的な操作を必要とせずに、1時間にわたって数百のワームにおけるレバミゾール誘発性麻痺の評価および定量を可能にする。この手順は、NMJにおけるシグナル伝達の変化の機能的結果を実証するために、レバミゾールに対する感受性を変化させた野生型および変異体の両方で使用することができる。
概要
骨格筋上のシナプス後アセチルコリン受容体(AChRs)の活性化は、筋肉収縮をもたらす電気信号をもたらす。神経筋機能の破壊は、ヒトにおける筋無力症候群および筋ジストロフィーをもたらす1,2,3,4。線虫Caenorhabditis elegansは、進化的に保存された基本的な生物学的プロセスと病気のメカニズムについて学ぶために広く使用されてきました。脊椎動物の骨格筋とC.エレガンス体壁筋は、移動運動の制御において機能的に同等である5。ここでは、野生型C.エレガンスを、神経筋シグナル伝達または筋肉機能を変化させた変異体と比較するために使用できる簡単なアッセイを提示する。
コリン作動性およびGABA作動性運動ニューロンからそれぞれ受け取った興奮性および抑制性の入力は、C. elegans体の片側の筋肉を収縮させ、他方の側の筋肉を弛緩させ、協調移動を可能にする6。寄生線虫感染症の治療に使用される駆虫剤であるレバミゾールは、体壁筋上のAChRの1つのクラスに結合し、恒常的に活性化し、時間依存性麻痺をもたらす7。したがって、レバミゾールに対する変化した感受性は、興奮性シグナル伝達および阻害性シグナル伝達のバランスに欠陥を有するC.エレガンス7、8、9、10、11、12、13、14、15を同定するために使用することができる。例えば、UNC-63などのレバミゾール感受性AChR(L-AChR)のサブユニットにおける変異、ならびにシナプスでのL-AChRクラスタリングに必要なCubilin、LEV−10のC.エレガンスホモログは、興奮性シグナル伝達に影響を与え、レバミゾール耐性をもたらす7、8。GABAA受容体UNC-49の変異は、抑制性シグナル伝達を低下させ、レバミゾール12に対する過敏症を引き起こす。
レバミゾールに対する過敏症または耐性は、伝統的に、動物をレバミゾールを含む寒天プレートに移し、次いで定期的にワームを突いて麻痺が起こる時点を決定することによって評価されてきた13,14,15。私たちは、動物の物理的操作の必要性を排除し、わずか1時間で数百匹の動物のスクリーニングを可能にする液体レバミゾール水泳アッセイを開発しました。ここでは、野生型、unc-63(x26)、lev-10(x17)、およびunc-49(e407)動物とのこのアッセイの使用が記載されている。しかしながら、このプロトコルは、レバミゾール感受性の変化についてゲノムワイドRNAiスクリーンで同定されたノックダウンを検証するために行われたように、RNAiに曝露されたC.エレガンスに対しても実施することができる11。
この薬理学的アッセイのために、ワームを24ウェルプレートで成虫期まで増殖させ、M9緩衝液中の0.4mMレバミゾールを各ウェルに添加し、そして移動する動物の数を1時間5分ごとに記録した。レバミゾール誘発性麻痺を経時的に目視で観察し、アッセイ終了後、データを定量した。野生型 C. elegans とともに変異体を評価することで、学生は最初に潜在的な表現型効果について予測を行い、次に仮説をテストするための実験を行うことができます。結論として、このシンプルで安価な液体レバミゾールアッセイは、NMJ機能に対する特定の遺伝子の喪失の影響を実証する理想的な方法です。
プロトコル
1. レバミゾールアッセイ用プレートの調製
- 線虫増殖培地(NGM)培地を、攪拌子のあるフラスコ内で、3gのNaCl、2.5gのペプトン、および17gの寒天と1Lの脱イオン(DI)水とを組み合わせて調製する。
- オートクレーブ処理後、70°Cに設定したホットプレートに培地を入れ、適度な速度で1時間攪拌する。
- 沈殿を防ぐために、1 mL の 5 mg/mL コレステロールを滴下し、1 mL の 1 mL の 1 M CaCl2、1 mL の 1 M MgSO4、および 25 mL の 1 M pH 6.0 リン酸カリウム緩衝液を培地に加えます。
- 2 mLのNGM培地を滅菌血清学的ピペットで24ウェルプレートの各ウェルに移します(図1)。
- プレートをベンチトップで2日間乾燥させてから、細菌を播種します。長期間保管するには、4°Cに置きます。
- 消化液ブロス(LB)プレート上のOP50 大腸菌 をストリークアウトし、37°Cで一晩増殖させる。
- 単一のOP50コロニーをBブロス(1LのDIH2O中の10gのトリプトンおよび5gのNaCl)にピックし、培養振盪を37°Cで一晩設定した。
- 滅菌ピペットを使用して、OP50懸濁液30μLを各ウェルの中央の寒天上に滴下する(図1)。
注:寒天の表面を傷つけないようにしてください、これはワームの穴を掘ることにつながります。 - 播種後少なくとも2日間、プレートを室温で放置して、細菌の芝生を形成させます。
メモ:センターウェル内のバクテリアが2日経っても乾燥していない場合は、プレートをフード内で20分間開いたままにします(図1)。プレートを注ぎ、アッセイの1〜2週間前に細菌を播種する必要があります。
2. C.エレガンスの 同期(1日目)
- 野生型、unc-63(x26)、lev-10(x17)、およびunc-49(e407) C. elegansを6cmプレート上で成虫期まで成長させ、1株あたり少なくとも8枚のプレートを調製する。皿の上に飢えていないグラビッドな大人がたくさんいることを確認します。
メモ: これは、必要なプレートの数の 2 倍です。しかし、卵の最初のバッチが漂白中に破壊された場合に備えて、バックアッププレートを持つことが重要です。 - 攪拌しながら 750 mL の DI 水に 59.6 g の Na2 HPO 4 (二塩基性)、29.9 g の KH 2 PO 4 (一塩基性)、12.8g の NaCl、および2.5g の MgSO4 を溶解して、10x M9 バッファーを作ります。溶解したら、容量を1 Lまで上げてろ過滅菌します。1:10とオートクレーブを希釈して、1x M9バッファーを作ります。
注:1x M9バッファは、数週間または数ヶ月前に作成することができます。 - 同期の日にフードの下に漂白液を準備します。10 mL の漂白剤 (材料表)、2.5 mL の 10 N NaOH、および 37.5 mL の DI 水を 50 mL の円錐形チューブに混ぜます。ゴーグル、手袋、白衣は、漂白液で作業するときはいつでも着用してください。
- プラスチック転写ピペットを使用して、少なくとも4つのプレートから1x M9バッファーで肉質の成虫を洗い流し、15mLの円錐形チューブに移します。
- 室温で1分間716 x g でスピンし、次いでトランスファーピペットを用いて上清を除去する。
- 漂白溶液10mLを加える。ワームの死骸のほとんど(すべてではない)が溶解するまで、チューブを反転させるか、または静かに約4分間振る(図1)。
注:これは卵を破壊するので、ワームを過剰に漂白しないように注意してください。特定の突然変異は、卵の単離の困難さを高める可能性がある。 - 716 x g で1分間回転します。
- 漂白剤溶液を1つの動きで注ぎます。この時点でチューブが振られない限り、卵はチューブの側面にくっつきます。
- 15 mL の 1x M9 バッファーを加え、転倒させます。716 x g で1分間スピンし、M9バッファーを1回の滑らかな動きで注ぎます。
- ステップ 2.9 で説明したように、1x M9 バッファーで合計 3 回の洗浄を実行します。
- 最終洗浄後、新鮮な1x M9を10mL加え、15°Cで一晩回転子の上に置き、飢餓に苦しんだ第1幼虫(L1)期動物の同期集団を単離する。
メモ:回転子を装着する前に、M9バッファに卵があることを確認してください。そうでない場合は、バックアッププレートと漂白剤で準備を短時間で繰り返します。
3. メッキ同期C.エレガンス (2日目)
- 24 ウェル プレート マップを印刷し、ランダム化された場所にひずみを割り当てます。各株は、24ウェルプレートに少なくとも6回表されるべきである。
- 漂白剤調製の約24時間後、孵化した飢えたL1ワームを室温で1分間716 x g のM9バッファー中でスピンダウンさせた。
- プラスチック転写ピペットで約9mLのM9緩衝液を除去し、次いで、飢えた第1幼虫期のワーム(L1s)を残りのM9緩衝液に穏やかに混合する。
- 直ちにM9バッファー中のワーム3μLを顕微鏡スライド上にピペットし、L1の数を決定する。必要な数は 3 μL で 20 ~ 30 L1s です。ワーム濃度が低すぎる場合はスピンダウンして M9 を除去し、濃度が高すぎる場合は M9 を追加します。
メモ: 3 μL あたりのワームの数を少なくとも 2 倍に確認し、毎回チューブを反転させます。 - 予め作成されたプレートマップに従って、各ウェルにL1sのピペット3μL(合計20〜30ワーム)を(ステップ3. 図1)。
注:M9のL1でチューブを頻繁に反転させて、ワームが底に落ち着くので均一な分布を維持します。これが行われないと、いくつかの井戸にはワームが少なすぎますが、他の井戸には多すぎます。また、ピペットの先端で寒天を突き刺さないでください。 - ワームを20°Cで3日間成人期に成長させます。
注:異なる成長温度と特定の突然変異の使用は成熟速度に影響を与える可能性があるため、 C. elegansの ライフサイクルを必ず考慮してください。
レバミゾールアッセイを行う(5日目)
- 空白のデータシートを印刷します。このデータシートを使用して、各ウェル内を移動するワームの数を 5 分ごとに 1 時間記録します。
注:学生は5分ごとに最大12の井戸でワームを数えることができます。上位12ウェルは最初の1時間でアッセイされ、下部12ウェルはその後の1時間でアッセイされます。 - 24ウェルプレートのワームを確認してください。マーカーを使用して、プレートに「X」を蓋をして、汚染されている井戸、飢えている井戸、またはワームが多すぎる(>40)ため、数えにくくなります。
- 100 mM レバミゾールストック 200 μL を 1x M9 の 50 mL に添加して、0.4 mM レバミゾール溶液を作ります。240.76mgの塩酸レバミゾールを10mLのH2Oに溶解して100mMレバミゾールストックを調製し、−20°Cで保存する。
注:レバミゾールはM9で希釈する必要があります。H2Oでの希釈は麻痺を促進する。生徒は手袋を着用するべきです。高濃度のレバミゾールの摂取は有毒である。 - タイマーを開始し、トランスファーピペットを使用して、動物が自由に泳ぐことができるように、最初の2つのウェルに1mLの0.4mMレバミゾールを加えます。隣接するウェルにレバミゾールを加え続け、アッセイするウェルの数に応じて時間をずらす。
注:例えば、10ウェルがアッセイされる場合、レバミゾールは、時間0のウェル1および2、1分後のウェル3および4、2分後のウェル5および6、3分後のウェル7および8、および4分後のウェル9および10の方法で添加される。 - 5 分で、最初のウェルから始めて、各ウェル内の移動するワームの数のみを手動でカウントし、その数をデータシートに記録します (図 1)。カウンターは使用できますが、移動するワームの数を正確に判断する必要はありません。
注:多くのワームが麻痺する前に、早い時間帯に遅れをとることがあるため、学生はタイマーに注意する必要があります。時間点の数を調整することも、必要に応じて各時点でアッセイできるウェルの数を減らすこともできます。 - 各ウェル内の移動ワームの数を5分ごとに1時間カウントし続けます。
注:M9に浸漬すると、この1時間のアッセイの過程で一定の水泳運動が誘導され、麻痺を評価するためにワームの突出が不要になります(図2A)。0.4mMレバミゾール溶液への曝露は、水泳の中止によって観察されるような時間依存性麻痺を誘発する。麻痺するワームは回復しません。 - 手順 4.4.-4.6 を繰り返します。プレート内の残りの井戸のために。
- アッセイの終了時、または時間が許す限り、各ウェル内のワームの総数を記録します。
5. データ解析
- プレートマップを取得し(ステップ3.1)、どのひずみが各ウェルに対応するかを記録します。
注: 収集されるデータの量により、その後のデータの分析と議論には少なくとも数時間かかります。 - データをスプレッドシートに入力し、各ウェル内のワームの総数から開始し、遺伝子型別に整理します。
- ウェルからのデータを組み合わせて、各系統について各時点で移動するワームの数を決定する。
- これらのデータを使用して、統計ソフトウェア(材料表)に「生存曲線」を作成し、集団の時間依存性麻痺を視覚的に表示します(図2B)。
- 左側の列に時間が表示され、後続の列に各ひずみのデータが含まれるようにデータ テーブルを作成します。最初の5分以内に麻痺した動物ごとに、行を作成し、5分間「1」を入力します。これを各時点について繰り返します。アッセイの終わりまでに麻痺しないすべての動物について、60分間「0」を入力します。
- 統計ソフトウェア(材料表)のログランク(Mantel-Cox)検定を使用してペアワイズ比較を実行し、2つの異なる系統間に統計的に有意な差があるかどうかを判断します。
- 追加/代替分析の場合、ステップ 5.3 を実行する代わりに。ステップ5.4と、各時点において各ウェル内を移動する動物の割合を決定する。スプレッドシートプログラムまたは統計ソフトウェアを使用してアッセイされたすべての株について、各時点での標準誤差で平均をプロットします(図2C)。
結果
AChRsおよびGABA受容体を介したシグナル伝達は、C.エレガンス体の片側の筋肉が収縮し、他方の側の筋肉が弛緩し、協調的な移動を可能にする6,16。電離性L-AChRsに結合するレバミゾールは収縮を引き起こし、野生動物の時間依存性麻痺をもたらす。ここでは、野生型、unc-63 L-AChR変異体、lev-10 L-AChRクラスタリング変異体、およびunc-49 GABAA受容体変異体C.エレガンスのレバミゾールに対する感受性を評価した。 L-AChRのサブユニットにおける変異、ならびにL-AChRsを筋肉原形質膜にトラフィッキングするために必要な遺伝子における変異、シナプス後L-AChRのクラスタリング、および下流のCa2+シグナル伝達は、unc-63およびlev-10変異体において観察されるように、レバミゾール誘発性麻痺に対する耐性を引き起こす7、8、9、10、11、16、17(図2B)。,C).GABA依存性イオンチャネルUNC-49の喪失は、コリン作動性およびGABA作動性シグナル伝達の適切なバランスの破壊によるレバミゾール過敏症(図2B、C)を引き起こした12。このアッセイが最近、高度な遺伝学研究室の学部生によって行われたとき、学生の100%がunc-63およびlev-10変異体でレバミゾール耐性を観察し、88%がunc-49変異体でレバミゾール過敏症を観察した。液体レバミゾール水泳アッセイで収集されたこれらのデータは、従来のプレートベースのレバミゾールアッセイ7、8、11、12、13で観察された表現型と一致する。
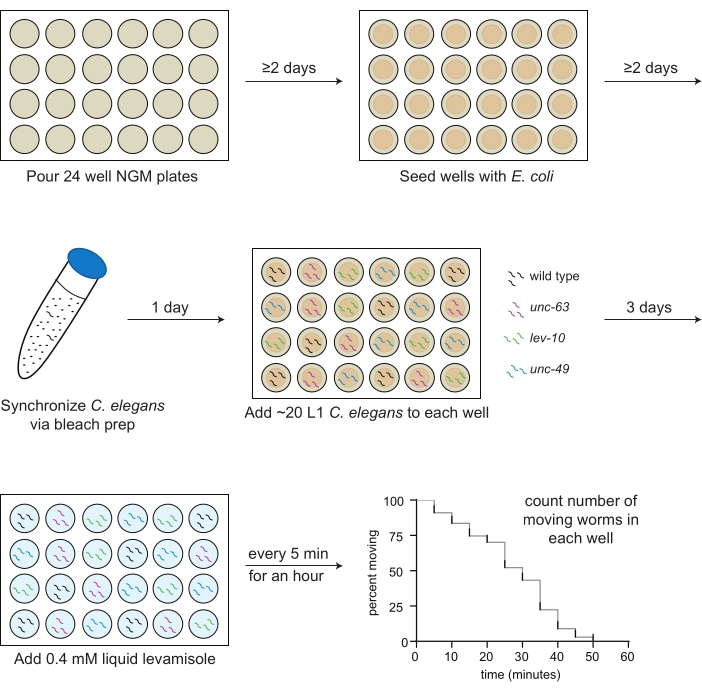
図1:レバミゾールアッセイの調製および実施の概略図。2日後、OP50大腸菌をウェルに播種する。C. elegansは、漂白剤調製、およびアッセイされる各株の最初の幼虫期(L1)動物(野生型、黒色;unc-63(x26), マゼンタ;レフ-10(x17)、緑;unc−49(e407),青色)は、翌日に所定のプレートマップに従ってウェルにピペットで送られる。20°Cで3日間成長した後、または動物が成人期に達したら、M9バッファー中の0.4mMレバミゾールを各ウェルに添加し、移動する動物の数は5分ごとに1時間カウントされます。 この図の拡大版を表示するには、ここをクリックしてください。
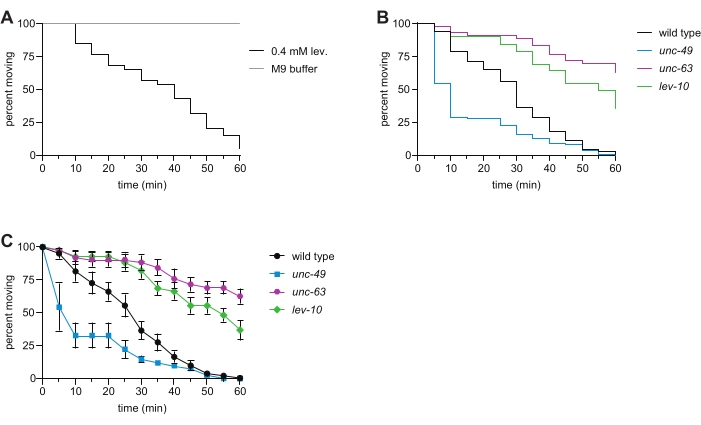
図2:野生型および代表的な変異型C.エレガンスにおけるレバミゾール誘発性麻痺。(A)0.4mMレバミゾールへの曝露は、時間依存性麻痺を引き起こす。これは、1x M9バッファー中で1時間泳ぐ動物では観察されない(B)レバミゾール水泳アッセイにおける野生型(ブラック)、unc-63(x26)(マゼンタ)、lev-10(x17)(グリーン)、およびunc-49(e407)(青)動物の時間依存性麻痺。 L−AChRサブユニットUNC−63またはL−AChRクラスタリングタンパク質LEV−10の喪失はレバミゾール耐性をもたらし、GABAA受容体UNC−49の喪失はレバミゾール過敏症を引き起こした。n≥遺伝子型あたり50であり、p<この代表的な実験において野生型と比較したすべての変異体について0.0001であった。(c)パネル(B)と同じデータを用いて、各時点における移動動物の割合(SEに±ける各ウェルに対する百分率の平均)を、各系統について決定した。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
レバミゾールに対する応答の変化は、シナプス後コリン作動性シグナル伝達および筋肉機能に必要な遺伝子を同定することができる。ここでのプロトコールは、1時間の期間にわたる時間依存性麻痺を定量するために使用される液体レバミゾールアッセイを記載している。学生は、特定の遺伝子変異の影響について予測を行い、大きなサンプルサイズで実験を行い、その結果を定量化します。このアッセイは、動物を摘んだり突いたりすることなく、レバミゾール誘発性麻痺を定量するシンプルで効率的な方法であり、学部の研究室や神経筋伝達を研究する研究者に適しています。ここでは、最も一般的な落とし穴、アッセイの限界、およびRNAiノックダウン動物での使用を可能にするプロトコルのバリエーションについて説明します。また、ここでは、このアッセイをコースベースの学部研究経験にどのように組み込むことができるかについても説明します。
24ウェルプレートの適切な調製は不可欠です。まず、細菌の芝生は、井戸でL1動物を見つける前に完全に乾燥していなければなりません。十分に乾燥していない場合、細菌はアッセイ中にレバミゾール溶液と混合し、液体を濁らせ、個体がワームを数えることができないようにする。第二に、漂白剤の準備を通してワームを同期させるとき、動物は卵の保護コーティングを崩壊させるので、漂白剤溶液にあまりにも長い間さらされてはならない。第三に、井戸内にワームが多すぎると、割り当てられた時間内に移動した数を正確に数えることが非常に困難になるため、井戸あたり20〜30個のL1のみを見つけることが重要です。最後に、汚染されたウェルをアッセイできないため、プレートの調製中に無菌技術を維持することが重要です。
このアッセイを実行する際に考慮しなければならないいくつかの制限があります。まず、各ウェル内の移動ワームの数を5分ごとに数えることは、ラボの経験がない人にとっては圧倒的であり、これは不正確なデータ収集につながる可能性があります。薬物感受性18,19を決定するために使用される他のアッセイに関しては、この実験はより少ない時点において実施することができる。第二に、漂白剤調製物から単離された飢餓L1のめっきは、同期集団を得るための簡単な方法である。ただし、アッセイする株間で発生タイミングが異なる場合は、調整を行う必要があります。このアッセイのために、後期第4幼虫期動物(L4s)を24ウェルプレートにピックすることが可能である。しかし、多くのプレートを準備する場合、これはあまりにも労働集約的です。あるいは、各株がL4に到達するのにかかる時間を決定し、成熟速度の違いを調整するために異なる時間にL1をウェルに配置する必要があります。最後に、このアッセイは、シナプス後筋機能11に重要な新しい遺伝子を同定するために使用することができるが、変化したレバミゾール応答は、シナプス前遺伝子12の突然変異またはRNAiノックダウンによっても引き起こされ得る。変化したレバミゾール感受性が観察される場合、この表現型の理由を決定するために追加の実験を行わなければならない。
24ウェルプレートにいくつかの改変を加えることによって、記載されたレバミゾール水泳アッセイを、RNAiノックダウン動物11に対しても行うことができる。RNAiを介した遺伝子ノックダウンは、目的遺伝子20に対応する二本鎖RNAを発現するC.エレガンス属細菌に給餌することによって達成することができる。RNAiプレートの調製のために、オートクレーブから取り出した後、培地1リットルあたり1mLの1M IPTGおよび1mLの25mg/mLカルベニシリンを1mL添加しなければならない。細菌培養物は、3 mLのLBブロスに3 μLの25 mg/mLカルベニシリンを加えた単一のコロニーをピッキングし、37°Cで一晩振とうすることによって増殖させ、異なる細菌がウェルにスポットされるとプレートマップが作成されます。C.エレガンは、記載されているように漂白剤調製によって同期される。しかし、遺伝子ノックダウンを増加させるために、RNAi過敏性eri-1(mg366)株を野生型の代わりに使用すべきである。RNAiノックダウンは、機能喪失変異体11について観察されるのと同じレバミゾール表現型をもたらす。
ここで提示されたプロトコルは、実験室研究、学部研究室でのスタンドアロン実験、または基本的な C. elegans 技術および神経筋機能の紹介として高度な学部コースのオープニングウィークに使用することができます。より高度な発見ベースのコースでは、学生はこのアッセイを使用して、重症筋無力症候群、筋ジストロフィー、または筋障害を有する個体において変異した遺伝子の C. elegans ホモログの喪失がレバミゾール感受性を変化させるかどうかを決定することができる。結論として、このシンプルで安価なレバミゾール感度アッセイは、NMJでのシグナル伝達について学び、 C. elegans モデルシステムでの作業経験を積むための実践的なアプローチを提供します。
開示事項
著者には利益相反はありません。
謝辞
デラウェア大学のBISC413 Advanced Genetics Laboratory(2022年春)で遺伝子型に盲目的に 図2B、C のデータを収集したRiya DattaniとLauren Hogstromに感謝します。BISC413コースベースの学部研究経験(CURE)に関する追加情報、およびJ. Tanisが設計したラボマニュアルへのアクセスは、リクエストに応じて利用できます。線虫株は、NIH-ORIP(P40 OD010440)によってサポートされている Caenorhabditis Genetics Centerによって提供された。この作品は、P20 GM103446デラウェア州インブレ・メンタリングド・キュア・アワード(J.E.T.宛)の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| 60 mm non-vented, sharp edge Petri Dishes | TriTech Research | Cat #: T3308 | |
| BD Difco Bacto Agar | Fisher Scientific | Cat#: DF0140-01-0 | |
| BioLite 24 Well Multidish | Fisher Scientific | Cat#:12-556-006 | |
| Calcium Chloride Dihydrate | Fisher Scientific | Cat#: BP510-500 | |
| Cholesterol | MP Biomedicals | Cat#: 02101382-CF | |
| eri-1(mg366) | Caenorhabditis Genetics Center (CGC) | GR1373 | |
| Gibco Bacto Peptone | Fisher Scientific | Cat#: DF0118-17-0 | |
| Gibco Bacto Tryptone | Fisher Scientific | Cat#: DF0123-17-3 | |
| GraphPad Prism (Statistical software) | GraphPad Software, Inc. | ||
| lev-10(x17) | Caenorhabditis Genetics Center (CGC) | ZZ17 | |
| Levamisole hydrochloride | Fisher Scientific | Cat#: AC187870100 | |
| Low Splash Regular Bleach - 121oz - up & up | Target | Search target.com | |
| Magnesium Sulfate Heptahydrate | Fisher Scientific | Cat#: BP213-1 | |
| Microsoft Excel | Microsoft, Inc | ||
| N2 wild type | Caenorhabditis Genetics Center (CGC) | Bristol N2 | |
| OP50 E. coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Potassium Phosphate Dibasic | Fisher Scientific | Cat#: BP363-1 | |
| Potassium Phosphate Monobasic | Fisher Scientific | Cat#: BP362-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | Cat#: BP358-1 | |
| Sodium Hydroxide 10N | Fisher Scientific | Cat#: SS255-1 | |
| Sodium Phosphate Dibasic | Fisher Scientific | Cat#: BP332-1 | |
| unc-49(e407) | Caenorhabditis Genetics Center (CGC) | CB407 | |
| unc-63(x26) | Caenorhabditis Genetics Center (CGC) | ZZ26 |
参考文献
- Engel, A. G., Shen, X. M., Selcen, D., Sine, S. M. Congenital myasthenic syndromes: Pathogenesis, diagnosis, and treatment. The Lancet Neurology. 14 (4), 420-434 (2015).
- Mahjneh, I., Lochmüller, H., Muntoni, F., Abicht, A. DOK7 limb-girdle myasthenic syndrome mimicking congenital muscular dystrophy. Neuromuscular Disorders. 23 (1), 36-42 (2013).
- Rodríguez Cruz, P. M., et al. Congenital myopathies with secondary neuromuscular transmission defects; A case report and review of the literature. Neuromuscular Disorders. 24 (12), 1103-1110 (2014).
- Montagnese, F., et al. Two patients with GMPPB mutation: The overlapping phenotypes of limb-girdle myasthenic syndrome and limb-girdle muscular dystrophy dystroglycanopathy. Muscle and Nerve. 56 (2), 334-340 (2017).
- Gieseler, K., Qadota, H., Benian, G. M. Development, structure, and maintenance of C. elegans body wall muscle. WormBook. , 1-59 (2017).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature Neuroscience. 2 (9), 791-797 (1999).
- Lewis, J. A., Wu, C. H., Berg, H., Levine, J. H. The genetics of levamisole resistance in the nematode Caenorhabditis elegans. Genetics. 95 (4), 905-928 (1980).
- Gally, C., Eimer, S., Richmond, J. E., Bessereau, J. L. A transmembrane protein required for acetylcholine receptor clustering in Caenorhabditis elegans. Nature. 431 (7008), 578-582 (2004).
- Eimer, S., et al. Regulation of nicotinic receptor trafficking by the transmembrane Golgi protein UNC-50. The EMBO Journal. 26 (20), 4313-4323 (2007).
- Gendrel, M., Rapti, G., Richmond, J. E., Bessereau, J. L. A secreted complement-control-related protein ensures acetylcholine receptor clustering. Nature. 461 (7266), 992-996 (2009).
- Chaya, T., et al. A C. elegans genome-wide RNAi screen for altered levamisole sensitivity identifies genes required for muscle function. G3: Genes, Genomes, Genetics. 11 (4), 047 (2021).
- Vashlishan, A. B., et al. An RNAi screen identifies genes that regulate GABA synapses. Neuron. 58 (3), 346-361 (2008).
- Krajacic, P., Pistilli, E. E., Tanis, J. E., Khurana, T. S., Lamitina, S. T. FER-1/Dysferlin promotes cholinergic signaling at the neuromuscular junction in C. elegans and mice. Biology Open. 2 (11), 1245-1252 (2013).
- Gottschalk, A., et al. Identification and characterization of novel nicotinic receptor-associated proteins in Caenorhabditis elegans. The EMBO Journal. 24 (14), 2566-2578 (2005).
- Loria, P. M., Hodgkin, J., Hobert, O. A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans. The Journal of Neuroscience. 24 (9), 2191-2201 (2004).
- Treinin, M., Jin, Y. Cholinergic transmission in C. elegans: Functions, diversity, and maturation of ACh-activated ion channels. Journal of Neurochemistry. 158 (6), 1274-1291 (2021).
- Rapti, G., Richmond, J., Bessereau, J. L. A single immunoglobulin-domain protein required for clustering acetylcholine receptors in C. elegans. The EMBO Journal. 30 (4), 706-718 (2011).
- Kim, S., Sieburth, D. A receptor tyrosine kinase network regulates neuromuscular function in response to oxidative stress in Caenorhabditis elegans. Genetics. 211 (4), 1283-1295 (2019).
- Oh, K., Kim, H. Aldicarb-induced paralysis assay to determine defects in synaptic transmission in Caenorhabditis elegans. Bio-Protocol. 7 (14), 2400 (2017).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved