Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lizin demetilaz Faaliyet Kantitatif Ölçümler MassSQUIRM Uygulaması
Bu Makalede
Özet
Biz lisin metilasyon değişiklikleri ölçmek için MALDI kütle spektrometresi ve indirgeyici metilasyon kimya kullanmak için bir yöntem sunuyoruz.
Özet
Son zamanlarda, epigenetik düzenleyiciler 1-3 çok farklı hastalıklara kilit oyuncular olarak tespit edilmiştir. Sonuç olarak, bu enzim küçük molekül çalışmalar ve ilacın geliştirilmesi 4 ana hedefi vardır. Birçok epigenetik regülatörler son zamanlarda saptanmış olması ve sınıflandırılmaktadır süreci halen devam etmektedir. Bu enzimler arasında histonlar ve diğer proteinler üzerindeki lysines gelen metil grupları kaldırmak lisin demethylases vardır. Enzimlerin bu sınıfın yeni niteliği nedeniyle, birkaç testler faaliyetlerini incelemek için geliştirilmiştir. Bu sınıflandırma ve histon demethylases yüksek verimlilik çalışması hem de yol bloğu olmuştur. Günümüzde çok az demetilaz testler var. Var yaptığımız bu doğada nitel olma eğilimindedir ve aynı anda farklı lizin metilasyon devletler arasında ayırt edemez (un-, mono-, di-ve tri-). Kütle spektrometresi yaygın demetilaz etkinliğini belirlemek için kullanılan ancak mevcut kitle spektrometrik deneyleri yapmak edilirayirt metillenmiş peptidler farklı iyonize olmadığına ilişkin. Metillenmiş peptidlerin Diferansiyel iyonlaşma metilasyon devletler zor ve (Şekil 1A) kesinlikle niceliksel değil karşılaştırma yapar. Böylece mevcut testlerin demetilaz faaliyet kapsamlı bir analiz için optimize edilmiş değildir.
Burada, böylece esas olarak aynı kimyasal maddeleri hale getirerek, tüm lysines di-metillenmiş olmak zorlamak için döteryumlanmış formaldehit ile amin gruplarının indirgeyici metilasyon dayanmaktadır MassSQUIRM olarak adlandırılan bir yöntem (izotopik indirgeyici metilasyon kullanılarak kütle spektrometrik kantitatif) ve dolayısıyla tarif iyonize aynı (Şekil 1B). Indirgeyici metilasyon izleyerek sadece kimyasal fark hidrojen ve MALDI iyonizasyon verimliliği etkilemez döteryum vardır. MassSQUIRM assay un-, mono-veya di-metillenmiş lysines ile demetilaz reaksiyon ürünleri için kesin. Assay da sa veren lisin methyltransferases için de geçerlidirBana reaksiyon ürünleri. Burada, indirgeyici bir metilasyon kimya ve MALDI kütle spektrometrisi LSD1 aktivitesini ölçmek için, bir sentetik peptid substrat üzerindeki 5, di-ve mono-metil grupları çıkarma yeteneğine sahip bir lisin demetilaz. Bir kombinasyonunu kullanmak Bu test kolay ve laboratuar veya bir proteomik tesisi yoluyla bir MALDI kütle spektrometresi erişimi olan herhangi bir laboratuvar kolayca tâbidir. Assay ~ 8 kat dinamik aralığı vardır ve plaka formatında 5 için kolayca ölçeklenebilir.
Protokol
Bu protokol, Blair ve ark değiştirilir. 6.
1. LSD1 demetilasyonu Assay
- 20 ul'lik bir son hacim içinde, demetilaz tampon içinde 0.25 g di-metil histon H3 peptit (ARTKme2QTARKSTGGKAPRKQLYK-biyotin) (50 mM Tris-Cl, pH 8.5, 50 mM KCI, 5 mM MgCl2,% 5 ile 125 ng rekombinant LSD1 kombine gliserol). Buna ek olarak, herhangi bir enzim ile bir peptid sadece kontrol gerçekleştirmek. Kontrol bölümü 3 ve indirgeyici metilasyon gerekmez.
- 37 de 2 saat boyunca inkübe ° C.
- Peptidler toplamak için, her bir örnek için 8 uL Póros R2, 20 mikron boncuklar ekleyin ve oda sıcaklığında 15 dakika boyunca ajite. Metanol 1 hacmine sahip boncuk 1 hacim süspanse ederek Poros boncuklar hazırlamak ve daha sonra% 5 formik asit /% 0.2 TFA içerisinde 10 hacim ekleyin.
- Durumu iki ucu içine% 0.1 TFA 20 uL aspirasyon ve bir pipet ile geri dışarı iterek C 18 ZipTips. % 0,1 T ile iki kez yapınFA, dört adet 70% asetonitril ile kere /% 0.1 TFA, ve% 0.1 TFA ile yeniden dört kez.
- ZipTips in C'de 18 reçinesi arkasında boncuk bulamaç pipet ve bir pipet ile yoluyla hacmi iterek şartlandırılmış C'de 18 ZipTips üzerine iki numune (kontrolü ve demetilaz reaksiyonu) yerleştirin.
- % 0.1 TFA içerisinde 20 uL ile iki kez yıkanır ZipTips.
- % 70 asetonitril /% 0.1 TFA içerisinde 40 uL içinde elüt edilmesi.
- Bir SpeedVac konsantratör tamamen her seyreltici Lyophilize.
2. Redüktif Metilasyon
Bu protokolün bir kısmı Blair ve ark modifiye edilir. Ve Rayment ve ark. 6,7.
- 50 mM fosfat tamponu, pH 7.4 100 ul içinde demetilaz Reaksiyon tekrar askıya.
- Demetilaz reaksiyon, 15 mg / mL boran dimetilamin 8 uL ekleyin. Boran dimetilamin 15 mg / mL stok çözelti vermesi için, 50 mM fosfat tamponu, pH 7.4 içinde çözülür.Bu taze yapılmalıdır.
- Demetilaz reaksiyon için, 250 mM döteryumlanmış formaldehit 16 uL ekleyin. 250 mM Döteryumlanmış formaldehid H 2 0 içinde stok seyreltilmesi ile hazırlanır. Bu taze yapılmalıdır.
- 2 saat süreyle 4 ° C'de inkübe edilir.
- Adımları 2.2, 2.3 ve 2.4 tekrarlayın.
- Adım 2.2 tekrarlayın.
- 4 ° C'de inkübe ~ 15 saat boyunca.
- Demetilaz örnek için, 1M Tris, indirgeyici metilasyon reaksiyonu gidermek için pH 7.4 12.5 uL ekleyin.
3. MALDI Kütle Spektrometresi
- Demetilaz reaksiyon Poros R2 20 mikron boncuk ekleyin ve adımları 1,3-1,6 açıklandığı gibi ZipTips üzerinde toplamak.
Not: 50 mM fosfat tamponu, pH 7.4 100 uL, kontrol yeniden askıya alma ve diğer örnek adım 3.1 başlayarak gibi davran.
- % 33 doyurmak 2 uL kullanılarak bir MALDI Örnek plakası üzerine ZipTips gelen kontrol ve demetilaz Reaksiyon numuneleri elüt edilmesid 2,5-dihidroksibenzoik asit. % 33 2,5-dihidroksibenzoik asit hazırlamak için,% 70 asetonitril /% 0.1 TFA içerisinde doymuş% 33 kadar seyreltik daha sonra% 70 asetonitril /% 0.1 TFA içerisinde 2,5-dihidroksibenzoik asit, doymuş bir çözelti yapmak ve. Yıkanan örnekleri kurulayın ve kristalize izin verin.
- Bir PerkinElmerSciex MALDI-prOTOF kütle spektrometresi veya mevcut yüksek çözünürlüklü MALDI kütle spektrometresi 8,9,10 kullanarak kütle spektrumları toplayın.
- Spektrumları görüntüleme ve kütle spektrometre üreticisi tarafından sağlanan PerkinElmerSciex TOFworks yazılım veya yazılım kullanarak pik alanları ayıklayın.
- Tandem kütle spektrometresi yetenekleri sağlayan kullanılabilir bir kütle spektrometresi sistemi ile MS 2 ile reaksiyon ürünleri doğrulayın.
4. Veri Analizi
- Ağır formaldehid (Şekil 1B) kullanılarak hazırlandı izotopik örtüşme telafi etmek için, pik alanı 13 C'de 2 ve 13 C'de 4 izotopları relativ (A) oranının belirlenmesiindirgeyici metilasyon (Şekil 2A) uğramamıştır kontrol örneği için Monoizotopik pik e.
Denklem 1: 13C2 / A 12C = r 1
Denklem 2: A 13C4 / A 12C = r 2
Bu sizin deney ve kütle spektrometresi özgü bu izotop devletlerin mevcut peptid oranı (r 1 ve r 2) verecektir. - Demetilaz reaksiyonu Örnek olarak, her durumda modifikasyon (Şek. 2B) mevcut peptid görece miktarı ölçülmesi için aşağıdaki formüllerde R 1 ve R2 değerlerinin kullanımı:
Eşitlik 3: H3K4me2 = A 1
Eq 4: H3K4me = A 2 - r 1 (A 1)
Denklem 5: H3K4 = A 3 - r 2 (A 1) - [r 1 (A 2 - r 1 (A 1))]
5.. Temsilcisi Sonuçlar
LSD1 kullanarak, kantifikasyonunda MassSQUIRM etkinliğini göstermeklisin demetilasyon. Gibi Protokolü Text bölümünde açıklandığı üzere, bu LSD1 125 ng ve 0.25 g di-metil histon H3 peptit (ARTKme2QTARKSTGGKAPRKQLYK-biotin) ile bir demetilaz deneyi gerçekleştirilir. Kontrolü ve demetilaz Reaksiyon numuneleri indirgeyici metilasyonu ve MALDI kütle spektrometrisi tabi tutuldu. Indirgeyici metilasyon uğramadı kontrol reaksiyonu Bu peptid için tipik izotopik zarfı gösterdi ve denklemleri 1 ve 2 (Şekil 2A) için pik alanları sağlamıştır. Demetilaz reaksiyon için kütle spektrumu denklemler 3-5 (Şekil 2B) için pik alanı temin. Kontrolü ve demetilaz reaksiyondan pik alanları kullanarak, LSD1 aşağıdaki reaksiyon ürünleri vermek üzere peptid demetillenmiş belirlenmiştir:% 33.7 di-metil Lys4,% 42.3 mono-metil Lys4, ve% 24 un-metillenmiş Lys 4. Blair ve ark bakınız. Tam LSD1 demetilaz aktivitesinin analizi gibi inhibitörü çalışmaları için 6. Not böyle reaksiyon süresi, enzim olarak değişen değişkenlerkonsantrasyonu ve substrat konsantrasyonu faaliyet derinlemesine bir analiz için izin verecektir.

Şekil 1. MassSQUIRM bakış. (A) histon H3 bir peptidin N-terminali olarak gösterilir un-(yeşil), mono-(kırmızı), ya da di-(mavi), lisin 4 azından metillenmiş. Her peptid kimyasal bileşiminin değişimiyle miktar karmaşık hale diferansiyel iyonizasyon yol açar. (B) indirgeyici metilasyon tüm peptidler benzer şekilde iyonize neden olur di-metil durumuna tüm lisin artıkları dönüştürür. Indirgeyici metilasyon reaksiyonu ağır formaldehit kullanımı metilasyon orijinal kimlik retansiyon sağlar. Kapalı daireler ağır metilasyon işaret ederken açık daireler ışık metilasyon gösterir. Blair ve ark. 2011 6. modifiye edilmiştir.
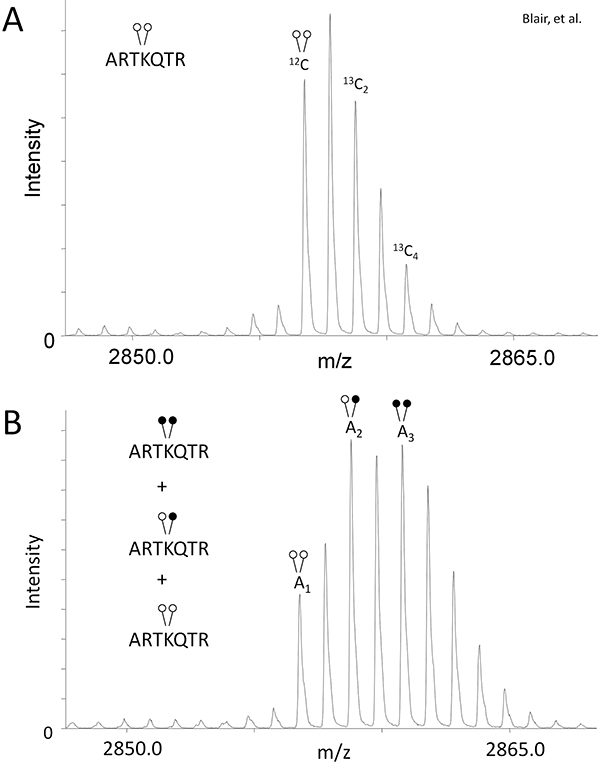
Figüre 2. MassSQUIRM diferansiyel olarak metillenmiş peptidler ölçmek için kullanılabilir. (A) bir di-metillenmiş sentetik histon H3 peptit (ARTKme2QTARKSTGGKAPRKQLYK-biyotin) R 1 ve denklemler 1 ve 2 'de R 2 olarak kaydedildi kütle spektrometrisi ve Monoizotopik pik göre pik oranları kullanılarak analiz edilmiştir. (B) aynı sentetik peptid, 37 ° C de iki saat süreyle demetilaz tampon içinde 125 ng LSD1 ile inkübe edildi Örnekler daha sonra, analizi MassSQUIRM tabi tutuldu. Zirveleri örtüşen karışık bir nüfus olarak Şekil 1B görülen üç farklı metilasyon devletleri temsil eder. Monoizotopik Pik Alanları A 1, A 2 ve A 3 olarak kaydedildi. Pik alanları denklemleri 3-5 kullanılmıştır. Kapalı daireler ağır metilasyon işaret ederken açık daireler ışık metilasyon gösterir. Blair ve ark Modifiye. 2011 6.
Tartışmalar
MassSQUIRM mono-ve di-metilasyon dahil lisin demethylases aktivitesinin analizi için kapsamlı bir ucuz ve niceliksel bir yöntemdir. MassSQUIRM reaksiyon ürününün aynı zamanda ara ürün için sadece kantitatif sunmaktadır. Bu testte LSD1 ve diğer histon demethylases mekanizması okuyan güçlü bir araç olarak kullanılabilir. Aynı zamanda böyle PHF8 olarak yeni keşfedilen lisin demetilaz enzimler sınıflandırmak ve belirli metil enzimleri için kullanılabilecek için yararlı olacaktır.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Biz kitle spektrometrik destek için UAMS Proteomik Tesis teşekkür ederim. Bu proje için finansman NIH hibe P20RR015569, P20RR016460 ve R01DA025755 tarafından sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| LSD1 | BPS Biosciences | 50100 | |
| H3K4me2-biotin peptit | in-house hazırlanır | hiçbiri | |
| Poros R2 20 mikron boncuk | Applied Biosystems | 1-1129-06 | |
| C 18 ZipTip | Millipore | ZTC18M | |
| Trifloroasetik asit (TFA) | Thermo | 28904 | |
| asetonitril | Balıkçı | A996 | |
| 2,5-dihidroksibenzoik asit | Sigma | 85707 | |
| Boran dimetilamin | Sigma | 180238 | |
| izotopça ağır d 2-formaldehit | Cambridge İzotop Laboratuvarı | DLM-805-20 | |
| Tris | Balıkçı | BP154 | |
| KCl | Balıkçı | BP366 | |
| MgCl2 | Balıkçı | BP214 | |
| Gliserin | Balıkçı | G33 | |
| Formik asit | Fluka | 06440 | |
| Metanol | Balıkçı | A452 | |
| Na-fosfat | Balıkçı | BP329 | |
| SpeedVac Konsantratörü | Bilgin | DNA110 | |
| MALDI-prOTOF kütle spektrometresi ve TOFworks yazılım | PerkinElmerSciex | hiçbiri |
Referanslar
- Goldberg, A. D., Allis, C. D., Bernstein, E. Epigenetics: a landscape takes shape. Cell. 128, 635-638 (2007).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128, 693-705 (2007).
- Blair, L. P., Cao, J., Zou, M. R., Sayegh, J., Yan, Q. Epigenetic Regulation by Lysine Demethylase 5 (KDM5) Enzymes in Cancer. Cancers (Basel). 3, 1383-1404 (2011).
- Cole, P. A. Chemical probes for histone-modifying enzymes. Nat. Chem. Biol. 4, 590-597 (2008).
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119, 941-953 (2004).
- Blair, L. P. MassSQUIRM: An assay for quantitative measurement of lysine demethylase activity. Epigenetics. 6, 490-499 (2011).
- Rayment, I. Three-dimensional structure of myosin subfragment-1: a molecular motor. Science. 261, 50-508 (1993).
- Collom, S. L., Jamakhandi, A. P., Tackett, A. J., Radominska-Pandya, A., Miller, G. P. CYP2E1 active site residues in substrate recognition sequence 5 identified by photoaffinity labeling and homology modeling. Arch. Biochem. Biophys. 459, 59-69 (2007).
- Gradolatto, A. Saccharomyces cerevisiae Yta7 Regulates Histone Gene Expression. Genetics. 179, 291-304 (2008).
- Taverna, S. D. Yng1 PHD finger binding to histone H3 trimethylated at lysine 4 promotes NuA3 HAT activity at Lysine 14 of H3 and transcripiton at a subset of targeted ORFs. Mol. Cell. 24, 785-796 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır