Method Article
Santral Sinir Sistemi Onarım İnceleyecek Bir Sakatlık Paradigma
Bu Makalede
Özet
Santral sinir sistemi rejenerasyon ve onarım araştırmak Drosophila larva ventral sinir kablosu kullanarak bir yaralanma paradigma açıklanmıştır. Kasıtlı geliştirilen yazılım ve genetiği ile kantitatif analiz ile birlikte zaman atlamalı ve sabit örneklerde konfokal mikroskopi lazer tarama, ardından bıçaklama MSS rejenerasyon ve onarım moleküler mekanizmalarının araştırılması için kullanılır.
Özet
Bir deneysel yöntem meyve sineği Drosophila kullanarak merkezi sinir sistemi (MSS) yaralanma hücresel cevaplarının araştırılması için geliştirilmiştir. Hayvanlarda Anlama onarım ve rejenerasyon biyolojide önemli bir sorudur. Hasarlı insan MSS yeniden ve rejenerasyon teşvik etmek nasıl bir anlayış tıbbi nörobilim ana amaçlarından biridir gelmez. Drosophila güçlü genetik araç MSS yenilenme sorunu çözmek için kullanılabilir.
MSS ventral sinir kablosu (VNC, omurgalı omurilik eşdeğerdir) bir lezyon bir tungsten iğne ile elle uygulanır. VNC sonradan zamanla lezyon gelişimini takip amacıyla 24 saat için lazer tarama konfokal mikroskopi kullanılarak time-lapse filme alınabilir. Alternatif olarak, daha sonra sabit ve konfokal mikroskopi ile nöron ve glial hücreleri görselleştirmek için immünofloresan kullanılarak boyandı, kültüre edilebilir. Cha, uygun işaretleri kullanmahasarının bir sonucu olarak hücre morfolojisi ve hücre durumda nges görselleştirilebilir. ImageJ ile ve bilerek geliştirilen eklentileri, niceliksel ve istatistiksel analizler zaman ve hücre proliferasyonu ve hücre ölümü ile yaralanmanın etkileri üzerinde yara boyutu değişiklikleri ölçmek için yapılabilir. Bu yöntemler büyük örneklem boyutlarının analizine izin verir. Onlar MSS rejenerasyon ve onarım altında yatan moleküler mekanizmalarının araştırılması Drosophila güçlü genetik ile kombine edilebilir.
Giriş
Hayvanlarda Rejenerasyon hücreler organizmanın büyüme emretti ve tam zaman hissedebilir ve nasıl yapısal bütünlüğünü bir organizmanın sağlanması ve sürdürülmesi olduğunu ortaya koymaktadır. Hücrelerin bu gizemli yetenekleri anlama biyoloji ilgi büyük. Rejenerasyonu teşvik medikal sinirbilim için önemli hedeflerinden biridir. İnsanlarda hasarlı santral sinir sistemi (MSS) yenilenmez. Omurilik yaralanması Kemirgen modelleri hücrelerinin hasarı nasıl tepki anlamak için kullanılır. Ancak, etik kaygılar, yüksek maliyetler ve hayvanların yavaş yaşam döngüsü ilerleme sınırlamaktadır.
Meyve sineği Drosophila gelişimsel biyoloji ve nörobilim yaygın olarak kullanılan bir model organizmadır. Güçlü genetik araçları ve kısa yaşam döngüsü sayesinde, Drosophila recurrently insan ve hastalığın anlaşılması için alaka ile genlerin fonksiyonlarının ve gen ağlarının keşfine yol açmıştır. Evrimsel con bol kanıt vardırinsanlara sinekler gen fonksiyonu servation.
Son yıllarda, sinir sistemi yaralanmaları için çeşitli paradigmalar Drosophila kurulmuştur. Bazı duyusal 1 ve motor aksonlar 2 dahil olmak üzere periferik sinirlerin kanat veya aksotomi koş periferik sinirlerin zarar oluşmaktadır. Ancak, periferik ve santral sinir sistemi birçok açıdan farklı, ve de birçok hayvanlarda periferik sinir sistemi CNS yapamam ise oluşturabildiği bilinmektedir. Böylece, CNS CNS rejenerasyon, doğrudan yaralanma anlamak daha uygun olacaktır. Bir iğne ile Stabbing yaralanma başarıyla yaralanma 3,4 yanıt araştırmak için Drosophila yetişkin beyin uygulanmıştır. Başka bir yaklaşım kullanarak, Ayaz ve ark. Kopmuş CNS bir Piezo elektrik microdissector sahip kültürlü yetişkin beyinlerinde aksonlar, ve 4 gün 5 için kendi rejenerasyon analiz. Bu daha sonra deney grubu u avantajıps onlar büyük ilgi şüphesiz beyin, odaklanmak olduğunu. Dezavantajı beynin sadece motor ve duyusal kontrolü ile uğraşan VNC, çok daha karmaşık olmasıdır. Erişkin beyni üzerine Çalışma aynı zamanda daha fazla zaman alıcıdır. Erişkin eclosion için yaklaşık 10 gün sürer ve sonra olgunlaşma için ek 5 gün ise larva, 4 gün içinde deneyler için hazır. Kaldırmak zordur kalın kütikül, kapsüllü çünkü yetişkin beyin, işlemek için de daha zordur. VNC omurgalı omuriliğe işlevsel olarak eşdeğer olan daha da cazibesi vardır.
Drosophila larvalarının yaygın nöroloji 6-9 için bir model organizma olarak kullanılır. Kesinlikle larva konuşma bir gelişim aşamasında olmasına rağmen, aynı zamanda bir hayvan tam olarak işlevsel olarak kabul edilebilir. Larva koku alma, tat ve nosisepsiyon, öğrenme ve bellek gibi hareket, farklı duyuları vardır. Böylece, larva VNC wgibi MSS yaralanma için ideal bir model olarak seçilmiştir.
Larva ve pupa VNCs hala 24 saat 10 için hücresel bütünlüğü koruyarak, çanak disseke ve kültüre edilebilir. Bu da yaralanma sonra bu süre boyunca için time-lapse kaydedilen veya bu süre içinde herhangi istenilen zaman bir noktada kültür ve sabit olabilir VNC, uygulanabilir öne sürdü.
Burada, Drosophila larva VNC kullanan MSS yaralanması için deneysel bir paradigma sunuyoruz. VNC ilk larva diseke edilir ve bıçaklama yaralanma bir tungsten iğne ile manuel olarak uygulanır. VNC sonra bir cam alt lamel üzerine yerleştirilir ve konfokal mikroskobu time-lapse lazer ile çekildi. Alternatif olarak, VNCs zaman istenilen süre kültüre edilebilir ve yaralanma hücresel etkileri immun ve konfokal mikroskopi kullanılarak sabit örneklerde analiz edilebilir. Yara alanı ölçülür, ve hücre nu kantitatif analiz edilebilirmber (hücre çoğalması ve hücre ölümü) kasıtlı olarak geliştirilmiş olan yazılım ile gerçekleştirilebilir. Büyük örnek boyutları kolayca istatistiksel geçerliliği sonuçları neden ele alınabilir. Bu yöntemler başarıyla MSS yaralanması 11 glial rejeneratif yanıtı yatan bir gen ağı keşfetmek için Drosophila güçlü genetik ile kombine edilmiştir.
Protokol
1. Koleksiyonu Larva Sahnelenen
- Sıra 15 kadın ve silindirik bir Perspex kafeste 15 erkek yetişkin sinekler 25 az 3 saat süreyle yapıştırın maya küçük kepçe ° C ile desteklenmiş agar ve üzüm suyu ile bir Petri kabı yumurtalarını bırakmak için Bir gün plaka 3-4 kez değiştirin ve ilk plaka (O / N yumurta-lay dan yani) atın. Ayrıca ilk günden itibaren plakalar atın. Üzerindeki ikinci günden itibaren, 25 yumurta ° C ile plakaları tutmak Yumurta toplama 7 gün sonra, yeni bir üst sinekler kurmak ile başlar.
- Sonra yaklaşık 24 saat, yumurtalardan çıkan larvaların. Bir inceltilmiş fırça ile veya forseps bir çift ile larva çengel olarak, üzüm agar gelen standart sinek yemek (10 ml) (Şekil 1A) içeren bir şişeye 35 larva transferi.
- 25 3 gün boyunca larva (Yumurta Döşeme sonra 96 saat, AEL) içeren flakon koruyun ° C.
2. Kültür Larva Ventral Sinir Kordonlar Diseksiyon
- Olmak temizleyin% 70 etanol ile NCH ve eller. 4 boyama blok, 2 forseps çiftleri ve% 70 etanol içeren bir iğne batırın ve hava kurumaya bırakın.
- Aşağıdaki medya ile 4 boyama blok hazırlayın: temizlemek ve Distile Su (DW) ile bir havuz temizliği larvaları için;% 1 penisilin ve Streptomisin, Ecdysone ücretsiz (M3 PS 2 Shield ml ve Sang M3 böcek orta ile ikinci bir larva incelemek için orta); havuzu disseke ventral sinir kablosu (VNCs) M3 PS orta 2 ml ile üçüncü ve bıçak VNCs M3 PS orta 2 ml ile dördüncü. Reaktiflerin tüm RT ön ısıtmaya tabi tutulmalıdır.
- 96 saat AEL larva içeren flakon su ekleyin. Sonra, bir spatula kullanarak, hafifçe ıslak bir kağıt havlu üzerine tüpten larvaları ile gıda yayıldı. Gıda yıkayın DW içeren bir boyama blok 10 larva aktarın. DW 6 kez değiştirin. Sonra M3 PS orta ile değiştirin.
- M3 PS ortam, 2 ml içeren bir lekelenme blok larvaların bir aktarın.
- Diseksiyon mikroskobu altında, distandart yöntemler 12 kullanılarak dikkatlice larva beyin ssect, ancak doku hasarı en aza indirmek için, aşağıdaki şekilde ilerleyerek özel ilgileneceğim. Larva dorsal yüzü yukarı yerleştirin ve forseps 2 çifti ile anterior ucu (her biri bir el) üçte bir oranında az dorsal tarafında tutun. Anterior bölümü tutarken, forseps ile posterior ucundan uzağa çekin ve epidermisi gözyaşı. Beyin ve VNC anterior yarısı arka kenarından görünür olmalıdır. Dikkatle vücut yağ, gut ve epidermis kaldırarak beyin ve VNC kompleksi izole. VNCs çok zarar olduğunda, VNCs yaralanma bıçaklama olmadan bile tamamen veya kısmen dejenere olacaktır. Dikkate aşağıdaki noktaları atın:
- Çekin veya bu VNC zarar verecektir torasik VNC gelen hayali diskler ve periferik sinirleri gözyaşı etmeyin. Periferik sinirleri kesmek için, birbirine yakın yerleştirilmiş forseps, iki çift periferik sinirleri basılı tutun ve sonra için ile sinirlerin çekinceps. Hayali diskler ve ağız parçaları VNC bağlı bırakılabilir.
- Beyin ekli halka bezi ve lenf bezi bırakın.
- Çok olmayan gıda içerdiği beyin, en yakın olan bir noktada bağırsak kesin.
- Ucu kesilmiş ve biraz genişletilmiş bir P20 Pipetman kullanarak, taze M3 PS orta içeren bir boyama blok VNC aktarın. Uç yapışmasını VNC önlemek için teşrih için kullanıldığında, yalnızca orta aşağı VNC, birinci pipet kadar iletim ve önce.
3. Drosophila larval VNC Sakatlık Stabbing
Bu bölümde VNCs amacıyla bıçaklama yaralanması gerçekleştirmek için, ve time-lapse analiz ve immun için bıçaklandı-VNCs nasıl hazırlanacağını anlatır. Post-bıçaklama kültür şartları ve süresi bölüm 5 (hızlandırılmış analiz için) ve Bölüm 6 (immun için) olarak ifade edilir.
- Time-lapse için (4-5 yeterince VNCs havuzu sonrave transferi bir VNC), immün için 24 üzerinde M3 PS içeren temiz bir boyama blok.
- Doğu VNC yani sırta ait neuropile mikroskop (Şekil 1B) altında görünümünde olmasıdır. Bu optik loblar eklenmesiyle yalan VNCs için en doğal bir yönelimdir.
- Stab elle dik açı neredeyse dorsal taraftan, diseksiyon mikroskop altında bir tungsten iğne kullanılarak ve VNC karın yarısı (Şekil 1B) hedefliyor.
Aşağıdaki özellikle dikkat edin:
- Sadece bir kez Stab.
- Iğne kadar Stab cam alt vurur. Ancak, iğne ucu zarar vermemek için dikkatli olun.
- Iğne tutucu gövde bıçaklama boyunca ortam temas etmemelidir.
- Yara diseksiyon mikroskop altında görülebilir değildir.
Not: Stab-yaralanma ilgisiz dejenerasyonu
ProsedürBıçaklama lezyondan VNC ayrı içinde hücre dejenerasyonuna neden olabilir. Neuropile delik içinde Dejenerasyon sonuçları ve bazen delikleri olmayan bıçakladı numunelerin korteks gözlenmiştir. Etkileyen neuropile veya yaygın dejenerasyonu etkileyen dejenerasyonu olan örnekler de VNC yüzey atılmalıdır. Dejenerasyon aşağıdaki gibi tanımlanabilir:
- Özellikle bıçaklama 22 saatte toraks ventral lateral / alanda, Pürüzlü yüzey. Aşırı durumlarda, VNC çıkıntı görünüyor.
- Floresans immünorektivitesi ile arka sinyal delikler gibi görünür olabilir torasik neuropile delikler veya vakuoller,.
4. İğne ve Forseps Bakım
- Rutin iğne ucu kadar keskin olup olmadığını kontrol edin. İğne ucu çeşitli deneyler için kullandıktan sonra bükülmüş veya künt olabilir. Bu durumda, bir Arkansas taş ya da eşdeğerini kullanarak uç keskinleştirmek.
- Forseps ipuçları gerekirmükemmel buluşuyor. Ipuçları kullanımı ile zarar görebilir. Bu durumda, bir Arkansas taşlar ya da eşdeğerini kullanarak uç ayarlayın.
5. Stabbed VNCs Kültür ve Time-lapse kayıt
G9 - 13 - yaşayan VNC, tüm etiketler aksonların bir GFP protein tuzak doğrultusunda aksonal neuropile görselleştirmek için kullanılabilir, ve glial sürücü repoGAL4 UASdsRed ifade etmek için kullanılabilecek bütün glial hücreler (glia orta hat dışında) görselleştirmek S197Y 14 muhabiri. Crossing G9 tarafından UASdsRedS197Y uçar;; repoGAL4 sinekler, döl larva VNCs canlı dokuda kaydedilebilir yeşil akson ve kırmızı glia ile elde edilir.
- Havuzlama 4-5 VNCs sonra, 2 M3 PS ml ve bıçaklama VNC karın yarım ihtiva eden bir temiz boyanması blok transferi 1 VNC olarak bölüm 3'te gösterildiği.
- M3 1 ml içeren Poly-L-Lysin kaplı 3,5 mm cam alt Petri kabı bıçakladı VNC aktarınPS. Aşağı VNCs sırt tarafında yerleştirin. Yavaşça VNC çanak sopa izin forseps bir çift düz tarafı kullanarak VNC itin.
- Yavaşça% 7.5 FBS son konsantrasyon işleme M3 PS% 15 FBS ve 1 ml ekleyin.
- Konfokal mikroskobu lazer kullanarak görüntü elde edin. Onun bütün kalınlığı boyunca bir Z-bölüm dizi toplama, VNC tarayın. Biz bir sıcaklık kontrollü çevre bölmesi ile Leica SP2 ters konfokal mikroskop kullanılır. Herhangi eşdeğer konfokal mikroskop çalışması gerektiğini, ancak tarama ayarlarını optimize gerektirebilir. Aşağıdaki gibi zaman atlamalı konfokal mikroskopi için ayarlar vardı: Çevresel odasının Sıcaklık: 25 ° C; 4 kez zoom 20X objektif; 512x512 piksel çözünürlük ile tarama modu xyzt, z = 1 mikron adımları ve 1 saat veya 2 - saat aralıklarla.
- Leica SP2 konfokal mikroskop tarama için dosya boyutu sınırlaması vardır. Bu ayarlarla, 8-9 zaman noktalarında taranabilir. IleDiğer konfokal mikroskoplar, o yani en fazla 24 saat kadar yayılma üzerinde, uzun süre puan için görüntü yığınlarından elde etmek mümkün olmalı.
6. Bıçaklanmış ve Sabit VNCs Kültür ve İmmun Boyamanın
- Kuyu başına M3 PS 7.5% FBS 500 ul içeren 24 iyi doku kültürü plaka hazırlayın.
- 24 iyi doku kültürü çanak için fazla 24 VNCs diseksiyonu tekrarlayın.
- Ucu kesme ile P20 Pipetman kullanarak, kuyu başına 1 VNC kullanarak, kültür çanak için havuzdan 12 sigara bıçakladı VNCs aktarın.
- Bölüm 3'te tarif edildiği gibi havuz içinde VNCs bir bıçakla kalanı. Bir de her her bıçakladı VNC aktarın.
- Deneye bağlı olarak istenen bir süre için 25 ° C inkübatör içinde 24 oyuklu çanak yerleştirin. Hücre bütünlüğünü en az 24 saat boyunca değişmeden olduğunu.
- Kültür sonra, uç kesme ile P20 Pipetman kullanarak, bir 1.5 ml tüp içinde% 4 formaldehit PEM 250 ul içinde 12 VNCs aktarın. Daha sonra, fixative dikkatle VNCs zarar vermemeye özen üzerinden pipet. Örnekleri karşılamak için sabitleştirici yeterli bir miktar her bir tüp içinde kalmalıdır. Daha sonra, taze fiksatif ekleyin ve hafifçe RT 50 dakika karıştırılır.
- % 0.3 Triton X PBS ile 2 kere yıkayın, sonra oda sıcaklığında% 0.3 Triton X PBS ile 10 dakika süreyle 2 kez yıkayın.
- Oda sıcaklığında 1 saat boyunca% 0.3 Triton X PBS içerisinde% 10 normal keçi serumu ile inkübe edilerek Blok VNCs. Örnekler, en az bir ay için 4 ° C sıcaklıkta saklanabilir.
- 4. en fazla 20 saat için primer antikorlar ile inkübe VNCs ° C.
- Oda sıcaklığında% 0.3 Triton X PBS ile 10 dakika için 3 kere yıkayın, sonra% 0.3 Triton X PBS ile 2 kez yıkayın.
- 4 de daha 16 saat süreyle ikincil antikor ile inkübe VNCs ° C.
- Oda sıcaklığında% 0.3 Triton X PBS ile 10 dakika (floresan ikincil antikorlar kullanılarak eğer karanlıkta) için 3 kere yıkayın, sonra% 0.3 Triton X PBS ile 2 kez yıkayın.
- En azından bir% 50 PBS:% 50 gliserol ile yerine PBSsaat.
- Sonra% 80 gliserol ile değiştirin:% 20 PBS en az bir saat için.
- Bir mikroskop cam slayt üzerine viyolonsel-bant 2 kat (yaklaşık 0,06 mm) yapılan bir pencerede bir VNC monte edin. Yönünü ayarlayın ve pencerenin üzerinde bir lamel (18x18 mm) yerleştirin. İki VNCs Bu yöntemi kullanarak bir slayt üzerine monte edilebilir.
Farklı hücresel yanıtları (hücre sayısı ve hücre şekli örneğin değişiklikler) analiz edilebilir, primer antikorlar çeşitli yaralanma kullanma.
7. ImageJ ve Eklentiler bir Aralığı Kullanarak Veri Analizi
VNC ilgisiz dejenerasyonu bıçaklama yoksa, örnek olsun lezyon boyutu analizi için sayılır olmalıdır. Bıçaklama elle yapıldığı gibi, lezyon boyutu her zaman farklıdır. Böylece istatistiksel olarak mümkün, bıçaklama etkisini analiz etmek önemlidir.
- Boyut ölçümü Yara. Yaranın büyüklüğü onarım 15 bir göstergesidir.Bıçaklama lezyon GFP ifade yoksun olarak görünür. Aşağıdaki gibi lezyon alanı, serbestçe kullanılabilir ImageJ yazılımı kullanılarak veri hızlandırılmış ölçülebilir:
- ImageJ kullanarak, "Dosya" menüsünden konfokal görüntüleri bir yığın açın, "İthalat" ve buradan "Görüntü dizisi" seçeneğini seçin. Bu bir yığın içine bireysel görüntüleri koleksiyonu dönecek.
- Sonraki "Image" menüsüne giderek bir "Hyperstack" içine "yığın" değiştirmek "Hyperstack" seçin, ardından "Hyperstack için Stack" seçeneğini seçin.
- "Image" menüsünden "Özellikler" kullanılarak voksel boyutu ayarlayın. Veriler Leica SP2 konfokal mikroskop kullanılarak elde, voksel boyutu tarama-yazılım elde edilen ve meta metin dosyasından görüntü ile birlikte kaydedilebilir. , Bölüm 3'te anlatılan bizim ayar ile, piksel boyutları xy = 0,366211 mikron ve z = 0,99709 mm'dir.
- Bir zaman noktasında tüm dilimleri inceleyerek, araç çubuğunda çokgen seçim aracını ile lezyon alanının maksimum anahat çizin. Buİlgilenilen Bölge (ROI).
- "Analyze" menüsüne giderek ROI yöneticisine ROI Ekle, aşağı kaydırın ve "Araçlar", ardından "ROI yöneticisi", ardından "Ekle" seçeneğini seçin.
- Her zaman noktaları için bu işlemi tekrarlayın.
- Her bir ROI alanının boyutu elde etmek için ROI yöneticisi "Tedbir" düğmesine tıklayın.
- Time-lapse kayıt sırasında VNC hareketin düzeltilmesi. "Stackreg" ve "Turboreg" plugins 16 (ImageJ web sitesinden http://rsbweb.nih.gov/ij/ ): bu eklentiler zaman atlamalı sırasında küçük bir örnek hareketleri düzeltmek için izin verir. Tüm zaman noktalarında ile eşdeğer bir temsili optik bölümü ile bir yığın oluşturun ve eklentileri geçerlidir. Bu zaman içinde nasıl lezyon değişiklikleri görselleştirmek için yardımcı olur. Bu yöntemler ve kullanım kılavuzu ile ilgili ayrıntıları bu eklentileri geliştirilen araştırma grubu mevcuttur. ( http://bigwww.epfl.ch / Thevenaz / stackreg /).
- Glial hücre sayımı otomatik. "DeadEasy glia" eklentisi ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html ): Bu Drosophila larva VNC içinde REPO-pozitif glial hücre sayısını saymak ve glial değişimi incelemek için geliştirilmiştir numarası yaralanma 17 bıçaklama kaynaklanır. Plug-in 0.1% yanlış pozitif ve% 4,3 yanlış negatifler 17 lik bir hata ile, doğru çalışır. Bu plug-in, ilk etiket anti-REPO antikorlar ile immünofloresan kullanarak numune tüm glia (orta hat dışında) kullanın. Sonra yüklemek eklenti ImageJ yılında, konfokal görüntüleri bir yığın açın ve plug-in çalıştırın. Yaklaşık 30 saniye içinde otomatik olarak glial hücreleri sayar.
- Apoptotik hücre Otomatik sayma. "DeadEasy Kaspaz larva" plug-in ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html) 18: Bu anti-yarılan-Caspase3 etiketli hücre sayısını saymak için geliştirilen ve yeni bir sürüm larva VNCs için adapte edilmiştir. Saplama hasar programlanmış hücre ölümü 11 'de bir artışa neden olur. Kullanmak için bu plug-in anti-yarılan-Kaspaz-3 antikorlar ile immünofloresan kullanarak numunede ilk etiketi apoptotik hücreler. Sonra yüklemek eklenti ImageJ yılında, konfokal görüntüleri bir yığın açın ve plug-in çalıştırın. Yaklaşık 30 saniye içinde otomatik olarak apoptotik hücreleri sayar.
8. Reaktifler
- Kültür ortamı: kalkan ve Sang M3 böcek ortam,% 7.5 fetal bovin serumu,% 1 penisilin ve% 1 streptomisin.
- % 0.01 steril DW Poly-L-Lysin.
- Sabitleme:% 4 formaldehit, PEM Ultra saf (0,1 M BORULAR, 2 mM EGTA, 1 mM MgSO4) çözümü.
- Immun için Engelleme çözüm:% 0.3 Triton X PBS içinde% 10 normal keçi serumu.
- Anti-Glutamin sentetaz2 antikorları: çözümü engelleme 1:250.
- Anti-GFP antikorları: çözümü engelleme 1:1,000.
- Anti-REPO antikorları: çözümü engelleme 1:250.
- Anti-ELAV antikorları: çözümü engelleme 1:250.
- Anti-yarılan Kaspaz 3 antikorları: çözümü engelleme 1:1,000.
- İkincil antikorları: çözümü engelleme 1:250.
Sonuçlar
Burada Drosophila larva VNC bıçaklama yaralanma gerçekleştirmek ve time-lapse kullanarak ve konfokal mikroskopi immün hasara hücresel yanıtları analiz nasıl gösterir.
Time-lapse veriler için, lezyonun G9 aksonal işaretleyici (Şekil 2) taşıyan örneklerin neuropile içinde GFP-negatif alanı olarak görüntülenmiştir. Bıçaklama Kısa bir süre sonra, küçük GFP-negatif alanlar, delikler veya vakuoller gibi, (Şekil 2A) görünmeye başlar. Böyle GFP-negatif alanlarda genellikle (Şekil 2A) bıçaklama sonra 6 ila 8 etrafında saat kadar büyütebilirsiniz. (Şekil 2B) Daha sonra, GFP-negatif alanları küçültmek ve hatta yok olabilir. Bıçaklama sonra 22 saat olarak, yara tarafından işgal edilen alan (Şekil 2A, B) bıçaklama sonra 6-8 saat idi maksimum alanı daha genel olarak daha küçüktür. Benzer şekilde glial süreçlerinde DsRed-negatif bölge başlangıçta da artar, fakat ShrinBıçaklama sonra 22 saat ile ks. İlginçtir, genellikle DsRed pozitif glial süreçleri öncesinde kendi kayboluş (Şekil 2C) için neuropile olarak GFP-negatif delikleri doldurun.
Sabit numuneler, ince glial süreçleri ve yaralanma onların yanıt immun kullanma time-lapse görüntüler ile daha iyi çözünürlük ile görüntülenebilir. Bu, tüm glial hücreler (glia orta hat dışında) görselleştirmek için sinekler bir zar gergin raportör (örneğin, UAS-mCD8GFP) ifade indüklemek için repoGAL4 glial sürücüsü kullanarak, örneğin, gerçekleştirilebilir. Bu, aynı zamanda neuropile ilişkili glial hücreleri (Şekil 3A, B) etiketler anti-GS2 gibi diğer glial belirteçler ile kombine edilebilir. Burada gösteriyor ki ventral sinir kablosu ventral bir göçük (Şekil 3A, ok başları) yaralanma sonucu bıçaklama, dorsal taraftan bıçakladı rağmen. Stabbing daha ciddi neuropile ve neuropile ilişkili glial hücreler inci etkileyecek gibi görünüyorbir yüzey ve korteks glial hücreler (Şekil 3B). Onlar hala kortekste örgüt gibi onların örgü korumak ise glial süreçleri, neuropile içinde dağınık görünür. Döküntü parçaları gibi normal hücrelerden farklı olduğu GS2-pozitif hücre kalıntıları, Yaralanma sonuç çok daha küçük ve bir hücre gövdesi ile bağlı değildir. Bu neuropile ilişkili glial hücreler (Şekil 3B) zarar ortaya koymaktadır. Dejenere neuropile ilişkili glial hücreler ayrıca elektron mikroskobu 15 tarafından gözlenmiştir. Anti-cleaved Kaspaz-3 + apoptoz boyama yaralanmaya bıçaklama üzerine apoptosise maruz gösteren neuropile ilişkili glial hücreleri 15 görülmektedir. Neuropile ilişkili glial hücreler aynı zamanda nöronal artıkları 15 ve GS2 fagosite + sinyal da glial işlemler tarafından apoptotik nöronlarının yutulma açığa olabilir gösterilmiştir. Kaspaz-cleaved + apoptotik hücre ayrıca (en azından Elav + nöronların karşılık bazıları, kortekste gözlenen Şekil 3C).
Sabit örnekleri kullanma ve immün ayrıca proliferasyon ve apoptoz etkileri, yaralanma hücresel yanıtları kantitatif analizleri sağlar. Bunun için, biz bilerek sırasıyla otomatik glial hücreler ve apoptotik hücre sayısını saymak için iki ImageJ eklentileri, DeadEasy Kaspaz Larva ve DeadEasy Glia geliştirdi. Onlar larva VNCs çalışmak doğrulanmış ve çok doğru olarak oylandı. Bu kullanılarak, 22 saat (Şekil 4A), 15, bıçaklama zedelenmesi sonucu REPO-pozitif glial hücre sayısında bir artış görülmesi mümkündür. 6 saat post-bıçaklama (Şekil 4B) 15 tarafından anti-cleaved-Kaspaz-3 apoptotik hücre sayısında bir artış vardır. Drosophila MSS hasarına yanıt olarak glial proliferasyon ve apoptoz tür artış omurgalı MSS yaralanma tepki anımsatır.
Bu pro çok önemli bir yönütokol VNC diseksiyonları kalitesidir. Bu VNCs bağlı olarak hasar ya da yok edilip diseksiyon sırasında anlatmak için zordur. Bu nazik diseksiyonlar gerçekleştirmek için özellikle dikkat çekmek için önemlidir. Ancak, kötü kalite örnekleri kaçınılmaz üretilen, ve bu, daha sonraki aşamalarda tespit ve atılır esastır edilecektir. Bizim ellerde, VNC dejenerasyonu yaralanma ilişkisiz gibi görünen, ancak bunun yerine kaba diseksiyon nedeniyle. Biz yaralanma yara kritik bir boyutu görülmektedir değil, ve biz bozulmamış tüm yaralandı örnekleri analiz. VNCs kendi bütünlüğünü korumak, VNC yüzey düzgün ve parlak bakmak eğilimi gösterir ve neuropile hiçbir delik (Şekil 5A) görülmektedir. VNCs bozulması VNC ventral ve lateral alanlarda (Şekil 5B) ve pürüzlü yüzeyi 24 saat sonrası diseksiyon tarafından kabul edilebilir. Bıçaklama yaralanma ilgisiz neuropile bozulması da oluşabilir ve bu neuropile saat olarak kabul edilmektedirimmunohistokimyasal numunelerin arka sinyal oles. Dejenerasyon bu belirtileri olan numuneler (Şekil 5C) atılmalıdır. Bizim ellerde, diseksiyon ve sağlam ve bıçaklanmış kontrol yaralanma (yw) sinekler için başarı oranı% 70 civarında her ikisi de. Bu oran deneyler yapan kişinin beceri ile değişir ve genotipi ile olacaktır.
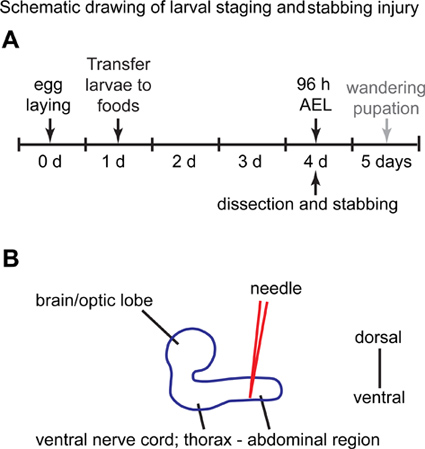
Şekil 1. Şematik çizim larva yaralanma evreleme ve bıçaklama. (A) gün 0 anda, sinekler 3 saat süreyle bir üzüm suyu Petri kabındaki yumurtalarını bırakmak için izin verilir. 1. günde, yumurtadan ilk evre larvalar (L1) toplanır ve onlar başka bir 3 gün boyunca tutulur standart maya besini içeren flakon yerleştirilir. 4. günde, larva gıda şişeden alınır ve bıçaklama deneyler için kullanılır. Larva merkezi sinir sistemi (B) Yanal görünümü.Ventral sinir kablosu karın bölgesi sırt tarafında bir iğne ile bıçaklandı. Anterior sola ve sağa posterior.
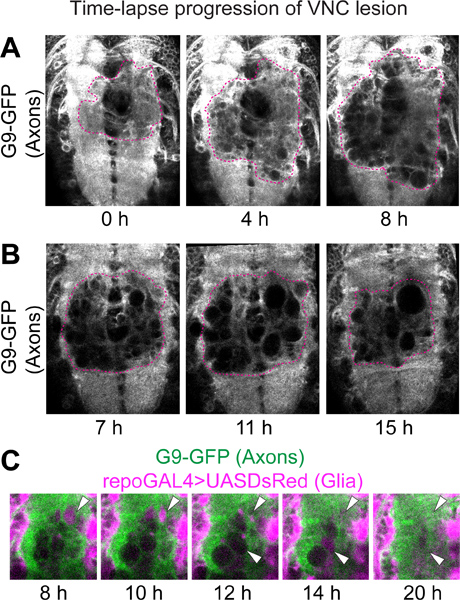
Şekil 2. VNC lezyonun Time-lapse ilerlemesi. GFP etiketli akson ve DsRed-etiketli glial hücreleri ile canlı VNCs üzerine Konfokal mikroskopi. Genotip:. UASDsRed / +; G9 / +; repoGAL4 / + (A) lezyon aksonal neuropile üzerindeki floresan eksikliği tarafından kabul edilmektedir. Bıçakladıktan sonra, GFP-negatif delikleri sonra büyüklükleri ve sayıları artan, görünür. Bıçaklama sonra 9 saat yaralanma bıçaklama sonra her zaman noktasından 5 optik kesit Projeksiyonlar. (B) aksonal neuropile lezyonun. Bu görüntüler yaralanma bıçaklama sonra farklı zaman noktalarında gelen tek optik bölümleridir. Her bir numune içinde eşdeğer pozisyonlarda, adet, aynı dilim numarasını belirlemek için,hızlandırılmış veri yığın kanal zaman noktası olarak seçilmiştir. Karşılaştırarak desenleri bıçaklama etkilenmeyen bölgede G9 ve repoGAL4> UASmCD8GFP görselleştirilir, dilimler Z ekseninde eşdeğer pozisyon olarak doğrulandı. Kesikli çizgiler (A, B) yara kenarına göstermektedir. Neuropile üzerindeki yaraların (c) yüksek büyütme. GFP-negatif delik DsRed pozitif glial süreçleri ile dolu, ve daha sonra (ok başları) kayboldu. Yatay görünüm. Anterior kadar.
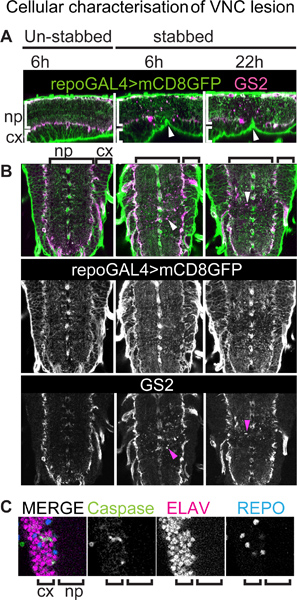
Şekil 3,. VNC lezyon Hücresel karakterizasyonu. Anti-GFP ve anti-GS2 bir neuropile ilişkili glial hücre işaretleyicisi ile boyanmış Tüm glial hücreler (midline glia hariç) bir membran gergin GFP muhabiri taşıyan VNCs. Genotip:. + / +; UASmCD8GFP / +; repoGAL4 / + (A) 'dan VNCs bokböceği vurulmuşsal tarafında, ama bu (ok başları) ventral bir göçük neden olur. Tek optik kesit Sagital görünümü kadar dorsal ve sol ön. (A, B) yaralanma Stabbing korteks ve yüzey glial hücreler daha ciddi neuropile ilişkili glial hücreleri etkiler. Tek optik kesit GS2 pozitif hücresel enkaz Sakatlık sonuçları (B ok başları). (B) Yatay görünüm, anterior kadar. Arrowheads GS2 işaret + hücre döküntüleri. (C) anti-apoptotik işaretleyici yarılan-Kaspaz-3 ve nöronal hasar işaretleyici üzerine kortekste ölen hücrelerin bazı nöronlar olduğunu gösteren anti-Elav arasında Colocalisation. np, neuropile; cx, korteks.
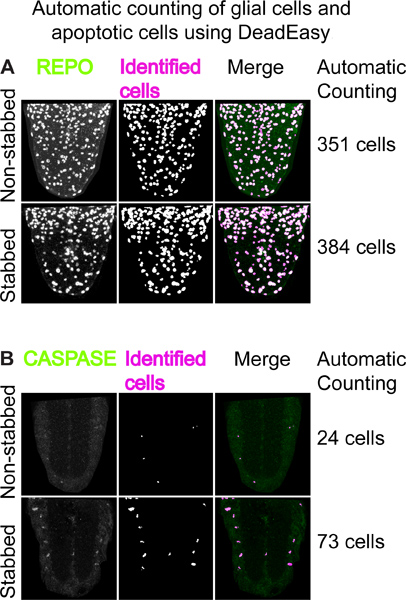
Şekil 4. DeadEasy kullanılarak glial hücreler ve apoptotik hücre otomatik sayma. (A) 'DeadEasy Larvaların glia' kullanılarak Örnek REPO pozitif saymakglial hücreler. Left: anti-REPO antikorları ile boyandı VNC ventral yarıları; orta: eklenti tarafından tanımlanan hücreler gösterilerek DeadEasy Larva glia den çıktılar; sağa: birleştirme. Sağdaki sayılar, yaklaşık 30 saniye içinde optik konfokal bölümlerden oluşan bir yığının bütün olarak otomatik olarak sayılır REPO-pozitif hücrelerin sayısını bulunmaktadır. Bıçakladı VNCs içinde glia artar sayısı. 'DeadEasy Kaspaz larva' kullanarak (B) Örnek. Left: anti-yarılan-kaspaz 3 antikor ile boyandı 5 optik konfokal bölümden projeksiyonlar; ortasında: eklenti tarafından tanımlanan hücreler gösterilerek çıkış; sağ: birleştirme. Sağdaki sayılar, yaklaşık 30 saniye içinde optik konfokal bölümlerden oluşan bir yığının bütün olarak otomatik olarak sayılır kaspaz-pozitif hücrelerin sayısını bulunmaktadır. Apoptotik hücre sayısının bıçakladım VNC de artar.
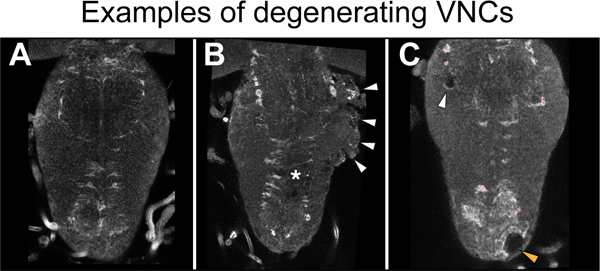
Şekil 5,. Degenerat örnekleriiyon. (A) Sağlıklı bir VNC. Yozlaşma belirtisi vardır. (B) Toraks tarafı bıçakladı örnekte yozlaşan (ok başları) 'dir. Asterisk lezyon yeri gösterir. (C) torasik neuropile (beyaz ok başı) ve korteks (turuncu ok başı) olmayan bir bıçaklanarak VNC içinde delikler. Hasarlı neuropile ve geniş vakuolizasyon ile örnekler atılmalıdır. İşte VNCs neuropile ilişkili glial belirteç anti-Abanoz ile boyandı. Yatay görünüm, anterior kadar.
Tartışmalar
Biz yaralanma, onarım ve yenilenmesi için hücresel yanıtları incelemektir Drosophila larva MSS yaralanması bıçaklama için bir protokol kurduk. Larva VNCs disseke ve zaman atlamalı mikroskopi ile filme veya glia ve nöronlara, apoptoz veya hücre bölünmesi görselleştirmek için floresan immun giderilen sonra, bıçaklandı edilir. Zaman içinde lezyonun ilerleme ölçülebilir. Bu yöntem yaralanması üzerine ve onarım sırasında hücre sayısı değişikliklerin niceliksel ve istatistiksel analiz için kasten geliştirilen yazılım eşlik ediyor.
Biz önce pupa ve daha sonra yetişkin sineğe geçiş 96 saat AEL larvaları (ve bu sabit veya daha da geliştirmek için izin verildi), gelişimsel bir sahne bıçakladı. Onlar Üçüncü dönem sahne ortasında, ve bu nedenle henüz pupa devresi geçiren değildir;; 96 saatte, VNCs bıçaklama için yeterince büyük ve sinir sistemi zaten reklamın buna tam olarak işlevsel benzerULT. Bu biraz daha larva vurmaya mümkün olabilir ve hassas zamanlama araştırma sorusuna uygun seçilmelidir. Ancak, yöneltilen sorulara bağlı olarak, genellikle yaralanma hücresel yanıtları gözlemlemek için bir süre kültür VNCs gerekli olacaktır. 120 saat AEL pupa devresi başlar bir süre sonra, bir süre MSS remodeled ve böylece zaman iyi kaçınılmalıdır. Böylece larva artı kültür bıçaklama için zaman penceresi oldukça sınırlıdır. Larvaları kullanılarak hala yetişkinler kullanarak üzerinde büyük bir teknik avantajı vardır: benzer yetişkin, iken, sinir sistemi hasarına yanıt analiz, zaten larvaları oldukça kolay ve hızlı tamamen işlevsel olmasıdır.
Bir tabak içinde kültür olmadan eşdeğer bir sonraki zaman noktasındaki disseke edilir VNCs bir çanak disseke ve kültüre beyinleri ve VNCs büyüklüğü ve morfolojisi karşılaştırırken, bu gelişme, in vivo daha kültürü yavaş görünür. Diğer açılardan,gelişimi normal kültür, doku bütünlüğü korunur ve hücreler canlı çoklu tepkiler gösteriyor sürdürmektedir. Yara genişleme, neuropile onarım ve glial proliferasyon 22 saat sonrası bıçaklama içinde yer alırlar. Bu yaralanma hücresel yanıtları kültüründe yer alan ve bir gün daha uzun eksplantlar korumak için gerek büyük olasılıkla olduğunu gösterir. Uzun süreli kültür arzu olsaydı, protokol bir kültür plaka ekleme 5 kullanma gibi daha fazla optimizasyon isteyebilir.
Bu yozlaşan olanlardan kaliteli örnekleri tespit etmek önemlidir. Bu protokol Optimize bazı beceri alır ve kaçınılmaz dejenerasyonu bazı örneklerde meydana gelecektir. VNC doku bütünlüğünün bozulmasına (Şekil 5B) yansıtan bir 'karnabahar' görünüm elde edebilirsiniz. Dejenerasyon ayrıca bağımsız olarak VNC dejenerasyon tarafından kabul edilmektedir (Şekil 5C bozulmamış, non-bıçaklandı örneklerde mevcut olabilir ki, bıçaklama ). Bu örnekler atılmalıdır. Dejenerasyon büyük olasılıkla sinirler ve yüzey glia ise koruyucu tabaka gözyaşı kaba diseksiyonu, kaynaklanır. Böylece büyük bir özenle yavaşça incelemek için alınmalıdır. Diğer etkileyen faktörler olarak protokolde belirtilen yıkar ve zamanlara kesinlikle kalarak temiz tutulması ve antibiyotik ile alınmalıdır kültür ortamı, içerir. Sonuç olarak, iğne iğne ve iğne tutucu, boyut ve keskinlik uzunluğu çok önemlidir. Iğne tutucu kültür ortamı bulaşabilen ve künt bir iğne kendini tamir edemez ve yozlaşmaya yol açacak büyük bir yaralanmaya neden olabilir. Bu rutin iğne keskin sürdürmek için önemlidir.
Bu protokol, biz geleneksel gal4-UAS sistemini kullanarak glial süreçlerin görselleştirme paralel neuropile görselleştirmek için sinekler bir protein tuzak çizgi yararlandı. Bu araçlar, aynı zamanda, Le gibi diğer ikili ifade sistemleri ile birleştirilebilirgal4 bağımsız xA 19 ve Q-sistemi 20,. Bu hasarına yanıt olarak, akson ve glial süreçler arasında örneğin etkileşimlerin analizine olanak sağlayacak. Ayrıca, bu tür dendritler 21 veya kalsiyum girişini 22 gazetecilere gibi diğer genetik araçlar ile birleştirerek, bu yöntem glial hücreler, nöron akson ve MSS dendritlerin yaralanma tepki arkasındaki hücre biyolojisi analiz için büyük bir fırsat sağlar. Son olarak, bu yöntem yaralanma ve rejenerasyon yanıtları gen işlevi sınamak için, standart genetik mutasyonlar ve gen aşırı ekspresyonu ile kombine edilebilir.
Bu protokol başarıyla MSS yaralanması 11 rejeneratif glial yanıtı yatan bir gen ağının keşfine yol açmıştır. Bu hücresel olayları ve meyve sinekleri gen fonksiyonları çözülüyor, gen fonksiyonu evrimsel korunması göz önüne alındığında ma anlayışı hakkında önemli bilgiler sağlamak için muhtemeldiryaralanma ve rejenerasyon mmalian CNS yanıtı.
Açıklamalar
Herhangi bir çıkar çatışması ilan etti.
Teşekkürler
Biz yazının eleştirel okuma ve bu çalışmanın kurs boyunca yaptıkları tartışmalar için laboratuvar diğer üyeleri için Mei Ann Lim ederim. Bu çalışma Yamada Bilim Vakfı ve Royal Society Kısa ziyaret Burslar ve KK AB Marie Curie Uluslararası Gelen Bursu GRR ve BBSRC Projesi Hibe (BB/H002278/1) ve Wellcome Trust Ekipman Hibe (073228/Z/03/Z) tarafından finanse edilmiştir AH
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ekipman | |||
| Blok Boyama | Brunel Mikroskop | ||
| Forseps No: 5 | örneğin Güzel Bilim Araçları | örneğin 11251-20 | |
| Tungsten iğne: çubuk çapı 0.5 mm; ucu boyutu, 1 mikron, uzunluğu, 2 inç | Roboz Cerrahi Alet | RS-6065 | |
| İğne tutucu | Roboz Cerrahi Alet | RS-6060 | |
| Arkansans taşlar: Dumont Forseps için Tamir Takımı | Güzel Bilim Araçları | 29000-00 | |
| 27 mm cam taban 35 mm Petri kabı | Iwaki | 3930-035 | |
| Çevre odası ile Leica SP2 AOBS konfokal inverted mikroskop | Leica | ||
| Reaktif | |||
| Shield ve Sang M3 böcek orta (ecdysone ücretsiz) | Sigma | S3652-500 ml'lik | |
| Penisilin ve streptomisin | Invitrogen | 15070-063 | |
| Fosfat tamponlu tuz (PBS) | 12 Bkz | ||
| FBS | Sigma | F7524 | |
| Poli-L-Lysin | Sigma | P1399-25mg | |
| Formaldehit,% 10, metanol ücretsiz, Ultra Saf | Polysciences | 04018-1 | |
| Fare anti-glutamin sentetaz antikor | Millipore | MAB302 | |
| Tavşan anti-GFP antikorlarının | Life teknolojileri | A11122 | |
| Fare anti-antikorlar REPO | Gelişim Çalışmaları Hibridoma bankası | 8D12 | |
| Sıçan anti-antikorlar ELAV | Gelişim Çalışmaları Hibridoma bankası | 7E8A10 | |
| Tavşan anti-aktif kaspaz 3 antikorlarının | Abcam | ab13847 | |
| Normal keçi serumu | Vektör Laboratuvarları | S-1000 | |
| Anti-tavşan Alexa Fluor 488 | Life teknolojileri | A11034 | |
| Anti-fare Alexa Fluor 647 | Life teknolojileri | A21236 | |
| Anti-sıçan Alexa Fluor 647 | Life teknolojileri | A21247 |
Referanslar
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Curr. Biol. 22, 590-595 (2012).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J. Cell Biol. 191, 211-223 (2010).
- Leyssen, M., et al. Amyloid precursor protein promotes post-developmental neurite arborization in the Drosophila brain. EMBO J. 24, 2944-2955 (2005).
- Kato, K., Awasaki, T., Ito, K. Neuronal programmed cell death induces glial cell division in the adult Drosophila brain. Development. 136, 51-59 (2009).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J. Neurosci. 28, 6010-6021 (2008).
- Rohrbough, J., O'Dowd, D. K., Baines, R. A., Broadie, K. Cellular bases of behavioral plasticity: establishing and modifying synaptic circuits in the Drosophila genetic system. J. Neurobiol. 54, 254-271 (2003).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr. Biol. 19, 799-806 (2009).
- Gomez-Marin, A., Louis, M. Active sensation during orientation behavior in the Drosophila larva: more sense than luck. Curr. Opin. Neurobiol. 22, 208-215 (2012).
- Schleyer, M., et al. A behavior-based circuit model of how outcome expectations organize learned behavior in larval Drosophila. Learn Mem. 18, 639-653 (2011).
- Brown, H. L., Cherbas, L., Cherbas, P., Truman, J. W. Use of time-lapse imaging and dominant negative receptors to dissect the steroid receptor control of neuronal remodeling in Drosophila. Development. 133, 275-285 (2006).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by pros-notch and pros-NFkappaB feedback. PLoS Biol. 9, e1001133 (2011).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 98, 15050-15055 (2001).
- Verkhusha, V. V., et al. An enhanced mutant of red fluorescent protein DsRed for double labeling and developmental timer of neural fiber bundle formation. J. Biol. Chem. 276, 29621-29624 (2001).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by Pros-Notch and Pros-NFkB feedback. PLoS Biol. 9, e1001133 (2011).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7, 27-41 (1998).
- Forero, M. G., Kato, K., Hidalgo, A. Automatic cell counting in vivo in the larval nervous system of Drosophila. J. Microsc. 46, 202-212 (2012).
- Forero, M. G., Pennack, J. A., Learte, A. R., Hidalgo, A. DeadEasy caspase: automatic counting of apoptotic cells in Drosophila. PLoS One. 4, e5441 (2009).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141, 536-548 (2010).
- Nicolai, L. J., et al. Genetically encoded dendritic marker sheds light on neuronal connectivity in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107, 20553-20558 (2010).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır