Method Article
Eine Verletzung Paradigm Central Nervous System Repair in Untersuchen
In diesem Artikel
Zusammenfassung
Eine Verletzung Paradigma mit der Drosophila Larve Bauchmark des zentralen Nervensystems Regeneration und Reparatur zu untersuchen beschrieben. Stabbing gefolgt von Laser-Scanning-konfokalen Mikroskopie im Zeitraffer und festen Proben mit quantitativen Analyse mit gezielt entwickelten Software und Genetik kombiniert werden verwendet, um die molekularen Mechanismen der ZNS-Regeneration und Reparatur zu untersuchen.
Zusammenfassung
Eine experimentelle Methode wurde entwickelt, um die zellulären Reaktionen des zentralen Nervensystems (ZNS) Verletzungen mit dem Obst-Drosophila zu untersuchen. Understanding Reparatur und Regeneration bei Tieren ist eine zentrale Frage in der Biologie. Die beschädigten menschlichen ZNS nicht regenerieren, und das Verständnis, wie die Regeneration zu fördern ist eines der wichtigsten Ziele der medizinischen Neurowissenschaft. Die leistungsfähige genetische Toolkit von Drosophila können verwendet werden, um das Problem der ZNS-Regeneration anzugehen.
Eine Läsion des ZNS Bauchmark (VNC, entspricht der Wirbeltiere Rückenmark) wird manuell mit einer Wolfram-Nadel angewendet. Der VNC kann nachträglich in Zeitraffer gefilmt werden mittels Laserabtastung Konfokalmikroskopie für bis zu 24 h, um die Entwicklung der Läsion mit der Zeit folgen. Alternativ kann sie kultiviert werden, dann fixiert und gefärbt mittels Immunfluoreszenz zu Neuron und Gliazellen mit konfokaler Mikroskopie visualisiert. Mit geeigneten Marker, changes der Zellmorphologie und Zellzustand als Folge von Verletzungen visualisiert werden. Mit ImageJ und absichtlich entwickelte Plug-Ins können quantitative und statistische Analysen durchgeführt werden, um Veränderungen in der Größe der Wunde über die Zeit und die Auswirkungen von Verletzungen in der Zellproliferation und Zelltod zu messen. Diese Methoden erlauben die Analyse großer Probenmengen. Sie können mit den leistungsfähigen Genetik von Drosophila, die molekularen Mechanismen, die ZNS-Regeneration und Reparatur zu untersuchen kombiniert werden.
Einleitung
Regeneration in Tieren zeigt, dass Zellen, wenn Organismuswachstum trägt und vollständig zu erfassen, und wie strukturelle Integrität eines Organismus erreicht und aufrechterhalten wird. Das Verständnis dieser geheimnisvollen Fähigkeiten der Zellen ist von großem Interesse in der Biologie. Förderung der Regeneration ist eines der wichtigsten Ziele für die medizinische Neurowissenschaften. Beim Menschen ist die beschädigte zentralen Nervensystems (CNS) nicht regenerieren. Nagermodellen von Rückenmarksverletzungen werden verwendet, um zu verstehen, wie Zellen, um Verletzungen zu reagieren. Allerdings beschränken ethische Bedenken, hohe Kosten und die langsame Lebenszyklus der Tiere Fortschritt.
Die Frucht-Fliege Drosophila ist ein weit verbreitetes Modell-Organismus in der Entwicklungsbiologie und Neurowissenschaften. Aufgrund ihrer starken genetischen Werkzeuge und kurze Lebensdauer hat Drosophila wiederkehrend zur Entdeckung von Genfunktionen und Netzwerke mit Relevanz für die Verständigung von Menschen und Krankheit geführt. Es gibt reichlich Beweise für evolutionäre conErhaltung der Genfunktion von Fliegen auf den Menschen.
In den letzten Jahren haben mehrere Paradigmen für Nervensystems Verletzungen in Drosophila etabliert. Einige bestehen beschädigen peripheren Nerven, die sich entlang dem Flügel oder Axotomie von peripheren Nerven, einschließlich sensorischer 1 und Motor 2 ausgeführt Axone. Allerdings unterscheiden sich die peripheren und zentralen Nervensystem in vielerlei Hinsicht, und es ist bekannt, dass bei vielen Tieren das periphere Nervensystem können, während das ZNS nicht regenerieren kann. So, um ZNS-Regeneration, eine direkte Schädigung des ZNS zu verstehen ist besser geeignet. Stabbing Verletzungen mit einer Nadel wurde erfolgreich an den Drosophila erwachsenen Gehirn angewendet, um die Reaktion auf eine Verletzung 3,4 untersuchen. Mit einem anderen Ansatz, analysiert Ayaz et al. Durchtrennt CNS Axone in kultivierten adulten Gehirn mit einem Piezo Macht Microdissector, und ihre Regeneration für 4 Tage 5. Der Vorteil dieser späteren experimentellen ups ist, dass sie auf das Gehirn, die zweifellos von großem Interesse zu konzentrieren. Der Nachteil ist, dass das Gehirn viel komplexer als die VNC, die nur mit motorischen und sensorischen Kontrolle befasst ist. Arbeiten an der erwachsenen Gehirn ist auch zeitaufwendig. Die Larve ist bereit für Experimente in 4 Tagen, während es etwa 10 Tage für Erwachsene Schlüpfen dauert, und dann weitere 5 Tage für ihre Reifung. Das erwachsene Gehirn ist auch schwieriger zu handhaben, weil es in dicken Kutikula, die schwer zu entfernen ist gekapselt ist. Der VNC hat den weiteren Attraktion ist funktional äquivalent zu der Wirbeltiere Rückenmark.
Die Drosophila Larve wird weithin als ein Modell für Neurowissenschaften 6-9 verwendet. Obwohl streng genommen die Larve ist in einer Aufbauphase, kann es auch als ein voll funktionsfähiges tierischen werden. Die Larve hat Fortbewegung, mehrere Sinne wie Riechen, Schmecken und Nozizeption und Lernen und Gedächtnis. Somit ist die Larven VNC wwie das ideale Modell für ZNS-Verletzung gewählt.
Larven und Puppen VNCs können seziert und in Schale kultiviert werden, aber behalten zelluläre Integrität für bis zu 24 Std. 10. Dies deutete darauf hin, dass eine Verletzung der VNC, die dann im Zeitraffer könnte werden in diesem Zeitraum von der Zeit aufgezeichnet oder kultiviert und zu einem beliebigen Zeitpunkt innerhalb dieser Zeitspanne festgelegt angewandt werden könnte.
Hier präsentieren wir ein experimentelles Paradigma für die ZNS-Verletzung mit der Drosophila Larve VNC. Der VNC wird zunächst aus der Larve seziert, und Stichwaffen Verletzungen wird manuell mit einer Wolfram-Nadel angewendet. Der VNC wird dann auf einem Glasboden-Deckglas gelegt, und filmte mit Zeitraffer-Laser-Scanning-konfokalen Mikroskopie. Alternativ können die VNCs für eine gewünschte Zeitdauer kultiviert werden, und die zellulären Wirkungen von Verletzung kann in festen Proben mittels Immunfärbung und konfokale Mikroskopie analysiert. Der Wundbereich kann gemessen werden, und die quantitative Analyse von Zell-number (Zellproliferation und Zelltod) kann mit gezielt entwickelten Software durchgeführt werden. Große Fallzahlen leicht gehandhabt werden kann, was statistisch validierte Ergebnisse. Diese Methoden wurden erfolgreich mit den leistungsstarken Genetik von Drosophila zu einem Gen-Netzwerk zugrunde liegenden Gliazellen regenerative Reaktion auf ZNS-Verletzung 11 entdecken.
Protokoll
Ein. Sammlung von Inszenierte Larven
- Platz 15 weiblichen und 15 männlichen erwachsenen Fliegen in einem zylindrischen Plexiglas Käfig Eier auf einer Petrischale lag mit Agar und Traubensaft mit einer kleinen Schaufel von Hefe für 3 Stunden bei 25 ° C fügen ergänzt Ändern Sie die Platte 3-4 mal am Tag, und entsorgen Sie die erste Platte (dh von der O / N Ei-lay). Entsorgen Sie auch die Platten vom ersten Tag an. Ab dem zweiten Tag auf, halten die Platten mit Eiern bei 25 ° C. Nach 7 Tagen Eier sammeln, mit einen neuen Schnitt der Muttergesellschaft Fliegen eingestellt starten.
- Nach ca. 24 h, Larven schlüpfen aus den Eiern. Durch Einhaken Larven mit einem ausgedünnten Pinsel oder mit einer Pinzette, übertragen 35 Larven aus der Traube Agar einem Fläschchen mit Standard-fly Speisen (10 ml) (Abbildung 1A).
- Pflegen Sie die Fläschchen mit Larven für 3 Tage (96 Stunden nach der Eiablage, AEL) bei 25 ° C.
2. Dissektion der Larven Ventral Nervenstränge für Kultur
- Sauber seinnch und Hände mit 70% Ethanol. Soak 4 Färbung Blöcke, 2 Paar Pinzette und eine Nadel mit 70% Ethanol und Luft trocknen lassen.
- Bereiten Sie 4 Färbung Blöcke mit den folgenden Medien: ein mit destilliertem Wasser (DW) zu reinigen und zu Pool gereinigt Larven, eine zweite mit 2 ml Shield und Sang M3 Insekten Medium mit 1% Penicillin und Streptomycin, Ecdysone-free (M3 PS mittel), um die Larven zu sezieren, eine dritte mit 2 ml M3 PS mittel Pool seziert ventral Nervenstränge (VNCs) und ein Viertel mit 2 ml M3 PS Medium zu erstechen die VNCs. Alle Reagenzien müssen RT vorgewärmt werden.
- Fügen Sie Wasser in die Durchstechflasche mit 96 hr AEL Larven. Dann wurde unter Verwendung eines Spatels, sanft verteilen Lebensmittel mit Larven aus dem Fläschchen auf einen feuchten Papiertuch. Übertragen 10 Larven zu einer Färbung Block mit DW abzuwaschen das Essen. Ersetzen DW 6 mal. Dann mit M3 PS Medium zu ersetzen.
- Übertragen eines der Larven zu einer Färbung Block mit 2 ml M3 PS Medium.
- Unter einem Binokular, dissect eine larvalen Gehirn sorgfältig mit Standardmethoden 12, aber um eine Gewebebeschädigung zu minimieren, indem besondere Sorgfalt walten ausgehend in der folgenden Weise. Legen Sie die Larve dorsalen Seite nach oben und halten Sie die Dorsalseite bei einem Drittel von dem vorderen Ende mit 2 Paar Pinzette (einen in jeder Hand). Während Sie die vorderen Abschnitt, ziehen Sie das hintere Ende mit der Zange, und reißen die Epidermis. Das Gehirn und das VNC sichtbar sein soll von der hinteren Kante der vorderen Hälfte. Sorgfältig trennen das Gehirn und das VNC-Komplex durch Entfernen der fetten Körper, Darm und Epidermis. Wenn die VNCs zu stark beschädigt ist, wird die VNCs ganz oder teilweise degenerierten auch ohne stechende Verletzungen. Berücksichtigen Sie die folgenden Punkte:
- Ziehen oder reißen die Imaginalscheiben und peripheren Nerven aus dem Thorax VNC, da dies die VNC beschädigt wird. Um die peripheren Nerven geschnitten, halten die peripheren Nerven mit zwei Paar Pinzette nahe einander gelegt, und ziehen Sie dann die Nerven mit dem fürSteinpilze. Imaginalscheiben und Mund Teile links an der VNC werden.
- Lassen Sie den Ring Verschraubung und Lymphknoten an das Gehirn.
- Schneiden Sie das gut an dem Punkt am nächsten an das Gehirn, wo nicht viel Nahrung enthalten ist.
- Durch die Verwendung eines P20 Pipetman mit der Spitze abgeschnitten und weiteten sich ein wenig, übertragen Sie die VNC zu einer Färbung Block mit frischem M3 PS Medium. Bevor Sie die VNC, erste Pipette nach oben und unten nur das Medium für die Dissektion verwendet, um den VNC vom Kleben an der Spitze zu verhindern.
3. Stabbing Verletzung der Drosophila Larven VNC
Dieser Abschnitt beschreibt, wie stechende Verletzungen der VNCs durchzuführen und erstochen-VNCs für Zeitraffer-Analyse und Immunfärbung vorzubereiten. Post-stechende Kulturbedingungen und Dauer werden in Abschnitt 5 (für Zeitraffer-Analyse) und in Abschnitt 6 (für Immunfärbung) beschrieben.
- Nach Zusammenlegung genug VNCs (4-5 für Zeitraffer-und über 24 für Immunfärbung), Transfer ein VNC auf eine saubere Färbung Block mit M3 PS.
- Richten Sie die VNC so dass die dorsale Neuropil ist im Hinblick unter dem Binokular (Abbildung 1B). Dies ist die natürliche Orientierung für VNCs in, wenn sie den optischen Loben angebracht liegen.
- Stab manuell mit einem Wolfram-Nadel unter die Dissektionsmikroskop, von dorsal nahezu im rechten Winkel und mit dem Ziel für die abdominale Hälfte des VNC (Abbildung 1B).
Achten Sie besonders auf die folgenden:
- Stab nur einmal.
- Stab bis die Nadel trifft den Boden des Glases. Aber seien Sie vorsichtig nicht die Nadelspitze zu beschädigen.
- Der Stamm des Nadelhalters nicht berühren darf das Medium während Stechen.
- Die Wunde ist nicht unter der Dissektionsmikroskop sichtbar.
Hinweis: Stab-Verletzungen unabhängigen Degeneration
Das Verfahrenin Zelldegeneration innerhalb der VNC unterscheidet sich von der stechenden Läsion führen. Degeneration führt zu Löchern in der Neuropil und gelegentlich Löcher in der Rinde von nicht erstochen Proben beobachtet. Proben mit Degeneration, die die Neuropil oder verbreitet Degeneration beeinflussen auch die VNC Oberfläche muss verworfen werden. Degeneration kann wie folgt ermittelt werden:
- Raue Oberfläche, vor allem an der seitlichen / ventralen Bereich des Thorax, bei 22 h Stechen. In extremen Fällen sieht das VNC hervor.
- Löcher oder Vakuolen in der Brust Neuropil, die sichtbar sein als Löcher im Hintergrund Signal mit Fluoreszenz-Immunfärbung können.
4. Wartung von Nadel und Pinzette
- Prüfen Sie regelmäßig, ob die Nadelspitze scharf genug ist. Die Nadelspitze kann verbogen oder stumpf nachdem es ihn für einige Experimente. In diesem Fall, schärfen die Spitze mit einem Arkansas Stein oder gleichwertig.
- Die Spitzen der Zange musserfüllen perfekt. Die Spitzen können mit der Verwendung beschädigt werden. In diesem Fall stellen die Spitze mit einem Arkansas-Steine oder gleichwertig.
5. Kultur und Zeitraffer-Aufnahme von Erstochen VNCs
G9 - 13 - um das axonale Neuropil im lebenden VNC, ein GFP-Protein, das alle Trapline Axone markiert visualisieren kann verwendet werden, und um alle Gliazellen (außer der Mittellinie Glia) visualisieren die gliale Fahrer repoGAL4 verwendet werden können, um die UASdsRed exprimieren S197Y 14 Reporter. Durch Kreuzung G9 fliegt UASdsRedS197Y;; repoGAL4 Fliegen, VNCs von Nachkommen Larven werden mit grünen Axone und rot Gliazellen, die im lebenden Gewebe aufgenommen werden kann, erhalten.
- Nach Pooling 4-5 VNCs, Transfer 1 VNC auf eine saubere Färbung Block mit 2 ml M3 PS, und stechen die Bauch Hälfte des VNC, wie in Abschnitt 3.
- Übertragen Sie die erstochen VNC auf eine Poly-L-Lysin beschichteten 3,5 mm Glasboden Petrischale mit 1 ml M3PS. Legen Sie die VNCs dorsalen Seite nach unten. Schieben Sie die VNC mit der flachen Seite eines Pinzette, damit der VNC auf dem Teller kleben.
- Vorsichtig 1 ml M3 PS 15% FBS Rendern der endgültigen Konzentration von FBS auf 7,5%.
- Erwerben Sie Bilder mit konfokaler Laser-Scanning-Mikroskopie. Scannen Sie den VNC, Sammeln einer Z-Profil-Serie über seine gesamte Dicke. Wir verwendeten ein Leica SP2 invertierten konfokalen Mikroskops mit einem temperaturgeregelten Klimakammer. Einer äquivalenten konfokalen Mikroskop sollte funktionieren, aber es kann verlangen, Optimierung der Einstellungen für das Scannen. Die Einstellungen für unsere Zeitraffer-Konfokalmikroskopie waren wie folgt: Temperatur der Klimakammer: 25 ° C; 20X-Objektiv mit 4-fach Zoom, Scan-Modus xyzt mit 512x512 Pixel Auflösung, z = 1 um Schritte und 1-Stunde oder 2 - Stunden-Intervallen.
- Die Leica SP2 konfokalen Mikroskop hat eine Begrenzung der Dateigröße für das Scannen. Mit diesen Einstellungen können 8-9 Zeitpunkten abgetastet werden. Mitanderen konfokalen Mikroskopen, sollte es möglich sein, Bildstapeln für längere Zeit Punkte zu erwerben, dh über den Zeitraum von bis zu 24 Stunden.
6. Kultur und Immunfärbung von erstochen und behoben VNCs
- Bereiten Sie eine 24-Well-Zellkultur Platte mit 500 ul M3 PS 7,5% FBS pro Vertiefung.
- Wiederholen Dissektion von mehr als 24 VNCs für eine 24-Well-Gewebekulturplatte.
- Durch die Verwendung des P20 Pipetman mit der Spitze abgeschnitten, übertragen 12 nicht erstochen VNCs aus dem Pool der Kulturschale mit 1 VNC pro Vertiefung.
- Stab der Rest VNCs im Pool wie in Kapitel 3 beschrieben. Übertragen Sie jede erstochen VNC zu einem gut jeder.
- Legen Sie die 24-Well-Platte in der 25 ° C-Inkubator für eine gewünschte Dauer je nach Experiment. Integrität der Zelle unverändert ist für mindestens 24 Stunden.
- Nach Kultur übertragen die 12 VNCs in 250 ul 4% Formaldehyd PEM in einer 1,5-ml-Tube mit dem P20 Pipetman mit der Spitze abgeschnitten. Dann wird die fixative wird vorsichtig aus, pipettiert dabei nicht um die VNCs beschädigen. Eine kleine Menge an Fixiermittel ausreicht, um die Proben abdecken sollte in jedem Rohr verbleiben. Anschließend fügen Sie frisches Fixativ, und sanft für 50 min bei RT rühren.
- Spülen 2 mal mit 0,3% Triton X PBS, und dann waschen 2 mal für 10 min mit 0,3% Triton X PBS bei RT.
- Block VNCs durch Inkubation mit 10% normalem Ziegenserum in 0,3% Triton X PBS für 1 h bei RT. Die Proben können bei 4 ° C für mindestens einen Monat gelagert werden.
- Inkubieren VNCs mit primären Antikörper für mehr als 20 Stunden bei 4 ° C.
- Spülen 2 mal mit 0,3% Triton X PBS, dann waschen 3 mal für 10 min mit 0,3% Triton X PBS bei RT.
- Inkubieren VNCs mit sekundärem Antikörper für mehr als 16 Stunden bei 4 ° C.
- Spülen 2 mal mit 0,3% Triton X PBS, dann waschen 3 mal für 10 min mit 0,3% Triton X PBS bei Raumtemperatur RT (im Dunkeln, wenn unter Verwendung von fluoreszierenden Sekundärantikörper).
- Ersetzen PBS mit 50% Glycerin 50% PBS für mindestens einStunde.
- Dann mit 80% Glycerin ersetzen: 20% PBS für mindestens eine Stunde.
- Montieren Sie einen VNC in einem Fenster auf 2 Lagen Cello-Band (ca. 0,06 mm) auf einem Mikroskopie Objektträger aus Glas gemacht. Passen Sie die Ausrichtung, und legen Sie eine Deckglas (18x18 mm) über dem Fenster. Zwei VNCs kann auf einer Folie mit dieser Methode angebracht sein.
Mit einer Vielzahl von primären Antikörpern, um Verletzungen zu verschiedenen zellulären Reaktionen analysiert werden (z. B. Änderungen der Zellzahl und Zellform) werden.
7. Analysieren von Daten mit ImageJ und eine Reihe von Plugins
Wenn der VNC keinen stechenden unabhängigen Degeneration, muss die Probe in der Analyse unabhängig von Größe der Läsion gezählt werden. Als stechende manuell durchgeführt wird, unterscheidet sich die Größe der Läsion jeder Zeit. Somit ist es wichtig, eine statistische Analyse der Wirkung stechend, wann immer möglich.
- Wundgröße Messung. Die Größe der Wunde ist ein Indikator für Reparatur 15.Der stechende Läsion sichtbar ist frei von GFP-Expression. Läsion Bereich kann lapse Daten über frei verfügbare ImageJ-Software gemessen werden, wie folgt:
- Mit ImageJ, öffnen Sie einen Stapel der konfokalen Bilder von "File"-Menü wählen Sie "Import" und wählen Sie hier "Image-Sequenz". Dadurch wird die Ansammlung von einzelnen Bildern in einem Stapel drehen.
- Weiter ändern Sie die "Stack" in einen "HyperStack", indem Sie auf "Image" Menü "HyperStack", und wählen Sie dann "Stapel zu HyperStack".
- Stellen Sie die Voxelgröße mit "Eigenschaften" aus Menü "Bild". Im gewonnenen Daten unter Verwendung des konfokalen Mikroskops Leica SP2 kann der Voxelgröße vom Scanning-Software erhalten werden, und aus den Metadaten Textdatei zusammen mit Bildern gespeichert. Mit unserer Einstellung, wie in Abschnitt 3 beschrieben, sind Pixelmaße xy = 0,366211 um und z = 0,99709 um.
- Durch die Untersuchung alle Scheiben in einem Zeitpunkt, ziehen Sie die maximale Kontur der Läsion mit dem Polygon-Werkzeug in der Werkzeugleiste. Dies ist derRegion Of Interest (ROI).
- Fügen Sie den ROI der ROI-Manager, indem Sie auf "Analyze"-Menü, scrollen Sie nach unten und wählen Sie "Extras", dann "ROI-Manager", dann auf "Hinzufügen".
- Wiederholen Sie diesen Vorgang für die alle Zeitpunkte.
- Klicken Sie auf das "Measure"-Button in der ROI-Manager, um den Bereich Größe der einzelnen ROI zu erzielen.
- Korrektur der VNC Bewegung während Zeitraffer-Aufnahmen. "Stackreg" und "Turboreg" plugins 16 (aus dem ImageJ Website http://rsbweb.nih.gov/ij/ ): Diese Plugins ermöglichen kleine Probe Bewegungen während Zeitraffer korrigieren. Bauen Sie einen Stapel mit einem gleichwertigen Vertreter optischer Schnitt durch alle Zeit-Punkten und wendet die Plugins. Es hilft, wie die Läsion Veränderungen im Laufe der Zeit zu visualisieren. Die Details zu diesen Methoden und die Bedienungsanleitung sind von der Arbeitsgruppe, die diese Plugins entwickelt. ( http://bigwww.epfl.ch / Thevenaz / stackreg /).
- Automatische Zählung von Gliazellen. "DeadEasy Glia" plugin ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html ): Diese wurde entwickelt, um die Anzahl der REPO-positive Gliazellen im Drosophila Larven VNC zu zählen und die Veränderung der Gliazellen zu untersuchen Zahl durch stechende Verletzungen 17 verursacht. Das Plug-in arbeitet präzise, mit einem Fehler von 0,1% falsch-positiven und falsch-negativen 4,3% 17. So verwenden Sie dieses Plug-in, first-Label alle Glia (außer der Mittellinie) in der Probe mittels Immunfluoreszenz mit anti-REPO Antikörper. Dann installieren Sie das Plug-in in ImageJ, öffnen Sie einen Stapel von konfokalen Bildern und Plug-in. Es zählt Gliazellen automatisch in etwa 30 Sekunden.
- Automatisches Zählen von apoptotischen Zellen. "DeadEasy Caspase Larven" plug-in ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html) 18: Dieses wurde entwickelt, um die Anzahl der Zellen mit anti-gespalten Caspase3-markiertem zu zählen, und eine neue Version wurde für die Larven VNCs angepasst. Stechende Schädigung bewirkt eine Erhöhung der programmierten Zelltod 11. So verwenden Sie dieses Plug-in, first-Label apoptotischen Zellen in der Probe mittels Immunfluoreszenz mit anti-gespaltenen-Caspase-3-Antikörper. Dann installieren Sie das Plug-in in ImageJ, öffnen Sie einen Stapel von konfokalen Bildern und Plug-in. Es zählt apoptotischen Zellen automatisch in etwa 30 Sekunden.
8. Reagenzien
- Kulturmedium: Schild und Sang M3 Insektenmedium, 7,5% fötalem Rinderserum, 1% Penicillin-Streptomycin und 1%.
- 0,01% Poly-L-Lysin in sterilem DW.
- Fixative: 4% Formaldehyd, Reinstwasser in PEM (0,1 M PIPES, 2 mM EGTA, 1 mM MgSO 4) Lösung.
- Blocking Lösung für Immunfärbung: 10% normalem Ziegenserum in 0,3% Triton X PBS.
- Anti-Glutamin Synthetase2-Antikörper: 1:250 in Blocking-Lösung.
- Anti-GFP-Antikörper: 1:1.000 in Blockierungslösung.
- Anti-REPO Antikörper: 1:250 in Blocking-Lösung.
- Anti-ELAV Antikörper: 1:250 in Blocking-Lösung.
- Anti-gespaltenen Caspase 3 Antikörper: 1:1000 in Blocking-Lösung.
- Sekundärantikörper: 1:250 in Blocking-Lösung.
Ergebnisse
Hier zeigen wir, wie stechende Verletzung der Drosophila Larve VNC durchführen und analysieren die zellulären Reaktionen auf Verletzungen mit Zeitraffer-und Immunfärbung konfokalen Fluoreszenzmikroskopie.
Für Zeitraffer-Daten ist der Läsion visualisiert als GFP-negativen Bereich innerhalb des Neuropil von Proben mit dem G9 axonalen Marker (Abbildung 2). Kurz nach Stechen, kleine GFP-negative Bereiche, die wie Löcher oder Vakuolen aussehen, beginnen zu erscheinen (Abbildung 2A). Solche GFP-negative Bereiche allgemein Vergrößern bis zu etwa 6 bis 8 Stunden nach Stechen (Abbildung 2A). Anschließend schrumpfen die GFP-negativer Bereiche und kann sogar verschwinden (2B). Von 22 h nach stechend, ist der Bereich von der Wunde besetzt Allgemeinen kleiner als der maximale Bereich war bei 6 bis 8 Stunden nach stechende (2A, B). Auch die DsRed-negativen Bereich in Gliazellen Prozessen steigt zunächst auch, aber Schwindks von 22 Stunden nach Stechen. Interessanterweise füllen oft DsRed-positiven glialen verarbeitet die GFP-negativer Löcher im Neuropil vor ihrem Verschwinden (2C).
Mit Immunfärbung in festen Proben, feine Gliazellen und deren Reaktion auf eine Verletzung kann mit einer besseren Auflösung als mit Zeitraffer-Bilder visualisiert werden. Dies kann getan werden, zum Beispiel unter Verwendung des repoGAL4 glialen Fahrer die Expression einer Membran gebundene Reporter (zB UAS-mCD8GFP) in Fliegen alle Gliazellen (außer der Mittellinie Glia) visualisieren induzieren. Dies kann auch mit anderen glialen Marker, wie zB Anti-GS2, welche Neuropil-assoziierten Gliazellen (3A, B) beschriftet kombiniert werden. Hier zeigen wir, dass obwohl die Bauchmark wird von dorsal erstochen, stechende Verletzungen führt zu einer dent ventral (3A, Pfeilspitzen). Stabbing scheint stärker auf die Neuropil und Neuropil-assoziierten Gliazellen theine Oberfläche und Cortex Gliazellen (Abbildung 3B). Gliazellen Prozesse erscheinen im Neuropil desorganisiert, während sie behalten noch ihre netzartige Organisation in der Hirnrinde. Verletzung die GS2-positiven Zelltrümmern, die sich von normalen Zellen als Fremdkörper Fragmente ist viel kleiner sind und nicht mit einer Zelle verbunden ist. Dies offenbart Beschädigung Neuropil-assoziierten Gliazellen (Abbildung 3B). Degenerierenden Neuropil-assoziierten Gliazellen wurden auch durch Elektronenmikroskopie 15 beobachtet. Anti-gespaltenen-Caspase 3 + Apoptose Färbung wird in Neuropil-assoziierten Gliazellen 15 beobachtet, zeigt sie Apoptose nach Messerstecherei Verletzungen. Neuropil zugehörigen Gliazellen erwiesen sich ebenfalls phagozytieren neuronalen Debris 15 und GS2 +-Signal könnten auch offenbaren die engulfment apoptotischer Neuronen durch glialen Prozesse. -Caspase gespalten + apoptotische Zellen sind auch im Cortex beobachtet, wobei zumindest einige davon an Elav + Neuronen entsprechen ( 3C).
Mit festen Proben und Immunfärbung ermöglicht auch quantitative Analysen der zellulären Reaktionen auf Verletzungen, wie Effekte in Proliferation und Apoptose. Dafür haben wir gezielt entwickelte zwei ImageJ Plug-Ins, DeadEasy Caspase Larva und DeadEasy Glia, um automatisch die Anzahl der Gliazellen und apoptotischen Zellen. Sie wurden validiert auf Larven VNCs arbeiten und sind sehr genau. Mit diesen ist es möglich, eine Zunahme in der Anzahl der REPO-positiven Gliazellen durch stechende verursachten Schädigung von 22 h (Abb. 4A) 15 zu beobachten. Es gibt auch eine Erhöhung der Anzahl von Anti-gespaltenen-Caspase-3 apoptotischen Zellen durch 6 h nach der stechende (4B) 15. Solche Erhöhung glialen Proliferation und Apoptose in Reaktion auf eine Verletzung im ZNS Drosophila erinnert an die Schädigung Reaktion in den Wirbeltier-ZNS.
Ein wesentlicher Aspekt dieses ProProtokoll ist die Qualität des VNC Dissektionen. Es ist schwierig, bei der Dissektion, ob die VNCs beschädigt wurden oder nicht in dem Prozess zu berichten. Es ist wichtig, besonders darauf achten zu sanften Dissektionen durchzuführen. Allerdings wird schlechter Qualität unweigerlich Proben hergestellt werden, und es ist wesentlich, dass diese in einem späteren Stadium erkannt und verworfen. In unseren Händen, erscheint VNC-Degeneration in keinem Zusammenhang mit Verletzungen, sondern durch grobe Dissektion verursacht. Wir haben nicht eine kritische Größe in der Verletzung Wunde beobachtet, und wir analysieren alle verletzt Proben, die nicht abgebaut werden. Wenn VNCs ihre Integrität aufrecht zu erhalten, neigt das VNC Oberfläche zu schauen glatt und glänzend, und keine Löcher in der Neuropil beobachtet werden (Abbildung 5A). Abbau von VNCs kann 24 Stunden post-Dissektion von der rauen Oberfläche der VNC ventralen und lateralen Bereich (5B) erkannt werden. Abbau des Neuropil unabhängig von stechenden Verletzung kann auch auftreten, und es ist als Neuropil h anerkanntoles im Hintergrund Signal immungefärbten Proben. Proben mit diesen Anzeichen von Degeneration muss verworfen (5C) werden. In unseren Händen, sind die Erfolgsrate für die Präparation und Verletzungen in intakten und stach Steuerung (yw) fliegt beide rund 70%. Dieser Satz wird mit der Fähigkeit der Person Durchführung der Experimente variieren, und mit dem Genotyp.
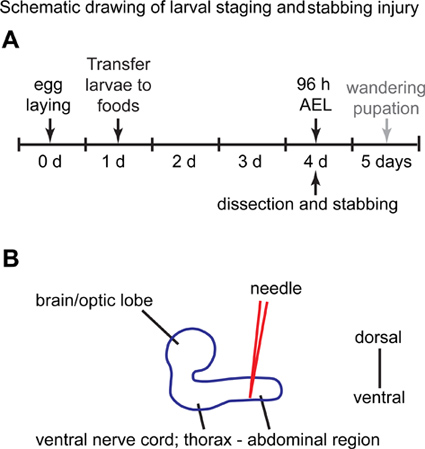
Abbildung 1. Schematische Darstellung der Larven Staging-und Stichwaffen Verletzungen. (A) am Tag 0, Fliegen dürfen Eier in einem Traubensaft Petrischale lag für 3 Stunden. Am Tag 1, der schraffierte erste Larvenstadium (L1) werden gesammelt und in Fläschchen mit Standard-Hefenahrung, wo sie für weitere 3 Tage aufbewahrt werden. Am Tag 4, Larven von Lebensmitteln Fläschchen gesammelt und verwendet für die stechenden Experimente. (B) Seitenansicht der Larven des zentralen Nervensystems.Die Bauchregion des Bauchmark ist mit einer Nadel von der dorsalen Seite gestochen. Anterioren ist nach links, und posterioren nach rechts.
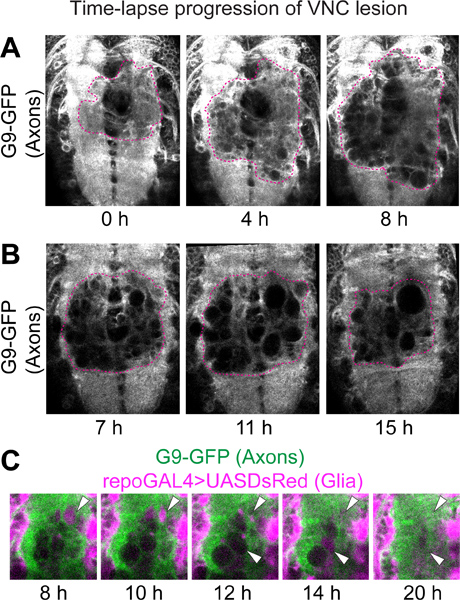
Abbildung 2. Zeitraffer-Progression von VNC Läsion. Konfokale Mikroskopie auf Live VNCs mit GFP-markierten Axone und DsRed-markierten Gliazellen. Genotyp:. UASDsRed / +; G9 / +; repoGAL4 / + (A) Die Läsion wird durch das Fehlen von Fluoreszenz auf der axonalen Neuropil erfasst. Nach stechende, erscheinen GFP-negativer Löcher, danach Erhöhung in Größe und Anzahl. Projektionen von 5 optische Schnitte von jedem Zeitpunkt nach der Messerstecherei Verletzungen. (B) Die axonale Neuropil Läsion schrumpft von 9 Stunden nach Stechen. Diese Bilder sind einzigen optischen Abschnitte aus verschiedenen Zeitpunkten nach stechende Verletzung. Um gleichwertige Positionen in jeder Probe die gleiche Scheibe aus ea identifizierench Zeitpunkt in dem Stapel von Zeitraffer-Daten ausgewählt wurde. Durch den Vergleich der Muster mit G9-und repoGAL4> UASmCD8GFP visualisiert im Bereich nicht durch die stechende betroffen waren, wurden die Scheiben als von vergleichbaren Positionen in der Z-Achse überprüft. Die gestrichelten Linien in (A, B) geben den Rand der Wunde. (C) Hohe Vergrößerung von Wunden auf der Neuropil. GFP-negativer Löcher wurden mit DsRed-positiven glialen Verfahren gefüllt und anschließend verschwunden (Pfeilspitzen). Horizontale Ansicht. Anterior up.
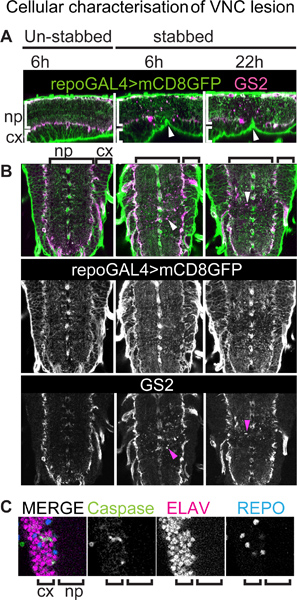
Abbildung 3. Charakterisierung der zellulären VNC Läsion. VNCs tragenden eine Membran gebundene GFP-Reporter für alle Gliazellen (außer Mittellinie Glia) mit Anti-GFP und Anti-GS2, ein Neuropil-assoziierten Gliazelle Marker angefärbt. Genotyp:. + / +; UASmCD8GFP / +; repoGAL4 / + (A) wurden aus dem VNCs dor erstochensal Seite, aber dies verursacht eine Delle ventral (Pfeilspitzen). Sagittale Ansicht von einzelnen optischen Schnitte, dorsalen und vorderen linken. (A, B) Stabbing Schädigung wirkt stärker Neuropil-assoziierten Gliazellen als Cortex und Oberfläche Gliazellen. Verletzung die GS2-positive Zelltrümmern (Pfeilspitzen in B). (B) Horizontale Ansicht der einzelnen optischen Schnitten, anterior up. Pfeilspitzen zeigen auf GS2 + Zelltrümmer. (C) Kolokalisation der apoptotischen Marker Anti-gespaltenen-Caspase-3 und den neuronalen Marker Anti-Elav zeigt, dass bei einigen der Schädigung sterbenden Zellen in der Hirnrinde Neuronen sind. np, Neuropil; cx, Kortex.
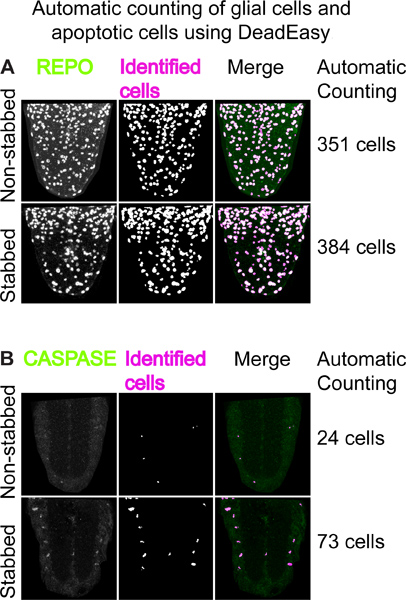
Abbildung 4. Automatische Zählung von Gliazellen und apoptotischen Zellen mit DeadEasy. (A) Beispiel für die Verwendung "DeadEasy Larven Gliazellen 'zu zählen REPO positiveGliazellen. Links: VNC ventrale Hälften mit anti-REPO Antikörpern gefärbt, Mitte: Ausgabe von DeadEasy Larven Glia zeigt Zellen durch das Plug-in identifiziert; rechts: verschmelzen. Die Zahlen auf der rechten Seite sind die Anzahl der REPO-positive Zellen automatisch in einem ganzen Stapel von optischen konfokale Schnitte in etwa 30 Sekunden gezählt. Die Anzahl der Erhöhungen der Glia erstochen VNCs. (B) Beispiel des Verwendens 'DeadEasy Caspase Larve'. Links: Projektionen von 5 optische konfokale Schnitte mit Anti-gespaltenen-Caspase-3 Antikörpern gefärbt, Mitte: Ausgang zeigt Zellen durch das Plug-in identifiziert; rechts: verschmelzen. Die Zahlen auf der rechten Seite sind die Anzahl der CASPASE-positive Zellen automatisch in einem ganzen Stapel von optischen konfokale Schnitte in etwa 30 Sekunden gezählt. Die Zahl der apoptotischen Zellen erhöht im erstochen VNC.
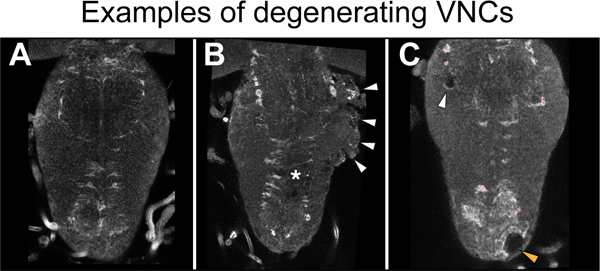
Abbildung 5. Beispiele degeneratIon. (A) Eine gesunde VNC. Es gibt keine Anzeichen von Degeneration. (B) Die Seite des Thorax degenerieren (Pfeilspitzen) in einem erstochen Probe. Sternchen zeigt Läsionsstelle. (C) Löcher in der thorakalen Neuropil (weiß Pfeilspitze) und Cortex (orange Pfeilspitze) in einer nicht-erstochen VNC. Proben mit beschädigten Neuropil und umfangreiche Vakuolisierung muss verworfen werden. Hier VNCs wurden mit dem Neuropil zugehörigen Gliazellen Marker anti-Ebony gefärbt. Horizontale Ansicht, anterior up.
Diskussion
Wir haben ein Protokoll für stechende Verletzungen der Drosophila Larve CNS, um die zellulären Reaktionen auf Verletzungen, Reparatur und Regeneration zu erforschen. Larven VNCs werden seziert und stach, nach denen sie mit Zeitraffer-Mikroskopie gefilmt oder fest für Fluoreszenz-Immunfärbung zu Gliazellen und Neuronen, Apoptose oder die Zellteilung zu visualisieren. Das Fortschreiten der Läsion im Laufe der Zeit gemessen werden kann. Diese Methode wird von absichtlich entwickelte Software für die quantitative und statistische Analyse von Zell-Zahl ändert sich auf Verletzungen und während der Reparatur begleitet.
Wir erstochen 96-Stunden AEL Larven (und diese wurden entweder fest oder erlaubt weiter zu entwickeln), ein Entwicklungsstadium vor dem Übergang zur Puppe und dann erwachsenen Fliege. Bei 96 Stunden sind VNCs groß genug für stechende, sie sind in der Mitte des dritten Larvenstadium Bühne, und somit nicht unterziehen Verpuppung noch nicht, und das Nervensystem ist bereits voll funktionsfähig ähnlich der AnzeigeUlt. Es könnte möglich sein, stab etwas später in Larven und der genaue Zeitpunkt zu wählen, um die Fragestellung angepasst werden. Jedoch in Abhängigkeit von den Fragen angesprochen, wird es im Allgemeinen notwendig sein, um die Kultur VNCs für einige Zeit, um die zellulären Reaktionen auf Verletzungen beobachten. Einige Zeit nach 120 Stunden AEL Verpuppung beginnt, eine Zeit, wenn die CNS umgebaut ist und somit am besten vermieden werden. So das Zeitfenster für stechende und Kultur in der Larve ist eher beschränkt. Verwendung Larven noch ein großer technischer Vorteil gegenüber der Verwendung Erwachsenen: während, ähnlich zu dem erwachsenen, ist das Nervensystem bereits voll funktionsfähig ist, Analysieren der Reaktion auf eine Verletzung ist wesentlich einfacher und schneller in Larven.
Beim Vergleich der Größe und Morphologie der Gehirne und VNCs seziert und in einer Schale zu VNCs die bei einer äquivalenten späteren Zeitpunkt ohne Kultivieren in einer Schale seziert kultiviert werden, scheint es, dass die Entwicklung in Kultur ist langsamer als in vivo. In anderer HinsichtEntwicklung führt auf normal in der Kultur-, Gewebe-Integrität gewahrt ist und die Zellen werden lebendig zeigt mehrere Antworten. Wound Expansion Neuropil Reparatur-und Gliazellen Verbreitung erfolgt innerhalb von 22 Stunden nach dem Stechen. Dies zeigt, dass die zellulären Reaktionen auf Verletzungen stattfinden in Kultur und es ist sehr wahrscheinlich keine Notwendigkeit, die Explantate für länger als einen Tag aufrecht zu erhalten. Wenn längerfristige Kultur wurden gewünscht, kann das Protokoll erfordern weitere Optimierung wie die Verwendung einer Kultur Wiegeplatteneinlage 5.
Es ist wichtig, um eine gute Qualität Proben aus den degenerierenden diejenigen zu identifizieren. Optimierung dieses Protokoll dauert etwas Geschick und zwangsläufig Degeneration wird in einigen Proben auftreten. Der VNC erwerben kann ein "Blumenkohl" Erscheinung, die einen Zusammenbruch des Gewebes Integrität (5B) widerspiegelt. Degeneration wird auch durch die Vakuolisierung des VNC unabhängig erkannte das Stechen, das kann in intakte, nicht erstochen Proben (5C ). Diese Proben müssen verworfen werden. Degeneration wird höchstwahrscheinlich durch grobe Dissektion, die Nerven und die Schutzschicht der Oberfläche Glia reißen kann verursacht werden. So große Sorge muß genommen, um sanft zu sezieren werden. Weitere Einflussfaktoren sind die Kulturmedium, das sauber gehalten werden müssen, und mit Antibiotika, strikter den Wäschen und Timings wie in dem Protokoll angegeben ist. Schließlich sind die Länge der Nadel und Nadelhalter, Größe und Schärfe der Nadel sehr wichtig. Der Nadelhalter kontaminieren kann das Kulturmedium und eine stumpfe Nadel kann eine große Verletzung, die nicht repariert werden können selbst an und wird zu einer Degeneration führen verursachen. Es ist wichtig, die Nadel zu halten routinemäßig scharf.
In diesem Protokoll, nutzten wir ein Protein Trapline von Fliegen, die Neuropil parallel zur Visualisierung von Gliazellen Prozesse mit Hilfe des traditionellen GAL4-UAS-System visualisieren. Diese Werkzeuge könnte auch mit anderen binären Expressionssysteme wie der Le kombiniert werdenxA 19 und Q-System 20, die unabhängig von GAL4 sind. Dies würde es der Analyse der Wechselwirkungen beispielsweise zwischen Axonen und glialen Prozessen, in Reaktion auf eine Verletzung. Durch weitere Kombination mit anderen genetischen Werkzeugen wie Reporter für Dendriten 21 oder Calcium-Einstrom 22, bietet diese Methode eine große Chance, um die Zelle Biologie hinter der Verletzung Antwort von Gliazellen, neuronale Axone und Dendriten im ZNS zu analysieren. Schließlich kann dieses Verfahren mit Standard Genetik, Mutationen und Überexpression von Genen kombiniert werden, um Genfunktion in Reaktion auf Verletzung und Regeneration zu testen.
Dieses Protokoll wurde erfolgreich zur Entdeckung eines Gens zugrundeliegenden Netzwerks regenerative glialen Reaktion auf ZNS-Verletzung 11 geführt. Angesichts der evolutionären Konservierung von Genfunktionen, entwirren diese zellulären Ereignissen und Genfunktionen in Fruchtfliegen voraussichtlich erhebliche Einblicke in das Verständnis der ma liefernmmalian CNS Reaktion auf Verletzungen und Regeneration.
Offenlegungen
Kein Interessenkonflikt erklärt.
Danksagungen
Wir danken Mei Ann Lim für die kritische Durchsicht des Manuskripts und anderen Mitgliedern unserer Labor für ihre Beratungen im Laufe dieser Arbeit. Diese Arbeit wurde von Yamada Science Foundation und der Royal Society Short Visit Stipendien und EU Marie Curie International Incoming Fellowship GRR nach KK und BBSRC Project Grant (BB/H002278/1) und Wellcome Trust Ausrüstung Grant (073228/Z/03/Z) finanziert AH
Materialien
| Name | Company | Catalog Number | Comments |
| Ausrüstung | |||
| Färbung Block | Brunel Mikroskop | ||
| Pinzetten Nr. 5 | zB Fine Science Tools | zB 11251-20 | |
| Wolframnadel: Stangendurchmesser, 0,5 mm; Größe der Spitze, 1 um; Länge, 2 Zoll | Roboz Surgical Instrument | RS-6065 | |
| Nadelhalter | Roboz Surgical Instrument | RS-6060 | |
| Arkansans Steine: Repair Kit für Dumont Pinzetten | Fine Science Tools | 29000-00 | |
| 35 mm Petrischale mit 27 mm Glasboden | Iwaki | 3930-035 | |
| Leica SP2-AOBS konfokalen inversen Mikroskop mit Klimakammer | Leica | ||
| Reagens | |||
| Schild und Sang M3 Insekten Medium (Ecdyson kostenlos) | Sigma | S3652-500 ml | |
| Penicillin und Streptomycin | Invitrogen | 15070-063 | |
| Phosphat-gepufferte Salzlösung (PBS) | Siehe 12 | ||
| FBS | Sigma | F7524 | |
| Poly-L-Lysin | Sigma | P1399-25mg | |
| Formaldehyd, 10%, Methanol frei, Ultra Pure | Polysciences | 04018-1 | |
| Mouse anti-Glutaminsynthetase Antikörper | Millipore | MAB302 | |
| Rabbit anti-GFP Antikörper | Life Technologies | A11122 | |
| Mouse anti-REPO Antikörper | Developmental Studies Hybridoma Bank | 8D12 | |
| Ratte-anti-ELAV Antikörper | Developmental Studies Hybridoma Bank | 7E8A10 | |
| Rabbit anti-aktive Caspase 3-Antikörper | Abcam | ab13847 | |
| Normalem Ziegenserum | Vector Laboratories | S-1000 | |
| Anti-Kaninchen-Alexa Fluor 488 | Life Technologies | A11034 | |
| Anti-Maus Alexa Fluor 647 | Life-Technologien | A21236 | |
| Anti-Ratte Alexa Fluor 647 | Life Technologies | A21247 |
Referenzen
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Curr. Biol. 22, 590-595 (2012).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J. Cell Biol. 191, 211-223 (2010).
- Leyssen, M., et al. Amyloid precursor protein promotes post-developmental neurite arborization in the Drosophila brain. EMBO J. 24, 2944-2955 (2005).
- Kato, K., Awasaki, T., Ito, K. Neuronal programmed cell death induces glial cell division in the adult Drosophila brain. Development. 136, 51-59 (2009).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J. Neurosci. 28, 6010-6021 (2008).
- Rohrbough, J., O'Dowd, D. K., Baines, R. A., Broadie, K. Cellular bases of behavioral plasticity: establishing and modifying synaptic circuits in the Drosophila genetic system. J. Neurobiol. 54, 254-271 (2003).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr. Biol. 19, 799-806 (2009).
- Gomez-Marin, A., Louis, M. Active sensation during orientation behavior in the Drosophila larva: more sense than luck. Curr. Opin. Neurobiol. 22, 208-215 (2012).
- Schleyer, M., et al. A behavior-based circuit model of how outcome expectations organize learned behavior in larval Drosophila. Learn Mem. 18, 639-653 (2011).
- Brown, H. L., Cherbas, L., Cherbas, P., Truman, J. W. Use of time-lapse imaging and dominant negative receptors to dissect the steroid receptor control of neuronal remodeling in Drosophila. Development. 133, 275-285 (2006).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by pros-notch and pros-NFkappaB feedback. PLoS Biol. 9, e1001133 (2011).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 98, 15050-15055 (2001).
- Verkhusha, V. V., et al. An enhanced mutant of red fluorescent protein DsRed for double labeling and developmental timer of neural fiber bundle formation. J. Biol. Chem. 276, 29621-29624 (2001).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by Pros-Notch and Pros-NFkB feedback. PLoS Biol. 9, e1001133 (2011).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7, 27-41 (1998).
- Forero, M. G., Kato, K., Hidalgo, A. Automatic cell counting in vivo in the larval nervous system of Drosophila. J. Microsc. 46, 202-212 (2012).
- Forero, M. G., Pennack, J. A., Learte, A. R., Hidalgo, A. DeadEasy caspase: automatic counting of apoptotic cells in Drosophila. PLoS One. 4, e5441 (2009).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141, 536-548 (2010).
- Nicolai, L. J., et al. Genetically encoded dendritic marker sheds light on neuronal connectivity in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107, 20553-20558 (2010).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten