Method Article
Травма Paradigm по расследованию центральной нервной системы в ремонт
В этой статье
Резюме
Травмы парадигмы использования Drosophila личиночной брюшной нервной расследовать центральной нервной системы регенерации и ремонта описаны. Stabbing последующей лазерной сканирующей конфокальной микроскопии в замедленной и фиксированного образца, в сочетании с количественным анализом с целенаправленно разработанного программного обеспечения и генетики, используются для изучения молекулярных механизмов центральной нервной системы регенерации и репарации.
Аннотация
Экспериментальный метод был разработан для исследования клеточных реакций на центральную нервную систему (ЦНС), травмы помощью плодовой мушки дрозофилы. Ремонт взаимопонимании и регенерации у животных, является ключевым вопросом в биологии. Поврежденной центральной нервной системы человека не регенерирует, и понимание того, как способствовать регенерации является одной из главных целей медицинской неврологии. Мощный генетический инструментарий Drosophila может быть использован для решения проблемы регенерации ЦНС.
Поражение в ЦНС брюшной нервной (VNC, что эквивалентно позвоночных спинного мозга) наносится вручную с вольфрамовой иглой. VNC впоследствии может быть снят в замедленной помощью лазерной сканирующей конфокальной микроскопии в течение 24 часов следить за развитием поражения с течением времени. Кроме того, он может быть культурным, а затем фиксировали и окрашивали использованием иммунофлюоресценции для визуализации нейронов и глиальных клеток с конфокальной микроскопии. Используя соответствующие маркеры, чаnges в морфологии клеток и их состояния в результате травмы могут быть визуализированы. С ImageJ и специально разработанные плагины, количественный и статистический анализ может быть выполнен для измерения изменений в рану размером с течением времени и последствий травм в клеточной пролиферации и гибели клеток. Эти методы позволяют анализировать большие размеры образца. Они могут быть объединены с мощными генетике дрозофилы исследовать молекулярные механизмы, лежащие в основе CNS регенерации и репарации.
Введение
Регенерация у животных показывают, что клетки чувствуют, когда организм роста заказать и полный, и как структурную целостность организма достигается и поддерживается. Понимание этих загадочных способностей клеток представляет большой интерес в биологии. Содействие регенерации является одной из ключевых целей для медицинских нейронаук. У людей, поврежденных центральной нервной системы (ЦНС), не восстанавливаются. Грызун модели травмы спинного мозга используются понять, как клетки реагируют на травмы. Тем не менее, этические проблемы, высокая стоимость и медленный цикл жизни животных сдерживать прогресс.
Плодовой мушки Drosophila широко используется модель организма в биологии развития и нейронауки. Благодаря своей мощной генетических инструментов и короткий жизненный цикл, Drosophila была в очередной привели к открытию гена функций и генных сетей, имеющих отношение к пониманию человека и болезни. Существует множество доказательств эволюционного консохранения функции гена от мух до человека.
За последние годы несколько парадигм для нервной системы травмы были созданы в дрозофилы. Некоторые состоят из повреждения периферических нервов, которые расположены вдоль крыла или аксотомии периферических нервов, в том числе сенсорные 1 и двигатель аксонов 2. Тем не менее, периферической и центральной нервной системы отличаются во многих отношениях, и это хорошо известно, что у многих животных периферическая нервная система может восстанавливаться в то время как в ЦНС не может. Таким образом, чтобы понять, центральной нервной системы регенерации, прямой ущерб в ЦНС является более целесообразным. Stabbing травмы иглой была успешно применена к мозгу взрослого Drosophila расследовать ответ на повреждение 3,4. Используя другой подход, Аяз и соавт. Разорвал ЦНС аксоны в культуре мозг взрослого с Piezo власти microdissector, и проанализировал их регенерации в течение 4 дней 5. Преимущество этих более поздних экспериментальной установки иPS то, что они сосредоточены на мозг, который, несомненно, представляет большой интерес. Недостатком является то, что мозг является гораздо более сложным, чем VNC, которая имеет дело только с двигателем и сенсорное управление. Работа на мозг взрослого человека также является более трудоемким. Личинка готов для экспериментов в 4 дня, в то время как она занимает около 10 дней для вылета имаго, а затем еще 5 дней для их созревания. Взрослом мозге также более трудно справиться, потому что она заключена в толстой кутикулой, которые трудно удалить. VNC имеет дальнейшего привлечения быть функционально эквивалентны позвоночных спинного мозга.
Личинки дрозофилы широко используется в качестве модельного организма для неврологии 6-9. Хотя, строго говоря личинка находится в стадии развития, она также может считаться полностью функциональный животных. Личинка имеет передвижения, в том числе несколько чувства обоняния, вкуса и ноцицепции и обучения и памяти. Таким образом, личиночных VNC Wкак выбрано в качестве идеальной модели для травм ЦНС.
Личинки и куколки VNCs можно разрезать и культивировали в блюдо, сохраняя целостность сотовых до 24 ч 10. Это предполагает, что травмы могли быть применены к VNC, которые затем могут быть записаны в замедленной за этот период времени, или культивировать и фиксируется на любой желаемый момент времени, в течение этого периода.
Здесь мы приводим экспериментальные парадигмы ЦНС травмы использованием Drosophila личиночной VNC. VNC сначала расчлененный от личинки, и колоть травма наносится вручную с вольфрамовой иглой. VNC помещается на стеклянным дном покровное, и снимали с покадровой лазерной сканирующей конфокальной микроскопии. Кроме того, VNCs может быть культивировали в течение требуемого периода времени, и сотовые последствия травмы могут быть проанализированы в фиксированных экземпляров использовании иммуноокрашивания и конфокальной микроскопии. Области раны могут быть измерены, и количественный анализ клеточного нюmber (клеточной пролиферации и гибели клеток) может быть осуществлено с специально разработанного программного обеспечения. Большие размеры образца может быть легко обрабатывается, в результате статистически подтверждено результатами. Эти методы были успешно сочетается с мощным генетике дрозофилы, чтобы обнаружить ген сети, лежащей в основе глиальных регенеративного ответа на ЦНС травмы 11.
протокол
1. Коллекция Постановка Личинки
- Место 15 женщин и 15 мужчин взрослых мух в цилиндрической клетке Perspex, чтобы отложить яйца на чашку Петри с агаром и виноградный сок дополнен небольшим шариком дрожжей вставьте в течение 3 часов при 25 ° C. Изменение пластины 3-4 раза в день, и отказаться от первой пластинки (т.е. с O / N яйцо-Lay). Откажитесь также пластин с первого дня. Со второго дня, держать пластины с яйца при температуре 25 ° C. Через 7 дней после сбора яиц, начните с новым набором из родителей мух.
- После примерно 24 часов, личинки вылупляются из яиц. При вызовах личинок с разбавленной кистью или с парой щипцов, передавать 35 личинок из винограда агара в пробирку, содержащую стандартную пищу муха (10 мл) (рис. 1А).
- Поддерживать флаконах, содержащих личинки в течение 3 дней (96 часов после откладки яиц, AEL) при 25 ° C.
2. Препарирование личинок брюшной нервные стволы по культуре
- Очистите бытьNCH и руки с 70% этанола. Замочить 4 окрашивание блоков, 2 пары щипцов и иглы с 70% этанола, и пусть воздух сухой.
- Подготовка 4-х блоков окрашивания с помощью следующих средств: один с дистиллированной водой (DW) для очистки и бассейн очищается личинок; вторая с 2 мл Щит и пели M3 насекомых среду с 1% пенициллина и стрептомицина, Ecdysone-Free (M3 PS среды), чтобы анализировать личинки, третий с 2 мл M3 PS среднего бассейна расчлененный вентральные нервные стволы (VNCs), а четвертое с 2 мл среды M3 PS ударить VNCs. Все реактивы должны быть предварительно нагревают до комнатной температуры.
- Добавить воду в пробирку, содержащую 96 часов AEL личинок. Затем с помощью шпателя, мягко распространяться пищи с личинками из флакона на влажное бумажное полотенце. Передача 10 личинок на окрашивание блок, содержащий DW смыть пищу. Заменить DW 6 раз. Затем заменить со средним M3 PS.
- Передача одной из личинок окрашивания блок, содержащий 2 мл среды M3 PS.
- Под микроскопом рассечение, диssect личиночной мозга, тщательно используя стандартные методы 12, но чтобы свести к минимуму повреждение тканей, проявлять особую осторожность, исходя следующим образом. Поместите стороне личинки спины, и держать спинной стороны на уровне одной трети от переднего конца 2 пары щипцов (по одному в каждой руке). Удерживая переднюю секцию, вырваться на заднем конце с щипцами, и разрыв эпидермиса. Мозг и VNC должна быть видна от заднего края передней половине. Тщательно изолировать мозг и VNC комплекса путем удаления жира в организме, кишечника и эпидермиса. Когда VNCs поврежден слишком сильно, VNCs выродится полностью или частично даже без колющие травмы. Примите во внимание следующие моменты:
- Не тяните и не рвите имагинальных дисков и периферических нервов от грудных VNC, так как это может привести к повреждению VNC. Чтобы сократить периферических нервов, удерживая периферических нервов с двумя парами щипцов расположены близко друг к другу, а потом потрепать нервы с побелые грибы. Имагинальные диски и рот части можно оставить прикреплены к VNC.
- Оставьте железы кольцо и лимфатические железы прикреплены к мозгу.
- Сокращение кишечника в точке ближе к мозгу, где не так много еды содержится.
- С помощью P20 Pipetman с наконечником отрезать и слегка расширились, передает VNC для окрашивания блок, содержащий свежую M3 PS среды. Перед передачей VNC, в первую пипетки вверх и вниз только среда, используемая для вскрытия в целях предотвращения VNC от прилипания к концу.
3. Stabbing Травма личинок дрозофилы VNC
В этом разделе описывается, как выполнять колющие повреждения VNCs, и подготовить ножом-VNCs для покадровой анализа и иммуноокрашивания. После колоть культура условия и продолжительность описаны в разделе 5 (для покадровой анализ) и в разделе 6 (для иммуноокрашивания).
- После объединения достаточно VNCs (4-5 для покадровойи более 24 для иммуноокрашивания), передаточной VNC на чистый блок окрашивания содержащие M3 PS.
- Orient VNC так, что спинной нейропиле является в силу в соответствии с рассекает микроскопом (рис. 1б). Это самая естественная ориентация на VNCs лежать в при подключении к оптическим долях.
- Stab вручную с помощью вольфрамовой иглы под микроскопом рассечение, со спинной стороны практически под прямым углом, и стремясь к брюшной половины VNC (рис. 1б).
Обратите особое внимание на следующее:
- Stab только один раз.
- Stab, пока игла не попадает в нижнюю часть стекла. Однако, будьте осторожны, чтобы не повредить кончик иглы.
- Стебель держатель иглы не должен касаться среды во время поножовщины.
- Рана не видно под микроскопом рассечение.
Примечание: Stab травмы связаны вырождения
Процедураможет привести к сотовой дегенерацией в VNC отличие от колющих поражения. Вырождение результатов в отверстия в нейропиле, а иногда и дыры были обнаружены в коре головного мозга не-ножом образца. Образцы с вырождением, влияющие на нейропиле или распространение дегенерации влияет также на поверхности VNC должна быть отброшена. Вырождение могут быть определены следующим образом:
- Грубая поверхность, особенно при боковом / вентральной области грудной клетки, в 22 ч ножом. В крайнем случае, VNC выглядит торчали.
- Отверстия или вакуолей в грудной нейропиле, которые могут быть видны как отверстия в фоновый сигнал с флуоресцентной иммуноокрашивания.
4. Поддержание иглы и пинцет
- Регулярно проверяйте ли кончик иглы является достаточно острым. Иглы могут быть согнуты или тупой после ее использования в течение нескольких экспериментов. В этом случае, резкость кончик использованием каменных Арканзасе или эквивалент.
- Кончики пинцета должнывстретиться отлично. Советы могут быть повреждены при использовании. В этом случае, установите кончик использованием Арканзас камней или эквивалент.
5. Культура и покадровой записи из Ножом VNCs
Для визуализации аксонов нейропиле в живых VNC, ловушка белка GFP линии, которая помечает все аксоны - G9 13 - может быть использован и для визуализации всех глиальных клеток (кроме средней линии глии) глиальных водитель repoGAL4 могут быть использованы для выражения UASdsRed S197Y 14 репортер. По пересечения G9 летит в UASdsRedS197Y;; repoGAL4 мух, VNCs от потомства личинки, полученные с зеленым и красным аксонов глии, которые могут быть записаны в живую ткань.
- После объединения VNCs 4-5, передачи 1 VNC на чистый блок окрашивания, содержащий 2 мл M3 PS, и удар брюшной половины VNC, как указано в разделе 3.
- Передача ножом VNC для поли-L-лизин покрытием 3,5 мм со стеклянным дном чашки Петри, содержащей 1 мл M3PS. Поместите VNCs спинной стороной вниз. Аккуратно надавите на VNC помощью плоской стороной пара щипцов, чтобы VNC придерживаться блюдо.
- Аккуратно добавить 1 мл M3 PS 15% FBS вынесения окончательного концентрации FBS до 7,5%.
- Получить изображения с помощью лазерной сканирующей конфокальной микроскопии. Сканирование VNC, сбор Z-секции серии на протяжении всей своей толщине. Мы использовали Leica SP2 перевернутой конфокальной микроскопии с контролируемой температурой экологической камеры. Любой эквивалентной конфокальной микроскопии должно работать, однако это может потребовать оптимизации параметров сканирования. Настройки для нашей замедленной конфокальной микроскопии были следующими: температура экологической камеры: 25 ° C; 20X объектив с 4 раза зумом; режим сканирования xyzt, с разрешением 512x512 пикселей, г = 1 мкм шаги и 1-час или 2 - часовым интервалом.
- Leica SP2 конфокальной микроскопии имеет ограничение на размер файлов для сканирования. С этими настройками, 8-9 моменты времени могут быть проверены. Сдругие конфокальный микроскоп, она должна быть возможность получить изображение стеки больше моментов времени, т.е. на протяжении до 24 часов.
6. Культура и Иммуноокрашивание из Ножом и фиксированной VNCs
- Подготовка 24-луночных культуре ткани пластины, содержащие 500 мкл M3 PS 7,5% FBS на лунку.
- Повторите рассечение более 24 VNCs для 24-а блюдо культуры ткани.
- С помощью P20 Pipetman с наконечником отключения, передать 12 не зарезал VNCs от бассейна к культуре блюдо, используя 1 VNC на лунку.
- Stab остальные VNCs в бассейн, как описано в разделе 3. Передача каждого зарезал VNC, чтобы хорошо каждый.
- Поместите 24-а блюдо в 25 ° С инкубатор для желаемой продолжительности в зависимости от эксперимента. Сотовые целостности является неизменным в течение по крайней мере 24 часов.
- После культуру, передавать 12-VNCs в 250 мкл 4% формальдегида PEM в 1,5 мл трубки с помощью P20 Pipetman с наконечником обрезания. Тогда, fixatiве тщательно пипеткой в аренду, стараясь не повредить VNCs. Небольшое количество фиксатора достаточно для покрытия образцы должны оставаться в каждой пробирке. Затем добавить свежие фиксатор и аккуратно перемешивать в течение 50 мин при комнатной температуре.
- Промойте 2 раза с 0,3% Triton X PBS, а затем мыть 2 раза в течение 10 мин с 0,3% Triton X PBS при комнатной температуре.
- Блок VNCs путем инкубации с 10% нормальной козьей сывороткой в 0,3% Triton X PBS в течение 1 часа при комнатной температуре. Образцы можно хранить при температуре 4 ° С в течение не менее одного месяца.
- Инкубируйте VNCs с первичными антителами в течение более 20 ч при 4 ° C.
- Промойте 2 раза с 0,3% Triton X PBS, а затем промыть 3 раза в течение 10 мин с 0,3% Triton X PBS при комнатной температуре.
- Инкубируйте VNCs с вторичными антителами более 16 ч при 4 ° C.
- Промойте 2 раза с 0,3% Triton X PBS, а затем промыть 3 раза в течение 10 мин с 0,3% Triton X PBS при комнатной RT (в темное время суток при использовании флуоресцентного вторичные антитела).
- Заменить PBS с 50% глицерина, 50% PBS, по крайней меречаса.
- Затем заменить с 80% глицерина: 20% PBS, по крайней мере час.
- Установить VNC в окне производится на 2 слоя виолончель ленты (около 0,06 мм) на предметное стекло микроскопа. Отрегулируйте ориентацию, и поместить покровное (18x18 мм) по сравнению с окном. Два VNCs может быть установлен на слайде с помощью этого метода.
Использование различных первичных антител, различные клеточные реакции на повреждение могут быть проанализированы (например, изменение числа клеток и их формы).
7. Анализ данных с помощью ImageJ и ряд плагинов
Если VNC не колоть не связаны вырождения, образец должен быть засчитана в для анализа независимо от размера повреждения. Как колоть делается вручную, размер повреждения отличается каждый раз. Таким образом, важно проанализировать статистически эффект ножом, когда это возможно.
- Рана размером измерения. Размер раны является показателем ремонта 15.Колоть поражения видна как лишенные выражения GFP. Поражение области может быть измерен промежуток данных с помощью свободно доступных ImageJ программного обеспечения, а именно:
- Использование ImageJ, откройте стек конфокальной изображения из меню "Файл" выберите "Импорт" и отсюда выбрать "Изображение последовательности". Это превратит набор отдельных изображений в стеке.
- Следующее изменение "стек" в "HyperStack", выбрав "Image" выберите "HyperStack", затем выберите "стек HyperStack".
- Установить размер воксела с помощью "Свойства" из "Image" меню. В данных полученных с помощью Leica SP2 конфокальной микроскопии, размер воксела может быть получен из сканирующего программного обеспечения, а из текстового файла метаданные сохраняются вместе с изображениями. С нашей установки, как описано в разделе 3, размер в пикселях являются ху = 0,366211 мкм и г = 0,99709 мкм.
- Изучив все ломтики в один момент времени, привлечь максимальное контуры поражения области с полигона выбора инструмента на панели инструментов. ЭтоОбласть интереса (ROI).
- Добавить ROI с менеджером ROI, перейдя в "Анализ" меню, прокрутите вниз и выберите "Сервис", затем "ROI менеджер", затем "Добавить".
- Повторите эту процедуру для всех моментов времени.
- Нажмите кнопку "Мера" кнопка в менеджере ROI для получения области размер каждого ROI.
- Коррекция движения VNC при покадровой записи. "Stackreg" и "Turboreg" плагинов 16 (с сайта ImageJ http://rsbweb.nih.gov/ij/ ): эти плагины позволяют корректировать небольшие перемещения образца при замедленной. Построить стек с приравненных к ним представительств оптической части во всех временных точках и применять плагины. Это помогает визуализировать, как поражение изменения с течением времени. Подробнее об этих методах и инструкции можно получить в исследовательскую группу, которая разработала эти плагины. ( http://bigwww.epfl.cч / thevenaz / stackreg /).
- Автоматический подсчет клеток глии. "DeadEasy глии" плагин ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html ): это была разработана для подсчета количества репо-положительных клеток глии в Drosophila личиночной VNC и изучить изменения в глиальных Число вызванных травмой колоть 17. Плагин работает точно, с погрешностью 0,1% ложных срабатываний и 4,3% ложноотрицательных 17. Для использования этого плагина, первая метка все глии (за исключением средней линии) в образце использованием иммунофлюоресценции с анти-РЕПО антител. Затем установите плагин в ImageJ, откройте стек конфокальных изображений и запустить плагин. Он считает глиальных клеток автоматически примерно через 30 секунд.
- Автоматический подсчет апоптоза клеток. "DeadEasy личинки каспазы" плагин ( www.biosciences-labs.bham.ac.uk/hidalgo/Software.html) 18: Это был разработан для подсчета количества клеток, меченных анти-дрова-Caspase3, и новая версия была адаптирована для личиночной VNCs. Stabbing травма приводит к увеличению запрограммированной клеточной гибели 11. Для использования этого плагина, первая метка апоптоза клеток в образце использованием иммунофлюоресценции с анти-дрова-каспазы-3 антител. Затем установите плагин в ImageJ, откройте стек конфокальных изображений и запустить плагин. Он считает апоптоза клеток автоматически примерно через 30 секунд.
8. Реагенты
- Культура среде: Щит и пели M3 насекомых среднего, 7,5% эмбриональной телячьей сыворотки, 1% пенициллина и стрептомицина на 1%.
- 0,01% поли-L-лизин в стерильных DW.
- Fixative: 4% формальдегида, Ultra чистые PEM (0,1 М ТРУБЫ, 2 мМ EGTA, 1 мМ MgSO 4) решение.
- Блокирование решения для иммуноокрашивания: 10% нормальной козьей сывороткой в 0,3% Triton X PBS.
- Anti-глутаминсинтетазы2 антител: 1:250 в блокировании решения.
- Anti-GFP антител: 1:1000 в блокирующем растворе.
- Anti-РЕПО антител: 1:250 в блокировании решения.
- Anti-ELAV антител: 1:250 в блокировании решения.
- Anti-дрова каспазы 3 антител: 1:1000 в блокирующем растворе.
- Вторичные антитела: 1:250 в блокировании решения.
Результаты
Здесь мы покажем, как выполнить колющие повреждения Drosophila личиночной VNC и анализа клеточных реакций на травму использованием замедленной и иммунной конфокальной микроскопии флуоресценции.
Для покадровой данным, поражения визуализируется в виде GFP-отрицательной области в течение нейропиле образцов подшипников G9 аксональной маркером (рис. 2). Вскоре после поножовщины, небольшой GFP-отрицательной области, которые выглядят как отверстия или вакуолей, начинают появляться (рис. 2A). Такие GFP-негативные районах в целом увеличить примерно до 6 до 8 часов после колоть (рис. 2A). Впоследствии, GFP-отрицательной области сокращаться и может даже исчезнуть (рис. 2В). К 22 ч после поножовщины, площадь, занимаемая раны, как правило, меньше, чем максимальный области было от 6 до 8 часов после того, как колоть (рис. 2A, B). Точно так же DsRed-отрицательной области в глиальных процессов сначала возрастает тоже, но shrinKS на 22 часа после поножовщины. Интересно, что часто DsRed-позитивных глиальных процессов заполнить GFP-негативные отверстия в нейропиле до их исчезновения (рис. 2С).
Использование иммуноокрашивания у фиксированных экземпляров, прекрасно глиальных процессов и их ответ на повреждение могут быть визуализированы с лучшим разрешением, чем с покадровой изображений. Это можно сделать, например, с помощью repoGAL4 глиальных водитель индуцируют экспрессию мембранных привязанный репортер (например, UAS-mCD8GFP) у мух визуализировать все глиальные клетки (за исключением средней линии глии). Это также может быть объединена с другими глиальных маркеров, таких как анти-GS2, который называет нейропиле связанных глиальные клетки (рис. 3а, б). Здесь мы показываем, что, несмотря на брюшной нервной наносят удар со спинной стороны, колющие травмы результатов в вмятина снизу (рис. 3А, наконечники стрел). Stabbing кажется, затрагивает более серьезно нейропиле и нейропиле связанных глиальных клеток-йПоверхность коры и глиальные клетки (рис. 3В). Глиальных процессы проявляются дезорганизована в нейропиле, в то время как они все еще сохраняют свою сетку, как организация в коре головного мозга. Травма приводит к GS2-позитивных клеточных остатков, которые отличаются от нормальных клеток, как мусор фрагментов намного меньше и не подключены к телу клетки. Это показывает повреждения нейропиле связанных глиальные клетки (рис. 3В). Вырождающиеся нейропиле связанных глиальных клеток наблюдались также с помощью электронной микроскопии 15. Anti-дрова-каспазы 3 + апоптоза окрашивание наблюдается в нейропиле связанных глиальные клетки 15, показывают, что они подвергаются апоптозу на колющие травмы. Нейропиле связанных глиальные клетки были также показаны фагоцитируют нейронов мусора 15 и GS2 + сигнал может также выявить охвата апоптоза нейронов глиальные процессов. Расколотая-каспазы + апоптоза клеток наблюдается также в коре головного мозга, по крайней мере, некоторые из которых соответствуют ELAV + нейронов ( Рисунок 3C).
Использование фиксированных образцов и иммунной также позволяет количественного анализа клеточных реакций на травму, такие как воздействие на пролиферацию и апоптоз. Для этого мы специально разработали два ImageJ плагинов, DeadEasy Личинка каспазы и DeadEasy Glia, автоматически рассчитывать количество глиальных клеток и апоптоза клеток, соответственно. Они были проверены для работы на личиночной VNCs и очень точный. Используя их, можно наблюдать увеличение количества репо-положительных клеток глии вызвано колющие травмы, на 22 часов (рис. 4а) 15. Существует также увеличение числа анти-дрова-каспазы-3 апоптоза клеток на 6 ч после колоть (рис. 4В) 15. Такое увеличение глии пролиферации и апоптоза в ответ на повреждение в центральной нервной системе Drosophila напоминает о травме ответ в позвоночный ЦНС.
Одним из важнейших аспектов этой пропротокол является качество VNC вскрытия. Трудно сказать во время вскрытия ли VNCs были повреждены или не в процессе. Важно уделять особое внимание для выполнения нежный вскрытия. Тем не менее, плохие образцы качества неизбежно будут произведены, и очень важно, что они определены на более поздних стадиях и отбрасываются. В наших руках, VNC дегенерации, как представляется, не связанные с травмой, но вместо этого, вызванные неосторожным рассечение. Мы не наблюдается критического размера в травме раны, и мы анализируем все ранения образцы, которые не разрушаются. Когда VNCs сохранять свою целостность, поверхность VNC имеет тенденцию выглядеть гладкой и блестящей, а не отверстия в нейропиле наблюдается (рис. 5). Деградация VNCs может быть признана 24 часов после рассечения с шероховатой поверхностью VNC вентральной и боковых зон (рис. 5б). Деградация нейропиле связанных с колющие раны может также произойти, и это признано как нейропиле чОлесь в фоновом режиме сигнал иммуноокрашиванию образцов. Образцы с этими признаками вырождения должны быть отброшены (рис. 5С). В наших руках, вероятность успеха для рассечения и травмы в неповрежденном и зарезали управления (YW) мухи являются около 70%. Эта ставка будет меняться в зависимости от квалификации лица, осуществляющего экспериментов, и с генотипом.
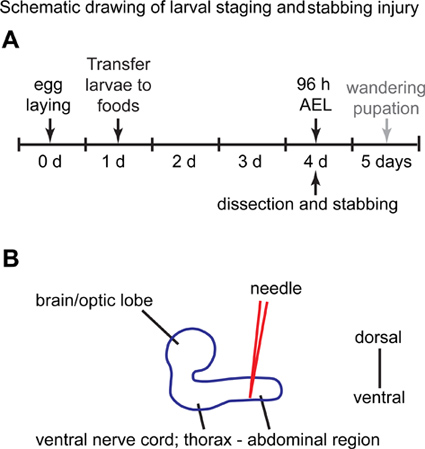
Рисунок 1. Схематическое изображение личинок постановки и колющие раны. (A) в день 0, мухи могут откладывать яйца в виноградный сок блюдо Петри в течение 3 часов. В 1-й день, вылупившиеся личинки первого возраста (L1) собраны и помещены во флаконах, содержащих стандартное питание дрожжей, где они хранятся в течение еще 3 дней. На 4-й день, личинки собираются из пищи флакон, и использоваться для колющих экспериментов. (B) Вид сбоку личиночной центральной нервной системы.Брюшную область брюшной нервной заколот иглу из спинной стороне. Передняя находится слева, а задняя с правой стороны.
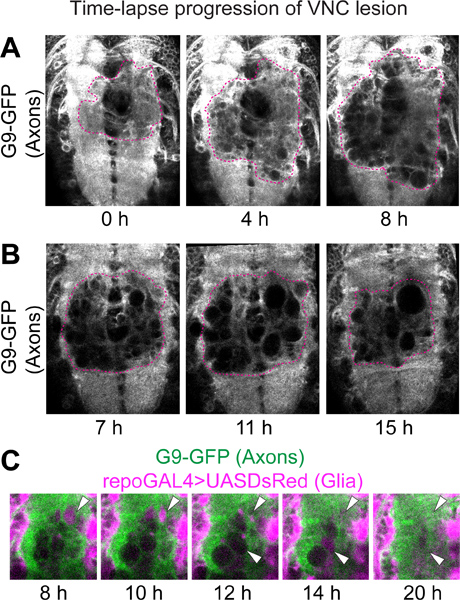
Рисунок 2. Покадровый прогрессирование поражения VNC. Конфокальной микроскопии на живом VNCs с GFP-меченых аксонов и DsRed-меченых клеток глии. Генотип:. UASDsRed / +; G9 / +; repoGAL4 / + (A) поражение признано отсутствие флуоресценции от аксонов нейропиле. После поножовщины, GFP-негативные дырки, после чего увеличиваются в размерах и количестве. Прогнозы из 5 разделов из оптического каждый момент времени после колющие раны. (B) аксональной нейропиле сжимается поражения с 9 часов после поножовщины. Эти образы одного оптического разделов с разных точек времени после колющие травмы. Чтобы определить эквивалентные позиции в каждом образце, столько же кусочек от ЕАCH момент времени в стеке покадровой данных был выбран. Сравнивая модели визуализировали с G9 и repoGAL4> UASmCD8GFP в области не зависит от ножевых ран, ломтики были проверены как от аналогичных позициях по оси Z. Пунктирные линии на (A, B), указывают на края раны. (C) Высокая увеличение раны на нейропиле. GFP-негативные отверстия были заполнены DsRed-позитивных глиальных процессов, а затем исчез (наконечники стрел). Горизонтальная зрения. Передняя вверх.
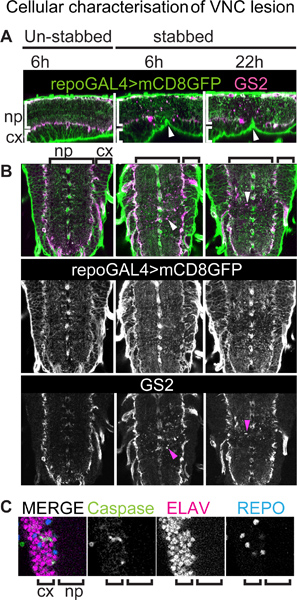
Рисунок 3. Сотовый характеристика поражения VNC. VNCs подшипника мембраны привязанный репортера GFP для всех глиальных клеток (кроме средней линии глии) окрашивали анти-GFP и анти-GS2, нейропиле связанных глиальные клетки маркером. Генотип:. + / +; UASmCD8GFP / +; repoGAL4 / + (A) VNCs были заколоты с дорсал стороне, но это вызывает вмятину вентрально (наконечники стрел). Сагиттальный вид одного оптического разделов, спины и передней левой. (A, B) Stabbing травмы влияет на более серьезно нейропиле связанных глиальных клеток, чем коры и поверхности глиальных клеток. Травма приводит к GS2-позитивных клеточных остатков (наконечники стрел в B). (B) Горизонтальные зрения одного оптического разделов, передние вверх. Стрелки указывают на GS2 + клеток мусора. (C) Colocalisation из маркеров апоптоза анти-дрова-каспазы-3 и нейронального маркера анти-ELAV показывает, что после повреждения некоторых из умирающих клеток в коре головного мозга являются нейроны. пр, нейропиле; сх, коры головного мозга.
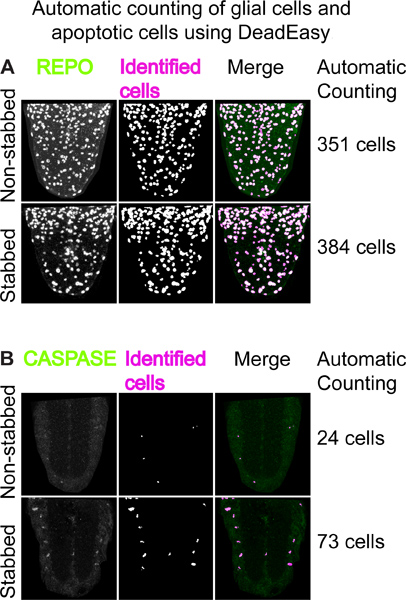
Рисунок 4. Автоматический подсчет глиальных клеток и апоптоза клеток с использованием DeadEasy. (A) Пример использования "DeadEasy личинок глии 'считать положительным РЕПОглиальных клеток. Слева: VNC вентральной половины окрашивали анти-антител РЕПО; середина: выход из DeadEasy личинок глии показывающие клетки определенных плагинов; права: слияние. Цифры справа показывают число РЕПО-положительных клеток считается автоматически в весь стек оптической конфокальной разделы около 30 секунд. Числа глиальных увеличение ножом VNCs. (B) Пример использования "DeadEasy личинки каспазы. Слева: проекции из 5 конфокальной оптической срезах, окрашенных анти-дрова-каспазы 3 антитела, средний: выход показывающие клетки определенных плагинов; права: слияние. Цифры справа показывают число каспазы-положительных клеток считается автоматически в весь стек оптической конфокальной разделы около 30 секунд. Число апоптоза клеток возрастает в зарезали VNC.
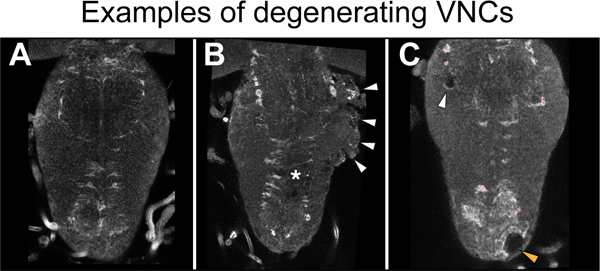
Рисунок 5. Примеры degeneratион. (A) здоровых VNC. Есть никаких признаков дегенерации. (B) стороне грудной клетки вырождается (наконечники стрел) в зарезали образца. Звездочка указывает на поражение сайта. (C) отверстия в грудной нейропиле (белые стрелки) и коры (оранжевая стрелка) в не зарезал VNC. Образцы с поврежденной нейропиле и обширные вакуолизация должны быть отброшены. Здесь VNCs окрашивали нейропиле связанных глиальных маркеров анти-негр. Горизонтальная зрения, передняя вверх.
Обсуждение
Мы создали протокол за нанесение ножевых ранений травм Drosophila личиночной ЦНС для исследования клеточных реакций на травму, восстановления и регенерации. Личинок VNCs расчленены и нанес удар, после которого они сняты с покадровой микроскопии или фиксируется на флуоресценцию иммуноокрашивания для визуализации глии и нейронов, апоптоз, или клеточное деление. Прогрессирование поражения с течением времени могут быть измерены. Этот метод сопровождается специально разработанное программное обеспечение для количественного и статистического анализа клеточных изменений на количество травм и во время ремонта.
Мы зарезали 96-часовой AEL личинок (а это были либо фиксированными или позволили разработать далее), стадии развития до перехода в куколку, а затем взрослые мухи. В 96 часов, VNCs являются достаточно большими для колющих, они находятся в середине третьего этапа возраста, и, таким образом, не проходит окукливания еще и нервная система уже полностью функциональный похож на объявлениеУльт. Можно было бы ударить чуть позже у личинок и точные сроки должны быть выбраны в соответствии с исследования вопроса. Однако, в зависимости от вопросов, рассматриваемых, это вообще будет необходимо культуры VNCs в течение некоторого времени наблюдать за клеточный ответ на травму. Некоторое время после 120 часов начинается AEL окукливания, в период, когда ЦНС реконструированы и, таким образом, лучше избегать. Таким образом, временное окно для колющих плюс культура в личинки довольно ограничены. Использование личинки по-прежнему имеет большое техническое преимущество по сравнению с использованием взрослых: в то время, как и взрослые, нервная система уже полностью функциональным, анализируя ответ на повреждение значительно проще и быстрее в личинок.
При сравнении размеров и морфологии мозга и VNCs расчлененных и культивировали в блюдо VNCs, что расчленены на эквивалентную позднее время без культивирования в блюдо, кажется, что развитие идет медленнее, в культуре, чем в естественных условиях. В других отношениях,развитие продолжается обычно в области культуры, целостность тканей сохраняется, и клетки живых показывает несколько ответов. Рана расширения, нейропиле ремонт и пролиферации глиальных состоится в течение 22 часов после поножовщины. Это показывает, что клеточный ответ на травмы происходят в культуре и есть, скорее всего, не нужно для поддержания эксплантов дольше, чем один день. Если долгосрочной перспективе культуры желаемого, протокол может потребовать дальнейшей оптимизации, такие как использование вставки культуры пластины 5.
Важно определить хорошего качества образцов от тех, вырождается. Оптимизация этого протокола требует некоторого навыка и вырождение неизбежно будут возникать в некоторых образцах. VNC может приобрести «цветной капусты» внешний вид, что отражает распад целостности ткани (рис. 5В). Вырождение признается также вакуолизация VNC независимо от ножевых ран, которые могут присутствовать в неповрежденном, не зарезал образцов (рис. 5C ). Эти образцы должны быть уничтожены. Вырождение, скорее всего, вызвана грубым вскрытие, которое может разорвать нервы и защитный слой поверхности глии. Таким образом, большое внимание должно быть принято рассекать осторожно. Другие факторы, влияющие включают в культуральной среде, которая должна содержаться в чистоте и с антибиотиками, строго придерживаясь моет и тайминги, как указано в протоколе. Наконец, длина иглы и иглодержатель, размер и острота иглы очень важны. Иглодержатель могут загрязнять среду культивирования и тупой иглой может привести к большим травмам, которые не могут восстановить себя и приведет к вырождению. Важно регулярно поддерживать иглу резким.
В этом протоколе, мы воспользовались линии белка ловушки мухи визуализировать нейропиле в параллельной визуализации глиальных процессов с использованием традиционных GAL4-UAS системы. Эти средства также могут быть объединены с другими двоичной системы экспрессии, такие как LeХА 19 и Q-система 20, которая не зависит от GAL4. Это позволило бы анализ взаимодействий, например, между аксонов и глиальных процессов, в ответ на повреждение. При дальнейшем сочетая его с другими генетическими такие инструменты, как репортеры дендритов 21 или приток кальция 22, этот метод дает большие возможности для анализа клеточной биологии за травмы ответ глиальных клеток, аксонов и дендритов в ЦНС. Наконец, этот метод может быть объединен со стандартным генетики, мутации и чрезмерной экспрессии генов, чтобы проверить функции генов в ответ на травму и регенерации.
Этот протокол успешно привели к открытию гена сети, лежащей в основе регенеративной глиальных ответ на ЦНС травмы 11. Учитывая эволюционные сохранения функции гена, распутывая этих клеточных событий и функций генов в фруктовых мух, вероятно, обеспечит значительную способность проникновения в суть понимания маmmalian ЦНС ответ на повреждения и регенерации.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Mei Ann Lim за критическое прочтение рукописи и другие члены нашей лаборатории для их обсуждения на протяжении всей этой работы. Эта работа финансировалась Ямада научного фонда и Королевского общества Короткий визит стипендий и ЕС Мари Кюри международного входящего GRR стипендий для KK, и BBSRC гранта (BB/H002278/1) и Wellcome Trust Оборудование Грант (073228/Z/03/Z) в AH
Материалы
| Name | Company | Catalog Number | Comments |
| Оборудование | |||
| Окрашивание блок | Brunel микроскоп | ||
| Щипцы № 5 | например изобразительных инструментов науки | например 11251-20 | |
| Вольфрамовой иглы: диаметр стержня, 0,5 мм, размер чаевых, 1 мкм, длина 2 дюйма | Roboz хирургических инструментов | RS-6065 | |
| Иглодержатель | Roboz хирургических инструментов | RS-6060 | |
| Arkansans камни: Ремонтный комплект для Дюмон щипцы | Средства изобразительных наук | 29000-00 | |
| 35 мм чашки Петри с 27 мм база стекло | Iwaki | 3930-035 | |
| Leica SP2-AOBS конфокальной инвертированный микроскоп с окружающей средой камеры | Leica | ||
| Реагент | |||
| Щит и пели M3 насекомых среды (экдизона бесплатно) | Сигма | S3652-500 мл | |
| Пенициллина и стрептомицина | Invitrogen | 15070-063 | |
| Фосфат-буферный раствор (PBS) | Смотрите 12 | ||
| FBS | Сигма | F7524 | |
| Поли-L-лизин | Сигма | P1399-25мг | |
| Формальдегид, 10%, метанола бесплатно, Ultra Pure | Polysciences | 04018-1 | |
| Мышь анти-глутамин синтетазы антител | Millipore | MAB302 | |
| Кролик анти-GFP антител | Жизнь технологий | A11122 | |
| Мышь анти-антител РЕПО | Развития исследований Hybridoma банка | 8D12 | |
| Крысы анти-антител ELAV | Развития исследований Hybridoma банка | 7E8A10 | |
| Кролик анти-активные каспазы 3 антитела | Abcam | ab13847 | |
| Нормальной козьей сывороткой | Vector Laboratories | S-1000 | |
| Anti-кролик Alexa Fluor 488 | Жизнь технологий | A11034 | |
| Anti-мышь Alexa Fluor 647 | Жизнь технологий | A21236 | |
| Anti-крысы Alexa Fluor 647 | Жизнь технологий | A21247 |
Ссылки
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Curr. Biol. 22, 590-595 (2012).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J. Cell Biol. 191, 211-223 (2010).
- Leyssen, M., et al. Amyloid precursor protein promotes post-developmental neurite arborization in the Drosophila brain. EMBO J. 24, 2944-2955 (2005).
- Kato, K., Awasaki, T., Ito, K. Neuronal programmed cell death induces glial cell division in the adult Drosophila brain. Development. 136, 51-59 (2009).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J. Neurosci. 28, 6010-6021 (2008).
- Rohrbough, J., O'Dowd, D. K., Baines, R. A., Broadie, K. Cellular bases of behavioral plasticity: establishing and modifying synaptic circuits in the Drosophila genetic system. J. Neurobiol. 54, 254-271 (2003).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr. Biol. 19, 799-806 (2009).
- Gomez-Marin, A., Louis, M. Active sensation during orientation behavior in the Drosophila larva: more sense than luck. Curr. Opin. Neurobiol. 22, 208-215 (2012).
- Schleyer, M., et al. A behavior-based circuit model of how outcome expectations organize learned behavior in larval Drosophila. Learn Mem. 18, 639-653 (2011).
- Brown, H. L., Cherbas, L., Cherbas, P., Truman, J. W. Use of time-lapse imaging and dominant negative receptors to dissect the steroid receptor control of neuronal remodeling in Drosophila. Development. 133, 275-285 (2006).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by pros-notch and pros-NFkappaB feedback. PLoS Biol. 9, e1001133 (2011).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 98, 15050-15055 (2001).
- Verkhusha, V. V., et al. An enhanced mutant of red fluorescent protein DsRed for double labeling and developmental timer of neural fiber bundle formation. J. Biol. Chem. 276, 29621-29624 (2001).
- Kato, K., Forero, M. G., Fenton, J. C., Hidalgo, A. The glial regenerative response to central nervous system injury is enabled by Pros-Notch and Pros-NFkB feedback. PLoS Biol. 9, e1001133 (2011).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7, 27-41 (1998).
- Forero, M. G., Kato, K., Hidalgo, A. Automatic cell counting in vivo in the larval nervous system of Drosophila. J. Microsc. 46, 202-212 (2012).
- Forero, M. G., Pennack, J. A., Learte, A. R., Hidalgo, A. DeadEasy caspase: automatic counting of apoptotic cells in Drosophila. PLoS One. 4, e5441 (2009).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141, 536-548 (2010).
- Nicolai, L. J., et al. Genetically encoded dendritic marker sheds light on neuronal connectivity in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107, 20553-20558 (2010).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены