Method Article
Verimli Üretimi ve Saflaştırılması Rekombinant murin kindlin-3 Biophysical Çalışmaları Böcek hücrelerinden
Bu Makalede
Özet
Kindlins İntegrinlerin yoluyla hücre yapışması temel vardır ama bunların çalışmalar bakteriyel konaklarda rekombinant olarak bunları ifade karşılaşılan zorluk engel olmuştur. Burada bakulovirüs ile enfekte olmuş böcek hücrelerinde bunların verimli üretimi için yöntemleri tarif eder.
Özet
Kindlins hücre yüzeyi reseptörleri integrinlerin, Talin ile, temel koaktivatörler ve aynı zamanda dış-sinyalleşme integrin katılmak ve hücre çekirdeği içinde gen transkripsiyonu kontrol. Kindlins ~ 75 kDa alanlı proteinlerdir ve NPxY motifi ve integrin β-alt-biriminin sitoplazmik kuyruğunun üst T / S kümesine bağlanır. Hematopoietically önemli kindlin izoform, kindlin-3, trombus oluşumu sırasında trombosit toplanması için kritik olan, enfeksiyon ve enflamasyon ve kemik erimesinin osteoklast podosit oluşumuna yanıt olarak haddeleme lökosit. Bu süreçlerde kindlin-3'ün rol geniş hücre ve fizyolojik çalışmalar ile sonuçlanmıştır. Bununla birlikte, daha ileri çalışmalar için, proteinin yüksek kaliteli miligram miktarları elde etkili bir yönteme ihtiyaç vardır. Bir bakulovirüs-d kullanımı ile rekombinant murin kindlin-3'ün etkili ifadesi ve saflaştırılması için, burada tarif edilen bir protokol geliştirdikbiyofiziksel karakterizasyonu olanak vermek için yüksek saflıkta, tam-boy proteinin yeterli miktarda elde Sf9 hücrelerinde ifade sistemi parçalanmaktadır. Aynı yaklaşım, diğer memeli kindlin izoformlarının çalışmaya alınabilir.
Giriş
Kindlin ailesinin proteinleri önemli bir fokal yapışma montaj komponenti, ve karmaşık yaşam için bu nedenle çok önemlidir. 3 memelilerde izoformu (kindlin-1, kindlin-2 ve kindlin-3) var olan Kindlins, Talin 1 yanında hücre dışı reseptörleri integrinlerin koaktivatörler olarak kabul edilir. Integrin aracılı hücre yapışma yüksek Ökaryotlarda hücre dışı matrisin (ECM) hücre yüzey bağlanır. Bu doku bütünlüğünün embriyogenesisi, kemik metabolizması, hemostaz ve bağışıklık içeren fizyolojik olayların, bir bolluk kritik ve ortak bir süreçtir. Integrin aracılı hücre yapışma bunların korunmuş NPxY motifleri de integrin β-alt-biriminin sitoplazmik kuyruk (CTS) ve Talin kindlin bağlanmasının ile iç-dış sinyal iletimi yoluyla aktive edilir. Kindlin proteinlerin biyomedikal önemi kadar kindlin-2 transkripsiyon dahil olmak üzere birçok yeni raporlarda gösterilmiştir çekirdeği, gibi ancak uzanıral 2,3 kontrol eder.
Kindlins onun F2 subdomain merkezinde bir pleckstrin homoloji (PH) etki ile kesilen bir ikili C-terminal FERM (4.1 bandı, Ezrin, radixin, moesin) etki, elinde tarafından hallmarked yaklaşık 75 kDa multidomain proteinlerdir 4,5. Kindlin-2 ve kindlin-3 PH etki çalışmaları, bu lipid ikinci habercileri fosfatidilinositol-(3,4,5)-trifosfat ve fosfatidilinositol-(4,5)-bifosfat 6-8 bağlanan gösterdi. Bununla birlikte, kindlin-1 PH etki çalışmalar bağlanmasını engelleyen bir izoform lipidler özgü bir tuz köprüsü ile kindlin-1 'de açıklanabilir çok daha düşük bir afinite ile, PtdIns (3,4,5) P3 bağlanan olduğunu göstermektedir 9. Buna ek olarak, katlanmamış gibi belirlenmiştir, ancak plazma zarının 10,11 iç broşürde fosfatidilserin bağlanan bir kindlins en F1 alanı içine yerleştirilen bir ~ 100 amino asit köprüsü vardır. Kindlin FERMtalin FERM alanı bir pleckstrin homology sahip olmamakla birlikte etki, Talin FERM etki homolog kabul edilir. Her ikisi de talin kindlins ve bunların FERM etki F3 bölgesi aracılığıyla integrin β-kuyrukları NPxY motifleri ile etkileşime girmez, fakat talin zara yakın bir hedef 12-16 süre kindlin, zar distal motifine bağlar. Buna ek olarak her iki Kindlins ve talin diğer FERM proteinler 11,17 bulunmayan bir ubikitin benzeri kat ile, bir N-terminal alanı F0 sahiptirler. Kindlin-2'nin F0 etki üzerinde yapılan çalışmalar bu, bağımsız bir şekilde, fosfatidilinositol-(4,5)-bifosfat zenginleştirilmiş membran 17 bağlanan göstermiştir.
Kindlins paralogue spesifik doku ekspresyonu ve fazla-olmayan fizyolojik fonksiyonları gösterirler. Kindlin-1 esas olarak epidermis olarak ifade edilir, ama aynı zamanda bir dereceye kadar kolon, mide, böbrekler, kindlin-2 ifade edilir, ancak her yerde bulunan bir ortamda konsantre edilir ve düz çizgilikas ve embriyonik gelişim 4 olarak ifade edilen tek kindlin olması ve kindlin-3 megakaryositlerin 18 bulunan kindlin-3 en yüksek konsantrasyon ile hematopoietik dokularda ifade edilmektedir. Ancak daha yeni çalışmalar, işlevsel protein hem de 19 endotelial dokular olarak ifade edilir olduğunu ileri sürmüşlerdir.
Kindlin-3 nedeniyle kandaki önemli fizyolojik rolüne akut tıbbi ilgi çekicidir. Bu, trombosit agregasyonu ve enfeksiyon ve enflamasyon 21,22 ve kemik erimesinin 23 osteoklast podosit oluşumuna yanıt olarak trombüs oluşumu 20, lökosit haddeleme sırasında yaymak için kritik önem taşır. Hayatı tehdit eden kanama bozuklukları ve tekrarlayan bakteriyel enfeksiyonlar 20,24,25 ile karakterize bir hastalıktır - Ayrıca, kindlin-3 insanlarda tükenmesi adezyon eksikliği tip-III lökosit yol açar. Farelerde kindlin-3 nakavt çalışmaları, proteinin önemli bir işlev olarak açıklanmıştırhücre yapışması KIND3 -. / - fareler kindlin-3 eksik insanlarda belirtiler benzeyen nedeniyle inaktif trombosit integrinlerin, ciddi osteopetrozla ve bozulmuş lökosit yapışması 20,22 böyle şiddetli kanama gibi farklı fenotipleri, gösterir.
Kindlins yüksek çözünürlüklü yapısal veri, bugüne kadar, bu tür pleckstrin homoloji kindlin-1, 9 ve kindlin-2 26,27 arasında (PH) domain ve kindlin-1 11 ve kindlin ve F0 alanı olarak subdomainler sınırlı olmuştur -2 17. Her kindlin polipeptit alt etki alanlarının çoğu ancak klonlama ve yapısal analizi (Yates ve Gilbert, yayınlanmamış gözlemler) direnen ve tam uzunluktaki proteinlerin çalışmalar E. kullanılarak yeterli miktarlarda ifade ve arındırıcı bir zorluk tarafından engellendi coli (yayınlanmamış gözlemler ve Harburger et al. 14). Kindlin-3 ve fu önemli tıbbi ilgi vardırnction, diğer iki aile üyeleri ile birlikte, ve yakın zamanda bakulovirüs enfeksiyonu 12 ile tahrik Spodoptera frugiperda hücrelerinde rekombinant ekspresyon yoluyla bunun miligramlık miktarlarda oluşturulur. Bu nedenle, burada geniş yapısal çalışmaları ve biyokimyasal analizler için uygun böcek hücre kültüründe rekombinant fare kindlin-3 miligram miktarları, üretimi için metotları tarif etmektedir.
Bu protokolde bir mühendislik nakavt bakmit (: 1629 BAC10 KO) faydalanmak O, tek başına, canlı viryonlarını 28 üretemez. Viral DNA, böylece bu durumda da kindlin-3 geni (FERMT3) ve bir rekombinant virüs ile sonuçlanan yüksek derecede ifade edilen fakat gereksiz olduğu çok geç gen, değiştirme FERMT3 geninde sonuçlarını içeren bir transfer vektör ile rekombinasyonu ile kurtarılır virüs yaşam döngüsünün 28 bir parçası olarak fare kindlin-3 ifade eden bir virüs. Bu tespitkindlin-3 üretimi için bir yöntem diğer ifade hosts bunu ifade ve arındırmak için girişimleri nedeniyle biz klonlanması için kullanılan ve birçok ifadede dağıtılan olabilir POPIN vektör paketi, çok yönlülük (yayınlanmamış gözlemler) engelleyici zor oldu ama aynı sonra 29 ev sahipliği yapıyor.
Protokol
IM Jones tarafından geliştirilen ve 1629: Bu protokol, fare kindlin-3 geni (FERMT3) başarılı bir şekilde çok geç p10 promotörünün alt ve vektör bakmit BAC10 KO ile rekombinasyona izin vermek için bakulovirüs dizileri yan sahip olduğu bir vektöre klonlanmıştır varsayar arkadaşları 28. Bu protokol için, kindlin-3 geni pOPINE 29 içine klonlandı ve kullanılan primerler ve klonlama stratejisi başka bir yerde tarif edilen 12 bulunabilir. FERMT3 geni (kindlin-3) bakuloviral p10 promotörünün kontrolü altındadır ve vektörün 5 'ORF UTR/ORF603 ve 1629 içerir ve aşağı akış saflaştırmasında 29 için bir C-terminal His6-tag kodlayan, böylece plazmid tasarlanmıştır.
1.. Böcek Hücre Kültürü ve Bakım
- Önceki rekombinan bakulovirüs amplifikasyonuna, Spodoptera frugiperda hücreleri, süspansiyon kültüründe (Sf9 hücreleri) için gereken uyarlanmışyetiştirilmiş ve muhafaza edilebilir. Böcek hücreler her zaman özel bir doku kültürü davlumbaz aseptik teknikler kullanılarak ele alınmalıdır.
- Böcek hücre süspansiyon kültürleri SF-900 II (SFM) 100 rpm'de çalkalanarak 27 ° C'de şişeler içinde 100 ug / ml streptomisin, 100 ug / ml penisilin ile desteklenmiş serumsuz sıvı ortam içinde inkübe edilir.
- Böcek hücresi kültür yoğunluğu aralığını muhafaza 6 ila 10 x 1 ile - bölme ve taze 900 Sf-II ile ortam hücre kültürü seyreltilmesi hücre / ml 7 ila 10 x 1.
Not: Sağlıklı hücre boyutu üniforma bakmak gerekir ve şekil olarak küresel olması gerekir. - Kültür hücre yoğunluğunu hesaplamak için bir hemasitometre ve ışık mikroskopisi kullanılarak bir numune hacmi içindeki hücreleri saymak.
2. Rekombinant Bakulovirüsün Üretimi
- Kültür ve 100 ug / ml penisilin ile takviye edilmiş 900 Sf-II ortamı kullanılarak Sf9 hücreleri süspansiyon içinde muhafazan ve 100 ug / ml streptomisin. 1 x 10 6 hücre / ml - bakulovirüs üretimi için, böcek hücreleri 5 x 10 5 arasında bir yoğunluk aralığı için kültür olmalıdır.
- Tohum, yaklaşık 1 x 10 ila 100 ug / ml streptomisin, 100 ug / ml penisilin ile desteklenmiş 900 Sf-II ortamı içinde 2 ml steril bir 6-yuvalı doku kültür plakasının her bir oyuğu başına 6 Sf9 hücreleri. Plastik kuyu tabanına yapışmasına çeker ocak içinde, oda sıcaklığında Sf9 hücreleri bırakın ve böylece bir tek tabaka oluşturur.
- Tek tabakalı kültürü üzerine bacmid DNA ve plazmid DNA ile kotransfekte yeniden birleştirici baculovirüs nesil yapın.
- Antibiyotikler (Çözelti A) olmadan Sf-900 II SFM, 100 ul 1629: Her transfeksiyon için, arıtılmış, BAC10 KO 0.5 ug ORF1629 bakulovirüs elemanları sahip saflaştırılmış pOPINE-mFERMT3, 1-2 ug karıştırın.
- Ayrı bir tüp içinde, anti-olmayan Sf-900 II SFM, 100 ul Cellfectin II reaktifi 6 ul seyreltikHer transfeksiyon reaksiyonu (solüsyon B) için biotics. Birçok transfeksiyonlan gerekiyorsa bir 'master mix', düşük sıvı taşıma için, burada oluşturulabilir.
- Iki çözeltinin (A ve B, yaklaşık 200 ul) karıştırın ve bir lipid-DNA kompleksini oluşturmak için 20 dakika boyunca oda sıcaklığında inkübe edin.
- Antibiyotikler olmadan 800 ul Sf-900 II SFM ile lipid-DNA kompleksleri seyreltin. Dikkatlice Sf9 hücre tek tabaka ortamı aspire ve dikkatlice Sf9 tek tabaka üstünde çözelti, A / B ve ortam pipetle.
- 27 ° CO / N nemlendirilmiş bir kuluçka makinesi içinde transfekte hücreler inkübe edin ve bir sonraki gün her bir tek tabakalı kültürü, antibiyotikler olmadan Sf-900 II SFM başka bir 1 ml. Başka bir 5 gün için 27 ° C'de inkübe hücreleri.
- Kültür ortamında (toplamda yaklaşık 2 mi) doğrudan rekombinant bakulovirüs hasat ve temiz bir santrifüj tüpüne (örneğin, bir 15 ml Falcon tüpü) transfer.
- Herhangi Sf9 hücre debr netleştirinOda sıcaklığında 5 dakika boyunca 1000 x g'de santrifüj gereğidir. , Kullanılana kadar karanlıkta 4 ° C'de temiz bir tüpe ve saklamak için sonuçtaki süpernatan içinde ve P1 gösterilen virüsü, transfer edin. Bu aşamada, geri kalan tek tabaka Sf9 böcek hücrelerinde rekombinant kindlin-3 varlığını değerlendirerek rekombinant virüs oluşumunu değerlendirmek için de kullanılabilir.
- 0.5 ml PBS ile yeniden süspanse edin ve tek tabaka 2x SDS-PAGE yükleme tampon maddesinin eşit hacmi ile, 10 ul örnek seyreltin. En az 10 dakika boyunca 95 ° C '> de örnekleri ısıtın.
- Bu doğru jel yükleme için fazla yapışkan olduğu durumlarda, bir mikro sonikatör ucu kullanılarak% 10 genliğinde 1 saniye için örnek sonikasyon.
3. Rekombinant Bakulovirüsün amplifikasyonu
- Süspansiyon içinde virüs amplifikasyonu için, 1.4 x 10 6 hücre / ml 'lik bir hücre yoğunluğuna kullanmak ve bu (örneğin, 50 ml kültür toplam şişe hacminin 1/20 işgal edilmelidirBir 2 L bir şişe).
- Aşağıdaki formüle göre 0.1 'lik bir enfeksiyon çokluğu (İB) de P1 viral stok ile enfekte edilmiş böcek hücre kültürü tarafından rekombinant virüsün amplifikasyonu elde;

Not: P1 virüs üretimi 1 x 10 7 pfu / ml 'lik bir beklenen viral titre sahip olduğu kabul edilebilir. Bununla birlikte, plak deneyi önce bu aşamada gerçekleştirilebilir. - 3 gün (72 saat) boyunca 100 rpm'de çalkalanarak 27 ° C'de P1-enfekte edilmiş böcek kültür inkübe edin.
- Oda sıcaklığında 5 dakika boyunca 1000 x g'de santrifüjleme ile ortamdan hücreleri ayırarak virüsü hasat. SDS-PAGE ve western blotting ile kindlin-3 protein ifadesini değerlendirmek rekombinant virüs üretim teyidi için bu aşamada elde edilen hücre topağı kaydedin.
- 4 ° C de temiz bir tüpe ve saklamak için açıklık virüs zenginleştirilmiş medya aktarmakkullanılana kadar karanlık. Bu viral stok P2 olarak gösterilir.
Not: 2 x 8 10 pfu / ml (veya 100 pfu / hücre bir büyütme oranında) ihtiva eden bir viral titresi tahmin edilebilir.
4. Bakulovirüs enfekte edilmiş Sf9-in-3 kindlin ekspresyonu
- Önce saflaştırma için büyük ölçekli rekombinant kindlin-3 ekspresyonuna 100 ug / ml penisilin ve 100 ug / ml streptomisin ile takviye edilmiş Sf-900 II SFM içinde süspansiyon halinde Sf9 hücreleri kültürlerinin yeterli bir hacmi büyür. 100 rpm'de çalkalanarak ve toplam kültür hacmi olan 27 ° C 'de süspansiyon kültürleri inkübe: 1:05 hacim oranında şişeye.
- 2 x 10 6 hücre / ml 'lik bir yoğunlukta Sf9 süspansiyon kültürleri, Infect.
- % 1 bir son konsantrasyona sahip Sf9 kültürleri Supplement (v / v) fetal sığır serumu (FBS) içinde bir 1 moi vermek üzere güçlendirilmiş bir rekombinant virüs (P2-viral stoku) takip etti. 100 rpm'de çalkalanarak 27 ° C 'de enfekte kültürleri inkübe edin.
- Hasat recombinant kindlin-3-CHIS 1000 x g'de santrifüj ile Sf9 hücreleri 72 saat post-enfeksiyon 6-sentezleyen ve elde edilen hücre topağı, kullanılıncaya kadar -20 ° C'de saklandı veya uzun süreli depolama için -80 ° C.
5. Rekombinant kindlin-3 saflaştırılması
- Buz üzerinde yeniden birleştirici kindlin-3 ifade çözülme dondurulmuş bakülovirüs enfekte edilmiş böcek hücreleri (Sf9) peletler.
- Liziz tamponu ile çözülmüş hücre pelletini (50 mM Tris-HCl, pH 7.5, 500 mM NaCl, 1% (v / v) Tween-20), EDTA içermeyen proteaz inhibitör kokteyli ve DNase1 1,000-2,000 arasında U ile takviye edilmiştir.
Not: NaCl konsantrasyonu endojen Sf9 hücre proteinleri ve alt saflaştırma için kullanılan immobilize metal afinite sütunu (aşağıya bakınız) arasındaki spesifik olmayan etkileşimleri önlemek için 500 mM'ye ayarlandı olduğu Seçenek olarak ise, tadil edilmiş fosfat tamponlu tuzlu su (PBS), aynı zamanda, kullanılabilmektedir. - Deterjan ve Vo ile yeniden süspansiyon haline getirilmiş hücreler inkübe edilerek Lyse hücrelerrtexing. Sonikasyon, bir buz banyosu içinde daha fazla hücre bozulması için örnek (% 40 genlik, 10 sn darbe 10 döngü 10 saniye, ardından soğutma) ya da seçenek olarak, bir Dounce homojenleştirici kullanın.
- 4 ° C'de 1 saat süre ile 48,000 x g'de santrifüj ile lizat netleştirmek 1 ml / dk 'lık bir hızda 4 ° C sıcaklıkta bir HisTrap kolonu (5 mi kolon hacmi) liziz tamponu ile önceden dengelenmiş olan, üzerine elde edilen süpernatant yerleştirin.
Not: Alternatif olarak, açıklık lizat önceden dengelenmiş nikel sefaroz boncuklar bir 1-5 ml yatak hacmi 1-2 saat boyunca 4 ° C 'de (örneğin, Ni Sepharose 6 Hızlı Akış) ile inkübe edilebilir. Ni-sepharoz sütun yerçekimi akış kolon kullanılarak bağlanma adımından sonra oluşturulabilmektedir. - Yıkama tamponunun 10 kolon hacmi ile sütun yıkayın (50 mM Tris-HCl, pH 7.5, 500 mM NaCl, 10 mM imidazol) bağlanmamış proteinleri çıkarın.
- Elüt edilmesi için bir AKTA FPLC kullanılarak 10 mM / ml (veya 10 kolon hacmi içinde) bir oranda 10-500 mM arasında bir imidazol gradyanı kullanarak doğrusalbağlanmış rekombinant kindlin-3-CHIS 6.
- Genellikle 300 mM arasında bir imidazol konsantrasyonunda elüsyon kindlin-3-CHIS 6 ihtiva eden fraksiyonlar ile AKTA FPLC ile 0.5-1 ml fraksiyonlar halinde elüsyon fraksiyonlanması.
- SDS-PAGE ile yıkama sıvısının her bir protein bileşiminin değerlendirilmesi ve ilk kez arıtma için bir anti-His 6 antikoru ya da anti-fare kindlin-3 antikoru kullanılarak Western blotting ile teyit etmektedir.
- 20 mM Tris-HCI, pH 7.5, 200 mM NaCl, 50 kDa molekül ağırlığı kesmesi (MWCO) olan bir santrifüj protein konsantratör kullanılarak tampon maddesi ve numune konsantrasyonları içine bir dizi seyreltmesi ile içine kindlin-3 ve tampon değişimi ihtiva eden fraksiyonlar Havuz 4 ° C'de
Not: Alternatif olarak, 20 mM Tris-HCI, pH 7.5, 200 mM NaCl içine O / N 4 saat boyunca 4 ° C 'de, 30 kDa'lık bir MWCO ile Slide-A-Lyzer diyaliz kaseti kullanılarak protein çözeltisi dialyze.
Not: iyon değişimi (aşağıya bakınız) NaCI daha düşük bir konsantrasyonu, , olabilir, ve bu aşama için kullanılmıştır. - 0.5 ml / dk 'lık bir hızda bir AKTA FPLC ile önceden dengelenmiş bir HiTrap Heparin HP kolonu (5 mi kolon hacmi) üzerine, tampon ile-yer değiştirilmiş protein çözeltisi uygulanır.
Not: bağlı kindlin-3 10 mM / ml 'lik bir oranda artırılması, aynı tamponda doğrusal bir NaCl gradyanı (1 M NaCl ile 0.2 M NaCl) kullanılarak akıtılır. Kindlin-3-CHIS6 ~ 0.6 M NaCI ile elüt edilmesi için tahmin edilmektedir. - 0.5-1 ml fraksiyonlar halinde elüsyon bölümlere ayrılması ve uygun olduğu takdirde, SDS-PAGE ve western blotting ile protein bileşiminin değerlendirilmesi.
Not: SDS-PAGE ile değerlendirildiği gibi, bir yakın% 95 bir protein saflık beklenebilir. - 0.5-2 ml'lik bir nihai hacme, 50 kDa'lık bir MWCO bir santrifüj protein konsantratör kullanılarak kindlin-3 ve konsantre ihtiva eden fraksiyonlar Pool.
- Son bir adımda, konsantre edilmiş protein cila ve boyut dışlama kromatografisi (SEC) ile proteinin tampon değişimi.
- Bir su üzerine, saflaştırılmış protein uygulanırperdex S200 (16/60) ya da (10/30), kolon büyüklüğüne bağlı olarak 1 ml / dak 'ya da 0.5 ml / dk' lık bir hızda 20 mM Tris-HCI, pH 7.5, 200 mM NaCI, 1 mM DTT içinde önceden dengelenmiş kullanılır.
Not: Gerekirse boyut çıkarma kromatografisi da fosfat tamponlu tuzlu su (PBS) içinde gerçekleştirilebilir. - Kullanılan kolon büyüklüğüne bağlı olarak 1 ml / dk ya da 0.5 ml / dk bir hızda kolona tampon uygulanarak ölçülerine uygun proteinleri saflaştırmak.
Not: kolonundan protein parçalanmış ve 280 nm'de emicilik kullanılarak izlenmiştir. - Tek bir emme zirve, parçalanır ve homojenlik belirlemek için SDS-PAGE ile değerlendirilmiş ve bu adımdan sonra tipik olarak>% 95 saf olduğunu SEC, beklenmelidir.
- Bir su üzerine, saflaştırılmış protein uygulanırperdex S200 (16/60) ya da (10/30), kolon büyüklüğüne bağlı olarak 1 ml / dak 'ya da 0.5 ml / dk' lık bir hızda 20 mM Tris-HCI, pH 7.5, 200 mM NaCI, 1 mM DTT içinde önceden dengelenmiş kullanılır.
- Konsantre, 50 kDa'lık bir MWCO için ~ 15 mg / ml, 109.320 M hesaplanmış bir sönüm katsayısı (ε) kullanılarak spektrofotometrik olarak değerlendirilen -1 cm -1 bir santrifüj protein konsantratör kullanılarak kindlin-3-CHIS 6 arıtıldı/ Sup> (tüm sistein artıkları azalır varsayarak).
- -80 ° C -20 ° C ve uzun süreli depolama de depolama için, kısım PCR tüpleri ve flaş dondurularak sıvı azot içinde örnekleri içine proteini. Seçenek olarak ise, protein, biyokimyasal ve biyofiziksel teknikler kullanılarak araştırma için direkt olarak kullanılabilir.
Sonuçlar
Baculovirüs ile enfekte edilmiş Sf9 hücreleri kullanılarak rekombinant fare kindlin-3'ün büyük ölçekli ifadesi şematik Şekil 1A'da gösterildiği gibi, miligram miktarları elde etmek için en az iki hafta alır ve bir QIAprep Miniprep kiti plasmid DNA, sadece küçük bir miktar gerektirir için olabilir örnek. Şekilde gösterildiği gibi, ve 5-7 gün sonra da yeni oluşturulmuş virionlar hasat: rekombinan bakulovirüslerin üretimi fare kindlin-3-(FERMT3) tasarlanmış bir lineer bakmit (KO 1629 BAC10) ile birlikte ihtiva eden plasmid ile kotransfekte edilmiş Sf9 hücreleri ile elde edilmektedir 1A. Bu, esas olarak% 100, rekombinant virüslerin üretimi bakulovirüs sonuç yöntemi ve plak saflaştırma 28,30 ihtiyacını dağıtır. Temsili bir küçük çaplı (2 mi tek katmanlı) kültür ml başına 1 x 10 7 plak oluşturan birim beklenen bir viral titresi (pfu) ile bir rekombinant virüs içeren çözelti oluşturacaktırkültürü. Bir gerçek viral titresini belirlemek için, bir plak deneyi oluşturabilirler, ancak yapıların yüksek sayıda yapı çalışmaları için de test edilmiştir, bu belki de çok emek-yoğundur. Virüs üretim aşamasının başarısı, tipik olarak ortaya koyan, bu kindlin-3-konstrüktü, Sf9 tek tabaka PBS içinde yeniden süspanse edilebilir ve SDS-PAGE ve western blotting ile değerlendirilen, paralel bir eGFP içeren plazmid kullanılarak değerlendirildi, ya da olabilir Şekil 1B 'de gösterildiği gibi, bir 75 kDa His-etiketli bir proteine karşılık gelen açık bir grup. Virüs daha sonra büyük ölçekli (litre hacim) böcek hücre enfeksiyonu ve rekombinant protein izolasyonu için yeterli miktarlarda elde etmek için yükseltilir. İkinci geçit virüsü (P2) 0.1 'lik bir MOI tahmini (protokolü) ile süspansiyon kültürlerini enfekte tarafından oluşturulur. Bu amplifikasyon Sf9 süspansiyon kültürü, toplam şişe hacminin sadece Yirmilik kaplamasıdır önemlidir. Bu ek havalandırma sağlar ki, elde edilen vir3 gün (72 saat) Enfeksiyondan sonra hasat us-ihtiva eden ortam, daha sonraki sentezleme kültür kindlin-3 yeterli miktarda üretecektir. Amplifiye edilen virüs stoku (P2) 2 x 10 6 hücre bir hücre yoğunluğu kullanılarak / ml amplifikasyon 31 boyunca 100 pfu / hücre muhafazakar bir tahmin göre 2 x 10 8 pfu / ml 'lik bir beklenen viral titre sahip olduğu varsayılır. Şekil 1C 'de gösterildiği gibi Genel olarak, optimum bakulovirüs amplifikasyonu ve protein üretimi için Sf9 hücreleri, boyut ve küresel olarak sabit olmalıdır. Ek olarak, viral amplifikasyonu ve protein ifadesi 72 saat sonrası enfeksiyon maksimumdur ve her ikisi de önemli ölçüde 96 saat sonrası enfeksiyon azalır.
Virüs büyütülmüş ve büyük ölçekli deneylerde Sf9 hücreleri enfekte etmek için kullanılmıştır kez yeniden birleştirici kindlin-3 kısmen işlenmiş C-terminal His6-tag kullanılarak immobilize metal afinite kromo sayesinde saflaştırılırmatography, Şekil 2'de gösterildiği gibi. Bu, 4 ° C 'de arıtma gerçekleştirmek için önemlidir ve yeterli proteaz inhibitörleri proteolizini engellemek için eklenmiştir. Şekil 3'te gösterildiği gibi, kısmen saflaştırılmış kindlin-3, a heparin kolonu kullanılarak iyon değiştirme kromatografisi (IEC) tarafından yakın homojenliğe kadar daha fazla saflaştırılır. Bunun yerine, geleneksel iyon değişim kolonunda heparin bir sütunun kullanımı istihdam biz kindlin-3 F1 etki alanı içindeki bir poli-lizin esnek parçası da dahil bazik artıklar, büyük sayıda, negatif yüklü sülfat grupları ile kuvvetli bir etkileşime olacağını tahmin edildiği gibi Sütunun. Bu strateji Cid1 32 uridiltransferaz örneğin RNA bağlayıcı terminali, temel nükleik asit bağlama yamaları ile DNA-ve RNA-bağlayıcı proteinler için özellikle yararlıdır. Son olarak kindlin-3 saflık gösterildiği gibi, agrega kaldırma ve homojenlik elde etmek için boyut dışlama kromatografisi ile "malzeme" olduğuŞekil 4. Protokolleri belirtilen tamponlar sık sık yapısal analizi için protein saflaştırma kullanılan standart tamponlar bulunmaktadır. Genel olarak, fosfat bazlı tamponlar, yapı çalışmaları için de proteinlerin saflaştırılması için nedeniyle (özellikle 4 ° C'de deneyler için) kristalizasyon damla fosfat kristallerinin oluşumuna özellikle kristalizasyon tarama kaçınılır. Şekil 5'te gösterildiği gibi Ancak, tampon kindlin-3 için stabilize edildi belirlemek için bir Thermofluor tabanlı bir termal kayma deneyi gerçekleştirilmiştir. Kısaca, saflaştırılmış bir protein çözeltisi bu nedenle, 2-boyutlu bir biçim verme eleğine, pH ve sodyum klorür konsantrasyonları bir dizi kapak arabellekleri seyreltilir. Proteinin erime sıcaklığı 20-95 ° C (293-368 K) boyunca katlanmış protein çekirdek içinde hidrofobik tortuları, bağlanan SYPRO Turuncu boyası (molecular Probes) gelen floresan gözlenmesiyle ölçülür. Sıcaklık orta noktası inci hangie protein (geçiş sıcaklığı, T m) Opticon Monitör yazılımı kullanılarak hesaplandı ve 33 başka bir yerde tarif edilmiştir gözler önüne serilir. Kindlin-3 tutarlı bir geçiş sıcaklığı (T m) ile, pH, 7.0-9.0 arası olan yüksek konsantrasyonda sodyum klorür (500 mM) da stabil olduğu gözlendi 55 ° C Ayrıca kindlin-3'ün T m 7,0-7,5 ne olursa olsun, sodyum klorür konsantrasyonunun pH aralığında, yaklaşık 55 ° C olduğu görülmüştür.
Biz kindlin-3 sınırlı proteoliz saflaştırılması sırasında ama yüksek derecede konsantre edilmiş bir protein (~ 15 mg / ml) ve SDS-PAGE analizi, eşit yoğunlukta iki ek polipeptidleri ile sınırlı kirlenme etkisi olduğu bulunmuştur. Şekil 4'te gösterildiği gibi Garip bir biçimde, ancak boyut dışlama kromatografisi ile ilave türlerin herhangi bir işaret yoktur. Bu nedenle protein proteazlar tarafından çentikli olduğu düşünülmektedir, ancak katlanır ve hydrodyn kalırtam uzunluktaki proteinden amically ayırt edilemez. İlginç olarak, Calpain bilinen bir proteaz olduğu pleckstrin homoloji (PH) etki 34 β1-β2 döngü olduğunu ve gözlemleri açıklayabilir Tyrosine373, en kindlin-3 böler. Toplandığı zaman Ayrıca, western blotting polipeptid çifti birinin, bir C-terminal His-etiketi ve dubletin görünür moleküler ağırlığa sahip olduğunu ortaya koymaktadır, 75 kDa, doğal protein olarak aynı moleküler ağırlıkta, eşittir. Saflaştırılmış rekombinant kindlin-3 litre başına Sf9 hücrelerinin (~ 2 g hücre ağırlık) verimi en iyi, 5 mg'dır.
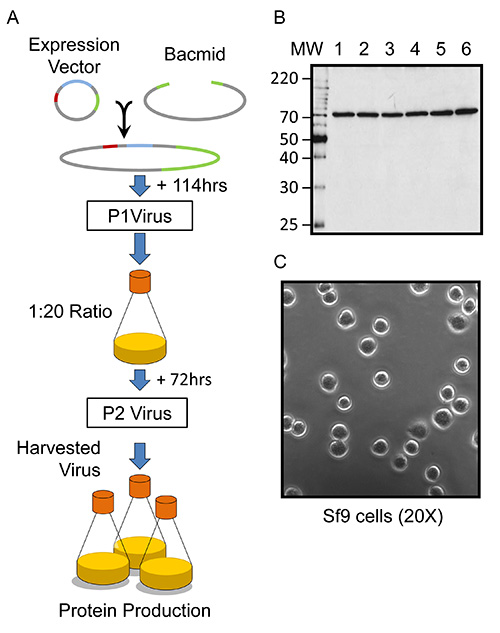
Şekil 1. Bakulovirüs generatio of bakulovirüs enfekte edilmiş böcek hücre heterolog protein ifade bakış. (A) genel şematikSf9 hücrelerinde, n ve kindlin-3 ifadesi. DNA vektörü şemalarda, 5'UTR / ORF603, kırmızı renkli ORF1629 yeşil renkli ve ilgi (POI) protein geni mavi renklidir. (B) Rekombinant bakulovirüs ve rekombinant murin kindlin-3 üreten Sf9 hücreleri, altı küçük ölçekli (2 mi tek katmanlı) kültürleri (kulvarlar kültürüne göre etiketlenmiş) bir anti-His 6 antikoru kullanılarak Western blot,. (C) Sf-900 II SFM içinde süspansiyon içinde yetiştirilmiş sağlıklı Sf9 hücreleri ışık mikroskobu görüntü antibiyotikler ile takviye edilmiş ve bir 35 mm yuvalı doku kültürü çanağı (protokol bakın) transfer edilmiştir. Görüntü 20X büyütme.
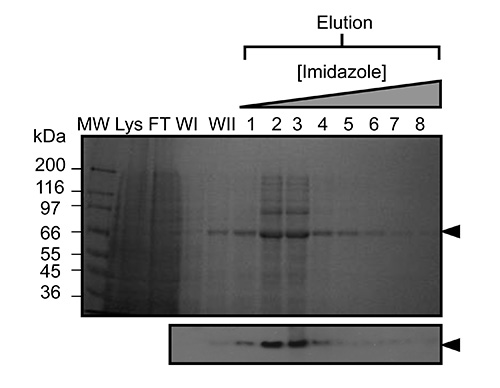
Şekil 2. Huknikel afinite immobilize metal afinite kromatografisi (IMAC) ile kindlin-3'ün ntative saflaştırılması. SDS-PAGE saflaştırılmış rekombinant kindlin-3 Sf9 hücrelerini (~ 2 g hücre ağırlık) olarak ifade edilmiştir, bakülovirüs enfekte edilmiş kemirgen. Adsorbe protein (jel yukarıda gösterilen) bir imidazol gradyanı kullanılarak elüt edilmiştir. Aşağıdaki gibi Lanes etiketlenmiş MW;, molekül ağırlığı işaretleyici; Lys, bütün hücre lizatı, FT, (ciltlenmemiş) akmasına, WI, 1 yıkayın; WII, 2 yıkayın. Western Blot analizi (aşağıda) de rekombinant protein mühendisliği His etiketinin varlığını doğrulamak için elüsyon kesirler kullanılarak gerçekleştirildi. , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
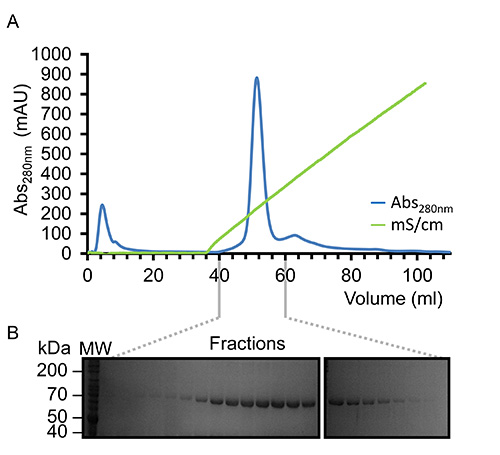
Şekil 3,. Reprekindlin-3 Heparin Afinite Kromatografisi kriteri sentative saflaştırılması. (A) Elüsyon profili 0,05-1,0 M. NaCl konsantrasyon aralığı kullanılarak bir doğrusal bir sodyum klorür gradyanı (yeşil) altında, tek bir simetrik elüsyon tepe gösteren 280 nm (mavi) (gözlenen 75 kDa proteinin varlığını gösteren fraksiyonlara elüsyonun B) SDS-PAGE analizi, kindlin-3 (etiketli K3). , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
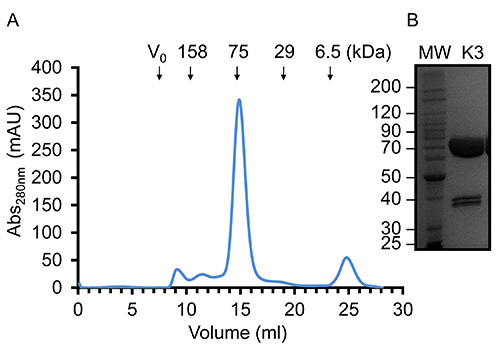
Şekil 4 kullanılarak. Örnek jel filtrasyon kromatografisi ile saflaştırılmış kindlin-3'ün konsantre kindlin-3. (A) Jel süzme elüsyon profili20 ° C'de Tris-HCI, pH 7.5, 150 mM NaCl ve 1 mM DTT içinde bir Superdex S200 (16/60) Elusyon hacminde göre, kindlin-3 göç eder ağırlıklı olarak monomerik olduğunu düşündürmektedir, 75 kDa proteini için beklendiği gibi. (B) SDS-PAGE derece konsantre saflaştırılmış rekombinant kindlin-3 14.5 mg / ml. , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
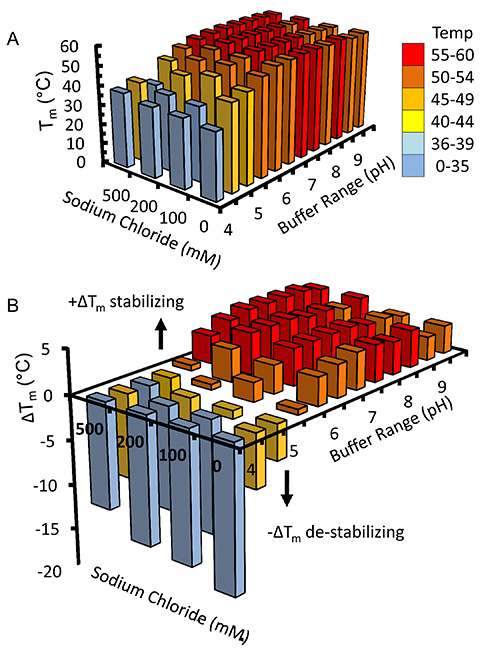
Tampon taranması. Kindlin-3 için Şekil 5,. Thermofluor dayalı termal Shift Assay bir sodyum klorür konsantrasyonuna karşı pH iki boyutlu bir ekran içeren çeşitli tampon içinde seyreltilmiştir. Geçiş sıcaklığı (sıcaklık orta noktası) flüoresanı gözlendihidrofobik olarak bağlanmış boya, SYPRO Orange (Molecular Probes) ile Opticon Monitör yazılımı kullanılarak hesaplandı. (A) bir geçiş sıcaklıklarının bir 3 boyutlu histogram (B) 50.4 ° C, hesaplanan ortalama geçiş sıcaklık değişimi ile birlikte çizilmiştir Anlaşılır olması için çubukları onlar karşılık hangi sıcaklık aralığına göre renkli. , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
Tartışmalar
Bakulovirüs sentezleme sistemleri, giderek daha popüler ve X-ışını kristalografisi gibi biyo-fiziksel çalışmalar kullanılarak protein karakterizasyon için yeniden birleştirici proteinin miligram miktarlarda üretimi için önemli bir araç haline gelmektedir. Daha deneysel talep olmasına karşın bakulovirüs ekspresyon sistemleri E üzerinde çeşitli avantajlar sunar E. coli içinde bir tane uygun şaperonlar ve post-translasyonel modifikasyon için fırsat mevcudiyetinde, örneğin, ökaryotik menşeli proteinler için, bir yakın yerel bir ortamdır. Kindlin-3 ifade için kendi çabaları, alternatif ifadesi barındıran memeli hücre hatları ve bakteriyel ifade suşları (yayınlanmamış gözlemler) dahil olmak üzere kullanılmıştır. Genel olarak, birçok E. coli suşları test edilen yeniden birleştirici kindlin-3 çok küçük miktarlarda (, yayınlanmamış gözlemler ~ 0.5 mg / L kültür) üretti. Ancak, böcek hücrelerinde baculovirüs ekspresyon odaklı co, özellikle etkili olduğu görülmüştür veRekombinant sitoplazmik proteinlerin (yayınlanmamış gözlemler) bir miligram izole edilmesi için gereken büyük biyokütle üretilmesi için daha uygun memeli hücrelerinde, geçici ifade mparison. Biz varlığı ökaryot chaperones kindlin-3 verimli üretim izin verebilir spekülasyon.
Bakulovirüsler böcek hücreleri enfekte edebilir ve rekombinant protein ekspresyonu için bu çalışmada kullanılan bakulovirüs nükleer polihedroz virüsü (AcNPV), Autographa californica dayanır. Doğada Autographa californica (alfalfa Lopper) böcek larvalarını enfekte AcNPV, Virionlar böylece serbest bırakılması için gerekli korumayı temin eden bir kristal protein matrisi içinde kapsüllenir ve böylece oklüzyonlarını oluşturulması için polihedrin proteini gerektirir. Kültürlenmiş hücrelerde oklüzyon cisimlerin oluşumu replikasyonu için gerekli olan ve bu nedenle de vazgeçilebilir olduğunu değildir. Yabancı proteinlerin ifade durumunda, polihedrin geni protein r olabilir,ilgilenilen protein için gen ile bir rekombinant AcNPV içinde eplaced. AcNPV diğer pulkanatlının türleri enfekte edebilir ve rekombinant protein ekspresyon tırtıl Spodoptera frugiperda amaçları için pupa yumurtalık hücreleri kullanılır. O, öyle ki: temel bir viral gen, ORF1629, (KO 1629 BAC10) bir knock-out bakmit sonuçlanan kloramfenikol asetil transferaz yerleştirilmesi ile deaktive edilir ve böylece burada tarif edilen bir yaklaşımda, AcNPV bacmid (BAC10) tasarlanmıştır bulaşıcı baculovirions 28 oluşturamayan. KO 1629 ve FERMT3 içeren transfer vektörü onarımlar da polihedrin promoterinin 28 kontrolü altında FERMT3 genini dahil olan uygun bir genomu içinde elde aktarılması yoluyla etkin ORF1629,: doğrusallaştırılmış BAC10 ile Sf9 hücrelerinin birlikte transfeksiyon.
Bir tasarımda ile kindlin-3, son derece saf rekombinant fare izolasyonu için saflaştırma protokolünü açıklare adım kromatografik yaklaşım. Burada kullanılan metotlar kolayca diğer His-etiketli proteinler de uygulanabilir. Biz daha kindlin-3 saflaştırmak için bir iyon değişim adımı kullanılır fakat biz kindlin-3 kendi F1 etki alanı içindeki bir poli-lizin esnek parçası da dahil bazik tortuların çok sayıda sahip olarak başka bir sözde-afinite adımı olduğuna inanıyoruz. Buna ek olarak, kindlin-3 bağlanan ve bu fonksiyonları, plazma zarının, sitoplazmik yüzü ile etkileşime olarak kabul edilir, ve bu nedenle temel kalıntılarının kümelenme protein, negatif yüklü membran karşı sağlayacak tahmin.
Saflaştırma protokolleri açıklanan tamponlar standart olarak kabul edilir ve sık sık yapısal biyoloji kullanılmaktadır. Thermofluor deneyi (Şekil 5) kindlin-3, pH 6.0 'Yukarıdaki en fazla tampon koşullarında stabil olduğunu göstermektedir. Β1: kinldin-3 eğitim Bu bizim deneyleri bilgilendirmek için özellikle yararlı ve önemli olduğunuNaCI 12 düşük konsantrasyonları ile pH 6.1 'de çok iyi spektrumları elde edildi NMR ile bir kuyruk etkileşimi.
Herhangi bir biyofiziksel çalışma yapılabilir önce, ilgi konusu saflaştırılmış protein gerçekten doğru bir şekilde katlanmış ve fonksiyonel olarak aktif olduğunu göstermek için önemlidir. Önceki bir yayında, rekombinant kindlin-3 olarak ifade ve boyut-dışlama kromatografisi, dinamik ışık saçılımı, Analitik ultrasantrifüj, küçük açılı X ışını dağılımı ile değerlendirilen saflaştırılmış, bu yöntem kullanılarak, çözelti içinde, bir monomer ve tekil dağılımlı olduğunu gösterdi ve oldu Ayrıca, önceki hücre ve fizyolojik çalışmalar 14,20,22 doğrultusunda olan doğal proteini, gibi davranır onaylayan bu nedenle, bağlayıcı ve zara-uzak ve NPxY β 1A sitoplazmik kuyruk 14 üst akışında Serin / Threonin küme tanıma yeteneğine sahip. Termal stabilite deneyinin kullanılması inci düşündüren ek bir yoludurilgi konusu bir proteinin e uygun katlama gibi yanlış katlanmış protein nedeniyle maruz hidrofobik kalıntısı elde etmek, yüksek floresan arka neden olur.
Proteinlerin kindlin aile vivo İntegrinlerin temel Koaktivatörlerin olarak beklenmedik rolü keşfedildi beri çok ilgi odağı olmuştur. Bu rekombinant bunları ifade ve onların yapılarını çözmek için çok çaba tetikledi. Bugüne kadar sınırlı bir başarı tam boyunda biraraya getiren proteinin miligram miktarları ifade eden bildirilmiştir ama biz burada, yapısal çalışmalar, mümkün hale seviyelerde büyük ölçekli ekspresyona izin veren bir bakulovirüs sistemi kullanımını tarif etmişlerdir. Rekombinant kindlin-3 büyük miktarlarda üreterek bu proteinin daha fazla çalışmaları yardım edeceğini tahmin ediyoruz. Rekombinant murin kindlin-3 için, burada açıklanan bakulovirüs odaklı yöntemi ve arıtma akışı aynı zamanda diğer kindlin izoformları ifade edilmesi ve saflaştırılması için kullanılabilir, Burada da ifade etmek ve aynı zamanda, poli-lisin uzanan sahip zor olan, ve ayrıca, bakteriyel suşlar ifade başarısız nükleik asit bağlayıcı proteinler gibi diğer sitoplazmik proteinler için adapte edilebilir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz kültür ve Sf9 hücre stoklarının bakımı için teknik yardım Weixan Lu teşekkür ederim. LAY Tıbbi Araştırma Konseyi (MRC) lisansüstü öğrencilik tarafından desteklenmiştir. RJCG Royal Society Üniversitesi Araştırma Görevlisi oldu. Yapısal Biyoloji Bölümü Oxford İnsan Genetiği, Wellcome Trust Çekirdek Ödülü Hibe Numarası 090532/Z/09/Z için Wellcome Trust Centre parçasıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sf-900 II serum free media (SFM) 1x liquid | Life Technologies | 10902-096 | store at 4 °C and warm to RT before use |
| Cellfectin II Reagent | Invitrogen | 10362-100 | Alternatively, GeneJuice transfection (EMD) reagent can be used |
| Streptomycin sulphate (solid) | Melford | S0148 | Sterilize filter (0.22 μm filter) before use |
| Penicillin G, potassium salt (solid) | Melford | P0580 | Sterilize filter (0.22 μm filter) before use |
| CELLSTAR Sterile 6-well Culture Plate | Greiner Bio-One | 657160 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10100-147 | |
| Protease Inhibitor Cocktail | Sigma | P8849 | Caution: Protease inhibitors are dissolved in DMSO |
| Bovine pancrease deoxyribonuclease (Dnase) I | Sigma | D5025 | |
| HisTrap FF (5 ml) | GE Heathcare | 17-5286-01 | Requires an Äkta FPLC machine |
| HiTrap Heparin (5 ml) | GE Heathcare | 17-0407-01 | Requires an Äkta FPLC machine |
| Amicon Ultra-15 Centrifugal Filter Units (with Ultracel-50 membrane) | Millipore | UFC905024 | 15 ml capacity and a MWCO of 50 kDa protein concentrator |
Referanslar
- Moser, M., Legate, K. R., Zent, R., Fassler, R. The tail of integrins, talin, and kindlins. Science. 895, 899- (2009).
- Yu, Y., et al. Kindlin 2 forms a transcriptional complex with β-catenin and TCF4 to enhance Wnt signalling. EMBO Rep. 13, 750-758 (2012).
- Yu, Y., et al. Kindlin 2 promotes breast cancer invasion via epigenetic silencing of the microRNA200 gene family. Int J Cancer. , (2013).
- Meves, A., Stremmel, C., Gottschalk, K., Fassler, R. The Kindlin protein family: new members to the club of focal adhesion proteins. Trends Cell Biol. 19, 504-513 (2009).
- Siegel, D. H., et al. Loss of kindlin-1, a human homolog of the Caenorhabditis elegans actin-extracellular-matrix linker protein UNC-112, causes Kindler syndrome. Am. J. Hum. Genet. 73, 174-187 (2003).
- Hart, R., Stanley, P., Chakravarty, P., Hogg, N. The kindlin 3 PH domain has an essential role in integrin LFA-1-mediated B cell adhesion and migration. J. Biol. Chem. , (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to Kindlin-2 pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Qu, H., et al. Kindlin-2 regulates podocyte adhesion and fibronectin matrix deposition through interactions with phosphoinositides and integrins. J. Cell Sci. 124, 879-891 (2011).
- Yates, L. A., et al. Structural and Functional Characterisation of the Kindlin-1 Pleckstrin Homology Domain. J. Biol. Chem. 287, 43246-43261 (2012).
- Bouaouina, M., et al. A conserved lipid-binding loop in the kindlin FERM F1 domain is required for kindlin-mediated αIIbβ3 integrin coactivation. J. Biol. Chem. 287, 6979-6990 (2012).
- Goult, B. T., et al. The structure of the N-terminus of kindlin-1: a domain important for AlphaIIbBeta3 integrin activation. J. Mol. Biol. 394, 944-956 (2009).
- Yates, L. A., Fuzery, A. K., Bonet, R., Campbell, I. D., Gilbert, R. J. Biophysical Analysis of Kindlin-3 Reveals an Elongated Conformation and Maps Integrin Binding to the Membrane-Distal β-Subunit NPXY motif. J. Biol. Chem. 287, 37715-37731 (2012).
- Anthis, N. J., Campbell, I. D. The tail of integrin activation. Trends Biochem. Sci. 36, 191-198 (2011).
- Harburger, D. S., Bouaouina, M., Calderwood, D. A. Kindlin-1 and -2 directly bind the C-terminal region of beta integrin cytoplasmic tails and exert integrin-specific activation effects. J. Biol. Chem. 284, 11485-11497 (2009).
- Tadokoro, S., et al. Talin binding to integrin beta tails: a final common step in integrin activation. Science. 302, 103-106 (2003).
- Garcia-Alvarez,, et al. Structural determinants of integrin recognition by talin. Mol. Cell. 11, 49-58 (2003).
- Perera, H. D., Ma, Y. Q., Yang, J., Hirbawi, J., Plow, E. F., Qin, J. Membrane binding of the N-terminal ubiquitin-like domain of kindlin-2 is crucial for its regulation of integrin activation. Structure. 19, 1664-1671 (2011).
- Ussar, S., Wang, H. V., Linder, S., Fassler, R., Moser, M. The Kindlins: subcellular localization and expression during murine development. Exp. Cell Res. 312, 3142-3151 (2006).
- Bialkowska, K., et al. The integrin co-activator Kindlin-3 is expressed and functional in a non-hematopoietic cell, the endothelial cell. J. Biol. Chem. 285, 18640-18649 (2010).
- Moser, M., Nieswandt, B., Ussar, S., Pozgajova, M., Fassler, R. Kindlin-3 is essential for integrin activation and platelet aggregation. Nat. Med. 14, 325-330 (2008).
- Lefort, C. T., et al. Distinct roles for talin-1 and kindlin-3 in LFA-1 extension and affinity regulation. Blood. 119, 4275-4282 (2012).
- Moser, M., et al. Kindlin-3 is required for beta2 integrin-mediated leukocyte adhesion to endothelial cells. Nat. Med. 15, 300-305 (2009).
- Schmidt, S., Nakchbandi, I., Ruppert, R., Kawelke, N., Hess, M. W., Pfaller, K., Jurdic, P., Fassler, R., Moser, M. Kindlin-3-mediated signaling from multiple integrin classes is required for osteoclast-mediated bone resorption. J. Cell Biol. 192, 883-897 (2011).
- Malinin, N. L., et al. A point mutation in KINDLIN3 ablates activation of three integrin subfamilies in humans. Nat. Med. 15, 313-318 (2009).
- Svensson, L., et al. Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat. Med. 15, 306-312 (2009).
- Liu, Y., Zhu, Y., Ye, S., Zhang, R. Crystal structure of kindlin-2 PH domain reveals a conformational transition for its membrane anchoring and regulation of integrin activation. Protein Cell. 3, 434-440 (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to kindlin-2 protein pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Zhao, Y., Chapman, D. A., Jones, I. M. Improving baculovirus recombination. Nucleic Acids Res. 31, (2003).
- Berrow, N. S., et al. A versatile ligation-independent cloning method suitable for high-throughput expression screening applications. Nucleic Acids Res. 35, 45 (2007).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J Struct. Biol. 172, 55-65 Forthcoming.
- Wasilko, D. J., et al. The titerless infected-cells preservation and scale-up (TIPS) method for large-scale production of NO-sensitive human soluble guanylate cyclase (sGC) from insect cells infected with recombinant baculovirus. Protein Expr. Purif. 65, 122-132 (2009).
- Yates, L. A., Fleurdépine, S., Rissland, O. S., De Colibus, L., Harlos, K., Norbury, C. J., Gilbert, R. J. Structural Basis for the activity of a cytoplasmic RNA terminal uridylyl transferase. Nat. Struct. Mol. Biol. 19, 782-787 (2012).
- Sainsbury, S., Ren, J., Saunders, N. J., Stuart, D. I., Owens, R. J. Crystallization and preliminary X-ray analysis of CrgA, a LysR-type transcriptional regulator from pathogenic Neisseria meningitidis MC58. Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. 64, 797-801 (2008).
- Zhao, Y., et al. Regulation of cell adhesion and migration by Kindlin-3 cleavage by calpain. J. Biol. Chem. 287, 40012-40020 Forthcoming.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır