Method Article
La production efficace et purification de recombinant murin Kindlin-3 à partir de cellules d'insectes pour les études biophysiques
Dans cet article
Résumé
Kindlins sont fondamentales pour l'adhésion cellulaire intégrines mais les études d'entre eux ont été entravés par la difficulté rencontrée dans leur expression par recombinaison dans des hôtes bactériens. Nous décrivons ici des procédés pour leur production efficace dans des cellules d'insecte infectées par un baculovirus.
Résumé
Kindlins coactivateurs sont essentiels, avec la taline, des récepteurs de surface cellulaire et les intégrines participent également à l'extérieur de l'intégrine dans la signalisation, et le contrôle de la transcription des gènes dans le noyau cellulaire. Les kindlins sont ~ 75 protéines multidomaines kDa et se lient à un motif NPxY et en amont pôle T / S de l'intégrine β-unité queue cytoplasmique. L'isoforme de Kindlin hematopoietically-importante, Kindlin-3, est essentielle pour l'agrégation des plaquettes au cours de la formation de thrombus, roulement des leucocytes en réponse à l'infection et de l'inflammation et de la formation des ostéoclastes de podocytes dans la résorption osseuse. Le rôle de Kindlin-3 dans ces processus a donné lieu à de nombreuses études cellulaires et physiologiques. Cependant, il existe un besoin pour un procédé efficace d'acquérir quelques milligrammes de haute qualité de la protéine pour des études ultérieures. Nous avons mis au point un protocole, ici décrits, par l'expression efficace et purification de murine Kindlin-3 recombinante par l'utilisation d'un baculovirus-ddéchiré système d'expression dans des cellules Sf9 produisant des quantités suffisantes de haute pureté protéine complète pour permettre sa caractérisation biophysique. La même approche peut être adoptée dans l'étude des autres isoformes de Kindlin mammifères.
Introduction
Les protéines de la famille des Kindlin sont une composante essentielle de l'ensemble d'adhésion focale, et donc indispensable à la vie complexe. Kindlins, dont il existe trois isoformes chez les mammifères (Kindlin-1-2, Kindlin et Kindlin-3), sont considérés comme des co-activateurs des récepteurs extracellulaires intégrines côtés taline 1. l'adhésion cellulaire médiée par l'intégrine relie la surface des cellules à la matrice extracellulaire (ECM) dans les eucaryotes supérieurs. Il s'agit d'un processus critique et commune à une multitude de phénomènes physiologiques, qui comprennent l'intégrité des tissus, l'embryogenèse, le métabolisme de l'os, l'hémostase et l'immunité. l'adhésion cellulaire médiée par l'intégrine est activé par inside-out transduction du signal via la liaison de Talin et Kindlin aux intégrines β-unité queues cytoplasmiques (TC) à leurs motifs NPxY conservées. L'importance biomédicale de protéines Kindlin s'étend cependant pour autant que le noyau, où Kindlin-2 a été démontrée dans plusieurs rapports récents d'être impliqués dans la transcriptional contrôler 2,3.
Kindlins sont des protéines multidomaines d'environ 75 kDa, labellisés par la possession d'un FERM bipartite C-terminale (4.1 bande, Ezrin, radixine, moésine) domaine, qui est interrompu par une homologie de pleckstrine (PH) de domaine au centre de son sous-domaine de F2 4,5. Les études sur les domaines Kindlin-2 et Kindlin-3 PH ont montré qu'il se lie à l'seconds messagers lipidiques phosphatidylinositol (3,4,5) triphosphate-et phosphatidylinositol-(4,5)-bisphosphate 6-8. Cependant, les études du domaine Kindlin-1 PH montrent qu'il se lie à PtdIns (3,4,5) P 3 avec une affinité beaucoup plus faible, ce qui peut s'expliquer en Kindlin-1 par un pont de sel isoforme spécifique de liaison à la prévention de lipides 9. En outre, il existe une boucle ~ 100 d'acide aminé inséré dans le domaine des kindlins F1 qui est prévu comme devant être déplié, mais se lie à la phosphatidylsérine sur le feuillet interne de la membrane plasmique 10,11. Le FERM de Kindlindomaine est considéré comme homologue au domaine talin de FERM, bien que le domaine talin de FERM ne possède pas un domaine pleckstrine. Les deux kindlins taline et interagissent avec des motifs NPxY sur l'intégrine β-queue par l'intermédiaire de la région F3 de leur domaine FERM, mais Kindlin se lie à la membrane motif distale, tandis que la cible taline proximale de la membrane une 16.12. Kindlins et talin fois en plus possèdent un domaine de F0 N-terminal avec un pli de l'ubiquitine-like qui ne se trouve pas dans d'autres protéines FERM 11,17. Des études sur le domaine de F0 de Kindlin-2 ont montré qu'il se lie indépendamment à phosphatidylinositol-(4,5)-diphosphate membranes enrichies en 17.
Les kindlins présentent des profils d'expression tissus paralogue spécifique et les fonctions physiologiques non redondants. Kindlin-1 est principalement exprimé dans l'épiderme, mais aussi dans une moindre mesure du côlon, de l'estomac et les reins; Kindlin-2 est exprimé de façon ubiquitaire mais est concentrée dans strié et lissemusculaire et est le seul Kindlin exprimé dans le développement embryonnaire 4, et Kindlin-3 est exprimé dans les tissus hématopoïétiques avec la plus forte concentration de Kindlin-3 trouvés dans les mégacaryocytes 18. Cependant, des études plus récentes ont suggéré que la protéine fonctionnelle est exprimée dans les tissus endothéliales ainsi 19.
Kindlin-3 est d'un intérêt médical aigu en raison de son rôle physiologique important dans le sang. Il est essentiel pour l'agrégation plaquettaire et la diffusion au cours de la formation de thrombus 20, roulement des leucocytes en réponse à l'infection et de l'inflammation et de la formation des ostéoclastes 21,22 de podocytes dans la résorption osseuse 23. En outre, l'épuisement des Kindlin-3 chez l'homme conduit à l'adhésion des leucocytes carence de type III - une maladie caractérisée par des troubles de saignement menaçant la vie et les infections bactériennes récurrentes 20,24,25. Kindlin-3 études knock-out chez la souris ont révélé le rôle crucial de la protéine dansadhésion cellulaire nature3 -. / - souris présentent des phénotypes distincts, comme des saignements graves dus à des intégrines inactifs de plaquettes, ostéopétrose sévère, et troubles de l'adhérence des leucocytes 20,22, ressemblant à des symptômes chez l'homme manque Kindlin-3.
Haute résolution des données structurelles sur les kindlins, à ce jour, a été limitée à des sous-domaines particuliers tels que l'homologie de pleckstrine (PH) de domaine de Kindlin-1 9 et Kindlin-2 26,27 et le domaine de F0 de Kindlin-1 11 et Kindlin -2 17. La plupart des sous-domaines de chaque polypeptide Kindlin ont cependant résisté clonage et l'analyse structurelle (Yates et Gilbert, observations non publiées), et des études sur les protéines de pleine longueur ont été entravés par la difficulté d'exprimer et de purification de quantités suffisantes en utilisant E. coli (observations non publiées et Harburger et al. 14). Il ya un intérêt médical considérable dans Kindlin-3 et son function, aux côtés des deux autres membres de la famille, et, récemment, nous avons généré quelques milligrammes de celui-ci par l'expression recombinante dans des cellules de Spodoptera frugiperda entraînées par l'infection baculovirus 12. Nous avons donc ici de décrire les méthodes pour la production de quelques milligrammes de souris recombinante Kindlin-3 dans la culture de cellules d'insectes, adapté à de nombreuses études structurales et analyse biochimique.
Dans ce protocole, nous faisons usage d'un bacmide conçu KO (KO BAC10: 1629) c'est-à-seul, incapable de produire des virions viables 28. L'ADN viral est alors recueilli par la recombinaison avec un vecteur de transfert qui, dans ce cas inclut également le gène Kindlin-3 (FERMT3) et des résultats dans le gène FERMT3 remplaçant le virus très tard gène qui est fortement exprimé, mais redondant, ce qui entraîne un recombinant virus qui exprime la souris Kindlin-3 en tant que partie du cycle de vie du virus 28. Nous avons identifié ceProcédé pour la production de Kindlin-3 après des tentatives d'exprimer et de purifier dans d'autres hôtes d'expression se sont avérés excessivement difficile (observations non publiées), mais aussi en raison de la polyvalence du vecteur bains Popin, que nous avons utilisé pour le clonage et que pouvons déployé dans de nombreux expression accueille 29.
Protocole
Ce protocole suppose que la souris Kindlin-3 gène (FERMT3) a été clone avec succès dans un vecteur en aval du promoteur p10 très tard, et que le vecteur possède les séquences flanquantes de baculovirus pour permettre la recombinaison avec le bacmide BAC10 KO: 1629 développé par IM Jones et collègues 28. Pour ce protocole, le gène Kindlin-3 a été cloné dans pOPINE 29 et les amorces et la stratégie de clonage utilisés peut être trouvée décrit ailleurs 12. Le plasmide est conçu de telle sorte que le gène FERMT3 (Kindlin-3) est sous le contrôle de la p10 du baculovirus promoteur et le vecteur contient 5 'UTR/ORF603 et ORF 1629 et code pour un son 6-tag C-terminal pour la purification en aval 29.
Une. Insect Cell Culture et entretien
- Avant de baculovirus recombinant amplification, les cellules de Spodoptera frugiperda adapté à la culture en suspension (cellules Sf9) doiventêtre développée et maintenue. Les cellules d'insectes doivent être manipulés en utilisant des techniques aseptiques dans une culture tissulaire hotte dédiée.
- Les cultures en suspension de cellules d'insectes sont mises à incuber dans Sf-900 II (SFM) un milieu liquide exempt de sérum supplémenté avec de la pénicilline 100 pg / ml et 100 pg / ml de streptomycine dans des flacons à 27 ° C sous agitation à 100 tours par minute.
- Maintenir la plage de densité de la culture de cellules d'insecte entre 1 x 10 6 - 1 x 10 7 cellules / ml par dilution de la séparation et de la culture cellulaire avec des produits frais Sf-900 II médias.
Remarque: saine cellules devraient regarder de taille uniforme et doivent être de forme sphérique. - Compter le nombre de cellules dans un volume d'échantillon en utilisant un hémocytomètre et la microscopie à lumière pour calculer la densité cellulaire de la culture.
2. Génération de baculovirus recombinant
- Culture et maintenir en suspension des cellules Sf9 en utilisant Sf-900 II milieu supplémenté avec 100 ug / ml penicillin et 100 pg / ml de streptomycine. Pour la production de baculovirus, des cellules d'insectes doivent être mises en culture à une plage de densité de 5 x 10 5 - 1 x 10 6 cellules / ml.
- Graine d'environ 1 x 10 6 cellules Sf9 par puits d'un tissu à 6 puits plaque de culture stérile dans 2 ml de Sf-900 II milieu complété avec de la pénicilline 100 pg / ml et 100 pg / ml de streptomycine. Laisser les cellules Sf9 à TA dans la hotte à adhérer au fond des puits en plastique et ainsi former une monocouche.
- Effectuer la génération de baculovirus recombinant par co-transfection de l'ADN de bacmide et l'ADN plasmidique sur une culture monocouche.
- Pour chaque transfection, mélanger 1-2 pg de purifié pOPINE-mFERMT3, qui possède les éléments ORF1629 baculovirus, avec 0,5 pg de purifié BAC10 KO: 1629 dans 100 pi de Sf-900 II SFM sans antibiotiques (solution A).
- Dans un tube séparé, diluer 6 pi de Cellfectin II réactif avec 100 pi de Sf-900 II SFM sans contrebiotiques pour chaque réaction de transfection (Solution B). Un «mélange maître» peut être créé ici, pour la manipulation de liquides réduite, si de nombreux transfections sont nécessaires.
- Mélanger les deux solutions (A et B, environ 200 ul) et incuber à température ambiante pendant 20 min pour former un complexe lipide-ADN.
- Diluer les complexes lipide-ADN avec 800 pi Sf-900 II SFM sans antibiotiques. Aspirer délicatement le support monocouche de cellules Sf9 et pipetage soigneux la solution A / B et les médias sur le dessus de la monocouche Sf9.
- Incuber les cellules transfectées dans un incubateur humidifié à 27 ° CO / N et ajouter encore 1 ml de Sf-900 II SFM sans antibiotiques pour chaque culture monocouche le lendemain. Incuber les cellules à 27 ° C pendant encore 5 jours.
- Récolter le baculovirus recombinant directement à partir du milieu de culture (environ 2 ml au total) et transférer dans un tube à centrifuger propre (par exemple un tube Falcon de 15 ml).
- Clarifier une cellule debr Sf9est par centrifugation à 1000 xg pendant 5 min à température ambiante. Transférer le virus, qui est dans le surnageant résultant et notée P1, dans un tube propre et conserver à 4 ° C dans l'obscurité jusqu'à utilisation. A ce stade, la monocouche Sf9 restante peut être utilisée pour évaluer la production de virus recombinant par l'évaluation de la présence de Kindlin-3 recombinant dans des cellules d'insectes.
- Reprendre la monocouche avec 0,5 ml de PBS et diluer un échantillon de 10 pi avec des volumes égaux de 2x tampon SDS-PAGE chargement. Chauffer les échantillons à> 95 ° C pendant au moins 10 min.
- Soniquer l'échantillon pendant 1 sec à 10% d'amplitude en utilisant une pointe de micro-appareil à ultrasons si elle est trop visqueux pour chargement du gel.
3. Amplification de baculovirus recombinant
- Pour l'amplification du virus dans la suspension, en utilisant une densité de cellules de 1,4 x 10 6 cellules / ml, ce qui devrait occuper au 1/20 du volume de la fiole totale (c'est à dire 50 ml de culture dansun flacon de 2 litres).
- Réaliser l'amplification du virus recombinant en infectant la culture de cellules d'insecte avec le stock viral P1 à une multiplicité d'infection (MOI) de 0,1 à l'aide de la formule suivante;

Remarque: la génération de virus de P1 peut être supposé avoir un titre viral attendu de 1 x 10 7 pfu / ml. Cependant, un dosage de plaque peut être réalisée avant cette étape. - Incuber la culture d'insecte infectées par P1 à 27 ° C sous agitation à 100 rpm pendant 3 jours (72 heures).
- Récolter le virus par la séparation des cellules des supports par centrifugation à 1000 xg pendant 5 min à température ambiante. Enregistrer le culot cellulaire obtenu à ce stade, pour la confirmation de la production du virus recombinant en évaluant Kindlin 3-expression de la protéine par SDS-PAGE et western blot.
- Transférer les médias de virus enrichi clarifiées dans un tube propre et conserver à 4 ° C dansl'obscurité jusqu'à utilisation. Ce stock viral est notée P2.
Note: A titre viral de 2 x 10 8 pfu / ml (soit un taux de 100 pfu / cellule d'amplification) peuvent être anticipés.
4. Expression de Kindlin-3 infectées par un baculovirus Sf9
- Cultiver un volume suffisant de cellules Sf9 cultures en suspension dans Sf-900 II SFM supplémenté avec 100 ug / ml de pénicilline et 100 pg / ml de streptomycine, préalablement à grande échelle Kindlin-3 recombinant expression pour la purification. Incuber les cultures en suspension à 27 ° C sous agitation à 100 tours par minute et avec un volume total de culture: flacon rapport en volume de 1:5.
- Infecter des cultures en suspension de cellules Sf9 à une densité de 2 x 10 6 cellules / ml.
- Supplément cultures Sf9 avec une concentration finale de 1% (v / v) de sérum bovin fœtal (FBS), suivie par le virus recombinant amplifié (P2-viral magasin) pour donner une MOI de 1. Incuber les cultures infectées à 27 ° C sous agitation à 100 tours par minute.
- Récolte recombinaisonnt Kindlin-3-CHIS 6 cellules exprimant Sf9 72 heures après l'infection par centrifugation à 1000 xg et le culot cellulaire résultant conservé à -20 ° C jusqu'au moment de l'utilisation, ou -80 ° C pour stockage à long terme.
5. La purification du recombinant Kindlin-3
- Décongeler cellule d'insectes infectées par un baculovirus (Sf9) pastilles exprimant recombinant Kindlin-3 sur la glace.
- Remettre en suspension le culot de cellules décongelé avec un tampon de lyse (50 mM Tris-HCl, pH 7,5, NaCl 500 mM, 1% (v / v) de Tween-20), complété par un inhibiteur de protease sans EDTA cocktail et 1,000-2,000 U de DNase1.
Remarque: En variante, la solution tampon phosphate modifié (PBS) peut également être utilisé, où la concentration en NaCl est ajustée à 500 mM pour éviter les interactions non spécifiques entre endogènes protéines de cellules Sf9 et la colonne d'affinité avec un métal immobilisé utilisée pour la purification en aval (voir ci-dessous). - Lyser les cellules en incubant les cellules remises en suspension avec le détergent et vortexing. Traitement par ultrasons (amplitude 40%, 10 cycles de 10 impulsions de 10 secondes suivie d'un refroidissement sec) de l'échantillon pour obtenir la rupture des cellules dans un bain de glace ou encore d'utiliser un homogénéisateur Dounce.
- Clarifier le lysat par centrifugation à 48 000 x g pendant 1 h à 4 ° C. Charger le surnageant résultant sur une colonne HisTrap (5 ml de volume de colonne), pré-équilibrée avec du tampon de lyse à 4 ° C à un débit de 1 ml / min.
Remarque: En variante, le lysat clarifié peut être incubée avec un volume de lit de 1 à 5 ml de billes de sépharose de nickel pré-équilibrée (par exemple Ni Sepharose 6 Fast Flow) à 4 ° C pendant 1-2 heures. Une colonne de Ni-Sepharose peut être formée après l'étape de liaison à l'aide d'une colonne à écoulement par gravité. - Lavez colonne avec 10 volumes de colonne tampon laver (50mM Tris HCl pH 7,5 NaCl 500mM mM imidazole 10) remouvoir protéines brochés.
- Utiliser un gradient d'imidazole linéaire de 10 à 500 mM à un débit de 10 mM / ml (ou dans 10 volumes de colonne) à l'aide d'une FPLC Äkta pour éluerrecombinant Kindlin-3-6 lié CHIS.
- Fractionner l'élution en fractions de 0,5 à 1 ml à l'aide de la FPLC Äkta, avec les fractions contenant Kindlin-3-CHIS 6 éluant habituellement à une concentration d'imidazole de 300 mM.
- Évaluer la composition de protéine de l'éluant par SDS-PAGE et purifications pour la première fois les confirmer par western blot en utilisant un anticorps anti-His 6 ou anticorps anti-souris Kindlin 3-anticorps.
- Réunir les fractions contenant Kindlin-3 et échange de tampon en 20 mM Tris-HCl, pH 7,5, 200 mM de NaCl à travers une série de dilutions dans du tampon et les concentrations échantillon en utilisant un concentrateur de protéine centrifuge avec un 50 kDa de poids moléculaire limite (MWCO) à 4 ° C.
Remarque: En variante, on dialyse la solution de protéine à l'aide Slide-A-lyseur cassette de dialyse avec un MWCO de 30 kDa à 4 ° C pendant 4 heures à O / N dans 20 mM Tris-HCl, pH 7,5, 200 mM de NaCl.
Remarque: pour l'échange d'ions (voir ci-dessous) d'une concentration plus faible de NaCl, ie 50 mM, peut être et a été utilisé pour cette étape. - Appliquer la solution de protéine à un échange de tampon sur une colonne pré-équilibrée héparine HiTrap HP (5 ml de volume de colonne) en utilisant une FPLC Äkta à un débit de 0,5 ml / min.
Remarque: Le Kindlin-3 liée est éluée en utilisant un gradient linéaire de NaCl (0,2 M de NaCl à 1 M de NaCl) dans le même tampon, ce qui augmente à un taux de 10 mM / ml. Kindlin-3-CHIS6 est prévu pour éluer à environ 0,6 M de NaCl. - Fractionner l'élution dans 0,5-1 ml de fractions et d'évaluer la composition des protéines par SDS-PAGE et Western blot, le cas échéant.
Nota: on peut s'attendre à un degré de pureté de la protéine de près de 95%, tel qu'évalué par SDS-PAGE. - fractions de piscine contenant Kindlin-3 et on concentre en utilisant un concentrateur de protéine de la centrifugeuse avec une kDa MWCO 50 à un volume final de 0,5 à 2 ml.
- Dans une dernière étape, polir la protéine concentrée et échanger le tampon de la protéine en utilisant une Chromatographie d'exclusion de taille (SEC).
- Appliquer la protéine purifiée sur un Superdex S200 (16/60) ou (10/30) pré-équilibrée dans 20 mM de Tris-HCl, pH 7,5, NaCl 200 mM, DTT 1 mM à un débit de 1 ml / min ou 0,5 ml / min selon la taille de la colonne utilisé.
Remarque: la chromatographie d'exclusion de taille peut également être effectuée dans une solution saline tamponnée au phosphate (PBS), si nécessaire. - Purifier les protéines en fonction de la taille par l'application d'un tampon sur la colonne à un débit de 1 ml / min ou 0,5 ml / min, en fonction de la taille de la colonne utilisée.
Remarque: La protéine éluée de la colonne est fractionné et contrôlé en utilisant l'absorbance à 280 nm. - Un pic d'absorbance unique devrait être attendu de SEC, qui est fractionnée et évaluée par SDS-PAGE afin de déterminer l'homogénéité, et est typiquement> 95% pure après cette étape.
- Appliquer la protéine purifiée sur un Superdex S200 (16/60) ou (10/30) pré-équilibrée dans 20 mM de Tris-HCl, pH 7,5, NaCl 200 mM, DTT 1 mM à un débit de 1 ml / min ou 0,5 ml / min selon la taille de la colonne utilisé.
- Concentrer le purifie Kindlin-3-CHIS 6 en utilisant un concentrateur de protéine de la centrifugeuse avec une kDa MWCO de 50 à ~ 15 mg / ml, telle qu'évaluée par spectrophotométrie en utilisant un coefficient d'extinction calculé (ε) de 109 320 M -1 cm -1 </ Sup> (en supposant que tous les résidus cystéine sont réduits).
- Pour le stockage à -20 ° C et le stockage à long terme à -80 ° C, aliquote de la protéine dans des tubes PCR et le flash-congeler les échantillons dans de l'azote liquide. En variante, la protéine peut être utilisée directement pour la recherche en utilisant un certain nombre de techniques biochimiques et biophysiques.
Résultats
L'expression à grande échelle de souris recombinante Kindlin-3 en utilisant des cellules Sf9 infectées par un baculovirus peut prendre moins de deux semaines pour obtenir des quantités en milligrammes, comme illustré dans la figure schématique 1A et nécessite seulement une petite quantité d'ADN plasmidique à partir d'un kit QIAprep Miniprep, pour exemple. La génération de baculovirus recombinant est obtenu par co-transfection des cellules Sf9 avec des souris Kindlin-3 (FERMT3) contenant un plasmide avec un bacmide linéarisé conçu (BAC10: KO 1629) et la récolte des virions nouvellement formés au bout de 5-7 jours, comme le montre la Figure 1A. Cette méthode de génération du baculovirus dans des virus recombinants de 100% et distribue essentiellement la nécessité d'une purification sur plaque 28,30. Un représentant de la culture à petite échelle (2 ml monocouche) va générer une solution contenant le virus recombinant avec un titre viral attendu d'unités de formation de 1 x 10 7 de plaque (pfu) par ml deculture. On peut effectuer un essai de plaque pour déterminer le titre viral réelle mais ce n'est peut-être trop de travail quand un grand nombre de constructions sont testés pour des études structurales. Le succès de l'étape de génération de virus peut être évaluée en utilisant un plasmide contenant eGFP-en parallèle, ou, pour cette Kindlin-3 d'assemblage, la monocouche Sf9 peut être remis en suspension dans du PBS et évaluée par SDS-PAGE et transfert de Western, qui illustre typiquement une bande claire correspondant à un 75 kDa marquée par His, comme le montre la figure 1B. Le virus est ensuite amplifié pour générer des quantités suffisantes pour à grande échelle (volume d'un litre) infection de cellules d'insecte et l'isolement de la protéine recombinante. Le virus de la deuxième passage (P2) est généré en infectant des cultures en suspension à une MOI d'environ 0,1 (voir le protocole). Il est essentiel que l'amplification Sf9 culture en suspension occupe seulement vingtième du volume du ballon totale. Cette aération supplémentaire assure que la résultante virnous contenant médias, récoltées dans les 3 jours (72 h) après l'infection, va générer des quantités suffisantes de Kindlin-3 dans la culture d'expression ultérieure. Le stock de virus amplifié (P2) est supposé posséder un titre viral attendu de 2 x 10 8 pfu / ml sur la base d'une estimation prudente de 100 pfu / cellule en utilisant une densité de cellules de 2 x 10 6 cellules / ml au cours de l'amplification 31. En général, pour l'amplification optimale de baculovirus et la production de protéine, les cellules Sf9 doivent être uniformes en taille et en forme sphérique, comme le montre la figure 1C. En outre, l'amplification et l'expression des protéines virales est maximale à 72 heures après l'infection, et les deux sont significativement réduite à 96 heures après l'infection.
Une fois que le virus a été amplifié et utilisé pour infecter des cellules Sf9 dans des expériences à grande échelle recombinant Kindlin-3 est partiellement purifié par la vertu de son extrémité C-terminale His 6-tag immobilisé en utilisant la chromatographie d'affinité sur ions métalliques par géniegraphie, comme représenté sur la figure 2. Il est important d'effectuer la purification à 4 ° C et que les inhibiteurs de la protéase ont été ajoutés suffisantes pour empêcher une protéolyse. Le Kindlin-3 partiellement purifiée est encore purifiée à homogénéité proche par chromatographie d'échange d'ions (CEI) en utilisant une colonne d'héparine, comme le montre la figure 3. Nous avons utilisé l'utilisation d'une colonne d'héparine au lieu d'une colonne classique d'échange ionique, comme nous avons prédit que le grand nombre de résidus basiques, y compris un tronçon de poly-lysine à l'intérieur du domaine Kindlin-3 F1, serait interagir fortement avec les groupes sulfates chargés négativement de la colonne. Cette stratégie est particulièrement utile pour l'ADN et des protéines liant l'ARN avec des plaques de liaison aux acides nucléiques de base, par exemple la borne de liaison à l'ARN uridylyl-transférase CID1 32. Enfin Kindlin-3 pureté est "poli" par chromatographie d'exclusion stérique pour éliminer les agrégats et obtenir une homogénéité, comme le montreFigure 4. Les tampons spécifiées dans les protocoles sont tampons standard fréquemment utilisées dans la purification des protéines pour l'analyse structurelle. Généralement, les tampons à base de phosphate sont évités pour la purification de protéines pour des études structurales, en particulier la cristallisation préalable due à la formation de cristaux de phosphate dans les gouttes de cristallisation (en particulier pour les expériences à 4 ° C). Cependant, nous avons effectué un dosage par déplacement thermique à base de Thermofluor pour déterminer quels tampons se stabilisent pour Kindlin-3, comme le montre la figure 5. Brièvement, une solution de protéine purifiée est diluée dans des tampons qui couvrent une gamme de concentrations en chlorure de sodium de pH et, par conséquent, la formation d'un écran de dimension 2. La fusion de la protéine est mesurée en observant la fluorescence de Sypro colorant orange (sondes moléculaires), qui se lie aux résidus hydrophobes au sein du noyau de la protéine repliée, au dessus de la plage de température de 20 à 95 ° C (293 à 368 K). Le point médian température à laquelle èmee protéine se déroule (température de transition, T m) a été calculée à l'aide du logiciel Opticon Monitor et est décrit ailleurs 33. Kindlin-3 a été observée pour être stables à des concentrations de chlorure de sodium élevées (500 mM) à l'intérieur de la plage de pH 7,0 à 9,0, avec une température de transition uniforme (T m) de 55 ° C. Il a également été observé que la Tm de Kindlin-3 était d'environ 55 ° C dans la plage de pH de 7,0 à 7,5 quelle que soit la concentration en chlorure de sodium.
Nous avons trouvé qu'il y avait une protéolyse limitée de Kindlin-3 au cours de la purification, mais l'analyse SDS-PAGE de protéines hautement concentré (~ 15 mg / ml) ont démontré une contamination limitée avec deux polypeptides complémentaires d'égale intensité. Curieusement, cependant il n'y a aucune indication d'espèces supplémentaires par chromatographie d'exclusion stérique, comme le montre la figure 4. Il est donc estimé que la protéine est entaillé par des protéases mais reste plié et hydrodynamically indiscernable de protéine complète. Fait intéressant, la calpaïne est une protéase qui clive connu Kindlin-3 à Tyrosine373, qui est dans la boucle β1-β2 de l'homologie de la pleckstrine (PH) de domaine et 34 peuvent expliquer les observations. En outre, un transfert de Western révèle que l'un des doublets de polypeptide possède un His-tag C-terminal et le poids moléculaire apparent de la doublet, lorsque additionnées, est égal à 75 kDa, la même masse moléculaire que la protéine native. Le rendement de Kindlin-3 recombinante purifiée par litre de cellules Sf9 (~ poids de cellules de 2 g) est, au mieux, 5 mg.
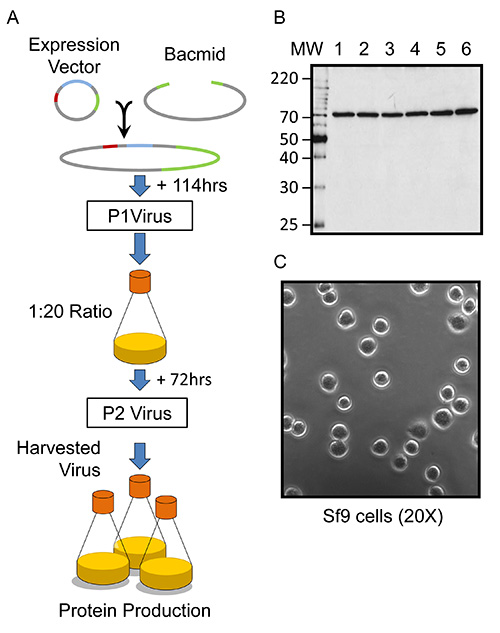
Figure 1. Aperçu Aperçu des baculovirus-cellules d'insectes infectées hétérologue expression de la protéine. (A) schématisé de generatio baculovirusn et l'expression de Kindlin-3 dans des cellules Sf9. Dans les schémas de vecteur d'ADN, 5'UTR / ORF603 est coloré en rouge, le ORF1629 est coloré en vert et, le gène de la protéine d'intérêt (POI) est de couleur bleue. (B) Western blot, en utilisant un anticorps anti-His 6, de six à petite échelle (2 ml) de cultures mono-couche (couloirs étiquetés conformément à la culture) de cellules Sf9 produisant le baculovirus recombinant murin et Kindlin-3 recombinant. (C) Image en microscopie optique des cellules Sf9 saines cultivées en suspension dans Sf-900 II SFM complété avec des antibiotiques et transféré dans une boîte de culture de tissus ainsi de 35 mm (voir protocole). L'image est un grossissement de 20x.
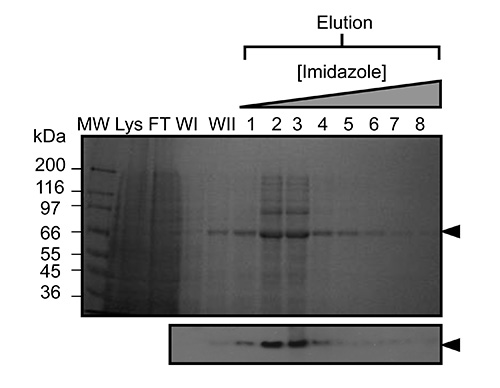
Figure 2. Represepurification de ntative Kindlin-3 par chromatographie d'affinité sur ions métalliques immobilisés (IMAC). SDS-PAGE de l'affinité de nickel purifiée recombinante murine Kindlin-3 exprimé dans des cellules Sf9 infectées par le baculovirus (~ 2 g de poids de cellules). Protéine adsorbée a été éluée en utilisant un gradient d'imidazole (illustré ci-dessus le gel). Voies sont étiquetés comme suit: MW, marqueur de poids moléculaire; Lys, lysat de cellules entières; FT, traversent (non consolidé); WI, laver 1; WII, laver 2. Analyse par Western blot (ci-dessous) a également été réalisée en utilisant les fractions d'élution de confirmer la présence de l'His-tag conçu sur la protéine recombinante. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
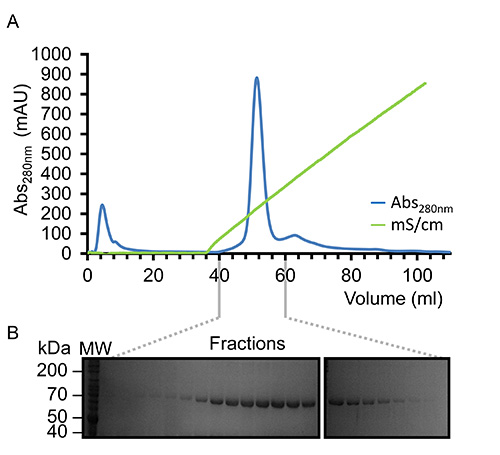
Figure 3. Représenterpurification sentant de Kindlin-3 par héparine Chromatographie d'affinité. (A) Profil d'élution observé à 280 nm (bleu) d'afficher un seul pic symétrique en éluant avec un gradient de chlorure de sodium linéaire (vert) en utilisant la gamme de concentration de NaCl de 0,05-1,0 M. ( B) analyse SDS-PAGE de l'élution fractionnée en évidence la présence de la protéine de 75 kDa, Kindlin-3 (K3 marqué). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
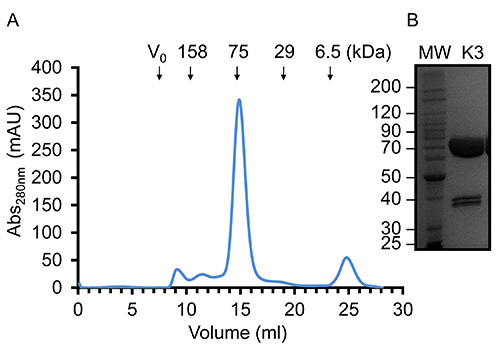
Figure 4. Représentative Chromatographie de filtration sur gel et concentré Kindlin-3 (A). Filtration sur gel profil d'élution de Kindlin-3 purifié à l'aideune Superdex S200 (16/60) dans du Tris-HCl, pH 7,5, NaCl 150 mM et DTT 1 mM à 20 ° C. Sur la base du volume d'élution, Kindlin-3 migre comme attendu pour une protéine de 75 kDa, ce qui suggère que ce sont principalement monomérique. (B) SDS-PAGE de très concentré recombinant purifié Kindlin-3 à 14,5 mg / ml. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
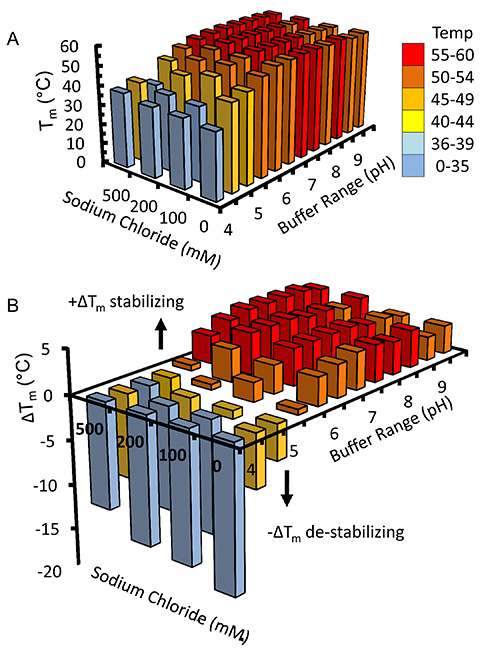
À base d'Thermofluor Figure 5. Dosage par déplacement thermique pour Buffer dépistage. Kindlin-3 a été dilué dans différents tampons comprenant un écran à deux dimensions de pH par rapport à la concentration en chlorure de sodium. températures de transition (température moyenne de points) ont été observées par fluorescence de lacolorant hydrophobe lié, Sypro orange (sondes moléculaires) et calculée à l'aide du logiciel Opticon Monitor. (A) Un histogramme 3D des températures de transition est tracée conjointement avec (B) le changement de la température de transition à partir de la moyenne calculée de 50,4 ° C. Pour plus de clarté les barres sont colorés en fonction de la gamme de températures auxquels ils correspondent. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Systèmes d'expression de baculovirus sont de plus en plus populaire et un outil important pour la production de quelques milligrammes de protéines recombinantes pour la caractérisation des protéines en utilisant des études biophysiques, y compris cristallographie aux rayons X. En dépit d'être plus exigeant expérimentalement les systèmes d'expression de baculovirus offrent plusieurs avantages par rapport à E. coli dont l'un est un environnement quasi-native des protéines d'origine eucaryote par exemple la présence d'accompagnateurs et possibilité de modification post-traductionnelle appropriés. Dans nos propres efforts pour exprimer Kindlin-3, hôtes d'expression alternatifs ont été utilisés, y compris des lignées de cellules de mammifères et des souches d'expression bactériens (observations non publiées). En général, le nombre E. coli souches testées ont produit de très petites quantités de recombinant Kindlin-3 (~ 0,5 mg / L de culture; observations non publiées). Toutefois, l'expression entraînée baculovirus en cellules d'insectes a été particulièrement efficace et, en comparison à l'expression transitoire dans des cellules de mammifères, plus enclins à le générer la grande biomasse nécessaire pour isoler milligrammes de protéines cytoplasmiques recombinantes (observations non publiées). Nous pensons que la présence de chaperons eucaryotes peuvent permettre la production efficace de Kindlin-3.
Les Baculoviridae infectent les cellules d'insectes et d'expression de protéines recombinantes baculovirus utilisée dans ce travail est basé sur la Autographa californica virus de la polyédrose nucléaire (AcNPV). Dans la nature, la AcNPV, qui infecte la Autographa californica (luzerne sécateur) de larves d'insectes, nécessite la protéine polyhédrine pour former des occlusions laquelle les virions sont encapsulés dans une matrice protéique cristalline offrant ainsi la protection nécessaire pour leur libération. Dans les cellules en culture la formation de corps d'occlusion n'est pas requise pour la réplication et est donc indispensable. Dans le cas de l'expression de protéines étrangères du gène de la protéine de la polyhédrine peut être replaced dans un AcNPV recombinant avec le gène codant pour la protéine d'intérêt. AcNPV peut infecter d'autres espèces lépidoptères et aux fins de ver protéine de l'armée d'expression recombinant Spodoptera frugiperda cellules ovariennes de nymphose sont utilisés. Dans l'approche décrite ici, le bacmide AcNPV (BAC10) est conçu de telle sorte qu'un gène viral essentiel, ORF1629, est inactivé par l'insertion de la chloramphénicol acétyl transférase entraîne une bacmide knock-out (BAC10: KO 1629), tel qu'il est incapable de former baculovirions infectieuses 28. La co-transfection de cellules Sf9 avec BAC10 linéarisé: KO 1629 et les FERMT3 contenant transfert vecteur répare la ORF1629 inactif, par transposition, résultant dans un génome viable qui a également intégré le gène FERMT3 sous le contrôle du promoteur de la polyédrine 28.
Nous décrivons un protocole de purification pour l'isolement de souris recombinante hautement pur Kindlin-3 par l'intermédiaire d'un three étape approche chromatographique. Les méthodes utilisées ici pourraient facilement être appliquées à d'autres protéines His-marqués. Nous avons utilisé une étape d'échange d'ions pour purifier davantage Kindlin-3, mais nous croyons qu'il s'agit d'une nouvelle étape de pseudo-affinité Kindlin-3 possède un grand nombre de résidus de base, y compris un tronçon de poly-lysine dans son domaine de F1. En outre, Kindlin-3 est considéré se lier à et coopérer avec la face cytoplasmique de la membrane plasmique, où il fonctionne, et par conséquent nous prévoyons que le regroupement de résidus basiques permettra à la protéine pour contrer la membrane chargée négativement.
Les tampons décrits dans les protocoles de purification sont considérés comme standard et sont fréquemment utilisées dans la biologie structurale. Le dosage de thermofluor (figure 5) montre que Kindlin-3 est stable dans la plupart des conditions de tampon au-dessus de pH 6,0. Cela a été particulièrement utile et important d'informer nos expériences lors de l'étude kinldin-3: β1Une queue interaction par RMN, ce qui a donné une excellente spectres à pH 6,1 avec de faibles concentrations de NaCl 12.
Avant toute étude biophysique peut être réalisée, il est important de démontrer que la protéine purifiée d'intérêt est effectivement correctement plié et il est fonctionnellement actif. Dans une publication précédente, nous avons démontré que le Kindlin-3 recombinante exprimée et purifiée en utilisant cette méthode était un monomère et monodisperse en solution, tel qu'évalué par chromatographie d'exclusion stérique, diffusion dynamique de la lumière, ultracentrifugation analytique et petit angle diffraction des rayons X, et était également capable de se lier et de reconnaître la NPxY membrane distale et groupe sérine / thréonine en amont de β 1A queues cytoplasmiques 14, confirmant ainsi qu'il se comporte comme la protéine native, qui est en ligne avec les études cellulaires et physiologiques précédentes 14,20,22. L'utilisation d'un essai de stabilité thermique est un moyen supplémentaire de proposer èmee repliement correct d'une protéine d'intérêt, en tant que protéine incorrectement repliée entraîne un bruit de fond élevé de fluorescence due à des résidus hydrophobes exposés.
La famille de Kindlin de protéines a été l'objet de beaucoup d'attention car leur rôle inattendu comme co-activateurs essentiels de intégrines in vivo a été découvert. Cela a déclenché beaucoup d'efforts pour les exprimer par recombinaison et de résoudre leurs structures. A ce jour un succès limité a été rapporté dans l'expression de quelques milligrammes de plein protéine recombinante de longueur, mais nous avons ici décrit l'utilisation d'un système baculovirus qui permet l'expression à grande échelle à des niveaux où les études structurelles deviennent possible. En générant de grandes quantités de recombinant Kindlin-3, nous prévoyons que cela aidera d'autres études de cette protéine. Le procédé et le flux de travail entraînée purification décrit ci-baculovirus recombinant murin pour Kindlin-3 peut aussi être utilisé pour exprimer et purifier les autres isoformes de Kindlin, Qui sont également difficile à exprimer et également posséder des tronçons de poly-lysine, et peut en outre être adapté pour d'autres protéines cytoplasmiques, telles que des protéines de liaison d'acide nucléique, qui ne parviennent pas à exprimer dans des souches bactériennes.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions Weixan Lu pour l'assistance technique dans la culture et l'entretien des stocks de cellules Sf9. LAY a été soutenue par un Conseil de recherches médicales (CRM) bourse d'études supérieures. RJCG était un chercheur de l'Université Royal Society. La Division Oxford de Biologie Structurale fait partie du Wellcome Trust Centre for Human Genetics, Wellcome Trust de base d'attribution des subventions Nombre 090532/Z/09/Z.
matériels
| Name | Company | Catalog Number | Comments |
| Sf-900 II serum free media (SFM) 1x liquid | Life Technologies | 10902-096 | store at 4 °C and warm to RT before use |
| Cellfectin II Reagent | Invitrogen | 10362-100 | Alternatively, GeneJuice transfection (EMD) reagent can be used |
| Streptomycin sulphate (solid) | Melford | S0148 | Sterilize filter (0.22 μm filter) before use |
| Penicillin G, potassium salt (solid) | Melford | P0580 | Sterilize filter (0.22 μm filter) before use |
| CELLSTAR Sterile 6-well Culture Plate | Greiner Bio-One | 657160 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10100-147 | |
| Protease Inhibitor Cocktail | Sigma | P8849 | Caution: Protease inhibitors are dissolved in DMSO |
| Bovine pancrease deoxyribonuclease (Dnase) I | Sigma | D5025 | |
| HisTrap FF (5 ml) | GE Heathcare | 17-5286-01 | Requires an Äkta FPLC machine |
| HiTrap Heparin (5 ml) | GE Heathcare | 17-0407-01 | Requires an Äkta FPLC machine |
| Amicon Ultra-15 Centrifugal Filter Units (with Ultracel-50 membrane) | Millipore | UFC905024 | 15 ml capacity and a MWCO of 50 kDa protein concentrator |
Références
- Moser, M., Legate, K. R., Zent, R., Fassler, R. The tail of integrins, talin, and kindlins. Science. 895, 899- (2009).
- Yu, Y., et al. Kindlin 2 forms a transcriptional complex with β-catenin and TCF4 to enhance Wnt signalling. EMBO Rep. 13, 750-758 (2012).
- Yu, Y., et al. Kindlin 2 promotes breast cancer invasion via epigenetic silencing of the microRNA200 gene family. Int J Cancer. , (2013).
- Meves, A., Stremmel, C., Gottschalk, K., Fassler, R. The Kindlin protein family: new members to the club of focal adhesion proteins. Trends Cell Biol. 19, 504-513 (2009).
- Siegel, D. H., et al. Loss of kindlin-1, a human homolog of the Caenorhabditis elegans actin-extracellular-matrix linker protein UNC-112, causes Kindler syndrome. Am. J. Hum. Genet. 73, 174-187 (2003).
- Hart, R., Stanley, P., Chakravarty, P., Hogg, N. The kindlin 3 PH domain has an essential role in integrin LFA-1-mediated B cell adhesion and migration. J. Biol. Chem. , (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to Kindlin-2 pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Qu, H., et al. Kindlin-2 regulates podocyte adhesion and fibronectin matrix deposition through interactions with phosphoinositides and integrins. J. Cell Sci. 124, 879-891 (2011).
- Yates, L. A., et al. Structural and Functional Characterisation of the Kindlin-1 Pleckstrin Homology Domain. J. Biol. Chem. 287, 43246-43261 (2012).
- Bouaouina, M., et al. A conserved lipid-binding loop in the kindlin FERM F1 domain is required for kindlin-mediated αIIbβ3 integrin coactivation. J. Biol. Chem. 287, 6979-6990 (2012).
- Goult, B. T., et al. The structure of the N-terminus of kindlin-1: a domain important for AlphaIIbBeta3 integrin activation. J. Mol. Biol. 394, 944-956 (2009).
- Yates, L. A., Fuzery, A. K., Bonet, R., Campbell, I. D., Gilbert, R. J. Biophysical Analysis of Kindlin-3 Reveals an Elongated Conformation and Maps Integrin Binding to the Membrane-Distal β-Subunit NPXY motif. J. Biol. Chem. 287, 37715-37731 (2012).
- Anthis, N. J., Campbell, I. D. The tail of integrin activation. Trends Biochem. Sci. 36, 191-198 (2011).
- Harburger, D. S., Bouaouina, M., Calderwood, D. A. Kindlin-1 and -2 directly bind the C-terminal region of beta integrin cytoplasmic tails and exert integrin-specific activation effects. J. Biol. Chem. 284, 11485-11497 (2009).
- Tadokoro, S., et al. Talin binding to integrin beta tails: a final common step in integrin activation. Science. 302, 103-106 (2003).
- Garcia-Alvarez,, et al. Structural determinants of integrin recognition by talin. Mol. Cell. 11, 49-58 (2003).
- Perera, H. D., Ma, Y. Q., Yang, J., Hirbawi, J., Plow, E. F., Qin, J. Membrane binding of the N-terminal ubiquitin-like domain of kindlin-2 is crucial for its regulation of integrin activation. Structure. 19, 1664-1671 (2011).
- Ussar, S., Wang, H. V., Linder, S., Fassler, R., Moser, M. The Kindlins: subcellular localization and expression during murine development. Exp. Cell Res. 312, 3142-3151 (2006).
- Bialkowska, K., et al. The integrin co-activator Kindlin-3 is expressed and functional in a non-hematopoietic cell, the endothelial cell. J. Biol. Chem. 285, 18640-18649 (2010).
- Moser, M., Nieswandt, B., Ussar, S., Pozgajova, M., Fassler, R. Kindlin-3 is essential for integrin activation and platelet aggregation. Nat. Med. 14, 325-330 (2008).
- Lefort, C. T., et al. Distinct roles for talin-1 and kindlin-3 in LFA-1 extension and affinity regulation. Blood. 119, 4275-4282 (2012).
- Moser, M., et al. Kindlin-3 is required for beta2 integrin-mediated leukocyte adhesion to endothelial cells. Nat. Med. 15, 300-305 (2009).
- Schmidt, S., Nakchbandi, I., Ruppert, R., Kawelke, N., Hess, M. W., Pfaller, K., Jurdic, P., Fassler, R., Moser, M. Kindlin-3-mediated signaling from multiple integrin classes is required for osteoclast-mediated bone resorption. J. Cell Biol. 192, 883-897 (2011).
- Malinin, N. L., et al. A point mutation in KINDLIN3 ablates activation of three integrin subfamilies in humans. Nat. Med. 15, 313-318 (2009).
- Svensson, L., et al. Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat. Med. 15, 306-312 (2009).
- Liu, Y., Zhu, Y., Ye, S., Zhang, R. Crystal structure of kindlin-2 PH domain reveals a conformational transition for its membrane anchoring and regulation of integrin activation. Protein Cell. 3, 434-440 (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to kindlin-2 protein pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Zhao, Y., Chapman, D. A., Jones, I. M. Improving baculovirus recombination. Nucleic Acids Res. 31, (2003).
- Berrow, N. S., et al. A versatile ligation-independent cloning method suitable for high-throughput expression screening applications. Nucleic Acids Res. 35, 45 (2007).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J Struct. Biol. 172, 55-65 Forthcoming.
- Wasilko, D. J., et al. The titerless infected-cells preservation and scale-up (TIPS) method for large-scale production of NO-sensitive human soluble guanylate cyclase (sGC) from insect cells infected with recombinant baculovirus. Protein Expr. Purif. 65, 122-132 (2009).
- Yates, L. A., Fleurdépine, S., Rissland, O. S., De Colibus, L., Harlos, K., Norbury, C. J., Gilbert, R. J. Structural Basis for the activity of a cytoplasmic RNA terminal uridylyl transferase. Nat. Struct. Mol. Biol. 19, 782-787 (2012).
- Sainsbury, S., Ren, J., Saunders, N. J., Stuart, D. I., Owens, R. J. Crystallization and preliminary X-ray analysis of CrgA, a LysR-type transcriptional regulator from pathogenic Neisseria meningitidis MC58. Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. 64, 797-801 (2008).
- Zhao, Y., et al. Regulation of cell adhesion and migration by Kindlin-3 cleavage by calpain. J. Biol. Chem. 287, 40012-40020 Forthcoming.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon