Method Article
Poli (ε-kaprolakton) electrospun İplik İnsan Mezenkimal Kök Hücre Ek Optimize
Bu Makalede
Özet
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
Özet
Biyomalzeme ve doku mühendisliği araştırmalar genellikle başlangıç hücre sayısı ilk bilgi gerektiren hücre bazlı in vitro araştırmalar içerir. Araştırmacılar genellikle kendi ekim yoğunluğu başvuru yaparken bu mutlaka söz konusu malzemeye yapışmış olan hücrelerin gerçek sayısını göstermez. Bu durum, özellikle, standart hücre kültürü kuyucuğu tabanını örtmeyen malzeme ya da yapı iskelesi, için de geçerlidir. Bu çalışma kültüründe 4 saat sonra electrospun poli (ε-kaprolakton) iplik üzerine bilinen bir sayı numaralı seribaşı insan mezenkimal kök hücrelerin ilk eki inceler. Electrospun iplikler 9 rpm, petri çanakları içine yerleştirilmiştir düşük bir bağlanma kuyucuğu ve politetrafloroetilen (PTFE) olukları içinde yer alan hücre kültür ekleri dönen biyoreaktör damarları dahil olmak üzere, pek çok farklı kurulumlar içinde yapıldı. Son iki bir çalkalama plakası üzerinde statik şartlar ya da maruz kalmış veya bir yer (30 37 C 'de 4 saat inkübasyon% 5 CO2 sonra ekilmiş hücrelerin bulunduğu yere hücre, DNA testi ile belirlendi. Iskeleleri bunların kaplardan uzaklaştırılmış ve liziz tamponu içine yerleştirildi. Ortam fraksiyonu benzer çıkarıldı ve santrifüj edildi - yüzer madde ayrılır ve topak lisis tamponu ile parçalanır. Liziz tamponu her haznesine eklenir, ya da iyi ve mevcut olabilecek herhangi bir hücre serbest kazınmıştır. Hücre DNA testi iskele içinde bulunan hücreler, medya ve iyi fraksiyonların yüzdesini belirledi. Hücre eki iplikler hücre kültürü ekler içinde tutulan ve hareket sallayarak tabi için büyük eki (% 30) ile, tüm deney seti-up için düşük oldu. Bu çalışma, bağımsız belirtilen hücre tohumlama yoğunluğu iskeleleri takılarak hücrelerin gerçek sayısı farkındalığı arttırır.
Giriş
Iskeleleri rutin geliştirilen ve biyomalzeme ve doku mühendisliği uygulamaları için araştırılmaktadır. Bu haliyle, genel olarak, örneğin, hücre proliferasyonu, hücre tespit eden deneyler ile karakterize edilen hücreler ve in vitro davranışı ile tohumlanır. Bu gibi deneyler için, başlangıçtaki hücre sayısı bilinmektedir zorunludur ve araştırmacılar ml veya cm2 başına hücre sayısı açısından tohum konsantrasyonunu belirtmektedir. Bu özellikle ölçek-up amaçlı iyi bir uygulama, iken, o (biyomalzeme yüzeyinin 1 yapışkan özelliklerine bağlıdır) iskele yüzeyine yapışır hücrelerin gerçek sayısı hesaba katmaz. Hücreler yapı uzak düşebilir ve nedeniyle deney genellikle statik doğası, inte malzeme ile temas geri gelmek asla bu hücre kültürü plaka tüm tabanını örtmeyen iskeleleri için özellikle doğrudurdinlenme. Electrospun elyaf iplikler de (Şekil 1A) tabanını kapsamaz bir iskele iyi bir örnektir. Bu durumda, yüzey ile muamele edilmiş olan düşük bir bağlanma yuvalı plakalar plakanın yüzeyine bağlanması ve bu nedenle herhangi bir iyi-bazlı bir tahlilin sonuçlarını bozan hücreleri önlemek için kullanılmalıdır.
Peki plakalar kolayca iskeleleri üzerine hücre tohumlama için kullanılır, ancak mevcut tek yöntem değildir. Döner hücre kültürü sistemleri, 1980 sonlarında NASA Yaşam Bilimleri Bölümü tarafından geliştirilen bioreaktörün bir tip, benzer simüle mikrogravite ile üç boyutlu (3D) ortamında iskeleleri tohum kullanılır. Bioreaktörün Bu tür dünya çapında araştırmacılar ile popüler bir seçenek kalır ve hücreleri 4,5 ve doku mühendisliği 6,7 kök hücre 2,3 sinyalizasyon için çalışmalar dahil edilmiştir. Ne de plakaları tercih döner biyoreaktör yapan bakım,genellikle olduğu gibi, dedifferentiating gelen farklılaşmış hücrelerin önlemeye yardımcı olan bir 3D çevre, zaman geleneksel 2D koşulları 8 içinde kültüre.
Bu kağıt bir 4 saat süre içinde bu iskeleleri takılarak hücrelerin ilk sayısını maksimize etmek için Bosworth ve ark., 9 fabrikasyon olarak electrospun poli (ε-kaprolakton) lif iplikleri insan mezenkimal kök hücreleri tohumlama için farklı teknikler inceler. 2B kültür için, iplik güvenli bir kuyucuğu veya ısmarlama poli (tetrafluoroetilen) (PTFE) olukları içinde tutulan ve statik koşullar altında tutulur, ya da 30 rpm'de sallanmıştır. 3D kültür için, iplikler ve hücreler 9 rpm'de dönen biyoreaktör damarları içinde yapılmıştır.
Protokol
1.Scaffold İmalat ve Sterilizasyon
- % 10 ağırlık / hacim konsantrasyonu vermek üzere, 1,1,1,3,3,3-heksaflorizopropanol içinde PCL eritin. . Polimer çözeltisi (parametreler: 20 kV, 1 ml / saat olduğu, 20 cm) electrospin Bosworth ve arkadaşları, 9 içinde tarif edildiği gibi, ve dönen bir mandrel (600 rpm) kenarında lifleri hizalanmış toplamak. (Olukları ve döner gemiler için) 3 cm ve uzunlukları (hücre kültürü ekler için) 4 cm - bir neşter ile kısa uzunluklarda kesilmiş sonra toplanan lif şeridi çıkarın ve.
- İnce forseps distile su bireysel şeritleri batığın ve kaldırmak kullanma.
- Başparmak ve işaret parmağı arasında iki ucunu tutan; bu konuyu benzer kadar elle şeridi bükün.
- Kısaca distile su içinde bu ipliksi iskele batığın ve kurulamak için temiz, lifli olmayan kartta yer.
- Kuruduktan sonra, ayrı ayrı temiz mikrosantrifüj tüpleri içine yerleştirildi ve damıtılmış su içinde% 50 h / h etanol 1 ml. Kapakları kapatın ve 2 bırakın4 saat.
Not: laminer akış altında aşağıdaki adımları uygulayın: - Bir düzgün akış kabininde mikrosantrifüj tüpleri ve% 50 hacim / hacim çözeltisi aspire. Damıtılmış su, yakın kapakların 1 ml% 70 h / h etanol ile değiştirin ve 24 saat bırakın.
- % 90 ve damıtılmış su (1 mi hacim) içinde% 100 h / h etanol için tekrarlayın.
- Yıkama fosfat tamponlu tuzlu su çözeltisi (PBS), yıkama başına 24 saat (2 x 1 mi) ile iki kez iskeleleri.
- PBS çıkarın ve 1 ml hücre kültür ortamı ile değiştirin. Not: iskeleleri kullanım sonrası 24 saat için hazırdır.
2. İskele Yüzey Alanı ve Hücre Sayısını Belirleme
- Bir ışık mikroskobu ve görüntü programı kullanarak, bir ortalama değeri tespit etmek uzunluğu boyunca electrospun ipliğin çapı ölçülür.
- Silindirik bir çubuk olması ve kullanarak yüzey alanını yaklaştığı iplik varsayalım:
- Nerede A = Yüzey alanı, r = yarıçap ve h = uzunluk
Not: Yüzey alanı 18902 olduğu hesaplandı800 mikron 2. Bundan başka, iplik yüzey alanını arttıracağı ince liflerin, yüzlerce oluşan fiili yüzey alanı Bu hesaplama daha büyük olacağı belirtilmelidir. Bu nedenle daha büyük bir hücre sayısı iskele eklemek gerekir. Bununla birlikte, bu test grupları arasında doğrudan bir karşılaştırma yapılmaktadır etkilemez. - Tarafından maruz iskele yüzeyine eklemek olabilir hücrelerin sayısını belirleyin:
Not: bir ışık mikroskobu ve görüntü yazılımı kullanılarak, insan mezenkimal kök hücrelerin çapı belirlenmiştir 20 um (varsayarak hücreler yuvarlak), bu nedenle bu durumda, hücreler = 60200 sayısı.
3. İskele Ayar - Hücre Kültürü ekler (Şekil 1A)
- Laminer akış altında steril 6 oyuklu hücre kültürü ekler açık ve geniş bir halkalı gövdelerinden dişleri kısa halkaları ayırın.
- Dişleri yukarı bakacak şekilde halka alın. Birini asmakyapma halkanın merkezi üzerinde 4 cm iskelelerinin emin iki tarafta çakışıyor. Dişli halkası ve iskele üzerinde halkalı vücut ve pozisyon almak ve iskele konumda kalır ve hücre kültürü ucun ortasından yatıyor emin aşağı doğru itin.
- 6-çukurlu, düşük bağlanma plaka oyuğuna iskele hücre kültürü eki yerleştirin.
- Iskele kültür ortamı 10 ml ilave edilir.
4. İskele Set-up - Oluk (Şekil 1B)
- Laminer akış altında yer poli (tetrafluoroetilen) (PTFE), ayrı ayrı petri çanaklarına oluklara ve çukur kültür ortamı 10 ml ekleyin.
- Emin uzunluğu yaparak, forseps çukur içine 3 cm iskelelerinin birini asmak kullanarak teknenin uzun kenarına paralel yatıyor.
5. İskele Set-up - Biyoreaktör Gemi (Şekil 1C)
- Laminer akış altında, biyoreaktör gemi en yoluyla 10 ml steril PBS dağıtmakana limanı ve 10 dakika bekletin.
- PBS çıkarın ve 8 ml kültür ortamı ile değiştirin.
- Forseps kullanarak, ana port üzerinden damar içine 3 cm iskelelerinin birini yerleştirin.
- Ana limanı kapatmak.
6. Hücre Sayım
- Kadar hasat öncesinde geçit 4 üretici protokolüne göre kemik iliğinden elde edilen kültür, insan mezenkimal kök hücreleri (hMSC).
- 75 cm kemik iliği (geçit 4,% 80 kaynaşma) türetilen hMSCs içeren 2 şişeyi medya aspire.
- 10 ml steril PBS ve aspirat hücreleri yıkayın.
- 3 mi tripsin ilave edin ve hücreleri, kap yüzeyinden yerinden kadar 37 ° C'de,% 5 CO2 seviyesinde bir balon içinde inkübe edilir.
- Enzimler inaktive edildi ve bir santrifüj tüpünün bu toplam hacmi (10 mi) aktarmak için 7 ml kültür ortamı eklenir.
- Homojen içinde hücreleri dağıtmak için yukarı pipetleme ve birkaç kez aşağı bu hücre süspansiyonu yeniden süspanseMedya ve sınır hücre topaklar (10 ml pipet).
- Bir haemocytometer hücre süspansiyonu ve transfer 20 ul çıkarın.
- X10 objektif bir ışık mikroskobu ve görüntüsü altında haemositometre yerleştirin.
- Kılavuz çizgilerini Odak ve ızgara her köşesinde 4 x 4 kareler hücrelerin sayısını ve hangi meydanın giren ve sağ elini veya alt sınır çizgisini olanlar. 4 x 4 kareler (ızgara başına 4 sayımları) her set için güvenin.
- Tabanda ve hücre alınma sayısı üç kez (6,6-6,9 adımları) tekrarlayın.
- Ortalama hücre sayısını hesaplayın ve hücre tabanda (200 ul hücre konsantrasyonu 60.200) için gerekli ortamın hacmi belirlemek. Örneğin, hemositometrede ortalama hücre sayısını belirlemek ve daha sonra üç ayrı sayıları hücrelerin genel ortalama sayısını belirlemek. Vermek hücre süspansiyonu, toplam hacmi ile çarpın sonra mi başına hücre sayısı ve elde 1 x 10 4 ile çarpınHücrelerin tal sayısı. Tabanda için gerekli ortamın hacmini belirlemek için aşağıdaki denklemi kullanın:
- 5 dakika boyunca 241 xg'de hücre süspansiyonu santrifüjleyin.
7. Hücre Tohumculuk
- Hücre topaklarını bırakarak santrifüj tüpten ortamı aspire ve hesaplanan ortam hacmi ile değiştirin.
- Hatta karıştırmak bir için hücreleri ve medya yeniden süspanse.
- P200 Gilson pipet kullanarak yavaş yavaş iskele boyunca ve ortam sıvı yüzeyinin altında pipet ucu çalıştırarak her bir yapı iskelesi üzerinde hücre süspansiyonu 200 ul dağıtmak. 20 dakika boyunca rahatsız edilmeden bekleme.
- Biyoreaktör gemileri için, ana bağlantı noktası üzerinden hücre süspansiyonu 200 ul dağıtmak. Şırınga portları üzerinden kontör kalan 2 ml kültür ortamı 10 ml toplam hacim vermek.
8. Deneysel Başlangıç
- RCCS-4DQ biyoreaktöre biyoreaktör gemileri aktarın ve 9 rpm'de döndürmek için ayarlayın.
- Trançalkalama plakası, hücre kültürü ekler ve çukurları kuyucuğu Sfer ve 30 rpm'de dönmek üzere.
- 37 ° C'de,% 5 CO2 (statik kültür) ayarlanmış bir hücre kuluçka makinesi içinde rafa hücre kültürü ekler ve çukurları kuyucuğu aktarın.
9. DNA'nın Deneyi
- Lizis tamponu, 1x TE tampon, DNA standartları ve hücre DNA çalışma çözümü - - üreticinin talimatlarına göre çözüm hazırlayın.
- 4 saat sonra, kuluçka örnekleri çıkarın ve laminer akış altında yerleştirin.
- Tüm örneklerde medya fraksiyonları çıkarın ve ayrı etiketli santrifüj tüpleri yerleştirmek. Tüpleri 241 xg santrifüj. Süpernatantı ve 3 ml lizis tamponu ekleyin. Kırmak üzere hücre pelleti çözeltisi tekrar.
- Forseps biyoreaktör gemiler içinde iskeleleri için 3 ml lizis tamponu içeren (santrifüj tüplerine iskeleleri ve yer kaldırmak kullanarak, önce beni aspire için iskele kaldırmakdia). Hücre kültürü ekler içinde yapılacak iskeleler için, ilk olarak bir neşter kullanılarak geçmenin kenarına yakın iskele keserek iskele ücretsiz.
- Her iskele yuvasına lizis tamponu 3 ml ekleyin ve yüzeyi kazıyın (şiddetle biyoreaktör gemiler için ajitasyon). Liziz tamponunu çıkarın ve ayrı bir şekilde etiketlenmiştir santrifüj tüpleri içinde yer.
- Vorteks yaklaşık olarak 1 dakika boyunca, her santrifüj tüpü hücrelerinin yeterli ajitasyon temin ve tampon ve hücre membranı parçalanma teşvik etmek için.
- Iskele, ortam ve de (çift) - siyah 96 oyuklu bir plaka içerisinde, her bir numune kısmıyla liziz tamponu içinde 100 ul ilave edin.
- Karanlıkta, liziz tamponu içeren bütün yuvalara hücre, DNA çözeltisinin 100 ul ve hafifçe karıştırın.
- Plaka bir negatif ve pozitif kontrol temin etmek üzere herhangi bir DNA, ve hücre, DNA çözeltisi ihtiva eden liziz tamponu ile kuyu içerir.
- Bir floresan plak okuyucu kullanarak, bir çukurun absorbansı ölçmek485 nm uyarma ve 520 nm emisyon ile s.
- Üreticinin talimatlarına göre DNA standartlarından oluşturulan standart eğri ile veri karşılaştırın.
10. Taramalı Elektron Mikroskobu (SEM) Sabitleme
- Laminer akış altında aşağıdaki adımları gerçekleştirin: 4 saat sonra, yeni bir 6-plaka (ayrı kuyu) içindeki kapların ve yerden tüm iskeleleri kaldırmak.
- PBS ile iki kez iskeleleri yıkayın.
- Açık bankta aşağıdaki adımları uygulayın: Her iyi iskelenin tam kapsama sağlamak için PBS içinde% 1.5 v / v glutaraldehit 2 ml ekleyin.
- Hücre tespiti için, 4 ° C'de en az 30 dakika boyunca plaka bırakın.
- Sabitleştirici çözüm çıkarın ve PBS ile iki kez iskeleleri yıkayın.
- % 70 h / h,% 90 h, ardından% 50 v / v ile başlayan damıtılmış su içinde etanol, artan yoğunluklardaki iskeleleri dihidrat / h. Her bir konsantrasyon için, tamamen eriyik iskeleleri daldırılmasın, (2 mi) ve 3 dakika süre ile bırakın. Çözüm atın ve tekrarlayın.
- Çözelti içinde tamamen iskelesi (2 mi) içine batırmak ve 5 dakika bırakılarak% 100 etanol içinde dehidre olmaktadır. Çözüm atın ve tekrarlayın.
- Kimyasal bir duman dolap içinde heksametildisilazan kullanarak iskeleleri (HMDS) kurutun. HMDS'nin iskeleleri (2 ml) daldırın ve 5 dakika bekletin. HMDS 'yi çıkartın ve tekrar.
- HMDS 'yi çıkartın ve iskeleler kurumasını bekleyin. (Bu durumda yapışkan karbon sekmeleri ile paslanmaz çelik taslakları olarak) piyasada mevcut SEM taslakları üzerinde iskeleleri monte edin.
- SEM içinde inceleyen kolaylaştırmak için, 2 dakika süreyle bir altın püskürtmeli kaplayıcı kullanılarak ceket örnekleri ince ve hatta kapsama sağlamak.
- Ve SEM içinde yerleştirin örnekleri 5 KeV elektron ışını kullanarak hücre numaralı seribaşı iskeleleri görselleştirmek.
Sonuçlar
Sonuçlar araştırıldı her deneysel set-up için 4 saat sonrası tohumlama aşağıdaki hücrelerin yerini vurgulamak. Şekil 2A, bu süre içinde iskele yüzeye bağlı hücrelerin yüzdesini gösterir. 8.5 pg / hücre, bir dönüşüm faktörü hücre sayısı olarak ölçülen bir DNA içeriği dönüştürmek ve böylece hücrelerin 10 yüzdesini belirlemek için kullanılmıştır. Tüm tohum düzenekleri incelenmiştir için, hücre bağlanma yüzdesi, hücre kültürü ekler içinde tutulan ve 30 rpm'de (yerleştirin Shaker) çalkalandı iskeleleri için büyük hücre uyumunu (% 30) ile nispeten düşüktür. Düşük yapışma (% 15), hücre kültürü ekler içinde tutulan İskele ve statik koşullarda (Ekle Statik) altında tutulur.
Hücrelerin büyük bir kısmı ortam fraksiyonu (Şekil 2B) içinde mevcut olan, özellikle% 50 ve% 51 olan düşük bir bağlanma plakası (yerleştirin Statik) ve döner damarların içinde tutulan hücre kültürü parçaları içinsırasıyla. Çukur Shaker için hücrelerin% 48 ve Dip Statik 50% - olukları içinde tutulan iskeleleri tutucu kendisinde mevcut hücrelerin yükseltilmiş sayıda gösterdi.
Taramalı elektron mikroskobu hücre numaralı seribaşı iskeleleri görsel değerlendirmeyi (Şekil 3) izin verdi. Temsilcisi görüntüleri bakılmaksızın set-up tohumlu, lifli yüzey hücreleri sınırlı varlığını vurguladı. Bununla birlikte, hücrelerin ve hücre topaklarının daha fazla sayıda hücre kültürü ekler içinde tutulan ve 30 rpm'de (yerleştirin Shaker) çalkalandı iskeleler mevcut değildi.
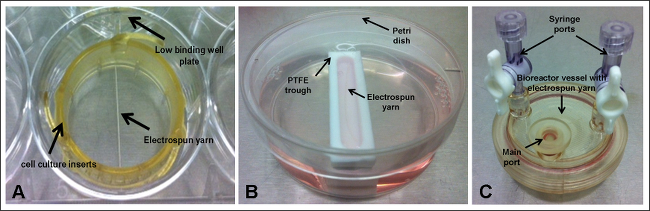
Electrospun İplik içinde Yapıldı Şekil 1. Deney Seti-up; (A), hücre kültür ekleri ve düşük bir bağlanma yuvalı plaka (B) poli (tetrafluoroetilen) (PTFE) oluğu ve petri kabı; ve (C) biyoreaktör gemi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
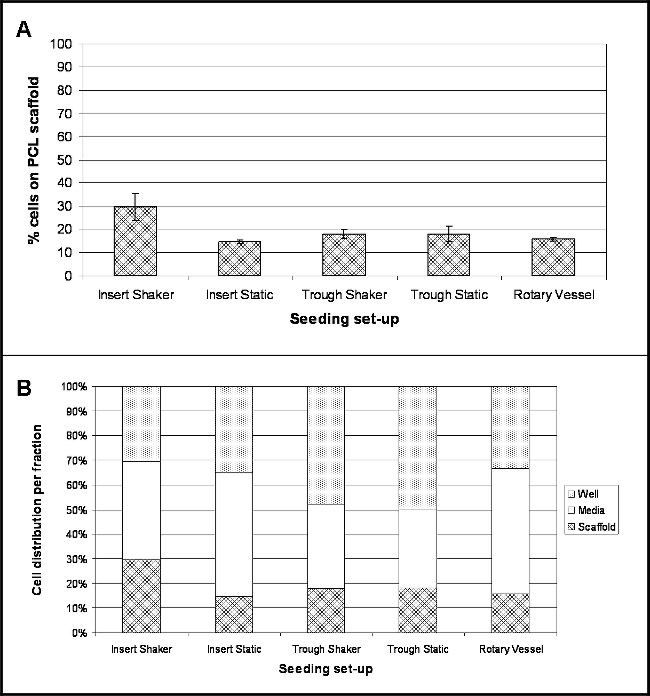
Farklı Tohumculuk Set-up kullanarak PCL electrospun İplikler üzerine Hücreleri 4 saat sonrası tohumlama Şekil 2. Konum. Ortam, (de ve yapı iskelesi, n = 4, veriler olarak sunulur (B) - üç kat içinde hücre konumu yüzdesi yayılmasını vurgular (A) (ortalama ± standart sapma), PCL iskele bağlı hücrelerin yüzdesini gösterir ) değerleri ortalama. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 3. Temsilcisi Taramalı Elektron Mikrograflan İnsan Mezenkimal Kök Hücreler ile PCL electrospun İplik, 4 İlk Tohumculuk Farklı Deney Seti-up kullandıktan sonra saat. Için (1,000X büyütmede tüm görüntüleri, ölçek bar = 130 mikron.) Bir görüntülemek için buraya tıklayınız Bu rakamın büyük versiyonu.
Tartışmalar
Biyopolimerlerden fabrikasyon electrospun elyaf matrisleri düzenli biyomateryali ve / veya doku mühendisliği uygulamaları 11,12 hücre eki ve çoğalmasını desteklemek için kullanılır. Bu durumda, matris kolayca bir hücre kültürü oyuklu plakanın bütün taban kapağı ve bu yüzden, hücre eki artırır tohumlanmış hücreleri ile tam temas halinde olan lif ince levhalar genellikle. Ancak, biyomalzeme iskele tamamen plaka tabanını kapsamaz ise, numaralı seribaşı hücrelerin büyük bir kısmı iskele ile temas halinde kalmak olmaz ve sonuçta eklemek mümkün olmayacak bir yüksek şans var. Bu çalışma, gelecekteki hücre bazlı deneyler için tavsiye edilebilir optimize edilmiş bir teknik belirlemek için, plaka tabanını örtmeyen iskeleler üzerine tohum hücreleri için çeşitli yöntemler araştırılmıştır.
Beş farklı set-up (Şekil 1) araştırılmıştır: scaffoLDS (electrospun iplik), düşük bağlanma kuyu plakaları içinde hücre kültürü ekler kullanarak düzenlenen ve ya statik koşullar altında tutulan veya 30 rpm'de çalkalandı; 30 rpm'de dar PTFE olukları içinde yerleştirilir ve statik tutulan ya da sarsılmış iskeleleri; ve iskeleler 9 rpm'de dönen biyoreaktör damarları içinde yer. Tüm tohumlama set-up (Şekil 2) için bağlantı düşük bir oranda bir DNA deneyi ile electrospun iplikler yapıştırılmış etmiş olan hücrelerin sayısı göstermişlerdir belirlenmesi; ve bu daha fazla elektron mikrograflannı (SEM) (Şekil 3) tarama teyit edildi. Greatest hücre eki - 30 veya% ~ 18.060 hücre hücre kültürü ekler içinde tutulan ve sürekli hareket maruz kalan iplikler için gözlenmiştir muydu. İlginç bir şekilde, en düşük hücre eki (% 15) radyal hareket dahil iskele ile temas hücreleri tutmak üzerinde olumlu bir etkiye sahip olduğunu göstermektedir olur hücre kültürü ekler tarafından tutulan statik şartlar altında tutulmuştur iplikler için elde edilmiştir. Bununla birlikte,bu medyanın akışının sürekli çevreleme SEM görüntüleri gözlenen hücre aglomeralarının sorumlu olabileceği unutulmamalıdır. Shaker plaka en düşük ayarda kuruldu - 30 rpm - Bu set-up bir sınırlama olabilir. Yavaş radyal hareket kullanma önlemek veya hücre aglomerasyonunu azaltmaya yardımcı olabilir ve hücreler daha az kuvvet yaşayacaksınız aynı zamanda hücre eki artırabilirsiniz. Gelecek deneyler gelişmiş hücre eki için ideal bir çalkalayıcı hızı optimize odaklanmalıdır. Her iki senaryolar% 18 eki (~ 10.836 hücreleri) elde olan, benzer bir eğilimin sonucu vermedi olukları içinde tutulan iplikler için hareket birleştirilerek; Bu olukları içinde iskelelerinin kısmi yüzdürme nedeniyle olabilir ama onlar tabanına tutturulmuş değil gibi (çalkalama plaka üzerine yerleştirilen olukları için gözlenen). Malzeme ve yapıştırma ile temas etmesini oluğun altına inmiştir herhangi hücrelerini engeller iskele kısmi dalgalı. TOnun özellikle set-up, çukur bir petri içinde muhafaza edildi ve medyanın toplam 10 ml hacminde ekledi. oluğun küçük boyutları ortam çoğunluğu petri kabı içinde mevcut olan herhangi bir hareketi olması durumunda, hücreler petri uzak çukur kayması ve skafoldun erişemeyeceği tamamen kalabilir anlamına gelir. Bu maruz kalan iskeleleri için kendi yüzmesini ve özellikle hareketi (önleyecek gerektiği gibi, bu sınırlamaları aşmak için, başka deneyler, iskelelerinin uçları steril ince iğneler kullanılarak olukları tabanına tutturulmuş sayede protokol, fazladan bir adım içermelidir sonuçta iskele ekleme hücrelerin sayısında artışa yol açacaktır radyal hareket). Hücrelerin% 16 döner gemiler içinde mevcut ipliklere bağlı etmişti. 3D kültür için iyi kurulmuş bir tekniktir olmasına rağmen, sorunlar gevşek attac sonuçlandı olabilir gemilerin ana limanına iskelelerinin kaldırılması ile ortaya çıkmıştırhed hücreler kaybetmiş olmanın. Tam olarak bu sorunu ortadan kaldıracak açılabilir gemiler; Bu satın almak için kullanılabilir, ancak önemli ölçüde bu çalışmada kullanılan tek damarlarda daha pahalıdır.
Bu çalışma, standart hücre kültürü kuyucuğu tüm tabanını örtmeyen iskeleleri tohumlama ile güncel konular göstermektedir. Bilinen bir hücre sayısını Tohumlama bağlı tüm hücreler için izin İskele yüzölçümünün rağmen, iskele üçüncü yapanlar daha az sonuçlandı. Bu gelecekteki potansiyel tıbbi cihaz olarak iskele ile biyouyumluluk ve hücre-malzeme / hücre-hücre davranışlarını ve etkileşimlerini değerlendirmek diğer hücre bazlı tahlillerde zararlı sonuçlar doğurabilir. Çalışmanın başka sınırlamalar 4 saat zaman noktası içerebilir - ilk hücre tohumlama sağlamak için yeterince uzun olmasına rağmen (hücreleri sıkıca otuz dakika 13,14,15 içinde yüzeylere eklemek gösterilmiştir), içeri makul olabilirDaha sonra zaman noktaları, aksi takdirde, başlangıçtaki hücre sayısı eğrilik gibi hücreler, daha uzun bir zaman dilimi boyunca çoğalmazlar temin incelenmelidir. Bu durumda, 10 ml ortam hacminin azaltılması, aynı zamanda da hücre ve iskele arasında teması geliştirmek ve sonuçta hücre eki artırabilir. Gelecekteki çalışmalar hücre hasarını ve / veya hücre ölümüne yol 16 hücre tohum işlemi olarak hücre canlılığı dikkate almalıdır. Böyle bir canlı / ölü tahlil, örneğin, canlılık düzeyini vurgulamak gibi hücre, DNA deneyleri, canlı ve cansız hücreler arasında ayrım yoktur.
Bu soruşturma bilinen bir miktar tohumlama rağmen iskele eklemek hücrelerin gerçek sayısı farkındalığı arttırır. Hücrelerin başlangıç sayısının güveniyor çalışmalar için, araştırmacıların bu rakamın birçok gerçeği ilgi substrata yapışır yapmak tam olarak nasıl olduğunu çok önemlidir.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
MRC-FAP hibe kodu G1000788-98812 - Yazarlar bu araştırmayı finanse Tıbbi Araştırma Konseyi teşekkür ve kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
Referanslar
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426 (2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds.. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -. I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır