Method Article
Optimisation Fixation des mésenchymateuses humaines cellules souches sur Poly (ε-caprolactone) électrofilées Yarns
Dans cet article
Résumé
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
Résumé
La recherche sur les biomatériaux et ingénierie tissulaire comprend souvent des enquêtes à base de cellules in vitro, qui exigent des connaissances initiale du numéro de cellule de départ. Bien que les chercheurs de référence couramment leur densité de semis cela ne indique pas nécessairement le nombre réel de cellules qui ont adhéré à la matière en question. Ce est particulièrement le cas pour les matériaux ou échafaudages, qui ne couvrent pas la base de plaques de puits de culture cellulaire standard. Cette étude examine la fixation initiale de cellules souches mésenchymateuses humaines ensemencées à un nombre connu sur électrofilées poly (ε-caprolactone) fil après 4 h dans la culture. Électrofilées fils ont eu lieu au sein de plusieurs différents set-up, y compris les navires de bioréacteurs tournant à neuf tours, des inserts de culture cellulaire positionnés dans faible plaques à puits contraignantes et polytétrafluoroéthylène (PTFE) creux placés dans des boîtes de Pétri. Les deux derniers ont été soumis à des conditions soit statiques ou positionné sur une table à secousses (30 ° C, 5% CO 2, l'emplacement de cellules ensemencées a été déterminée par dosage de l'ADN cellulaire. Les échafaudages ont été retirés de leur emballage et placés dans du tampon de lyse. La fraction de milieu a été retiré et centrifugé de manière similaire - et le surnageant a été rejeté brisé culot avec du tampon de lyse. Le tampon de lyse a été ajouté à chaque récipient, ou bien, et gratté pour libérer les cellules qui peuvent être présents. Le test de l'ADN cellulaire a déterminé le pourcentage de cellules présentes à l'intérieur de l'échafaudage, les médias et les fractions ainsi. la fixation des cellules était faible pour tous les montages expérimentaux, avec le plus grand attachement (30%) pour les fils détenus dans des inserts de culture cellulaire et soumis à des secousses mouvement. Cette étude sensibilise au nombre réel de cellules attachées aux échafaudages indépendamment de la densité de l'ensemencement des cellules déclaré.
Introduction
Les échafaudages sont régulièrement développés et étudiés pour les applications de biomatériaux et ingénierie tissulaire. Comme tels, ils sont généralement ensemencées avec des cellules et leur comportement in vitro, caractérisé par des essais qui déterminent la prolifération cellulaire et du nombre de cellules, par exemple. Pour les expériences comme celles-ci, il est impératif que le nombre initial de cellules est connu et chercheurs déclarent souvent la concentration d'ensemencement en termes de nombre de cellules par ml ou 2 cm. Bien que ce est une bonne pratique, en particulier à des fins d'intensification, on ne tient pas compte du nombre réel de cellules qui adhèrent à la surface de l'échafaudage (qui est aussi dépendante des propriétés adhésives de la surface du biomatériau 1). Cela est particulièrement vrai pour les échafaudages qui ne couvrent pas l'ensemble de la base de la culture plaque de puits de cellule que les cellules pourraient tomber de la construction et, en raison de la nature souvent statique de l'expérience, peuvent ne jamais revenir en contact avec le matériau de porcelainereste. fils de fibres de électrofilées sont un bon exemple d'un échafaudage qui ne couvre pas la base du puits (figure 1A). Dans ce cas, plaques à puits de liaison faibles qui ne ont pas été traitées en surface devraient être utilisés pour empêcher les cellules de se fixer à la surface de la plaque et donc fausser les résultats de tout essai basé bien.
Plaques à puits sont facilement utilisés pour l'ensemencement des cellules sur des échafaudages, mais ils ne sont pas la seule méthode disponible. Systèmes de culture cellulaire Rotary, un type de bioréacteur développé par la Division sciences de la vie à la NASA dans la fin des années 1980, peuvent même être utilisées pour ensemencer échafaudages dans un (3D) environnement tridimensionnel avec microgravité simulée. Ce type de bioréacteur reste un choix populaire auprès des chercheurs du monde entier et a été intégré dans les études pour la signalisation cellulaire 2,3, les cellules souches 4,5 et ingénierie tissulaire 6,7. Ce qui rend le bioréacteur rotatif préférable de plaques à puits est le maintiend'un environnement 3D, ce qui contribue à empêcher les cellules différenciées de se dé-différencier, comme ce est souvent le cas lorsqu'il est cultivé dans des conditions 2D conventionnels 8.
Cet article examine différentes techniques pour l'ensemencement de cellules souches mésenchymateuses humaines de poly électrofilé (ε-caprolactone) des fils de fibres comme fabriqué en Bosworth et al., 9 afin de maximiser le nombre initial de cellules attachées à ces échafaudages dans un délai de 4 heures. Pour la culture 2D, fils étaient solidement tenues dans plaques à puits ou poly-mesure (tétrafluoroéthylène) (PTFE) creux et conservés dans des conditions statiques ou agitées à 30 tours par minute. Pour la culture 3D, fils et les cellules ont été organisées dans les cuves de bioréacteur tournant à 9 tours.
Protocole
Fabrication 1.Scaffold et stérilisation
- Dissoudre dans PCL 1,1,1,3,3,3-hexafluoro-isopropanol pour donner un 10% p / v de concentration. Comme décrit dans Bosworth et al, 9 electrospin la solution de polymère (parameters: 20 kV, 1 ml / h, 20 cm). Et de recueillir des fibres alignés sur le bord d'un mandrin rotatif (600 tpm). Avec un scalpel retirez le ruban de fibres recueillies et puis les couper en longueurs plus courtes - 3 cm (pour les creux et les vaisseaux rotatifs) et 4 cm (pour la culture cellulaire inserts) longueurs.
- En utilisant des pinces fines bandes individuelles immerger dans de l'eau distillée et supprimer.
- En tenant les deux extrémités entre le pouce et l'index; tourner manuellement la bande jusqu'à ce qu'il ressemble fil.
- Plonger brièvement ce échafaudage filiforme dans l'eau distillée et placer sur le nettoyage, carte non fibreuse à sécher.
- Une fois sec, le lieu individuellement dans des microtubes propres et ajouter 1 ml de 50% v / v d'éthanol dans de l'eau distillée. Fermer le couvercle et laisser reposer pendant 24 h.
Remarque: Effectuez les étapes suivantes sous flux laminaire: - Placez microtubes dans une hotte à flux laminaire et aspirer la solution v / v 50%. Remplacer avec 1 ml 70% v / v d'éthanol dans l'eau distillée, à proximité couvercles et laisser reposer pendant 24 heures.
- Répéter à 90% et 100% v / v d'éthanol dans de l'eau distillée (1 ml volumes).
- Laver deux fois avec du phosphate échafaude une solution saline tamponnée (PBS), 24 h par lavage (2 x 1 ml).
- Retirer et remplacer PBS avec 1 ml de milieu de culture cellulaire. Remarque: Les échafaudages sont prêts pour une utilisation post-24 h.
2. Détermination Espace Échafaudages de surface et le nombre de cellules
- Utilisation d'un logiciel d'imagerie microscope et la lumière, mesurer le diamètre du fil par électro long de sa longueur pour déterminer une valeur moyenne.
- Supposons que le fil pour être une tige cylindrique et une approximation de la surface en utilisant:
- Où A = Surface, r = rayon et h = longueur
Remarque: La surface a été calculée à 18 902, 2 800 pm. En outre, il convient de noter que l'aire de surface réelle est plus grande que ce calcul que le fil est composé de plusieurs centaines de fibres fines, ce qui augmentera l'aire de surface. Par conséquent, un plus grand nombre de cellules devrait être en mesure de joindre à l'échafaud. Cependant, cela ne affecte pas une comparaison directe entre les groupes de test ont été réalisés. - Déterminer le nombre maximal de cellules qui peuvent se attacher à la surface exposée de l'échafaudage par:
Remarque: L'utilisation d'un logiciel de microscope et l'imagerie de lumière, le diamètre des cellules souches mésenchymateuses humaines a été déterminée à 20 um (en supposant cellules sont rondes), donc dans ce cas, le nombre de cellules = 60200.
3. Échafaudages Set-up - Culture Cellulaire Inserts (figure 1A)
- Sous flux laminaire, ouvrir les 6 puits inserts de culture de cellules stériles et séparer les anneaux avec des dents plus courtes des corps plus large annelé.
- Prenez le ring avec les dents pointant vers le haut. Drapé unedes échafaudages 4 cm sur le centre de l'anneau en vous assurant qu'il chevauche sur les deux côtés. Prenez le corps et la position annelé sur la couronne dentée et échafaudage et pousser vers le bas en veillant à l'échafaud reste en position et passe par le centre de l'insert de culture cellulaire.
- Placez l'insert de culture cellulaire avec échafaudage dans le puits d'un puits 6, faible plaque de fixation.
- Ajouter 10 ml de milieux de culture à l'échafaud.
4. Échafaudages Set-up - Fosse (figure 1B)
- Sous flux laminaire, le lieu de poly (tétrafluoroéthylène) (PTFE) des creux dans des boîtes de Pétri individuelles et ajouter 10 ml de milieu de culture à l'auge.
- En utilisant des pinces draper une des échafaudages 3 cm dans l'auge, en se assurant de sa longueur est parallèle au bord de l'auge plus.
5. Échafaudages Set-up - bioréacteur navire (figure 1C)
- Sous flux laminaire, verser 10 ml de PBS stérile à travers le récipient de bioréacteurprincipal port et laisser reposer pendant 10 min.
- Retirez le PBS et le remplacer par 8 ml de milieu de culture.
- En utilisant des pinces, insérez un des échafaudages cm 3 dans le récipient via le port principal.
- Fermez le port principal.
6. Décompte Cellulaire
- Culture de cellules humaines souches mésenchymateuses (CSMh) dérivées de moelle osseuse conformément au protocole du fabricant jusqu'à quatre passage avant la récolte.
- Aspirer le support à partir d'un flacon de 75 cm2 contenant des CSMh dérivées de moelle osseuse (passage 4, 80% de confluence).
- Laver les cellules avec du PBS 10 ml stérile et aspirer.
- Ajouter 3 ml de trypsine et on incube le flacon à 37 ° C, 5% de CO 2 jusqu'à ce que les cellules sont délogés de la surface du ballon.
- Ajouter 7 ml de milieu de culture pour inactiver l'enzyme et transférer ce volume total (10 ml) dans un tube de centrifugeuse.
- Reprendre cette suspension cellulaire par aspiration et à plusieurs reprises pour disperser de manière homogène des cellules au sein de lamédias et agglomérats limite cellulaires (10 ml) de pipette.
- Retirer 20 pi de suspension de cellules et le transfert d'un hémocytomètre.
- Placez le hémocytomètre sous un microscope optique et image au objectif x10.
- Concentrer le quadrillage et de compter le nombre de cellules dans les 4 x 4 places dans chaque coin de la grille et qui relèvent de la place et ceux qui traversent la main droite ou de la ligne de limite inférieure. Comptez pour chaque ensemble de 4 x 4 places (4 chefs d'accusation par grille).
- Répétez la remise en suspension et la cellule compte trois fois (étapes 6.6 à 6.9).
- Calculer le nombre de cellules moyen et déterminer le volume du support requis pour la remise en suspension de cellules (concentration de 60 200 cellules dans 200 ul). Par exemple, déterminer le nombre moyen de cellules de l'hémocytomètre et ensuite déterminer le nombre moyen global de cellules des trois chefs d'accusation distincts. Multiplier par 1 x 10 4 à envoyer nombre de cellules par ml, puis multiplié par le volume total de la suspension cellulaire pour donner àNuméro tal de cellules. Utilisez l'équation suivante pour déterminer le volume des médias nécessaires à la remise en suspension:
- Centrifuger la suspension de cellules à 241 xg pendant 5 min.
7. Cellule semis
- Aspirer les médias du tube centrifugé laissant le culot cellulaire et le remplacer par le volume des médias calculée.
- Remettre en suspension les cellules et les médias pour une même mélanger.
- En utilisant une pipette Gilson P200, verser lentement 200 ul de suspension cellulaire sur chaque échafaudage en exécutant la pointe de la pipette le long de la longueur de l'échafaudage et en dessous de la surface du liquide de support. Laisser reposer pendant 20 min.
- Pour les navires de bioréacteurs, dispenser 200 pi de suspension de cellules à travers le port principal. Haut-le 2 ml de milieu de culture restant par les ports de la seringue pour obtenir un volume total de 10 ml.
8. expérimentale Démarrer
- Transférez les cuves de bioréacteur dans le bioréacteur RCCS-4DQ et mettre à tourner à neuf tours.
- TranSFER les plaques à puits avec des inserts de culture cellulaire et des creux à la plaque de shaker et mis à tourner à 30 tours par minute.
- Transférer les plaques de puits avec des inserts de culture cellulaire et les creux de la plate-forme d'un incubateur de cellules fixé à 37 ° C, 5% CO 2 (culture statique).
9. ADN Assay
- Préparer des solutions - tampon de lyse, tampon 1x TE, normes d'ADN et de solution de travail de l'ADN cellulaire - selon les instructions du fabricant.
- Après 4 heures, retirer les échantillons de l'incubateur et placer sous flux laminaire.
- Retirez les fractions de médias de tous les échantillons et les placer dans des tubes de centrifugeuse étiquetés séparément. Centrifuger les tubes 241 xg. Eliminer le surnageant et ajouter un tampon de lyse de 3 ml. Reprendre la solution pour rompre le culot cellulaire.
- En utilisant des pinces supprimer les échafaudages et les placer dans des tubes à centrifuger contenant 3 ml de tampon de lyse (pour les échafaudages dans les cuves de bioréacteur, retirez l'échafaud avant l'aspiration du moidia). Pour échafaudages détenus dans des inserts de culture cellulaire, d'abord libérer l'échafaud en coupant l'échafaud près du bord de l'insert à l'aide d'un scalpel.
- Ajouter 3 ml de tampon de lyse à chaque récipient d'échafaudage et gratter la surface (agiter vigoureusement pour les navires de bioréacteurs). Retirer le tampon de lyse et les placer dans des tubes de centrifugation marqués séparément.
- Vortexer chaque tube de centrifugation pendant environ 1 minute pour assurer une agitation suffisante des cellules et le tampon et pour favoriser la lyse de la membrane cellulaire.
- Dans une plaque à 96 puits noir, ajouter 100 pi de tampon de lyse pour chaque fraction de l'échantillon - échafaudage, les médias et bien (duplicate).
- Dans l'obscurité, ajouter 100 ul de solution d'ADN de cellules dans tous les puits contenant le tampon de lyse et mélanger doucement.
- Inclure les puits avec du tampon de lyse contenant pas de solution d'ADN et l'ADN de la cellule pour fournir un contrôle négatif et positif pour la plaque de puits.
- En utilisant un lecteur de plaques de fluorescence, mesurer l'absorbance du puitss en utilisant une excitation 485 nm et émission à 520 nm.
- Comparer les données à la courbe standard générée par les normes d'ADN selon les instructions du fabricant.
10. microscope électronique à balayage (MEB) Fixation
- Effectuez les étapes suivantes sous flux laminaire: Après 4 h, retirez tous les échafaudages de leurs récipients et place dans une nouvelle plaque de 6 puits (puits séparés).
- Laver les échafaudages deux fois avec PBS.
- Effectuez les étapes suivantes sur le banc ouvert: Pour chaque puits, ajouter 2 ml de 1,5% v / v glutaraldéhyde dans du PBS pour assurer une couverture complète de l'échafaud.
- Laisser la plaque pendant au moins 30 min à 4 ° C pour la fixation des cellules.
- Retirer la solution de fixateur et laver les échafaudages deux fois avec PBS.
- Déshydrater les échafaudages avec des concentrations croissantes d'éthanol dans de l'eau distillée à partir de 50% v / v, puis 70% v / v et 90% v / v. Pour chaque concentration, immerger pleinement les échafaudages en solution (2 ml) et laisser reposer pendant 3 min. Jeter la solution et répéter.
- Déshydrater dans 100% d'éthanol en immergeant totalement les échafaudages en solution (2 ml) et en laissant 5 min. Jeter la solution et répéter.
- Sécher chimiquement les échafaudages utilisant hexaméthyldisilazane (HMDS) dans une hotte. Plonger les échafaudages dans HMDS (2 ml) et laisser reposer pendant 5 min. Retirez les HMDS et répéter.
- Retirez les HMDS et permettent les échafaudages pour sécher. Monter les échafaudages sur disponibles dans le commerce talons SEM (dans ce cas des talons d'acier inoxydable avec onglets de carbone adhésives).
- Pour faciliter la visualisation dans le SEM, enduire les échantillons à l'aide d'une coucheuse or pulvérisation pendant 2 minutes pour assurer une couverture mince et uniforme.
- Placer les échantillons au sein du SEM et de visualiser les échafaudages cellulaires ensemencées en utilisant un faisceau d'électrons de 5 KeV.
Résultats
Les résultats mettent en évidence l'emplacement des cellules suivantes quatre heures après l'ensemencement pour chaque montage expérimental étudié. La figure 2A montre le pourcentage de cellules qui ont attaché à la surface de l'échafaudage pendant ce temps. Un facteur de conversion de 8,5 pg / cellule a été utilisé pour convertir le contenu d'ADN mesurée en nombre de cellules et donc de déterminer le pourcentage de cellules 10. Pour tous les semis set-up d'une enquête, le pourcentage de la fixation des cellules est relativement faible, avec la plus grande adhérence des cellules (30%) pour les échafaudages détenus dans des inserts de culture cellulaire et secoué à 30 tours (Insérer Shaker). Le plus bas adhésion (15%) était pour les échafaudages détenus dans les inserts de culture cellulaire et maintenu dans des conditions statiques (Insérer statiques).
Un grand nombre de cellules étaient présents au sein de la fraction des médias (figure 2B), notamment pour les inserts de culture cellulaire détenus dans des plaques de liaison faible (Insérer statiques) et des navires de rotation étant de 50% et 51%respectivement. Les échafaudages détenus dans les auges ont démontré un nombre élevé de cellules présentes dans le support lui-même - 48% des cellules pour Trough Shaker et 50% pour Trough statique.
microscopie électronique à balayage a permis une évaluation visuelle des échafaudages cellulaires tête de série (Figure 3). Images représentant a relevé une présence limitée de cellules sur la surface fibreuse, indépendamment de l'ensemencement set-up. Cependant, un plus grand nombre de cellules et d'agglomérats de cellules étaient présents sur les échafaudages détenus dans les inserts de culture cellulaire et secoué à 30 tours (Insérer Shaker).
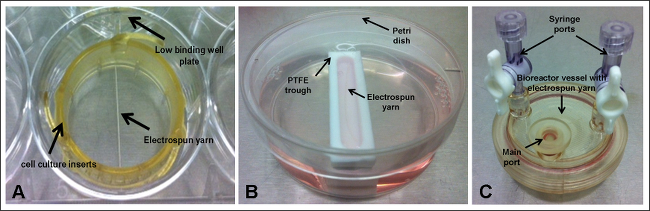
Figure 1. expérimental ups, où électrofilées Fils est tenue dans; (A) des inserts de culture cellulaire et une faible plaque à puits de liaison; (B) poly (tétrafluoroéthylène) (PTFE) auge et boîte de Pétri; et (C) de récipient bioréacteur. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
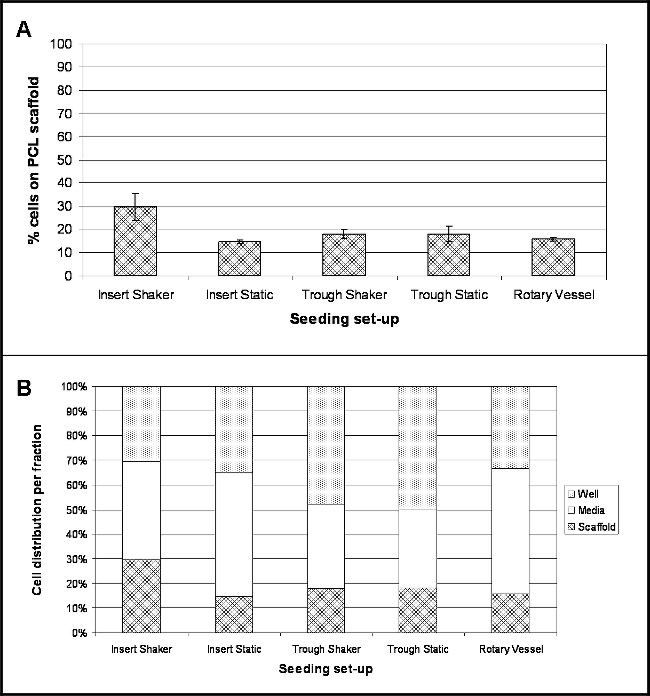
Figure 2. Emplacement des cellules 4 heures post-semis SUR DES PCL électrofilées Fils utilisant différents semis Set-up. (A) montre le pourcentage de cellules qui ont attachés à l'échafaud PCL (moyenne ± écart-type); (B) met en évidence le pourcentage propagation de emplacement de cellule dans les trois fractions - médias, bien et échafaudage (n = 4, les données présentées comme valeurs moyennes). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Représentant analyse au microscope électronique pour PCL électrofilées Fils avec mésenchymateuses humaines cellules souches, quatre heures après l'amorçage initial utilisant Différents montages expérimentaux. (Toutes les images à 1,000X agrandissement, barre d'échelle = 130 um.) Se il vous plaît cliquer ici pour voir une plus grande version de ce chiffre.
Discussion
Électrofilées matrices de fibres fabriqués à partir de biopolymères sont régulièrement utilisés pour supporter la fixation et la prolifération cellulaires pour des applications de biomatériau et / ou d'ingénierie tissulaire 11,12. Dans ces cas, les matrices sont souvent minces feuilles de fibres qui couvrent facilement toute la base d'une plaque de puits de culture cellulaire et ainsi sont en contact avec les cellules ensemencées qui améliore la fixation des cellules. Toutefois, si l'échafaud biomatériau ne couvre pas entièrement la base de la plaque bien, il ya de fortes chances qu'une grande proportion des cellules ensemencées ne sera pas rester en contact avec l'échafaud et, finalement, ne sera pas en mesure de joindre. Cette étude a examiné plusieurs méthodes différentes pour l'ensemencement de cellules sur des échafaudages qui ne couvrent pas la base de la plaque de puits, afin de déterminer une technique optimisée qui pourrait être recommandé pour les futures expériences à base de cellules.
Cinq différents set-up ont été étudiés (Figure 1): Scaffolds (électrofilé fils) a tenu en utilisant des inserts de culture cellulaire dans des plaques de faible et de liaison et soit maintenu dans des conditions statiques ou secoué à 30 tours; échafaudages placés dans les creux de PTFE étroites et détenus statique ou secouées à 30 tours; et échafaudages logés à l'intérieur des navires de bioréacteur à 9 tours. Déterminer le nombre de cellules qui avaient adhéré aux fils électrofilées par dosage de l'ADN a démontré un faible pourcentage de fixation pour tous les semis set-ups (figure 2); et ce est également confirmée à partir de micrographies électroniques à balayage (SEM) (figure 3). Plus l'attachement des cellules - 30% ou ~ 18060 cellules -Est observés pour les fils qui ont eu lieu dans les inserts de culture cellulaire et soumis à un mouvement continu. Fait intéressant, la fixation des cellules plus bas (15%) a été atteint pour les fils détenus par des inserts de culture cellulaire, mais gardés dans des conditions statiques, ce qui donnerait à penser que l'inclusion de mouvement radial a un effet positif sur le maintien des cellules en contact avec l'échafaud. Par Contre,il convient de noter que indirecte continue des flux de médias pourrait être responsable des agglomérats de cellules observées à partir des images SEM. La plaque d'agitation a été mis sur son réglage le plus bas - 30 tours - qui pourrait être une limitation à ce set-up. Utilisation d'un mouvement radial lente peut aider à prévenir ou réduire l'agglomération cellulaire et pourrait également améliorer la fixation des cellules comme les cellules connaîtront moins de force. Les expériences futures devraient se concentrer sur l'optimisation de la vitesse d'agitation idéal pour une meilleure fixation des cellules. Comportant un déplacement pour les fils détenus dans les creux n'a pas abouti à une tendance similaire, avec les deux scénarios qui donne 18% de fixation (~ 10 836 cellules); bien que cela puisse être dû à la flottaison partielle des échafaudages dans les auges (observé pour les creux placés sur la table à secousses), car ils ne ont pas été ancrés à la base. Flottante partielle de l'échafaudage empêchera pas de cellules qui ont coulé au fond de la cuve de venir en contact avec le matériau et adhérant. Pour tnotamment son set-up, la cuve a été logé dans une boîte de Pétri et un volume total de 10 ml de milieu ajouté. Les faibles dimensions de l'auge signifie que la majorité des médias est présent dans la boîte de Pétri et se il n'y a aucun mouvement, les cellules peuvent se éloigner de l'auge dans la boîte de Pétri et restent totalement hors de portée de l'échafaudage. Pour surmonter ces limitations, d'autres expériences devraient inclure une étape supplémentaire dans le protocole, les extrémités des échafaudages sont épinglés à la base des creux à l'aide de fines aiguilles stériles, car cela devrait empêcher leur flottaison et le mouvement (en particulier pour les échafaudages exposés à mouvement radial), qui devrait finalement conduire à une augmentation du nombre de cellules attachées à l'échafaud. 16% des cellules était attaché à des fils présents dans les récipients rotatifs. En dépit d'être une technique bien établie pour la culture 3D, les problèmes ne se posent à l'enlèvement des échafaudages du port principal de vaisseaux, ce qui peut avoir entraîné attac lâcheHED cellules perdues. Les navires qui se ouvrent complètement éliminerait ce problème; ils sont disponibles à l'achat, mais sont considérablement plus coûteux que les récipients jetables utilisés dans cette étude.
Cette étude démontre les problèmes actuels avec l'ensemencement échafaudages qui ne couvrent pas toute la base de plaques de puits de culture cellulaire standard. Ensemencement d'un nombre de cellules connu conduit à moins de un tiers de fixation à l'échafaud, en dépit de la superficie de l'échafaud en permettant à toutes les cellules d'adhérer. Cela pourrait avoir des conséquences néfastes dans d'autres tests cellulaires qui peuvent évaluer le comportement de la biocompatibilité et la cellule-matériau / cellule-cellule et les interactions avec l'échafaud comme un futur dispositif médical potentiel. Autres limites de l'étude peuvent inclure le 4 h point de temps - en dépit d'être suffisamment longue pour assurer l'ensemencement cellulaire initiale (cellules ont été montré pour fixer solidement à des substrats dans les 30 minutes 13,14,15), il peut être raisonnable dansvestigate des périodes subséquentes, la fourniture de cellules ne prolifèrent pas pendant un laps de temps plus long que ce serait autrement fausser le nombre de cellules de départ. La réduction du volume des médias, dans ce cas 10 ml, pourrait également améliorer le contact entre les cellules et échafaudage et, finalement, d'accroître la fixation des cellules. Les études futures devraient également envisager la viabilité des cellules que le processus d'ensemencement des cellules peuvent endommager les cellules et / ou la mort cellulaire 16. tests d'ADN cellulaire ne font pas de distinction entre les cellules viables et non viables, en tant que tel essai vivants / morts, par exemple, mettrait en évidence le niveau de viabilité.
Cette enquête vise à sensibiliser au nombre réel de cellules qui se fixent à l'échafaud, malgré l'ensemencement d'une quantité connue. Pour les études qui se appuient sur le nombre de cellules de départ, il est très important que les chercheurs savent exactement combien ce chiffre ne avez en fait adhérer au substrat d'intérêt.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Les auteurs tiennent à remercier et à reconnaître le Conseil de recherches médicales pour le financement de cette recherche - MRC-FAP code subvention G1000788-98812.
matériels
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
Références
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426 (2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds.. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -. I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon