Method Article
ChIP-seq Denemeleri otomatikleştirme 10.000 HeLa Hücreleri üzerinde epigenetik Profilleri oluşturmak için
Bu Makalede
Özet
Methods for mapping in vivo protein-DNA interactions are becoming crucial for every aspect of genomic research but they are laborious, costly, and time consuming. Here a commercially available robotic liquid handling system that automates chromatin immunoprecipitation for mapping in vivo protein-DNA interactions with limited amounts of cells is presented.
Özet
Chromatin immunoprecipitation followed by next generation sequencing (ChIP-seq) is a technique of choice for studying protein-DNA interactions. ChIP-seq has been used for mapping protein-DNA interactions and allocating histones modifications. The procedure is tedious and time consuming, and one of the major limitations is the requirement for high amounts of starting material, usually millions of cells. Automation of chromatin immunoprecipitation assays is possible when the procedure is based on the use of magnetic beads. Successful automated protocols of chromatin immunoprecipitation and library preparation have been specifically designed on a commercially available robotic liquid handling system dedicated mainly to automate epigenetic assays. First, validation of automated ChIP-seq assays using antibodies directed against various histone modifications was shown, followed by optimization of the automated protocols to perform chromatin immunoprecipitation and library preparation starting with low cell numbers. The goal of these experiments is to provide a valuable tool for future epigenetic analysis of specific cell types, sub-populations, and biopsy samples.
Giriş
Yeni Nesil Dizi (NGS) teknolojileri yaygın ve daha erişilebilir hale geldikçe, şimdi transkripsiyon faktörü keşfini sağlayan NGS algılama (ChIP-seq), ardından immunoprecipitation kromatin protein-DNA etkileşimleri genom haritalama için birincil yöntem histon modifikasyonları siteleri veya desenler bağlanma. ChIP seq zenginleştirilmiş DNA fragmanlarının ölçülmesiyle protein-DNA etkileşim niceliksel ve niteliksel analizi için kullanılabilecek tüm genom yüksek verimlilik verilerinin sağlanması için avantajlıdır. Bununla birlikte, bu tür bir sekans kitaplığı oluşturmak için yeterli malzeme elde etmek güçlüğü gibi standart bir çipli seq deneylerde bazı dezavantajları da vardır.
ChIP deneyleri, hücre parçalama ve immunokomplekslerin sonikasyon ile kromatin kesme, 3) oluşumunu içerir 2) numune hazırlama 1) çapraz protein DNA bağlayıcı bölgeler de dahil olmak üzere altı temel adımlar ayrılırImmunokomplekslerin 4) yağış, immunokomplekslerin 5) yıkanması ve qPCR ve NGS tarafından zenginleştirilmiş materyal ve analiz 6) elüsyon.
kognat antijeni için antikorun iyi kromatin hazırlanması, orjinal numune içinde antijen miktarı ve özgüllük ve afinitesi en: bir çip tahlilinde başarısı üç faktöre bağlıdır. Önemli bir kısıtlaması, bir sıralama kütüphane oluşturmak için yeterli zenginleştirilmiş DNA elde etmek için hücre sayıları başlayan yüksek tutarlar için gerekliliktir. Böyle biyopsi örneklerinde veya hücre alt-popülasyonları gibi sınırlı miktarda numune ile çalışmak bilim adamları için, ChIP-seq deneyler çok zorlu. Hücreler 1 düşük bir miktarda, 2 ile çalışırken son çalışmalar ChIP seq tahliller yapılabilir göstermiştir. Diagenode hücre sınırlı sayıda başlatırken tam ChIP seq deneyler otomatik bir robot sıvı taşıma sistemi geliştirmiştir.
Otomasyon sağlarChIP-seq numunelerin manuel hazırlanması üzerinde birçok avantajı insan hata azaldıkça, değişkenliği azaltır, ve deneysel maliyetini düşürür. Kromatin immünopresipitasyon ve kütüphane hazırlanması için yarı-otomatik protokolleri bildirilmiştir ama düşük hücre sayıları, 3, 4, 5, 6 kullanırken bu çalışmaların hiçbiri verileri göstermiştir.
Bu yazıda tam otomatik iş akışı manyetik boncuk tabanlı teknoloji kullanır ve bu protokol optimizasyonu birden fazla parametre ele bir robot sıvı-işleme sistemi kromatin immunoprecipitation ve kütüphane hazırlık deneyleri hem açıklanmıştır. Burada, otomatik ChIP-seq deneyler başarıyla basitleştirilmesi standartlaştırılması ve küçük hücre popülasyonlarının epigenetik profillerini incelemek için güvenilir bir çözüm sağlamak amacı ile hücrelerin sınırlı sayıda yapılmıştır. Bu yazıda anlatılan otomatik ChIP protokol belirli histon antikorlar ve reaktifler b kullanarak HeLa hücreleri üzerinde optimize edilmiştirakışını ut deneysel optimizasyonu karşılık gelen başka hücre hatları ve antikorlar için adapte edilebilir.
Protokol
1. Standart ChIP Deneyler
- Hücre toplanması ve DNA-protein çapraz bağlama.
- % 80 -90% bir izdiham HeLa-S3 hücreleri büyütün. , Kültür ortamı çıkarın 1x fosfat tamponlu tuzlu su (PBS), 10 ml ile iki kez bulaşık yıkama ve kültür plakasına Tripsin-EDTA (1x) ekleyin. Çanak hücreleri ayırmak için 2 dakika arasında bir süre için inkübe edilir. Hücreler toplanır ve 10 ml PBS ile iki kez yıkanır.
Not: uzun inkübasyon süreleri, hücre hasarına yol açar. - 500 xg'de 5 dakika boyunca hücreler santrifüj ve 20 ml PBS içinde tekrar süspansiyon hücreleri. Hücreleri saymak için devam edin.
- 500 xg'de 5 dakika santrifüj hücreleri süpernatant atın ve PBS 500 ul ekleyin. katılaştırma basamağında hücrelerin optimum sayısı, 500 ul PBS başına 10000000 hücredir.
- Hücre süspansiyonu 500 ul ve her seferinde taze% 37 formaldehid 13.5 ul ekleyin. Oda sıcaklığında 8 dakika hücreleri sabitleşmek.
- 1.25 M glisin SOLUT 57 ul ekleiyon tespit durdurmak için. Hafif bir girdaptan ile sabit karıştırma ile oda sıcaklığında 5 dakika süreyle inkübe edilir. Bu noktadan itibaren buz üzerinde çalışın.
- 4 ° C'de 5 dakika boyunca 500 x g'de santrifüj hücreleri ve hücre pelletini bozmadan süpernatant atılır.
- 1 ml PBS ile iki kez hücreleri yıkayın. Yavaşça Süpernatantı atın ve buz üzerinde hücre pelet tutmak.
- % 80 -90% bir izdiham HeLa-S3 hücreleri büyütün. , Kültür ortamı çıkarın 1x fosfat tamponlu tuzlu su (PBS), 10 ml ile iki kez bulaşık yıkama ve kültür plakasına Tripsin-EDTA (1x) ekleyin. Çanak hücreleri ayırmak için 2 dakika arasında bir süre için inkübe edilir. Hücreler toplanır ve 10 ml PBS ile iki kez yıkanır.
- Hücre parçalama ve kromatin kesme
- Hücre pelletine buz gibi soğuk lisiz tamponu il1 10 ml ilave edilir (1.000.000 hücre başına liziz tamponu için 1 mi optimum oran). Pipet ve birkaç kez aşağı ve yumuşak karıştırma ile 4 ° C'de 10 dakika inkübe edilir.
- 500 xg 5 dakika 4 ° C lizat santrifüj. Süpernatantı atın.
- Lizatların buz soğuk lizis tamponu il2 10 ml ekleyin ve yukarı ve aşağı pipetleme hafifçe karıştırın. 4 ° C'de 10 dakika boyunca lizatları inkübe edin.
- 500 xg'de 5 dakika ve 4 ° C Santrifüj ve supernatant atın.
- PrepaIS1 kesme tampon 200x proteaz inhibitörü kokteyl (PIC) ekleyerek tam kesme tampon yeniden. 5 dakika buz üzerinde tampon tutun ve daha sonra buz üzerinde çalışacak. Pelet her biri 10 milyon hücre tam IS1 kesme tampon 1 ml ekleyin ve hafifçe yukarı ve aşağı pipetleme karıştırın. 10 dk numunenin viskozitesini azaltmak için sonikasyon önce buz üzerinde örneklerin inkübe edin.
- 10 döngü, her biri 2-3 kümeleri için, bir su banyosu sonikatör kullanılarak sonikasyon ile kromatin 300 ul alikotları Kayma. Bir döngü 30 sn "ON" ve yüksek güç ayarı 30 sn "OFF" oluşur. Alternatif olarak, 30 sn "ON", 30 saniye "OFF" 5 ila 10 döngü kısa bir sonikasyon süresi ile bir pico-sonikasyon cihazı kullanın. Kısaca vorteks çalışır arasındaki tüpleri spin ve. Selenleyici diğer türleri kullanırken, kromatin kesme için üreticinin talimatlarına gelen izleyin.
- 10 dakika ve c 16.000 xg'de makaslanmış kromatin santrifüjIP adımda hemen kullanılmak üzere yüzer ollect. Seçenek olarak ise, ileride kullanılmak üzere en fazla 2 ay boyunca -80 ° C 'de kromatin saklayın.
- Önce 1-1.5% TAE agaroz jeller veya bionalyzer kullanarak immunopresipitasyon adım kromatin kesme verimliliğini analiz. Optimal kromatin fragman boyutları 100-600 bp arasında değişmektedir.
2. Düşük Cell işlemcisinde Deneyler
- Hücre toplama ve DNA-protein çapraz
- % 80 -90% bir izdiham HeLa-S3 hücreleri büyütün. , Kültür ortamı çıkarın 1x fosfat tamponlu tuzlu su (PBS), 10 ml ile iki kez bulaşık yıkama ve kültür plakasına 1x Tripsin-EDTA ekleyin. Çanak hücreleri ayırmak için 2 dakika arasında bir süre için inkübe edilir.
Not: uzun inkübasyon süreleri, hücre hasarına yol açar. - 1 ml santrifüj tüpüne serumu içeren 1 ml kültür ortamı eklenerek hücreler toplanır. Hücreleri saymak.
- X g, 500 ° C'de 5 dakika için hücreler santrifüj. Hücre sayısını getirtespiti için kültür ortamının ml'si başına 10,000 hücre için.
- Tespiti için her bir tüp içine% 36.5 taze hazırlanmış formaldehit 27 ul ekle. Tüpü, iki ya da üç kez ters çevirin ve oda sıcaklığında 10 dakika inkübe edilir.
- Tüp ters, numune, iki ya da üç kez 1.25 M glisin çözeltisi 115 ul ilave edin ve oda sıcaklığında 5 dakika inkübe edilir. Bu noktadan itibaren buz üzerinde çalışın.
- 4 ° C'de 10 dakika boyunca 300 x g'de hücreleri santrifüjleyin. Yavaş yavaş Süpernatantı atın.
- PIC (200x, nihai konsantrasyon 1 x) ile, 1 ml buz gibi soğuk HBSS hücreleri yıkayın. 4 ° C'de 10 dakika boyunca 300 x g'de hücreleri ve santrifüj tekrar süspansiyon tüpü, iki ya da üç kez ters çevirin. Yavaşça Süpernatantı atın ve buz üzerinde hücre pelet tutmak.
- % 80 -90% bir izdiham HeLa-S3 hücreleri büyütün. , Kültür ortamı çıkarın 1x fosfat tamponlu tuzlu su (PBS), 10 ml ile iki kez bulaşık yıkama ve kültür plakasına 1x Tripsin-EDTA ekleyin. Çanak hücreleri ayırmak için 2 dakika arasında bir süre için inkübe edilir.
- Hücre parçalama ve kromatin kesme
- 10,000 hücre başına tam Liziz Tampon TL1 (Liziz Tampon TL1 + PIC) 25 ul ekleyin ve hücreleri tekrar süspansiyon elle tüpün alt çalkalayın. 5 dakika boyunca buz üzerinde inkübe edilir.
- Tam HBSS 75 ul ekleyin (HBSS + PIC) 10.000 hücreleri içeren ve her seferinde içine tampon.
- 5 döngü, her biri 5 kümeleri için sonikasyon ile 10,000 hücre, 100 ul alikotları Kayma. Bir döngü 30 sn "ON" ve yüksek güç ayarı 30 sn "OFF" oluşur. Alternatif olarak, 30 sn "ON", 30 saniye "OFF" 5 döngü kısa sonikasyon zaman kullanılan bir pico-sonikasyon cihazı kullanın. Optimal kromatin fragman boyutları 100-600 bp arasında değişmektedir. Kromatin hazırlıkları, hücre tipleri ve farklı selenleyici ayrı kesme optimizasyon deneyleri gerektirdiğini unutmayın.
- Santrifüj 10 dakika süpernatant çözünmeyen malzeme atmak ve toplamak için 14.000 xg makaslanmış kromatin IP adımda hemen kullanılır. Seçenek olarak ise, ileride kullanılmak üzere en fazla 2 ay boyunca -80 ° C 'de kromatin saklayın.
- 1-1.5% TAE agaroz jelleri kullanarak önce immunopresipitasyon adım kromatin kesme verimliliğini analiz veyabionalyzer. Önceden RNase ile muamele etmek örnekleri kesme görsel değerlendirme geliştirmek için jel analizini agaroz. Optimal kromatin fragman boyutları 100-600 bp arasında değişmektedir.
3. Kromatin Immunoprecipitation ve Kütüphane Hazırlık
- Standart Otomatik ChIP deneyleri için
- Kromatin makaslanmış 100 ul ChIP Tampon H (ChIP Tampon H + PIC) 120 ul ekleyin. IP 200 ul kullanın ve giriş örnek olarak 20 ul 2 ul tutmak.
- Otomasyon aracı otomatik ChIP 200 ul protokolünü seçin. Protokolün çıktı vadede başına 1 ila 16 örnekleri olduğunu.
- Kromatin 1-2000000 hücreleri anti-H3K79me3 1-2 ug tekabül eden kullanılarak otomatik bir ChIP deney çalıştırın -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, -H3K9 / 14ac, -H3K36me3 ve H3K9me3 ChIP seq dereceli tavşan poliklonal antikorları elde edilebilir. Optimal antikor miktarları histon modifikasyonu ve afinite ve spec bağlı olarak değişirkarşılık gelen antikorun spesifite.
- Bir izotip kontrol antikoru olarak bağışıklığı olmayan tavşan IgG eşit miktarda kullanın. Alternatif olarak, kaplanmamış boncuk ya da ChIP kontrolleri gibi spesifik bloke antikor kullanın. Her reaksiyon için protein-kaplanmış bir manyetik boncuk 20 ul ekle.
- Anti-H3K79me3 ve -H3K4me2 poliklonal antikorlar ile otomatik ChIP deneyleri gerçekleştirmek için otomatik histon ChIP-seq kiti reaktifleri kullanın. Anti-H3K27me3, -H3K4me3, -H3K9ac ile -H3K9 / 14ac, -H3K36me3 ve -H3K9me3 ChIP deneyleri gerçekleştirmek için ideal bir ChIP-seq kiti reaktifleri kullanın.
- Otomasyon cihazı uygulanan yazılım talimatları takip otomatik ChIP protokolünü seçin. Antikor kaplama aşaması için 4 saat ve immünopresipitasyon aşaması için 15 saat için ChIP deney parametreleri ayarlayın. ters çapraz bağlama kademesi 4 saat süre ile 65 ° C'de otomatik cihaz içinde yer alır.
- Otomatik bir sistem ile ilgili ters çapraz-bağlanmış DNA arındırın. Seç autbir protokol ya da kit manyetik tane bazlı DNA saflaştırılması kullanılarak DNA saflaştırma için omated protokolleri. Su 25 ul DNA Zehir.
- Immunoprecipitated DNA% 10 ayıklanması immunopresipite DNA niceliğini. imüno-DNA ürünü kromatin ve antikor, hücre tipi ve hedef histon modifikasyonu kalitesine bağlıdır. Üreticinin talimatlarına göre bir deney takımı ile DNA miktarı belirlenir.
- En azından pozitif 1 ve 1 negatif kontrol genomik bölgelerde primerler kullanılarak kantitatif PCR ile DNA immunopresipite kalitesini analiz. ChIP zenginleşme değerlendirmek için toplam immunoprecipitated DNA% 10'dan fazla kullanmayın.
- QPCR reaksiyonları hazırlayın. 2x SyberGreen qPCR ana karışımı 10 ul, primer karışımı 1 ul, çökeltilir veya giriş DNA ve 20 ul nihai reaksiyon hacmi steril su yukarı 1-5 ul ekle. QPCR programı, 95 ° C'de bir ilk denatürasyon adımı içerir5-10 dakika boyunca Taq polimeraz sağlayıcısına bağlı olarak ve tavlama sıcaklıkları seçilen primerler göre ayarlanması gerekir.
- Yonga DNA yanı sıra, aynı kromatin hazırlanması kaydedilen giriş DNA her ikisini de kullanarak kitaplıkları oluşturmak için ticari olarak temin edilebilen Illumina ChIP seq kütüphane hazırlanması ayıraçlar ile uyumlu kullanımlar otomatik kütüphane hazırlık protokolleri. Kütüphane hazırlanması için her bir antikordan çökeltilir DNA 10-20 ng kullanın. Vadede başına 16 otomatik kütüphaneler kadar hazırlayın.
- Kütüphaneler sırası ve Illumina üreticinin talimatlarına göre kümeleri oluşturmak. Standart Illumina boru hattı, filtre aşağıdaki birincil biyoinformatik analizi (küme filtreleme, taban arama, vb) gerçekleştirmek ve ELAND hizalayıcısı ile (güncel sürüm GRCh38 olan) son insan genom montaj okur hizalamak. Pik arama için SICER 7 veya 8 MACS kullanın ve w doruklarına mansap analizleri yapmaki Homer 9, BEDTools 10 veya tercih edilen yazılımları.
- Düşük hücre sayısı otomatik ChIP deneyleri için
- Kromatin makaslanmış 100 ul tam ChIP tampon TC1 (ChIP Tampon TC1 + PIC) 120 ul ekleyin. IP 200 ul kullanın ve girdi olarak 20 ul tutmak.
- Otomasyon sisteminde otomatik ChIP 200 ul protokolünü seçin. Protokolün çıktı vadede başına 1 ila 16 örnekleri olduğunu.
- Düşük kromatin miktarları üzerinde çalışmak üzere optimize otomatik ChIP reaktifleri ve ChIP sınıf antikorları kullanarak otomatik ChIP-seq deney çalıştırın. 10,000 hücre ve 100,000 hücre anti-H3K27me3 0.5 ug, 0.25 ug -H3K4me3, 0.1 ug -H3K27ac, 0.25 ug -H3K9me3 tavşan prim ChIP seq dereceli tavşan poliklonal antikorlar, karşılık gelen kromatin kullanın. Optimum antikor miktarları histon modifikasyonu ve karşılık gelen antikor yakınlık ve özgüllük bağlı olarak değişir.
- Non-immun rab eşit miktarda kullanınbir izotip kontrol antikoru olarak biraz IgG. Alternatif olarak, kaplanmamış boncuk ya da ChIP kontrolleri gibi spesifik bloke antikor kullanın. Her reaksiyon için protein-kaplanmış bir manyetik boncuk 10 ul ekle.
- Otomasyon cihazı uygulanan yazılım talimatları takip otomatik ChIP protokolünü seçin. Antikor kaplama aşaması için 4 saat ve immünopresipitasyon aşaması için 15 saat için ChIP deney parametreleri ayarlayın. ters çapraz bağlama kademesi 4 saat süre ile 65 ° C'de otomatik cihaz içinde yer alır.
- Üreticinin talimatlarını takip ederek, su içinde 25 ul 6 ul gelen hacim elüte döndürme kolonları kullanılarak ters çapraz-bağlanmış DNA arındırın.
- Piyasada bulunan değerlendirme kiti kullanılarak DNA miktarı belirlenir. QPCR ChIP kalitesini değerlendirmek için pozitif ve negatif kontrol bölgeleri için primerler kullanarak sonuçları analiz edin.
- Düşük DNA Quan ile kütüphaneleri hazırlamak için optimize kütüphane hazırlık reaktifleriyle bir kütüphane hazırlık seti kullanıntities. 30 pg ve kütüphane hazırlanması için (sırasıyla 10,000 ve 100,000 hücre deneyleri gelen) ChIP DNA 300 syf kullanın. Kütüphane hazırlık reaktif ile uyumlu otomatik protokolünü kullanarak kütüphaneleri hazırlayın. Otomatik kütüphane hazırlık hacmi vadede başına 1 ila 48 kütüphaneler olduğunu.
- Çift sarmallı DNA şablonları sonu onarımı takiben, sıralama astar siteleri içeren bölünebilir kök-döngü adaptörleri Arter. DNA uzatma adımı takiben, kütüphane hazırlık seti protokolde belirtilen yüksek sadakat büyütme yöntemi ile örnek yükseltmek.
- Kütüphane amplifikasyon sonra, ölçmek ve kütüphane hazırlık seti yönergeleri izleyerek kütüphaneleri arındırmak. Arıtma gerekli değildir bundan sonra boyutu seçimini unutmayın.
- Kütüphaneler sırası ve üreticinin talimatlarına göre kümeleri oluşturmak. Stand aşağıdaki birincil biyoinformatik analizi (küme filtreleme, taban arama, vb) gerçekleştirmekard üretici boru hattı, filtre ve ELAND 7 hizalayıcısı ile (güncel sürüm GRCh38 olan) son insan genom montaj okur hizalamak. , BEDTools 10, ya da herhangi bir tercih edilen yazılımları tepe arama için SICER 8 veya 9 MACS kullanın ve Homer ile doruklarına mansap analizleri yapmak.

IP-Yıldızlı Compact otomatik ChIP deneyleri kurmak için nasıl gösteren yazılım Şekil 1. Ekran. Yazılım yanı sıra anahtar deney parametreleri (Antikor Kaplama, IP ve yıkar değiştirmek için çalışma başına örneklerin miktarını seçmek için esneklik sağlar ) araştırmacı ihtiyaçlarına göre. Otomatik işlem paralel farklı koşullar (örneğin, farklı ve antikor miktarları, farklı ve hücre miktarda ve hatta farklı t test veriyorYPES ve aynı vadede manyetik boncuk miktarları. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil otomasyon sisteminde kütüphane kiti kullanılarak yeni nesil dizileme için otomatik kütüphane hazırlığı kurmak için nasıl gösteren yazılım 2. Ekran. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
Sekiz farklı histon belirteçleri için otomatik ChIP-seq deneyler Optimize
Başarıyla geliştirmek ve daha önce manuel ChIP-Seq deneyler valide edildi otomatik ChIP protokolleri, ChIP-seq sınıf antikorları doğrulamak için seçildi (veriler gösterilmemiştir). Anti-H3K79me3, -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, -H3K9 / 14ac, -H3K36me3 ve -H3K9me3: Aşağıdaki ChIP seq dereceli antikorlar, bu çalışma için seçilmiştir. Tüm yonga seq dereceli antikorların özelliği, daha önce dot blot peptid dizileri ve Western Blot deneyler ile teyit edilmiştir (veriler gösterilmemiştir). Artan antikor miktarlarda Pilot ChIP-qPCR deneyleri antikorların (Şekil 3) hassasiyetini belirlemek için yapılmıştır. en az iki olumlu ve iki negatif kontrol hedefleri ile QPCR analiz edildi ve yüksek negatif hedefin üzerinde pozitif zenginleşme ile profiller beşli sıralama exper için nitelikli daha iments. Bu makaslanmış kromatin yüksek kalite ile ChIP ve ChIP-seq deneyler gerçekleştirmek için önemlidir. Bu yayında yer alan tüm talaş deneyler taze kromatin kullanılarak gerçekleştirilmiştir. Bu, -80 ° C'de sabit hücreler dondurma ve farklı bir gün kromatin hazırlama ve kesme işlemine devam etmek de mümkündür. Ancak, kromatin taze hazırlanmış, kromatin ve bu nedenle sonication koşulları her kromatin hazırlanması için optimize edilmesi gerekebilir farklı davranabilir donmuş sabit hücrelerden hazırladı. Farklı hücre tipleri ile çalışırken, farklı deterjan bileşimlerinde (SDS) ile kesme tamponlar da kullanılabilir. Bu süspansiyon içinde yetiştirilmiş birincil hücre çizgileri veya hücre gibi hücre tipleri zor hücreler kesme ve HeLa düşük SDS konsantrasyonu (% 0,1) gerektirir gibi kesme kolay hücre çizgileri, buna karşın yüksek SDS konsantrasyonlarda (% 1) gerektirir olan kesme tamponlar da kullanılabilir.
res.jpg "/>
Şekil otomasyon sistemi kullanarak çipe dereceli antikorların 3. Doğrulama. ChIP anti H3K79me3, -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, H3K9 / 14ac ile gerçekleştirildi dan kesilmiş kromatin -H3K36me3 ve -H3K9me3 tavşan poliklonal antikorlar histon modifikasyonları bağlı, 1 milyon HeLa-S3 hücreleri. 200 ul çalışma hacmi ile otomatik ChIP protokolleri antikor titrasyon deneyleri için otomatik alet kullanılmıştır. 1, 2, 5 ve 10 ug antikor miktarları ChIP deney başına test edildi ve 2 ug IgG, her bir deney için, negatif kontrol olarak kullanıldı. Zenginleştirmeler qPCR ile değerlendirildi. Sonuçlar girdi bir (% qPCR analizi sonrasında giriş DNA'ya kıyasla immunoprecipitated DNA nispi miktarı) olarak gösterilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Doğrulama ve optima belirledikten sonra ChIP dereceli antikorların l miktarları otomasyon sistemi içinde kullanılmak üzere, otomatik ChIP seq deneyleri her histon modifikasyonu (Şekil 4) için dizilim profilleri oluşturmak amacıyla yapılmıştır.

Şekil 4. Histon ChIP-seq profiller otomatik ChIP-seq deneyler tarafından oluşturulan. Şekil H3K4me3, H3K9ac ve H3K9 / 14acH3K4me2 H3K79me3 ve H3K36me3 için farklı genomik bölgelerde ChIP-seq profillerini göstermektedir. 4A tam X boyunca zirve dağılımını gösterir -Kromozom ve 4B, GAPDH geni çevreleyen bir 75 kb bölgesi dağıtım. 4C MYT1 geni çevreleyen bir 500 kb bölgesi içinde H3K27me3, H3K36me3 ve H3K4me3 profillerini gösterir ve 4D 200 kb bölgesi çevresindeki ZNF12 içinde H3K9me3 dağılımını göstermektedir.large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
Geni ifadesi ile ortak altı farklı histon değişiklikler için Histon epigenetik profiller (H3K4me3, H3K9ac, H3K9 / 14ac, H3K4me2, H3K79me3 ve H3K36me3) oluşturulmuştur. Şekil 4A farklı histon belirteçleri kromozom X boyunca ChIP seq profillerini göstermektedir. 6 farklı histon profilleri arasında gözlemlenen yüksek tepe ilişki doğru ve güvenilir veri oluşturmak için otomatik bir sistem özelliklerini gösterir. Şekil 4B, 4C ve 4D özel genomik bölgelerden farklı histon değişiklikler için tepe dağılımını göstermektedir.
200 hücrelerine kadar Otomatik kromatin immünopresipitasyon deneyleri
ChIP deneylerinde kullanılabilir hücrelerin en az miktarda kromatin kalitesine bağlıdır, specificity ve antikor ve çalışılan histon modifikasyonu veya protein bolluğu duyarlılığı. Sınırlı numune miktarları ve optimal reaktifler ve farklı taşıyıcı seçimi ile çalışma, DNA kurtarma verimliliğini artırır ve ChIP deney başarısına katkıda zaman iyi ChIP-seq sınıf antikorları seçilmesi önemlidir. Özellikle kromatin düşük miktarları ile çalışmak için optimize edilmiş talaş reaktifler kullanılarak, IP-Star otomatik sistemi içinde denendi otomatik ChIP protokolü işleyebilir hücreleri, kromatin, antikor ve manyetik boncuk farklı miktarlarının en az miktarını belirlemek için.
Protokolde tarif edildiği gibi İlk olarak, 10,000 hücre ile ilgili kromatin sonike edilmiştir. ChIP sonuçları negatif kontrol bölgelerinde H3K4me3 pozitif kontrol bölgeleri antikorun ve ihmal edilebilir bir sinyal ile önemli zenginleşme göstermektedir qPCR (Şekil 5A) ile doğrulanmıştır. Karşılaştırma ve tutarlılık kanıtı, additiona için10000 hücreleri kullanılarak H3K27ac, H3K9me3 elde edilen l verileri ve H3K27me3 antikorlar temin edilmektedir.
Otomatik ChIP deneyler aynı H3K4me3 antikoru kullanılarak hücrelerin düşük miktarlarda çalışmak için otomatik sistemin yeteneklerini göstermek için daha sonra yapılmıştır. otomatik ChIP tekrarlanabilir ve manuel ChIP sonuçları (Şekil 5B) ile son derece benzer olan on adet IP bir dizi tepkime ile ortaya iyi bir performans sergiledi. Manuel ve otomatik deneyler yapıldı ve otomatik protokollerin faydaları değişkenlik (Şekil 5C) deneme deney azaltmada görüldü.
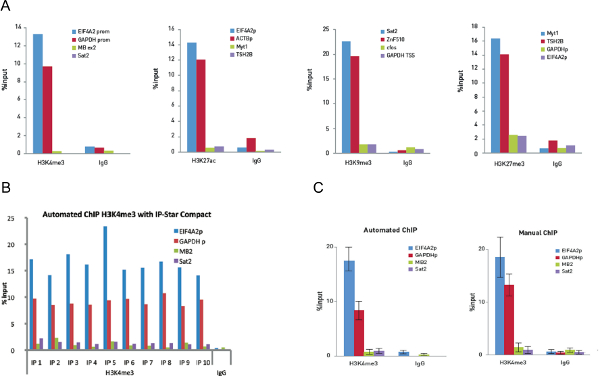
Şekil 5. Manuel ChIP deneyleri 10.000 hücreleri üzerinde gerçekleştirilmiştir 10.000 hücreleri üzerinde ChIP ve Auto ChIP deneyleri optimizasyonu ve H3K4me3 0.25 ug, H3K27ac 0.1 ug, H3K9me3 ve 0.2 0.5 ug kullanarakH3K27me3 antikorların 5 ug. Tavşan IgG Aynı miktarlardaki bir kontrol olarak kullanılmıştır. QPCR iki pozitif lokus ve her bir yonga için deney için iki negatif lokusların primerlerle gerçekleştirilmiştir. Şekil 5A, kurtarma, giriş bir yüzdesinde (qPCR analizi sonra giriş DNA ile karşılaştırıldığında çökeltilir DNA nispi miktarı) olarak ifade gösterir. Şekil 5b Şekil 10 ChIP reaksiyonları 0.25 mikrogram H3K4me3 poliklonal antikor ve tavşan IgG 0.25 mikrogram olarak negatif kontrol antikoru kullanarak IP-Yıldızlı Compact çalışır. Daha sonra QPCR analizi pozitif lokus EIF4A2 promoteri ve GAPDH TSS ve negatif lokuslarının miyoglobinin exon2 ve SAT2 için primerler ile gerçekleştirildi. Şekil iyileşme olduğunu gösterir, giriş (qPCR analizi sonra giriş DNA ile karşılaştırıldığında imüno DNA nispi miktarı) yüzdesi olarak ifade edilmiştir. Şekil 5C, 10 otomatik ChIP deneylere karşılık, 10 kılavuzu ChIP deneyler H3K4me3 çip veri gösterir. Hata çubukları s temsil On çoğaltır her tandard sapmalar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Otomatik ChIP protokolleri duyarlılığını anlamak için, deneyler IP başına 100,000, 200 kadar hücreler arasında değişen hücrelerin miktarı kullanılarak gerçekleştirilmiştir. Bir çok yaygın bir histon modifikasyonu olduğu gibi anti-H3K27me3 antikoru kullanılmıştır. Diğer histon ya da olmayan histon antikorların kullanımı epitopunun bolluğu ve antikorun kalitesine bağlı olarak, daha fazla veya daha az hücre gerektirebilir. Deneyler ile nicel PCR ile doğrulanır ve bu boncuklar ve deneyler antikor arka miktarını azaltarak kadar az 200 hücreleri antikor (Şekil 6) ile başarılı bir şekilde ChIP-qPCR sonuçlar sağlayan düşük olduğu gözlenmiştir.
iles / ftp_upload / 52.150 / 52150fig6highres.jpg "/>
Şekil 6. 200 hücreleri üzerinde ChIP deneyleri otomatik. Hela-S3 hücreleri ve antikor H3K27me3 karşı. Kromatin, 1 milyon hücreleri ve ChIP reaksiyon başına kullanıldı (100.000 200 hücre eşdeğeri) Bu kromatin seri dilüsyonları kesildi. Protein A-kaplı manyetik boncuklar 1 H3K27me3 ug ve 10 ul H3K27me3 0.5 ug ile 10,000 ve 1000 hücreleri üzerinde boncuklar 10 ul ve H3K27me3, 0.25 ug ila 500 ve 200 ile boncuk 5 ul, 100,000 hücre deneyi kullanıldı Hücreler. 100,000 hücre sırasıyla 1000 hücreleri ile deneyler yaparken 1 ug ve tavşan IgG ug 0.5 negatif kontrol antikoru olarak kullanılmıştır. 6A. Girişi üzerinden% olarak TSH2B ve GAPDH genlerin doluluk göstermektedir 6B negatif GAPDH kontrolü karşı TSH2B göreli doluluk göstermektedir genomik bölge.
Üzerindeki ChIP-seq sonuçları Mansap analizi10,000 hücre
10,000 HeLa hücrelerinde ve yonga deneyler H3K4me3 antikorun 0.25 ug fiş seq tahliller yapılmıştır otomatik hücre düşük başlangıç sayıları ile otomatik ChIP seq deneylerin genel kalitesini değerlendirmek için 100,000 HeLa-S3 hücreleri kullanılmıştır ile deney için pozitif kontrol olarak. otomatik kütüphaneleri bir düşük DNA'lı miktarda hazırlanmış kütüphaneler için uyarlanmış MICROPLEX kütüphane hazırlık seti reaktif maddeler kullanılarak elde edildi. Mümkün olsa bile daha az 10.000 hücreleri ile başarılı otomatik ChIP-deneyler gerçekleştirmek için unutmayın, aşağı çekti DNA miktarları kiti reaktifleri kullanılarak kütüphaneleri hazırlamak için yeterli olmayacaktır. Küme oluşturma ve dizileme, imalatçının talimatlarına göre yapılmıştır. biyoinformatik düşük hücre sayısı ChIP örneklerinden sıralama gösterisi olağanüstü sonuçlar sonrası analizleri. 30 mg veri kümesi (başlangıç malzemesinin 10,000 karşılık gelen hücrelerdeki ) Düşük arka plan gürültüsü ve başlangıç malzemesinin 100,000 hücre tekabül eden 300 pg veri kümesi () ve harici bir referans olarak kullanılmıştır KODLAMASI projesi için geniş Enstitüsü tarafından üretilen H3K4me3 veri kümesi de doğrulandı son derece güvenilir zenginleştirme tepe içerir. İki veri setleri en% 40, en az% 80'lik bir örtüşme vardır karşılaştırılması durumunda ChIP seq tekrarlanabilir olarak kabul edildiği KODLAMASI 11 projede kullanılan standart bir yönteme değinmektedir en 40 örtüşme oranı verileri not etmek önemlidir önemi puanı göre sıralanmış piklerin. 300 pg veri kümesi (kendi doruklarına tüm değil, sadece en iyi 40% dikkate alınarak) ve Geniş Enstitüsü verilerine (Tablo 1) hem kıyasla 30 pg veri kümesi bu kriterleri yerine getirmektedir. 300 pg veri kümesi 98% Top 40 örtüşme oranı (Şekil 7) ile Broad Enstitüsü'nden verilerine hemen hemen aynı doruklarına gösterir.
ighres.jpg "/>
10.000 hücreleri ChIP-seq deneyler 7. ChIP deneyleri Şekil ve kütüphane nesil H3K4me3 antikoru (/ ul 0.25 mikrogram) ile 10,000 ve 100,000 HeLa-S3 hücreleri üzerinde oluşturulmuştur. 35 bp etiketleri ELAND hizalayıcısı insan genomunun eşleştirilmiş edildi. SICER güvenilir düşük hücre sayıları yanı sıra hücrelerin milyonlarca zenginleşme tespit olabilir çağırarak sonraki zirve sırasında. veri setleri analiz edilmiş ve her bir diğeri ile ve geniş Enstitüsü tarafından oluşturulan bir referans veri ile karşılaştırıldı. düşük hücre numuneleri uygun olan ve çok yüksek bir benzerlik mevcuttur. 30 pg örnek yerine ENCODE kriterleri 11 (dk. Doruklarına üst% 40% 80 üst üste gelmelidir). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
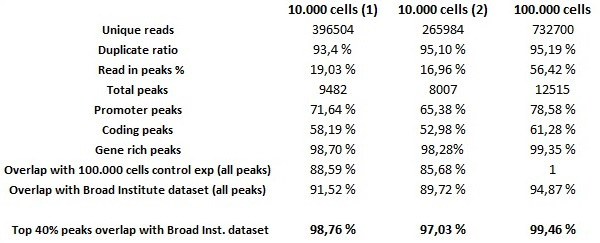
Tablo 1.
Tartışmalar
Dizinlemeyi müteakip, Kromatin immüno-çökeltmesi artık yeni bir standart bir prosedürdür. İşte başlangıç materyali olarak az 10.000 hücreleri ile kromatin epigenetik profillerini oluşturabilir otomatik ChIP-seq protokol sunulmuştur.
ChIP ve kütüphane hazırlık deneyleri otomatikleştirme ChIP optimizasyon prosedürü standartlaştırılması ve deneysel değişkenliği azaltarak sağlar. Burada sunulan sıvı taşıma sistemi, zamanında sadece 30 dakika eller azaltılması ChIP ile ilişkili manuel prosedürlerin çoğu ortadan kaldırır örnek kaybını en aza indirir ve kütüphane giriş sadece birkaç pikogram ile doğru ChIP-seq sağlar. Başarılı otomatik ChIP-seq deneyler gerçekleştirmek için, aynı zamanda her bir deney sistemi yüksek kalitede makaslanmış kromatin hazırlıklarını ve ChIP-seq sınıf antikorları kullanmak önemlidir manyetik boncuk tabanlı teknoloji kullanır ve inkübasyon gibi ana deney parametrelerini değiştirme esnekliği sunar Antikor kat için zamanimmunoprecipitation adımlar ya da ChIP-seq optimizasyonu için gerekli tüm deneyler için araştırmacı izin yıkama koşullarının değiştirilmesi ing ve. Otomatik bir sistem, aynı zamanda, her bir hücre hattı ve antikor için deney koşullarının optimizasyonu için paralel olarak birden fazla maddenin karşılaştırılmasına olanak sağlar ve çeşitli türlerde ve kromatin konsantrasyonlarda, farklı antikorlardan ve manyetik hatta farklı türde doğrudan karşılaştırma sağlayan bir "açık" bir platformdur boncuklar.
Otomatik bir sistem sınırlamaları biri 5 ul 200 ul aralığı hacimlerde tüm protokolleri otomasyonunu ihtiyacıdır. Ancak, bu otomatik platformda deney minyatürleştirilmesi de reaktif maliyetleri tasarruf sağlar.
Bu çalışmada tarif edilen protokollere ek olarak, sistem, uyum sağlayabilir ve aynı zamanda immüno-a gibi diğer manyetik boncuk esaslı çeşitli uygulamalar otomatiknd metilatlı DNA (MeDIP ve MethylCap teknolojileri), hydroxylmethylated DNA (hMEDIP), sıralı kromatin immunoprecipitation (Rechip), RNA immunoprecipitation (RNA-IP), bisülfit dönüşüm immünopresipitasyonu ve DNA saflaştırma deneyleri yakalama.
Açıklamalar
The authors of this article, at the time of its writing, are employed by Diagenode S.A. and Diagenode, Inc., the manufacturer of the automated system described.
Teşekkürler
This work was supported by the BLUERPINT EU grant (BLUEPRINT – A BLUEPRINT of Haematopoietic Epigenomes). We also thank the Walloon Region (DG06) for its financial support.
Malzemeler
| Name | Company | Catalog Number | Comments |
| PBS | Life technologies | 14190-094 | |
| Trypsin-EDTA | Sigma | T3924-100ML | |
| Formaldehyde 37% | Sigma | F8775-25 | |
| 1.25 M Glycine Solution | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL2 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Shearing Buffer iS1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Protease Inhibitors Mix (200x) | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| HBSS (no calcium, no magnesium, no phenol red) | Life technologies | 14175-053 | |
| Lysis Buffer tL1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ChIP Buffer tC1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ideal ChIP-seq kit | Diagneode | C01010051 | |
| ChIP-Buffer H | Diagenode | C01010020 | Component of the Auto Histone ChIP-seq kit |
| Auto Histone ChIP-seq kit | Diagenode | C01010020 | |
| Auto True Micro ChIP kit | Diagenode | C01010130 | |
| H3K79me3 polyclonal antibody-Classic | Diagenode | C15310068 | |
| H3K27me3 polyclonal antibody-Classic | Diagenode | C15410069 | |
| H3K4me3 polyclonal antibody-Classic | Diagenode | C15410030 | |
| H3K4me2 polyclonal antibody-Classic | Diagenode | C15410035 | |
| H3K9ac polyclonal antibody-Premium | Diagenode | C15410004 | |
| H3K9/14ac polyclonal antibody-Premium | Diagenode | C15410200 | |
| H3K36me3 polyclonal antibody-Premium | Diagenode | C15410058 | |
| H3K9me3 polyclonal antibody-Premium | Diagenode | C15410193 | |
| Rabbit IgG | Diagenode | C15410206 | |
| Protein-A coated paramagnetic beads | Diagenode | C01010020 | |
| Auto IPure | Diagenode | C03010010 | |
| MicroChIP DiaPure columns | Diagenode | C03040001 | |
| Universal SyberGreenMaster Mix 1.25 ml | Diagenode | DMMLD2D100 | |
| Quant-IT dsDNA | Invitrogen | Q32854 | |
| Illumina Sample Preparation kit fro Genomic DNA | Illumina | FC-121-3001 | |
| Illumina True-seq kit ChIP library Prep kit | Illumina | IP-202-1012 | |
| MicroPlex Library Preparation Kit | Diagenode | C05010010 | |
| Agencourt AMPure XP beads | Beckman Coulter | A63881 | |
| Illumina Library prep Quantification kit | Kapa Biosystems | KK4844 | |
| IP-Star Compact Automated System | Diagenode | B03000002 | |
| Bioruptor Plus | Diagenode | B01020001 | |
| Bioruptor Pico | Diagenode | B01060001 | |
| Qubit system | Invitrogen | Q32857 | |
| Illumina Hiseq systems | Illumina |
Referanslar
- Dahl, J. A., Collas, P. A rapid micro chromatin immunoprecipitation assay (microChIP). Nature Protocols. 3, 1032-1045 (2008).
- Adli, M., Bernstein, B. E. Whole-genome chromatin profiling from limited numbers of cells using nano-ChIP-seq. Nature Protocols. 6, 1656-1668 (2011).
- Blecher-Gonen, R., et al. High-throughput chromatin immunoprecipitation for genome-wide mapping of in vivo protein-DNA interactions and epigenomic states. Nature Protocols. 8, 539-554 (2013).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biology. 14, 124 (2013).
- Farias-Hesson, E., et al. Semi-automated library preparation for high-throughput DNA sequencing platforms. Journal of Biomedicin., & Biotechnology. 2010, (2010).
- Callejas, S., Alvarez, R., Benguria, A., Dopazo, A. AG-NGS: a powerful and user-friendly computing application for the semi-automated preparation of next-generation sequencing libraries using open liquid handling platforms. BioTechniques. 56, 28-35 (2014).
- Zang, C., et al. A clustering approach for identification of enriched domains from histone modification ChIP-Seq data. Bioinformatics. 25, 1952-1958 (2009).
- Zhang, Y., et al. Model-based analysis of ChIP-Seq (MACS). Genome Biology. 9, 137 (2008).
- Heinz, S., et al. Simple combinations of lineage-determining transcription factors prime cis-regulatory elements required for macrophage and B cell identities. Molecular Cell. 38, 576-589 (2010).
- Quinlan, A. R., Hall, I. M. BEDTools: a flexible suite of utilities for comparing genomic features. Bioinformatics (Oxford, England). 26, 841-842 (2010).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Research. 22, 1813-1831 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır