Method Article
Endotel Hücre yapışma miktarının belirlenmesi
Bu Makalede
Özet
We report an in vitro method that allows the quantitation of the actual number of adhesive cells within an endothelial cell monolayer.
Özet
Inflamasyon ana işlemlerden biri, çevredeki dokuya kan damarı lümeninden bağışıklık hücrelerinin sızıntıdır. Kan damarları kaplayan endotel hücreler, monositler gibi bağışıklık hücreleri, dolaşımdaki yapışkan olduğunda ortaya çıkar. Bu yapışkanlık in vitro ölçülmesi artık yeni bir doğrudan sayısı olarak ya bir endotel katmana yapışık monositler sayısı miktarının yapılır kadar veya yapışık monositler floresan dolaylı ölçümü ile saptanmıştır. Bu ölçümler endotel hücre popülasyonunun ortalama yapışma gösterir ise de, bu tür hücre sayısı gibi faktörler, bir dizi eleştirilmiştir edilir ve aslında yapışkandır endotel hücrelerinin oranını göstermez. Burada tarif ve endotel tek tabaka bir test nüfus içinde yapışkan hücrelerin numaralandırma sağlayan bir yöntem ortaya koymaktadır. Endotel hücreleri cam lamelleri üzerinde yetiştirilen ve istenen aşağıdakitedavisi (yani, floresanla işaretlenmiş olabilir) monositler ile tehdit edilir. Daldırma ve drenaj birden mermi içeren inkübasyon, bir durulama prosedürü, sonra hücreler sabittir. Monositler çevrili Yapıştırıcı endotel hücreleri, kolayca tespit ve yapışkan olan nüfus içindeki endotel hücrelerinin gerçek oranını ortaya bir yapışma indeksi vererek, numaralandırılan.
Giriş
Kan damarlarını kaplayan endotel hücre tabakası boyunca monositler gibi immün hücrelerin infiltrasyonu iltihabı 1 sürecinde önemli bir adımdır. Bu yaralanmanın bir siteye bağışıklık hücreleri (imünositler) homing sağlar. Örneğin, koroner ve karotis arter gibi durumlarda ve yerlerde, endotel tabaka boyunca monosit sızması potansiyel istilanın 2 oluşumuna yol, arter çeperinde bu hücrelerin istenmeyen uzun süreli ikamet yol açabilir. Immünosit infiltrasyonu Her durumda, ilk adım, kan damarının lokal bir bölgedeki endotel hücrelerinin aktivasyonunu içermektedir. Endotel hücreleri, endotel hücre yüzeyi 3- üzerine immünositlerin görevlendirilmesini ve bağlanmasını kolaylaştırmak örneğin, VCAM, ICAM ve E-selektin gibi hücre yüzeyi proteinlerinin ifadesini geliştirmek için, TNF-α ve IL-6 pro-enflamatuvar sitokinler tarafından aktive edilir 6.
Başlangıçta, endotelyal hücre yapışma ölçümü tek tabaka 7 endotel yapışık monositler sayımı sureti ile ifa edilmiştir. hassasiyet açısından bu yönteminin sınırlamaları lenfositler ve monositler yapışma 4 karşılık gelen radyoaktif madde miktarının, ardından radyo işaretli lenfosit veya monosit kullanımına yol açmıştır. Bu yöntem, sonuçta 8 ölçülür ilgi imünositler farkı yerine radyoaktivite bu floresans olduğu yukarıdaki ile aynı prosedüre floresans boya ile etiketlenir ve tabi tutuldu ve böylece bir floresans bazlı yöntem, değiştirildi. Halen bu yöntem en uygun olarak ortaya çıkmıştır ve çok sayıda ticari tedarikçiler tarafından kit halinde satılmaktadır. Bu deney, kontrol ve deney numuneleri arasındaki yapışkanlık göreli düzeylerini ölçmek mümkün olmakla birlikte, floresan bir değişiklik bütün e boyunca yapışkanlık üniform bir değişikliğe bağlı olup olmadığı ortaya koymamaktadırndothelial hücre topluluğu veya değişiklik, hücre alt-popülasyonu içinde yapışkanlık bir farka ise. Bu yıkama darlığı sonucu üzerinde derin etki gösterir ve daha da önemlisi, farklı endotel hücre mono tabakaları arasındaki ilişkisiz monositler kapalı durulama tekdüzelik numuneler arasında sonuçların çoğaltır sonuçlarının yakınlık ve tekrarlanabilirlik büyük ölçüde etkileyeceğini de açıktır . Daha yakın zamanda, bir endotelyal hücre tek tabaka boyunca ortam içinde monositleri pompa çeşitli sistemler, bu sorunu çözmek 9 için kullanılmıştır. Buna ek olarak, bu akış sistemleri de endotelyal hücreler üzerinde kesme kuvvetinin etkisi özetlemek. Bu sistemlerin avantajı net ve çok cazip olmakla birlikte, akut iltihap durumunda olduğu gibi, bu örneğin iyonize edici radyasyon gibi TNFa, başka bir aktivatörleri, gibi faktörler ile, endotelial hücre yapışkanlığı önemli ölçüde artar edilebilir ise gerçekleştirmek için de önemlidir 10 meydana çıkarmak t değiştirirşapka kolaylıkla bunlar çok sıkı sistemlerinin in vitro deneysel süreler dahilinde tespit edilmez. Endotel hücre yapışma gibi dakika değişiklikleri kolayca cevapsız veya in vitro ilişiği kesilen iken, kronik inflamasyon özelliği olan bir yaşam süresi içinde böyle küçük değişiklikler, çok önemli sonuçlar uygulamayın in vivo, mutlaka iyi huylu değildir. Dolayısıyla sağlam, ancak duyarlı ve spesifik bir yöntem tespit ve endotel hücre yapışkanlık gereklidir ölçmek için.
Burada, doğrudan endotel hücrelerinin yapışkanlığını ölçmek için bir yöntem sunulmaktadır. Bu yöntem, endotelyal hücre yapışma dolaylı taşıyıcı göstergesi olarak floresans ölçümleri dayanmaz. Bu yapışkanlık değişiklikler tüm hücrelerin tektip değişiklik nedeniyle ya da bir alt nüfusa sınırlı olup olmadığını ortaya koymaktadır. Bundan başka, bu örneğin yaşlanmayla ilişkili beta-galaktosidaz, hücre canlılığı, mar olarak işaretleri ile endotel hücrelerinin ko-lekeleme sağlarker, Calcien AM ve bazı hücre durumlar veya spesifik protein ekspresyonuna bireysel yapışkan endotel hücrelerinin ilişki sağlayan hücre yüzeyi ve hücre içi proteinlere karşı antikorlar.
Protokol
Cam lameller hazırlanması 1.
- Etanol tüm lamelleri toplam pozlama sağlamak için zaman zaman ajitasyon ile en az 10 dakika süreyle% 70 etanol onları iliklerine cam lamelleri yuvarlak 12 mm çapında sterilize edin. Steril hücre kültürü kabı içine cam lamelleri ve etanol dökün (ya da 6 cm ya da 10 cm çapında).
- Steril ince 5B forseps bir çift ile, pick up ve 24 de küme plaka bir kuyuya her cam lamel yerleştirin. Lamelleri Kuyunun taraflarına dokunarak ve kuyunun ortasında yaklaşık olarak emin olmak için özen gösterin.
- Akış kabinede kurumaya cam lamelleri ile un kaplı 24 kuyu küme plaka bırakın. Bu yaklaşık 10 dakika sürer
- Bu süre içinde, 0.1 mg / ml Hank'in dengeli tuz çözeltisi (HBSS) içinde 10 mg / ml insan fibronektin seyreltilmesi ile kaplama karışımı hazırlayın.
- Lamelleri kuruduğunda, her bir cam co üstüne kaplama çözeltisi pipetle 100 ulböylece verslip çözüm de dış çevresindeki havuzu olmayan tek cam kaplar. En azından bir saat için bir hücre kültürü inkübatöründe kaplı 24 çukurlu toplu plaka koyun.
- Sadece Kullanmadan önce, kaplama çözümü çıkarın. aynı kaplama çözeltisi steril bir tüpe transfer edilmiş ve etkinlik görünür bir kayıp ile üç kez kullanılabilir.
Endotel Hücre Monolayer 2. Hazırlık
- 37 ° C 'de orta ve% 5 karbon dioksit Kültür insan koroner arter endotel hücreleri (EC).
- Kültür ortamı aspire ve 10 ml HBSS ile AK tek tabaka durulayın
- HBSS kapalı aspire ve 2 ml% 0.5 tripsin,% 0.2 EDTA çözeltisi. Yaklaşık olarak 5 dakika boyunca oda sıcaklığında inkübe edin.
- AT şişeye tarafına bir musluk tarafından yerinden edilebilir olduğunda, soya fasulyesi tripsin inhibitörü 5 ml ilave edilir ve pipet ile daha da hücreleri çıkarmak için şişenin yüzeyi fışkırtma.
- 15 ml'lik bir tüp ve santrifüj tüpü içine aktarın hücreleri5 dakika boyunca 200 x g'de.
- Süpernatant kapalı aspire ve medya 5 ml AK pelletini. Bir haemocytometer ile hücre sayımı ve AT medya ml başına 50.000 EC hücre konsantrasyonunu ayarlamak.
- Kaplanmış cam lamelleri içeren 24 çukurlu bir levhanın her bir çukuruna hücre süspansiyonu 1 ml koyun. 37 ° C artı% 5 karbon dioksit, hücre kültürü inkübatöründe hücreleri O / N inkübe edin.
- konfluent tek tabaka 3 gün içinde, meydana getirildiği zaman hücreler, deneylerde kullanılmak üzere hazırdır.
Monositler 3. hazırlanması
- RPMI içinde kültürlenir transfer HL-60 hücreleri bir 15 ml tüp içine, süspansiyon kültürü olarak% 10 fetal dana serumu ile takviye edilmiştir. 5 dakika boyunca 200 x g'de santrifüjleyin hücreleri.
- 5 mi ortam içinde yüzer ve tekrar süspansiyon hücreleri çıkarın ve 2.000.000 hücre / ml ortam hücre konsantrasyonunu ayarlamak. HL-60 floresan etiketleme isteniyorsa, serum ve PR olmadan RPMI hücreleri tekrar süspansiyonbölüm 4'te tarif edildiği gibi oceed.
- 1 ile 3 arasında bir zaman seçilen sabit bir süre için AT tek tabaka ihtiva eden 24 çukurlu toplu plakanın her oyuğuna HL-60 hücre süspansiyonu, 0.5 ml ilave edilir ve 37 ° C'de ve% 5 karbon dioksit, bir hücre kültürü inkübatöründe inkübe plaka hr. Küçük bir fark bağlama doygunluk elde edilir, 1 saat, 3 saat zaman noktası arasında görülmektedir.
- Hücre Yıkama / toplama için hazırlayın: HBSS, 100 ml ile 120 ml tüp doldurun. Taze 24 yuvalı plakanın her oyuğuna formalin 1 ml koyun.
- Dokunmamaya özen kuluçka döneminden sonra, keskin forseps bir çift kullanın ve kuyudan cam lamel pick up ve dikey lamel tutun ve 3 sn bankta doku parçasının üzerine lamel kenarına dab doku ile lamel hücre kaplı yüzeyi.
- Forseps bir çift ile sıkıca lamel tutarak, ve HBSS beş kez dışarı lamel dunk.
- Beşinci dunk sonraHBSS, 3 saniye boyunca doku üzerinde lamel kenarına hafifçe sürün.
- Bir dab izledi 5 dunks üç set toplam yapım, 3.6 ve 3.7 'de açıklandığı smaç vurma ve prosedürleri tekrarlayın.
- RT'de hücreleri gidermek için iyi içeren% 10 formalin içine lamel aktarın. Lamel, numaralandırma hazır uzun süreli depolama için ya da aşağıda tarif edilen diğer prosedürler tabi etmektir.
Hücre Tracker ile HL-60 hücrelerinin 4. Etiketleme (isteğe bağlı)
- Sayım bir 15 ml santrifüj tüpüne HL-60 hücreleri (örneğin, 10000000) uygun miktarda aktarın. Santrifüj HL-60, 5 dakika boyunca 200 x g'de hücreleri. Süpernatantı.
- 1.000.000 hücre / ml'lik bir konsantrasyonda serumsuz RPMI ortamı içinde hücre Tracker tekrar süspansiyon hücre peleti. 1 saat süre ile hücre kültürü inkübatöründe inkübe hücreleri.
- 200 x g'de santrifüjleyin hücreler, 5 dakika süreyle tavlandı ve süpernatant atılır. 2.000.000 C'lik bir konsantrasyona kadar ortam içinde tekrar süspansiyon hücre peletiarşın / ml olmuştur.
- Cam lamel üzerinde büyümüş içeren her endotel hücrelerine hücre Takibi etiketli HL-60, 0.5 ml ilave edilir. 3.3 devam edin.
Yapıştırıcı endotel hücrelerinin 5. numaralandırma
- Mikroskop bireysel hücreleri belirlemek için DAPI karşı boyası ile slaytlar Mount lamelleri.
- Bir 4X veya 10X amacı ile ters bir mikroskop kullanılarak, çeşitli alanlarda (örneğin, 5 alanlar) görüntülerini almak ve un-ışınlanmış endotel hücreleri üzerinde agrega monositlerin en çok (Bu genellikle 3-5 olmalıdır) saymak.
- Endotel hücre monositlerin eşik olarak iki kez bu sayısını ayarlayın bir küme olarak tanımlanabilir için. Eğer gerekirse, farklı bir kriter, deney doğasına bağlı olarak bir küme tanımlamak için kullanılabilir.
- Kümelerinin sayısını ve alan endotel hücre sayısı. Yapışkan endotel hücrelerinin yüzdesini elde etmek rezistans tarafından önceki bölün. GolÇok sayıda alanları sayısı arasında bir ortalama ve standart sapma elde edilmiştir.
Antikorlar 6. counterstaining
- Lamel yapışma deneyi ve hücreler oda sıcaklığında 15 dakika için% 10 formalin içinde sabitlenir sonra, standart bir prosedür 10 ve seçim antikorlar kullanılarak immünofloresans lamelleri maruz.
- Ekle ve endotel hücrelerine bağlı monositler yerinden oynatmamaya önlemek için çok çeşitli çözümler yavaşça çıkarın.
Yaşlanmayla bağlantılı beta-galaktosidaz aktivitesi bakımından 7. counterstaining
- Lamel yapışma deneyi ve hücreler yaşlanmayla ilişkili beta-galaktosidaz faaliyeti için 15 dakika, leke için formalin sabit edildikten sonra boyama seti eşlik kılavuzunda açıklandığı gibi. Ekle ve endotel hücrelerine bağlı monositler yerinden oynatmamaya önlemek için çok çeşitli çözümler yavaşça çıkarın.
Sonuçlar
Bu yöntem, bir popülasyon içindeki bireysel yapışkan endotelyal hücrelerin saptanmasını sağlar. Örneğin, un ışınlanmış endotelyal hücre tek-tabakalı (önceki bağımsız endotel hücreleri çevresinde en kümelerdeki monositler bağlı edildi monositler ile kuluçkalamadan 7 gün sonrası 10Gy ışınlama ile inkübasyon ve yıkama, endotel tek tabakalı sonra birkaç sporadik HL-60 monositler muhafaza ederken Şekil 1). Bu fenomen faz kontrast mikroskobu altında kolaylıkla gözlemlenebilir olmasına rağmen, floresan mikroskopi monosit kümeleri daha da net bir görüntü ortaya koyuyor.
Tarif edilen yapışma tahlili gerçekleştirdikten sonra, standart yöntemler ile immünofloresan uygun antikorlar kullanılarak membran, sitoplazmik ya da nükleer (Şekil 2) proteinlerin hücrelerin boyanması devam etmek mümkündür. Bundan başka, örneğin yaşlanmayla ilişkili beta-galaktosidaz (Şekil 3) gibi enzim-bazlı analiz aynı zamanda PE olabilirrformed.
Her bir monosit, küme bağımsız bir endotelyal hücreye karşılık geldiğinden, kümelerin numaralandırma tek tabaka içinde yapışkan endotelyal hücrelerin sayısı ortaya çıkaracaktır (Şekil 4) ve popülasyon içindeki yapışkan endotel hücreleri bu nedenle oranı (Tablo 1, Şekil 6) . Bu endotel hücre yapışma gibi ölçümü sağlar bugüne kadar tek yöntemdir. Burada yapılan deneylerde kullanılan endotel hücreleri temas inhibe ve kaplayana kadar sayısındaki artış yoktur dikkat çekicidir. Bu daha sonraki zaman noktalarında artmış endotel hücre sayısına göre yarattığı potansiyel karmaşıklığı ortadan kaldırır. Eğer arzu edilirse, endotelyal monokatmanlarına bağlanmış monositler (3.9 yerine tespiti)% 0.5 tripsin% 0.2 EDTA çözeltisi ile yerinden alınabilir ve modern yöntemler durumda (Şekil 5) olduğu gibi floresans bir plaka okuyucusu kullanılarak ölçüldü.
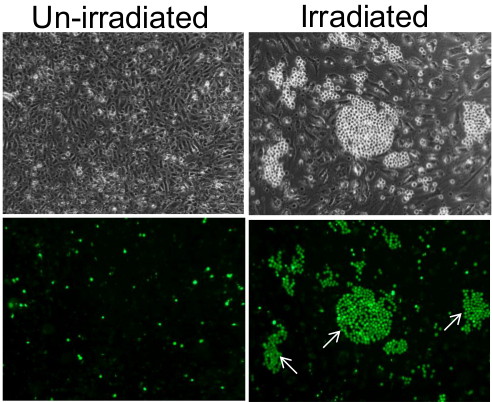
Endotel hücrelerinin tek tabaka üzerinde monositlerin Şekil 1. yapışması. Un-ışınlanmış endotel hücreleri üzerinde, monositler sporadik ve rastgele bir şekilde tek tek hücrelerin (paneller sol) olarak ve post-10 Gy ışınlanmış 7 gün bireysel endotel hücreleri üzerinde kümeler halinde yapıştırılır tek tabaka (sağ paneller). Alt paneller faz kontrast altında görülebilen, küçük ve parlak bir küresel hücrelerin gerçekten de hücre-Tracker Green ile ön-etiketli monositler olduğunu teyit üst panellerin floresans görüntüleri bulunmaktadır. Monosit kümeleri Bazı beyaz oklarla gösterilir. Görüntüler 10X objektif kullanılarak alınmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
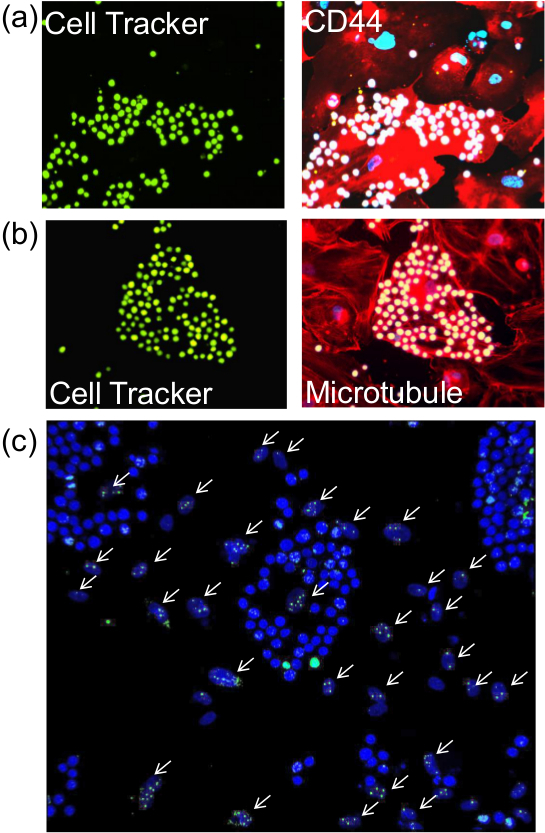
Proteinler sonrası yapışma deneyi için, endotel hücrelerinin Şekil 2. boyanması. Anlatılan yapışma deneyi gerçekleştirmek sonra, cam lameller üzerine hücreler (A), membran proteinin (CD44) için immünofloresan tabi tutuldu, b) Sitoplazmik protein (tubulin) veya c) nükleer protein (γ-H2AX). (A) ve gösteri monositler Hücre Tracker Green ve sağ panellerde benzer bir görüntü ile önceden etiketlenmiş (20X amacı ile görülen) (B) Sol panel CD44 ve mikrotübüller (kırmızı) ve DAPI lekeli çekirdekleri (mavi) ortaya koymaktadır. Γ-H2AX karşı antikorlar ile boyandı ışınlanmış endotel hücre çekirdekleri için (C) noktasında beyaz oklar. DAPI tarafından parlak bir mavi lekeli Monosit çekirdekleri kolayca endotel hücrelerinin oval biçimli çekirdekleri ayırt edilir. Görüntüler 20X amacı ile alınmıştır. jove.com/files/ftp_upload/52924/52924fig2large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
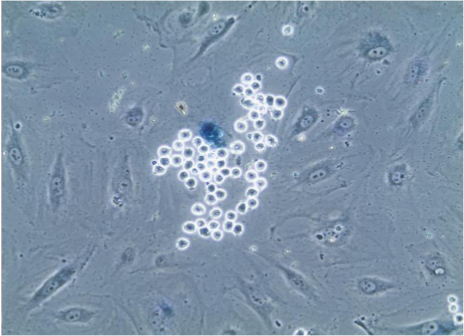
Endotel hücresindeki açıkça görüldüğü gibi endotel hücrelerinin Şekil 3. yaşlanmayla bağlantılı beta-galaktosidaz boyama. Adezyon deneyinde sonra lamelleri hücreler, yaşlanmış hücrelerin lizozom mavi dönmesine neden olur yaşlanmayla bağlantılı beta-galaktosidaz için boyama maruz kaldığı seçici nedeniyle küçük boyutu ve küresel şekle kolayca tespit sayısız monositler, ile bağlıdır. 20X objektif görünen görüntü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2924 / 52924fig4.jpg "/>
Bireysel endotelyal hücreler üzerinde monosit kümelerinin Şekil 4. numaralandırma. Adezyon deneyinde sonra hücrelerin görüntüleri alan birçok farklı pozisyonlarda ve monosit kümelerden alındı ve (yeşil) çember. Bir küme, bir endotelyal hücre 10 veya daha fazla veya monositlerin bir aglomerasyon olarak tanımlandı. Görüntüdeki Monosit kümeleri ve 12 gün sonrası ışınlanmış endotel hücreleri sayısı sayısı (kırmızı noktalı) sayıldı ve hesaplanan yapışık endotel hücrelerin yüzdesi 10X objektif ile çekilen Tablo 1. Görüntü gösterildiği gibi. bir görmek için buraya tıklayınız Bu rakamın büyük bir sürümü.
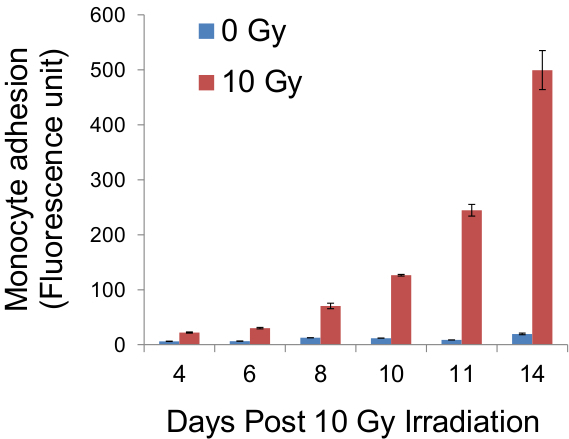
Şekil yapışık monositler floresansının 5. miktarının belirlenmesi. Aşağıdaki Adhe sion deneyi, cam lameller üzerine hücreler tripsinize edildi ve monositlerin endotelyal floresan tek tabaka yapışkanlık dolaylı bir göstergesi olarak, bir floresan plaka okuyucu kullanılarak ölçülmüştür CellTracker Green ile önceden etiketlenir. Belirtilen gün sonrası ışınlama tür ölçümlerden elde edilen sonuçlar ve yukarıdaki grafikte platted bulundu.
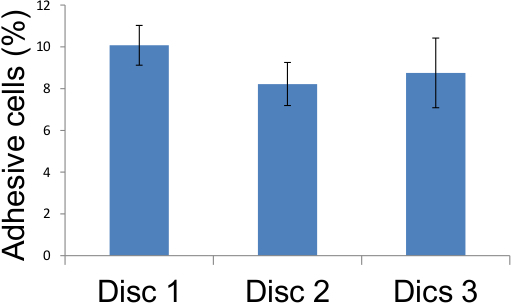
Şekil 4'te tarif edilen sonuçlar, ışınlanmış de 12 gün sonra 10 Gy ışınlama, 8-10 oranında gösteren yukarıdaki tabloda verilen üç cam lameller üzerine beş farklı konumlarda 1. Yapışkan endotel hücreleri skorlandı Tablosundan yapışma deneyi skoru Şekil 6. Temsil Endotel hücreler, Yapışkan olmuştur.
endotel hücreleri
| Disc 1 | Disc 2 | Disk 3 | |
| Tarla 1 | 8.65 | 8.29 | 8.21 |
| Alan 2 | 10.44 | 7.27 | 7.21 |
| Alan 3 | 9.63 | 9.05 | 8.33 |
| Alan 4 | 11.11 | 7.09 | 8.41 |
| Alan 5 | 10.55 | 9.4 | 11.61 |
| Ortalama | 10.07 | 8.22 | 8.75 |
Tablo 1. Yapışma deneyi puanları. F de tarif edildiği gibi, üç cam lameller üzerine beş farklı konumlarda Yapışkan endoteliyal hücreler skorlandıŞEKIL 4 ve sonuçlar, 12 gün, 10 Gy ışımadan sonra, ışınlanmış endotel hücrelerinin 8-10 oranında yapıştırıcı haline geldiğini gösteren yukarıdaki tablo.
Tartışmalar
Yukarıda tarif edilen monosit yapışma deneyi endotel mono tabakaları 10 iyonizan radyasyon biyolojik etkilerini incelemek amacıyla tasarlanan deneylerde başarılı bir şekilde kullanılmıştır. Bu endotel tek tabaka yapışkanlığını değerlendirmek için tek yöntem değildir, ancak, bu yapıştırıcı, bir tek tabaka içindeki oranı veya endotelyal hücrelerin yüzdesi ölçümü sağlayan tek bir yöntemdir. Bu monositler yapışmasının küresel bir niceliksel değişiklik olarak önemli bir fark, diğer yöntemlerle ölçülen endotel tek tabaka ya da endotel hücrelerinin bir alt-nüfusa artışı yapışkanlık tüm hücre yapışma genel bir artışa ya da atfedilebilir tek tabaka içinde yukarıdaki örnekte gösterilmiştir. Bu bilgiye sahip değer ışınlama ines neden sonra yeteneği gelişmiş yapışkanlığı sergiledi endotel hücrelerinin yüzdesini ölçmek için gerçeği ile örneklenmiştirBu etki, yapışkan olan hücrelerin yüzdesi olarak belirli bir genin, genetik mutasyona bağlı değildir sahip sonuç, bu dozda X-radyasyon ile bir genin rastgele mutasyon beklenebilecek olanı (1000 kat daha fazla) büyük ölçüde yukarıda edildi .
Sonuçların iyi tekrarlanabilirlik sağlayan faktörü yıkama rejimidir. Yıkama işlemi, bir doku üzerinde dabbing ardından yıkama tamponu içine cam lamel daldırma içerdiğinden, kaçınılmaz olarak kuyuya yıkama tamponu pipetleme gelen eski yöntem ortaya tamponu türbülansa değişkenliği önlenir. Aslında yıkama adımından değişkenlik elemanı kaldırılmış bir yıkama işlemi hazırlamak için bize mecbur pipet yöntemi kullanılarak elde edilen çoğaltır arasındaki aşırı değişkenlik gözlem oldu.
Kuşkusuz, muhtaç bu testte yalan sınırlamalar n do monosit kümeleri manuel sayısı, yürütmek içinOT yüksek verimlilik analizleri için adapte edilmesini sağlar. İkincisi, birçok monositler bir küme oluşturan nasıl karar yarı keyfi belirlenmelidir ve düzeyi çok yüksek ayarlanmış ve bazı orijinal kümeler dışlanmasına neden olabilir. bu yöntemde, kesme kuvveti eksikliği, aynı zamanda, endotelyal hücrelerin ağır gelişmiş yapışkanlık neden olduğu deneylerde (örneğin, + TNFa) bir sınırlama olarak görülebilir. Bu yapışkanlık az abartılmış büyütme algılanmasını sağlar diğer durumlarda ancak, kesme kuvveti eksikliği bir avantajdır. Monosit yapışkanlık mütevazı bir artış özellikle önemlidir ve ilgili olabilir. İn vivo koşullarında, monositler (tipik bir deney zamanında) kırma gücüne karşı büyük ölçüde yapışkanlık mütevazı bir artış ile endotelial hücrelere büyük sayılarda takmak için beklenmez. Zaman içinde, ancak bazı monositler olasılıkla olur ve bu kronik iltihaplanma ortamı temsil etmek için daha olasıdır. Gibi,o yapışkanlık artışının makaslama stres altında uyulması gereken izin tipik olarak kısa ve muhtemelen çok kısacık deneysel zaman dilimlerinde ortaya endotel hücre yapışkanlık küçük artışlar için fırsat sağlar olarak kesme kuvveti bulunmaması bir avantaj olabilir.
Yukarıda gösterildiği gibi, belirli hücresel proteinlerin ya da hücresel devletlere özgü endotel hücrelerinin yapışkanlık ilişkisini veriyor gibi yaşlanma tahlil ve immünofloresan boyama gibi diğer analizlere bu tahlilde sonra hücrelerin maruz yeteneği, bir özellik bu yöntemin yararını artırır Eski yapışma deneyleri ile mevcut değildir.
Bu yöntem, EST2-ölümsüzleştirilmiş insan koroner endotel hücreleri ve benzer sonuçlar ile kullanılmıştır da sadece özel bir hücre hattına özgü olmadığını gösteren, primer insan koroner endotel hücreleri 10 ile elde edilmiştir. Ayrıca, adoendotel hücrelerinin yapışkanlığı tahlil bu yöntemin ption etiketli immünositlerin floresan ölçer standart yapışma deneyi aynı hücrelerin maruz engel değildir. Birlikte, bu rapor, bu yöntem, kapsayıcı, çok yönlü ve standart yapışma deneyinde çok daha fazla bilgi sağladığını göstermektedir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
We are very grateful to Simon Bouffler for his full support and to Public Health England for infrastructure support. This work was supported by Public Health England throughthe National Institute for Health Research (NIHR) grant. This report is work commissioned by the NIHR. The views expressed in this publication are those of the authors and not necessarily those of the NHS, NIHR or the Department of Health. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hepes Buffered Saline Solution (HBSS) | Sigma | H6648 | |
| Glass coverslips Round 12 mm Diameter | Menzel-Glaser | CB00120RA1 | |
| 24-well cluster plate | Costar | 3526 | |
| Meso-Endo Cell media | Cell Applications | 212-500 | |
| Trypsin-EDTA | Sigma | T4174 | |
| Soybean trypsin inhibitor | Life Technologies | 17075-029 | |
| Cell Tracker Green | Life Technologies | C7025 | |
| RPMI | Sigma | R8758 | |
| Foetal Calf Serum | Life Technologies | 10500064 | |
| Beta glasctosidase Assay kit | CellSignaling | 9860 | |
| Fibronectin | Sigma | F0895 |
Referanslar
- Ortega-Gomez, A., Perretti, M., Soehnlein, O. Resolution of inflammation: an integrated view. EMBO Mol Med. 5 (5), 661-674 (2013).
- Libby, P. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr. 83 (2), 456S-460S (2006).
- Ikuta, S., Kirby, J. A., Shenton, B. K., Givan, A. L., Lennard, T. W. Human endothelial cells: effect of TNF-alpha on peripheral blood mononuclear cell adhesion. Immunology. 73 (1), 71-76 (1991).
- Watson, C., et al. IL-6 acts on endothelial cells to preferentially increase their adherence for lymphocytes. Clin Exp Immunol. 105 (1), 112-119 (1996).
- Sans, M., et al. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 116 (4), 874-883 (1999).
- Su, Y., Lei, X., Wu, L., Liu, L. The role of endothelial cell adhesion molecules P-selectin, E-selectin and intercellular adhesion molecule-1 in leucocyte recruitment induced by exogenous methylglyoxal. Immunology. 137 (1), 65-79 (2012).
- Hallahan, D., Kuchibhotla, J., Wyble, C. Cell adhesion molecules mediate radiation-induced leukocyte adhesion to the vascular endothelium. Cancer Res. 56 (22), 5150-5155 (1996).
- Vaporciyan, A. A., Jones, M. L., Ward, P. A. Rapid analysis of leukocyte-endothelial adhesion. J Immunol Methods. 159 (1-2), 93-100 (1993).
- Prabhakarpandian, B., Shen, M. C., Pant, K., Kiani, M. F. Microfluidic devices for modeling cell-cell and particle-cell interactions in the microvasculature. Microvasc Res. 82, 210-220 (2011).
- Lowe, D., Raj, K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression. Aging Cell. 13 (5), 900-910 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır