Method Article
La quantificazione di adesività delle cellule endoteliali
In questo articolo
Riepilogo
We report an in vitro method that allows the quantitation of the actual number of adhesive cells within an endothelial cell monolayer.
Abstract
Uno dei processi cardinali di infiammazione è l'infiltrazione di cellule immunitarie dal lume del vaso sanguigno al tessuto circostante. Questo si verifica quando le cellule endoteliali, che rivestono i vasi sanguigni, diventano adesivo circolanti cellule immunitarie come monociti. In vitro degli questo adesività è finora fatto quantificando il numero totale di monociti che aderiscono ad uno strato endoteliale sia come conteggio diretto o attraverso la misura indiretta della fluorescenza di monociti aderenti. Mentre tali misurazioni indicano l'adesività media della popolazione di cellule endoteliali, sono confusi da una serie di fattori, come il numero di cellule, e non rivelano la proporzione di cellule endoteliali che sono effettivamente adesivo. Qui si descrive e dimostrare un metodo che consente l'enumerazione delle cellule adesive all'interno di una popolazione testata di monostrato endoteliale. Le cellule endoteliali sono coltivate su vetrini e seguendo desideratotrattamento sono sfidati con monociti (che può essere fluorescente). Dopo l'incubazione, una procedura di risciacquo, che coinvolge vari cicli di immersione e scarico, le cellule vengono fissate. Cellule endoteliali adesivi, che sono circondate da monociti sono facilmente identificabili e enumerati, dando un indice di adesione che rivela la percentuale effettiva di cellule endoteliali all'interno della popolazione che sono adesivi.
Introduzione
Infiltrazione di cellule immunitarie quali monociti attraverso lo strato di cellule endoteliali che rivestono i vasi sanguigni è un passo importante nel processo di infiammazione 1. In questo modo il homing delle cellule immunitarie (immunociti) a un sito di lesione. In altri casi e luoghi come l'arteria coronarica e carotidea, infiltrazione di monociti attraverso lo strato endoteliale può portare alla residenza indesiderabile lungo termine di queste cellule nella parete dell'arteria, potrebbe condurre alla formazione di placche 2. In tutti i casi di immunocyte infiltrazione, la prima fase prevede l'attivazione delle cellule endoteliali in una regione localizzata del vaso sanguigno. Le cellule endoteliali sono attivati da citochine pro-infiammatorie come TNF-α e IL-6 per aumentare l'espressione di proteine di superficie cellulare come VCAM, ICAM ed E-selectina che facilitano il reclutamento e il fissaggio dei immunociti sulla superficie delle cellule endoteliali 3- 6.
Inizialmente, la misura di adesione delle cellule endoteliali è stata effettuata contando monociti che hanno aderito al endoteliale monostrato 7. Le limitazioni di questo metodo in termini di precisione condotto all'uso di linfociti radio-marcato o monociti, seguita dalla quantificazione del materiale radioattivo corrispondente al linfociti o monociti adesione 4. Questo metodo è stato poi sostituito con un metodo basato sulla fluorescenza, per cui immunociti di interesse sono state marcate con fluorescenza colorante e sottoposti alla stessa procedura come sopra, con la differenza che invece di fluorescenza della radioattività viene misurata 8. Attualmente questo metodo è emerso come il più conveniente ed è venduta in kit da diversi fornitori commerciali. Mentre questo test può misurare i livelli relativi di adesività tra controlli e campioni sperimentali, non rivela se un cambiamento della fluorescenza è causa di un cambiamento uniforme adesività sull'intera epopolazione cellulare ndothelial o se la modifica è dovuta a una differenza di adesività di un sub-popolazione di cellule. E 'evidente, inoltre, che il rigore di lavaggio esercita un profondo effetto sul risultato, e, soprattutto, l'uniformità di risciacquo monociti non legate tra diverse monostrati di cellule endoteliali inciderà notevolmente sulla vicinanza dei risultati di repliche e la riproducibilità dei risultati tra i campioni . Più di recente, diversi sistemi che pompano monociti in media attraverso un monostrato di cellule endoteliali sono stati usati per affrontare questo problema 9. Inoltre, questi sistemi di flusso anche ricapitolano l'effetto della forza di taglio sulle cellule endoteliali. Mentre i vantaggi di tali sistemi sono chiare e molto attraente, è anche importante rendersi conto che mentre adesività cellule endoteliali può essere notevolmente aumentata, come nel caso in infiammazione acuta, da fattori come TNFa, alcuni altri attivatori, come le radiazioni ionizzanti 10 suscitare cambia tcappello non sono prontamente rilevate in tempi sperimentali in vitro da questi sistemi molto rigorosi. Mentre tali modifiche minime di adesività delle cellule endoteliali sono facilmente perso o revocati in vitro, non è necessariamente benigna in vivo, in cui tali piccoli cambiamenti in un tempo di vita, che è caratteristico di infiammazione cronica, possono esercitare risultati molto significativi. Quindi un metodo robusto, ma sensibile e specifico per rilevare e misurare è necessaria l'adesività delle cellule endoteliali.
Qui riportiamo un metodo per misurare l'adesività delle cellule endoteliali direttamente. Questo metodo non si basa sulla misura della fluorescenza come indicatore indiretto di surrogata adesività cellule endoteliali. Esso rivela se i cambiamenti in adesività sono dovuti al cambiamento uniforme in tutte le cellule o confinato in una sotto-popolazione. Inoltre, esso permette co-colorazione di cellule endoteliali con marcatori come senescenza associata beta-galattosidasi, vitalità cellulare marker, Calcien AM e anticorpi contro superficie delle cellule e proteine intracellulari, permettendo l'associazione di singole cellule endoteliali adesivi per certi stati cellulari o espressione di proteine specifiche.
Protocollo
1. Preparazione di vetrini di vetro
- Sterilizzare 12 millimetri di diametro tondo vetrini, mettetelo a bagno in etanolo al 70% per almeno 10 minuti con agitazione occasionale per garantire l'esposizione totale di tutti i vetrini per l'etanolo. Versare coprioggetto di vetro e l'etanolo in un piatto di coltura cellulare sterile (o sei centimetri o 10 cm di diametro).
- Con un paio di sterili fini 5B pinze, prendere e posizionare ogni singolo vetrino di vetro in un pozzo di una piastra ben cluster di 24. Fate attenzione che i coprioggetti non tocchino le pareti del pozzo e sono circa a metà del pozzo.
- Lasciare la piastra ben grappolo non-coperto 24 con vetrini ad asciugare al gabinetto di flusso. Questo richiede circa 10 min
- Durante questo periodo, preparare la miscela di rivestimento diluendo 10 mg / ml di fibronectina umana in soluzione salina bilanciata di Hank (HBSS) a 0,1 mg / ml.
- Quando i coprioggetti sono asciutti, pipettare 100 ml di soluzione di rivestimento su ciascun co vetroverslip così la soluzione copre solo il vetro senza riunendo intorno alla parte esterna del pozzo. Posizionare la piastra a 24 pozzetti di cluster coperto in un incubatore di coltura cellulare per almeno un'ora.
- Appena prima dell'uso, rimuovere la soluzione di rivestimento. La stessa soluzione di rivestimento può essere trasferito in una provetta sterile e utilizzato fino a tre volte senza perdita visibile di efficacia.
2. Preparazione di endoteliali monostrato cellulare
- Cellule di coltura umane coronarico endoteliali (EC) in mezzo a 37 ° C e 5% di anidride carbonica.
- Aspirare off terreni di coltura e risciacquare monostrato CE con 10 ml di HBSS
- Aspirare off HBSS e aggiungere 2 ml di 0,5% tripsina, soluzione di EDTA 0,2%. Incubare a temperatura ambiente per circa 5 minuti.
- Quando CE da poter essere rimosse da un rubinetto per il lato del pallone, aggiungere 5 ml di inibitore della tripsina di soia e con pipetta spruzzare la superficie del pallone per rimuovere ulteriormente le cellule.
- Trasferire le cellule in una provetta da 15 ml e centrifugare la provettaa 200 xg per 5 min.
- Aspirare il surnatante e risospendere il pellet CE in 5 ml di media. Contare le cellule con un emocitometro e regolare la concentrazione cellulare a 50.000 CE per ml di supporti CE.
- Dispensare 1 ml di sospensione cellulare in ciascun pozzetto della piastra ben 24 contenente vetrini rivestiti. Incubare le cellule O / N in colture cellulari incubatore a 37 ° C più il 5% di anidride carbonica.
- Le cellule sono pronte per l'uso negli esperimenti quando un monostrato confluente si forma, entro 3 giorni.
3. Preparazione dei monociti
- Trasferire cellule HL-60 che sono coltivate in RPMI integrato con siero di vitello fetale al 10%, come coltura in sospensione, in un tubo 15 ml. Centrifugare le cellule a 200 xg per 5 min.
- Rimuovere le cellule surnatante e risospendere in 5 ml media e regolare la concentrazione cellulare con supporti a 2 milioni di cellule / ml. Se si desidera etichettatura fluorescenza del HL-60, risospendere le cellule in RPMI senza siero e proceed come descritto nella sezione 4.
- Aggiungere 0,5 ml di HL-60 sospensione cellulare in ciascun pozzetto della piastra a 24 pozzetti cluster contenente monostrato CE ed incubare la piastra in un incubatore di coltura cellulare a 37 ° C e 5% di biossido di carbonio per un periodo fisso di tempo scelto tra 1 e 3 h. Poca differenza è osservata tra 1 ora e 3 ore time-point, in cui la saturazione di legame è raggiunto.
- Preparati per cella lavaggio / raccolta: Riempite un tubo da 120 ml con 100 ml di HBSS. Dispensare 1 ml di formalina in ciascun pozzetto di una piastra ben 24 fresco.
- Dopo il periodo di incubazione, utilizzare un paio di pinze taglienti e prendere il vetrino di vetro dal pozzo e tenere premuto il vetrino verticale e tamponare il bordo del vetrino su un pezzo di tessuto in panchina per 3 secondi, facendo attenzione a non toccare la superficie cellulare-coperta del vetrino con il tessuto.
- Tenendo il vetrino saldamente con un paio di pinze, dunk il vetrino dentro e fuori le HBSS cinque volte.
- Dopo il quinto dunkin HBSS, tamponare il bordo del vetrino sul tessuto per 3 sec.
- Ripetere le procedure nelle schiacciate e tamponando descritte in 3.6 e 3.7, per un totale di tre serie di 5 schiacciate seguiti da una piccola quantità.
- Trasferire il vetrino in un pozzo contenente il 10% di formalina per fissare le cellule a RT. Il vetrino è pronto per il conteggio, per la conservazione a lungo termine o da sottoporre ad altre procedure descritte di seguito.
4. Etichettatura di HL-60 celle con Tracker cellulare (facoltativo)
- Contare e trasferire quantità appropriata di cellule HL-60 (ad esempio, 10 milioni) in una provetta da centrifuga da 15 ml. Centrifuga cellule HL-60 a 200 xg per 5 min. Rimuovere il surnatante.
- Pellet cellulare Risospendere in Tracker cellulare in RPMI media senza siero ad una concentrazione di 1 milione di cellule / ml. Incubare le cellule in coltura cellulare incubatore per 1 ora.
- Cellule centrifugare a 200 xg per 5 minuti e scartare il surnatante. Pellet cellulare Risospendere in media per una concentrazione di 2 milioni di cells / ml.
- Aggiungere 0,5 ml di cellule Tracker marcati HL-60 in ciascun pozzetto contenente cellule endoteliali coltivate su vetrino di vetro. Continuare a 3.3.
5. enumerazione delle cellule endoteliali Adhesive
- Mount coprioggetto su vetrini da microscopio con DAPI contro-macchia per identificare le cellule individuali.
- Utilizzando un microscopio rovesciato con un obiettivo 4X o 10X, acquisire immagini di diversi settori (ad esempio, 5 campi) e contare il maggior numero di monociti che si aggregano sulle cellule endoteliali non-irradiati (Questo dovrebbe essere tipicamente 3-5).
- Impostare numero doppio come soglia di monociti su cellule endoteliali a quello definito come cluster. Se necessario, un criterio diverso può essere utilizzata per definire un cluster a seconda della natura dell'esperimento.
- Contare il numero di cluster e il numero di cellule endoteliali nel campo. Dividere il primo da quest'ultimo per ottenere la percentuale di cellule endoteliali adesive. Puntonumerosi campi per ottenere un media e deviazione standard dei conti.
6. Controcolorazione con Anticorpi
- Dopo il test di adesione e le cellule sul vetrino sono stati fissati in formalina al 10% per 15 minuti a temperatura ambiente, sottoporre i coprioggetti per immunofluorescenza con procedura standard 10 e anticorpi di scelta.
- Aggiungere e rimuovere le varie soluzioni molto delicatamente per evitare di spostare i monociti che sono collegati alle cellule endoteliali.
7. Controcolorazione per senescenza associata beta-galattosidasi Activity
- Dopo il test di adesione e le cellule sul vetrino sono stati fissati in formalina per 15 minuti, macchia per attività beta-galattosidasi senescenza associata, come descritto nelle istruzioni che accompagnano il kit di colorazione. Aggiungere e rimuovere le varie soluzioni molto delicatamente per evitare di spostare i monociti che sono collegati alle cellule endoteliali.
Risultati
Questo metodo permette la rilevazione di singole cellule endoteliali adesive all'interno di una popolazione. Per esempio, mentre un monostrato di cellule endoteliali non-irradiati mantenuto alcuni sporadici HL-60 monociti seguenti incubazione e lavaggio, monostrato endoteliale a 7 giorni dopo la 10Gy irradiazione prima dell'incubazione con monociti sono stati legati da monociti a grappoli intorno cellule endoteliali singole ( Figura 1). Anche se questo fenomeno è facilmente osservabile al microscopio a contrasto di fase, microscopia a fluorescenza rivela un'immagine ancora più nitida dei cluster monociti.
Dopo aver eseguito il test aderenza descritto, è possibile procedere alla colorazione delle cellule per membrana citoplasmatica o nucleare (Figura 2) proteine utilizzando anticorpi appropriati con metodi immunofluorescenza standard. Inoltre, saggio basato enzimi come senescenza associata beta-galattosidasi (Figura 3) può anche essere performed.
Poiché ogni cluster monociti corrisponde ad una cellula endoteliale individuale, enumerazione dei clusters rivelerà il numero effettivo di cellule endoteliali adesive all'interno del monostrato (figura 4), e quindi la percentuale di cellule endoteliali adesive all'interno della popolazione (Tabella 1, Figura 6) . Questo è l'unico metodo per data che consente tale quantificazione di adesività delle cellule endoteliali. È interessante notare che le cellule endoteliali utilizzate negli esperimenti qui sono il contatto inibito e non aumentano di numero dopo il raggiungimento di confluenza. Questo elimina la complessità potenziali causati da un aumento del numero di cellule endoteliali a successivi momenti. Se lo si desidera, monociti collegati a monostrati endoteliali da poter essere rimosse dalla soluzione di tripsina-EDTA 0,2% 0,5% (invece di fissazione in 3.9) e loro fluorescenza misurati usando un lettore di piastre, come accade nei metodi contemporanee (Figura 5).
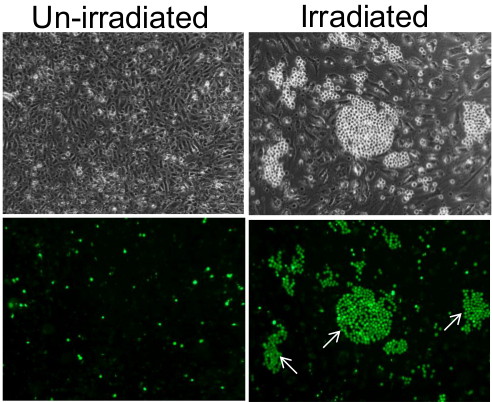
Figura 1. Adesione dei monociti in monostrato di cellule endoteliali. In cellule endoteliali non-irradiati, monociti aderito come le singole cellule in maniera sporadica e casuale (pannelli di sinistra) e in cluster su singole cellule endoteliali dei 7 giorni dopo la 10 Gy irradiati monostrato (pannelli di destra). Pannelli inferiori sono immagini di fluorescenza dei pannelli superiori, a conferma che i piccoli e luminosi celle sferiche visibili sotto contrasto di fase sono infatti monociti che sono stati pre-etichettati con Cell-Tracker Verde. Alcuni dei cluster monociti sono indicati con frecce bianche. Le immagini sono state scattate con un obiettivo 10X. Cliccate qui per vedere una versione più grande di questa figura.
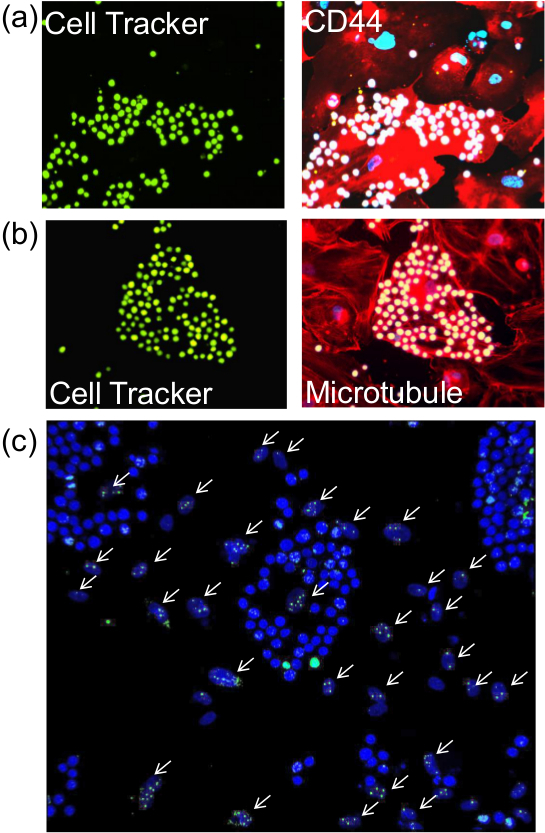
Figura 2. La colorazione di cellule endoteliali per il dosaggio delle proteine post-adesione. Dopo aver eseguito il test aderenza descritto, le cellule sui vetrini sono stati sottoposti a immunofluorescenza per la rilevazione di (A) proteina di membrana (CD44), b) proteina citoplasmatica (tubulina) oppure c) proteina nucleare (γ-H2AX). Pannelli di sinistra (A) e (B) (visto con obiettivo 20X) mostrano monociti pre-etichettati con Cell Tracker verde e l'immagine simile ai pannelli di destra rivelano CD44 e microtubuli (rosso) e nuclei DAPI-macchiati (blu). Frecce bianche in (C) punto irradiati nuclei delle cellule endoteliali che sono state colorate con anticorpi contro γ-H2AX. Nuclei monociti, che si sono macchiati di un brillante blu da DAPI sono facilmente distinguibili dai nuclei di forma ovale delle cellule endoteliali. Le immagini sono state scattate con obiettivo 20X. jove.com/files/ftp_upload/52924/52924fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
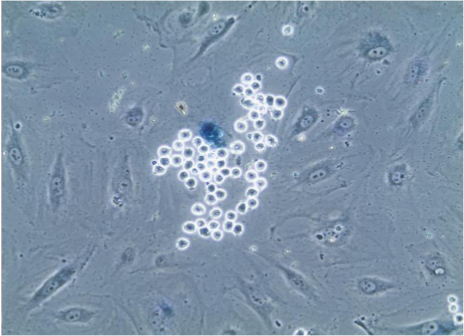
Figura 3. senescenza-associata beta-galattosidasi colorazione di cellule endoteliali. Dopo saggi di adesione, le cellule su vetrini sono stati sottoposti a colorazione per senescenza-associata beta-galattosidasi che provoca lisosomi di cellule senescenti al blu, come è evidente in cellule endoteliali che viene selettivamente vincolato da numerosi monociti, che sono facilmente identificabili causa delle loro piccole dimensioni e la forma sferica. Immagine visto attraverso obiettivo 20X. Cliccate qui per vedere una versione più grande di questa figura.
2924 / 52924fig4.jpg "/>
Figura 4. enumerazione dei cluster monociti sulle cellule endoteliali individuali. Dopo saggi di adesione, le immagini delle cellule sono stati presi da diverse posizioni e cluster monociti identificati e cerchiata (in verde). Un cluster è stata definita come un agglomerato di 10 o più monociti su una cellula endoteliale. Il numero di cluster di monociti e il numero di 12 giorni cellule endoteliali post-irradiati (tratteggiata in rosso) nell'immagine sono stati contati e la percentuale di cellule endoteliali aderenti calcolati come indicato nella tabella 1. Immagine presa attraverso obiettivo 10X. Clicca qui per visualizzare un versione più grande di questa figura.
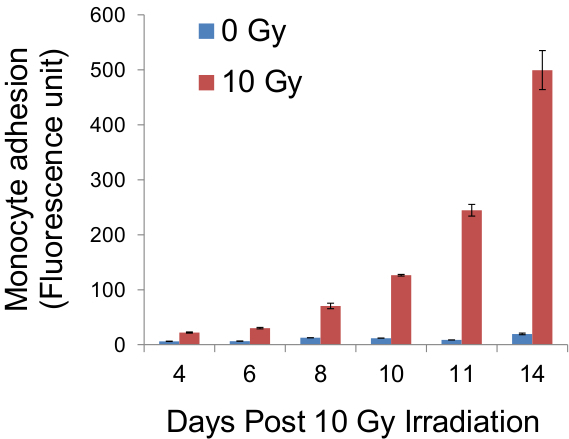
Figura 5. Quantificazione della fluorescenza monociti aderenti. Dopo Adhe test sione, celle su vetrini sono stati trypsinised e la fluorescenza dei monociti pre-etichettato con CellTracker Verde è stata misurata, utilizzando un lettore di piastre in fluorescenza, come un indicatore indiretto l'adesività del monostrato endoteliale. I risultati di tali misurazioni a giorni stabiliti post-irradiazione sono state ottenute e, intrecciata sul grafico di cui sopra.
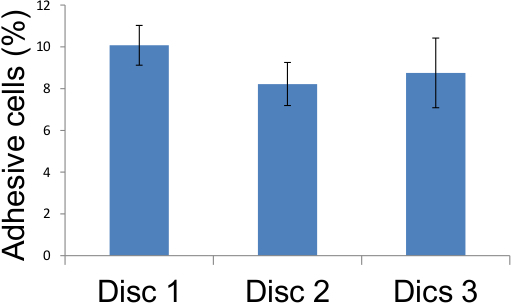
Figura 6. Rappresentazione dei punteggi del test di adesione Tabella 1. adesivi cellule endoteliali in cinque luoghi diversi su tre vetrini di vetro sono stati segnati come descritto nella figura 4 e risultati tabulati sopra dimostrando che 12 giorni dopo 10 Gy di irradiazione, dall'8 al 10 per cento del combustibile irraggiato cellule endoteliali divennero adesivo.
cellule endoteliali
| Disco 1 | Disco 2 | Disco 3 | |
| Campo 1 | 8.65 | 8.29 | 8.21 |
| Campo 2 | 10.44 | 7.27 | 7.21 |
| Campo 3 | 9.63 | 9.05 | 8.33 |
| Campo 4 | 11.11 | 7.09 | 8.41 |
| Campo 5 | 10.55 | 9.4 | 11.61 |
| Media | 10.07 | 8.22 | 8.75 |
Tabella 1. Adesione punteggi del test. Cellule endoteliali adesivi in cinque luoghi diversi su tre vetrini di vetro sono stati segnati come descritto in FIGURA 4 ed i risultati riportati in tabella dimostrano che 12 giorni dopo 10 Gy, da 8 a 10 per cento di cellule endoteliali irradiati divenne adesivo.
Discussione
Il dosaggio monociti sopra descritta è stata utilizzata con successo in esperimenti volti a studiare gli effetti biologici delle radiazioni ionizzanti su monostrati endoteliali 10. Anche se questo non è l'unico metodo disponibile per valutare l'adesività di un monostrato endoteliale, è l'unico metodo che consente la quantificazione della proporzione o percentuale di cellule endoteliali in un monostrato che è adesivo. Questa è una distinzione importante come cambiamento quantitativo globale nell'adesione dei monociti, come misurato mediante altri metodi può essere attribuito sia a un aumento generale adesività di tutte le cellule del monostrato endoteliale o all'aumento adesività di un sub-popolazione di cellule endoteliali all'interno del monostrato, come mostrato nell'esempio precedente. Il valore di avere queste informazioni è esemplificato dal fatto che la capacità di quantificare la percentuale di cellule endoteliali che mostravano una maggiore adesività dopo irradiazione portato ai inesconclusione capace che questo effetto non è dovuta a mutazione genetica di un particolare gene come la percentuale di cellule che erano adesivo erano notevolmente sopra (oltre 1.000 volte di più) quella che ci si aspetterebbe da mutazione casuale di un gene da X-radiazione a tale dose .
Il fattore che consente una buona riproducibilità dei risultati è il regime di lavaggio. Poiché la procedura di lavaggio prevede l'immersione del vetrino di vetro nel tampone di lavaggio seguito da tamponando su un tessuto, la variabilità nella turbolenza tampone che deriva inevitabilmente dal vecchio metodo di pipettamento del tampone di lavaggio in un pozzo è evitata. Infatti è stato l'osservazione di una eccessiva variabilità tra le repliche ottenuti con il metodo di pipettaggio che ci costretto ad ideare un procedimento di lavaggio che ha rimosso l'elemento di variabilità della fase di lavaggio.
Certo, i limiti di questo saggio si trovano nella necessità di effettuare conteggio manuale dei grappoli monociti, che fanno not permettono di essere adattato per analisi ad alta produttività. In secondo luogo, la decisione su quanti monociti costituiscono un cluster deve essere determinato semi-arbitrariamente e il livello può essere troppo elevata e provocare l'esclusione di alcuni cluster veri. La mancanza di forza di taglio in questo metodo può anche essere visto come una limitazione in esperimenti in cui grossolanamente maggiore adesività delle cellule endoteliali è indotta (ad esempio, + TNFa). In altre situazioni, tuttavia, la mancanza di forza di taglio è un vantaggio in quanto permette di rilevare meno esagerato aumento della adesività. Modesto aumento dei monociti adesività può essere particolarmente importante e rilevante. In vivo, monociti non sarebbero (in un tipico tempo sperimentale) può aspettare per fissare in gran numero alle cellule endoteliali con modesto aumento della adesività, in gran parte dovuto al taglio forza. Nel tempo, tuttavia, alcuni monociti probabilmente sarebbe, e questo è più probabile per rappresentare l'ambiente di infiammazione cronica. Come tale,l'assenza di forza di taglio può essere un vantaggio in quanto offre l'opportunità per i piccoli aumenti di adesività delle cellule endoteliali per essere rivelato in tempi sperimentali, che sono in genere di breve e forse troppo fugace per consentire modesto aumento della adesività da osservare sotto sforzo di taglio.
La possibilità di sottoporre le cellule dopo questo saggio ad altre analisi come senescenza dosaggio e immunofluorescenza aumenta l'utilità di questo metodo in quanto consente l'associazione di adesività di specifiche cellule endoteliali a particolari proteine cellulari o stati cellulari come dimostrato sopra, una caratteristica che non è disponibile con i saggi di adesione più anziani.
Questo metodo è stato utilizzato con celle coronariche umane immortalizzate est2 endoteliali e risultati simili sono stati ottenuti anche con cellule primarie umane endoteliali coronariche 10, dimostrando che non è specifico per un solo particolare linea cellulare. Inoltre, il rumoreption di questo metodo di saggiare adesività delle cellule endoteliali non preclude sottoporre le stesse cellule per saggio di adesione standard che misura la fluorescenza di immunociti etichettati. Insieme, questo rapporto dimostra che questo metodo è versatile, inclusiva e fornisce molte più informazioni di quanto il test di adesione standard.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
We are very grateful to Simon Bouffler for his full support and to Public Health England for infrastructure support. This work was supported by Public Health England throughthe National Institute for Health Research (NIHR) grant. This report is work commissioned by the NIHR. The views expressed in this publication are those of the authors and not necessarily those of the NHS, NIHR or the Department of Health. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Materiali
| Name | Company | Catalog Number | Comments |
| Hepes Buffered Saline Solution (HBSS) | Sigma | H6648 | |
| Glass coverslips Round 12 mm Diameter | Menzel-Glaser | CB00120RA1 | |
| 24-well cluster plate | Costar | 3526 | |
| Meso-Endo Cell media | Cell Applications | 212-500 | |
| Trypsin-EDTA | Sigma | T4174 | |
| Soybean trypsin inhibitor | Life Technologies | 17075-029 | |
| Cell Tracker Green | Life Technologies | C7025 | |
| RPMI | Sigma | R8758 | |
| Foetal Calf Serum | Life Technologies | 10500064 | |
| Beta glasctosidase Assay kit | CellSignaling | 9860 | |
| Fibronectin | Sigma | F0895 |
Riferimenti
- Ortega-Gomez, A., Perretti, M., Soehnlein, O. Resolution of inflammation: an integrated view. EMBO Mol Med. 5 (5), 661-674 (2013).
- Libby, P. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr. 83 (2), 456S-460S (2006).
- Ikuta, S., Kirby, J. A., Shenton, B. K., Givan, A. L., Lennard, T. W. Human endothelial cells: effect of TNF-alpha on peripheral blood mononuclear cell adhesion. Immunology. 73 (1), 71-76 (1991).
- Watson, C., et al. IL-6 acts on endothelial cells to preferentially increase their adherence for lymphocytes. Clin Exp Immunol. 105 (1), 112-119 (1996).
- Sans, M., et al. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 116 (4), 874-883 (1999).
- Su, Y., Lei, X., Wu, L., Liu, L. The role of endothelial cell adhesion molecules P-selectin, E-selectin and intercellular adhesion molecule-1 in leucocyte recruitment induced by exogenous methylglyoxal. Immunology. 137 (1), 65-79 (2012).
- Hallahan, D., Kuchibhotla, J., Wyble, C. Cell adhesion molecules mediate radiation-induced leukocyte adhesion to the vascular endothelium. Cancer Res. 56 (22), 5150-5155 (1996).
- Vaporciyan, A. A., Jones, M. L., Ward, P. A. Rapid analysis of leukocyte-endothelial adhesion. J Immunol Methods. 159 (1-2), 93-100 (1993).
- Prabhakarpandian, B., Shen, M. C., Pant, K., Kiani, M. F. Microfluidic devices for modeling cell-cell and particle-cell interactions in the microvasculature. Microvasc Res. 82, 210-220 (2011).
- Lowe, D., Raj, K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression. Aging Cell. 13 (5), 900-910 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon