Method Article
A quantificação da Adesividade celular endotelial
Neste Artigo
Resumo
We report an in vitro method that allows the quantitation of the actual number of adhesive cells within an endothelial cell monolayer.
Resumo
Um dos processos principais da inflamação é a infiltração de células imunitárias do lúmen do vaso sanguíneo para o tecido circundante. Isto ocorre quando as células endoteliais, que revestem os vasos sanguíneos, tornam-se adesivas para células imunes circulantes, tais como monócitos. In vitro, a medição da adesividade tem até agora sido feito através da quantificação do número total de monócitos que aderem a uma camada endotelial, quer como uma contagem directa ou indirecta por medição da fluorescência de monócitos aderentes. Embora tais medições indicam a adesividade média da população de células endoteliais, que são confundidos por um número de factores, tais como o número de células, e não revelam a proporção de células endoteliais que são realmente adesiva. Aqui descrevemos e demonstrar um método que permite a enumeração de células adesivas dentro de uma população testada de monocamada endotelial. As células endoteliais são cultivadas em lamelas de vidro e seguindo o desejartratamento são desafiados com monócitos (que pode ser marcado de forma fluorescente). Após a incubação, um procedimento de enxaguamento, que envolve múltiplos ciclos de imersão e secagem, as células são fixadas. Células endoteliais adesivas, que são rodeadas pelos monócitos são prontamente identificados e enumerados, dando um índice de adesão que revela a percentagem real de células endoteliais dentro da população que são adesiva.
Introdução
A infiltração de células imunes tais como os monócitos através da camada de células endoteliais que revestem os vasos sanguíneos é um passo importante no processo de inflamação 1. Isto permite que o homing de células imunitárias (imunócitos) para um local da lesão. Em outros casos, e locais, tais como a artéria coronária e artéria carótida, infiltração de monócitos através da camada endotelial pode conduzir à residência indesejável longo prazo destas células da parede da artéria, o que pode conduzir à formação de placas 2. Em todos os casos de imunoc�tica infiltração, o primeiro passo envolve a activação das células endoteliais numa região localizada do vaso sanguíneo. As células endoteliais são activados por citoquinas pró-inflamatórias, tais como TNF-α e IL-6 para aumentar a expressão de proteínas da superfície celular, tais como VCAM, ICAM e E-selectina que facilitam o recrutamento e fixação dos imunócitos sobre a superfície da célula endotelial 3- 6.
Inicialmente, a medição da adesão de células endoteliais foi realizada por contagem de monócitos que aderiram ao monocamada endotelial 7. As limitações deste método em termos de precisão levou à utilização de linfócitos marcados com rádio ou monócito, seguido por quantificação de material radioactivo, que corresponde aos linfócitos ou monócitos adesão 4. Este método foi eventualmente substituída por um método baseado em fluorescência, em que imunócitos de interesse foram marcadas com corante fluorescente e submetidos ao mesmo procedimento tal como acima, com a diferença de que em vez de fluorescência é medida de radioactividade 8. Presentemente este método tem emergido como a mais conveniente e é vendido na forma de kit por vários fornecedores comerciais. Embora este ensaio pode medir os níveis relativos de adesividade entre os controlos e amostras experimentais, não revela se uma alteração na fluorescência é devido a uma modificação uniforme ao longo de toda a adesividade endothelial população de células ou se a mudança se deve a uma diferença de adesividade dentro de uma sub-população de células. É também evidente que o rigor da lavagem exerce um efeito profundo sobre o resultado, e mais importante ainda, a uniformidade de enxaguar monócitos não ligadas entre diferentes monocamadas de células endoteliais será de grande impacto sobre a proximidade dos resultados de repetições e reprodutibilidade dos resultados entre as amostras . Mais recentemente, vários sistemas que bombeiam monócitos em meio através de uma monocamada de células endoteliais foram utilizadas para resolver este problema 9. Além disso, estes sistemas de fluxo também recapitular o efeito da força de corte sobre as células endoteliais. Enquanto as vantagens de tais sistemas são muito clara e atraente, também é importante perceber que, apesar de adesividade de células endoteliais pode ser grandemente aumentada, como é o caso na inflamação aguda, por factores, tais como o TNFa, alguns outros activadores, tais como radiação ionizante 10 elicit muda tchapéu não são prontamente detectado in vitro dentro de intervalos de tempo experimentais por estes sistemas muito rigorosas. Embora estas alterações de adesividade de células endoteliais minutos são facilmente perdido ou rejeitado na vitro, não é necessariamente benignos in vivo, em que essas pequenas mudanças dentro de um tempo de vida, o que é característico de inflamação crónica, pode exercer resultados muito significativos. Assim, um método robusto, mas sensível e específico para detectar e medir a aderência de células endoteliais é necessária.
Aqui, nós relatamos um método para medir a aderência de células endoteliais diretamente. Este método não se baseia na medição de fluorescência como indicador substituto indirecta de adesividade de células endoteliais. Revela se as mudanças na adesividade são devido a alteração uniforme em todas as células ou confinados a uma sub-população. Além disso, ele permite a co-coloração de células endoteliais com marcadores, tais como beta-galactosidase associada a senescência, a viabilidade celular Marker, Calcien AM e anticorpos contra as proteínas da superfície celular e intracelulares, que permitem a associação de células endoteliais adesivos individuais para certos estados de células ou a expressão de proteínas específicas.
Protocolo
1. Preparação de lamelas de vidro
- Esterilizar 12 mm de diâmetro redondo lamelas de vidro por imersão em etanol a 70% durante pelo menos 10 minutos com agitação ocasional para garantir a exposição total de todas as lamelas para o etanol. Despeje lamelas de vidro e etanol em uma cultura de células estéril prato (ou 6 centímetros ou 10 cm de diâmetro).
- Com um par de fórceps estéreis finas 5B, pegar e colocar cada lamela de vidro indivíduo em um poço de uma placa de aglomerado 24. Ter o cuidado de assegurar que as lamelas não tocam as paredes do poço e está aproximadamente no meio do poço.
- Deixe a placa de aglomerado coberto de un 24 com lamelas de vidro para secar no gabinete do fluxo. Isso leva cerca de 10 min
- Durante este período, a preparação da mistura de revestimento por diluição de 10 mg / ml de f ibronectina humana em solução salina equilibrada de Hank (HBSS) a 0,1 mg / ml.
- Quando as lamelas estão secos, pipetas 100 ml de solução de revestimento sobre cada co vidroverslip então a solução abrange apenas o vidro sem agrupamento em torno do lado de fora do poço. Colocar a placa de 24 poços aglomerado coberto numa incubadora de cultura de células durante pelo menos uma hora.
- Imediatamente antes da utilização, remover a solução de revestimento. A mesma solução de revestimento pode ser transferido para um tubo esterilizado e usado até três vezes sem perda visível de eficácia.
2. Preparação da monocamada de células endoteliais
- Culturas de células endoteliais de artérias coronárias humanas (CE) em meio a 37 ° C e 5% de dióxido de carbono.
- Aspirar off meios de cultura e lavar monocamada CE com 10 ml HBSS
- Aspirar off HBSS e adicionar 2 ml de 0,5% de tripsina, a solução de EDTA 0,2%. Incubar à temperatura ambiente durante aproximadamente 5 min.
- Quando CE pode ser deslocada por uma torneira para a parede lateral do balão, adicionar 5 ml de inibidor de tripsina de soja e com pipeta esguichar a superfície do frasco para desalojar as células mais.
- Transferência de células para um tubo de 15 ml e centrifugar o tuboa 200 xg durante 5 min.
- Aspirar o sobrenadante e ressuspender o sedimento em 5 ml de CE de meios de comunicação. Contar as células com um hemocitómetro e ajustar a concentração de células a 50.000 CE por ml de meio de CE.
- Pipetar 1 mL da suspensão de células em cada poço da placa de 24 poços contendo lamelas de vidro revestidas. Incubar as células S / N na incubadora de cultura de células a 37 ° C, mais 5% de dióxido de carbono.
- As células estão prontas para utilização em experiências em que uma monocamada confluente é formado, no prazo de 3 dias.
3. Preparação de monócitos
- Transferir células HL-60 que são cultivadas em RPMI suplementado com 10% de soro fetal de vitelo, como cultura em suspensão, para um tubo de 15 ml. Centrifugar as células a 200 xg durante 5 min.
- Remover as células sobrenadante e ressuspender em 5 ml de meio e ajustar a concentração de células com meios para 2 milhões de células / ml. Se marcação por fluorescência do HL-60 for desejada, ressuspender as células em meio RPMI sem soro e proceed conforme descrito na seção 4.
- Adicionar 0,5 ml de células HL-60 suspensão de células em cada poço da placa de 24 poços contendo monocamadas de cluster CE e incubar a placa numa incubadora de cultura de células a 37 ° C e 5% de dióxido de carbono durante um período fixo de tempo escolhido entre 1 e 3 h. Pouca diferença é observada entre 1 hora e 3 horas de tempo de ponto, onde a saturação de ligação é atingido.
- Prepare-se para celular lavar / colheita: Encha um tubo de 120 ml com 100 ml de HBSS. Pipetar 1 mL de formalina em cada poço de uma nova placa de 24 poços.
- Após o período de incubação, use um par de fórceps cortantes e pegar a lamela de vidro do bem e mantenha a lamela vertical e bata levemente na borda da lamela em um pedaço de tecido no banco durante 3 segundos, tomando cuidado para não tocar na coberto de superfície celular da lamela com o tecido.
- Segurando a lamela firmemente com um par de fórceps, enterrar a lamela dentro e fora dos HBSS cinco vezes.
- Após o quinto enterradaem HBSS, alisar a borda da lamela sobre o tecido durante 3 seg.
- Repita os procedimentos descritos dunking e enxugando em 3,6 e 3,7, perfazendo um total de três grupos de cinco enterradas seguido por uma pincelada.
- Transferir a lamela num poço contendo formalina a 10% para fixar as células à temperatura ambiente. A lamela está pronto para enumeração, para armazenamento a longo prazo ou pode ser submetido a outros processos descritos a seguir.
4. Rotulagem de células HL-60 com Rastreador de celular (opcional)
- Contagem e transferir a quantidade apropriada de células HL-60 (por exemplo, 10 milhões) para um tubo de centrífuga de 15 ml. Centrifugar células HL-60 a 200 xg durante 5 min. Remover o sobrenadante.
- Ressuspender o sedimento celular em Rastreio celular em meio RPMI sem soro para uma concentração de 1 milhão de células / ml. Incubar as células em cultura de célula incubadora durante 1 h.
- Centrifugar células a 200 xg durante 5 min e desprezar o sobrenadante. Ressuspender o sedimento de células em meio a uma concentração de 2 milhões de cells / ml.
- Adicionar 0,5 ml de Rastreio celular marcado com HL-60 a cada poço contendo as células endoteliais cultivadas em lamelas de vidro. Continue em 3,3.
5. Contagem de Células Endoteliais adesiva
- Mount lamelas em lâminas de microscópio com DAPI contra-mancha para identificar células individuais.
- Usando um microscópio invertido com um objetivo 4X ou 10X, adquirir imagens de diversas áreas (por exemplo, 5 campos) e contar o maior número de monócitos que agregam em células endoteliais un irradiado (Isso deve ser tipicamente 3-5).
- Definir duas vezes esse número como o limiar de monócitos em uma célula endotelial ser que definido como um cluster. Se necessário, um critério diferente pode ser usado para definir um conjunto de acordo com a natureza da experimentação.
- Contar o número de grupos e o número de células endoteliais no campo. Dividir a primeira pela segunda para obter a percentagem de células endoteliais adesivas. Pontonumerosos campos para obter uma média e desvio padrão das contagens.
6. contracoloração com Antibodies
- Após o ensaio de adesão de células e sobre a lamela ter sido fixada em formalina a 10% durante 15 min à TA, sujeitar as lamelas a imunofluorescência, utilizando um processo padrão de 10 e anticorpos de escolha.
- Adicionar e remover as várias soluções muito cuidado para evitar a retirada monócitos que estão ligados às células endoteliais.
7. contracoloração para-associado Senescence Beta-galactosidase Atividade
- Após o ensaio de adesão de células e sobre a lamela ter sido fixada em formalina durante 15 minutos, a mancha para actividade beta-galactosidase associada a senescência, como descrito nas instruções que acompanham o kit de coloração. Adicionar e remover as várias soluções muito cuidado para evitar a retirada monócitos que estão ligados às células endoteliais.
Resultados
Este método permite a detecção de células endoteliais adesivos individuais dentro de uma população. Por exemplo, enquanto que uma monocamada de células endoteliais irradiadas com un retidas algumas esporádicos HL-60 de monócitos após a incubação e lavagem, monocamada endotelial aos 7 dias pós-irradiação 10Gy antes da incubação com os monócitos foram ligados por monócitos em agregados em torno de células endoteliais individuais ( Figura 1). Embora esse fenômeno pode ser facilmente observado sob microscopia de contraste de fase, microscopia de fluorescência revela uma imagem mais clara dos clusters de monócitos.
Depois de realizar o ensaio de ades descrito, é possível proceder a coloração das células para a membrana, citoplasmática ou nuclear (Figura 2) as proteínas utilizando anticorpos apropriados com métodos de imunofluorescência standard. Além disso, o ensaio com base em enzima, tal como associada a senescência da beta-galactosidase (Figura 3) também pode ser PErformed.
Uma vez que cada conjunto de monócitos corresponde a um indivíduo de células endoteliais, enumeração dos aglomerados vai revelar o número real de células endoteliais adesivas dentro da monocamada (Figura 4), e, consequentemente, a percentagem de células endoteliais adesivas dentro da população (Tabela 1, Figura 6) . Este é o único método que permite que até à data, tais quantificação da aderência de células endoteliais. Vale ressaltar que as células endoteliais utilizados nos experimentos aqui são inibidas por contato e não aumentam em número depois de atingir confluência. Isto elimina a complexidade potenciais ocasionados por aumento do número de células endoteliais em pontos de tempo posteriores. Se desejado, os monócitos ligados a monocamadas endoteliais pode ser deslocada por uma solução de tripsina-EDTA a 0,2% a 0,5% (em vez de fixação em 3,9) e a sua fluorescência medida utilizando um leitor de placas, como é o caso nos métodos contemporâneos (Figura 5).
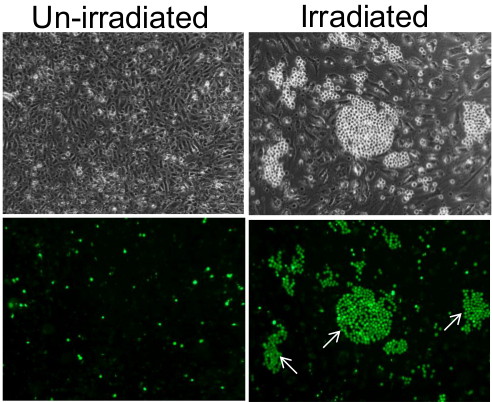
Figura 1. A adesão de monócitos na monocamada de células endoteliais. Em células endoteliais un irradiado, monócitos aderidos como células individuais de uma forma esporádica e aleatória (painéis da esquerda) e em cachos sobre as células endoteliais individuais dos 7 dias pós-10 Gy irradiados monocamada (painéis da direita). Painéis inferiores são imagens de fluorescência dos painéis de topo, confirmando que as pequenas e brilhantes células esféricas visíveis sob contraste de fase são, de facto monócitos que foram pré-marcadas com celular-Tracker Green. Alguns dos aglomerados de monócitos são indicados por setas brancas. As imagens foram tiradas com uma objetiva de 10X. Por favor clique aqui para ver uma versão maior desta figura.
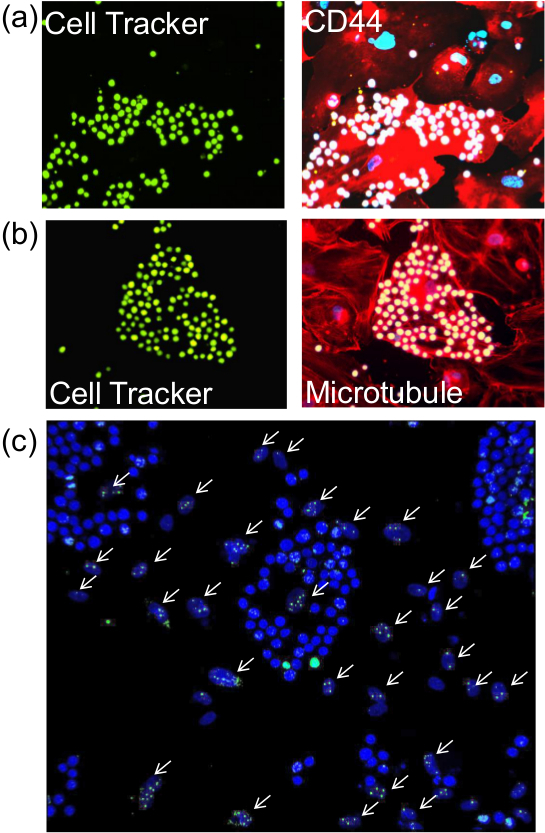
Figura 2. Coloração de células endoteliais para o ensaio de proteínas pós-adesão. Depois de realizar o ensaio de ades descrito, as células nas lamelas de vidro foram sujeitas a imunof luorescência para a detecção da (A), proteína de membrana (CD44), b) proteína citoplasmática (Tubulina) ou c) proteína nuclear (γ-H2AX). Painéis esquerdo de (A) e (B) (visto com objectiva de 20x) mostrar monócitos pré-marcado com celular Rastreio de verde e a imagem semelhante nos painéis direitos revelar CD44 e microtúbulos (vermelho) e DAPI núcleos corados (azul). Setas brancas em (C) Ponto de núcleos de células endoteliais irradiados que foram coradas com anticorpos contra γ-H2AX. Núcleos de monócitos, os quais são coradas por azul brilhante um DAPI são facilmente distinguidos dos núcleos de forma oval das células endoteliais. As imagens foram tomadas com objetivo 20X. "target =" _ blank jove.com/files/ftp_upload/52924/52924fig2large.jpg "> Clique aqui para ver uma versão maior desta figura.
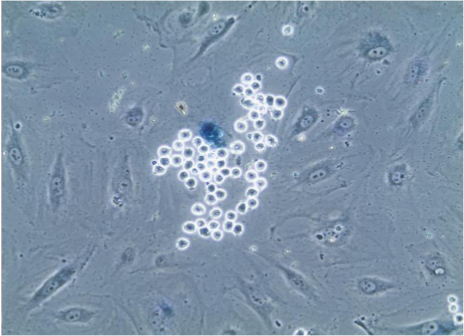
Figura 3. A senescência associada-beta-galactosidase de coloração de células endoteliais. Após ensaio de adesão, as células em lamelas foram submetidas a coloração associada à senescência para a beta-galactosidase, que faz com que os lisossomas de células senescentes a ficar azul, como é evidente na célula endotelial que é selectivamente ligada por numerosos monócitos, que são facilmente identificados devido ao seu pequeno tamanho e forma esférica. Imagem vista através objetivo 20X. Por favor clique aqui para ver uma versão maior desta figura.
2924 / 52924fig4.jpg "/>
Figura 4. Enumeração de aglomerados de monócitos nas células endoteliais individuais. Após ensaio de adesão, as imagens das células foram tomadas a partir de várias posições diferentes e aglomerados de monócitos identificados e circulado (a verde). Um conjunto foi definida como um aglomerado de 10 ou mais monócitos em uma célula endotelial. O número de clusters de monócitos e número de 12 dias células endoteliais pós-irradiados (pontilhada em vermelho) na imagem foram contadas ea percentagem de células endoteliais aderentes calculados conforme demonstrado na Tabela 1. Imagem tomada através objetiva de 10X. Por favor clique aqui para ver uma versão maior desta figura.
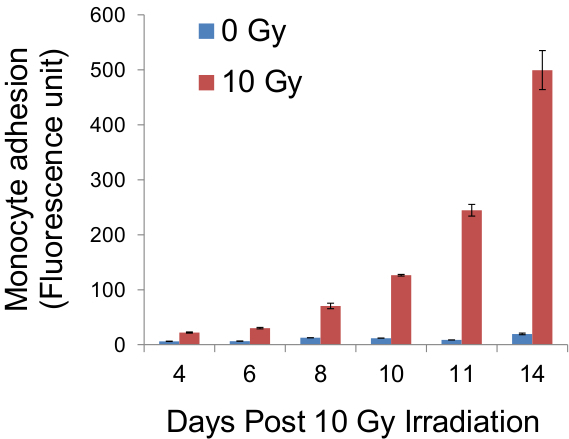
Figura 5. A quantificação da fluorescência de monócitos aderentes. Seguindo Adhe sion ensaio, as células em lamelas de vidro foram tripsinizadas e a fluorescência de monócitos pré-marcado com CellTracker verde foi medida, utilizando um leitor de placas de fluorescência, como um indicador indirecto da adesividade da monocamada endotelial. Os resultados de tais medições em dias determinados pós-irradiação foram obtidos e tecendo no gráfico acima.
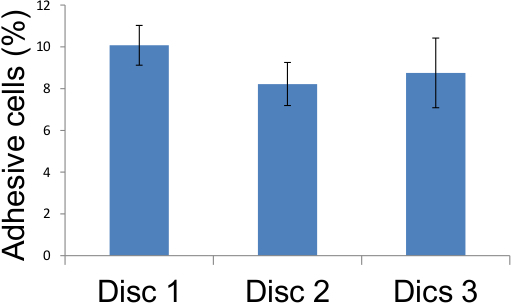
Figura 6. Representação das contagens de ensaio de adesão de células endoteliais Tabela 1. O adesivo em cinco locais diferentes em três lamelas de vidro foram marcados, tal como descrito na Figura 4 e os resultados tabulados acima demonstram que 12 dias após a irradiação com 10 Gy, 8 a 10 por cento de irradiado células endoteliais tornou-se adesivo.
células endoteliais
| Disco 1 | Disco 2 | Disco 3 | |
| O campo 1 | 8.65 | 8.29 | 8.21 |
| O campo 2 | 10,44 | 7,27 | 7,21 |
| Campo 3 | 9.63 | 9.05 | 8.33 |
| O campo 4 | 11.11 | 7,09 | 8.41 |
| Campo 5 | 10,55 | 9.4 | 11,61 |
| Média | 10,07 | 8.22 | 8.75 |
Tabela 1. escores de ensaio de aderência. Células endoteliais adesivas em cinco locais diferentes em três lamelas de vidro foram marcados como descrito no Figura 4 e os resultados tabulados acima demonstram que 12 dias após a irradiação com 10 Gy, 8 a 10 por cento de células endoteliais irradiados tornou-se adesivo.
Discussão
O ensaio de adesão de monócitos descrita acima foi utilizada com sucesso em experiências concebidas para estudar os efeitos biológicos da radiação ionizante sobre monocamadas endoteliais 10. Embora isto não é o único método disponível para avaliar a aderência de uma monocamada endotelial, é o único método que permite a quantificação da proporção ou a percentagem de células endoteliais no interior de uma monocamada que é adesiva. Esta é uma distinção importante como uma alteração quantitativa global na adesão de monócitos, conforme medido por outros métodos pode ser atribuído quer a um aumento geral na adesividade de todas as células da monocamada endotelial ou para o aumento da adesividade de uma sub-população de células endoteliais no interior da monocamada, tal como mostrado no exemplo acima. O valor de ter esta informação é exemplificada pelo facto de que a capacidade de quantificar a percentagem de células endoteliais que exibiram adesividade aumentada após a irradiação conduziu aos inescapaz conclusão de que este efeito não é devido a uma mutação genética de um gene particular como a percentagem de células que estavam adesiva eram muito acima (mais de 1000 vezes mais) do que seria de esperar de mutação aleatória de um gene por raios-X em que doses .
O factor que permite uma boa reprodutibilidade dos resultados é o regime de lavagem. À medida que o processo de lavagem envolve a imersão da lamela de vidro para o tampão de lavagem seguido por esfregando sobre um tecido, a variabilidade no tampão de turbulência que resulta inevitavelmente a partir do método antigo de pipetagem da solução de lavagem dentro de um poço é evitada. Na verdade, foi a observação da variabilidade excessiva entre repetições obtidos usando o método de pipetagem que nos obrigou a elaborar um procedimento de lavagem que removeu o elemento variabilidade da etapa de lavagem.
É certo que as limitações desta mentira ensaio na necessidade de proceder a contagem manual de clusters de monócitos, o que fazer not permitir que ele seja adaptado para análises de elevado rendimento. Em segundo lugar, a decisão sobre quantas monócitos constituem um cluster tem de ser determinado semi-arbitrariamente eo nível pode ser muito alto e resultar na exclusão de alguns grupos genuínos. A falta de força de cisalhamento neste método também pode ser visto como uma limitação em experiências nas quais é induzida grosseiramente aumentada adesividade de células endoteliais (por exemplo, TNFa +). Em outras situações, no entanto, a ausência de força de corte é uma vantagem, uma vez que permite a detecção do aumento da adesividade menos exagerada. Aumento modesto em monócitos adesividade pode ser particularmente importante e relevante. In vivo, monócitos não seria (em um tempo experimental típico) ser esperado para anexar em grande número às células endoteliais com modesto aumento na adesividade, em grande parte devido à força de cisalhamento. Em vez no entanto, alguns monócitos provavelmente faria, e isso é mais provável para representar o ambiente de inflamação crónica. Como tal,a ausência de força de cisalhamento pode ser uma vantagem, pois proporciona a oportunidade para que pequenos aumentos na adesividade de células endoteliais a ser revelado em prazos experimentais que são tipicamente curto e, possivelmente, demasiado fugaz para permitir modesto aumento na adesividade a ser observado sob tensão de cisalhamento.
A capacidade de sujeitar as células após este ensaio para outras análises, tais como ensaio de senescência e imunofluorescência aumenta a utilidade deste método uma vez que permite a associação de adesividade de células endoteliais específicos para proteínas celulares particulares ou estados celulares tal como demonstrado acima, uma característica que não se encontra disponível com os ensaios de adesão mais velhos.
Este método tem sido utilizado com células endoteliais coronárias humanas imortalizadas EST2 e resultados semelhantes também foram obtidos com células endoteliais coronárias humanas primárias 10, demonstrando que não é específico para apenas uma linha de células particular. Além disso, o ADOPÇÃO deste método de ensaio de aderência de células endoteliais não se opõem sujeitando as mesmas células para o ensaio de adesão padrão que mede a fluorescência de imunócitos rotulados. Juntos, este relatório demonstra que este método é versátil, inclusiva e fornece muito mais informações do que o ensaio de adesão padrão.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
We are very grateful to Simon Bouffler for his full support and to Public Health England for infrastructure support. This work was supported by Public Health England throughthe National Institute for Health Research (NIHR) grant. This report is work commissioned by the NIHR. The views expressed in this publication are those of the authors and not necessarily those of the NHS, NIHR or the Department of Health. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Materiais
| Name | Company | Catalog Number | Comments |
| Hepes Buffered Saline Solution (HBSS) | Sigma | H6648 | |
| Glass coverslips Round 12 mm Diameter | Menzel-Glaser | CB00120RA1 | |
| 24-well cluster plate | Costar | 3526 | |
| Meso-Endo Cell media | Cell Applications | 212-500 | |
| Trypsin-EDTA | Sigma | T4174 | |
| Soybean trypsin inhibitor | Life Technologies | 17075-029 | |
| Cell Tracker Green | Life Technologies | C7025 | |
| RPMI | Sigma | R8758 | |
| Foetal Calf Serum | Life Technologies | 10500064 | |
| Beta glasctosidase Assay kit | CellSignaling | 9860 | |
| Fibronectin | Sigma | F0895 |
Referências
- Ortega-Gomez, A., Perretti, M., Soehnlein, O. Resolution of inflammation: an integrated view. EMBO Mol Med. 5 (5), 661-674 (2013).
- Libby, P. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr. 83 (2), 456S-460S (2006).
- Ikuta, S., Kirby, J. A., Shenton, B. K., Givan, A. L., Lennard, T. W. Human endothelial cells: effect of TNF-alpha on peripheral blood mononuclear cell adhesion. Immunology. 73 (1), 71-76 (1991).
- Watson, C., et al. IL-6 acts on endothelial cells to preferentially increase their adherence for lymphocytes. Clin Exp Immunol. 105 (1), 112-119 (1996).
- Sans, M., et al. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 116 (4), 874-883 (1999).
- Su, Y., Lei, X., Wu, L., Liu, L. The role of endothelial cell adhesion molecules P-selectin, E-selectin and intercellular adhesion molecule-1 in leucocyte recruitment induced by exogenous methylglyoxal. Immunology. 137 (1), 65-79 (2012).
- Hallahan, D., Kuchibhotla, J., Wyble, C. Cell adhesion molecules mediate radiation-induced leukocyte adhesion to the vascular endothelium. Cancer Res. 56 (22), 5150-5155 (1996).
- Vaporciyan, A. A., Jones, M. L., Ward, P. A. Rapid analysis of leukocyte-endothelial adhesion. J Immunol Methods. 159 (1-2), 93-100 (1993).
- Prabhakarpandian, B., Shen, M. C., Pant, K., Kiani, M. F. Microfluidic devices for modeling cell-cell and particle-cell interactions in the microvasculature. Microvasc Res. 82, 210-220 (2011).
- Lowe, D., Raj, K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression. Aging Cell. 13 (5), 900-910 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados