Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Üç Verici Kartezyen Yazıcı Kullanımı Bioprinted Hücresel Yapıların Canlılık
Bu Makalede
Özet
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Özet
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Giriş
Doku mühendisliği, korumak, geri yükleme veya yerel dokuyu geliştirmek ve işlevsel ikame gelişiminde biyoloji ve mühendislik prensiplerini kullanır. Doku mühendisliği yanı sıra hücre tabanlı sensörler, ilaç / toksisite taraması, doku veya tümör modellerinde, diğer bilimsel ve teknolojik gelişmeleri kolaylaştıracak talep üzerine üç boyutlu biomimetic yapılar üretme yeteneği. Yakından hücreler ve nativ dokuda hücre dışı matrisin yüksek organize etkileşimi taklit eden gerekir, çünkü doku mühendisliği yapılarının üç boyutlu kuruluş imalat yönteminin temel bir bileşenidir.
Biyolojik olarak parçalanabilir ve şekli oluşturan üç boyutlu iskele hücreleri, bir hücre, iki boyutlu bir tabaka meydana getirmek üzere göç için yeni bir doku yapıları üreten kritik faktörler vardır, ancak tercih edilen üç boyutlu bir büyüme kabiliyetinden yoksundur. Iskele hücre için geçici bir vakıf olarak hizmet vermektedirbağlanma ve proliferasyonu, yani kontrol gözeneklilik ve biyolojik olarak parçalanma ve yeterli mekanik Integrit sahip olan malzemelerden imâl edilmelidir. Iskele malzemeleri sitotoksik veya ana bilgisayardan olumsuz bir yanıt oluşturmak gerekir. Hidrojeller yaygın doku mühendisliği teknikleri kullanılmıştır ve nedeniyle hidrofilik hidrojeller structur boyunca sıvı ve gaz değişimi izin verir. Farklı hidrojeller birleştirerek, sentezlenen hidrojelin özellikleri farklı uygulama ihtiyacını karşılamak için değiştirilebilir vardır.
Geleneksel doku mühendisliği yaklaşımı hücreleri post-fabricatio ile ekilir aselüler gözenekli kurban iskelelerinin oluşturulmasını içerir. Birçok teknikler elyaf bağlama, çözücü döküm olarak, istihdam ve kalıp eritmek, ancak doku mühendisliği uygulamaları için minimal başarılı olduğunu kanıtladı edilmiştir. Fiber bağlama yöntemleri lifler belirli şekillerde hizalanmış izin, ama onlar yanlısı yalnızca yeteneğine sahipÇok ince iskele ducing. Solvent döküm yöntemleri, çok gözenekli yapıları üretilen ancak büyük üretilen membran thic sadece 3 mm oldu. Bu nedenle, üç boyutlu yapılar oluşturma teknikleri kullanarak, bu mümkün değildir. Erime kalıplama teknikleri, üç boyutlu yapı iskelesi üretiminde başarılı oldu, fakat bu yüksek sıcaklıklar, biyolojik malzeme üretim süreç sırasında eklenen edilemeyeceğini gerekmektedir. Iskeleleri önceden tanımlanmış veya kontrol mikroyapılarına ve üç boyutlu iskeleleri üretmek için doku mühendisliği gereksinimlerini karşılamak için kendi yeteneği sınırlıdır sonrası imalat numaralı seribaşı. Katı iskele tohumlama teknolojileri ile bir başka önemli konu damarlanma ve kötü mekanik eksikliği olduğunu.
Bioprinting beri geleneksel dezavantajlarının üstesinden gelmek için toksik olmayan, biyolojik olarak parçalanabilen, termo-tersinir jellerin kullanımı yoluyla üç boyutlu şekilde genişletilmiştir. Katı serbest form imalat t birkaçŞu anda istihdam edilen tekniki lazer yardımlı bioprinting ve inkjet baskı vardır. Lazer destekli bioprinting teknikleri Darbeli bir lazer kaynağı, bir hedef plakası ve üç boyutlu oluşturmak için bir alıcı alt-tabakanın kullanımı. Ancak, bu teknik, düşük verimlilik, düşük hücre canlılığı ile sınırlıdır ve yalnızca photocrosslinkable ön-polimerler çapraz bağlı bir hidrojel oluşturmak üzere kullanılabilir, çünkü sadece imal dokularda sınırlı düzenlemeleri üretebilir. Mürekkep püskürtmeli baskı pikolitre mürekkep yatırarak bir tabaka üzerinde dijital görüntü verilerini üretir temassız yöntem olarak geliştirilmiştir. Bununla birlikte, yüksek çözünürlüklü bir yapı üretmek etmez mürekkep püskürtmeli baskı, tecrübe hızlı protein denatürasyonu oluşturur ve hücrelerin çoğu yerleştirilmesi sırasında lizlenir.
Şu anda, yeni katkı üretim bioprinting yöntemleri geliştirilmiştir. Bu sistemlerde, hücre, proteinler, büyüme faktörleri ve biomimetik hidroj tipik haliyle matris mater entegreIALS imalat işlemi sırasında ve aynı zamanda yakın yerli mikromimarisini taklit üç boyutlu iskele tabanlı hücre yüklü yapılar oluşturmak için bir bilgisayar kontrollü aktüatörleri kullanarak yatırılır. Hücre yüklü hidrojeller birden fazla hücre tipleri, ya da homojen oluşan heterojen olabilir bioink oluşturmaktadır. Katkı üretim sistemleri yatırma bioink açılan yan damla x, y ve z yönde hareket edebilen bir bilgisayar kontrollü sahne üzerine yöneltilmesi veya katman-katman atılabilir şırıngalar ve ipuçları ile. Bilgisayar yazılımları sayesinde, basılı iskelelerinin mimarisi kolayca uygulama gereksinimlerine bağlı olarak manipüle edilebilir. Geleneksel tekniklerle farklı olarak, üç boyutlu tıbbi teknolojiler (manyetik rezonans görüntüleme, bilgisayarlı tomografi) hastaya özgü yapının yaratılmasında, tasarımlar içine dahil edilebilir. Yapıları daha yüksek l üretildikleri için, bu yöntemleri de vaskülarize yedek üretme olasılığını izinocal hücre yoğunluğu, hücre-hücre etkileşimleri izin vermek ve implantasyon sonrası surviva olasılığını arttırır.
Palmetto Yazıcı üç boyutlu heterojen doku yapıları (Şekil 1) üretmek için programlanabilir robotik üretim metotları kullanan özel inşa edilmiş üç boyutlu çoklu dağıtıcı sistemidir. Bu benzersiz kombinasyon malzemelerin bir çok kullanımı heterojen yapıların üretilmesi için izin verir. Bioprinter başlatma size bioprinted yapıların basılabilirliği optimize etmek için parametrelerin çeşitli ayarlamanızı sağlar, çünkü bioprinting en önemli adımlardan biridir.
Bioprinter kullanıcı etkileşimli dokunmatik ekran kontrol paneli üzerinden faaliyet gösteren bir programlanabilir lojik kontrol (PLC), (Şekil 1, A) tarafından kontrol başlangıç, işletme ve kapatma dizileri ile bir toplu tipi sürecini kapsar. Biyo kirlenmesini önlemek içinmantıklı malzemeler bioprinter pozitif basınçlı poli (metil metakrilat) içine bir yüksek verimlilikli parçacık Yakalama (HEPA) ile (PMMA) odacık hava sirkülasyon sistemi filtreli (Şekil 1 A, B, C). Yazıcının içi dahili ultraviyole ışık kaynağı (Şekil 1, D) kullanılarak sterilize edilebilir. Bioprinter merkezi bileşeni tekrarlanabilir 10 mikrometre (Şekil 1, E) bir hassasiyetle bir dağıtıcı ucu yerleştirebilirsiniz tamamen programlanabilir konumlandırma robottur. Bir döner vida kullanarak 230 nl (Şekil 1, F) kadar küçük miktarlar yatırmak mümkün üç dağıtıcılar vardır. Her dağıtıcı için (Şekil 1, G) baskı parametrelerini yöneten ayrı bilgisayar kullanarak bağımsız programlanabilir. Döner vidalı dağıtma bir şırınga ve aşağı şırınga ucunun üzerinden bioink taşımak için bir motor tahrikli vidasının dönüşü kullanmaktadır. Bu dağıtıcılar, bir pnömatik üzerine monte edilirly kontrol aracı yuvası (Şekil 2A, B), bir robot programlanan kontrol (Şekil 1, H) altında Z ekseni robot kolu üzerine monte edilmiş dağıtıcı geçiş sağlayan.
XYZ robotu (Şekil 1, I) çalıştıran bir bilgisayara tasarım yazılımı baskı talimatlarını alır. Her program dağıtım yerleri, kalibrasyon rutinleri ve dağıtıcı değişen protokolleri içerir. Her bir dağıtıcı malzemenin biriktirilmesi nerede esas XYZ oluşur Oluşturulan yapılar tasarımı koordine eder. Bioprinter XYZ şırınga ucu ucunun koordinatları belirlemek için iki optik ışık sensörleri (Şekil 2C) ihtiva eder. Bu sensörler dağıtıcı ucu uçları konumlarını hesaplamak için aşağıdaki kullanan robot, bilgi koordinat gönderin. Bir Accura ile mesafeyi ölçmek için 30 x 100 mikrometre spot büyüklüğü bir 633 nm diyot kırmızı lazer ışını projeler ek deplasman lazer (Şekil 2B) Orada0,1 mikrometre cy. Kiriş çok odaklı olduğunda robot baskı yüzeyinin Z mesafeyi belirler. Bu ölçüm ve Z de uç optik ışık sensörleri ölçümü doğru Z hesaplanması baskı yüzeyine göre dağıtıcı ucu yerleştirmek için kullanılan koordinatları sağlar. Dağıtıcı ipuçları Y ve Z merkezleri bulmak için X ekseni odaklı optik ışık sensörü sayesinde yanal ve düşey hareket ve yanal bir Y ekseni sensörü sayesinde X ekseni merkezini bulmak için. Yüzey dağıtma ucu ucuna konumuna göreli yeri belirlemek için + cz = d ax +: baskı yüzeyi xyz uzayda düz bir uçak için formül kullanılarak eşleştirilir. Yazıcı aşaması (Şekil 1, J) çapı 80 mm bir örnek Petri kabı kadar tutar ve ayarlanan sıcaklığı (Şekil 1, K) korumak için devirdaim su banyosu kullanır. Aşama sıcaklığı -20 aralığında ayarlamak içinde sabit kalır edilebilir. USB kamera var monteRobot Z-kol üzerine baskı işleminde (Şekil 1, L) sırasında dağıtım ucu büyütülmüş görünümünü sağlamak. Yazdırma işlemi (Şekil 1, L) sırasında bioprinter tam bir görünümünü sağlar odacık iç üst kısmına doğru monte edilmiş bir ikinci kamera var.
Bir bilgisayar destekli tasarım çizim yazılımı biriktirme deseni belirler ve kullanıcı artarak aralıklı damlacıkların ve karmaşık yapıları (Şekil 3) oluşturmak için izin verir. Üç boyutlu yolları elle yazıcı uyumlu tasarım yazılımı içine kodlanmış veya ayrı bir bilgisayar destekli tasarım yazılımı çizim (Şekil 4, Tablo 1) alınabilir. Yazıcı uyumlu yazılım izin veren bu tür şırınga ucu sonu ve subst arasındaki çökelme yöntemiyle (tek damlacık birikmesi veya sürekli yolu birikimi) yollarının, üç boyutlu geometri, çökelme hızı, mesafe olarak baskı parametrelerinin varyasyonlarıoran baskı yüzeyi, bireysel damla ve yüksekliğini yatırmak ve şırınga hızlandırmak için süre damla birikimi arasında kaldırılır. Her program yazdırma sırasında, operatör müdahalesi olmadan, steril bir ortam sağlamak için XYZ dağıtım yerleri, uç kalibrasyon rutinleri ve dağıtıcı değişen protokolleri içerir. Robotun programlanabilir lojik kontrolör (PLC) tasarım yazılımını çalıştıran bilgisayardan talimat alır ve dış denetleyicileri olayların zamanlaması (örneğin, dağıtıcılar) kontrol eder. Bunu yapmak için, PLC dağıtıcılar kontrol etmek için bir döngü mekanizması kullanır , robotik konumlandırma cihazı ve çevresel faktörler.
Bir döner vidalı, sıvı dağıtma sistemi kullanan üç boyutlu doğrudan yazma bioprinting daha verimli, doğru ve önceki yöntemlerden daha kolay olması için hücrelerin yatırma süreci sağlar. Bu çalışma özel inşa bioprinter ce üretebilen gösteriyoryüksek hücre canlılığı ile ll yüklü hidrojel yapıları.
Protokol
Aljinat Hidrojeller Üç Boyutlu Bioprinting için Jelatin içeren substratın hazırlanması 1.
- Yüksek içerikle ilişkili azaltılmış canlılığı önlemek için Pataky ve ark 11 tarafından tarif kalsiyum / jelatin tabaka yöntemi izlenerek kalsiyum / jelatin substrat hazırlayın. Kalsiyum / jelatin tabaka yöntemi aşağıda listelenmiştir.
- Damıtılmış su içinde kalsiyum klorür dihidrat (ağırlıkça% 1.5), sodyum klorür (ağırlıkça% 0,9), ve domuz jelatin (ağırlıkça% 2) birleştirin ve 100 mM jelatin solüsyonu oluşturmak için 2 dakika boyunca kaynatılır.
- Jel O kadar buzdolabında düz bir yüzeyde, 100 mm standart petri kutularının içine jelatin / kalsiyum solüsyonu 5 ml dökün düz bir yüzey üzerinde kaplama yapmak için etrafında çözüm girdap ve yer / N (jel izin en az 8 Kullanmadan önce saat).
- Jelatin / CaCl2 çözeltisine, titanyum dioksit (% 0.3'e) ekleyin, alt-tabaka yüzeyinin opaklığını arttırmak. 10 dakika boyunca karıştırın. Autsterilize edilmesi, 30 dakika için sıvı döngüsü jelatin / TiO2 çözeltisi oclave.
- Daha önce hazırlanan jelatin levhaların yüzeyine jelatin / TiO2 çözeltisi 3 ml ekleyin. Eşit yüzeyine karşı yayılmaktadır sağlamak için karışım döndürülür. 4 ° C buzdolabı O'da jel izin ver / N (kullanımdan önce en az 8 saat jel izin verir). Alt-tabakalar 3 gün içinde kullanılmalıdır.
2. Aljinat oksidasyonu
- Aşağıda tarif Bouhadir ve ark 30 ile kısmen oksitlenmiş aljinat metodu izleyerek, sodyum alginat bioink okside.
- % 5 oksitlenmiş aljinat çözeltisi yapmak için, damıtılmış su içinde 100 ml sodyum alginat 1 g çözülür. % 5 oksidasyon solüsyonu elde etmek için, sodyum periodat sulu çözeltisi (0.25 M, 0.25 mmol), oksitleyici madde ekleyin. Oda sıcaklığında 19 saat boyunca karıştırın. Rea sona erdirmek için 24 saat sonra solüsyona 40 ml etilen glikol eklemection.
- Çözelti içinde sodyum klorür 2.5 g çözündürülür. Oksitlenmiş alginatlar çökeltilmesi için: (1 oranında 2) etil alkol içerisinde aşırı miktarda ekleyin. Çökeltilerin toplamak için 1000 xg'de çözüm Santrifüj ve distile su içinde bunları yeniden çözülür. Etanol yıkama tekrarlayın.
- Freeze-kurumasını kullanıma hazır olana kadar -20 ° C'de okside aljinat pelet ve mağaza.
- Sodyum yüzdesi ölçerek oksidasyon derecesini belirlemek etilen glikol tarafından bitirildiği önce tüketilen perıodat.
- Bir potasyum iyodür çözeltisi (w / v% 20, pH 7.0 sodyum fosfat tamponu) ve thyodene çözeltisi (w / v% 10, pH 7.0 sodyum fosfat tampon) hazırlayın. Oda sıcaklığında oksitlenmiş alginat ile iki çözüm karıştırın.
- Yavaş yavaş potasyum iyodür ve theodyne çözeltilerinin karışımı içine reaksiyona alginat ve sodyum periodat çözeltisi bırakın. Spektrofotometrik 426 nm'de karışımın absorbansı ölçülür. O ulaştığında birMaksimum, V 1 olarak aljinat ve sodyum periodat çözeltisi kullanılan hacim kaydedilir.
- Tepkidir
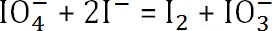 . Reaksiyona girmemiş sodyum periodat miktarıdır
. Reaksiyona girmemiş sodyum periodat miktarıdır 
- Sodyum miktarının periodat tüketilen belirlemek ilk konsantrasyondan tepkimemiş sodyum periodat miktarını çıkarın. Bir önceki formülü kullanarak, aljinat nihai oksidasyon derecesini belirler.
3. Aljinat Peptide Konjugasyon
- Hücre eki ve yayılma teşvik etmek için, aşağıda tarif edilen Rowley ve diğerleri tarafından 31 RGD Alginat konjügasyon yöntemini izleyerek önce hazırlanmış oksitlenmiş aljinat içine açık bir arginin-glisin-aspartik asit sekansı (peptid) ı olan Birleşmiş ligandlar.
- Sulu carbod kullanınG 4 RGDSPto konjügatı 31 iimide kimyası.
- 0.1 M 2- (N-morfolino) etansülfonik asit,% 5 oksitlenmiş aljinat 1 g çözündürün (MES) tampon maddesi (pH = 4 1-etil- (dimetilaminopropil) karbodiimid (EDC, 0.54 mmol) ilave edin ve N-Hidroksisüksinimid 2 NHS, 0.27 mmol),: 1 oranında amit ara madde oluşturulur.
- Terminal amin ile aljinat polimer omurgasına 0.28 mmol peptid birleştirme ekleyin. RT O / N at karıştırın.
- Çözeltiye 2,5 g sodyum klorür ilave edilerek bağlanma reaksiyonu durdurun. Oksitlenmiş alginatlar çökeltilmesi için: (1 oranında 2) etil alkol içerisinde aşırı miktarda ekleyin. Çökelti toplamak için 5 dakika boyunca 4000 x g'de santrifüjleyin karışımı. Hücre kültürü kaputu ortamı aspire ve damıtılmış su içinde çökelti yeniden çözündürün. Etanol yıkama tekrarlayın.
- Tamamen kurumuş olur kadar (beyaz toz madde olarak görünecektir) çökeltiler kurutmak-Freeze ve sonrası için C buzdolabında ° -20 saklamakkullanın.
4. İnsan Yağ Dokusu Stromal hücreler (hADSC en) Hücre Kültürü
- Kültür insan adipoz dokusu stromal hücreler (hADSC en),% 10 fetal sığır serumu ve% 1 penisilin-streptomisin,% 1 glutamin ve% 1 antimycin 15 mi, düşük glukoz DMEM ile kaplı hücre kültürü şişeleri (T75 şişeleri) ile muamele 75 cm bölgesi. Onlar confluency (% 80-90) ulaşana kadar her iki günde bir, hücre kültürü kaputu, medyayı değiştirin.
- Birleşmiş kez hücre kültürü kaputu T75 şişeler aktarmak ve hADSC en tripsin enzim sindirimi yöntemi kullanılarak askıya.
- Kaput, hücre dışı hücre kültür ortamının tüm aspire. Kalsiyum ve magnezyum (DPBS ++) ile Dulbecco'nun Fosfat-Tamponlu Salin, 5 ml ile durulayın. Hücrelerin kapalı DPBS ++ aspire.
- Kaputu birlikte, 1 ml tripsin ve 4 ml DPBS ++ karıştırılarak tripsin ve DPBS ++ bir çözeltisini yapmak. Her şişe, solut 5 ml gerektiririyonu, yani Birleşik kaplardan sayısı için uygun hacimde. Her balona tripsin / DPBS ++ 5 ml ekleyin ve 2 dakika süreyle inkübatör koyun.
- 2 dakika sonra, şişeler kaldırmak ve hafifçe dipleri hücreleri gevşetmek için onları kenarlarını hafifçe vurun. Hücreler askıya sağlamak için mikroskop altında her şişeye bak. Lütfen hücre kültürü kaputu şişeler yerleştirin ve her bir şişeye, uygun hücre kültür ortamının 3 ml ekleyin. Bu tripsin reaksiyon sona erer.
- Her balona hücre yüklü medyayı aktarın ve 50 ml'lik bir konik koymak. 5 dakika boyunca 1.000 xg'de onları santrifüj. Hücreler konik alt küçük beyaz pelet olarak görünmelidir. Geri hücre kültürü kaputu transfer ve medya aspire. Hücre kültür ortamı 2 ml tekrar süspansiyon hücreleri.
- Mikroskop altında Hemasitometre kullanarak hücreleri saymak. Hücreler sayılmış edildikten sonra, medya kültürü kaputu, kısım miktarı ~ 1.3 millio içerenn hücreleri ve 15 ml konik transfer. Santrifüj 1000 x g'de 5 dakika boyunca tekrar hücreleri ihtiva eden 15 ml'lik konik.
- Kültür kaput, her şişeye ~ 350,000 hücrelik bir konsantrasyon ilave, çok sayıda T-75 şişelerinde kalan hücreleri reseed. DMEM medya 15 ml ekleyin ve tekrar birbirine karışana kadar inkübatör dönmek.
- Santrifüj işlemi tamamlandıktan sonra, hücre kültürüne 15 ml konik döner. Hücre topağından ortamı aspire ve genellikle çözelti terteriating, bioink mililitresi başına 1.300.000 hücre konsantrasyonunda sulu aljinat çözeltisi içinde tekrar süspansiyon hücreleri, böylece bioink boyunca homojen bir hücreler dağılımı vardır. Steril yazıcı uyumlu 3 ml'lik enjektöre hücre yüklü bir çözüm yükleyin ve steril 22 G plastik ucunda vida.
5. Bioprinter Kur
- Bioprinter dağıtıcı bilgisayarların her ve FİLTRELİ açınSu banyosu ing.
- El ile jelleşme mekanizması için için sirkülasyon su banyosu sıcaklığını ayarlamak.
- Elle correlating dağıtıcı bilgisayardaki her dağıtıcı için baskı parametrelerini ayarlamak. 0 backsteps 230 nl, numaraya dağıtma seviyesini ayarlamak ve Dağıtım oranı -sec 10 ul için.
- Tasarım yazılımını ve bilgisayardaki USB kameranın görüntüsünü görüntülemek için programını açın.
- Yazılımını kullanarak, elle damlalar arasında 2,4 mm aralıklı 5 x 5 noktalı dizi için koordinatları girin.
- Olmak üzere baskı parametrelerini ayarlayın: ucu ucuna ve substrat yüzeyi arasındaki mesafe = 0.1 mm; Yükseklik şırınga yeminli arasında kaldırdı = 20 mm; çökelme başına geçen süre 1 sn =.
- Programı kaydedin ve robot göndermek.
- 4 ° C yazıcı sahnede jelatin / TiO 2 içeren Petri kabı yerleştirin. Kapatın ve bölme kapı kilidi.
- Ini için PLC kullanınultraviyole ışık kaynakları tialize ve 90 saniye boyunca odasını sterilize edin.
- Sterilizasyon işlemi tamamlandıktan sonra, odasına açın ve hADSC en Gun içine aljinat içinde süspanse 1. Kapat içeren şırınga yüklemek ve bölme kapı kilidi.
- Fan sistemi açmak denge, iç basınç için 30 saniye beklemek zorunda PLC kullanın.
- Bilgisayarda, geometrik yolu ve baskı parametreleri içeren programı çalıştırın.
- Baskı süreci boyunca, doğru ve düzgün bir baskı onaylamak için bilgisayardaki USB kameranın görüntüsünü izlemek.
- Baskı bittikten sonra, yapıları 40 dakika jel izin verir.
6. Hücre Canlılık Değerlendirmesi
- Görüntüleme zamanına kadar inkübatör hemen DMEM sonrası baskı ve mağaza yansıması için gidiş değildir yapıları kapsamaktadır.
- Konstruktların canlılığını ölçmek için, bir flüoresan bazlı canlılığı / sitotoksisite tahlili kullanarak leke, birkonfokal mikroskopi kullanılarak nd görüntü.
- Kit talimatlarını izleyerek, kalsein AM ve ethidium homodimeri-1 içeren bir boyama solüsyon hazırlanır. , Boyama çözeltisi 10 ml yapmak etidyum homodimer-1 20 ul ve kalseinin 5 ul eklemek için steril 10 ml ben, doku kültürü dereceli Dulbecco'nun Fosfat-Tamponlu Tuzu (+ magnezyum + Kalsiyum; DPBS ++).
- Karanlıkta 15 dakika boyunca boyama çözeltisi içinde bioprinted yapıları bırakın.
- Görüntü günlerde 0 ve 8 de bir konfokal mikroskop sistemi kullanılarak boyandı yapılar 300 mikron derinliğinde üzerinde 30 optik dilim Z-yığın parametreleri kullanılarak, her bioprinted yapısının birden fazla fotoğraf çekin, elle hücreleri saymak. Hücreler, sarı veya kırmızı görünmesini ise yeşil bunları hayatta saymak ve eğer onları ölü sayılır.
- Yapının toplam hücre sayısına bölünmesi ile canlı hücre sayısı olarak hücre canlılığı yüzdesi hesaplanır; Hücre Canlılık = sayısıCanlı hücrelerin (yeşil + sarı) / toplam hücre sayısını (yeşil + kırmızı + sarı) x% 100.
- 0. günde hücre sayısı bölü günde 8 hücre sayısı olarak, her numune için, hücre çoğalması miktarını hesaplayın; Gün 8 / canlı hücreyi Hücre Çoğalması = canlı hücre sayımı günde 0 x% 100 güvenebilirsiniz.
7. RGD Peptide Konjugasyon Analizi
- Alginat RGD peptid konjugasyon başarısını analiz etmek için, RGD konjuge aljinat ve eşlenik olmayan aljinat karşılaştırın. ('6-diamidino-2-fenilindol, Dihydrochloride 4) kullanılarak (DAPI) ve phalloidin lekeleri bu görüntüyü basılı yapılar yapmak.
- DPBS ++ 200 ul metanolik stok çözeltisi 5 ul seyreltilmesi ile çalışma çözeltisi phalloidins sağlayın. Kullanılıncaya kadar -20 ° C'de saklayın.
- (0,10509 g / L) / (350,3 g / mol) = 3 × 10 -4 M = 0.0003 M = 0.300 mM = 300 uM: denklemin aşağıdaki DAPI leke 300 mcM stok solüsyonu olun. Th olune DAPI stok çözelti seyreltilerek 1 çalışma çözeltisi: ++ DPBS içinde 100 3 uM çözelti elde etmek için. Kullanılıncaya kadar -20 ° C'de saklayın.
- Tamamen% 4 paraformaldehid örneği daldırın. Oda sıcaklığında 1 saat süreyle inkübe edin. Çözelti 5 dakika, her yıkama için oturup izin DPBS ++ ile üç kez yıkayın. Sürecinde fazla jel çevirme, cam bir slayta kuyudan jel örnek aktarın. 10 dakika boyunca DPBS içinde% 0.1 Triton X-100 (0.1 g / 100 mi) ++ jel bırakın. Her yıkama için 5 dakika izin DPBS ++ ile üç kez yıkayın.
- Çalışma çözeltisi içine daldırılarak falloidinle baskılı yapıları Leke. Folyo ile kaplayın ve 4 saat süreyle inkübe edin. Phalloidin leke çıkarın ve DPBS ++ ile üç kez yıkayın. İlk yıkama ikincisi yıkar 5 dakika her biri için oturmalı, hızlı olmalıdır.
- DAPI hazır çözelti içine daldırılarak DAPI ile basılmış yapıları Leke. Folyo ile örtün ve oda sıcaklığında 30 dakika inkübe edilir. YıkamaHer bir yıkama sağlayan DPBS ++ ile üç kez 5 dakika boyunca dinlendirilir. Bir konfokal mikroskop sistemi üzerinde örnekleri gözlemleyin ve görüntü.
Sonuçlar
Sonuçlar bioprinter doğru belirli bir üç boyutlu yerle hücre yüklü hidroj biriktirilmesi ve sürekli olarak bilgisayar destekli yazılımı kullanılarak yeteneğine sahiptir göstermektedir. Bu yazılımlar her damla yerleşimini belirler ve (Şekil 3,4) dağıtmak için parametrelerin çoğunu kontrol eder. Uygun biyomalzemeleri yatırmak bioprinter tekrarlanabilirliği doku mühendisliği uygulamaları başarısı için esastır.
Hücre canlılığı, başarılı b...
Tartışmalar
Doku mühendisliği odak noktası, geri sürdürmek, ya da yerli doku functio geliştirme yeteneğine sahip biyolojik değiştirmeleri geliştirerek, organ sıkıntısı ve transplantasyon ihtiyaçları arasında köprü olmaktır. Bu iç Geometr üzerinde bir kompleks, anatomik olarak uygun dış geometri ve hassas kontrolü ile iskelelerinin doğrudan imalat yol açmıştır. Üç boyutlu bioprinting katman-katman approac kullanarak dijital model çeşitli boyut ve şekillerde üç boyutlu yapılar oluşturmak için k...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu çalışma Hibe No EPS-0903795 Ulusal Bilim Vakfı, NIH NIDCR R01-DE019355 (MJY PI) ve Grant 8P20 GM103444 (YM PI) tarafından verilen altında Hükümet Desteği ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
Referanslar
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır