Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Lebensfähigkeit Bioprinted Cellular Konstrukte unter Verwendung einer Drei Dispenser kartesischen Drucker
In diesem Artikel
Zusammenfassung
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Zusammenfassung
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Einleitung
Tissue Engineering nutzt die Prinzipien der Biologie und Technik in der Entwicklung von Funktionsersatz zu erhalten, wiederherzustellen oder zu verbessern nativem Gewebe und. Die Fähigkeit zur Erzeugung von dreidimensionalen biomimetischen Konstrukte auf Anforderung würde wissenschaftliche und technologische Fortschritte in der Gewebetechnik sowie in zellbasierten Sensoren Arzneimittel / Toxizitäts, Gewebe- oder Tumormodellen, und andere zu erleichtern. Die dreidimensionale Organisation des Tissue-Engineering Konstrukten ist ein wesentlicher Bestandteil des Herstellungsverfahrens, da es eng die hoch organisierten Wechselwirkung von Zellen und extrazellulärer Matrix in nativem Gewebe nachahmen.
Biologisch abbaubar und formgebenden dreidimensionalen Gerüsten sind entscheidende Faktoren bei der Erzeugung von neuen Gewebekonstrukte, da die Zellen wandern, um eine zweidimensionale Schicht von Zellen zu bilden, aber die Fähigkeit fehlt, in bevorzugten dreidimensionalen wachsen. Das Gerüst dient als Grundlage für die vorübergehende Zellund die Zellenproliferation, also muss es aus Materialien mit steuerbarer Porosität und biologische Abbaubarkeit und eine ausreichende mechanische integrit konstruiert werden. Die Trägermaterialien sollten nicht zytotoxisch sein, oder erstellen Sie einen negativen Antwort vom Host. Hydrogele wurden häufig in Tissue Engineering-Techniken verwendet werden, und aufgrund ihrer Hydrophilie ermöglichen Hydrogele Flüssigkeits- und Gasaustausch im ganzen Structur. Durch die Kombination verschiedener Hydrogele, sind die Eigenschaften des synthetisierten Hydrogels modifizierbaren um verschiedene Anwendungsanforderungen zu erfüllen.
Die herkömmliche Tissue-Engineering-Ansatz beinhaltet die Schaffung von azellulären poröse Opfergerüste, die mit Zellen post-fabricatio ausgesät werden. Viele Techniken verwendet worden, wie beispielsweise Faserbindung, Lösungsmittelgießen und Schmelzformen, doch erwies sich minimal erfolgreich für das Tissue Engineering-Anwendungen zu sein. Faserbindungsverfahren ermöglichen Fasern in bestimmten Formen ausgerichtet werden, aber sie sind nur in der Lage, pro sindGabe sehr dünnen Gerüst. Lösungsmittel-Gießverfahren hergestellte hochporöse Konstrukte jedoch die größte hergestellte Membran war nur 3 mm thic. Daher schaffen dreidimensionale Konstrukte nicht möglich ist die Verwendung dieser Techniken. Schmelzformungstechniken bewährt bei der Herstellung von dreidimensionalen Gerüsten, aber solch hohe Temperaturen erforderlich, dass biologische Materialien nicht in den Fertigungsprozess integriert werden. Gerüste ausgesät nach der Herstellung sind in ihrer Fähigkeit, die Anforderungen des Tissue Engineering zu treffen, um dreidimensionalen Gerüsten mit vordefinierten oder steuerbare Mikrostrukturen und produzieren begrenzt. Ein weiteres wichtiges Thema mit soliden Gerüst Aussaat Technologien ist der Mangel an Durchblutung und schlechte mechanische.
Bioprinting seitdem auf drei Dimensionen durch die Verwendung von nicht-toxischen, biologisch abbaubaren, thermoreversible Gele, die Nachteile des herkömmlichen überwunden erweitert. Ein paar von den festen Freiform-Herstellungs techniques derzeit verwendet werden, sind die lasergestützte Bioprinting und Inkjet-Druck. Lasergestütztes Bioprinting Techniken verwenden eine gepulste Laserquelle, einer Zielplatte, und einem Empfangssubstrat zu erzeugen dreidimensional. Jedoch ist diese Technik aufgrund der geringen Durchsatz, geringe Lebensfähigkeit der Zellen beschränkt und kann nur begrenzte erzeugen Anordnungen gefertigten Strukturen, da nur photovernetzbaren Prepolymere verwendet werden können, um ein vernetztes Hydrogel zu bilden. Tintenstrahldruck wurde als berührungslose Methode, die digitalen Bilddaten auf einem Substrat durch Abscheidung wieder Picoliter Tinte entwickelt. Jedoch Tintenstrahldruck nicht ein hochauflösendes Konstrukt zu erzeugen, konstruiert Erfahrung rasche Denaturierung des Proteins, und viele der Zellen während der Abscheidung lysiert.
Derzeit neue Additive Manufacturing Bioprinting Methoden entwickelt worden. In diesen Systemen Zellen, Proteinen, Wachstumsfaktoren und biomimetische Hydrogele werden typischerweise in Matrix mater integriertenrialien während des Herstellungsprozesses und mit computergesteuerten Aktoren an dreidimensionalen Gerüst-basierte Zellbeladene Konstrukte, die die Mikroarchitektur des nativen genau imitieren erzeugen gleichzeitig abgeschieden. Die zellbeladenen Hydrogele bilden die bioink, die heterogen sein kann, die aus mehreren Zelltypen oder homogen. Additiv Fertigungssysteme Ablagerung bioink Tropfen für Tropfen oder Schicht-für-Schicht durch Einmalspritzen und Spitzen auf einem computergesteuerten Bühne bewegen kann, in der x, y und z-Richtungen. Durch Computer-Software, kann die Architektur der gedruckten Gerüste leicht manipuliert werden je nach Anforderung der Anwendung. Im Gegensatz zu herkömmlichen Techniken kann dreidimensionalen medizinischen Technologien (Magnetresonanztomographie, Computertomographie) in den Designs integriert werden, Erzeugen der patientenspezifischen Konstrukt. Diese Verfahren die Möglichkeit der Herstellung vaskularisierten Ersatz erlauben auch, weil Konstrukte werden mit einer höheren l hergestelltocal Zelldichte, wodurch Zell-Zell-Interaktionen und die Verbesserung der Wahrscheinlichkeit nach der Implantation Surviva.
Der Palmetto Printer ist ein speziell angefertigten dreidimensionalen Multi-Spendersystem, das programmierbare Roboter-Fertigungsverfahren verwendet, um dreidimensionale heterogene Gewebekonstrukte (Abbildung 1) zu erzeugen. Sie ermöglicht die Verwendung einer Vielzahl von Materialien in einer einzigartigen Kombination an heterogene Strukturen herzustellen. Die Initialisierung des bioprinter ist einer der wichtigsten Schritte bei der Bioprinting weil es Ihnen erlaubt, eine Vielzahl von Parametern, um die Bedruckbarkeit der bioprinted Konstrukte zu optimieren.
Die bioprinter umfasst einen Chargenprozess mit Inbetriebnahme, Betrieb und Abfahren Sequenzen durch eine speicherprogrammierbare Steuerung (SPS), die der Nutzer durch eine interaktive Touchscreen-Bedienfeld arbeitet (Abbildung 1, A) gesteuert. Um eine Verunreinigung von Bio verhindernlogische Materialien der bioprinter ist in einem positiv-Druck von Poly (methylmethacrylat) eingeschlossen (PMMA) Kammer mit einer Hocheffizienzpartikelrückhaltevermögen (HEPA) -filtered Luftzirkulationssystem (1, B, C). Das Innere des Druckers unter Verwendung der integrierten UV-Lichtquellen (1, D) zu sterilisieren. Die zentrale Komponente des bioprinter ist eine voll programmierbare Positionierung Roboter, der reproduzierbar platzieren können eine Spenderspitze mit einer Genauigkeit von 10 Mikrometern (Abbildung 1, E). Es gibt drei Abgabevorrichtungen, die in der Lage, Volumen so klein wie 230 nl Rotationsschraube (1, F) hinterlegen. Sie sind unabhängig programmierbare Verwendung separater Computer, Druckparameter regeln für jede Abgabevorrichtung (1, G). Drehschneckeabgabe nutzt die Drehbewegung eines Motors angetriebene Schnecke nach unten einer Spritze aus der Spritzenspitze bewegen bioink. Diese Spender werden auf eine pneumatische montiertly gesteuerten Bearbeitungskopf (2A, B), so dass der Roboter Zufuhr auf die Z-Achsen-Roboterarm unter Programmsteuerung (1, H) montiert zu schalten.
Die XYZ-Roboter empfängt Druckanweisungen von einem Computer-Design-Software (Abbildung 1, I). Jedes Programm enthält Abgabestellen, Kalibrierungsroutinen und Spender wechselnden Protokolle. Das Design der generierten Konstrukte besteht im Wesentlichen aus den XYZ-Koordinaten, wo jedes Spenders wird Material zu hinterlegen. Die bioprinter zwei optische Lichtsensoren (2C), die bestimmen, die XYZ-Koordinaten des Spritzenspitzenende. Diese Sensoren senden Koordinateninformationen an den Roboter, die diese verwendet, um Positionen der Spender Spitzenenden zu berechnen. Es wird eine zusätzliche Verschiebung Laser (2D), das eine 633 nm-Diode roten Laserstrahl der Punktgröße Projekte 30 x 100 Mikrometer, um Abstand mit einem Accura messency von 0,1 Mikrometern. Wenn der Strahl hoch konzentriert sich der Roboter bestimmt den Z-Abstand der Druckfläche. Diese Messung und die optische Lichtsensoren Messung des Spitzenendes in Z, erlaubt die Berechnung von genauen z-Koordinaten verwendet, um die Spenderspitze in Bezug auf die Druckoberfläche zu platzieren. Die Dispenser-Spitzen seitlich und vertikal zu bewegen durch die orientierte X-Achsen-optischen Lichtsensor, um die Y- und Z-Zentren zu finden, und sich seitlich durch einen Y-Achsen-Sensor, um die Mitte der X-Achse zu finden. Ax + by + cz = d zu bestimmen, wo die Oberfläche relativ zu der Position der Ausgabespitzenende ist: die Druckoberfläche wird unter Verwendung der Formel für eine flache Ebene im XYZ-Raum abgebildet. Der Drucker Stufe (1, J) enthält eine Proben-Petrischale bis zu 80 mm im Durchmesser und verwendet einen rezirkulierenden Wasserbades, um die Solltemperatur (1, K) zu erhalten. Bühnentemperatur kann in einem Bereich von -20 eingestellt werden und bleibt im Stall. Es gibt eine USB-Kamera montiertauf den Roboter Z-Arm, um eine vergrößerte Ansicht der Abgabespitze während des Druckprozesses (1, L) zu liefern. Es gibt eine zweite Kamera auf der Oberseite des Kammerinneren, die eine vollständige Ansicht des bioprinter während des Druckprozesses (Abbildung 1, L) bietet montiert.
Ein Computer-Aided-Design-Zeichensoftware bestimmt die Ablagerungsmuster und erlaubt es dem Benutzer, inkremental beabstandeten Tröpfchen und komplexen Strukturen (Figur 3) zu erzeugen. Dreidimensionale Wege können manuell in den Drucker-kompatible Design-Software codiert oder von einem separaten Computer-Aided Design Zeichensoftware (Abbildung 4, Tabelle 1) importiert werden. Der Drucker entwickelte Software Variationen von Druckparametern, wie beispielsweise der Niederschlagsverfahren (Einzeltröpfchenabscheidung oder kontinuierlichen Weg deposition), dreidimensionale Geometrie der Signalwege, Abscheidungsrate, der Abstand zwischen der Spitze der Spritze Ende und substRate Druckoberfläche, die Höhe der Zeit, eine individuelle Tropfen, und die Höhe zu hinterlegen und zu beschleunigen, die Spritze zwischen Abscheidung der Tropfen gehoben. Jedes Programm enthält XYZ Abgabestellen, Spitzenkalibrierungsroutinen und Spender wechselnden Protokolle, um eine sterile Umgebung während des Druckvorgangs zu schaffen, ohne Bedienereingriff. Die speicherprogrammierbare Steuerung (SPS) des Roboters empfängt Anweisungen von dem Computer mit der Design-Software und die Zeitsteuerung von Ereignissen von der externen Controller (beispielsweise die Abgabevorrichtungen). Um dies zu tun, verwendet die Steuerung eine Schleifenmechanismus, um die Abgabevorrichtungen zu steuern , Roboter-Positionierungseinrichtung und Umweltfaktoren.
Dreidimensionale Direktschreib Bioprinting Verwendung eines Rotationsschnecken, flüssige Abgabesystem ermöglicht, den Prozess der Abscheidung Zellen effizienter zu sein, genau und einfacher als bisherige Verfahren. Diese Studie zeigt, die angefertigten bioprinter der Lage ist, cell beladene Hydrogel-Konstrukte mit hoher Zelllebensfähigkeit.
Protokoll
1. Herstellung von gelatinehaltigen Substrat für dreidimensionale Bioprinting von Alginat Hydrogele
- Bereiten Sie das Calcium / Gelatine-Substrat nach der von Pataky et al 11 beschrieben, um reduzierten Lebensfähigkeit mit einem hohen Gehalt assoziiert zu vermeiden Calcium / Gelatine-Substrat-Methode. Das Calcium / Gelatinesubstratverfahren ist unten aufgeführt.
- Kombinieren Calciumchlorid-Dihydrat (1,5 Gew%), Natriumchlorid (0,9 Gew%) und Schweinegelatine (2 Gew%) in destilliertem Wasser und kochen für 2 Minuten, um eine 100 mM Gelatinelösung zu erstellen.
- Gießen Sie 5 ml der Gelatine / Calcium-Lösung in 100 mm-Standardpetrischalen, schwenken Sie die Lösung um, um eine gleichmäßige Beschichtung auf der Oberfläche, und auf einer ebenen Fläche im Kühlschrank gelieren O / N (lassen gelieren mindestens 8 h vor der Verwendung).
- Um die Deckkraft der Substratoberfläche zu erhöhen, fügen Titandioxid (0,3 Gew%) zu der Gelatine / CaCl 2 -Lösung. Rühre 10 Minuten. Autoclave die Gelatine / TiO & sub2; -Lösung auf den Flüssigkeitskreislauf 30 min, um es zu sterilisieren.
- 3 ml der Gelatine / TiO 2 Lösung auf die Oberfläche der zuvor hergestellten Gelatineplatten. Das Gemisch wird gerührt, um sicherzustellen, dass es gleichmäßig über die Oberfläche verteilt wird. Gestatten, in 4ºC Kühlschrank O-Gel / N (erlauben, mindestens 8 Stunden vor der Verwendung Gel). Die Untergründe müssen innerhalb von 3 Tagen verwendet werden.
2. Alginate Oxidation
- Oxidieren das Natriumalginat bioink folgenden das Verfahren zum teilweise oxidierten Alginat Bouhadir et al 30 unten beschrieben.
- Um eine 5% oxidierte Alginat-Lösung zu machen, lösen sich 1 g Natriumalginat in 100 ml destilliertem Wasser. Hinzufügen einer wässrigen Lösung von Natriumperiodat (0,25 M, 0,25 mmol), das Oxidationsmittel, um eine 5% Oxidationslösung herzustellen. Rühre 19 Stunden bei Raumtemperatur. In 40 ml Ethylenglykol zu der Lösung nach 24 Stunden, um die rea beendenction.
- Aufzulösen 2,5 g Natriumchlorid in der Lösung. Fügen Sie eine überschüssige Menge an Ethylalkohol (Verhältnis 2: 1), um die oxidierten Alginate auszufällen. Zentrifugieren Sie die Lösung bei 1000 · g, um die Niederschläge zu sammeln und wieder auflösen in destilliertem Wasser. Wiederholen Sie den Ethanol waschen.
- Gefrierzutrocknen die oxidierte Alginat-Pellets und bei -20 ° C bis zur Verwendung.
- Bestimmen den Grad der Oxidation durch Messen des Prozentsatzes Natriumperiodat, bevor sie vom Ethylenglycol beendet verbraucht.
- Vorbereitung einer Kaliumiodid-Lösung (20% w / v, pH 7,0, Natriumphosphat-Puffer) und einem thyodene Lösung (10% w / v, pH 7,0 Natriumphosphatpuffer). Vermischt die beiden Lösungen mit dem oxidierten Alginats bei RT.
- Allmählich ab der reagierten Alginat und Natriumperiodat-Lösung zu der Mischung aus Kaliumiodid und theodyne Lösungen. Die Extinktion des Gemisches spektrophotometrisch bei 426 nm. Wenn es erreicht hat, einmaximale, notieren Sie die verwendeten Volumen von Alginat und Natriumperiodat-Lösung als V 1.
- Die Reaktion
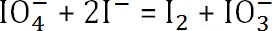 . Die Menge an nicht umgesetztem Natriumperiodat
. Die Menge an nicht umgesetztem Natriumperiodat 
- Subtrahieren der Menge an nicht umgesetztem Natriumperiodat von der ursprünglichen Konzentration, die Menge an Natriumperiodat verbraucht bestimmen. Verwendung der vorherigen Formel, bestimmen die endgültigen Oxidationsgrad des Alginats.
3. Alginate Peptidkonjugation
- Konjugat-Liganden mit einem freiliegenden Arginin-Glycin-Aspartat Sequenz (Peptid) in die zuvor hergestellte oxidierte Alginat durch Befolgen des RGD-Alginat Konjugationsmethode von Rowley et al 31 nachfolgend beschrieben, um die Zellhaftung und die Verbreitung zu fördern.
- Verwenden wässrigen carbodiimide Chemie mit G 4 RGDSPto Konjugat 31.
- Man löst 1 g 5% oxidierte Alginat in einer 0,1 M 2- (N-Morpholino) ethansulfonsäure (MES) -Puffer, pH = 4. 1-Ethyl (dimethylaminopropyl) carbodiimid (EDC, 0,54 mmol) und N-Hydroxysuccinimid ( NHS, 0,27 mmol) in 2: 1-Verhältnis zu bilden Amidzwischenprodukt.
- Hinzufügen 0,28 mmol Peptids Koppeln mit dem Rückgrat des Alginatpolymer über den Anschluß Amin. Es wird bei RT O / N.
- Stoppen der Kupplungsreaktion durch Zusatz von 2,5 g Natriumchlorid zu der Lösung. Fügen Sie eine überschüssige Menge an Ethylalkohol (Verhältnis 2: 1), um die oxidierten Alginate auszufällen. Zentrifugieren der Mischung bei 4.000 xg für 5 min, um die Niederschläge zu sammeln. Aspirieren, die Medien in der Zellkultur Haube und Wiederauflösung des Niederschlags in destilliertem Wasser. Wiederholen Sie den Ethanol waschen.
- Gefrierzutrocknen der Niederschläge, bis es vollständig getrocknet ist (wird als eine weiße pulvrige Substanz erscheinen) und speichert in der -20 ° C Kühlschrank für späterbenutzen.
4. humanem Fettgewebe Stromazellen (hADSC ist) Zellkultur
- Kultur humanem Fettgewebe Stromazellen (hADSC ist) in 75 cm behandelten Zellkulturflaschen (T75-Flaschen), mit 15 ml low glucose DMEM mit 10% fötalem Rinderserum und 1% Penicillin-Streptomycin, 1% Glutamin und 1% Antimycin bedeckt. Ändern Sie den Medien, in der Zellkultur Kapuze, alle zwei Tage, bis sie Konfluenz (80-90%) erreicht zu haben.
- Sobald konfluent, übertragen Sie die T75-Kolben zu der Zellkultur Kapuze und Aussetzung der hADSC die Verwendung des Trypsin Enzymverdau Methode.
- In der Haube, saugen die gesamte Zellkulturmedien aus der Zellen. Spülen mit 5 ml Dulbecco-phosphatgepufferter Kochsalzlösung mit Calcium und Magnesium (DPBS ++). Saugen Sie das DPBS ++ Aus der Zellen.
- Während in der Haube, stellen eine Lösung von Trypsin und DPBS ++ durch Mischen von 1 ml Trypsin und 4 ml DPBS ++. Jeder Kolben erfordert 5 ml der SolutIonen, so stellen Sie das entsprechende Volumen für die Anzahl der konfluenten Kolben. 5 ml Trypsin / DPBS ++ zu jedem Kolben und steckte sie in den Inkubator für 2 min.
- Nach 2 min, entfernen Sie die Flaschen und leicht auf die Seiten von ihnen, um die Zellen von den Böden lockern. Schauen Sie sich jeden Kolben unter einem Mikroskop, um sicherzustellen, die Zellen suspendiert sind. Setzen Sie die Kolben zurück in die Zellkultur Kapuze und 3 ml der entsprechenden Zellkulturmedien zu jedem Kolben. Damit endet die Trypsin-Reaktion.
- Übertragen Sie die zellhaltige Medien aus jedem Kolben und in einem 50 ml konischen setzen. Zentrifugieren bei 1.000 xg für 5 min. Die Zellen sollten als kleine weiße Pellet in der Unterseite des konischen angezeigt. Transfer zurück zum Zellkultur Kapuze und saugen Sie den Medien. Resuspendieren der Zellen in 2 ml von Zellkulturmedien.
- Zähle die Zellen unter Verwendung eines Hämozytometers unter dem Mikroskop. Sobald die Zellen gezählt worden sind, in der Kultur Haube, aliquoten die Menge der Medien, die ~ 1,3 million-Zellen und in ein konisches 15 ml. Zentrifuge mit 15 ml konischen den Zellen erneut für 5 min bei 1.000 x g.
- In der Kultur Haube, reseed die restlichen Zellen in mehreren T-75-Kolben, Hinzufügen einer Konzentration von ~ 350.000 Zellen in jeden Kolben. 15 ml DMEM-Medium und zum Brutschrank bis zur Konfluenz wieder.
- Sobald die Zentrifuge Zyklus abgeschlossen ist, geben die 15-ml-Erlen zu der Zellkultur. Saugt den Medien von dem Zellpellet, und Resuspendieren der Zellen in wässrigen Natriumalginatlösung mit einer Konzentration von 1,3 Millionen Zellen pro Milliliter bioink, terteriating der Lösung oft so eine homogene Verteilung der Zellen über die bioink. Laden Sie die zellbeladenen Lösung in einem sterilen Drucker-kompatible 3-ml-Spritze und schrauben Sie die sterile 22 G Spitze aus Kunststoff.
5. Bioprinter Setup-
- Einschalten des bioprinter, wobei jeder der Spender-Computer und dem recirculating Wasserbad.
- Manuelles Setzen des Umlaufwasserbadtemperatur bis zur Gelierung Mechanismus.
- Druckparameter für jeden Spender auf der korrelierenden Spender Computer manuell einstellen. Stellen Sie den Abgabevolumen auf 230 nl, die Anzahl der Rückschritte auf 0, und die Abgabegeschwindigkeit um 10 ul -sec.
- Öffnen Sie die Design-Software und das Programm für die Anzeige der USB-Kamera-Anzeige auf dem Computer.
- Mit der Software manuell eingeben die Koordinaten für eine 5 x 5 Punkt-Array mit 2,4 mm Abstand zwischen den Tropfen.
- Stellen Sie die Druckparameter zu sein: Abstand zwischen Kopfende und Substratoberfläche = 0,1 mm; Höhen Spritze zwischen Abscheidungen angehoben = 20 mm; die Zeitdauer pro Abscheidungs = 1 Sek.
- Speichern Sie das Programm und senden Sie es an den Roboter.
- Legen Sie die Gelatine / TiO 2 -haltigen Petrischale auf der 4 ° C Druckstufe. Schließen und verriegeln Sie die Kammertür.
- Verwenden Sie den PLC INItialize die ultravioletten Lichtquellen und Sterilisieren der Kammer 90 sec.
- Nach der Sterilisation abgeschlossen ist, öffnen Sie die Kammer und laden Sie die Spritze mit hADSC in Alginat in Gun suspendiert 1. Schließen und verriegeln Sie die Kammertür.
- Verwenden Sie die SPS auf dem Lüftersystem drehen, warten Sie 30 Sekunden für das Gleichgewicht Innendruck.
- Auf dem Computer, starten Sie das Programm die geometrischen Weg und Druckparameter enthält.
- Während des gesamten Druckprozess, beobachten Sie die USB-Kamera-Anzeige auf dem Computer, um eine genaue und gleichmäßige Druck bestätigen.
- Wenn der Druckvorgang beendet ist, ermöglichen die Konstrukte, um für 40 Minuten gelieren.
6. Zellrentabilitätsbewertung
- Decken Sie die Konstrukte, die nicht gehen, um sofort nach dem Drucken in DMEM und Speicher in den Inkubator abgebildet werden bis zum Zeitpunkt der Bildgebung.
- Um die Überlebensfähigkeit der Konstrukte zu quantifizieren, färben sie unter Verwendung eines Fluoreszenz-basierten Lebensfähigkeit / Zytotoxizitätstest einnd Bild mit Hilfe der konfokalen Mikroskopie.
- Im Anschluss an die Set Anweisungen, bereiten eine Färbelösung, enthaltend Calcein AM und Ethidiumhomodimer-1. Zu 10 ml Farblösung zu machen, fügen Sie 20 ul der Ethidiumhomodimer-1 und 5 ul der Calcein AM zu 10 ml sterilem, Gewebekultur-grade Dulbeccos phosphatgepufferter Salzlösung (+ Magnesium + Calcium; DPBS ++).
- Eintauchen bioprinted Konstrukte im Färbelösung für 15 Minuten im Dunkeln.
- Bild die gefärbten Konstrukte mit einem konfokalen Mikroskop-System an den Tagen 0 und 8. Nehmen Sie mehrere Bilder der einzelnen bioprinted Konstrukt unter Verwendung von Z-Stapel-Parameter der 30 optischen Scheiben über einen 300 & mgr; m Tiefe, und die Zellen manuell zu zählen. Wenn Zellen, gelb oder grün erscheinen, zählen sie als lebendig, und wenn rot, zählen sie wie tot.
- Berechnen die Lebensfähigkeit der Zellen in Prozent als die Anzahl der lebenden Zellen, geteilt durch die Gesamtzahl der Zellen in dem Konstrukt; Die Lebensfähigkeit der Zellen = Anzahl derlebenden Zellen (grün + gelb) / Gesamtzahl der Zellen (grün + gelb + rot) x 100%.
- Berechnung der Menge der Zellproliferation für jede Probe als die Zellzahl von Tag 8 geteilt durch die Anzahl von Zellen am Tag 0; Cell Proliferation = Live Zellzahl an Tag 8 / Live-Zellzahl an Tag 0 x 100%.
7. RGD-Peptid Konjugation Analysis
- Um den Erfolg der RGD-Peptid-Konjugation auf dem Alginat analysieren, die RGD-konjugiertes Alginat und nichtkonjugierten Alginat. Um dies zu Bild die gedruckten Konstrukte der Arbeit (4 ', 6-Diamidino-2-phenylindol, Dihydrochloride) (DAPI) und Phalloidin Flecken.
- Nehmen Sie die phalloidins Arbeitslösung durch Verdünnen von 5 ul der methanolischen Stammlösung mit 200 ul DPBS ++. Lagerung bei -20 ° C bis zur Verwendung.
- Machen Sie eine 300 & mgr; M Stammlösung des DAPI-Färbung nach der Gleichung: (0,10509 g / L) / (350,3 g / mol) = 3 × 10 -4 M = 0,0003 M = 0,300 mm = 300 & mgr; M. Machen the DAPI Arbeitslösung durch Verdünnen der Stammlösung 1: 100 in DPBS ++ bis 3 & mgr; M Lösung zu erhalten. Lagerung bei -20 ° C bis zur Verwendung.
- Vollständig bedeckt die Probe in 4% Paraformaldehyd. Inkubieren für 1 h bei RT. Dreimal mit DPBS ++ waschen, man die Lösung für 5 min bei jedem Wasch sitzen. Übertragen Sie die Gel-Probe aus dem Brunnen auf einen Objektträger aus Glas, Spiegeln das Gel über in den Prozess. Tauchen des Gels in 0,1% Triton X-100 (0,1 g / 100 ml) in DPBS ++ für 10 min. Dreimal mit DPBS ++ waschen, so dass 5 Minuten für jeden Wasch.
- Färben die gedruckte Konstrukte mit Phalloidin von in der Arbeitslösung eingetaucht werden. Mit Folie abdecken und Inkubation für 4 Stunden. Entfernen Sie die Phalloidin-Färbung und dreimal mit DPBS ++. Die erste Wäsche sollte schnell sein, letztere Wäschen sollte für jede 5 Minuten sitzen.
- Färben die gedruckte Konstrukte mit DAPI von in der DAPI-Arbeitslösung eingetaucht werden. Mit Folie abdecken und inkubieren Sie bei Raumtemperatur 30 min. Washdreimal mit DPBS ++, so dass jeder zu waschen, um für 5 Minuten sitzen. Beobachten Sie und Bild der Proben auf einem konfokalen Mikroskop-System.
Ergebnisse
Die Ergebnisse zeigen, das in der Lage ist bioprinter Abscheiden zellbeladene Hydrogele in spezifische dreidimensionale Positionen genau und konsistent mit Computer-Aided-Software ist. Diese Software bestimmt die Platzierung jedes Tröpfchens und steuern viele der Parameter für die Abgabe (Figur 3,4). Die Wiederholbarkeit des bioprinter angemessen abzuscheiden Biomaterialien ist grundlegend für den Erfolg in Tissue Engineering-Anwendungen.
Lebensfähigkeit der Zellen, eine...
Diskussion
Der primäre Fokus des Tissue Engineering ist es, die Lücke zwischen Organmangel und Transplantation Bedürfnisse durch die Entwicklung von biologischen Ersatzstoffe zur Wiederherstellung, Erhaltung oder Verbesserung der nativen Gewebe functio brücken. Dies hat zur direkten Herstellung von Gerüsten mit einem komplexen, anatomisch korrekte Außengeometrie und eine genaue Kontrolle über den internen geometr geführt. Dreidimensionale Bioprinting ist eine Methode zur Erzeugung von dreidimensionalen Konstrukte in versch...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde durch Unterstützung der Regierung unter Grant No EPS-0903795 von der National Science Foundation, NIH NIDCR R01-DE019355 (MJY PI), und Grant 8P20 GM103444 (YM PI) ausgezeichnet unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
Referenzen
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten