È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Viabilità di Bioprinted cellulari Costruisce Utilizzando un dispenser stampante cartesiana Tre
In questo articolo
Riepilogo
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Abstract
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Introduzione
L'ingegneria dei tessuti utilizza i principi della biologia e ingegneria nello sviluppo di sostituti funzionali a mantenere, ripristinare o migliorare tessuto nativo e. La capacità di generare costrutti biomimetici tridimensionali su richiesta faciliterebbe progressi scientifici e tecnologici in ingegneria dei tessuti, così come nei sensori basati su celle, droga / proiezione tossicità, modelli di tessuto o di tumore, e altri. L'organizzazione tridimensionale dei costrutti tissutale è un componente fondamentale del metodo di fabbricazione perché deve strettamente mimare l'interazione altamente organizzato di cellule e matrice extracellulare in tessuto nativo.
Scaffold tridimensionali biodegradabili e di forma che formano sono fattori critici nel generare nuovi costrutti di tessuto perché le cellule migrano per formare uno strato bidimensionale di celle, ma non hanno la capacità di crescere in favorita tridimensionale. L'impalcatura serve come base temporanea per cellulareattaccamento e la proliferazione, quindi deve essere costruito con materiali porosi controllabile e biodegradabilità, e sufficiente integrit meccanica. I materiali scaffold non dovrebbero essere citotossici o creare una risposta avversa dall'host. Gli idrogel sono stati comunemente usati nelle tecniche di ingegneria tissutale, e per la loro idrofilia, gli idrogel consentire scambio fluido e gas in tutta la structur. Grazie alla combinazione di diverse idrogeli, le proprietà del idrogel sintetizzato sono modificabili per soddisfare le richieste di applicazione distinti.
L'approccio di ingegneria tissutale convenzionale prevede la creazione di acellulari scaffold sacrificali porosi che sono seminati con cellule post-fabricatio. Sono state impiegate molte tecniche, come ad esempio la fibra bonding, colata di solvente, e fondere stampaggio, ma rivelato minimamente successo per applicazioni di ingegneria tissutale. Metodi leganti di fibre consentono di fibre da allineare in forme specifiche, ma sono solo in grado di produrre patibolo molto sottile. Metodi di fusione di solventi prodotte costrutti altamente porosi, tuttavia la membrana più grande prodotto è stato solo 3 mm thic. Pertanto, la creazione costrutti tridimensionali non è possibile utilizzando queste tecniche. Tecniche di stampaggio Melt rivelate efficaci nel produrre scaffold tridimensionali, ma tali temperature elevate, sono necessari materiali biologici non possono essere utilizzati nel procedimento di produzione. Ponteggi seminate post-fabbricazione sono limitate nella loro capacità di soddisfare i requisiti di ingegneria dei tessuti per la produzione di scaffold tridimensionali con microstrutture predefinite o controllabili e. Un altro grosso problema con le tecnologie impalcatura seeding solidi è la carenza di vascolarizzazione e poveri meccanico.
Bioprinting è stata estesa a tre dimensioni attraverso l'uso di,, gel termo-reversibile biodegradabili atossici per superare gli svantaggi della convenzionale. Alcuni del solido a forma libera fabbricazione techniques attualmente in fase di impiegati sono bioprinting ea getto d'inchiostro di stampa laser assistita. Tecniche bioprinting laser assistita utilizzano una sorgente laser impulsata, piastra segnale, e un substrato di ricezione per generare tridimensionale. Tuttavia, questa tecnica è limitata a causa della bassa produttività, bassa vitalità cellulare, e può produrre solo disposizioni limitate di strutture fabbricate perché solo prepolimeri photocrosslinkable possono essere utilizzati per formare un idrogel reticolato. Stampa a getto d'inchiostro è stato sviluppato come un metodo senza contatto che riproduce i dati di immagine digitali su un substrato depositando inchiostro picolitri. Tuttavia, la stampa a getto d'inchiostro non produce un'alta risoluzione costrutto, costruisce esperienza rapida denaturazione proteica, e molte delle cellule sono lisati durante la deposizione.
Attualmente, sono stati sviluppati nuovi metodi di produzione di additivi bioprinting. In questi sistemi cellule, proteine, fattori di crescita e idrogel biomimetici sono tipicamente integrati in mater matriceIALS durante il processo di fabbricazione e contestualmente depositata tramite attuatori controllati dal computer per generare costrutti cellulari carichi basati impalcatura-tridimensionali che imitano da vicino la microarchitettura di natale. Gli idrogeli cellule cariche costituiscono il bioink, che può essere eterogenea, costituita da più tipi di cellule, o omogenea. Additivo sistemi produttivi deposito bioink goccia a goccia o layer-by-layer con siringhe monouso e suggerimenti su una fase controllata da computer in grado di muoversi nelle direzioni x, ye z. Attraverso software, l'architettura di scaffold stampati può essere facilmente manipolato a seconda delle esigenze dell'applicazione. A differenza delle tecniche tradizionali, tecnologie mediche tridimensionali (risonanza magnetica per immagini, tomografia computerizzata) possono essere incorporati nei disegni, generando costrutto paziente-specifici. Questi metodi consentono anche la possibilità di produrre sostituzioni vascolarizzati perché costrutti sono prodotti con un più alto ldensità cellulare Ocal, permettendo interazioni cellula-cellula e migliorare la probabilità di post-impianto Surviva.
La stampante Palmetto è personalizzato costruito un sistema multi-dispenser tridimensionale che utilizza metodi di fabbricazione robotizzati programmabili per generare costrutti eterogenei tessuto tridimensionale (Figura 1). Esso consente l'utilizzo di una pluralità di materiali in combinazioni uniche per produrre strutture eterogenee. L'inizializzazione del bioprinter è uno dei passi più importanti nella bioprinting perché permette di impostare una serie di parametri per ottimizzare la stampabilità dei costrutti bioprinted.
Il bioprinter comprende un processo di tipo batch con avvio, uso e arresto sequenze controllati da un controllore logico programmabile (PLC), che l'utente opera attraverso un pannello di controllo touch screen interattivo (Figura 1, A). Per impedire la contaminazione biomateriali logici il bioprinter è racchiuso in un poli positivo-pressione (metilmetacrilato) (PMMA) camera con un arrestance particelle ad alta efficienza (HEPA) -filtered sistema di circolazione dell'aria (Figura 1, B, C). L'interno della stampante può essere sterilizzato usando le fonti di luce ultravioletta incorporate (Figura 1, D). Il componente centrale del bioprinter è un posizionamento robot completamente programmabile che può riproducibile collocare il puntale dispenser con una precisione di 10 micrometri (Figura 1, E). Ci sono tre dispenser, che sono in grado di depositare volumi piccoli come 230 nl utilizzando una vite rotante (Figura 1, F). Essi sono indipendentemente programmabili tramite computer separati che regolano i parametri di stampa per ciascun erogatore (Figura 1, G). Rotary-vite erogazione utilizza la rotazione di una vite motorizzata per spostare bioink giù una siringa e dalla punta della siringa. Questi distributori sono montati su un pneumaticoStrumento Nest controllata ly (Figura 2A, B), che consente al robot di cambiare erogatore montato sul braccio robotico asse Z sotto controllo programmata (Figura 1, H).
Il robot XYZ riceve istruzioni per la stampa da un computer dotato di software di progettazione (Figura 1, I). Ogni programma contiene sedi di erogazione, le routine di calibrazione e protocolli-dispenser che cambia. La progettazione di costrutti generati costituito principalmente le coordinate XYZ dove ogni distributore depositerà materiale. Il bioprinter comprende due sensori ottici ottici (Figura 2C) che determinano le coordinate XYZ della fine punta della siringa. Tali sensori inviano informazioni al robot, che usa per calcolare le posizioni delle estremità punta dell'erogatore coordinate. C'è un laser spostamento supplementare (Figura 2D) che proietta un 633 nm diodo rosso raggio laser di dimensioni dello spot 30 x 100 micrometri per misurare la distanza con un accuracy di 0,1 micrometri. Quando il raggio è altamente focalizzato il robot determina la distanza Z della superficie di stampa. Questa misura, e sensori di luce ottica misurazione della estremità di punta in Z, permette di calcolare accurate Z coordinate usato per posizionare la punta dell'erogatore rispetto alla superficie di stampa. I puntali si muovono lateralmente e verticalmente attraverso il sensore di luce ottica X-asse orientato per trovare i centri Y e Z, e lateralmente attraverso un sensore asse Y per trovare il centro dell'asse X. La superficie di stampa è mappato utilizzando la formula per una superficie piana in spazio xyz: ax + by + cz = d per determinare dove la superficie è relativo alla posizione dell'estremità ago erogatore. La fase di stampa (Figura 1, J) detiene un piatto Petri campione fino a 80 mm di diametro e utilizza un bagnomaria ricircolo per mantenere la temperatura impostata (Figura 1, K). Temperatura di fase può essere impostato in un intervallo compreso tra -20 e rimane stabile all'interno. C'è una fotocamera USB montatasul robot Z-braccio per fornire una vista ingrandita della punta di erogazione durante il processo di stampa (Figura 1, L). Vi è una seconda telecamera montata verso la parte superiore della camera di interni che fornisce una visione completa della bioprinter durante il processo di stampa (Figura 1, L).
Un software di disegno progettazione assistita da computer determina il pattern di deposizione e permette all'utente di generare goccioline incrementale distanziati e strutture complesse (Figura 3). Percorsi tridimensionali possono essere codificati manualmente nel software di progettazione compatibile con stampante o importati da un software separato computer-aided disegno di progetto (Figura 4, tabella 1). Il software compatibile con stampante consente variazioni di parametri di stampa, come il metodo di deposizione (deposizione singola gocciolina o percorso continuo deposizione), la geometria tridimensionale dei percorsi, velocità di deposizione, la distanza tra la fine punta della siringa e substtasso superficie di stampa, la quantità di tempo per depositare una goccia individuale, e l'altezza e velocizzare la siringa viene sollevato tra la deposizione delle gocce. Ogni programma contiene XYZ sedi di erogazione, le routine di calibrazione punta e protocolli-dispenser che cambia per fornire un ambiente sterile, senza l'intervento dell'operatore, durante la stampa. Il controllore logico programmabile (PLC) del robot riceve istruzioni dal computer che esegue il software di progettazione e controlla la temporizzazione degli eventi dai controllori esterni (ad esempio, i dispensatori). Per fare questo, il PLC utilizza un meccanismo di loop per controllare i distributori , dispositivo di posizionamento robotico, e fattori ambientali.
Tridimensionale bioprinting-scrittura diretta utilizzando una vite rotante, sistema di erogazione del liquido permette al processo di deposizione cellule per essere più efficiente, accurato e più facile rispetto ai metodi precedenti. Questo studio dimostra l'bioprinter su misura è in grado di generare cell carico di costrutti idrogel con la vitalità delle cellule di alta.
Protocollo
1. Preparazione del substrato contenente gelatina per tridimensionale Bioprinting di alginato idrogel
- Preparare il substrato di calcio / gelatina seguendo il metodo substrato calcio / gelatina descritto da Pataky e altri 11 per evitare la redditività ridotta associata ad alto contenuto. Il metodo substrato calcio / gelatina è elencato di seguito.
- Combinare diidrato cloruro di calcio (1.5 wt%), sodio cloruro (0,9% in peso), e la gelatina porcina (2 wt%) in acqua distillata e far bollire per 2 minuti per creare una soluzione di gelatina 100 mM.
- Versare 5 ml della soluzione di gelatina / calcio in 100 mm piatti Petri standard, agitare la soluzione attorno a rendere ancor rivestimento sulla superficie, e posto su una superficie piana in frigorifero a gel O / N (permette di gel di almeno 8 hr prima dell'uso).
- Per aumentare l'opacità della superficie del substrato, aggiungere biossido di titanio (0.3 wt%) alla soluzione di gelatina CaCl / 2. Agitare per 10 min. Autoclave soluzione di gelatina / TiO 2 sul ciclo liquidi per 30 min per sterilizzarlo.
- Aggiungere 3 ml della / soluzione di gelatina TiO 2 alla superficie delle piastre di gelatina precedentemente preparati. Agitare la miscela per assicurarsi che sia distribuito uniformemente su tutta la superficie. Lasciare gel nel 4 ° C frigo O / N (permettere a gel, almeno 8 ore prima dell'uso). I supporti devono essere utilizzati entro 3 giorni.
2. alginato Ossidazione
- Ossidare il bioink alginato di sodio secondo il metodo per alginato parzialmente ossidato Bouhadir et al 30 descritto di seguito.
- Per fare una soluzione di alginato ossidato 5%, sciogliere 1 g di alginato di sodio in 100 ml di acqua distillata. Aggiungere una soluzione acquosa di periodato di sodio (0,25 M, 0,25 mmol), l'agente ossidante, per produrre una soluzione al 5% di ossidazione. Mescolare per 19 ore a temperatura ambiente. Aggiungere 40 ml di glicole etilenico alla soluzione dopo 24 ore per terminare la reaction.
- Sciogliere 2.5 g di cloruro di sodio in soluzione. Aggiungere una quantità in eccesso di alcol etilico (rapporto 2: 1) per precipitare i alginati ossidati. Centrifugare a 1.000 xg per raccogliere i precipitati e ri-sciogliere in acqua distillata. Ripetere il lavaggio etanolo.
- Liofilizzare il pellet alginato ossidati e conservare a -20 ° C fino al momento dell'uso.
- Determinare il grado di ossidazione misurando la percentuale di sodio periodato consumato prima di essere terminato da glicole etilenico.
- Preparare una soluzione di ioduro di potassio (20% w / v, pH 7,0 tampone fosfato di sodio) e una soluzione thyodene (10% w / v, pH 7,0 tampone fosfato di sodio). Mescolare le due soluzioni con l'alginato ossidato a RT.
- Gradualmente cadere l'alginato di sodio e soluzione di periodato reagito nella miscela di soluzioni di ioduro di potassio e theodyne. Misurare l'assorbanza della miscela spettrofotometro a 426 nm. Quando ha raggiunto unmassimo, registrare il volume utilizzato di alginato di sodio e soluzione periodato come V 1.
- La reazione è
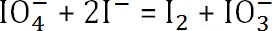 . La quantità di periodato di sodio non reagito è
. La quantità di periodato di sodio non reagito è 
- Sottrarre la quantità di periodato di sodio non reagito dalla concentrazione iniziale per determinare la quantità di sodio periodato consumato. Usando la formula precedente, determinare il grado di ossidazione finale del alginato.
3. alginato Peptide Coniugazione
- Leganti coniugati con una sequenza di arginina-glicina-aspartato esposti (peptide) nella alginato ossidato precedentemente preparato seguendo il metodo coniugazione RGD-alginato da Rowley et al 31 di seguito descritto per promuovere l'adesione delle cellule e la diffusione.
- Utilizzare carbod acquosachimica iimide con G 4 RGDSPto coniugato 31.
- Sciogliere 1 g di 5% alginato ossidato in 0,1 M 2- (N-morfolino) Acido etansolfonico (MES) tampone pH = 4. Aggiungere 1-etil- (dimetilamminopropil) carbodiimmide (EDC, 0,54 mmol) e N-Hydroxysuccinimide ( NHS, 0,27 mmol) in rapporto 2: 1 per formare ammide intermedia.
- Aggiungere 0,28 mmol peptide, giunto alla spina dorsale del polimero alginato mediante il terminale amminico. Mescolare a RT O / N.
- Arrestare la reazione di accoppiamento con l'aggiunta di 2,5 g di cloruro di sodio alla soluzione. Aggiungere una quantità in eccesso di alcol etilico (rapporto 2: 1) per precipitare i alginati ossidati. Centrifugare la miscela a 4000 xg per 5 minuti per raccogliere i precipitati. Aspirare i media nel cofano coltura cellulare e ri-sciogliere i precipitati in acqua distillata. Ripetere il lavaggio etanolo.
- Liofilizzare precipitati fino a quando non diventa completamente asciugato (apparirà come una sostanza polverosa bianca) e conservare in frigo a -20 ° C per più tardiutilizzare.
4. adiposo umano Cellule tessuto stromale coltura cellulare (di hADSC)
- Cultura adiposo umano cellule stromali tessuto (di hADSC) in 75 cm trattati boccette di coltura cellulare (fiasche T75), coperto con 15 ml basso DMEM glucosio con il 10% di siero fetale bovino e 1% di penicillina-streptomicina, 1% glutamina e 1% antimicina. Modificare i media, nel cofano coltura cellulare, ogni due giorni fino a quando non hanno raggiunto confluenza (80-90%).
- Una volta confluenti, trasferire i fiaschi T75 alla cappa coltura cellulare e sospendere la hADSC del utilizzando il metodo tripsina digestione enzimatica.
- Nella cappa, aspirare tutti i terreni di coltura cellulare spento delle cellule. Sciacquare con 5 ml di Dulbecco fosfato-Buffered Saline con calcio e magnesio (DPBS ++). Aspirare il DPBS ++ fuori delle cellule.
- Mentre nella cappa, fare una soluzione di tripsina e DPBS ++ miscelando 1 ml tripsina e 4 ml DPBS ++. Ogni beuta richiede 5 ml della solution, in modo da rendere il volume appropriato per il numero di flaconi confluenti. Aggiungere 5 ml della tripsina / DPBS ++ per ogni pallone e metterli in incubatrice per 2 min.
- Dopo 2 minuti, togliere i flaconi e battere leggermente ai lati del loro di allentare le cellule dai fondi. Guardare ogni beuta sotto un microscopio per assicurare le cellule sono sospese. Collocare i flaconi di nuovo nel cofano coltura cellulare e aggiungere 3 ml di mezzi appropriati di coltura cellulare per ogni pallone. Questo termina la reazione tripsina.
- Trasferire i mezzi di comunicazione cellula-carico da ogni pallone e mettere in una conica da 50 ml. Li centrifugare a 1000 xg per 5 min. Le celle dovrebbero apparire come una piccola pallina bianca sul fondo del cono. Rientro alla cappa coltura cellulare e aspirare i media. Risospendere le cellule in 2 ml di colture cellulari.
- Contare le cellule utilizzando un emocitometro al microscopio. Una volta che le cellule sono state contate, nella cappa coltura, un'aliquota la quantità di materiale contenente ~ 1,3 million cellule e trasferimento in una conica da 15 ml. Centrifugare la conica 15 ml contenente nuovamente le cellule per 5 minuti a 1000 x g.
- Nel cofano cultura, reseed le restanti celle in più T-75 palloni, l'aggiunta di una concentrazione di ~ 350.000 cellule per ogni pallone. Aggiungere 15 ml di media DMEM e tornare alla incubatore fino confluenti di nuovo.
- Terminato il ciclo di centrifuga, riportare la conica 15 ml per la coltura cellulare. Aspirare il supporto dal pellet cellulare, e risospendere le cellule in soluzione acquosa di alginato ad una concentrazione di 1,3 milioni di cellule per millilitro di bioink, terteriating la soluzione spesso così vi è una distribuzione omogenea di cellule in tutto il bioink. Caricare la soluzione di cellule-carico in una siringa da 3 ml compatibile stampante sterile e avvitare la sterile 22 G punta di plastica.
5. Bioprinter Setup
- Accendere il bioprinter, ogni computer dispenser, e la recirculating bagnomaria.
- Impostare manualmente la temperatura del bagno a ricircolo d'acqua per per il meccanismo di gelificazione.
- Impostare manualmente i parametri di stampa per ogni dispenser sul computer distributore di correlazione. Impostare il volume di erogazione di 230 nl, il numero di backsteps a 0, e la velocità di erogazione di 10μl -sec.
- Aprire il software di progettazione e il programma per la visualizzazione del display della videocamera USB del computer.
- Utilizzando il software, inserire manualmente le coordinate per una matrice di punti 5 x 5 con 2,4 millimetri spaziatura tra gocce.
- Impostare i parametri di stampa per essere: distanza tra fine punta e superficie del substrato = 0,1 millimetri; siringa altezza viene sollevato tra deposizioni = 20 mm; la quantità di tempo per deposizione = 1 sec.
- Salvare il programma e inviarlo al robot.
- Porre la capsula di Petri di gelatina / TiO2 -contenenti sul palco della stampante C 4 °. Chiudere e bloccare la porta della camera.
- Utilizzare il PLC per initialize le fonti di luce ultravioletta, e sterilizzare la camera per 90 sec.
- Una volta che la sterilizzazione è completo, aprire la camera e caricare la siringa contenente del hADSC sospeso in alginato in Gun 1. Chiudere e bloccare la porta della camera.
- Utilizzare il PLC per accendere il sistema di ventilazione, attendere 30 secondi per l'equilibrio della pressione interna.
- Sul computer, eseguire il programma contenente i parametri pathway e stampa geometrica.
- Durante tutto il processo di stampa, vedere lo schermo della telecamera USB del computer per confermare la stampa accurata e uniforme.
- Una volta che la stampa è terminata, consentire i costrutti di gel per 40 min.
6. cellulare vitalità Assessment
- Coprire i costrutti che non stanno andando per essere ripreso immediatamente dopo la stampa in DMEM e conservare in incubatrice fino al momento di imaging.
- Per quantificare la vitalità dei costrutti, macchia utilizzando un test di fattibilità / citotossicità fluorescenti-based, unimmagine nd utilizzando la microscopia confocale.
- Seguendo le istruzioni del kit, preparare una soluzione colorante contenente calceina AM e etidio omodimero-1. Per fare 10 ml di soluzione colorante, aggiungere 20 ml di etidio omodimero-1 e 5 ml della calceina am a 10 ml di sterile, coltura di tessuti di prima scelta di Dulbecco Phosphate-Buffered Saline (+ magnesio, + calcio; DPBS ++).
- Immergere i costrutti bioprinted nella soluzione macchia per 15 minuti al buio.
- Immagine costrutti colorate utilizzando un sistema di microscopio confocale a giorni 0 e 8. Prendete più foto di ogni costrutto bioprinted, utilizzando parametri Z-stack da 30 fette ottici su una profondità di 300 micron, e contano manualmente le cellule. Se le cellule appaiono di colore giallo o verde li contano come vivi, e se rosso, contarli come morto.
- Calcolare la percentuale vitalità cellulare come il numero di cellule vive diviso per il numero totale di cellule nel costrutto; La vitalità cellulare = numero dicellule vive (verde + giallo) / numero di cellule totali (verde + giallo + rosso) x 100%.
- Calcolare la quantità di proliferazione cellulare per ogni campione come il numero di cellule del giorno 8 diviso per il numero di cellule al giorno 0; La proliferazione cellulare = numero di cellule dal vivo il giorno 8 / cellule vive contare il giorno 0 x 100%.
7. RGD peptide Coniugazione Analisi
- Per analizzare il successo di RGD peptide coniugazione in alginato, alginato confrontare RGD coniugato e alginato non-coniugato. Per fare questo, immagine i costrutti stampati con (4 ', 6-diamidino-2-phenylindole, Dihydrochloride) (DAPI) e falloidina macchie.
- Effettuare le phalloidins soluzione di lavoro diluendo 5 ml di soluzione madre metanolica con 200 ml di DPBS ++. Conservare a -20 ° C fino al momento dell'uso.
- Effettuare una soluzione stock di 300 micron della macchia DAPI seguente equazione: (0,10509 g / L) / (350,3 g / mol) = 3 × 10 -4 M = 0,0003 M = 0.300 mm = 300 micron. Fai °e DAPI soluzione di lavoro diluendo la soluzione madre 1: 100 in DPBS ++ per ottenere 3 micron soluzione. Conservare a -20 ° C fino al momento dell'uso.
- Completamente immergere il campione in paraformaldeide al 4%. Incubare per 1 ora a RT. Lavare tre volte con DPBS ++, permettendo la soluzione a sedere per 5 minuti ogni lavaggio. Trasferire il campione di gel dal pozzo di un vetrino, lanciando il gel sopra nel processo. Immergere il gel in 0.1% Triton X-100 (0,1 g / 100 ml) in DPBS ++ per 10 min. Lavare tre volte con DPBS ++, permettendo a 5 minuti per ogni lavaggio.
- Colorare i costrutti stampati con falloidina immergendole nella soluzione di lavoro. Coprire con un foglio e incubare per 4 ore. Rimuovere la macchia falloidina e lavare tre volte con DPBS ++. Il primo lavaggio dovrebbe essere veloce, questi ultimi lavaggi dovrebbero sedere per 5 minuti ciascuno.
- Colorare i costrutti stampati con DAPI immergendole nella soluzione di lavoro DAPI. Coprire con un foglio e incubare a temperatura ambiente per 30 min. lavaggiotre volte con DPBS ++, permettendo ogni lavaggio a sedere per 5 min. Osservare e immagine dei campioni su un sistema microscopio confocale.
Risultati
I risultati dimostrano la bioprinter è in grado di depositare idrogel cellulari carichi in specifiche posizioni tridimensionali accuratamente e coerentemente con il software assistita da computer. Questi software determinano il posizionamento di ciascuna gocciolina e controllano molti dei parametri di erogazione (Figura 3,4). La ripetibilità del bioprinter per depositare in modo appropriato biomateriali è fondamentale per il suo successo nelle applicazioni di ingegneria tissutale.
Discussione
L'obiettivo principale di ingegneria dei tessuti è quello di colmare il divario tra la carenza di organi e le esigenze di trapianto attraverso lo sviluppo di sostituti biologici in grado di ripristinare, mantenere, o migliorare functio tessuto nativo. Questo ha portato alla realizzazione di ponteggi diretta con un complesso, anatomicamente corretta geometria esterna e controllo preciso sul geometr interna. Bioprinting tridimensionale è una metodologia utilizzata per generare costrutti tridimensionali di varie dime...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto dal governo sostegno di cui di assegnazione N ° EPS-0903795 assegnati dalla National Science Foundation, NIH NIDCR R01-DE019355 (MJY PI), e Grant 8P20 GM103444 (YM PI).
Materiali
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
Riferimenti
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon