Method Article
Fare C1498 Cep Hattı ve İlişkili Lösemi Fare Modeli Karakterizasyonu için Detaylı Protokolü
Bu Makalede
Özet
Bu yazıda, in vitro ve enjeksiyondan sonra farelerde akut lösemide C1498 hücre kültürlerinin karakterize etmek için kullanılabilen bir teknik prosedürü sağlar. Fenotipik ve fonksiyonel analizler flow sitometri, immünofloresan mikroskopi, histokimya ve Mayıs-Grünwald Giemsa boyama kullanılarak gerçekleştirilir.
Özet
1941 Bu enjeksiyonlar, akut lösemi gelişme olmasına neden olduğundan, genetik olarak özdeş ya konjenik farelere C1498 hücrelerinin damar içi enjeksiyon yapılmıştır. Bununla birlikte, bu hastalığın doğasına, literatürde iyi belgelenmiştir edilmemiştir. Burada, in vitro C1498 hücreleri karakterize etmek için in vivo olarak uyarılan lösemi doğasını belirlemek için bir teknik protokol sağlar. Bu prosedürün ilk bölümü hematopoietik soy ve kültür C1498 hücrelerin farklılaşma aşamasının belirlenmesinde odaklanmıştır. Bunu elde etmek için, çok parametre akış sitometrik boyama hematopoietik hücre markörleri tespit etmek için kullanılır. İmmünofloresan mikroskopi, sitokimyasal ve Mayıs-Grünwald Giemsa boyama sonra sırasıyla, miyeloperoksidaz ifadesini, esteraz ve hücresel morfoloji aktivitesini değerlendirmek için yapılır. Bu protokolün ikinci bölümü indüklenir lösemi hastalığını anlatan adamıştırin vivo. Ikinci kan lösemik ve içsel hücre frekansları saptanmasıyla elde edilebilir sitometrisi belirli bir lekeleme kullanılarak ve akış hematopoietik organların (örneğin, kemik iliği ve dalak) ve non-lenfoid dokular (örneğin, karaciğer ve akciğer) analiz eder. lösemi doğası sonra kemik iliğindeki özel esteraz için Mayıs-Grünwald Giemsa boyama ve boyama kullanılarak teyit edilmiştir. Burada, aynı yaştaki C1498- ve PBS ile enjekte edilmiş farelerde, bu protokol kullanılarak elde edilen sonuçları sunulmaktadır.
Giriş
Akut miyeloid lösemi (AML) olgunlaşma farklı aşamalarında engellenir hematopoietik miyeloid hücrelerin kontrolsüz çoğalma ile karakterize edilir. Bu düzensizliği granülositik, monositik, eritrosit veya megaryocytic farklılaşma yolları 1 etkileyebilir. AML hücreleri trombositopeni, lenfopeni ve anemi ile sonuçlanır engelli hematopoez, yol, kemik iliğinde birikir. lösemi hücreleri, kan ve Lenfoid olmayan organları istila.
C1498 fare modeli literatür kana işgali tarif kanser hücreleri 1941 bir lösemi 10 aylık bir C57BL / 6 (H-2b) dişi fare izole çünkü akut lösemi için bir model olarak yıllardır kullanılmaktadır hematopoietik organları (örneğin, dalak ve lenf düğümleri) ve non-hematopoetik organların (örneğin, karaciğer, akciğer, yumurtalık ve böbrek) yüksek proliferatif C1498 hücreleri tarafından da bir IN ile enjekte edildikten sonratravenous, duyarlı farelere 2-4 içine deri altı veya intra-peritoneal rota. Ancak, bu fare modeli ya granülositik 2,5 veya miyelomonositik 6 lösemi uyardığı bildirildi. Daha yakın zamanlarda, 2002 yılında yayınlanan bir çalışmada, kemirgen NKT hücreli lösemi 7 olarak bu kanser türü tanımladı. Bu durumda, literatür, bu C1498 hücre hattının yapısı ve farelerde indükler ilişkili lösemi ile ilgili değişiklik gösterir. 70 - Bu tutarsızlıklar detaylı eksikliği ve hücrelerin hakkında güncel yayımlanan bilgilerin ve birçok çalışma 1950 yılında yapılmıştır çünkü genel olarak lösemi hastalığına başlıca nedeni vardır.
Burada C1498 hücreleri tanımlama ve farelere damar içine enjekte edilmesiyle uyandırılır lösemi hastalığın doğasını analiz açıklamak için ayrıntılı bir protokol sağlar. Bu protokolün birinci bölüm, in vitro olarak kültür edilmiş C1498 hücre açıklama ayrılmıştır. floresan antiyüzey ve hücre içi hematopoietik belirteçler karşı organları akış sitometrisi kullanılarak fenotipi belirlemek için kullanıldı. miyeloperoksidaz varlığı immünofloresan mikroskopi kullanılarak değerlendirildi, onların hematopoetik soy ve farklılaşma sahne esterazların aktivitesini değerlendirmek için sitokimya kullanılarak değerlendirildi ve Mayıs-Grünwald Giemsa boyama yapıldı. C1498 Hücreler daha sonra farelere enjekte edildi ve indüklenen akut lösemi hastalığı Bu yazının ikinci bölümünde tarif edilmektedir. Aynı teknikler frekansları ve kemik iliğindeki lösemi ve içsel hücre, periferal kan, dalak ve non-hematopoetik organ (karaciğer, akciğer) fenotipleri belirlemek için kullanıldı.
Bu protokol yüksek tekrarlanabilir ve burada sunulan veriler araştırmacılar yeni tedavi stratejilerinin etkilerini değerlendirmek için yardımcı olacaktır. Bu lösemi fare modeli zaten immünoterapi yaklaşımları test etmek için kullanılmıştırnd farklı kanser kemoterapötik ilaçları 8,9. Onların etkinliği tümör yükü ve sağkalım oranları evrimini belirlenerek değerlendirildi. Bu protokol tedavi sırasında lösemili ve diğer hematopoetik hücre popülasyonlarının dağılımı ve geçim hakkında ek bilgi sağlamak için kullanılabilir.
Protokol
Hayvan konut ve tüm deneysel prosedürleri yerel Hayvan Bakım Etik Komitesi tarafından, CEEA.NPDC (anlaşma no.512012) onaylanmış ve tüm deneyler Laboratuvar Hayvanları Bakım ve Kullanım Fransız ve Avrupa kurallarına uygun olarak yapıldı.
C1498 Celi Line In Vitro Tespiti 1.
- C1498 hücrelerinin in vitro kültüründe
- Hazırlama tam RPMI (Roswell Park Memorial Institute) fetal sığır serumu, 50 ml (FBS), penisilin, 5 ml ilave edilerek 1640 ortamında (100 U / ml) (100 ug / ml), 50 mM β-merkaptoetanol, 500 ul -streptomycin 5 N-2-hidroksi-N-2-etan sülfonik asit (HEPES) içinde mi, esansiyel olmayan amino asitler ile 5 mL RPMI ortamı, 500 ml sodyum piruvat 5 ml.
- tam RPMI içinde C1498 hücre hattı büyütün. pipetleme süspansiyon hücreleri hasat ve 50 ml'lik bir tüp hücre transfer edin. 10 dakika boyunca 350 xg'de santrifüj ve Superna kaldırmaktant.
- 10 dakika boyunca 350 xg'de fosfat tamponlu tuzlu su (PBS) (1x) çözeltisi santrifüj 20 ml ilave edilir, ve supernatant çıkarın.
- 10 flüoresanslı etkinleştirilmiş hücre ayırıcı (FACS) tamponu (sığır serum albümini (BSA) pudra 2.5 g ve 2 PBS çözeltisi, 500 ml 0.5 M etilendiamin tetraasetik asit (EDTA) çözeltisi mi) içinde tekrar süspansiyon hücreleri. tripan mavisi ile boyanması sonrası bölme sayma Thoma hücre kullanarak hücreleri sayın.
- C1498 hücre çizgisinin fenotipik nitelendirilmesi immün kullanarak akış sitometri analizine
- Hücre yüzey boyama
- FACs tampon hazırlayın.
- 10 7 hücre / ml FACS tampon hasat hücreleri ayarlamak ve tüpler akış sitometrisi her bir boyama deney için (100 ul), 10 6 hücre dağıtın.
- FACS tamponu içinde seyreltilmiş, aşağıdaki antikorlar ya da bunların ilişkili izotip kontrolleri 100 ul hücreleri etiketlemek:
- Formön ve farklı hücre arkers anti-CD11b / anti-CD18 (1), bir anti-Ly-6G (1), anti-CD19, anti-B220 (2), anti-NK1.1, anti-hücreleri etiketlemek CD49b, anti-CD4 (1), anti-CD8 (2), anti-CD3 (3), anti-CD21 / 35, anti-CD115 ve anti-TCRVβ antikorları yer alır.
- Hematopoietik kök / progenitor hücreler belirteçleri, anti-CD34, bir arada kullanmak / anti-CD117 / anti-Sca-1, anti-CD150 / anti-CD117 / anti-Sca-1, anti-CD117 / anti-CD127 veya anti tek başına CD16 / 32-biotin antikorları.
- Hücre fonksiyonları (örn, yapışma, antijen sunumu, ortak uyarıcı moleküller ve reseptör) belirteçleri, anti-CD18 (2) / anti-CD11a, bir anti-MHC sınıf I, anti-MHC sınıf II, anti-hücreleri leke CD31, anti-CD44, anti-CD80-biotin, anti-CD86 ve anti-CD274 antikorları yer alır.
- 30 dakika boyunca 4 ° C'de tüpler akış sitometrisi tüm inkübe edin.
- iki kez 5 dakika boyunca 350 xg'de Her tüpe FACS tamponu 2 ml santrifüj ekleyerek hücreleri yıkanır ve supernatant çıkarın.
- Her tüpe FACS tampon 100 ul ilave edin ve biyotinile-konjüge antikorlarla (1/200 nihai seyreltme için FACS tampon 1/100) fluoresan streptavidin 100 ul ilave edilerek sekonder boyama geçin. 30 dakika boyunca 4 ° C'de inkübe edin.
- şöyle hücreler iki kez yıkayın: 5 dakika boyunca 350 xg'de, her tüpe santrifüj tüpleri FACS tamponu 2 ml ekleyin ve pipetleme ile süpernatantı.
- Soğuk 500 ul PBS hücrelerin tekrar ve tüpler kapsayacak şekilde alüminyum folyo ile karanlıkta tutarak, buz üzerinde hücreleri yerleştirin. Bir Sitometreyi 10 kullanarak sonuçları analiz edin.
- Hücre içi boyama
- PBS çözeltisi 375 ml% 4 paraformaldehit (PFA) çözeltisi 125 ml ekleyerek sabitleme tamponu hazırlayın.
NOT: havalandırılmış başlığı içinde bir karıştırma plakası üzerinde yaklaşık 60 ° C'de% 4 PFA 500 mi, sıcak PBS çözeltisi 400 ml hazırlanması. PFA tozu 20 g ekleyin ve pH'ı yükseltmekkadar PFA eritilir. Çözelti, soğumaya 6.9 pH ayarlamak ve PBS ile 500 ml birimi oluşturacak izin verin. - Saponin 0.5 g ve PBS çözeltisi 500 ml BSA 0.5 g ekleyerek geçirimli tamponu hazırlayın.
- 10 7 hücre / ml FACS tampon hasat hücreleri ayarlamak ve tüpler akış sitometrisi her bir boyama deneyi için hücreler (100 ul) 10 6 dağıtın. 5 dakika boyunca 350 xg'de hücreleri Santrifüj ve süpernatant kaldırmak.
- % 1 PFA çözeltisi 200 ul hücre saptamak ve 4 ° C'de 10 dakika inkübe edilir.
- 5 dakika boyunca 350 xg'de, her tüpe santrifüj tüpleri geçirimli tampon 2 ml ilave edilir, ve pipetleme ile süpernatantı. Her tüpe tampon Su-geçirimli 100 ul ekle.
- tampon Su-geçirimli bunları inceltilerek aşağıdaki antikorlar veya bunların karşılık gelen izotip kontrolleri 100 ul hücreleri etiketlemek: anti-CD3 (2) / anti-CD8 (1), anti-CD3 (3) A /nti-CD4 (2), anti-CD107b ve anti-CD3 (3) / anti-TCRVβ.
- 30 dakika boyunca 4 ° C'de inkübe hücreleri.
- iki kez, her tüpe tampon Su-geçirimli 2 ml ekleyerek hücreleri yıkanır. 5 dakika boyunca 350 xg'de tüpler santrifüj ve süpernatant kaldırmak.
- hücrelere tampon Su-geçirimli 100 ul ekle. biotinlenmiş-konjuge antikor tampon permeabilizing seyreltilmiş floresan streptavidin 100 ul ekleyerek ikincil boyanması geçin. 30 dakika boyunca 4 ° C'de inkübe edin.
- Her bir tüpe tampon Su-geçirimli 2 ml ilave edilir, 5 dakika boyunca 350 xg'de tüpler santrifüj ve supernatant çıkarın. Bu adımı bir kez daha tekrarlayın.
- Soğuk 500 ul PBS hücrelerin tekrar ve karanlıkta buz üzerinde hücreleri yerleştirin. 10 debi sitometresinde analiz sonuçları.
- PBS çözeltisi 375 ml% 4 paraformaldehit (PFA) çözeltisi 125 ml ekleyerek sabitleme tamponu hazırlayın.
- Hücre yüzey boyama
- için mikroskop bir hücre süspansiyonunun hazırlanması
- Ha Yıkama 10 6soğuk FACS 5 ml (adım 1.1.4 'de elde edilen) rvested C1498 hücreler iki kez tampon ve soğuk FACS tampon maddesi 1 ml hücre seyreltin. buz üzerinde tüpler yerleştirin.
- Önceden takılı filtre kartları ile tek odalarına slaytlar yerleştirin ve bir Sitosantrifüj içine bu yerleştirin.
- Her bir oda ve filtre kartına FACS tampon 100 ul ekle ve 4.52 x g'de 2 dakika boyunca her dönerler.
- Her bir oda ve filtre kartına 100 ul hücre ekleyin ve 2 dakika boyunca 4.52 xg'de hücreleri dönerler.
- Dikkatle odalarından slaytlar kaldırmak ve miyeloperoksidaz (adım 1.4), esterazlar (adım 1.5) ya da Mayıs-Grünwald Giemsa (adım 1.6) ile boyamadan önce slaytlar hava kurutun.
- Immünofloresan için Miyeloperoksidaz boyama
- 2 dakika için çözelti ve daha sonra slaytlar hava kuru: aseton (1: 1:) soğuk metanol slaytlar daldırılmasıyla slaytlar üzerinde hücreleri saptamak.
- Bir ci çizmek, hücreleri içeren slayt alanına sıvı sınırlandırmak içinSu tutmayan kalem kullanarak hücrelerin etrafında Dairesel.
- 10 dakika boyunca soğuk PBS çözeltisi 200 ul hücre durulayın.
- normal eşek serumu, 10 ul saflaştırılmış anti-CD16 / 32 antikorları, 10 ug / ml içeren% 3 BSA / PBS tampon 200 ul hücre bloke eder.
- (% 3 BSA / PBS tamponu içinde 20 ug / ml'ye seyreltilmiş), anti-fare miyeloperoksidaz 200 ul uygulanır. bir nem odası 4 ° C'de hücreler O / N inkübe edin.
- Soğuk% 0.1 BSA / PBS 200 ul hücreleri yıkanır.
- % 3 BSA / PBS tamponu içinde 1/250 oranında seyreltilen anti-keçi IgG antikorlarının 200 ul uygulanır. bir nem odası, oda sıcaklığında 2 saat süre ile inkübe hücreleri.
- soğuk PBS içinde iki kez% 0.1 BSA / PBS tampon 200 ul hücreleri 3 kez yıkayın.
- Oda sıcaklığında 2 dakika boyunca (1 ug / ml bir son konsantrasyona kadar), PBS içinde 1 / 1,000 seyreltilmiş Hoechst 200 ul hücre çekirdekleri leke.
- su ile slaytlar yıkayın ve mountin önce kurumaya onlara izinörn. hücrelere orta 1 montaj bir damla uygulayın, slayt üzerine bir kapak cam bir kenarını yerleştirin ve dikkatlice forseps kullanarak hücreleri üzerine indirin. yavaşça kapak camına basın herhangi bir hava kabarcıklarını çıkarmak için.
- esteraz sitokimya
Not: RT Pre-sıcak tüm reaktifler.- Sabitleme hazırlık
- 2.5 sitrat solüsyonu, aseton, 6.5 ml bir cam şişe için 0.8 mi% 37 formaldehid ilave, sitrat-aseton-Formaldehit (CAF) solüsyonu hazırlamak. İyice karıştırın ve 4 ° C'de saklayın.
- Naftol AS-D kloroasetat esteraz (CAE) aktivite deneyi
- 37 ° C'ye ısınmaya deiyonize su.
- 50 ml'lik bir tüp içinde, boya çözeltisinin 1 ml sodyum nitrit çözeltisi 1 ml. İyice karıştırın ve 2 dakika bekletin. Ekle önceden ısıtılmış deiyonize su, 40 mL, 5 pH 6.3 tampon maddesi konsantresi ml naftol AS-D kloroasetat çözeltisi 1 mi. Mix ve bir Coplin kavanozun içine aktarın.
- üzerine hücreleri düzeltmekSlaytlar CAF çözeltisi (adım 1.5.1.1 bakınız) 30 saniye için (bakınız Bölüm 1.3) ve iyonu giderilmiş su ile 45 saniye boyunca slaytlar yıkayın.
- Aşama 1.5.2.2 hazırlandı çözeltisi içine slaytlar aktarın ve ışıktan korunan bir nem odası içinde 30 dakika süreyle 37 ° C'de inkübe slaytlar.
- slaytlar kurutun ve daha sonra 2 dakika boyunca iyonu giderilmiş su içine batırılarak ile durulayın.
- Hematoksilin çözeltisi damlatılır ve 1 dakika için onları kuluçka hücreleri karşıt.
- nötr su (pH 7) ile slaytlar yıkayın ve kurumaya onlara izin. hücrelere orta 2 montaj bir damla uygulayın, slayt üzerine bir kapak cam bir kenarını yerleştirin ve dikkatlice forseps kullanarak hücreleri üzerine indirin. yavaşça kapak camına basın herhangi bir hava kabarcıklarını çıkarmak için.
- Alfa-Naftil butirat esteraz (BOU) aktivite deneyi
- kullanımdan önce 37 ° C ye ısınmasına α-naftil butirat çözeltisi.
- Sodyum sirke bir tablet seyreltiniyonu giderilmiş su 6.25 ml ayin.
- 50 ml'lik bir tüp içinde bir sodyum nitrit, tablet 1.5 ml çözelti ve Pararosaniline 1.5 ml çözelti ilave edin. İyice karıştırın ve solüsyon 5 dakika bekletin. fosfat tamponlu çözelti 40 ml çözelti Ek. dikkatli bir şekilde 10 N NaOH damla damla eklenerek pH 6'ya getirin. , Α-naftil butirat çözeltisi 5 ml tam çözüm karıştırmak ve Coplin kavanoza aktarın.
- Oda sıcaklığında CAF çözeltisi kullanılarak 10 saniye boyunca slaytlar üzerine hücreleri düzeltmek ve deiyonize su ile 45 saniye boyunca durulayınız.
- Aktarım ışıktan korunması ise aşama 1.5.3.2 hazırlanır ve bir nemlilik bölmesi içerisinde 37 ° C'de 1 saat boyunca birlikte inkübe edildi çözeltisi içeren Coplin kavanoza kayar.
- 2 nötr suda dakika (pH 7) ve hava-kuru için slaytlar durulayın.
- slayt birkaç damla eklenmesiyle metilen mavi solüsyonla hücreleri karşıt ve 4 dakika için inkübe edilir.
- deio slaytlar daldırın2 dakika boyunca su immünize ve havada kurumaya izin verin. Slaytlar monte hücrelere orta 2 montaj bir damla uygulamak için, slayt üzerine kapak cam bir kenarını yerleştirin ve dikkatlice forseps kullanarak hücreleri üzerine indirin. yavaşça kapak camına basın herhangi bir hava kabarcıklarını çıkarmak için.
- Sabitleme hazırlık
- Mayıs-Grünwald Giemsa (MGG) boyama
- 3 dakika Mayıs-Grünwald çözeltisi içeren bir Coplin kavanoza slaytlar daldırarak (bölüm 1.3 hazırlanan) hücreleri leke.
- 1 dakika boyunca pH 6.8 tampon çözeltisi içeren bir Coplin kavanoza slaytlar aktarın.
- 10 dakika süre ile (pH 6.8 tampon çözeltisi içinde 1/20 seyreltilmiş) Giemsa R çözeltisi içeren bir Coplin kavanoza yerleştirilmesiyle, slaytlar Leke. 10 saniye boyunca, nötr su (pH 7) ile slaytlar yıkayın.
- Drenaj ve slaytlar hava kurutun. hücreleri üzerine orta 2 montaj bir damla uygulayarak slaytlar monte edin. slayt üzerine kapak cam bir kenarını yerleştirin ve dikkatle üzerinde düşürmekhücrelere forseps kullanılarak. yavaşça kapak camına basın herhangi bir hava kabarcıklarını çıkarmak için.
Vivo Geliştirme 2. ve Akut Lösemi Karakterizasyonu
Not: Dört haftalık dişi konjenik C57BL / 6J-Ly5.1 fareleri (steril bir ortamda, örneğin,) belirli bir patojen içermeyen koşullar altında tutuldu. 5 ila 6 haftalık iken farenin enjekte edilmiştir.
- C1498 hücreler damar içine enjeksiyonu
- pipetleme süspansiyonlar kültürlenen C1498 hücreleri hasat. 10 dakika boyunca 350 xg'de 50 ml tüp ve santrifüj hücreleri aktarın. Iki kez soğuk PBS ile 10 ml hücre yıkayın ve PBS içinde 10 7 hücre / ml hücre süspansiyonu hazırlamak. enjeksiyon gerçekleştirmeden önce buz üzerinde hücresel süspansiyon yerleştirin.
- Bir süzgeç fare yerleştirin ve bir laminer akış kaputu steril koşullar altında enjeksiyon gerçekleştirin.
- içine hücreleri enjekte etmek için bir şırınga ile bir 29G iğne kullanınKuyruk ven. uzak ucunda kuyruk kavrayın ve% 70 etanol batırılmış bir gazlı bez sünger ile dezenfekte edin. Şırınga içinde hiçbir hava kabarcığı olmadığından emin olmak için kontrol edin ve ardından yavaşça kuyruk damar içine C1498 hücre süspansiyonu 100 ul (10 6 hücre) enjekte edilir.
- Enjeksiyondan sonra, kuyruk iğne çıkarılır ve enjeksiyon yerinde steril bir gazlı sünger ile basınç uygulayarak herhangi bir kanama kontrolü. önümüzdeki saatler ve günler boyunca onun sağlığını kontrol dikkatle kafesine hayvan dönün ve.
- Retro orbital kan toplama
- Lösemi hastalığı (ör piloerection, gruptan izolasyon ve indirgenmiş veya kafes içinde herhangi bir hareket) belirtilerini PBS- ve C1498-enjekte edilmiş farelerden davranışını izler.
NOT: hücreleri enjekte edilir sonra bu, genellikle 17 ila 19 gün arasında meydana gelir. - hemen ötenazi önce, retro orbital kan toplama gerçekleştirmek laminer akış steril koşullar altında (adım 2.2.7 bakınız)kaput ve bir ısıtma lambası altında hipotermi önlemek için.
- Anestezi için 10 mg / kg, 150 mg / kg ve ksilazin ketamin kullanın. PBS çözeltisi, 18 ml ksilazin 1.5 ml ketamin ve 0.5 ml seyreltilmesi ile anestezi çözeltisi hazırlayın.
- kontrol ve lösemik fareler anestezi. 26G iğne kullanılarak fare 10 gramı başına anestetik çözeltisi 200 ul bir intraperitoneal enjeksiyon ve 1 ml şırınga ile devam edin. Anestezi onaylamak için pedal refleks kaybı olup olmadığını kontrol edin.
- Gözün medial canthus içine kılcal tüp takın. Kan kılcal tüpe orbital sinüsten yükselecek. nazikçe steril bir gazlı sünger ile gözün üzerine basınç uygulayarak kanamayı kontrol.
Not: Kan, 100 ila 200 ul bir hacmi bu teknik kullanılarak elde edilebilir. - bir EDTA tüpe kan toplayın ve mononükleer hücreler izole önce buz üzerinde örnek saklayın.
- servikal dislokasyon kullanarak fare Euthanize veorganları (bölüm 2.3) izole geçin.
- Lösemi hastalığı (ör piloerection, gruptan izolasyon ve indirgenmiş veya kafes içinde herhangi bir hareket) belirtilerini PBS- ve C1498-enjekte edilmiş farelerden davranışını izler.
- Organlar ve hücreler izolasyon
- organlar izolasyon
- Bir plastik kartındaki sırtına ötenazi fare yerleştirin ve organ izole edilmesini kolaylaştırmak için hayvanın ayaklarını pin iğne kullanın. bir kesi yapmadan önce% 70 etanol kullanarak fare dezenfekte edin.
- Steril makas kullanarak, boyun, karın deriden ventral kesi yapmak. karaciğer erişmek için karın duvarından kesti. göğüs kafesi ve akciğerler erişmek için diyafram üzerinden kesin. tarafına bağırsak hareket ettirin ve steril makas ve forseps kullanarak dalak çıkarın.
- Kemik iliği izole etmek için, steril makas kullanarak eklemin üzerinde uyluk kemiklerinin üstündeki bacaklarını kesti. hafifçe çekerek femur tibia ayırın ve forseps ve makas kullanılarak kemiklerden cilt ve kasların çıkarın.
- gibi soğuk PBS içeren 50 ml'lik bir tüp içinde, her organ ve kemik yerleştirin ve buz üzerine yerleştirin.
- organlardan hücrelerin izolasyonu
- hücreleri parçalayarak önce dalak tartın. Mekanik olarak 50 ml bir tüp içinde, bir şırınga pistonu kullanarak 70 mikron süzgecinden bastırarak dalak, akciğer ve karaciğer bozabilir ve soğuk PBS ile 30 ml hücreleri toplamak.
- , Kemik iliği hücreleri toplamak buz üzerinde bir Petri kabındaki femur ve tibia koymak, steril makas kullanarak ekstremitelerde kesilmiş ve soğuk PBS 5 ml içeren 10 ml şırınga bağlı bir 26G iğne sokarak kemik iliği dışarı floş.
- iğne / şırınga yoluyla hücre süspansiyonu geçirerek kemik iliği hücreleri bozabilir ve 50 ml'lik bir tüp içinde 70 mikron süzgecinden hücre süspansiyonu filtre.
- Santrifüj 10 dakika boyunca 350 xg'de organ ve kemik iliği hücreleri her içeren tüpler her. Süpernatant atılır ve 2 lizis tamponu (1 x) ve hücre akciğer ve kemik iliğinden toplanan hücreler tekrar süspansiyonhafifçe yukarı ve aşağı karışım pipetleme liziz tamponu (1x), 5 ml karaciğer ve dalak izole s. soğuk PBS ile 50 ml tüpler doldurun.
- 10 dakika boyunca 350 xg'de hücreleri Santrifüj. Akış sitometrisi analizi için FACS tamponu hücrelerin yeniden süspanse veya mikroskop için hücreleri hazırlamak için. tripan mavisi ile boyanarak, bir Thoma hücre sayım odası kullanarak hücreleri sayın.
- organlar izolasyon
- flow sitometri analizi için organlardan izole hücreler ile hücre yüzeyinin boyanması
- Boru sitometri akışı, etiket FACS tampon 100 ul saflaştırılmış anti-CD16 / 32 antikorları, 10 ug / ml organ izole edilmiştir 10 6 hücre içinde.
- 10 6, kemik iliği hücreleri için FACS tamponu içinde seyreltilmiştir, aşağıdaki antikorlar veya bunların kombinasyonlarından antikorların ve bunlara karşılık gelen izotip kontrolleri 100 ul: Anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), Anti-B220 (1) /anti-CD45.2/anti-CD19, anti-CD115 / anti-CD3 (1) / birTi-Ly6C / anti-Ly6G (2), anti-CD45.2 anti-Ly6G (2), bir anti-CD11b, anti-CD115 ya da tek başına dengeleme ayarları için bir anti-CD 19.
- splenosit için FACS tamponu içinde seyreltilmiştir 100 Aşağıdaki antikor ul ve bunlara karşılık gelen izotip kontrolleri ekleyin: / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220, anti-CD11b bir arada (1 ) /anti-CD45.2/anti-CD19 anti-CD45.2 anti-Ly6G (2), bir anti-CD11b veya dengeleme ayarları için bir anti-CD 19.
- akciğer ve karaciğer hücrelerine, 100 anti-CD45.2 antikorlarının ul ve FACs tamponunda 1/100 seyreltilmiş karşılık gelen izotop denetimi ekleyin.
- 4 ° C'de 30 dakika boyunca hücre tüm çözümleri inkübe edin.
- Her tüpe FACS tamponu 2 ml ekleyerek hücreleri yıkanır. 350 xg'de 5 dakika boyunca tüpleri Santrifüj ve pipetleme süpernatant atarak. Bu adımı bir kez daha tekrarlayın.
- soğuk PBS 500 ul etiketli tekrar süspansiyon hücreleri. hücreleri buz üzerinde tutun ve ac için flow sitometri gerçekleştirmeden önce ışıktan korunmalıdıredinirken ve analizi 10.
- flow sitometri analizi için kan tek-çekirdekli hücreleri ve immünofloresan boyama izolasyonu
- protokolü başlamadan önce, RT'ye ayıran çözüm ön ısıtmak.
- mikrosantrifüj tüpüne (adım 2.2 elde 100 ila 200 ul), ve çözelti hacmi 500 ul kadar PBS / 1 mM EDTA çözeltisi ilave bir kan örneği aktarın. Dikkatlice 30G iğne ve 1 ml şırınga ile kan ihtiva eden çözelti altında çözüm ayrılması 500 ul tabaka. kan ve ayırma çözüm karışmaz.
- Oda sıcaklığında 20 dakika boyunca (fren olmadan) 800 x g'de santrifüjleyin tüpler. Santrifüj işleminden sonra, bir pipet kullanılarak, hücresel bir halka (opak beyaz tabaka) toplar. Bir mikrosantrifüj tüp hücreleri aktarın.
NOT: opak beyaz tabaka lenfositler yanı sıra monositler içerir ve alt katmanı arasında görünür - ayırma çözeltisi - ve üst katmanda. - 1 ml ilave edilirPBS çözeltisi, santrifüj 10 dakika boyunca 350 xg'de tüp. FACS tampon 600 ul tekrar süspansiyon hücreleri.
- (100 ul her biri) saflaştırılmış anti-CD16 / 32 antikorları, 10 ug / ml ilave edilir ve altı farklı tüplere hücre süspansiyonu 100 ul dağıtın.
- FACS tamponu içinde seyreltilmiş, aşağıdaki antikorlar ya da bunların ilişkili izotip kontrolleri 100 ul hücreleri etiketlemek: (1) / anti-B220 (1) /anti-CD45.2 ve anti-Ly6C / anti-CD115, anti-CD3 bir kombinasyonunu /anti-CD45.2 veya anti-CD45.2 tek başına dengeleme ayarları için, anti-CD115.
- 30 dakika boyunca 4 ° C'de tüpler her inkübe edin.
- Her tüpe FACS tamponu 2 ml ekleyerek hücreleri yıkanır ve daha sonra 350 x g'de 10 dakika boyunca santrifüj tüpleri ve bir pipet kullanılarak süpernatan atılır.
- 500 ul soğuk PBS etiketli hücreleri tekrar süspansiyon. Buz üzerinde hücreleri tutun ve toplama ve analiz 10 flow sitometri gerçekleştirmeden önce ışıktan korunmalıdır.
- için mikroskop kemik iliği hücre süspansiyonları hazırlanması
- Bölüm 1.3'de açıklanan adımları izleyin, ancak adım 1.3.1, 10 dakika süreyle 72,26 xg'de her odasına hücreleri 10 5 kemik iliği hücreleri kullanın ve adım 1.3.4 yılında, dönerler.
- Esteraz aktivite deneyleri kemik iliği hücreleri kullanılarak
- Kemik iliği esteraz sitokimya deneyleri gerçekleştirmek için, adım 1.5.3.7 1.5 devam edin.
- kemik iliği hücrelerinin Mayıs-Grünwald Giemsa boyama
- Kemik iliği hücreleri boyamak için, Bölüm 1.6'da tarif edilen protokol takip fakat adım 1.6.1 içinde, 5 dakika süre ile Mayıs-Grünwald çözeltisi slaytlar inkübe edin.
Sonuçlar
C1498 fare modeli karakterize etmek için, iki büyük adımlarla ilerledi. İlk olarak, C1498 hücreleri in vitro olarak bunların hematopoietik kökenli ve olgunlaşma aşamasına (Şekil 1) belirlenmesi için karakterize edildi. Bu hücreler daha sonra konjenik farelere enjekte edildi ve indüklenen lösemik hastalığın niteliği, farklı özellikleri belirlemek için değerlendirilmiştir: lösemik hücre infiltrasyonu, bunların fenotip, kemik iliğinde hematopoietik hücrelerin bir miktarının (olgun ve progenitorlar / ön), frekans C1498 hücreleri ve kan olgun hematopoietik hücrelerin ve organ şişme değerlendirilmesi (dalak, karaciğer ve akciğer) ve hücresel bileşimin.
In vitro C1498 hücresi fenotipleri karakterize etmek için, hücreler, hematopoietik öncüler ve olgun hücreleri (Tablo 1) ile ifade edilir moleküllerine karşı yöneltilen antikorlar ile etiketlenir ve sonuçlar akış cytomet kullanılarak analiz edilmiştirry. C1498 hücreleri Mac-1 (CD11b / CD18) (~% 7), B220 (>% 25) hücre yüzey ifadesi için pozitiftir ve bunlar CD3ε, T-hücre reseptör (TCR) Vβ zincirleri ve Mac hücre içi ifadesi sergilemiştir 3 (Şekil 2A ve B). hücreler, hücre yüzey markörlerinin Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, pan-NK molekülleri için negatif ve CD4 ve CD8 hücre içi ifadesi için (veriler gösterilmemiştir) . Daha sonra hematopoietik kök hücreler ve progenitorlar (Tablo 1) işaretleri için incelenmiştir. Ayrıca, CD117, CD34, Sca-1, CD150 ve CD16 / 32 hücre yüzey ifadesi için negatif idi (veriler gösterilmemiştir). Bu lösemili hücreler daha sonra yapışma, antijen sunumu ve ko-stimülatör moleküllerin ekspresyonunu belirlemek için test edildi. Hücreler yüzey belirteçleri LFA-1 (CD11a / CD18), CD44, CD31 (PECAM-1), ve H-2D B ifade, CD80, CD86 ve CD274 (veriler gösterilmemiştir) MHC sınıf II negatif idi. C1498 hücreleri, Therefore miyeloid (Mac-1, Mac-3) ve lenfoid işaretleri (B220, CD3, TCR) ifade edilmektedir.
daha iyi hematopoetik soy karakterize etmek için myeloperoksidaz ifade immünofloresan mikroskopi kullanılarak değerlendirildi. Tüm hücreleri onların miyeloid kökeni (Şekil 3A) doğrulandı miyeloperoksidaz, pozitif idi. Hücrelerin büyük bir kısmı, aynı zamanda α-naftil butirat esteraz (Şekil 3B, sol panel) için pozitif boyandı, ve bazıları naftol AS-D kloroasetat esteraz (siyah oklar) (Şekil 3B, sağ panel) için boyandı. Sonuçlar hücrelerin monositik ve granülositik hücrelerin karışımları ihtiva göstermektedir. Mayıs-Grünwald Giemsa boyama yapıldıktan sonra, C1498 hücreleri, yüksek Nucleo-sitoplazmik oranı ile çekirdeğinde 3 ila 5 nükleol, perinükleer halo, çok sayıda vakuoller ve bazofilik sitoplazma (Şekil 3C bir patlama şeklinde bir yapıya görüntülemek için gözlendi ). thUS, C1498 hücre çizgisi monoblastlardan ve miyeloblast oluşmaktadır.
C1498 hücreleri (CD45.2 +), daha sonra damar içine CD45.1 + farelere enjekte edildi. fareler hücreleri enjekte edildi 17 ila 19 gün sonra yenik düştü. hastalığın öldü önce lösemi türü analiz edilebilir, böylece bu fareler kurban edildi. PBS enjekte edildi Kontrol fareleri, karşılaştırma için, aynı zaman noktalarında analiz edilmiştir. C1498 hücre enjekte edilen fareler May-Grünwald Giemsa lekeleme (Şekil 4A) yapıldı sonra hücrelerin yüksek benzeri bir görünüm ile gösterildiği gibi, kemik iliği içine C1498 hücrelerinin yoğun infiltrasyonu gösterilir. Onlar da akut miyelomonositik lösemi özelliğidir monoblastik ve miyeloblastik hücrelerin birikimini gösteren, onların monosit ve granülositik fenotipleri (Şekil 4B ve C) korudu.
dmedüller hematopoetik hücreler sayılar, lösemik hücreler işgali, CD45.2 + C1498 hücreleri, B lenfositik, monositik ve (ataları, öncüleri ve olgun hücreler dahil) granülositik nüfus aşağıdaki düşüktü immunofluorescent boyama ve sitometri analizi çok parametrik akışını kullanarak ölçüldü olmadığını etermine. Lösemili hücrelerin hematopoietik hücrelerin% 36 16 temsil (veriler gösterilmemiştir). diğer hücre tipi tüm granülositik hücrelerin ortalama 3 kat ortalama olarak 4 kat, B hücresi alt-gruplar için ortalama 5-kat (PBS enjekte edilmiş farelerde daha C1498-enjekte edilmiş farelerde önemli ölçüde daha düşük sayıda mevcuttu C monositik alt-gruplar için) (Şekil 5A).
Lösemi ve kontrol fare kan örneklerinde tek çekirdekli hücrelerin frekanslarının bir araştırma da lenfositler (Şekil 6A) arasında benzer bir yüzdesi, ancak monositik daha yüksek bir frekans ihtiva ettiğini gösterdive lösemi hücreleri. Bu özellikler, akut miyelomonositik lösemi 11 (Şekil 6B) temsil etmektedir.
Akut miyelomonositik lösemi 12 diğer özellikleri arasında, C1498-enjekte edilen fareler şişmiş karaciğerleri (hepatomegali), akciğer ve dalak (splenomegali) (Şekil 7A) ile sunulmaktadır. CD45.2 + C1498 hücrelerin çeşitli frekanslar immünofloresan boyama ile bu organlarda tespit ve analiz (Şekil 7B) akış sitometrisi edildi. Splenomegali sızmış monositlerin yüksek sayıda kaynaklanabilir, biz de dalak nüfus oranlarını tahmin. B lenfosit, monositik hücreler ve granülositik hücre fraksiyonlarının sayılar 2 kat ortalama, önemli ölçüde daha büyük olan, 2.5 kat, 3 kat, sırasıyla kontrol dalak (Şekil 7C) göre lösemi dalaklarında.
İnce sayfa = "1"> 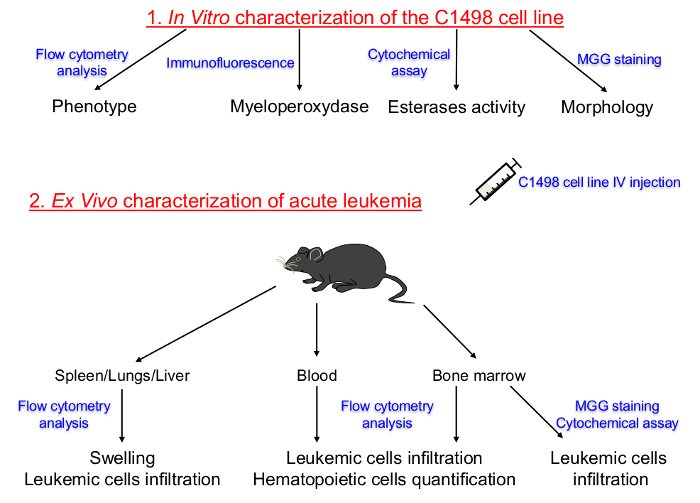
In vitro kültürlü C1498 Cep Hatları ve Akut Lösemi in vivo Tanımlar Karakterizasyonu için Kurma Protokolün. Hematopoetik soy ve doku kültüre C1498 hücrelerinin farklılaşma aşamasında Şekil 1. şematik Temsil ilk belirlendi. C1498 Hücreler daha sonra, akut lösemi gelişiminin uyarılması için konjenik farelere enjekte edildi. kemik iliği, periferik kan, dalak, karaciğer ve akciğer dokularında izolasyonu C1498 hücreleri infiltrasyonu sonra frekansları, fenotipleri ve morfolojik değişikliklerini saptamak amacıyla yapılmıştır. IV: Damar MGG:. Mayıs-Grünwald Giemsa bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
reklam / 54270 / 54270fig2.jpg "/>
In vitro kültür. Nokta diyagramları ve hücre yüzeyi (A), ve hücre içi (B) histogramları sitometrisi Örnek akış sonra C1498 Hücreler Şekil 2. fenotipik analizi hematopoetik olgun hücre farklılaşması ile ilişkili moleküller gösterilmiştir C1498 eksprese. C1498 hücreler, hücre yüzeyi CD11b, CD18 ve B220 işaretleri ya da bunların izotip kontrolleri için spesifik olan floresan antikorlar kullanılarak kültürler hasat yıkandı ve etiketlenmiştir. hücre içi boyama için, hücreler, sabit geçirgenleştirildi ve Mac-3, CD3ε karşı antikorlar ve TCR (T hücre reseptörü) Vβ zincirli ya da izotip kontrolleri ortak bir epitop ile etiketlenmiştir. Analizler, canlı hücreleri ile yolluk kullanılarak gerçekleştirilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
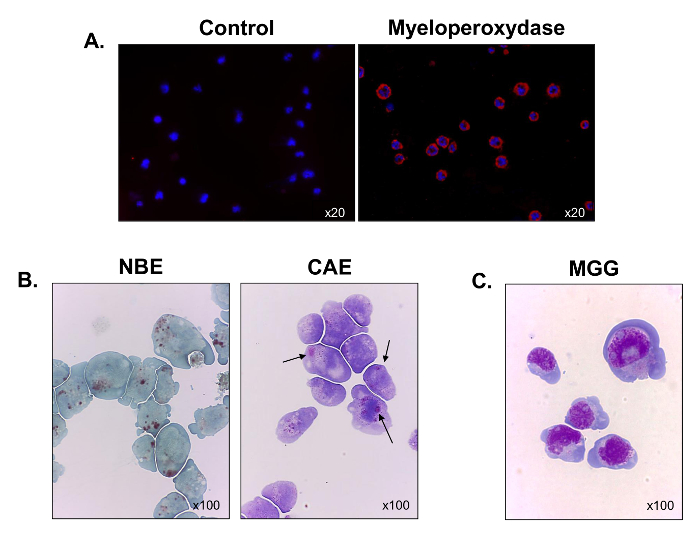
Şekil 3. Fonksiyonel ve Kültür C1498 Hücrelerinin Morfolojik Karakterizasyonu. C1498 hücre kültürlerinden hasat edilir ve mikroskopi için slaytlar üzerinde santrifüjlenmiştir. (A), miyeloperoksidaz ifadesi için boyama immünofloresan kullanılarak gerçekleştirildi. (B) Sitokimyasal reaksiyonlar α-naftil butirat esteraz (BOU) ve naftol AS-D kloroasetat esteraz analiz etmek için kullanıldı (CAE) C1498 hücreleri faaliyetleri. Hücreler, kahverengi, kırmızı, mor-geniş, sitoplazmik granüller sırasıyla gözlenmiştir her etiket için pozitif olarak kabul edilmiştir. C1498 hücrelerinin (C) May-Grünwald Giemsa (MGG) boyama. Her boyama deney için, mikroskop objektif büyütme gösterilir. Her bir görüntü, üç ayrı deneyi temsil etmektedir.large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
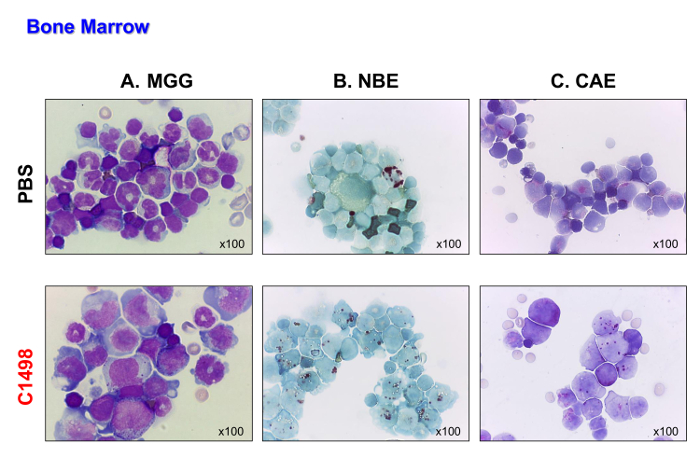
Şekil 4. PBS ve Kemik İliği morfolojileri Fare C1498 enjekte. Kemik iliği hücreleri PBS ve C1498 hücre enjekte edilen farelerin izole ve mikroskopi için slaytlar üzerine santrifüj edildi. (A) Mayıs-Grünwald Giemsa (MGG) boyama. (B ) α-naftil bütirat esteraz (NBE) ve kloroasetat esteraz (CAE) işlevleri sitokimya kullanılarak değerlendirildi AS-D (C) naftol. Panel A'da, bant (olgunlaşmamış) veya bölümlenmiş (olgun) nötrofiller PBS enjekte edilmiş farelerde daha C1498-enjekte edilen farelerin kemik iliği daha az görünür. Panel B, ve C kontrol kemik iliğinde görülen sayılar göre lösemi kemik iliği monositik ve granülositik hücrelerin birikimi olduğunu gösterir. Herşeymikroskopik analizler 100X büyütme objektif kullanılarak gerçekleştirilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
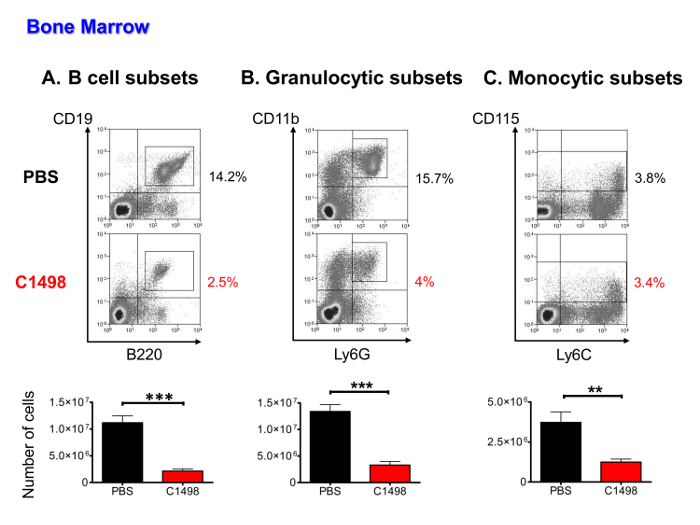
Şekil 5. PBS ve Medüller Populasyonlarının Kantitatif Analiz Fare C1498 enjekte. Kemik iliği hücreleri PBS ve C1498 hücre enjekte edilen farelerin izole ve hücre sayımı yapıldı sonra tahmin edilmiştir. Farklı hücre popülasyonlarının frekansları immün ve sitometri analizi canlı hücre kapı akış sonra belirlenmiştir. (A), B hücresi alt-gruplar B lenfositler (B), granülositik hücrelerin olgun pro-B hücreleri kademeli olarak CD19 + B220 + hücrelerinin dahil öncüleri bir yer ve CD11b + Ly6G + soy, - CD3. CD115 + ve monosit aşamalarını olgun atası hücreleri dahil - nd olgunlaşmamış ve olgun granülositler (C) monositik alt kümeleri CD3 olarak tanımlanmıştır. n = 7 fare / grup, ve veri = ortalama ± SEM gösteren histogramlar olarak sunulmaktadır. *** P <0.0001 ve ** p <0.01, PBS ve C1498 enjekte fareler karşılaştıran Student en t testi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
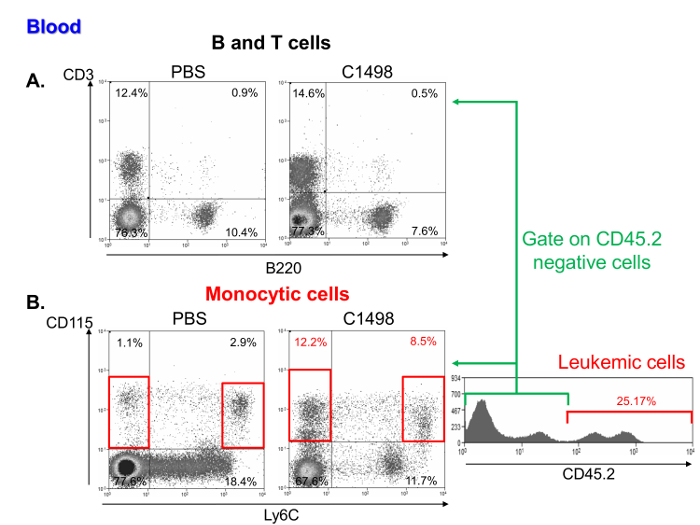
PBS ve Mononükleer Hücre Alt Grupları Şekil 6. Kan Analiz fareler C1498 enjekte. Sırasıyla, PBS ve C1498 CD3 + ve B220 + hücrelerinin olarak tanımlanan (a) T ve B limfosit yüzdeleri, dot sitometrisi lekeleri Örnek akış hücresi enjekte. ve CD115 + LY6C yüksek hücre - fareler (B) C1498 lösemik ve kontrol monositik hücre frekansları (PBS) farenin CD115 + LY6C analiz edilmesi ile belirlenmiştir. Analiz canlı hücreleri yolluk gerçekleştirildi. Lösemi ve kontrol fareleri karşılaştırmak için, C1498 hücreleri hariç tutulmuştur + CD45.2. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
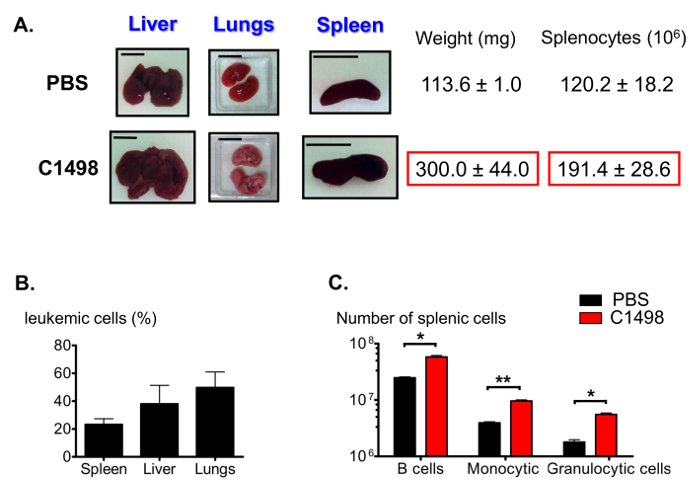
Lösemi ve Kontrol Farelerde Dalak Populasyonlarının Şekil 7. tahmini. (A), lösemi farelerde şişen, karaciğer, akciğer ve dalak Örnek fotoğraf kontrol fareleri ile karşılaştırıldığında. Dalaklar, doku bozulması, aşağıdaki toplanır ve tartılır ve splenositler sayıldı. (B) Histogram fark lösemik hücre frekansları temsil edenerent organları immün CD45.2 + hücreleri için yapıldı ve sonuçlar flow sitometri kullanılarak analiz edildikten sonra. (C) dalak B, immün sonra granülositik ve monositik hücre sayıları tahminleri ve analiz yolluk akım sitometri canlı CD19 + B220 belirlemek için yapılmıştır + CD3 - CD11b + Ly6G + CD3 - CD11b + Ly6C - ve CD3 - CD11 b + Ly6C yüksek hücreler. akciğerler, dalak ve karaciğerleri için gösterilen ölçek çubukları 1 cm göstermektedir. .. 5 = - 8 fare / grup, ve veri ortalama ± SEM olarak histogramlar temsil edilir * p <0.05; ** p = 0.0033, PBS ve karşılaştırma Student t testi en C1498-enjekte edilen fareler , lütfen Bu rakamın büyük halini görmek için buraya tıklayın.
| hücre Tipi | Zar veya hücre içi moleküller |
| Öncüleri ve Olgun hücreleri | |
| NK hücreleri | NK1.1 + pan-NK + |
| NKT hücreleri | NK1.1 + pan-NK + TCR Vbeta + (8.2), CD3 + |
| T lenfositleri | TCR Vbeta +, CD3 +, CD4 +, CD8 + |
| B hücreleri öncüleri ve B lenfositleri | B220 + CD19 +, CD21 / + 35 |
| granülositik öncüleri ve granülositler | Ly6G + Mac-1 + CD11b + |
| monositik ön-maddeleri ve monosit / makrofajlar | CD11b +, Mac-1 +, Mac-3 +, CD21 / + 35, CD115 + Ly6Chi |
| atalarıdır | |
| multipotent atalarıdır | CD117 + Sca-1+ CD34 + (Lin CD150-) |
| lenfoid hazırlanmış multipotent progenitörler | CD117hi Sca-1hi CD127 + (Lin-) |
| ortak lenfoid atalarıdır | CD117lo Sca-1LO CD127 + (Lin-) |
| Ortak miyeloid atalarıdır | CD16 / 32lo CD117 + CD34int (Lin Sca-1-) |
| granülosit-makrofaj progenitörler | CD16 / 32hi CD117 + CD34hi (Lin Sca-1-) |
| megakaryosit-eritroid atalarıdır | CD16 / 32lo CD117 + CD34lo (Lin Sca-1-) |
| Hematopoetik kök hücreler | CD117 + Sca-1 + CD150 + (Lin CD34) |
Tablo Hematopoetik hücre soylarının ve Farklılaşma 1. İşaretleyiciler.
CD: farklılaşma küme; Lin: Olgun hücrelerin belirteçleri; lo:Düşük ifadesi; hi: yüksek ifade; int: ara ifade; NK: doğal öldürücü hücreler; TCR: T-hücresi reseptörü.
Tartışmalar
Daha önce yapılan çalışmalarda, C1498 hücre çizgisi, akut granülositik 5, 6 ya da miyelomonositik NKT 7 hücre lösemi bir teşvik edici olarak tanımlanmıştır. Ancak literatürde demonstrasyon veri yok veya eksik ya idi. Burada sunulan protokol gibi flow sitometri, immünofloresans, MGG boyama ve sitokimyasal tahlilleri gibi farklı teknikler, kültürlü C1498 hücreleri karakterize etmek ve onlar enjekte edildikten sonra farelerde olduğu lösemi doğasını belirlemek için kullanır.
Bu immün sonra in vitro kültür C1498 hücrelerinde fenotiplenir ve sitometrisi analizi yapıldı akışındaki Bu hücreler daha önce literatürde 6,7 tarif edilmiştir birkaç hücre yüzeyi hematopoietik belirteçleri olmasından ötürü, bazı sınırlamalar görülmektedir. Bizim sonuçları ile uyum içinde, Labelle ve ark. Akış cytomet kullanarak C1498 hücreleri üzerinde olgun TCR hücre yüzey ekspresyonunu dikkat etmediry boyama. Onlar CD3ε ve TCRVβ8.2 mRNA 7 algılandı sonra ancak, bir NKT hücre hattı olmalarını kabul. Ayrıca hücreler (>% 70) çoğu TCRVβ zincirleri ve CD3ε moleküllerin hücre içi ekspresyonunu görülmektedir, ancak Mac-3 molekülünün birlikte hücre içi ekspresyonu, aynı zamanda orada dolayı hematopoietik soyların belirlenemedi.
Myeloperoksidaz, MGG boyama ve sitokimya kullanılarak fonksiyonel esterazları analiz değerlendirmeler C1498 hücre hattının bir miyeloid kökeni vardı ve monoblastlardan ve miyeloblast oluştuğunu göstermiştir. Bu sonuçlar boyama flow sitometri analizi elde edilmiştir, Mac-3 + hücrelerinin yüzdesi ile uyumlu idi. Bu adımlar önemli deneyler temsil nicel olmamasına rağmen yapılacak. Aslında, hiç ya da F ifade eden hematopoietik hücrelerin soyu ile farklılaşma aşamasında karakterize etmek için en iyi, mevcut yöntem, şimdiye kadar, devamew spesifik fenotipik belirteçler.
boyanma Flow sitometri C1498 hücreleri damardan enjekte edildikten sonra congenic farelerde akut lösemi gelişimini göstermek için yardımcı oldu. Periferik kan ve çeşitli organlarda sızmış CD45.2 + C1498 hücreleri izole edildi ve bunların frekansları belirlenmiştir. Niceleme da immünofenotiplendirme sonra doğal medüller ve dalak hücreleri analiz etmek için yapılmıştır. Onlar birkaç hematopoetik belirteçler ifade edilen C1498 hücre fenotipi organlarda incelendiğinde zaman Sınırlamalar rastlanmıştır (bunlardan sadece bir kaç B220 + idi). gözlenen akut lösemi doğasını, Mayıs-Grünwald Giemsa boyama ve monositik faaliyetlerinin analizini tanımlamak ve granülositik esterazlar kemik iliği kullanılarak gerçekleştirilmiştir. Sonuçlar C1498 hücreleri miyelomonositik lösemi başlangıcı açığa onların miyeloblastik ve monoblastik morfolojisi ve fonksiyonu korunmuş olduğunu göstermiştir.
, özel dikkat pH verilmelidir. granülosit ve lenfositler, yüksek pH değerlerinde, bu test için pozitif leke çünkü Örneğin, α-naftil butirat esteraz etkinliği sadece 6.0 pH'da monositik hücreler için geçerlidir. Hücreleri oturtulması MGG boyama yapmadan önce tavsiye ve biz C1498 hücreleri kullanarak esteraz sitokimyasal reaksiyonları yaparken sadece CAF tespit tatminkar sonuçlar sağladığı gösterdi değildir. Sitometrisi numuneleri (örneğin, kan, kemik iliği, dalak hücreleri) her prosedür sırasında buz üzerinde tutulmalıdır CD115 molekülünün ekspresyonunu ve akış tarafından algılama korumak için. Hiçbir boyama flow sitometri ve / veya immünofloresan deneyleri, antikorların referans kendi depolama yeniden gözlenmesi durumundacommendations ve seyreltme kontrol edilmelidir. malzemeler / ekipman tablosunda belirtilen referanslar akış sitometri veya immünofloresan uygulamaları için seçilmiştir. Birincil / ikincil antikorlar veya konjuge fluorophores nedeniyle uygunsuz depolama faaliyetlerini kaybetmiş olabilir (örneğin, ışığa veya ısıya maruz kalma), yanlış seyreltme, geniş donma / çözülme veya kontamine tamponlar kullanılması. Onlar düzgün çalıştığından emin olmak için pozitif kontrol çalıştırın. Fare kemik iliği ya da proteinleri eksprese ettiği bilinen dalağından alınan hücreler kullanın. yüksek arka plan ve non-spesifik boyama önlemek için, hücrelerin düzgün yıkanmış ve (Immünofloresan için) yüksek nemde tutulması ve talimat olarak antikorlar seyreltilmiş olduğunu emin olun. doğru örnek arka plan seviyesini belirlemek için izotip kontrol antikoru ve primer antikor için aynı konsantrasyon ve seyreltme kullanın. esteraz sitokimya deneyler için,reaktifler saflaştırılmış fare dalak granülositik (Ly6G +) ve monositik (CD115 +) hücreleri içeren pozitif ve negatif kontrol slaytlar kullanılarak test edilebilir.
Bu çalışmada açıklanan prosedür C1498 hücrelerin enjeksiyonundan sonra farelerde gözlemlenen lösemik özellikleri birçok insan akut miyelomonositik lösemi 11,12 ortak ayırt edici ortak gösterdi. işgal lösemik hücrelerin olgun ve olgun olmayan (progenitör ve öncüler) medüller hematopoietik hücrelerin bir azalma ile sonuçlandı. monositik hücreler gibi C1498 hücreleri, periferik kandaki yüksek frekans (>% 20) bulunmaktadır. Hepatomegali, splenomegali lösemik hücrelerin infiltrasyonu sonuçlandığı gözlenmiştir, ve B lenfositleri ve miyeloid hücrelerde önemli artışlar splenomegali birlikte gözlenmiştir. kan platelet sayıları hematoloji analiz cihazı kullanılarak tahmin edildiğinde trombositopeni gözlenmiştir.
Bu gösteri olduN, in vitro deneyler kullanarak, C1498 hücreleri, çözünebilir faktörleri 13 salgılayan normal murin hematopoez inhibe. Birkaç tümörlü fare modellerinde, (monositik ve granülositik hücreleri dahil olmak üzere), olgun myeloid hücreleri, anti-tümör spesifik T hücresi aktivasyonunu ve çoğalmasını 14 inhibe eden dalak, kemik iliğinden geçirmek için gösterilmiştir. Bu durumda, kemik iliği gözlendi hematopoietik hücrelerin azalma hematopoez ve / veya bunların göç bir eksiklik ya da meydana gelmiş olabilir. Bu ikinci bir mekanizma, periferik kandaki monositoz varlığının veya dalakta büyütülmüş miyeloid fraksiyonların gözlem açıklayabilir. Hücreler geliştirilmiş dalak hematopoez türemiş olabileceğini de düşünülebilir. Olgun B ön-maddeleri 15 lenfositler gibi Gerçekten de, sabit durum koşulları altında, dalak B hücrelerinin, bazı alt-gruplar tespit edilmiştir. Ayrıca, inflamatuar koşullar altında, medullary kök ve progenitorlar hücreler olgun monositler 16 üretimini uyarmak için dalak taşınmaya gösterilmiştir. Bu protokol bize lösemi gelişiminde katılan ve ek fonksiyonel yanı sıra moleküler deneyleri bunu yapmak için istihdam edilmelidir mekanizmaları ile ilgili sonuçlara varmak için izin vermez. Ancak bu veriler akut miyelomonositik lösemi klinik özellikleri hakkında ayrıntılı bilgi içermektedir ve değerlendirmek ve yeni terapötik ajanların etkilerini anlamak için araştırmacılara yardımcı olacaktır.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
Malzemeler
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/mL) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/mL) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10X) | BD Biosciences | 555899 | 1/10 |
| NaOH 10N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 mL tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24x24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150MM (capillary tube) | Fisherbrand | 1154-6963 | |
| 26G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29G | Terumo | BS05M2913 | |
| 30G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 mL) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15-30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 mL syringe | Terumo | SS-10L | |
| 1 mL syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Referanslar
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, &. #. 2. 1. 6. ;., Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. . Handbook of Flow Cytometry Methods. , (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır