Method Article
Un protocole détaillé pour caractériser la lignée cellulaire murine C1498 et son modèle associé leucémie Souris
Dans cet article
Résumé
Ce manuscrit fournit un procédé technique qui peut être utilisée pour caractériser des cultures de cellules C1498 in vitro et la leucémie aiguë induite chez la souris après leur injection. analyses phénotypiques et fonctionnelles sont effectuées à l'aide de cytométrie de flux, la microscopie d'immunofluorescence, cytochimie et May-Grünwald Giemsa.
Résumé
L'injection intraveineuse de cellules C1498 à des souris syngéniques ou congéniques a été réalisée depuis 1941. Ces injections se traduisent par le développement de la leucémie aiguë. Cependant, la nature de cette maladie n'a pas été bien documentée dans la littérature. Ici, nous fournissons un protocole technique pour caractériser les cellules C1498 in vitro pour déterminer la nature de la leucémie induite in vivo. La première partie de cette procédure est axée sur la détermination de la lignée hématopoïétique et le stade de la différenciation des cellules C1498 cultivées. Pour ce faire, multiparamétrique coloration par cytométrie de flux est utilisée pour détecter des marqueurs de cellules hématopoïétiques. La microscopie en immunofluorescence, cytochimie et coloration May-Grünwald Giemsa sont ensuite effectuées pour évaluer l'expression de la myéloperoxydase, l'activité des estérases et la morphologie cellulaire, respectivement. La seconde partie de ce protocole est consacrée à la description de la maladie de la leucémie qui est induite dansvivo. Ce dernier peut être réalisé en déterminant les fréquences des cellules leucémiques et inhérentes dans le sang, les organes hématopoïétiques (par exemple, la moelle osseuse et la rate) et les tissus non lymphoïdes (par exemple, le foie et les poumons) en utilisant une coloration spécifique et cytométrie de flux analyses. La nature de la leucémie est alors confirmée à l'aide de May-Grünwald Giemsa et coloration pour esterases spécifiques dans la moelle osseuse. Ici, nous présentons les résultats qui ont été obtenus en utilisant ce protocole chez les souris C1498- et PBS-injecté âge.
Introduction
la leucémie myéloïde aiguë (LMA) est caractérisée par la prolifération incontrôlée des cellules myéloïdes hématopoïétiques qui sont bloqués à différents stades de maturation. Cette dysrégulation peut affecter le granulocytaire, monocytaire, érythrocytaire ou voies de différenciation megaryocytic 1. les cellules AML accumulent dans la moelle osseuse, ce qui conduit à une altération de l'hématopoïèse, ce qui se traduit par une thrombopénie, une lymphopénie et une anémie. Les cellules leucémiques envahissent également le sang et les organes non lymphoïdes.
Le modèle C1498 de la souris a été utilisé pendant des décennies comme un modèle pour la leucémie aiguë puisque les cellules cancéreuses ont été isolées à partir d' un 10-month-old souris femelle leucémique C57BL / 6 (H-2 b) en 1941. La littérature décrit l'invasion dans le sang , les organes hématopoïétiques (par exemple, les ganglions lymphatiques et la rate) et des organes non-hématopoïétiques (par exemple, le foie, les poumons, les ovaires et les reins) par les cellules C1498 hautement prolifératives après qu'ils ont été injectés via un dansintraveineux, sous - cutanée ou par voie intra-péritonéale à des souris sensibles 2-4. Toutefois, ce modèle de souris a été signalé pour induire soit granulocytaire 2,5 ou myélomonocytaire 6 leucémie. Plus récemment, une étude publiée en 2002 décrit ce type de cancer que NKT murine leucémie 7. Ainsi, la littérature est différente en ce qui concerne la nature de cette lignée de cellules C1498 et la leucémie associée qu'il induit chez la souris. Ces écarts sont principalement dus à un manque d'informations détaillées et publiées à jour sur les cellules et la maladie leucémique en général, parce que de nombreuses études ont été réalisées dans les années 1950 - 70.
Ici, nous fournissons un protocole détaillé pour décrire la façon de caractériser les cellules C1498 et analyser la nature de la maladie leucémique qui est induite par l'injection intraveineuse à des souris. La première partie de ce protocole est consacrée à la description des cellules C1498 qui ont été cultivées in vitro. fluorescent anti-organismes dirigés contre la surface et des marqueurs hématopoïétiques intracellulaires ont été utilisés pour déterminer leur phénotype cytométrie en flux. La présence de la myéloperoxydase a été évalué en utilisant la microscopie à immunofluorescence, leur lignée et la différenciation hématopoïétique étape a été évaluée à l'aide cytochimie pour évaluer l'activité des estérases et May-Grunwald Giemsa a été réalisée. Les cellules C1498 ont ensuite été injectées dans des souris, et la maladie de la leucémie aiguë qui a été induit est décrit dans la seconde partie de ce manuscrit. Les mêmes techniques ont été utilisées pour déterminer les fréquences et les phénotypes des cellules leucémiques et inhérentes à la moelle osseuse, le sang périphérique, la rate et les organes non-hématopoïétiques (le foie et les poumons).
Ce protocole est hautement reproductible, et les données présentées ici permettra aux chercheurs d'évaluer les effets de nouvelles stratégies thérapeutiques. Ce modèle de la leucémie de la souris a déjà été utilisé pour tester l'immunothérapie approche d'unnd différents médicaments chimiothérapeutiques du cancer 8,9. Leur efficacité a été évaluée en déterminant l'évolution de la charge tumorale et le taux de survie. Ce protocole peut être utilisé pour fournir des informations supplémentaires sur la distribution et de subsistance des populations de cellules hématopoïétiques leucémiques et d'autres pendant le traitement.
Protocole
Logement des animaux et toutes les procédures expérimentales ont été approuvées par le Comité d'éthique de protection des animaux locale, CEEA.NPDC (accord no.512012), et toutes les expériences ont été réalisées en conformité avec les directives françaises et européennes pour le soin et l'utilisation des animaux de laboratoire.
1. Dans la caractérisation in vitro de la lignée cellulaire C1498
- La culture in vitro de cellules C1498
- Préparer RPMI complet (Roswell Park Memorial Institute) 1640 en ajoutant 50 ml de sérum bovin fœtal (FBS), 5 ml de pénicilline (100 U / ml) -streptomycin (100 pg / ml), 500 ul de 50 mM de β-mercaptoéthanol , 5 ml de N-2-hydroxyéthylpipérazine-N-2-éthane sulfonique (HEPES), 5 ml d'acides aminés non essentiels et 5 ml de pyruvate de sodium à 500 ml de milieu RPMI.
- Cultiver la lignée cellulaire C1498 dans RPMI complet. Récolter les cellules en suspension par pipetage, et transférer les cellules dans un tube de 50 ml. Centrifuger à 350 g pendant 10 min, puis retirez le supernatante.
- Ajouter 20 ml de solution saline tamponnée au phosphate (PBS) (1x) solution, centrifuger à 350 g pendant 10 min, et retirer le surnageant.
- Remettre en suspension les cellules dans 10 ml de Fluorescence-Activated Cell Sorter (FACS) du tampon (2,5 g d'albumine de sérum bovin (BSA) en poudre et 2 ml d'acide éthylènediaminetétraacétique (EDTA), solution à 0,5 M dans 500 ml de solution PBS). Compter les cellules en utilisant une cellule Thoma chambre de comptage après coloration des cellules avec du bleu trypan.
- la caractérisation phénotypique de la lignée de cellules C1498 en utilisant une immunocoloration et analyse par cytométrie de flux
- une coloration de surface cellulaire
- Préparer tampon FACS.
- Ajuster les cellules récoltées dans un tampon FACS à 10 7 cellules / ml et distribuer 10 6 cellules (dans 100 ul) pour chaque expérience de marquage en cytométrie de flux des tubes.
- Etiqueter les cellules avec 100 pi d'anticorps suivants ou leurs contrôles isotypiques associés dilués dans un tampon AAAF:
- Formearkers de précurseur et des cellules différenciées, étiqueter les cellules avec anti-CD11b / anti-CD18 (1), anti-Ly-6G (1), anti-CD19, anti-B220 (2), anti-NK1.1, anti- CD49b, anti-CD4 (1), anti-CD8 (2), anti-CD3 (3), des anticorps anti-CD115, anti-CD21 anti TCRVβ / 35.
- Pour hématopoïétiques cellules souches / progénitrices marqueurs, utiliser une combinaison d'anti-CD34 / anti-CD117 / anti-Sca-1, anti-CD150 / anti-CD117 / anti-Sca-1, anti-CD117 / anti-CD127 ou anti- anticorps CD16 / 32-biotine seul.
- Des marqueurs des fonctions cellulaires (par exemple, l' adhérence, la présentation des antigènes, des molécules co-stimulatrices et les récepteurs), colorer les cellules avec un anticorps anti-CD18 (2) / anti-CD11a, anti-CMH de classe I, anti-CMH de classe II, anti - CD31, anti-CD44, anti-CD80-biotine, l'anti-CD86 et anti-CD274 anticorps.
- Incuber tous les tubes de cytométrie en flux à 4 ° C pendant 30 min.
- Laver les cellules deux fois par addition de 2 ml de tampon FACS à chaque tube, centrifuger à 350 g pendant 5 min, et retirer le surnageant.
- Ajouter 100 ul de tampon FACS à chaque tube et procéder à une coloration secondaire en ajoutant 100 pi de streptavidine fluorescente (1/100 dans du tampon FACS pour une dilution finale de 1/200) aux anticorps biotinylé conjugués. Incuber les tubes à 4 ° C pendant 30 min.
- Laver les cellules deux fois comme suit: ajouter 2 ml de tampon FACS à chaque tube, centrifuger les tubes à 350 g pendant 5 min, et retirer le surnageant par pipetage.
- Resuspendre les cellules dans 500 ul de PBS froid et placer les cellules sur la glace, en les gardant dans l'obscurité en utilisant une feuille d'aluminium pour couvrir les tubes. Analyser les résultats en utilisant un cytomètre 10.
- coloration intracellulaire
- Préparer un tampon de fixation par addition de 125 ml d'une solution à 4% de paraformaldehyde (PFA) à 375 ml de solution PBS.
NOTE: Pour préparer 500 ml de 4% PFA, chaleur 400 ml de solution PBS à environ 60 ° C sur une plaque d'agitation dans une hotte ventilée. Ajouter 20 g de poudre PFA, et augmenter le pHjusqu'à ce que le PFA est dissous. Laisser refroidir la solution, ajuster le pH à 6,9, et de faire monter le volume à 500 ml avec PBS. - Préparer le tampon de perméabilisation en ajoutant 0,5 g de saponine et 0,5 g de BSA pour 500 ml de solution PBS.
- Ajuster les cellules récoltées dans un tampon FACS à 10 7 cellules / ml et distribuer 10 6 des cellules (100 ul) pour chaque essai de coloration en cytométrie de flux des tubes. Centrifuger les cellules à 350 g pendant 5 min, et retirer le surnageant.
- Fixer les cellules dans 200 pi de solution PFA 1% et incuber pendant 10 min à 4 ° C.
- Ajouter 2 ml de tampon de perméabilisation à chaque tube, centrifuger les tubes à 350 g pendant 5 min, et retirer le surnageant par pipetage. Ajouter 100 pi de tampon de perméabilisation à chaque tube.
- Marquer les cellules avec 100 ul d'anticorps suivants ou leurs témoins isotypes correspondants après leur dilution dans un tampon de perméabilisation: anti-CD3 (2) / anti-CD8 (1), anti-CD3 (3) / anti-CD4 (2), anti-CD107b et anti-CD3 (3) / anti-TCRVβ.
- Incuber les cellules à 4 ° C pendant 30 min.
- Laver les cellules deux fois par addition de 2 ml de tampon de perméabilisation à chaque tube. Centrifuger les tubes à 350 xg pendant 5 min, et retirer le surnageant.
- Ajouter 100 pi de tampon de perméabilisation aux cellules. Procéder à une coloration secondaire en ajoutant 100 pi de streptavidine fluorescente dilué dans perméabilisant tampon pour anticorps biotinylé conjugués. Incuber les tubes à 4 ° C pendant 30 min.
- Ajouter 2 ml de perméabilisation tampon pour chaque tube, centrifuger les tubes à 350 g pendant 5 min, et retirer le surnageant. Répétez cette étape une fois de plus.
- Resuspendre les cellules dans 500 ul de PBS froid, puis placer les cellules sur la glace dans l'obscurité. Analyser les résultats en utilisant un cytomètre de flux 10.
- Préparer un tampon de fixation par addition de 125 ml d'une solution à 4% de paraformaldehyde (PFA) à 375 ml de solution PBS.
- une coloration de surface cellulaire
- Préparation d'une suspension de cellules sur des lames pour microscope
- Wash 10 6 de la hacellules rvested C1498 (obtenues à l'étape 1.1.4) avec 5 ml d'AAAF froid tampon deux fois, et diluer les cellules dans 1 ml de tampon FACS froid. Placer les tubes sur la glace.
- Placez les diapositives dans les chambres jetables avec des cartes de filtres pré-joint et les placer dans un cytocentrifugeuse.
- Ajouter 100 pi de tampon FACS à chaque carte de chambre et le filtre, et tourner les 2 min à 4,52 x g.
- Ajouter 100 pi de cellules à chaque carte de chambre et le filtre, et tourner les cellules à 4,52 g pendant 2 min.
- Retirez délicatement les diapositives des chambres et l'air Sécher les lames avant de les colorer avec myéloperoxydase (étape 1.4), estérases (étape 1.5) ou May-Grünwald Giemsa (étape 1.6).
- coloration myéloperoxydase pour immunofluorescence
- Fixer les cellules sur les lames en immergeant les lames dans un mélange méthanol froid: acétone (1: 1) solution pendant 2 min, puis l'air sécher les lames.
- Pour confiner le liquide dans la zone de la diapositive contenant les cellules, dessiner un circle autour des cellules en utilisant un stylo hydrofuge.
- Rincer les cellules dans 200 ul d'une solution de PBS froid pendant 10 minutes.
- Bloquer les cellules dans 200 pi de tampon de BSA à 3% / PBS contenant 10 pi de sérum d'âne normale et 10 pg / ml d'anti-CD16 / 32 anticorps purifiés.
- Appliquer à 200 pi de la myéloperoxydase anti-souris (dilué à 20 pg / ml dans un tampon à 3% de BSA / PBS). Incuber les cellules O / N à 4 ° C dans une chambre humide.
- Laver les cellules avec 200 pi de 0,1% de SAB froid / PBS.
- Appliquer 200 pi d'anticorps IgG anti-chèvre dilué à 1/250 dans 3% de BSA / tampon PBS. Incuber les cellules pendant 2 heures à température ambiante dans une chambre humide.
- Laver les cellules 3 fois avec 200 pi de tampon de 0,1% de BSA / PBS et deux fois dans du PBS froid.
- Colorer les noyaux des cellules avec 200 pi de Hoechst dilués à 1/1 000 dans du PBS (à une concentration finale de 1 pg / ml) pendant 2 minutes à température ambiante.
- Laver les lames avec de l'eau et les laisser sécher à l'air avant mounting. Appliquer une goutte de milieu de montage 1 aux cellules, placez un bord d'un couvercle en verre sur la lame, et soigneusement abaisser sur les cellules en utilisant une pince. Appuyez doucement sur le couvercle en verre pour éliminer les bulles d'air.
- estérase cytochimie
Note: Pré-chaud tous les réactifs à température ambiante.- préparation fixateur
- Pour préparer la solution de citrate-acétone-formaldéhyde (CAF), ajouter 2,5 ml de solution de citrate, 6,5 ml d'acétone et 0,8 ml de formaldéhyde à 37% à une bouteille en verre. Mélanger délicatement et stocker à 4 ° C.
- Naphtol AS-D chloroacétate estérase (CAE) dosage de l'activité
- l'eau déminéralisée chaude à 37 ° C.
- Dans un tube de 50 ml, ajouter 1 ml de solution de nitrite de sodium dans 1 ml d'une solution de colorant. Mélanger délicatement et laisser reposer pendant 2 min. Ajouter 40 ml d'eau déminéralisée préchauffée, 5 ml de concentré à pH 6,3 tampon et 1 ml de solution de naphtol AS-D chloroacétate. Mélanger et transférer dans une jarre Coplin.
- Fixer les cellules sur ladiapositives (voir section 1.3) pendant 30 secondes avec une solution CAF (voir étape 1.5.1.1), et laver les lames pendant 45 secondes avec de l'eau déminéralisée.
- Placer les lames dans la solution qui a été préparée à l'étape 1.5.2.2 et incuber les lames à 37 ° C pendant 30 min dans une chambre d'humidité à l'abri de la lumière.
- Sécher les diapositives, puis rincez-les par immersion dans de l'eau déminéralisée pendant 2 min.
- Counterstain les cellules par addition de quelques gouttes de solution d'hématoxyline et en les incubant pendant 1 min.
- Laver les lames avec de l'eau neutre (pH 7) et leur permettre de sécher à l'air. Appliquer une goutte de milieu de montage 2 dans les cellules, placez un bord d'un couvercle en verre sur la lame et soigneusement abaisser sur les cellules en utilisant une pince. Appuyez doucement sur le couvercle en verre pour éliminer les bulles d'air.
- Alpha-naphtyl butyrate estérase (NBE) dosage de l'activité
- une solution de butyrate α-naphtyl chaud à 37 ° C avant utilisation.
- Diluer un comprimé de nit de sodiumrite dans 6,25 ml d'eau déminéralisée.
- Dans un tube de 50 ml, on ajoute 1,5 ml d'une solution de comprimés de nitrite de sodium et 1,5 ml d'une solution Pararosaniline. Mélanger délicatement et laisser reposer la solution pendant 5 min. Compléter la solution avec 40 ml d'une solution tamponnée au phosphate. Amener le pH à 6 en ajoutant prudemment goutte à goutte de NaOH 10 N. Ajouter 5 ml de la solution de butyrate α-naphtyle, mélanger l'ensemble de la solution, et de le transférer dans une jarre Coplin.
- Fixer les cellules sur les lames pendant 10 secondes en utilisant la solution CAF à la température ambiante et rincer pendant 45 secondes avec de l'eau déminéralisée.
- Transfert glisse dans le bocal de Coplin contenant la solution qui a été préparée à l'étape 1.5.3.2 et incuber ensemble pendant 1 heure à 37 ° C dans une chambre d'humidité tout en étant protégé de la lumière.
- Rincer les lames pendant 2 min dans de l'eau neutre (pH 7) et l'air sec.
- Counterstain les cellules avec une solution de bleu de méthylène en ajoutant quelques gouttes sur la lame et incuber pendant 4 min.
- Immerger les lames dans Deiol'eau nisé pendant 2 min et leur permettre de sécher à l'air. Pour monter les diapositives, appliquer une goutte de milieu de montage 2 dans les cellules, placez un bord de la lamelle sur la lame, et soigneusement abaisser sur les cellules en utilisant une pince. Appuyez doucement sur le couvercle en verre pour éliminer les bulles d'air.
- préparation fixateur
- Mai-Grünwald Giemsa (MGG) coloration
- Colorer les cellules (préparé dans la section 1.3) en plongeant les lames dans un récipient Coplin contenant une solution de May-Grünwald pendant 3 min.
- Transférer les lames dans une jarre Coplin contenant la solution pH 6,8 tampon pendant 1 min.
- Colorer les lames en les plaçant dans une jarre de Coplin contenant la solution de Giemsa R (dilué au 1/20 dans une solution tampon 6,8 pH) pendant 10 min. Laver les lames avec de l'eau neutre (pH 7) pendant 10 sec.
- Égoutter et sécher à l'air les diapositives. Monter les lames en appliquant une goutte de milieu de montage 2 sur les cellules. Placez un bord de la lamelle sur la lame et abaissez avec précaution suraux cellules en utilisant une pince. Appuyez doucement sur le couvercle en verre pour éliminer les bulles d'air.
2. Dans le développement Vivo et caractérisation de la leucémie aiguë
NOTE: Quatre semaines d'âge des souris congéniques femelles C57BL / 6J-Ly5.1 ont été maintenus dans des conditions exemptes d'organismes pathogènes spécifiques ( par exemple, dans un environnement stérile). Les souris ont été injectées quand ils étaient âgés de 5 à 6 semaines.
- L'injection intraveineuse avec des cellules C1498
- Récolter les cellules cultivées dans des suspensions C1498 par pipetage. Transférer les cellules dans un tube centrifugeur et 50 ml à 350 x g pendant 10 min. Laver les cellules dans 10 ml de PBS froid deux fois, et à préparer une suspension cellulaire de 10 7 cellules / ml dans du PBS. Placez la suspension cellulaire sur la glace avant d'effectuer l'injection.
- Placer la souris dans un dispositif de retenue et effectuer l'injection dans des conditions stériles sous une hotte à flux laminaire.
- En utilisant une aiguille de 29G avec une seringue pour injecter les cellules dans leveine de la queue. Saisir la queue à l'extrémité distale, et à désinfecter avec une éponge de gaze trempée dans 70% d'éthanol. Vérifiez que qu'il n'y a pas de bulles d'air dans la seringue, puis injecter lentement 100 pi de la suspension de cellules C1498 (10 6 cellules) dans la veine de la queue.
- Après l'injection, retirez l'aiguille de la queue, et contrôler les saignements en appliquant une pression avec une éponge de gaze stérile sur le site d'injection. Retour à l'animal de sa cage, et de vérifier soigneusement son état de santé au cours des prochaines heures et les jours.
- Retro collecte de sang orbital
- Surveiller le comportement des souris PBS- et C1498-injectées pour des signes de la maladie leucémique (par exemple, l' horripilation, l' isolement du groupe, et réduit ou pas de mouvements dans la cage).
NOTE: Cela se produit généralement entre 17 à 19 jours après que les cellules sont injectées. - Effectuer collection rétro de sang orbital juste avant l'euthanasie (voir étape 2.2.7) dans des conditions stériles dans un flux laminairele capot et sous une lampe chauffante pour éviter l'hypothermie.
- Pour l'anesthésie, utiliser la kétamine à 150 mg / kg et xylazine à 10 mg / kg. Préparer la solution anesthésique par dilution de 1,5 ml de kétamine et de xylazine 0,5 ml dans 18 ml de solution PBS.
- Anesthetize le contrôle et les souris leucémiques. Procéder à une injection intrapéritonéale de 200 ul de la solution anesthésique pour 10 g de souris en utilisant une aiguille 26G et une seringue de 1 ml. Vérifiez la perte du réflexe de pédale pour confirmer l'anesthésie.
- Insérer un tube capillaire dans le canthus interne de l'oeil. Le sang va augmenter à partir du sinus orbital dans le tube capillaire. Contrôler le saignement en appliquant doucement la pression sur l'oeil avec une éponge de gaze stérile.
REMARQUE: Un volume de 100 à 200 pi de sang peut être recueillie à l'aide de cette technique. - Recueillir le sang dans un tube EDTA, et stocker l'échantillon sur la glace avant d'isoler les cellules mononucléaires.
- Euthanize la souris par dislocation cervicale, etprocéder à isoler les organes (section 2.3).
- Surveiller le comportement des souris PBS- et C1498-injectées pour des signes de la maladie leucémique (par exemple, l' horripilation, l' isolement du groupe, et réduit ou pas de mouvements dans la cage).
- Les organes et les cellules d'isolement
- Organes d'isolement
- Placez la souris euthanasiés sur le dos sur une planche en plastique et utiliser des aiguilles à la broche les pattes de l'animal pour faciliter l'isolement d'organes. Désinfecter la souris en utilisant 70% d'éthanol avant d'effectuer une incision.
- Avec des ciseaux stériles, effectuer une incision ventrale de la peau abdominale au cou. Couper à travers la paroi abdominale pour accéder au foie. Couper à travers la cage thoracique et le diaphragme pour accéder aux poumons. Déplacer l'intestin vers le côté et enlever la rate avec des ciseaux et des pinces stériles.
- Pour isoler la moelle osseuse, couper les jambes au sommet des fémurs au-dessus du joint à l'aide de ciseaux stériles. Débranchez le tibia du fémur en tirant doucement, et enlever la peau et les muscles des os à l'aide de pinces et ciseaux.
- Placez chaque organe et de l'os dans un tube de 50 ml contenant du PBS froid, et les placer sur la glace.
- L'isolement des cellules des organes
- Peser la rate avant de perturber les cellules. désorganiser mécaniquement la rate, les poumons et le foie en les pressant à travers un tamis de 70 um au moyen d'un piston de la seringue dans un tube de 50 ml et recueillir les cellules dans 30 ml de PBS froid.
- Pour recueillir des cellules de la moelle osseuse, mettre les fémurs et tibias dans une boîte de Pétri sur de la glace, couper les extrémités à l'aide de ciseaux stériles, et rincer la moelle osseuse en insérant une aiguille de 26G fixée à une seringue de 10 ml contenant 5 ml de PBS froid.
- Désagréger les cellules de la moelle osseuse en faisant passer la suspension de cellules à travers l'aiguille / seringue, et filtrer la suspension de cellules à travers un tamis de 70 um dans un tube de 50 ml.
- Centrifuger tous les tubes contenant chacun des organes et des cellules de moelle osseuse à 350 x g pendant 10 min. Jeter le surnageant et remettre en suspension les cellules recueillies à partir des poumons et de la moelle osseuse dans 2 ml de tampon de lyse (1 x) et de la cellules isolé à partir du foie et de la rate dans 5 ml de tampon de lyse (1x) par pipetage doucement le mélange vers le haut et vers le bas. Remplir les tubes de 50 ml avec du PBS froid.
- Centrifuger les cellules à 350 xg pendant 10 min. Resuspendre les cellules dans un tampon FACS pour l'analyse de cytométrie en flux ou pour préparer les cellules pour la microscopie. Compter les cellules en utilisant une chambre de comptage de cellules Thoma après leur coloration au bleu trypan.
- Organes d'isolement
- surface cellulaire coloration des cellules isolées à partir d'organes de cytométrie de flux
- Dans un tube de cytométrie en flux, l' étiquette 10 6 cellules qui ont été isolées à partir d' organes avec 10 pg / ml d'anti-CD16 purifié / 32 anticorps dans 100 pi de tampon FACS.
- 10 6 cellules de la moelle osseuse, ajouter 100 ul des anticorps suivants ou combinaisons d'anticorps et leurs témoins isotypes correspondants dilués dans du tampon FACS: anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), l'anti-B220 (1) /anti-CD45.2/anti-CD19, anti-CD115 / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-CD45.2, anti-Ly6G (2), anti-CD11b, anti-CD115 ou anti-CD19 seul pour les paramètres de compensation.
- Pour splénocytes, ajouter 100 ul des anticorps suivants et leurs contrôles isotypiques correspondants dilués dans du tampon FACS: une combinaison d'anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1 ) /anti-CD45.2/anti-CD19, anti-CD45.2, anti-Ly6G (2), anti-CD11b et anti-CD19 pour les paramètres de compensation.
- Pour les cellules pulmonaires et hépatiques, ajouter 100 ul d'anticorps anti-CD45.2 et son contrôle isotypique correspondant dilué à 1/100 dans un tampon FACS.
- Incuber toutes les solutions de cellules pendant 30 minutes à 4 ° C.
- Laver les cellules par addition de 2 ml de tampon FACS à chaque tube. Centrifuger les tubes pendant 5 min à 350 x g et élimination du surnageant par pipetage. Répétez cette étape une fois de plus.
- Resuspendre les cellules marquées dans 500 pi de PBS froid. Gardez les cellules sur la glace et protégé de la lumière avant d'effectuer cytométrie en flux pour courant alternatifquisition et de l' analyse 10.
- L'isolement des cellules mononucléées du sang et de la coloration immunofluorescente pour l'analyse de cytométrie de flux
- Avant de démarrer le protocole de pré-chauffer la solution de séparation à la température ambiante.
- Transférer l'échantillon de sang (100 à 200 ul, obtenu à l'étape 2.2) dans un tube de microcentrifugeuse, et ajouter une solution de PBS / EDTA 1 mM, jusqu'à ce que le volume de la solution est de 500 ul. couche soigneusement 500 pi de solution de séparation sous la solution contenant le sang à l'aide d'une aiguille 30G et une seringue de 1 ml. Ne pas mélanger le sang et la solution de séparation.
- Centrifuger les tubes à 800 xg (sans frein) pendant 20 min à température ambiante. Après centrifugation, recueillir l'anneau cellulaire (la couche opaque blanc) à l'aide d'une pipette. Transférer les cellules dans un tube de microcentrifugation.
REMARQUE: La couche blanche opaque contient des lymphocytes, ainsi que des monocytes et apparaît entre la couche inférieure, - la solution de séparation, - et la couche supérieure. - Ajouter 1 mlde la solution PBS et centrifuger le tube à 350 g pendant 10 min. Resuspendre les cellules dans 600 pi de tampon FACS.
- Ajouter 10 pg / ml d'anticorps anti-CD16 / 32 anticorps purifiés et distribuer 100 ul de la suspension cellulaire dans six tubes séparés (100 ul chacun).
- Marquer les cellules avec 100 ul d'anticorps suivants ou leurs contrôles isotypiques associés dilués dans du tampon FACS: une combinaison d'anti-CD3 (1) / anti-B220 (1) et anti-/anti-CD45.2 Ly6C / anti-CD115 /anti-CD45.2 ou anti-CD45.2 et anti-CD115 seul pour les paramètres de compensation.
- Incuber tous les tubes à 4 ° C pendant 30 min.
- Laver les cellules par addition de 2 ml de tampon FACS à chaque tube, puis les tubes centrifuger pendant 10 min à 350 x g, et jeter le surnageant à l'aide d'une pipette.
- Resuspendre les cellules marquées dans 500 ul de PBS froid. Gardez les cellules sur la glace et protégé de la lumière avant d' effectuer cytométrie acquisition et l' analyse 10.
- Préparation de suspensions de cellules de moelle osseuse sur des lames pour microscope
- Suivez les étapes décrites dans la section 1.3, mais à l' étape 1.3.1, utiliser 10 5 cellules de moelle osseuse, et à l' étape 1.3.4, tourner les cellules dans chaque chambre à 72.26 xg pendant 10 min.
- dosages d'activité de l'estérase en utilisant des cellules de moelle osseuse
- Pour effectuer les tests de moelle osseuse estérase de cytochimie, passez des étapes 1,5 à 1.5.3.7.
- May-Grunwald Giemsa des cellules de moelle osseuse
- Pour colorer les cellules de la moelle osseuse, suivre le protocole décrit dans la section 1.6, mais à l'étape 1.6.1, incuber les lames dans une solution de May-Grünwald pendant 5 min.
Résultats
Pour caractériser le modèle C1498 de la souris, nous avons procédé à deux étapes principales. Tout d' abord, les cellules ont été caractérisées C1498 pour déterminer leur lignée hématopoïétique et la maturation étape in vitro (figure 1). Ces cellules ont ensuite été injectées dans des souris congéniques, ainsi que la nature de la maladie leucémique induite a été évaluée afin de déterminer des caractéristiques différentes: l'infiltration de cellules leucémiques, leur phénotype, une quantification des cellules hématopoïétiques (/ précurseurs matures et des progéniteurs) dans la moelle osseuse, les fréquences des C1498 et des cellules hématopoïétiques matures dans le sang et une évaluation du gonflement des organes (dans la rate, le foie et les poumons) et la composition cellulaire.
Afin de caractériser le phénotype de cellules C1498 in vitro, les cellules ont été marquées avec des anticorps dirigés contre des molécules qui sont exprimées par des précurseurs hématopoïétiques et des cellules matures (tableau 1) et les résultats ont été analysés à l' aide du flux cytometry. Les cellules C1498 ont été positifs pour l'expression de surface cellulaire de Mac-1 (CD11b / CD18) (~ 7%), B220 (> 25%), et ils affichent l'expression intracellulaire de CD3e, TcR chaînes (RCT) Vß et Mac -3 (figures 2A et B). Les cellules ont été négatifs pour les marqueurs de surface cellulaire Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, et pan-NK molécules et pour l'expression intracellulaire de lymphocytes CD4 et CD8 (données non présentées) . Ils ont ensuite été examinés pour les marqueurs des cellules et des progéniteurs (tableau 1) souches hématopoïétiques. Ils étaient également négatifs pour l'expression de surface cellulaire de CD117, CD34, Sca-1, CD150 et CD16 / 32 (données non présentées). Ces cellules leucémiques ont ensuite été testées pour déterminer l'expression de l'adhérence, la présentation des antigènes et des molécules co-stimulatrices. Les cellules expriment les marqueurs de surface LFA-1 (CD11a / CD18), CD44, CD31 (PECAM-1), et H-2D b et ont été négatifs pour le CMH de classe II, CD80, CD86 et CD274 (données non présentées). Les cellules T C1498herefore exprimées à la fois myéloïdes (Mac-1, Mac-3) et des marqueurs lymphoïdes (B220, CD3, TCR).
Afin de mieux caractériser leur lignée hématopoïétique, l'expression myéloperoxydase a été évaluée en utilisant la microscopie immunofluorescence. Toutes les cellules étaient positives pour la myéloperoxydase, ce qui a vérifié leur origine myéloïde (figure 3A). La majorité des cellules a également une coloration positive pour les α-naphtyl butyrate estérases (figure 3B, le panneau gauche), et certains d'entre eux pour les tachée naphtol AS-D chloroacétate estérases (flèches noires) (Figure 3B, panneau de droite). Les résultats indiquent que les cellules contiennent des mélanges de cellules monocytaires et granulocytaires. Après May-Grünwald Giemsa a été réalisée, les cellules C1498 ont été observées pour afficher une morphologie blastique-like avec un rapport nucléo-cytoplasmique élevé, 3 à 5 nucléoles dans le noyau, un halo périnucléaire, de nombreuses vacuoles et un cytoplasme basophile (figure 3C ). thnous, la lignée cellulaire C1498 est composé de monoblastes et myéloblastes.
Les cellules C1498 (CD45.2 +) ont ensuite été injectés par voie intraveineuse en CD45.1 + souris. Les souris ont succombé 17 à 19 jours après que les cellules ont été injectées. Ces souris ont été sacrifiées afin que leur type de leucémie pourrait être analysé avant de mourir de la maladie. Les souris témoins, qui ont été injectées avec du PBS, ont été analysés dans les mêmes points de temps pour la comparaison. Les souris C1498 cellulaire injecté affiche infiltration massive de cellules C1498 dans leur moelle osseuse, tel que démontré par l'apparition de souffle comme des cellules après May-Grünwald Giemsa a été réalisée (figure 4A). Ils ont également conservé leur monocytaire et phénotypes granulocytes (figure 4B et C), ce qui démontre une accumulation de cellules monoblastiques et myéloblastique qui est caractéristique de la leucémie myélomonocytaire aiguë.
Pour déterminer si médullaires nombre de cellules hématopoïétiques étaient plus faibles suivant les cellules leucémiques invasion, CD45.2 + C1498 cellules, B lymphocytaire, monocytes et granulocytes populations (y compris les progéniteurs, les précurseurs et les cellules matures), ont été quantifiés en utilisant immunofluorescence et flux multi-paramétrique cytométrie analyse. les cellules leucémiques représentent 16 à 36% des cellules hématopoïétiques (données non présentées). Les autres types de cellules ont été présents tout en nombre significativement plus faibles chez les souris C1498-injectées que chez les souris PBS-injectées (par 5 fois en moyenne pour les sous-ensembles de cellules B, 4 fois en moyenne pour les cellules granulocytes et 3 fois en moyenne, pour des sous - monocytaires) (figure 5A à C).
Une enquête sur les fréquences des cellules mononucléaires dans des échantillons de sang leucémiques et de la souris de contrôle a montré qu'ils contenaient un pourcentage comparable de lymphocytes (figure 6A) , mais une fréquence plus élevée des monocyteset des cellules leucémiques. Ces caractéristiques sont représentatives de la leucémie myélomonocytaire aiguë 11 (figure 6B).
Parmi les autres caractéristiques de la leucémie myélomonocytaire aiguë 12, les souris C1498-injectées présentées aux foies gonflés (de hépatomégalie), les poumons et la rate (splénomégalie) (Figure 7A). Différentes fréquences de cellules CD45.2 + C1498 ont été détectées dans ces organes à l' aide immunofluorescence et analyse par cytométrie de flux (figure 7b). Comme splénomégalie peut résulter d'un nombre élevé de monocytes infiltrés, nous avons également estimé les proportions des populations spléniques. Le nombre de cellules dans la chambre lymphocytaire, monocytaire et les fractions de cellules granulocytaires étaient significativement plus grandes, par une moyenne de 2 fois, 2,5 fois et 3 fois, respectivement, dans les rates leucémiques que dans les rates de commande (figure 7C).
mince page = "1"> 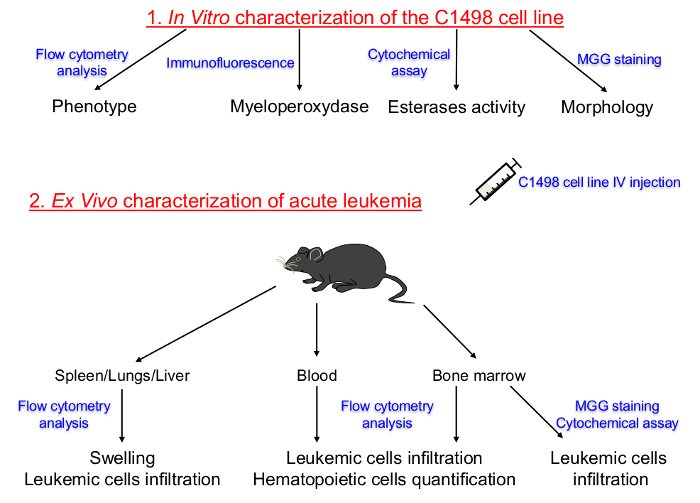
Figure 1. Représentation schématique du Protocole Set Up pour Caractériser in vitro des lignées cellulaires Cultured C1498 et descriptions in vivo de leucémie aiguë. La lignée hématopoïétique et le stade de la différenciation des cellules C1498 tissus en culture ont d' abord été déterminée. les cellules C1498 ont ensuite été injectées dans des souris congéniques pour induire le développement de la leucémie aiguë. L'isolement de l'os tissus pulmonaires osseuse, le sang périphérique, la rate, le foie et a été réalisée pour déterminer les fréquences, les phénotypes et des changements morphologiques des cellules C1498 après l'infiltration. IV: MGG intraveineux:. Mai-Grünwald Giemsa S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
ad / 54270 / 54270fig2.jpg "/>
Figure 2. Analyse phénotypique des cellules C1498 après culture in vitro. Flux représentant cytométrie parcelles de points et histogrammes de surface cellulaire (A) et intracellulaire (B) C1498-exprimé des molécules qui ont été associés à la différenciation des cellules hématopoïétiques matures sont présentés. les cellules C1498 ont été récoltées à partir de cultures, lavées et marquées à l'aide d'anticorps fluorescents qui étaient spécifiques à la surface des cellules CD11b, CD18 et des marqueurs de B220 ou de leurs contrôles isotypiques. Pour la coloration intracellulaire, les cellules ont été fixées, perméabilisées et marquées en utilisant des anticorps dirigés contre le Mac-3, CD3e et un épitope commun du TCR (T-Cell Receptor) chaîne Vß ou leurs contrôles isotypiques. Les analyses ont été effectuées en utilisant gating avec des cellules vivantes. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
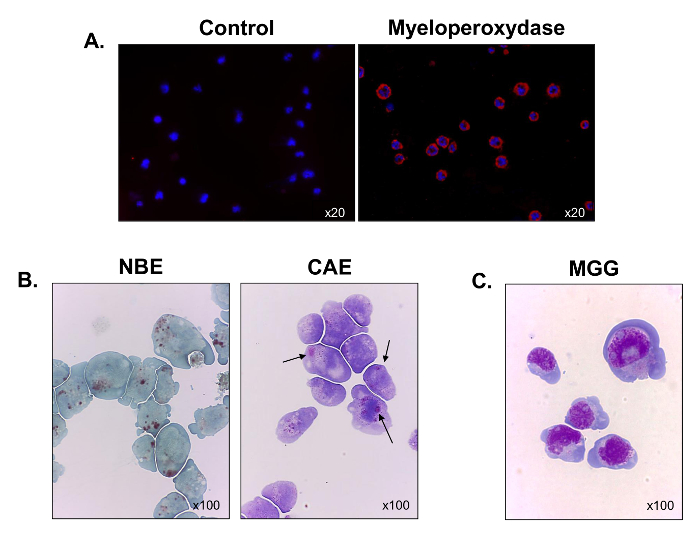
Figure 3. fonctionnelle et morphologique Caractérisation des cellules cultivées C1498. Les cellules C1498 ont été récoltées à partir des cultures et on les centrifuge sur des lames pour microscope. (A) La coloration pour l' expression de la myéloperoxydase a été réalisée par immunofluorescence (B) . Les réactions cytochimiques ont été utilisées pour analyser l'estérase α-naphtyl butyrate (NBE) et le naphtol AS-D chloroacétate estérase (CAE) activités dans les cellules C1498. Les cellules ont été considérés comme positifs pour chaque étiquette lorsque marron et rouge-pourpre, gros granules cytoplasmiques, respectivement, ont été observées. (C) Mai-Grünwald Giemsa (MGG) coloration des C1498 cellules. Pour chaque expérience, la coloration, le grossissement de l'objectif microscopique est indiqué. Chaque image est représentative de trois expériences distinctes.large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
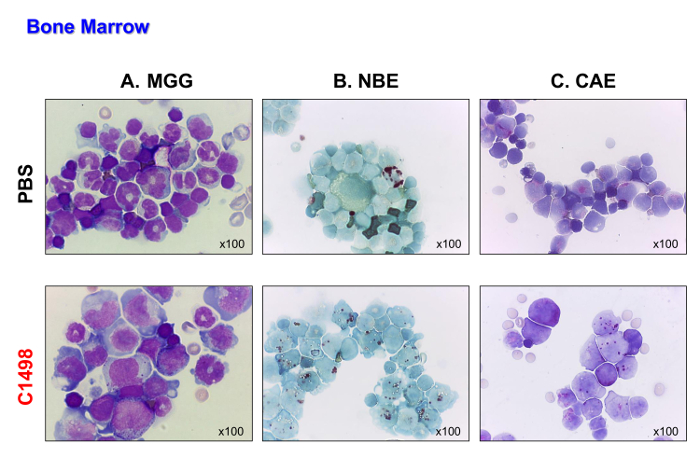
Figure 4. Souris de moelle osseuse Morphologies en PBS- et C1498-injecté. Des cellules de moelle osseuse ont été isolées à partir de PBS et souris injectées de cellules C1498 et centrifugés sur des lames pour la microscopie. (A) Mai-Grünwald Giemsa (MGG) coloration. (B ) estérase α-naphtyl butyrate (NBE) et (C) naphtol AS-D chloroacétate estérase (CAE) ont été évalués à l' aide des fonctions cytochimie. Dans le panneau A, la bande (immature) ou segmentées neutrophiles (matures) sont moins visibles dans la moelle osseuse des souris C1498-injectées que les souris PBS-injectées. Groupe B et C indiquent qu'il ya eu une accumulation de cellules monocytes et granulocytes dans la moelle osseuse leucémique par rapport aux chiffres observés dans le contrôle de la moelle osseuse. Toutanalyses microscopiques ont été réalisées avec un objectif de grossissement 100X. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
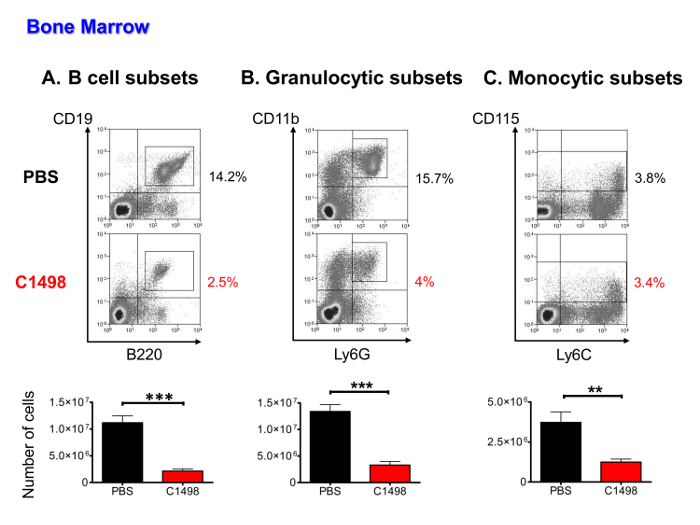
Figure 5. Souris Analyse quantitative des populations médullaires dans PBS- et C1498-injecté. Des cellules de moelle osseuse ont été isolées à partir de PBS et souris injectées de cellules C1498 et estimées après le comptage des cellules a été réalisée. Les fréquences des différentes populations cellulaires ont été déterminées après immunocoloration et flux de cellules fermée en direct analyse par cytométrie. (A) Les sous - ensembles de cellules B inclus CD19 + B220 + cellules dans les stades à partir de cellules pro-B à maturité des lymphocytes B (B) cellules granulocytaires dans le CD3 - et CD11b + Ly6G + lignées, qui comprenait un des précurseurse. granulocytes matures et immatures (C) Les sous - ensembles monocytaires ont été définis comme CD3 - CD115 + et les cellules incluses dans le progénitrices matures étapes monocytaires. n = 7 souris / groupe et les données sont présentées sous forme d'histogrammes représentant les moyennes ± SEM. ***, P <0,0001 et **, p <0,01, test t de Student non apparié comparant PBS- et souris C1498-injectées. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
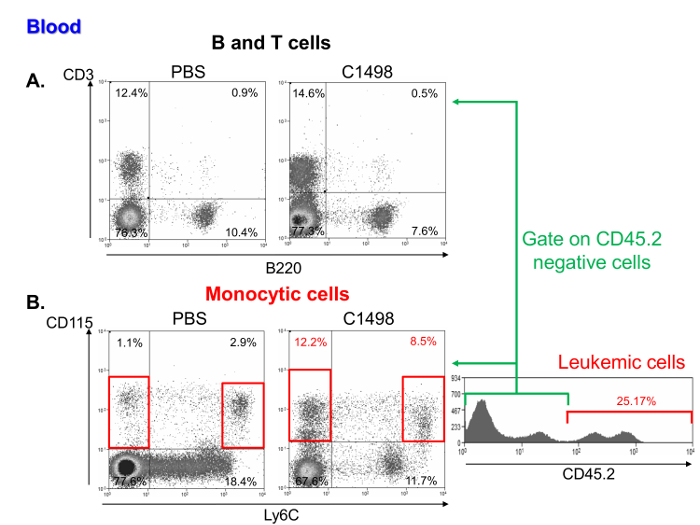
Figure 6. Analyse de sang de mononucléaires sous - ensembles de cellules dans PBS et souris C1498-injecté. Débit représentatif cytométrie tracés de points de (A) des pourcentages de lymphocytes T et B, qui sont respectivement définis comme étant CD3 + et les cellules B220 + dans du PBS et injecté cellules C1498. des souris (B) , les fréquences de cellules monocytaires dans C1498 leucémiques et de contrôle des souris (PBS) ont été déterminées en analysant CD115 + Ly6C - et CD115 + Ly6C cellules élevées. L'analyse a été réalisée par gating des cellules vivantes. Pour comparer les souris leucémiques et de contrôle, CD45.2 + C1498 cellules ont été exclus. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
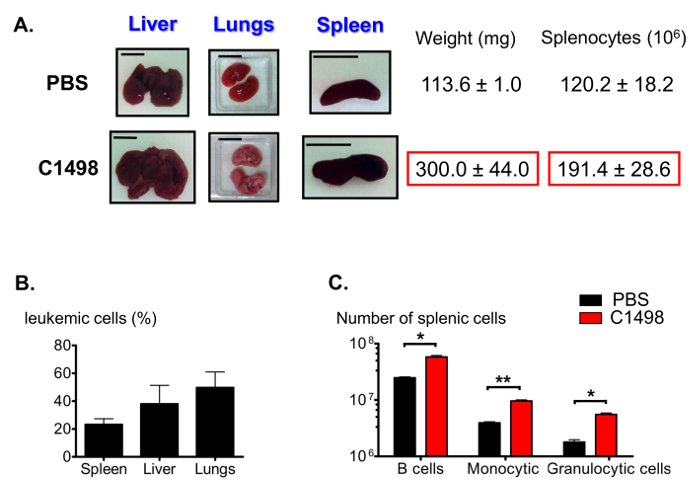
Figure 7. Estimation des populations spléniques en leucémiques et de contrôle des souris. (A) des photographies représentatives du foie, du poumon et de la rate gonflement chez les souris leucémiques comparées aux souris témoins. Les rates ont été recueillies et pesées, et les splénocytes ont été comptés après la rupture des tissus. (B) Histogramme représentant les fréquences de cellules leucémiques dans difforganes érents après immunocoloration a été réalisée pour CD45.2 + cellules et les résultats ont été analysés par cytométrie en flux. (C) Les estimations de B splénique, le nombre de granulocytes et de monocytes cellulaires après immunomarquage et l' analyse de cytométrie en flux gating ont été réalisées pour identifier en direct CD19 + B220 + , CD3 - CD11b + Ly6G +, CD3 - CD11b + Ly6C - et CD3 - cellules élevées CD11b + Ly6C. Les barres d'échelle indiquées pour les poumons, la rate et le foie indiquent 1 cm. .. n = 5-8 souris / groupe, et les données sont représentées dans les histogrammes que les moyens ± SEM *, p <0,05; **, p = 0,0033 souris, test t de Student non apparié comparant PBS- et C1498-injecté S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
| Type de cellule | Membrane ou intracellulaire Molécules |
| Précurseurs et cellules matures | |
| Les cellules NK | NK1.1 +, pan-NK + |
| Les cellules NKT | NK1.1 +, pan-NK +, TCR Vbeta + (8.2), CD3 + |
| Les lymphocytes T | Vbeta TCR +, CD3 +, CD4 +, CD8 + |
| cellules B précurseurs et de lymphocytes B | B220 +, CD19 +, CD21 / 35 + |
| précurseurs et granulocytes granulocytes | Ly6G +, Mac-1 +, CD11b + |
| précurseurs monocytes et les monocytes / macrophages | CD11b +, Mac-1 +, Mac-3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| Progéniteurs | |
| progéniteurs multipotentes | CD117 + Sca-1+ CD34 + (Lin- CD150-) |
| progénitrices multipotentes lymphoïdes amorcées | CD117hi 1hi Sca-CD127 + (Lin-) |
| progéniteurs lymphoïdes communs | CD117lo 1LO Sca-CD127 + (Lin-) |
| progéniteurs myéloïdes communs | CD16 / 32lo CD117 + CD34int (Lin- Sca-1-) |
| progéniteurs de granulocytes-macrophages | CD16 / 32hi CD117 + CD34hi (Lin- Sca-1-) |
| progéniteurs érythroïdes mégacaryocytes | CD16 / 32lo CD117 + CD34lo (Lin- Sca-1-) |
| Les cellules souches hématopoïétiques | CD117 + Sca-1 + CD150 + (Lin- CD34) |
Tableau 1. Les marqueurs de lignées de cellules hématopoïétiques et Différenciation.
CD: groupe de différenciation; Lin: marqueurs de cellules matures; lo:faible expression; salut: haute expression; int: expression intermédiaire; NK: les cellules tueuses naturelles; TCR: récepteur des cellules T.
Discussion
Dans des études antérieures, la lignée cellulaire C1498 a été décrit comme un inducteur de myéloïde aiguë 5, myélomonocytaire 6 ou 7 NKT leucémie. Toutefois, les données démonstratifs dans la littérature étaient absents ou incomplets. Le protocole présenté ici utilise différentes techniques telles que la cytométrie en flux, l'immunofluorescence, des dosages et MGG coloration cytochimique pour caractériser les cellules cultivées et C1498 pour déterminer la nature de la leucémie qui est induite chez la souris après leur injection.
Lorsque nous phénotypé dans les cellules C1498 cultivées in vitro après immunocoloration et de cytométrie de flux analyses ont été effectuées, nous avons observé certaines limites parce que ces cellules expriment quelques marqueurs hématopoïétiques de la surface cellulaire qui ont été décrits dans la littérature 6,7. En accord avec nos résultats, Labelle et al. N'a pas observé l'expression de surface cellulaire mature TCR sur les cellules C1498 utilisant cytomet de fluxry coloration. Cependant, ils les considéraient comme une lignée de cellules NKT après avoir détecté CD3e et TCRVβ8.2 ARNm 7. Nous avons également observé l'expression intracellulaire des chaînes TCRVβ et molécules CD3e dans la plupart des cellules (> 70%), mais leurs lignées hématopoïétiques n'a pu être déterminée, car il y avait aussi l'expression intracellulaire concomitante de la molécule Mac-3.
Myéloperoxydase, la coloration au MGG et des évaluations pour analyser les esterases fonctionnels à l'aide cytochimie démontré que la lignée de cellules C1498 a une origine myéloïde et se composait de monoblastes et les myéloblastes. Ces résultats sont concordants avec le pourcentage de Mac-3 + cellules qui ont été obtenues dans l' analyse de cytométrie en flux de la coloration. Bien que non quantitative, ces étapes représentent des expériences clés à effectuer. En effet, ils restent, jusqu'à présent, les meilleures méthodes actuelles de caractérisation de la phase de cellules hématopoïétiques qui expriment ou non f lignée et la différenciationmarqueurs phénotypiques spécifiques Ew.
Cytométrie de flux coloration a été utile pour démontrer le développement de la leucémie aiguë chez la souris congéniques après C1498 cellules ont été injectées par voie intraveineuse. Les CD45.2 + C1498 cellules qui se sont infiltrés dans le sang périphérique et divers organes ont été isolés, et leurs fréquences ont été déterminées. Quantification a également été réalisée pour analyser médullaires inhérente et les cellules spléniques après immunophénotypage. Limitations ont été rencontrées lorsque le phénotype de cellules C1498 a été examiné dans les organes comme ils ont exprimé quelques marqueurs hématopoïétiques (seulement quelques - uns d'entre eux étaient B220 +). Pour définir la nature de la leucémie aiguë observée, May-Grünwald Giemsa et une analyse des activités des monocytes et estérases granulocytes ont été effectuées en utilisant la moelle osseuse. Les résultats ont montré que les cellules C1498 ont conservé leur morphologie et la fonction myéloblastique et monoblastiques, révélant l'apparition de la leucémie myélomonocytaire.
En contrepartie des étapes critiques décrites dans ce protocole, une attention particulière devrait être accordée à pH lors de l'exécution des réactions cytochimiques et MGG coloration car les erreurs de pH peuvent conduire à des interprétations erronées des résultats. Par exemple, une activité esterase butyrate α-naphtyl est spécifique à des cellules monocytaires seulement à un pH de 6,0, car les granulocytes et les lymphocytes peuvent également colorées positivement pour ce test à des valeurs de pH plus élevées. Fixateur les cellules ne sont pas recommandé avant d'effectuer MGG coloration, et nous a montré que seulement la fixation CAF a fourni des résultats satisfaisants lors de l'exécution des estérases réactions cytochimiques utilisant C1498 cellules. Afin de préserver l'expression de la molécule CD115 et sa détection par cytométrie en flux, tous les échantillons (cellules par exemple, le sang, la moelle osseuse et la rate) devrait être maintenu sur la glace au cours de la procédure. Si aucune coloration est observée dans la cytométrie de flux et / ou des expériences d'immunofluorescence, la référence des anticorps, leur re de stockagefélicitations et leurs dilutions doivent être vérifiées. Les références indiquées dans le tableau des matériaux / équipements ont été sélectionnés pour des applications de cytométrie de flux ou d'immunofluorescence. Les principaux anticorps / secondaires ou leurs fluorophores conjugués pourraient avoir perdu leur activité due au stockage inapproprié (par exemple, l' exposition à la lumière ou à la chaleur), la dilution inappropriée, vaste congélation / décongélation ou l'utilisation de tampons contaminés. Exécuter des contrôles positifs pour veiller à ce qu'ils fonctionnent correctement. Utiliser osseuse de souris des cellules de rate dérivées qui sont connues pour exprimer les protéines d'intérêt ou de la moelle. Pour éviter un bruit de fond et la coloration non spécifique, assurez-vous que les cellules sont lavées correctement et maintenus à une humidité élevée (pour immunofluorescence) et que les anticorps sont dilués selon les instructions. En utilisant la même concentration et la dilution de l'anticorps témoin isotypique et l'anticorps primaire afin de déterminer avec précision le niveau d'arrière-plan dans l'échantillon. Pour les expériences estérase de cytochimie, lales réactifs peuvent être testés à l'aide de lames de contrôle positif et négatif contenant des granulocytes de souris purifié splénique (Ly6G +) et les cellules monocytaires (CD115 +).
La procédure décrite dans cette étude a montré que bon nombre des caractéristiques leucémiques observés chez les souris après l'injection de cellules C1498 partagé caractéristiques communes avec la leucémie myélomonocytaire aiguë humaine 11,12. Les cellules leucémiques envahies ont donné lieu à une réduction des matures et immatures (précurseurs) et les progéniteurs des cellules hématopoïétiques médullaires. les cellules C1498 sont présents à haute fréquence (> 20%) dans le sang périphérique, comme les cellules monocytes. Hépatomégalie et une splénomégalie ont été observées suite à l'infiltration de cellules leucémiques et des augmentations significatives dans les lymphocytes B et les cellules myéloïdes ont également été observées pour accompagner splénomégalie. Thrombopénie a également été observée lorsque le nombre de plaquettes de sang ont été estimées en utilisant un analyseur d'hématologie.
Il était shown, à l' aide des expériences in vitro, les cellules C1498 qui inhibent l' hématopoïèse normale de souris en sécrétant des facteurs solubles 13. Dans plusieurs modèles de souris de tumeurs, les cellules myéloïdes immatures (y compris les cellules monocytaires et granulocytaires) ont également montré que la migration de la moelle osseuse vers la rate où ils inhibent l' activation des cellules T spécifiques anti-tumorale et la prolifération 14. Ainsi, la réduction dans les cellules hématopoïétiques qui a été observée dans la moelle osseuse peut être due à une carence soit dans l'hématopoïèse et / ou de leur migration. Ce dernier mécanisme peut expliquer la présence d'une monocytose dans le sang périphérique ou l'observation des fractions myéloïdes agrandies dans la rate. Il est également envisageable que ces cellules pouvaient être dérivées d'une amélioration de l'hématopoïèse splénique. En effet, dans des conditions de régime permanent, certains sous - ensembles de cellules spléniques B ont été identifiés comme des précurseurs de maturité des lymphocytes B 15. En outre, dans des conditions inflammatoires, medcellules souches et progéniteurs ullary ont été montrés à déménager dans la rate pour induire la production de monocytes matures 16. Ce protocole ne nous permet pas de tirer des conclusions concernant les mécanismes qui sont impliqués dans le développement de la leucémie, et des tests fonctionnels ainsi que moléculaires supplémentaires devraient être employées pour le faire. Cependant, ces données comprennent des informations détaillées sur les caractéristiques cliniques de la leucémie myélomonocytaire aiguë et aideront les chercheurs à évaluer et à comprendre les effets de nouveaux agents thérapeutiques.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
matériels
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Références
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon