Method Article
쥐 C1498 세포주와 관련 백혈병 마우스 모델을 특성화에 대한 자세한 프로토콜
요약
이 논문은 시험 관내 및 주사 후 마우스에서 유도 된 급성 백혈병 C1498 세포 배양을 특성화하는데 사용될 수있는 기술적 인 방법을 제공한다. 표현형 및 기능 분석은 유동 세포 계측법, 면역 형광 현미경, cytochemistry 월 - 그룬 왈드 김사 염색을 사용하여 수행됩니다.
초록
1941이 주사 급성 백혈병의 개발 결과 때문에 동계 또는 congenic 마우스에 C1498 세포의 정맥 내 주사가 수행되었다. 그러나,이 병의 성격이 잘 문헌에 기록되지 않았습니다. 여기서는 C1498 시험 관내 세포의 특성과 생체 내에서 유도 성 백혈병의 특성을 결정하기위한 프로토콜 기술을 제공한다. 이 절차의 첫 번째 부분은 조혈 리니지 배양 C1498 세포의 분화 단계를 결정하는 단계에 초점을 맞추고있다. 이를 위해, 다중 파라미터 유세포 염색 조혈 세포 마커를 검출하기 위해 사용된다. 면역 형광 현미경 cytochemistry 및 5 월의 Grunwald 김사 염색 한 다음, 각각의 마이 엘 로퍼 옥시 다제 발현 및 세포 형태 에스 테라 제의 활성을 평가하기 위해 수행된다. 이 프로토콜의 두 번째 부분에 유도되는 백혈병 질환을 설명하기 위해 최선을 다하고 있습니다생체. 후자는 혈액에서 백혈병 및 고유 셀의 주파수를 결정함으로써 달성 될 수있다 계측법 특정 염색을 이용하여 유동 조혈 기관 (예, 골수, 비장) 및 비 림프계 조직 (예, 간, 폐)을 분석한다. 백혈병의 특성은 골수 특정 에스 테라 제에 대한 5-6의 Grunwald 김사 염색 얼룩을 사용하여 확인된다. 여기, 우리는 연령대 C1498- 및 PBS-주입 된 쥐에서이 프로토콜을 사용하여 얻었다 결과를 제시한다.
서문
급성 골수성 백혈병 (AML)의 성숙의 다른 단계에서 차단되어 골수 조혈 세포의 억제되지 않는 증식을 특징으로한다. 이 조절 곤란은 과립, 단핵구, 적혈구 또는 megaryocytic 분화 경로 1에 영향을 줄 수 있습니다. AML 세포는 thrombopenia, 림프구 감소증과 빈혈을 초래 장애인 조혈, 선도, 골수에 축적. 백혈병 세포는 혈액 및 비 림프 기관 침입.
C1498 마우스 모델은 문헌 혈액으로 침입 설명 암세포 1941에서 백혈병 10 개월 된 C57BL / 6 (H-2 b) 암컷 마우스로부터 분리 된 이후 급성 백혈병의 모델로서 수십 년 동안 사용되어왔다 조혈 기관 (예를 들어, 비장과 림프절) 및 비 조혈 기관 (예를 들어, 간은, 폐, 난소, 신장)이 높은 증식 C1498 세포로는은에서를 통해 주입 된 후travenous, 취약 마우스 2-4로 피하 또는 복강 내 경로. 그러나,이 마우스 모델은 하나 또는 과립 2,5- myelomonocytic 6 백혈병을 유도하는 것으로보고되었다. 최근에는 2002 년에 발표 된 연구는 쥐 NKT 세포 백혈병 (7)과 같은 암의 유형을 설명했다. 따라서, 상기 문헌은 본 C1498 세포주의 특성 및이 마우스에서 유도 관련 백혈병 관한 다르다. 70 년대 - 이러한 불일치는 세부의 부족과 세포에 대한 업데이트 게시 된 정보 및 많은 연구가 1950 년에 수행 되었기 때문에 일반적으로 백혈병 질병에 주로 기인한다.
여기에서는 C1498 세포를 특성화하고 마우스에 정맥 내 주사에 의해 그들의 유도 백혈병 질병의 특성을 분석하는 방법을 설명하는 세부적인 프로토콜을 제공한다. 이 프로토콜의 첫 번째 섹션은 체외에서 배양 된 C1498 세포의 설명에 최선을 다하고 있습니다. 형광 방지표면 및 세포 내 조혈 마커에 대해 감독 기관은 유동 세포 계측법 사용하여 표현형을 결정하는 데 사용되었다. 마이 엘 로퍼 옥시 다제의 존재가 면역 형광 현미경을 사용하여 평가하고, 그 리니지 조혈 및 분화 단계는 에스 테라 제의 활성을 평가하기 cytochemistry를 이용하여 평가하였고, 5-6의 Grunwald 김사 염색을 수행 하였다. C1498 세포는 생쥐에 주입하고, 유도 된 급성 백혈병 질환이 원고의 두번째 섹션에 설명되어있다. 동일한 기술은 주파수와 골수 백혈병 및 고유 세포, 말초 혈, 비장 및 비 - 조혈 기관 (간 및 폐)의 표현형을 결정하는 데 사용 하였다.
이 프로토콜은 높은 재현성이며, 여기에 제시된 데이터는 연구자들이 새로운 치료 전략의 효과를 평가하는데 도움이 될 것이다. 이러한 백혈병 마우스 모델 이미 면역이 접근 테스트하는 데 사용 된차 다른 암 화학 요법 약물 8,9. 효능은 종양 부담과 생존율의 진화를 확인하여 평가 하였다. 이 프로토콜은 치료 중 백혈병 및 다른 조혈 세포 집단의 생존 및 분포에 대한 추가 정보를 제공하는데 사용될 수있다.
프로토콜
동물 하우징과 모든 실험 절차는 로컬 동물 관리 윤리위원회, CEEA.NPDC (계약 no.512012)을 승인하고, 모든 실험은 실험 동물의 관리 및 사용에 대한 프랑스와 유럽의 지침에 따라 수행되었다.
C1498 세포주의 생체 특성 1.
- C1498 세포의 체외 배양에서
- 준비 완료 RPMI (로스웰 파크 메모리얼 연구소) 소 태아 혈청의 50 ㎖ (FBS), 페니실린 5ml를 첨가하여 1640 배지 (100 U / ㎖) (100 μg의 / ㎖)과 50mm β 머 캅토 에탄올 500 μL -streptomycin 5 N-2- 히드 록시 에틸-N-2- 에탄 술폰산 (HEPES)의 ㎖, 비 필수 아미노산 5 ㎖ 및 RPMI 배지 500㎖의 피루브산 나트륨 5 ㎖.
- 전체 RPMI에서 C1498 세포주를 성장. 피펫 팅에 의해 현탁 세포를 수확하고 50 ㎖ 튜브에 세포를 옮긴다. 10 분 동안 350 XG에 원심 분리기 및 superna를 제거중대장.
- 10 분 동안 350 XG에 인산염 완충 식염수 (PBS) (1 배) 솔루션, 원심 분리기 20 ML을 추가하고, 상층 액을 제거합니다.
- (10) 형광 - 활성화 된 세포 분류기 (FACS) 버퍼 용액 (소 혈청 알부민 (BSA) 분말 2.5 g 및 2 PBS 용액 500 mL의 0.5 M 에틸렌 디아민 테트라 아세트산 (EDTA) 용액의 ml) 중에 세포를 재현 탁. 트리 판 블루로 세포를 염색 한 후 챔버를 카운팅 토마 세포를 이용하여 세포 수를 계산.
- C1498 세포주의 표현형 적 특성을 이용하여 면역 분석 유동 세포 계측법
- 세포 표면 염색
- FACS 버퍼를 준비합니다.
- 107 세포 / ml로 FACS 완충액에서 수확 한 세포를 조정 튜브 유세포로 각각 염색 실험 (100 μL)에 10 6 세포를 분배.
- FACS 버퍼에 희석 한 다음 항체 또는 관련 이소 컨트롤을 100 ㎕로 세포를 레이블 :
- m에 대한전구체 및 분화 된 세포의 arkers는 항 -CD11b / 항 CD18 (1) 항 내지 Ly-6G (1), 항 CD19, 항 B220 (2) 항 NK1.1, 안티와 셀 레이블 CD49b, 항 CD4 (1) 항 CD8 (2) 항 CD3 (3), 항 CD21 / 35, 안티 CD115 및 항 TCRVβ 항체.
- 조혈 줄기 / 선조 세포의 마커, 항 CD34의 조합을 사용 방지 / CD117 / 안티 무서-1, 항 CD150 방지 / CD117 / 안티 무서-1, 항 CD117 / 항 CD127 또는 안티 혼자 CD16 / 32 비오틴 항체.
- 세포의 기능 (예를 들면, 접착, 항원 제시, 공동 자극 분자와 수용체)의 마커, 항 CD18 (2) / 항 CD11a에 방지 MHC 클래스 I, 항 MHC 클래스 II, 안티으로 세포를 염색 CD31, 항 CD44, 항 CD80 비오틴, 항 CD86 그리고 항 CD274 항체.
- 30 분 동안 4 ° C에서 튜브 유동 세포 계측법을 모두 품어.
- 두 번 5 분 동안 350 XG에서 각 튜브에 FACS 버퍼 2 ㎖, 원심 분리기를 추가하여 세포를 씻으, 상층 액을 제거합니다.
- 각 튜브에 FACS 버퍼 100 μl를 추가하고 비오틴 - 복합 항체 (1/200의 최종 희석 FACS 버퍼에 1/100) 형광 스트렙 타비 딘의 100 μl를 추가하여 차 염색을 진행합니다. 30 분 동안 4 ° C에서 튜브를 품어.
- 다음과 같이 두 번 세포를 씻으 : 5 분 동안 350 XG에, 각각의 튜브에 원심 분리기 튜브를 FACS 버퍼 2 ㎖를 추가하고 피펫으로 상층 액을 제거합니다.
- 차가운 PBS 500 μL의 세포를 재현 탁하고, 튜브를 피복하는 알루미늄 박을 사용하여 어두운 곳에서 그들을 유지 얼음 셀을 놓는다. 사이토 (10)를 사용하여 결과를 분석 할 수 있습니다.
- 세포 내 염색
- PBS 용액 375 mL의에 4 % 파라 포름 알데히드 (PFA) 125 ㎖의 용액을 첨가하여 고정 버퍼를 준비한다.
주 : 환기 후드에 저어 접시에 약 60 ° C에 4 % PFA 500 ml의 열 PBS 용액 400ml를 준비합니다. PFA 분말 20g을 추가하고 pH를 상승PFA까지 용해된다. 이 솔루션은 냉각 6.9로 pH를 조정하고, PBS 500 ml의에 볼륨을 구성 할 수 있습니다. - 사포닌 0.5 g 및 PBS 용액 500㎖의 BSA에 0.5 g을 첨가하여 permeabilizing 버퍼를 준비한다.
- 107 세포 / ml로 FACS 완충액에서 수확 한 세포를 조정 튜브 유세포로 각각 염색 실험 셀 (100 μL)의 106를 배포한다. 5 분 350 XG에서 세포를 원심 분리기 및 뜨는을 제거합니다.
- 1 % PFA 용액 200 ㎕를 상기 세포를 고정시키고, 4 ℃에서 10 분 동안 배양한다.
- 5 분 동안 350 XG에, 각각의 튜브에 원심 분리기 튜브를 permeabilizing 버퍼 2 ㎖를 추가하고 피펫으로 상층 액을 제거합니다. 각각의 튜브에 버퍼를 permeabilizing 100 μl를 추가합니다.
- 버퍼 permeabilizing대로 희석 다음 항체 또는 상응하는 아이소 타입 컨트롤 100 ㎕와 세포를 라벨 : 항 CD3 (2) / 항 CD8 (1) 항 CD3 (3) / ACD4-NTI (2) 항 CD107b 및 항 CD3 (3) / 항 TCRVβ.
- 30 분 동안 4 ° C에서 세포를 품어.
- 두 번 각각의 튜브에 버퍼를 permeabilizing 2 ㎖를 추가하여 세포를 씻으십시오. 5 분 350 XG에 튜브를 원심 분리하고, 상층 액을 제거합니다.
- 세포에 버퍼를 permeabilizing 100 μl를 추가합니다. 비오틴 - 복합 항체 버퍼를 permeabilizing에 희석 형광 스트렙 타비 딘의 100 μl를 추가하여 차 염색을 진행합니다. 30 분 동안 4 ° C에서 튜브를 품어.
- 각 튜브에 버퍼를 permeabilizing 2 ML을 추가 5 분 동안 350 XG에 튜브를 원심 분리하고, 상층 액을 제거합니다. 이 단계를 한 번 더 반복합니다.
- 차가운 PBS 500 μL의 세포를 재현 탁하고 어둠 속에서 얼음에 세포를 배치합니다. (10) 플로우 사이토 미터를 사용하여 결과를 분석한다.
- PBS 용액 375 mL의에 4 % 파라 포름 알데히드 (PFA) 125 ㎖의 용액을 첨가하여 고정 버퍼를 준비한다.
- 세포 표면 염색
- 현미경 슬라이드의 세포 현탁액의 제조
- 은 HA의 워시 (10) (6)차가운 FACS 5 ㎖로한다 (단계 1.1.4에서 얻어진 것) rvested C1498 세포 회 버퍼링 차가운 FACS 완충액 1 ml의 세포를 희석. 얼음에 튜브를 놓습니다.
- 사전 부착 된 필터 카드와 일회용 챔버에 슬라이드를 올려 놓고 cytocentrifuge에 이들을 배치합니다.
- 각 챔버 및 필터 카드에 FACS 버퍼 100 μl를 추가하고, 4.52 x g에서 2 분간을 회전.
- 각 챔버 및 필터 카드에 세포를 100 μl를 추가하고 2 분 동안 4.52 XG에서 세포를 스핀.
- 조심스럽게 챔버에서 슬라이드를 제거하고 마이 엘 로퍼 옥시 다제 (단계 1.4), 에스 테라 제 (단계 1.5) 또는 5 월 그룬 왈드 김사 (단계 1.6)로 염색하기 전에 슬라이드를 공기 - 건조.
- 면역에 대한 마이 엘 로퍼 옥시 다제 염색
- 2 분 동안 용액을 다음 슬라이드를 공기 - 건조 : 아세톤 (1 1 :) 냉 메탄올 슬라이드 침지하여 슬라이드에 세포를 고정한다.
- 정보원을 그려, 세포를 포함하는 슬라이드의 영역에 액체를 가두발수 펜을 사용하여 세포 주위 rcle.
- 10 분 동안 차가운 PBS 용액 200 μL의 세포를 씻어.
- 정상 당나귀 혈청 10 ㎕의 정제 된 항 CD16은 / 32 항체를 10 ㎍ / ml를 함유 3 % BSA / PBS 완충액 200 μL의 셀 블록.
- (3 % BSA / PBS 완충액에 20 μg의 / ㎖로 희석) 항 마우스 된 myeloperoxidase 200 μL를 적용한다. 습도 챔버에서 4 ° C에서 세포 O / N을 품어.
- 차가운 0.1 % BSA / PBS 200 μL와 세포를 씻으십시오.
- 3 % BSA / PBS 버퍼에 1/250로 희석 방지 염소의 IgG 항체의 200 μl를 적용합니다. 습도 챔버에서 RT에서 2 시간 동안 세포를 인큐베이션.
- 차가운 PBS에 두 번 0.1 % BSA / PBS 버퍼 200 μL와 세포를 3 회 반복합니다.
- RT에서 2 분간 (1 μg의 / ㎖로 최종 농도) PBS에서 1 / 1,000으로 희석 한 200 ㎕의 훽스트과 세포핵을 염색.
- 물 슬라이드를 세척하고 mountin 전에 공기 건조에 허용지. 세포에 매체 (1)를 장착 한 방울을 적용, 슬라이드에 커버 유리의 한쪽 끝을 배치하고 신중하게 집게를 사용하여 세포에 그것을 내립니다. 부드럽게 커버 유리에 눌러 기포를 제거합니다.
- 에스 테라 cytochemistry
참고 : RT에 대한 사전 따뜻한 모든 시약.- 정착액 준비
- 2.5 시트르산 용액 ㎖, 아세톤 6.5 ㎖의 유리 병에 0.8 ml의 37 % 포름 알데히드 추가 시트 레이트 - 아세톤 - 포름 알데히드 (CAF) 용액을 제조 하였다. 부드럽게 믹스와 4 ℃에서 저장한다.
- 나프톨 AS-D 클로로 에스 테라 제 (CAE) 활동 분석
- 37 ° C에 따뜻한 탈 이온수.
- 한 50㎖ 튜브에서, 염료 용액 1 ㎖에 아질산 나트륨 용액 1 ㎖를 추가한다. 부드럽게 믹스 2 분 동안 서 보자. 추가 예열 40㎖의 탈 이온수, 5의 pH 6.3 완충 용액 농축 나프톨 AS-D 클로로 아세테이트 용액 1 ㎖. 믹스와 코 플린 항아리에 전송합니다.
- 위에 세포를 수정슬라이드 CAF 용액 (단계 1.5.1.1 참조) 30 초 (섹션 1.3 참조), 탈 이온수로 45 초 동안 슬라이드를 씻는다.
- 1.5.2.2 단계에서 제조 된 용액에 슬라이드 이동하고, 빛으로부터 보호, 습도 챔버 내에서 30 분 동안 37 ° C에서 슬라이드를 배양한다.
- 슬라이드를 건조 후 2 분 동안 탈 물에 침수를 통해 그들을 씻어.
- 헤 마톡 실린 용액 몇 방울을 첨가하고, 1 분간을 배양하여 세포를 Counterstain과.
- 중성 (PH 7)와 슬라이드를 세척하고 자연 건조로 할 수 있습니다. 세포에 매체 (2)를 장착 한 방울을 적용, 슬라이드에 커버 유리의 한쪽 가장자리를 놓고 신중하게 집게를 사용하여 세포에 그것을 내립니다. 부드럽게 커버 유리에 눌러 기포를 제거합니다.
- 알파 - 나프 부티레이트 에스테라아제 (NBE) 활성 분석
- 사용하기 전에 37 ° C에 따뜻한 α 나프 틸 부티레이트 솔루션입니다.
- 나트륨 니트 중 하나 태블릿을 희석탈 이온수 6.25 ml의 의식.
- 50 ㎖의 튜브에, 아질산 나트륨 정제 용액 1.5 mL로하고 Pararosaniline 용액 1.5 mL로 추가한다. 부드럽게 혼합 용액을 5 분간 방치한다. 인산 완충 용액 40 ml를 가진 솔루션을 보충. 조심스럽게 10 N NaOH를 적가하여 pH를 6으로 가져옵니다. 의 α-나프 틸 부티레이트 솔루션의 5 ML을 추가 전체 솔루션을 혼합하고, 코 플린 항아리로 전송합니다.
- RT에서 CAF 용액을 사용하여 10 초 동안 슬라이드에 세포를 고정시키고 탈 이온수로 45 초간 린스.
- 전송 빛으로부터 보호하면서 단계 1.5.3.2에서 제조하고, 습도 챔버 내에서 37 ° C에서 1 시간 동안 함께 부화 된 용액을 함유하는 코 플린 항아리에 슬라이드.
- 2 중성 물에 분 (PH 7) 공기 건조에 대한 슬라이드를 씻어.
- 슬라이드에 몇 방울을 추가하여 메틸렌 블루 용액으로 세포를 Counterstain과 4 분 동안 품어.
- deio에 슬라이드를 담가2 분 동안 물을 nized하고 자연 건조로 할 수 있습니다. , 슬라이드 마운트 세포 매체 (2)를 장착 한 방울을 적용하려면, 슬라이드에 커버 유리의 한쪽 끝을 배치하고 신중하게 집게를 사용하여 세포에 그것을 내립니다. 부드럽게 커버 유리에 눌러 기포를 제거합니다.
- 정착액 준비
- 월 - 그룬 왈드 김사 (MGG) 염색
- 3 분 5 월 - 그룬 왈드 솔루션을 포함하는 코 플린 항아리에 슬라이드를 침지하여 (섹션 1.3에서 준비) 세포를 얼룩.
- 1 분 동안의 pH 6.8 완충액을 함유하는 코 플린 항아리에 슬라이드 이동.
- 10 분 동안 (pH를 6.8 완충액에 1/20로 희석)을 R 김사 용액을 함유하는 코 플린 병에 넣어서 슬라이드 얼룩. 10 초 동안 중성 (PH 7)와 슬라이드를 씻으십시오.
- 배수 및 슬라이드를 공기 건조. 세포 상 매체 (2)를 장착 한 방울을 가하여 슬라이드 마운트. 슬라이드에 커버 유리의 한쪽 가장자리를 놓고 조심스럽게 그것을 낮출세포에 집게를 사용. 부드럽게 커버 유리에 눌러 기포를 제거합니다.
생체 개발 2. 및 급성 백혈병의 특성
참고 : 4 주 된 여성 congenic C57BL / 6J-Ly5.1 마우스가 (무균 환경에서, 예) 특정 병원균이없는 조건에서 유지 하였다. 그들은 5 ~ 6 주 오래했다 때 마우스를 주사 하였다.
- C1498 세포와 정맥 주사
- 피펫 팅에 의해 현탁액의 배양 C1498 세포를 수확. 10 분 동안 350 XG에 50 ML의 튜브와 원심 분리기에 세포를 전송합니다. 회 냉 PBS 10 ㎖로 세포를 세척하고 PBS에서 107 세포 / ml의 세포 현탁액을 제조. 주사를 수행하기 전에 얼음에 세포 현탁액을 놓습니다.
- 제한 수단에 마우스를 위치시키고 층류 후드에서 무균 상태에서 주사를 수행한다.
- 로 세포를 주입 주사기와 29G 바늘을 사용하여꼬리 정맥. 선단에 꼬리를 잡고, 70 % 에탄올에 적신 거즈 스폰지를 소독. 주사기에 기포가 없는지 반드시 확인하고 천천히 꼬리 정맥에 C1498 세포 현탁액 100 ㎕ (10 6 세포)를 주입.
- 주입 후, 꼬리 바늘을 제거하고, 주사 부위 멸균 거즈 스펀지에 압력을 적용하여 출혈을 제어한다. 다음 시간 일 동안 그 상태를 확인 조심스럽게 케이지에 동물을 반환합니다.
- 레트로 궤도 혈액 수집
- 백혈병 질환 (예를 들어, 경직, 그룹에서 분리, 감소 또는 케이지없이 운동)의 흔적에 대한 PBS-및 C1498 주입 마우스의 동작을 모니터링합니다.
참고 : 세포가 주입 된 후이 보통 17 ~ 19 일 사이에 발생합니다. - 그냥 안락사 전에 복고풍 궤도 혈액 수집을 수행 층류에서 무균 조건 하에서 (단계 2.2.7 참조)후드와 가열 램프 아래 저체온증을 방지 할 수있다.
- 마취를 들어, 10 ㎎ / ㎏에서 150 ㎎ / ㎏과 자일 라진에서 케타민을 사용합니다. PBS 용액 18 ㎖에 자일 라진 1.5 케타민 ml의 0.5 ml에 희석하여 마취 솔루션을 준비합니다.
- 제어 및 백혈병 쥐를 마취. 26G 바늘을 사용하여 마우스의 10g 당 마취 용액 200 μL의 복강 내 주사하고 1 ML의 주사기를 진행합니다. 마취를 확인하기 위해 페달 반사의 손실을 확인합니다.
- 눈의 안쪽 눈구석에 모세관 튜브를 삽입합니다. 혈액은 모세관 튜브 내로 안와 부비동에서 일어날 것이다. 부드럽게 멸균 거즈 스펀지 눈에 압력을 적용하여 출혈을 제어한다.
주 : 혈액 100-200 μL의 양이이 방법을 사용하여 회수 할 수있다. - EDTA 튜브 내로 혈액을 수집하고, 단핵 세포를 분리하기 전에 얼음에 샘플을 저장한다.
- 경추 탈구를 사용하여 마우스를 안락사 및장기 (2.3 절)을 분리로 진행합니다.
- 백혈병 질환 (예를 들어, 경직, 그룹에서 분리, 감소 또는 케이지없이 운동)의 흔적에 대한 PBS-및 C1498 주입 마우스의 동작을 모니터링합니다.
- 장기 및 세포 분리
- 장기 격리
- 플라스틱 보드의 후면 상에 안락사 마우스를 놓고 기관의 분리를 용이하게하기 위해 동물의 발을 고정하기 위해 바늘을 사용합니다. 절개를 수행하기 전에 70 % 에탄올을 사용하여 마우스를 소독.
- 멸균 가위를 사용하여, 목 복부 피부에서 복부 절개를 수행한다. 간 액세스 할 복벽의 실수. 흉곽과 폐에 액세스 할 수있는 격막을 잘라. 옆에 장을 이동하고 멸균 가위와 집게를 사용하여 비장을 제거합니다.
- 골수를 분리하기 위해, 멸균 가위를 사용하여 상기 대퇴골 관절의 상단에서 다리를 잘랐다. 부드럽게 잡아 당겨 대퇴골의 경골을 분리하고 집게와 가위를 사용하여 뼈의 피부와 근육을 제거합니다.
- 차가운 PBS가 포함 된 50 ML 튜브의 각 장기와 뼈를 배치하고 얼음에 배치합니다.
- 기관에서 세포의 분리
- 세포를 파괴하기 전에 비장의 무게를. 기계적 50 ㎖ 튜브에서 주사기 플런저를 사용하여 70 ㎛의 여과기를 통해 가압하여 비장, 폐 및 간을 방해하고, 차가운 PBS 30 ㎖ 중에 세포를 수집한다.
- 골수 세포를 수집 얼음 페트리 접시의 대퇴골과 경골을 넣어 멸균 가위를 사용하여 사지 절단, 차가운 PBS 5 ㎖를 함유하는 10 mL의 주사기에 부착 26G 바늘을 삽입하여 골수를 플러시.
- 니들 / 주사기를 통해 세포 현탁액을 전달하여 골수 세포를 파괴하고 50 ㎖ 튜브에서 70 ㎛의 여과기를 통하여 세포 현탁액을 필터.
- 원심 10 분 동안 350 XG에 장기 및 골수 세포를 각각 함유하는 모든 튜브. 상층 액을 제거하고,이 세포 용해 완충액 ㎖ (1X) 및 셀 내에서 폐, 골수로부터 수집 한 세포를 재현 탁부드럽게 상하 혼합물을 피펫 팅하여 세포 용해 완충액 (1X) 5 ml의 간 및 비장에서 분리 s는. 차가운 PBS와 50ml로 튜브를 입력합니다.
- 10 분 동안 350 XG에서 세포를 원심 분리기. 유동 세포 계측법 분석 FACS 완충액에 세포를 재현 탁하거나 현미경 세포를 제조 하였다. 트리 판 블루로 염색 한 후 토마 셀 카운팅 챔버를 사용하여 세포를 계산합니다.
- 장기 격리
- 유동 세포 계측법 분석을 위해 기관에서 분리 된 세포의 세포 표면 얼룩
- 튜브 유세포 라벨 FACS 완충액 100 ㎕에서 정제 된 항 CD16은 / 32 항체 10 μg의 / ㎖으로 기관으로부터 분리 된 106 세포.
- 106 골수 세포, FACS 완충액에 희석 한 다음 항체 또는 이들 항체의 자신의 상응하는 아이소 타입 컨트롤 100 ㎕를 추가 항 -CD11b / 항 CD3 (1) / 항 Ly6C / 안티 Ly6G (2) 항 B220 (1) /anti-CD45.2/anti-CD19 방지 CD115 / 항 CD3 (1) /TI-Ly6C / 안티 Ly6G (2) 항 CD45.2 방지 Ly6G (2) 항 -CD11b, 항 CD115 또는 단독 보정 설정 안티 CD19.
- 비장 세포, FACS 완충액에 희석 된 100 다음 항체 μL 및 해당 아이소 타입 컨트롤을 추가 / 항 CD3 (1) / 항 Ly6C이 방지 / Ly6G (2) 항 B220 항 -CD11b의 조합 (1, ) /anti-CD45.2/anti-CD19 방지 CD45.2 방지 Ly6G (2) 항 -CD11b 또는 보정 설정 안티 CD19.
- 폐와 간 세포에, 100 항 CD45.2 항체의 μL 및 FACS 버퍼에 1/100로 희석 해당 아이소 타입 컨트롤을 추가합니다.
- 4 ° C에서 30 분 동안 셀 솔루션을 모두 품어.
- 각 튜브를 FACS 완충액 2 ㎖를 첨가하여 세포를 세척 하였다. 350 XG에 5 분 동안 튜브를 원심 분리기와 피펫으로 상층 액을 폐기. 이 단계를 한 번 더 반복합니다.
- 차가운 PBS 500 μL에 표시된 세포를 재현 탁. 얼음에 세포를 유지하고 교류를위한 유동 세포 계측법을 수행하기 전에 빛으로부터 보호quisition 및 분석 10.
- 유세포 분석을위한 혈액 단핵 세포와 면역 염색의 단리
- 프로토콜을 시작하기 전에, RT로 분리 용액을 미리 가온.
- 미세 원심 분리 관에 (단계 2.2에서 얻어진 100 내지 200 μL), 용액의 부피 500 μL 때까지 PBS / 1 mM의 EDTA 용액을 추가 혈액 샘플을 전송. 조심스럽게 30G 바늘 및 1 mL의 주사기를 이용하여 혈액을 함유하는 용액 하에서 분액 500 ㎕를 계층. 혈액과 분리 솔루션을 함께 사용하지 마십시오.
- 실온에서 20 분 동안 (브레이크없이) 800 XG에 튜브를 원심 분리기. 원심 분리 후, 피펫을 사용하여 세포 링 (불투명 한 흰색 층)을 수집합니다. 미세 원심 튜브에 세포를 전송합니다.
주 : 불투명 한 백색 층은 림프구뿐만 아니라 단핵구를 포함하며, 하부 층 사이에 나타나는 - 분리 용액 - 상층. - 1 ML을 추가PBS 용액에서 원심 분리를 10 분 동안 350 XG에 튜브. FACS 완충액 600 ㎕를 상기 세포를 재현 탁.
- (100 μL 각)를 정제 항 CD16 / 32 항체의 10 ㎍ / ㎖의 추가 여섯 별도의 튜브에 세포 현탁액 100 μl를 배포 할 수 있습니다.
- FACS 완충액에 희석 한 다음 항체 또는 관련 이소 타입 컨트롤 100 ㎕에 세포를 라벨 : (1) / 항 B220 (1) /anti-CD45.2 안티 Ly6C 방지 / CD115 항 CD3의 조합을 /anti-CD45.2 또는 항 CD45.2 혼자 보상 설정에 대한 안티 CD115.
- 30 분 동안 39 ° C에서 튜브 모든 부화.
- 각 튜브에 FACS 버퍼 2 ㎖를 첨가하여 세포를 세척 한 다음 350 XG에 10 분 동안 튜브를 원심 분리하고, 피펫을 사용하여 상층 액을 버린다.
- 500 μl의 차가운 PBS에 표시된 세포를 재현 탁. 얼음에 세포를 유지하고 수집 및 분석 (10) 유동 세포 계측법을 수행하기 전에 빛으로부터 보호.
- 현미경 슬라이드에 골수 세포 현탁액의 제조
- 1.3 절에 설명 된 단계를 수행하지만, 단계 1.3.1에서 10 분 동안 72.26 XG에서 각 챔버에 세포를 10 5 골수 세포를 사용하고, 단계 1.3.4에서, 스핀.
- 에스 테라 제 활성 분석 골수 세포를 사용하여
- 골수 에스 테라 제의 cytochemistry 분석을 수행하려면, 단계 1.5.3.7 1.5에서 진행합니다.
- 골수 세포의 Grunwald 월 - 김사 염색
- 골수 세포를 염색하기 위해, 1.6 절에 설명 된 프로토콜을 수행하되, 단계 1.6.1에서 5 분 동안 5-6의 Grunwald 용액 슬라이드를 배양한다.
결과
C1498 마우스 모델의 특성을하기 위해, 우리는 두 가지 주요 단계를 계속했다. 우선, C1498 세포는 시험 관내에서의 혈통 조혈 성숙 단계 (도 1)을 결정하는 것을 특징으로 하였다. 이들 세포를 congenic 생쥐에 주입하고, 유기 백혈병 질환의 성질은 상이한 특징을 결정하는 평가 하였다 : 백혈병 세포의 침윤, 그 표현형, 골수의 조혈 세포의 정량화 (성숙 및 선조 / 전구체) 주파수를 C1498 세포와 혈액에 성숙 조혈 세포 및 장기 부종의 평가 (비장, 간, 폐) 및 세포 조성물.
시험 관내 C1498 세포 표현형을 특성화하기 위해, 세포를 조혈 전구체 및 성숙한 세포 (표 1)에 의해 표현되는 분자에 대한 항체로 표지하고, 그 결과 유동 cytomet를 사용하여 분석 하였다공예. C1498 세포 맥-1 (CD11b를 / CD18) (~ 7 %), B220 (> 25 %)의 세포 표면 발현을위한 양성이었고, 그들은 CD3ε, T 세포 수용체 (TCR) Vβ 쇄 맥의 세포 내 발현을 나타 -3 (도 2A와 B). 세포는 세포 표면 마커 Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1 및 팬 NK 분자를 부정적이었고, CD4와 CD8의 세포 내 발현 (데이터 도시하지 않음) . 이들은 다음의 조혈 줄기 세포 및 전구 세포 (표 1)의 마커에 대해 조사 하였다. 그들은 또한 CD117, CD34, 무서-1, CD150 및 CD16 / 32의 세포 표면 발현을위한 음성이었다 (데이터는 보이지 않음). 이러한 백혈병 세포를 접착 항원 제시 및 공동 자극 분자의 발현을 확인하기 위해 테스트 하였다. 세포 표면 마커 LFA-1 (CD11a에 / CD18), CD44, CD31 (PECAM-1) 및 H-2D B를 발현시키고, CD80, CD86 및 CD274 (데이터 미도시) MHC 클래스 II 부정적이었다. C1498 세포 therefore 골수 (맥-1, 맥-3) 및 림프 마커 (B220, CD3, TCR) 모두를 표명했다.
더 잘 조혈 혈통을 특성화, 마이 엘 로퍼 옥시 다제 발현은 면역 형광 현미경을 사용하여 평가 하였다. 모든 세포는 골수 유래 (도 3A)을 검증 마이 엘 로퍼 옥시 다제, 양성이었다. 세포의 대부분은 또한 α 나프 틸 부티레이트 에스 테라 제 (그림 3B, 왼쪽 패널)에 대한 긍정적 인 염색, 그들 중 일부는 나프톨 AS-D 클로로의 에스 테라 제 (검은 색 화살표) (그림 3B, 오른쪽 패널)에 대한 스테인드. 그 결과 세포가 단핵 세포 및 과립구의 혼합물을 함유하는 것으로 나타낸다. 5-6의 Grunwald 김사 염색을 수행 한 후, C1498 세포는 높은 nucleo - 세포질 비율 핵 3-5 핵소체하는 핵 주변 할로, 다수의 액포와 호 염기성 세포질 (도 3c를 폭발과 같은 형태를 표시하는 관찰 ). 일우리는 C1498 세포주 monoblasts 및 골수성 구성된다.
C1498 세포 (CD45.2 +)은 다음 정맥 CD45.1 + 마우스에 주사 하였다. 쥐 세포를 주입하고 17 내지 19 일 후에 굴복. 그들은 질병 사망 전에 백혈병 유형을 분석 할 수 있도록 상기 마우스들을 희생시켰다. PBS 주입 된 대조군 마우스는, 비교를위한 동일 시점에서 분석 하였다. C1498 세포 주입 된 마우스는 5-6의 Grunwald 김사 염색 (도 4A)을 수행 한 후에 셀의 폭발과 같은 외관에 의해 입증 된 바와 같이, 그들의 골수 C1498 세포의 대량 침투를 표시. 또한 급성 myelomonocytic 백혈병의 특징이다 monoblastic 및 myeloblastic 세포의 축적을 보여주는, 자신의 단핵구 및 과립 표현형 (그림 4B 및 C)를 보존.
(D)에골수 조혈 세포 번호, 백혈병 세포의 침윤, CD45.2 + C1498 세포, B의 림프구, 단핵구 및 (조상, 전구체 및 성숙 세포를 포함) 과립 인구 다음 낮았다 면역 염색 및 세포 계측법 분석 다중 파라 메트릭 흐름을 사용하여 정량화되었는지 etermine. 백혈병 세포가 조혈 세포의 36 %로 (16)로 표시 (데이터는 보이지 않음). 다른 세포 유형 모두 과립 세포와 평균 3 배에 대한 평균 4 배, B 세포 하위 집합에 대한 평균 5 배 (PBS를 주입 쥐에 비해 C1498 주입 된 쥐에서 상당히 낮은 숫자에 제시 하였다 C에 단핵구 부분 집합에 대한) (그림 5A).
백혈병 및 제어 마우스 혈액의 단핵 세포의 빈도에 대한 조사는 림프구 (도 6A)의 비교 백분율하지만 단핵구 높은 주파수를 함유하는 것으로 나타났다및 백혈병 세포. 이러한 특성은 급성 백혈병 myelomonocytic (11) (도 6b)을 대표한다.
급성 myelomonocytic 백혈병 (12)의 다른 기능 중, C1498 주입 마우스 부어 간 (간 비대), 폐와 비장 (비장) (도 7a)에 발표했다. CD45.2 + C1498 세포의 다양한 주파수는 면역 형광 염색법을 사용하여 이러한 기관에서 검출 및 분석 (그림 7B) 유동 세포 계측법했다. 로 비장 비대 침투 단핵 세포의 높은 숫자에서 발생할 수 있습니다, 우리는 또한 비장 인구의 비율을 추정했다. 상기 B 림프구, 단핵 세포 및 과립구 세포 분획의 수는 2 배의 평균 상당히 컸다 2.5 배 및 3 배 각각 제어 비장 (도 7C)보다 백혈병 비장있다.
얇은 페이지 = "1"> 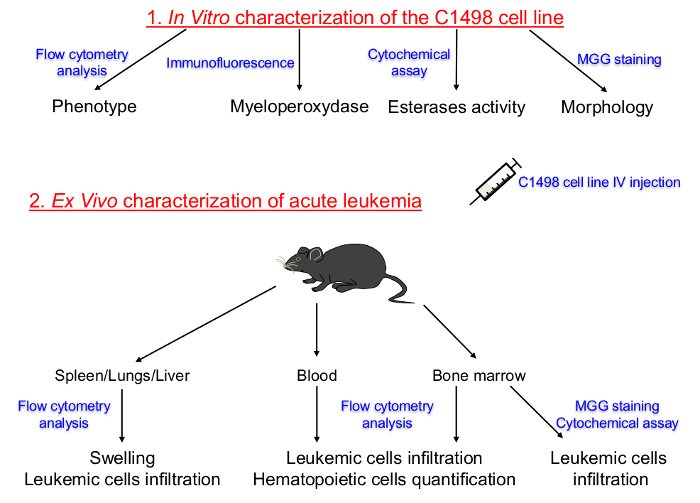
체외 배양 C1498 셀 라인과 급성 백혈병의 생체 설명에 특성화를위한 설정 프로토콜. 조혈 계통 및 조직 배양 C1498 세포의 분화 단계의 그림 1. 도식 표현 먼저 결정 하였다. C1498 세포는 급성 백혈병의 개발을 유도 congenic 마우스에 주사 하였다. 골수, 말초 혈, 비장, 간, 폐 조직의 분리는 C1498 세포 침윤 후 주파수 표현형 및 형태 학적 변화를 결정하기 위해 수행되었다. IV : 정맥 MGG :. 월 - 그룬 왈드 김사 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
광고 / 54270 / 54270fig2.jpg "/>
체외 문화. 도트 플롯과 세포 표면 (A) 및 세포 (B)의 히스토그램 세포 계측법 대표 흐름 후 C1498 세포의 그림 2. 표현형 분석 조혈 성숙한 세포 분화와 관련 된 분자가 표시됩니다 C1498-표현했다. C1498 세포는 세포 표면는 CD11b, CD18 및 B220 마커 또는 아이소 타입 컨트롤 특정 하였다 형광 항체를 사용하여, 배양 물로부터 수확 된 세정 표지 하였다. 세포 염색을 위해, 세포를 고정 및 투과 화 맥 3 CD3ε 대한 항체 및 TCR (T 세포 수용체) Vβ 쇄 또는 아이소 타입 컨트롤 공통 에피토프를 사용하여 라벨링 하였다. 분석은 살아있는 세포에 게이팅 사용하여 수행 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
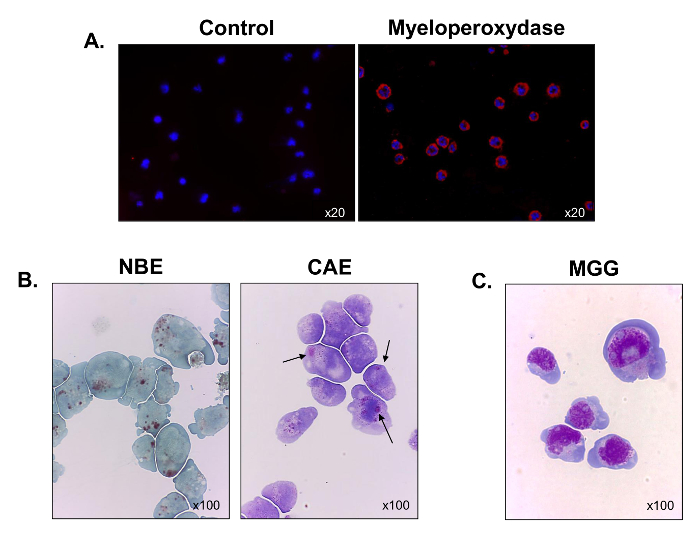
그림 3. 기능 및 배양 C1498 세포의 형태 학적 특성. C1498 세포 배양 물로부터 수확 현미경 슬라이드에 원심 분리 하였다. (A) 마이 엘 로퍼 옥시 다제 발현 염색 면역 형광을 사용하여 수행 하였다. (B) 세포 화학적 반응은 α-나프 부티레이트 에스테라아제 (NBE) 및 나프톨 AS-D 클로로 아세테이트 에스 테라 제를 분석 하였다 (CAE) C1498 세포에서 활동. 세포는 갈색과 붉은 보라색, 큰 세포질 과립, 각각 관찰되었다 각 레이블에 대한 긍정적 인 것으로 간주되었다. C1498 세포의 (C) 월 - 그룬 왈드 김사 (MGG) 염색. 각 염색 실험은 현미경 대물 렌즈 배율을 나타낸다. 각 이미지는 세 개의 실험을 나타낸다.large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
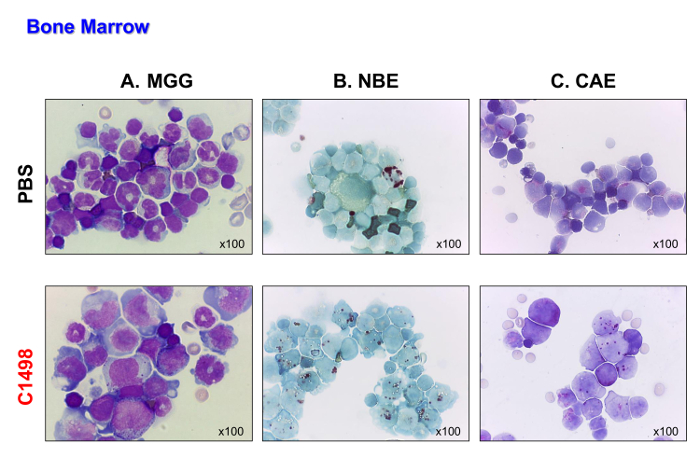
그림 4. PBS-과의 골수 모폴로지 마우스를 C1498 주입. 골수 세포는 PBS-및 C1498 세포 주입 쥐에서 분리하여 현미경 슬라이드에 원심 분리 하였다. (A) 월 - 그룬 왈드 김사 (MGG) 염색. (B ) α 나프 틸 부티레이트 에스 테라 제 (NBE) 및 클로로 에스 테라 제 (CAE) 기능이 cytochemistry를 사용하여 평가 하였다 AS-D (C) 나프톨. 패널 (A)에서, 밴드 (미숙 한) 또는 분할 (성숙) 호중구는 PBS-주입 된 쥐보다 C1498 주입 쥐의 골수에서 덜 볼 수 있습니다. 패널 B 및 C는 제어 골수에서 관찰 된 숫자에 비해 백혈병 골수 단핵 세포 및 과립구의 축적 있다는 것을 나타낸다. 모든현미경 분석은 100X 배율 목표를 사용하여 수행 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
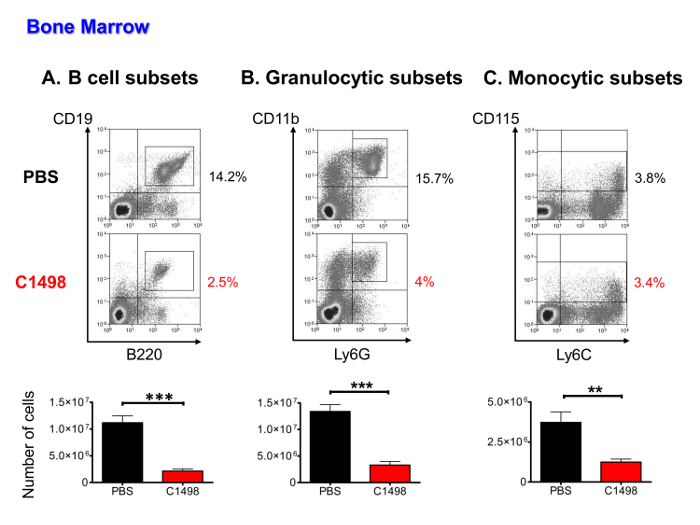
그림 5. PBS-과의 수질 인구의 정량 분석 마우스를 C1498 주입. 골수 세포는 PBS-및 C1498 세포 주입 쥐에서 분리 된 세포 계산을 수행 한 후 추정되었다. 다른 세포 집단의 주파수가 면역 및 세포 계측법 분석 생균 게이트 흐름 후에 측정 하였다. (A)가 B 세포의 서브 세트는에서 B 림프구 (B) 과립 세포 성숙 프로 B 세포로부터 단계에서 CD19 + B220 + 세포를 포함 전구체을 포함 CD11b를 + Ly6G + 계통, - CD3. CD115 + 및 단핵구 단계 성숙하는 전구 세포를 포함 - 차 미성숙과 성숙 과립구 (C)는 단핵구 부분 집합은 CD3로 정의 하였다. n은 7 마우스 / 그룹 및 데이터 =은 SEM ± 수단을 보여주는 히스토그램으로 표시하고 있습니다. ***, p <0.0001 **, P <0.01, PBS-및 C1498 주입 쥐를 비교 짝이 학생의 T- 테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
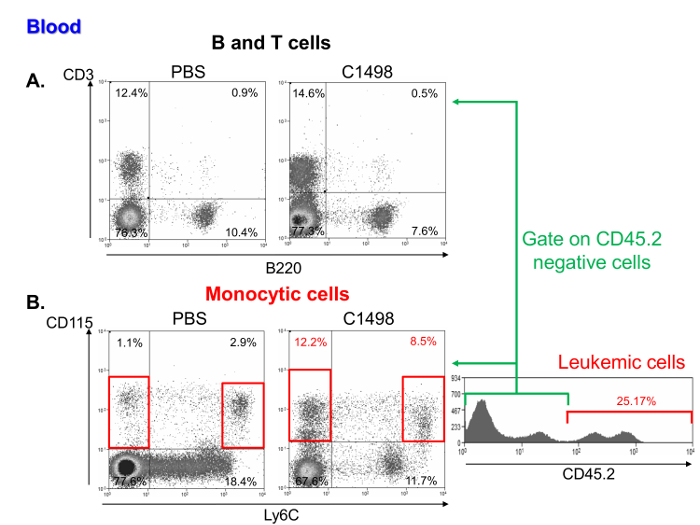
PBS-과의 단핵 세포 하위 집합의 그림 6. 혈액 분석 쥐를 C1498은 주입. 각각 PBS-및 C1498의에서 CD3 +와 B220 + 세포로 정의 하였다 (A) T와 B 림프구 비율의 도트 플롯 세포 계측법 대표 유동 세포 주입.와 CD115 + Ly6C 높은 세포 - 마우스 (B) C1498의 백혈병 및 제어에 단핵구 세포 주파수 (PBS) 마우스 CD115 + Ly6C를 분석하여 측정 하였다. 분석은 생균 게이팅에 의해 수행되었다. 백혈병 및 제어 쥐를 비교하기 위해, C1498 세포는 제외 하였다 + CD45.2입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
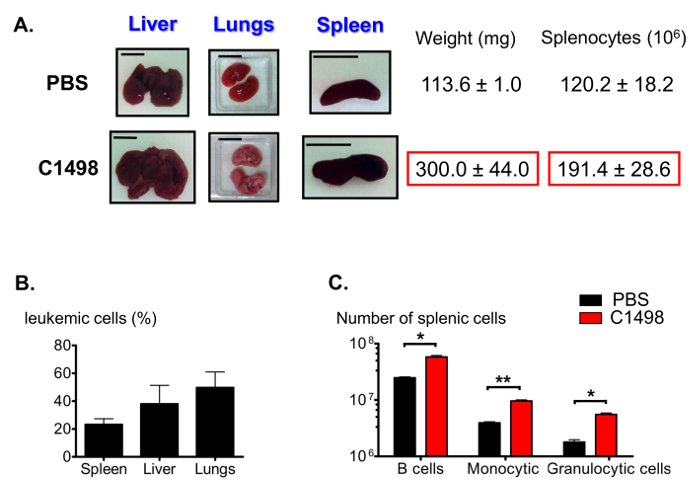
백혈병 및 제어 마우스의 비장 인구의 그림 7. 평가. (A) 마우스 백혈병 부종, 간, 폐, 비장의 대표 사진은 대조군 마우스와 비교. 비장은 조직 중단 다음 수집 및 무게, 및 비장 세포를 계수 하였다되었다. (B) 히스토그램은 diff에서 백혈병 세포의 주파수를 나타내는erent 기관 면역이 CD45.2 + 세포에 대해 수행하였으며, 그 결과는 유동 세포 계측법으로 분석 한 후. (C) 비장 B, 면역 후 과립구 및 단핵구 세포 수의 추계 분석 게이팅 유동 세포 계측법 살아있는 CD19 + B220을 식별하기 위해 수행되었다 + , CD3 - CD11b를 + Ly6G +, CD3 - CD11b를 + Ly6C - 및 CD3 - CD11b를 + Ly6C 높은 세포. 폐, 비장 및 간에 대해 표시 스케일 바는 1cm를 나타냅니다. .. n은 5 = - 8 마우스 / 그룹 및 데이터 SEM ± 수단으로 막대 그래프로 표시됩니다 * P <0.05, **, P = 0.0033, PBS-과 비교 짝이 학생의 T- 테스트 C1498이 주입 된 쥐 하세요 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 셀 유형 | 막 또는 세포 내 분자 |
| 전구체와 성숙한 세포 | |
| NK 세포 | NK1.1 +, 팬-NK의 + |
| NKT 세포 | NK1.1 +, 팬-NK +, TCR Vbeta + (8.2), CD3 + |
| T 림프구 | TCR Vbeta +, CD3 +, CD4 +, CD8 + |
| B 세포 전구체와 B 림프구 | B220 +, CD19 +, CD21 / 35 + |
| 과립 전구체 및 과립구 | Ly6G +, 맥-1 +, CD11b를 + |
| 단핵구 전구체 및 단핵구 / 대 식세포 | CD11b를 +, 맥-1 + 맥 - 3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| 조상 | |
| 능성 전구 세포 | CD117 + 무서-1+ CD34 + (선형 적 CD150-) |
| 림프 - 프라임 능성 전구 세포 | CD117hi 무서-1hi CD127 + (선형 적) |
| 일반적인 림프 전구 세포 | CD117lo 무서-1lo CD127 + (선형 적) |
| 공통 골수 전구 세포 | CD16 / 32lo CD117 + CD34int (선형 적 무서-1) |
| 과립구 - 대 식세포 선조 | CD16 / 32hi CD117 + CD34hi (선형 적 무서-1) |
| 거대 핵 세포 - 적혈구 전구 세포 | CD16 / 32lo CD117 + CD34lo (선형 적 무서-1) |
| 조혈 줄기 세포 | CD117 + 무서-1 + CD150 + (선형 적 CD34-) |
표 조혈 세포 계통과 차별화 1. 마커.
CD : 차별화의 클러스터; 린 : 성숙한 세포의 마커; 봐라:낮은 표현; 안녕하세요 : 고 발현; INT : 중간 표현; NK : 자연 살해 세포; TCR : T 세포 수용체.
토론
이전 연구에서, C1498 세포주 급성 과립 5 myelomonocytic 6 또는 7 NKT 세포 백혈병 유도제로서 설명 하였다. 그러나, 문학 실증 데이터가 없거나 불완전한 중 하나였다. 여기에 제시된 프로토콜은 유동 세포 계측법, 면역, MGG 염색 및 세포 화학적 분석과 같은 다른 기술, 배양 C1498 세포를 특성화하고 주입 후 쥐에서 유도되는 백혈병의 특성을 결정하기 위해를 사용한다.
우리는 면역 염색 후 체외 배양 C1498 세포 phenotyped과 세포 계측법 분석을 수행 하였다 흐름 때 이러한 세포가 이전에 문헌 6,7에 설명 된 몇 가지 세포 표면 조혈 마커를 표현하기 때문에, 우리는 몇 가지 제한을 관찰했다. 우리의 결과와 일치, 라벨 씨 등은. 흐름 cytomet를 사용하여 C1498 세포에 성숙한 TCR의 세포 표면 발현을 관찰하지 않았다공예 염색. 그들은 CD3ε 및 TCRVβ8.2 7 mRNA를 검출 한 후 그러나 그들은 NKT 세포주로 그들을 고려. 우리는 또한 세포 (> 70 %)의 대부분 TCRVβ 체인 및 CD3ε 분자의 세포 내 발현을 관찰하지만, 맥-3 분자의 수반 세포 내 발현도 있었기 때문에 자신의 조혈 계통은 확인할 수 없습니다.
마이 엘 로퍼 옥시 다제, MGG 염색 및 cytochemistry를 사용하여 기능 에스 테라 제를 분석 평가는 C1498 세포주는 골수 기원을 가지고 있었고, monoblasts 및 골수성로 구성되었음을 보여 주었다. 이러한 결과는 착색 유동 세포 계측법 분석 얻었다 맥 3 + 세포의 비율로 조화 된 있었다. 다음 단계는 키 실험을 나타내는 정량적하지 않지만 수행합니다. 사실, 그들은 전혀 또는 F를 표현 조혈 세포의 혈통과 분화 단계의 특성에 가장 적합한 기존의 방법은 지금까지 남아EW 특정 표현형 마커.
염색 유동 세포 계측법은 C1498 세포를 정맥 주사 한 후 congenic 마우스의 급성 백혈병의 개발을 설명하는 데 도움이되었다. 말초 혈액 및 다양한 기관에이 침투 CD45.2 + C1498 세포 격리했고, 그 주파수를 측정 하였다. 정량은 면역 표현형 후 고유 골수 및 비장 세포를 분석 하였다. 그들은 약간 조혈 마커를 나타낸 상기 C1498 세포 표현형 기관에서 조사 될 때 한계가 발견되었다 (이들 중 단지 소수의 B220 +이었다). 상기 관찰 급성 백혈병의 자연, 월 - 그룬 왈드 김사 염색 및 단핵구의 활동의 분석을 정의하고 과립 에스 테라 제 골수를 사용하여 수행 하였다. 결과는 C1498 세포가 myelomonocytic 백혈병의 발병을 공개, 그들의 myeloblastic 및 monoblastic 형태와 기능을 보존 것으로 나타났다.
특히주의 pH를 부여해야합니다. 과립구 및 림프구는 또한 더 높은 pH 값에서이 테스트에 대한 양성 염색 할 수 있기 때문에 예를 들면, α-나프 부티레이트 에스 테라 제 활성은 단지 6.0의 pH에서 단핵 세포에 특이. 세포를 집착하는 것은 MGG 염색을 수행하기 전에 권장, 우리는 C1498 세포를 이용하여 에스 테라 제를 세포 화학적 반응을 수행하는 경우에만 CAF 고정은 만족스러운 결과를 제공하는 것으로 나타났다되지 않습니다. 계측법은 시료 (예, 혈액, 골수, 비장 세포)의 모든 과정 동안 얼음에 보관해야 상기 CD115 분자의 발현과 흐름에 의해 그 검출을 보존. 전혀 오염은 유동 세포 계측법 / 또는 면역 실험 항체의 참조 스토리지 재 관찰되지 않으면표창 및 희석 확인해야합니다. 재료 / 장비 테이블에 지정된 참조는 유동 세포 계측법 또는 면역 응용 프로그램으로 선정되었습니다. 일차 / 이차 항체 또는 공액 형광 인해 부적절한 저장 그들의 활동을 분실했을 수 있습니다 (예를 들어, 빛이나 열에 노출), 부적절한 희석, 광범위한 동결 / 해동 또는 오염 된 버퍼의 사용. 그들이 제대로 작동하는지 확인하기 위해 긍정적 인 컨트롤을 실행합니다. 마우스 골수 또는 관심의 단백질을 발현하는 것으로 알려져있다 비장 유래 세포를 사용합니다. 높은 배경이 아닌 특정 얼룩을 방지하기 위해, 세포가 제대로 세척하고 (면역에 대한) 높은 습도 유지 및 지침에 따라 항체가 희석되어 있는지 확인하십시오. 정확한 샘플의 배경 레벨을 결정하기 위해 이소 타입 대조군 항체와 차 항체에 대해 동일한 농도의 희석을 사용한다. 에스 테라 cytochemistry 실험 들면,시약 정제 마우스 비장 과립 (Ly6G +) 및 단핵구 (CD115 +) 세포를 함유하는 양성 및 음성 대조군 슬라이드를 사용하여 테스트 될 수있다.
이 연구에 기술 된 절차 C1498 세포의 주입 후 쥐에서 관찰 백혈병 많은 기능 인간 급성 백혈병 myelomonocytic 11,12와 공통 특징을 공유하는 것으로 나타났다. 침략 백혈병 세포는 성숙과 미성숙 (전구 세포 및 전구 물질) 골수 조혈 세포의 감소 결과. 단핵 세포만큼 C1498 세포는 말초 혈에서 고주파 (> 20 %)에 존재한다. 비대와 비장은 백혈병 세포의 침투에 기인하는 것으로 관찰되었고, B 림프구 및 골수 세포에서 유의 한 증가는 비장 함께 관찰되었다. 혈소판 번호가 혈액 분석을 사용하여 추정 될 때 Thrombopenia도 관찰되었다.
그것은 쇼였다N, 시험 관내 실험에서 사용 C1498 세포를 용해 요소 (13)를 분비하여 정상 쥐의 조혈을 억제하는 것이다. 여러 종양 마우스 모델에서 (단핵구 및 과립 세포 포함) 미숙 골수 세포는 또한 항 - 종양 특이 적 T 세포 활성화 및 증식 (14)을 억제 비장에 골수 마이그레이션하는 것으로 나타났다. 따라서, 골수에서 관찰 한 조혈 세포의 감소는 조혈 및 / 또는 이민의 결핍 중 하나에 기인 할 수 있었다. 후자의 메커니즘은 말초 혈액에서 monocytosis의 존재 또는 비장 확대 골수성 분획의 관찰을 설명 할 수있다. 이들 세포는 조혈 개선 비장으로부터 유래 된 수 있다고도 생각할 수있다. 성숙한 B의 전구체 15 림프구 실제로, 정상 조건 하에서, 비장 B 세포의 일부 서브 세트는 확인되었다. 또한, 염증성 조건 하에서 메드ullary 조상 줄기 세포는 성숙한 단핵구 (16)의 생산을 유도하는 비장 이주 도시되었다. 이 프로토콜은 우리가 백혈병의 개발에 참여하고 있으며, 추가 기능뿐만 아니라 분자 분석이 이렇게하기 위해 사용되어야하는 메커니즘에 관한 결론을 도출 할 수 없습니다. 그러나, 이러한 데이터는 급성 myelomonocytic 백혈병의 임상 적 특징에 대한 자세한 정보를 포함하고 평가 및 새로운 치료제의 효과를 이해하는 연구자 도움이 될 것입니다.
공개
The authors declare that they have no competing financial interests.
감사의 말
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
자료
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
참고문헌
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유