Method Article
Подробный протокол Характеризуя клеточной линии мышиной C1498 и его модель Associated Лейкоз Mouse
В этой статье
Резюме
Эта рукопись обеспечивает техническую процедуру , которая может быть использована для характеристики культур C1498 клеток в пробирке и острый лейкоз , индуцированного у мышей после их инъекции. Фенотипические и функциональные анализы выполняются с помощью проточной цитометрии, иммунофлюоресценции микроскопии, цитохимических и Май-Грюнвальд Giemsa окрашивания.
Аннотация
Внутривенная инъекция C1498 клеток в сингенных или конгенных мышей было проведено с 1941. Эти инъекции приводят к развитию острого лейкоза. Тем не менее, природа этого заболевания не была хорошо описана в литературе. Здесь мы предоставляем технический протокол для характеристики клеток C1498 в пробирке и для определения характера индуцированного лейкоза в естественных условиях. Первая часть этой процедуры сосредоточена на определении кроветворную происхождение и стадию дифференцировки культивированных клеток C1498. Для достижения этой цели, многопараметрических проточной цитометрии окрашивания используется для обнаружения маркеров кроветворных клеток. Иммунофлуоресценции микроскопии, цитохимия и окрашивающий Май-Грюнвальд Гимза затем выполняется для оценки экспрессии миелопероксидазы, активность эстеразы и клеточной морфологии, соответственно. Вторая часть этого протокола посвящена описанию болезни лейкемии , которая индуцируется вестественных условиях. Последнее может быть достигнуто путем определения частот лейкозных и присущих клеток в крови, кроветворных органов (например, костного мозга и селезенки) и не лимфоидных тканей (например, печень и легкие) с использованием специфических окрашивания и проточной цитометрии анализа. Характер лейкоза затем подтверждена с помощью Май-Грюнвальд Giemsa окрашивания и окрашивания для специфических эстераз в костном мозге. Здесь мы приведем результаты, которые были получены с использованием этого протокола в подобранных по возрасту C1498- и PBS-инъецированных мышей.
Введение
Острый миелоидный лейкоз (ОМЛ) характеризуется неконтролируемой пролиферации гемопоэтических миелоидных клеток, которые блокируются на разных стадиях созревания. Это дисрегуляция может повлиять на гранулоцитарного, моноцитарного, эритроцитарного или megaryocytic путей дифференцировки 1. AML клетки накапливаются в костном мозге, что приводит к нарушению гемопоэза, что приводит к тромбопения, лимфопении и анемии. Лейкозных клеток также проникают в кровь и не-лимфоидных органов.
Модель C1498 мышь была использована в течение многих десятилетий в качестве модели для острого лейкоза , так как раковые клетки были выделены из лейкозных 10-месячного C57BL / 6 (H-2 б) самки мыши в 1941 году В литературе описаны вторжение в кровь , кроветворные органы (например, селезенки и лимфатических узлов) и не кроветворные органы (например, печень, легкие, яичники, почки) по высоко пролиферирующих C1498 после того, как они были введены через инtravenous, подкожное или внутрибрюшинно в восприимчивых мышей 2-4. Тем не менее, было сообщено эта модель мыши , чтобы вызвать либо гранулоцитарный 2,5 или миеломоноцитарным 6 лейкоз. Совсем недавно, в исследовании , опубликованном в 2002 году описал этот тип рака , как мышиный НКТ клеточный лейкоз 7. Таким образом, литература отличается относительно природы этой клеточной линии C1498 и связанный с лейкемией он индуцирует у мышей. Эти расхождения в основном из-за отсутствия подробной и обновленной опубликованной информации о клетках и лейкозных заболевания в целом, так как многие исследования были проведены в 1950 - 70-х годов.
Здесь мы предлагаем подробный протокол для описания того, чтобы охарактеризовать клетки C1498 и проанализировать природу лейкозных болезни, индуцированной их внутривенной инъекции в организм мышей. Первый раздел этого протокола посвящен описанию C1498 клеток, которые культивировали в пробирке. Флуоресцентные антитела, направленные против поверхностных и внутриклеточных гемопоэтических маркеров использовались для определения их фенотипа с использованием проточной цитометрии. Присутствие миелопероксидазы оценивали с помощью иммунофлюоресценции микроскопии, их гемопоэтические происхождение и степень дифференцировки, были оценены с использованием цитохимических для оценки активности эстераз, и Май-Грюнвальд Гимза проводили окрашивание. Клетки C1498 затем вводили мышам, и острое заболевание лейкоз, который индуцировали описан во второй части этой статьи. Те же методы были использованы для определения частоты и фенотипы лейкозных и присущих клеток в костном мозге, периферической крови, селезенки и некроветворных органов (печени и легких).
Этот протокол является очень воспроизводимые, и данные, представленные здесь, помогут исследователям оценить влияние новых терапевтических стратегий. Эта модель лейкемии мыши уже используется для тестирования иммунотерапия приближается кй различные препараты химиотерапевтические 8,9. Их эффективность оценивали путем определения эволюции опухолевой массы и выживаемости. Этот протокол может быть использован для предоставления дополнительной информации о распределении и существования популяций лейкозных и других гемопоэтических клеток во время лечения.
протокол
Содержание животных и все экспериментальные процедуры были одобрены местным этическим комитетом по уходу за животными, по CEEA.NPDC (соглашение no.512012), и все эксперименты были проведены в соответствии с французским и европейским директивам по уходу и использованию лабораторных животных.
1. В пробирке Характеризация C1498 клеточной линии
- В пробирке культуре клеток C1498
- Подготовить полный среды RPMI (Институт Парк Мемориал Roswell) 1640, путем добавления 50 мл фетальной бычьей сыворотки (FBS), 5 мл пенициллина (100 Ед / мл) -streptomycin (100 мкг / мл), 500 мкл 50 мМ бета-меркаптоэтанола , 5 мл N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты (HEPES), 5 мл несущественных аминокислот и 5 мл пирувата натрия в 500 мл RPMI среды.
- Grow линию C1498 клеток в полной среде RPMI. Сбора клеток в суспензии с помощью пипетки, и переносят клетки в 50 мл пробирку. Центрифуга при 350 мкг в течение 10 мин, и удалите supernaTant.
- Добавьте 20 мл фосфатно-солевым буферным раствором (PBS) (1x) раствор, центрифуге при 350 х г в течение 10 мин, и удалить супернатант.
- Ресуспендируют клеток в 10 мл Флуоресцентный-активированных клеток сортировщика (FACS) буфера (2,5 г бычьего сывороточного альбумина (БСА) порошка и 2 мл 0,5 М раствора этилендиаминтетрауксусной кислоты (ЭДТА) в 500 мл раствора PBS). Граф клеток с использованием клетки Thoma счетнокамерное после окрашивания клеток трипановым синим.
- Фенотипическая характеристика C1498 клеточной линии с использованием иммуноокрашивания и проточной цитометрии анализа
- клеточной поверхности окрашивания
- Подготовка FACS буфера.
- Отрегулируйте собранных клеток в буфере FACS до 10 7 клеток / мл и дозировать 10 6 клеток (в 100 мкл) для каждого окрашивания эксперимента в проточной цитометрии трубок.
- Этикетка клеток с 100 мкл следующих антител или их соответствующие регуляторы изотипных разведенных в буфере FACS:
- Для тarkers предшественника и дифференцированных клеток, маркировать клетки с анти-CD11b / анти-CD18, (1), анти-Ly-6G (1), анти-CD19, анти-В220 (2), анти-NK1.1, анти- CD49b, анти-CD4 (1), анти-CD8 (2), анти-CD3 (3), анти-CD21 / 35, анти-CD115 и анти-TCRVβ антитела.
- Для получения гемопоэтических стволовых клеток / клеток-предшественников маркеров, используют комбинацию анти-CD34 / анти-CD117 / анти-Sca-1, анти-CD150 / анти-CD117 / анти-Sca-1, анти-CD117 / анти-CD127 или анти- CD16 / 32-биотин антитела в одиночку.
- Для маркеров клеточных функций (например, адгезии, презентации антигена, костимуляторных молекул и рецепторов), окрашивают клетки с анти-CD18 (2) / анти-CD11a, анти-MHC класса I, анти-MHC класса II, анти CD31, анти-CD44, анти-CD80-биотин, анти-CD86 и анти-CD274 антитела.
- Инкубируйте все проточной цитометрии труб при температуре 4 ° С в течение 30 мин.
- Вымойте клетки в два раза путем добавления 2 мл буфера FACS в каждую пробирку, центрифуге при 350 мкг в течение 5 мин и удалить супернатант.
- Добавьте 100 мкл буфера FACS в каждую пробирку и перейти к вторичной окрашивания путем добавления 100 мкл флуоресцентного стрептавидином (1/100 в буфере FACS для окончательного разведения 1/200) с биотинилированным-конъюгированных антител. Инкубировать пробирки при температуре 4 ° С в течение 30 мин.
- Вымойте клетки дважды следующим образом: добавьте 2 мл буфера FACS в каждую пробирку, центрифужные пробирки при 350 мкг в течение 5 мин и удалить супернатант с помощью пипетки.
- Ресуспендируют клеток в 500 мкл холодного PBS и поместить клетки на льду, держа их в темноте с помощью алюминиевой фольги для покрытия трубы. Анализ результатов с помощью цитометра 10.
- внутриклеточного окрашивания
- Готовят фиксирующую буфер добавлением 125 мл раствора 4% параформальдегида (PFA) до 375 мл раствора PBS.
ПРИМЕЧАНИЕ: Для приготовления 500 мл 4% PFA, тепла 400 мл раствора PBS до приблизительно 60 ° С на мешалке в вытяжном шкафу. Добавьте 20 г порошка ПФА, а также повысить рНпока ПФА не растворится. Дайте раствору остыть, доведения рН до 6,9, и составляют объем до 500 мл с помощью PBS. - Подготовьте permeabilizing буфер добавлением 0,5 г сапонина и 0,5 г БСА на 500 мл раствора PBS.
- Отрегулировать собранных клеток в буфере FACS до 10 7 клеток / мл и распределяют 10 6 клеток (100 мкл) для каждого окрашивающего эксперимента в проточной цитометрии трубок. Центрифуга клетки при 350 мкг в течение 5 мин, и удалить супернатант.
- Фиксации клеток в 200 мкл 1% раствора PFA и инкубировать в течение 10 мин при 4 ° C.
- Добавляют 2 мл permeabilizing буфера в каждую пробирку, центрифужные пробирки при 350 мкг в течение 5 мин и удалить супернатант с помощью пипетки. Добавьте 100 мкл буфера permeabilizing в каждую пробирку.
- Этикетка клеток с 100 мкл следующих антител или их соответствующими контрольными изотипных после разбавления их в буфер permeabilizing: анти-CD3 (2) / анти-CD8 (1), анти-CD3 (3) / ANTI-CD4 (2), анти-CD107b и анти-CD3 (3) / анти-TCRVβ.
- Инкубацию клеток при температуре 4 ° С в течение 30 мин.
- Вымойте клетки в два раза путем добавления 2 мл permeabilizing буфера в каждую пробирку. Центрифуга трубки при 350 х г в течение 5 мин, и удалить супернатант.
- Добавьте 100 мкл буфера permeabilizing к клеткам. Перейдите к вторичному окрашивания путем добавления 100 мкл флуоресцентного стрептавидина, разведенного в permeabilizing буфер биотинилированный-сопряженными антител. Инкубировать пробирки при температуре 4 ° С в течение 30 мин.
- Добавляют 2 мл permeabilizing буфера в каждую пробирку, центрифугировать пробирки при 350 мкг в течение 5 мин и удалить супернатант. Повторите этот шаг еще раз.
- Ресуспендируют клеток в 500 мкл холодного PBS, а затем поместить клетки на льду в темноте. Анализ результатов с использованием проточного цитометра 10.
- Готовят фиксирующую буфер добавлением 125 мл раствора 4% параформальдегида (PFA) до 375 мл раствора PBS.
- клеточной поверхности окрашивания
- Приготовление суспензии клеток на предметном стекле для микроскопии
- Wash 10 6 гаrvested C1498 клетки (полученные на шаге 1.1.4) с 5 мл холодного буферного дважды ПТ, и разбавить клеток в 1 мл холодного буфера FACS. Место труб на льду.
- Поместите слайды в одноразовых камер с предварительно прикреплены фильтровальных карты и поместить их в цитоцентрифуге.
- Добавляют 100 мкл буфера FACS в каждую камеру и фильтра карты, и спина их в течение 2 мин при 4,52 х г.
- Добавьте 100 мкл клеток в каждую камеру и фильтра карты, и спина клетки при 4,52 мкг в течение 2 мин.
- Осторожно удалите слайды из камер и Высушите слайды перед тем окрашивания их с миелопероксидазы (шаг 1.4), эстеразы (шаг 1.5) или май-Grünwald Гимза (шаг 1.6).
- Миелопероксидазы окрашивание для иммунофлуоресценции
- Закрепить клетки на слайдах погружением слайдов в холодном метаноле: ацетон (1: 1) раствор в течение 2 мин, а затем высушенного на воздухе слайды.
- Для ограничения жидкости в области слайда, содержащей клетки, нарисовать CIrcle вокруг клетки, используя водоотталкивающую перо.
- Промыть клеток в 200 мкл холодного раствора PBS в течение 10 мин.
- Блок клеток в 200 мкл 3% БСА / PBS-буфере, содержащем 10 мкл нормальной ослиной сыворотки и 10 мкг / мл очищенного анти-CD16 / 32 антител.
- Применить 200 мкл миелопероксидазы анти-мыши (разбавленного до 20 мкг / мл в 3% БСА / ЗФР). Инкубируйте клетки O / N при 4 ° С во влажной камере.
- Промывают клетки с 200 мкл холодного 0,1% BSA / PBS.
- Применить 200 мкл анти-IgG-антител, козьих разведенных в 1/250 в 3% БСА / PBS буфера. Инкубируйте клетки в течение 2 ч при комнатной температуре во влажной камере.
- Промыть клетки 3 раза с помощью 200 мкл 0,1% BSA / PBS буфера и дважды в холодном PBS.
- Пятно Ядра клеток с 200 мкл Hoechst разведенных в 1/1000 в PBS (до конечной концентрации в 1 мкг / мл) в течение 2 мин при комнатной температуре.
- Вымойте слайды с водой и дайте им высохнуть на воздухе перед Mountinг. Нанесите одну каплю монтажа среды 1 к клеткам, поместите один край крышки стекла на предметное стекло и осторожно опустите его на клетки с помощью щипцов. Слегка нажмите на крышку стекла, чтобы удалить пузырьки воздуха.
- эстеразам цитохимия
Примечание: Предварительно Довести все реагенты до комнатной температуры.- Фиксирующий препарат
- Для приготовления раствора цитрата Ацетон-формальдегидные (CAF), добавляют 2,5 мл раствора цитрата, 6,5 мл ацетона и 0,8 мл 37% формальдегида в стеклянный флакон. Осторожно перемешать и хранить при температуре 4 ° С.
- Нафтол AS-D хлорацетатом эстеразы (CAE) анализ активности
- Теплой деионизированной воды до 37 ° С.
- В 50 мл пробирку, прибавляют 1 мл раствора нитрита натрия к 1 мл раствора красителя. Осторожно перемешать и дать постоять в течение 2 мин. Добавить 40 мл подогретого деионизированной воды, 5 мл рН 6,3 буферного концентрата и 1 мл раствора нафтол AS-Д эфира хлоруксусной кислоты. Смешайте и переносят в банку Коплин.
- Закрепить клетки наслайды (смотри раздел 1.3) в течение 30 секунд с раствором CAF (см шаг 1.5.1.1), и мыть слайды в течение 45 секунд с деионизированной водой.
- Передача слайды в раствор, который готовили на шаге 1.5.2.2, и инкубировать слайды при температуре 37 ° С в течение 30 мин в камере влажности, защищенном от света.
- Высушите слайды, а затем промойте их с помощью погружения в деионизированной воде в течение 2 мин.
- Проводят контрастное клетки путем добавления нескольких капель раствора гематоксилином и выдержки их в термостате в течение 1 мин.
- Вымойте слайды с нейтральной воды (рН 7) и дайте им высохнуть на воздухе. Нанесите одну каплю монтажа среды 2 к клеткам, поместите один край крышки стекла на предметное стекло и осторожно опустите его на клетки с помощью щипцов. Слегка нажмите на крышку стекла, чтобы удалить пузырьки воздуха.
- Альфа-Нафтил бутират эстеразы (NBE) анализ активности
- Теплый α-нафтил раствор бутирата до 37 ° С перед использованием.
- Разведите одну таблетку нит натрияобряду в 6,25 мл деионизированной воды.
- В 50 мл пробирку, добавляют 1,5 мл раствора таблеток нитрит натрия и 1,5 мл раствора Pararosaniline. Аккуратно перемешайте и дайте раствору отстояться в течение 5 мин. Дополнение раствора с 40 мл фосфатно-буферного раствора. Довести до рН 6 осторожным добавлением 10 N NaOH по каплям. Добавляют 5 мл раствора бутират α-нафтил, перемешать, чтобы весь раствор, и передать его в банку Коплин.
- Фиксации клеток на слайды в течение 10 сек с использованием раствора CAF при комнатной температуре и прополоскать в течение 45 с деионизированной водой.
- Передача скользит в банку Коплин, содержащую раствор, который был подготовлен на этапе 1.5.3.2 и инкубировать вместе в течение 1 ч при 37 ° С во влажной камере в то время как в защищенном от света.
- Промыть слайды в течение 2 мин в нейтральной воде (рН 7) и воздушно-сухой.
- Контрастное клетки с раствором метиленового синего, добавив несколько капель на слайде и инкубировать в течение 4 мин.
- Погрузитесь слайдов в deioнизован воды в течение 2 мин и дайте им высохнуть на воздухе. Для установки слайдов, нанесите одну каплю монтажа среды 2 к клеткам, поместите один край крышки стекла на предметное стекло и осторожно опустите его на клетки с помощью щипцов. Слегка нажмите на крышку стекла, чтобы удалить пузырьки воздуха.
- Фиксирующий препарат
- Май-Грюнвальд Гимза (МГГ) окрашивание
- Пятно клетки (полученного в разделе 1.3) погружением слайдов в банку, содержащую раствор Коплин Май-Грюнвальд в течение 3 мин.
- Передача слайдов в банку Коплин, содержащую буферный раствор с рН 6,8 в течение 1 мин.
- Пятно слайды, помещая их в банку Коплин, содержащую раствор Гимза R (разбавленный до 1/20 в растворе рН 6,8 буфере) в течение 10 мин. Вымойте слайды с нейтральной воды (рН 7) в течение 10 сек.
- Слить воду и высушить на воздухе слайды. Установите слайды, применяя одну каплю монтажа среды 2 на клетки. Поместите один край крышки стекла на предметное стекло и осторожно опустите его нак клеткам с помощью щипцов. Слегка нажмите на крышку стекла, чтобы удалить пузырьки воздуха.
2. В Vivo развития и характеристика острого лейкоза
Примечание: Четыре-недельных самок мышей конгенных C57BL / 6J-Ly5.1 выдерживали при определенных условиях патогена (то есть, в стерильной среде). Мышам вводили, когда они были в возрасте от 5 до 6 недель.
- Внутривенные инъекции с клетками C1498
- Урожай культивируемые C1498 клеток в суспензии с помощью пипетки. Передача клеток в 50 мл пробирку и центрифугируют при 350 х г в течение 10 мин. Промыть клетки в 10 мл холодного PBS дважды, и подготовить клеточную суспензию из 10 7 клеток / мл в PBS. Поместите клеточную суспензию на льду перед выполнением инъекции.
- Поместите мышь в фиксатор и выполнять инъекции в стерильных условиях в ламинарном потоке.
- С помощью 29G иглы с помощью шприца для инъекции клеток вхвостовую вену. Ухватить за хвост, на дистальном конце, и дезинфицировать его с марлевым губкой, смоченной в 70% -ном этаноле. Проверьте , чтобы убедиться , что нет пузырьков воздуха в шприц, а затем медленно вводят 100 мкл суспензии клеток C1498 (10 6 клеток) в хвостовую вену.
- После инъекции удалите иглу из хвоста, и контролировать любое кровотечение, применяя давление с помощью стерильной марлевой губки в месте инъекции. Вернуть животное в клетку, и тщательно проверить свое здоровье в течение следующих часов и дней.
- Ретро орбитальный сбора крови
- Контроль за поведением и C1498 PBS - инъецированных мышей на наличие признаков лейкозных заболевания (например, пилоэрекции, изоляции от группы, и уменьшенной или отсутствием движений в клетке).
Примечание: Как правило, это происходит от 17 до 19 дней после того, как клетки вводили. - Выполнить ретро орбитальную сбора крови непосредственно перед эвтаназии (см шаг 2.2.7) в стерильных условиях в ламинарном потокекапот и под нагревательной лампой, чтобы предотвратить переохлаждение.
- Для анестезии используют кетамин при 150 мг / кг и ксилазина в дозе 10 мг / кг. Готовят анестезирующий раствор путем разбавления 1,5 мл кетамина и 0,5 мл ксилазина в 18 мл раствора PBS.
- Обезболить контроль и лейкозных мышей. Продолжайте внутрибрюшинной инъекцией 200 мкл раствора анестетика на 10 г мыши с помощью иглы 26G и 1 мл шприца. Проверьте потерю рефлекса педали для подтверждения анестезии.
- Вставьте капиллярную трубку в медиальную кантус глаза. Кровь будет расти из орбитального синуса в капиллярную трубку. Контролировать кровотечение, осторожно применяя давление на глаз стерильной марлевой губкой.
Примечание: Объем от 100 до 200 мкл крови может быть собрана с помощью этой методики. - Собирают кровь в EDTA пробирку и хранить пробу на льду, прежде чем изолировать мононуклеарных клеток.
- Эвтаназии мыши с помощью цервикальной дислокации, иперейти к изоляции органов (раздел 2.3).
- Контроль за поведением и C1498 PBS - инъецированных мышей на наличие признаков лейкозных заболевания (например, пилоэрекции, изоляции от группы, и уменьшенной или отсутствием движений в клетке).
- Органы и клетки изоляции
- органов изоляция
- Поместите эвтаназии мыши на его спине на пластиковой доске и использовать иглы, чтобы закрепить ноги животного, чтобы облегчить изоляцию органов. Лечить мыши, используя 70% этанола перед выполнением надрез.
- Использование стерильных ножниц, выполнить вентральный надрез от кожи живота к шее. Вырезать через брюшную стенку, чтобы получить доступ к печени. Разрезать грудную клетку и диафрагму, чтобы получить доступ в легкие. Перемещение кишечника в сторону и удалить селезенку, используя стерильные ножницы и пинцет.
- Для того, чтобы изолировать костный мозг, вырезать ножки в верхней части указанных выше соединения с использованием стерильных ножниц бедренных костей. Отсоедините берцовую кость от бедренной кости, осторожно потянув, снимите кожу и мышцы от костей с помощью пинцета и ножниц.
- Поместите каждый орган и кости в 50 мл пробирку, содержащую холодный PBS, и поместить их на лед.
- Выделение клеток из органов
- Взвесьте селезенку перед тем разрушением клеток. Механически нарушить селезенка, легкие и печень, нажимая их через сито 70 мкм, с помощью шприца в 50 мл пробирку, и собирают клетки в 30 мл холодного PBS.
- Для сбора клеток костного мозга, положить бедренные кости и большеберцовые кости в чашку Петри на льду, вырезать конечностей с использованием стерильных ножниц, и вымывать костный мозг, вставив иглу 26G, прикрепленного к 10 мл шприц, содержащий 5 мл холодного PBS.
- Разрушени клеток костного мозга путем пропускания клеточной суспензии через иглу / шприц, и фильтр клеточной суспензии через сито 70 мкм в 50 мл пробирку.
- Центрифуга все пробирки, содержащие каждый из органов и клеток костного мозга при 350 мкг в течение 10 мин. Жидкость над осадком сливают и клетки вновь суспендируют, собранные из легких и костного мозга в 2 мл буфера для лизиса (1 раз) и клеткиы изолирован из печени и селезенки в 5 мл буфера для лизиса (1 раз), осторожно пипеткой смесь вверх и вниз. Заполните пробирки до 50 мл холодного PBS.
- Центрифуга клетки при 350 мкг в течение 10 мин. Ресуспендируют клеток в буфере FACS для анализа методом проточной цитометрии или для подготовки клеток для микроскопии. Граф клеток с использованием Thoma подсчета клеток в камере после окрашивания их с трипановым синим.
- органов изоляция
- Клеточной поверхности, окрашивание клеток, выделенных из органов для проточной цитометрии
- В проточной цитометрии трубки, этикетка 10 6 клеток , которые были выделены из органов с 10 мкг / мл очищенного анти-CD16 / 32 антител в 100 мкл буфера FACS.
- К 10 6 клеток костного мозга, вносят по 100 мкл следующих антител или комбинации антител и их соответствующими контрольными изотипных разведенных в буфере FACS: анти-CD11b / анти-CD3 (1) / анти-Ly6C / анти-Ly6G (2), анти-В220 (1) /anti-CD45.2/anti-CD19, анти-CD115 / анти-CD3 (1) / ANти-Ly6C / анти-Ly6G (2), анти-CD45.2, анти-Ly6G (2), анти-CD11b, анти-CD115 или отдельно для настройки компенсации против CD19.
- Для спленоцитов, добавьте 100 мкл следующих антител и их соответствующие средства управления изотипа разведенного в буфере FACS: сочетание анти-CD11b / анти-CD3 (1) / анти-Ly6C / анти-Ly6G (2), анти-В220 (1 ) /anti-CD45.2/anti-CD19, анти-CD45.2, анти-Ly6G (2), анти-CD11b или против CD19 для настройки компенсации.
- Для легкого и печени клетки, добавляют 100 мкл анти-CD45.2 антител и его соответствующий контроль изотипа разведенный в 1/100 в буфере FACS.
- Инкубируйте все решения клеток в течение 30 мин при температуре 4 ° С.
- Промывают клетки путем добавления 2 мл буфера FACS в каждую пробирку. Центрифуга пробирки в течение 5 мин при 350 х г и отбрасывая супернатант с помощью пипетки. Повторите этот шаг еще раз.
- Ресуспендируют меченых клеток в 500 мкл холодного PBS. Сохранить клетки на льду и защищенном от света месте перед выполнением проточной цитометрии для переменного токаприобрете- и анализ 10.
- Выделение мононуклеарных клеток крови и иммунофлуоресцентного окрашивания для проточной цитометрии
- Перед началом протокола, предварительно подогреть, отделяющую раствор до КТ.
- Перенести пробы крови (от 100 до 200 мкл, что, полученного на стадии 2.2) в микроцентрифужных трубки, и добавить PBS / 1 мМ раствора ЭДТА, пока объем раствора не составляет 500 мкл. Тщательно слой 500 мкл разделения раствора в раствор, содержащий в крови, используя 30G иглу и шприц емкостью 1 мл. Не следует смешивать кровь и раствор разделительную.
- Центрифуга трубки при 800 х г (без тормоза) в течение 20 мин при комнатной температуре. После центрифугирования собирают клеточный кольцо (непрозрачный белый слой) с помощью пипетки. Передача клеток в микроцентрифужных трубки.
Примечание: белый непрозрачный слой содержит лимфоциты, а также моноциты и появляется между нижним слоем - выделяющегося раствора - и верхним слоем. - Добавляют 1 млраствора PBS и центрифуге трубки при 350 х г в течение 10 мин. Ресуспендируют клеток в 600 мкл буфера FACS.
- Добавить 10 мкг / мл очищенного анти-CD16 / 32 антител и распределяют по 100 мкл клеточной суспензии на шесть отдельных трубок (100 мкл каждого).
- Этикетка клеток с 100 мкл следующих антител или их соответствующие регуляторы изотипных разведенных в буфере FACS: сочетание анти-CD3 (1) / анти-В220 (1) /anti-CD45.2 и анти-Ly6C / анти-CD115 /anti-CD45.2 или анти-CD45.2 и только для настройки компенсации анти-CD115.
- Инкубируйте все пробирки при температуре 4 ° С в течение 30 мин.
- Промывают клетки путем добавления 2 мл буфера FACS в каждую пробирку, а затем центрифугировать пробирки в течение 10 мин при 350 мкг, и отбросить супернатант с помощью пипетки.
- Ресуспендируют меченых клеток в 500 мкл холодного PBS. Сохранить клетки на льду и защищенном от света месте перед выполнением проточной цитометрии сбора и анализа 10.
- Получение суспензии клеток костного мозга на слайдах для микроскопии
- Выполните шаги , описанные в разделе 1.3, но на шаге 1.3.1, используют 10 5 клеток костного мозга, а также на этапе 1.3.4, спина клетки в каждую камеру в 72,26 мкг в течение 10 мин.
- Анализы эстеразы с использованием клеток костного мозга
- Для выполнения костного мозга эстеразы ЦИТОХИМИЯ анализы, исходят из шагов от 1,5 до 1.5.3.7.
- Май-Грюнвальд Гимза окрашивания клеток костного мозга
- Для того, чтобы окрасить клетки костного мозга, следовать протоколу, описанному в разделе 1.6, но на шаге 1.6.1, инкубировать слайды в растворе Май-Grünwald в течение 5 мин.
Результаты
Для того, чтобы охарактеризовать модель C1498 мыши, мы исходили два основных этапа. Во- первых, C1498 клетки были охарактеризованы , чтобы определить их кроветворную происхождение и созревания этап в пробирке (рис 1). Эти клетки затем вводили в конгенных мышей, а также характер индуцированного лейкозных заболевания оценивали, чтобы определить различные функции: лейкозных клеток инфильтрации, их фенотип, количественную кроветворных клеток (зрелые и предшественниках / прекурсоров) в костном мозге, частоты из C1498 клеток и зрелых гемопоэтических клеток в крови и оценке органов набухания (в селезенке, печени и легких) и клеточного состава.
Для того, чтобы охарактеризовать фенотипы C1498 клеток в пробирке, клетки метили с антителами , направленными против молекул, которые экспрессируются гемопоэтических предшественников и зрелых клеток (таблица 1), и результаты были проанализированы с использованием cytomet потокагу. Клетки C1498 были положительными на клеточной поверхности экспрессию Mac-1 (CD11b / CD18) (~ 7%), B220 (> 25%), и они проявляли внутриклеточной экспрессии CD3ε, Т-клеточного рецептора (TCR) Vβ цепей и Mac -3 (фиг.2А и В). Клетки были отрицательными для маркеров клеточной поверхности Ly6G, Ly6C, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, и пан-NK молекул и для внутриклеточной экспрессии CD4 и CD8 (данные не показаны) , Затем они были исследованы на маркеры гемопоэтических стволовых клеток и клеток - предшественников (таблица 1). Они также были отрицательными для клеточной поверхностной экспрессии CD117, CD34, Sca-1, CD150 и CD16 / 32 (данные не показаны). Эти лейкозных клеток затем тестировали, чтобы определить экспрессию адгезии, презентации антигена и костимуляторных молекул. Клетки выражены поверхностные маркеры LFA-1 (CD11a / CD18), CD44, CD31 (РЕСАМ-1), и H-2D б и были отрицательными для MHC класса II, CD80, CD86 и CD274 (данные не показаны). C1498 клетки тherefore выражается как миелоидный (Mac-1, Mac-3) и лимфоидные маркеры (B220, CD3, TCR).
Для того, чтобы лучше охарактеризовать их кроветворную происхождение, миелопероксидазы экспрессию оценивали с помощью иммунофлюоресценции микроскопии. Все клетки были положительными для миелопероксидазы, подтверждавшие их миелоидного происхождения (фиг.3А). Большинство клеток также окрашенных положительным для α-нафтил бутирата эстераз (рис 3B, левая панель), а некоторые из них окрашивают для нафтоловых AS-D хлорацетатом эстераз (черные стрелки) (рис 3B, правая панель). Эти результаты указывают на то, что клетки содержали смеси моноцитов и гранулоцитов. После того, как Май-Грюнвальд Гимза проводили окрашивание, наблюдались C1498 клетки , чтобы отобразить доменную морфологию с высоким ядерно-цитоплазматическим отношением, от 3 до 5 ядрышек в ядре, A перинуклеарном гало, многочисленные вакуоли и базофильной цитоплазмы (рис 3C ). Thмы, клеточная линия C1498 состоит из монобласт и миелобластов.
В C1498 клетки (CD45.2 +), затем внутривенно вводили в CD45.1 + мышей. Мышей поддался от 17 до 19 дней после того, как клетки вводили. Эти мыши были умерщвлены таким образом, что их тип лейкемии могут быть проанализированы, прежде чем они умерли от этой болезни. Контрольные мыши, которым вводили PBS, анализировали в тех же временных точках для сравнения. C1498 клеток инъецировали мышам отображается массивную инфильтрацию C1498 клеток в их костном мозге, о чем свидетельствует взрыв, как внешний вид клеток после того, как Май-Грюнвальд Гимза проводили окрашивание (фиг.4А). Они также сохранили свою моноцитарного и гранулоцитарного фенотип (рис 4В и С), что свидетельствует накопление монобластный и миелобластный клеток , что характерно для острого лейкоза миеломоноцитцарный.
Для гetermine ли были ниже медуллярные кроветворных клеток числа лейкозных клеток следующие вторжения, CD45.2 + C1498 клеток, B лимфоцитарными, моноцитов и гранулоцитов населения ( в том числе прародителей, предшественников и зрелых клеток), были определены количественно с помощью иммунофлуоресцентного окрашивания и многопараметрических проточной цитометрии анализа. Лейкозных клеток составила 16 до 36% от гемопоэтических клеток (данные не показаны). Другие типы клеток были все присутствующие в значительно более низкие показатели в C1498-инъецированных мышей, чем в PBS-инъецированных мышей (по 5 раз и в среднем на В-клеточных подмножеств, 4 раза в среднем по гранулоцитов и 3 раза в среднем для моноцитарными подмножеств) (рис 5A-C).
Исследование частот мононуклеарных клеток в лейкозных и контрольного мышиного образцов крови показал , что они содержали сопоставимый процент лимфоцитов (фиг.6а) , но более высокую частоту , моноцитарногои лейкозных клеток. Эти характеристики являются репрезентативными острого лейкоза миеломоноцитцарный 11 (рис 6б).
Среди других особенностей острого лейкоза миеломоноцитцарный 12, в C1498-инъецированные мышей представлены опухших печени (гепатомегалия), легких и селезенке (спленомегалия) (рис 7А). Различные частоты клеток CD45.2 + C1498 были обнаружены в этих органах с помощью иммунофлуоресцентного окрашивания и проточной цитометрии анализа (рис 7В). Как спленомегалия может быть результатом большого числа проникших моноцитов, мы также оценили пропорции селезеночных населения. Число клеток в B лимфоцитарной, моноцитов и гранулоцитов фракций клеток были значительно больше, в среднем в 2 раза, 2,5 раза и 3 раза, соответственно, в лейкозных селезенке , чем в контрольных селезенке (фиг.7С).
тонкослойных страница = "1"> 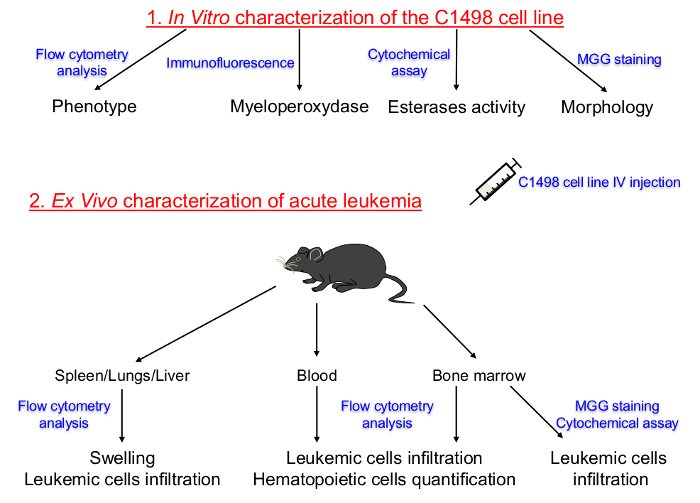
Рисунок 1. Схематическое изображение Протокола Set Up для Характеризуя в пробирке клеточных линий Выращенный C1498 и в естественных Описания острый лейкоз. Кроветворной линии и стадии дифференцировки тканей культивировали C1498 клеток впервые были определены. C1498 клетки затем вводили в конгенных мышам, чтобы вызвать развитие острого лейкоза. Выделение костного мозга, периферической крови, селезенки, печени и тканях легких проводили для определения частоты, фенотип и морфологические изменения после клеток инфильтрации C1498. IV: внутривенное МГГ:. Май-Грюнвальд Гимза Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Объявление / 54270 / 54270fig2.jpg "/>
Рисунок 2. Фенотипическое Анализ C1498 клеток после ин витро культуры. Репрезентативный поточной цитометрии участков точка и гистограмм клеточной поверхности (А) и внутриклеточной (B) C1498 экспрессируется молекулы , которые были связаны с гемопоэтических зрелой дифференцировки клеток показаны. Клетки C1498 собирали из культур, промывали и метили с помощью флуоресцентных антител, которые были специфическими для поверхности клеток CD11b, CD18 и маркеров В220 или их управления изотипу. Для внутриклеточного окрашивания, клетки фиксировали, проницаемыми и помечены с использованием антител, направленных против MAC-3, CD3ε и общий эпитоп TCR (Т-клеточный рецептор) Vβ цепи или их управления изотипу. Анализы были проведены с использованием стробирования с живыми клетками. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
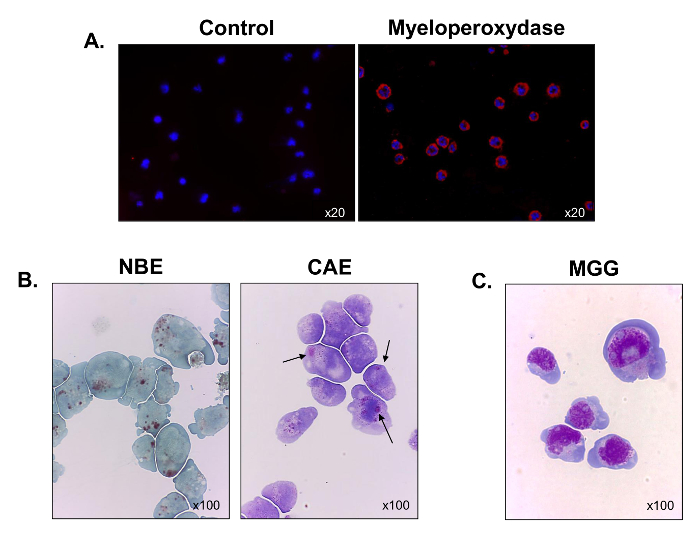
Рисунок 3. Функциональная и морфологическая характеристика Выращенный C1498 клеток. C1498 клетки собирали из культур , и центрифугировали на предметных стеклах для микроскопии. (А) Окрашивание для экспрессии миелопероксидазы проводили с использованием иммунофлуоресценции. (В) Цитохимические реакции были использованы для анализа α-нафтил бутирата эстеразы (NBE) и нафтол AS-Д хлоруксусной эстеразы (CAE) деятельность в C1498 клетках. Клетки считается положительным для каждой метки , когда коричневые и красно-фиолетовые, крупные цитоплазматические гранулы, соответственно, наблюдались. (C) Май-Грюнвальд Гимза (МГГ) окрашивание C1498 клеток. Для каждого окрашивания эксперимента, микроскопия объективное увеличение указывается. Каждое изображение из трех отдельных экспериментов.large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
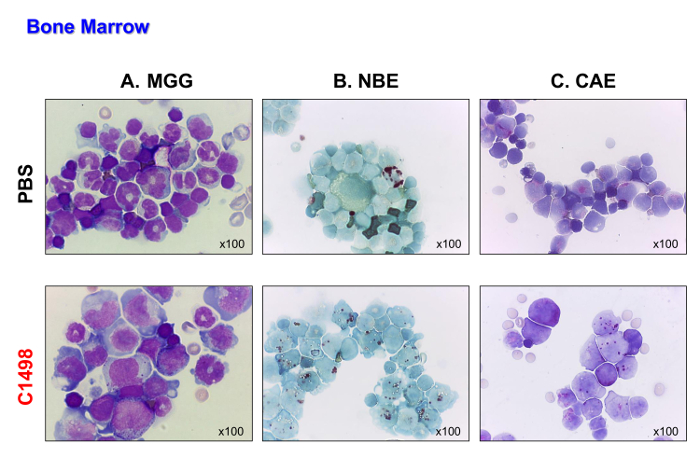
Рисунок 4. морфологию костного мозга в PBS - и C1498-вводили мышам. Клетки костного мозга выделяли из мышей и PBS - C1498 клеток-впрыскивается и центрифугировали на слайды для микроскопии. (А) Май-Грюнвальд Гимза (МГГ) окрашивание. (B ) α-нафтил бутират эстеразы (NBE) и (С) нафтол AS-Д хлоруксусной эстеразы (САЕ) функции оценивали с использованием цитохимических. В панели А, группа (незрелые) или (Географическая зрелые) нейтрофилы менее заметны в костном мозге из-C1498 вводили мышам, чем PBS-инъецированных мышей. На панели В и С показывают, что существует накопление моноцитов и гранулоцитов в лейкозных костного мозга по сравнению с количеством, наблюдаемых в контроле костного мозга. Всемикроскопические анализы были выполнены с использованием объектива 100х. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
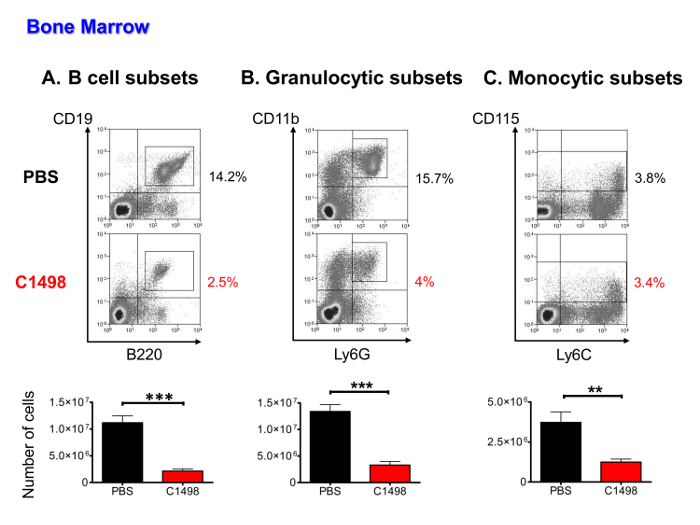
Рисунок 5. Количественный анализ медуллярной групп населения в PBS - и C1498-вводили мышам. Клетки костного мозга были выделены из PBS - и мышей C1498 клеток инъецировали и оценивается после подсчета клеток проводили. Частоты различных клеточных популяций определяли после иммунологического окрашивания и живой клетки закрытого типа проточной цитометрии анализа. (A) подмножеств В - клеток включены CD19 + В220 + клеток в стадиях от про-В - клеток в зрелых В - лимфоциты (В) гранулоцитарного клеток в CD3 - и CD11b + Ly6G + родословные, которые включали прекурсоры. е незрелых и зрелых гранулоцитов (C) моноцитов подмножества были определены как CD3 - CD115 + и включали клетки в родоначальника созревать стадии моноцитов. 7 мышей / группа, а данные представлены в виде гистограммы, показывающие средние значения ± SEM. *** Р <0,0001 и **, р <0,01, t- тест непарный Студенческая сравнивая и C1498 PBS - инъецированных мышей. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
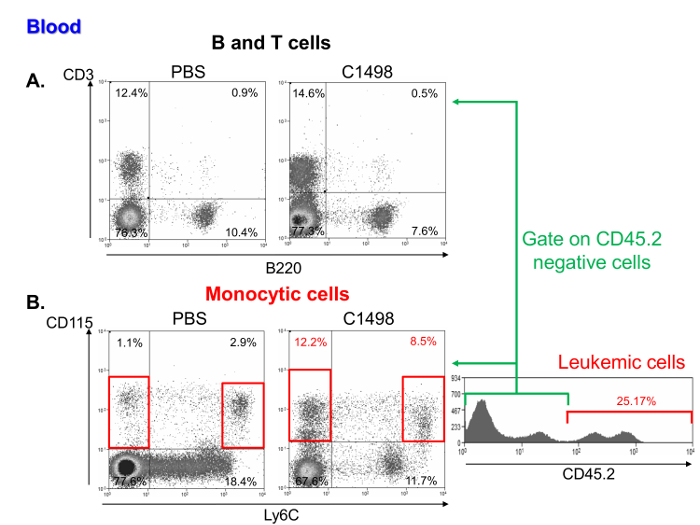
Рисунок 6. Кровь мононуклеарных клеток в подмножествах и C1498 PBS - инъецированных мышей. Представитель проточной цитометрии точечных участков (а) Т и В - лимфоцитов в процентах, которые были соответственно определены как CD3 + и В220 + клеток в PBS - и C1498 клетки инъецировали. мышей (B) Моноцитарные частоты клеток в C1498 лейкозных и контроля (PBS) мышей определяли с помощью анализа CD115 + Ly6C - и CD115 + Ly6C высокие клетки. Анализ проводился с помощью стробирования живых клеток. Для сравнения лейкозных и контрольных мышей, CD45.2 + были исключены C1498 клетки. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
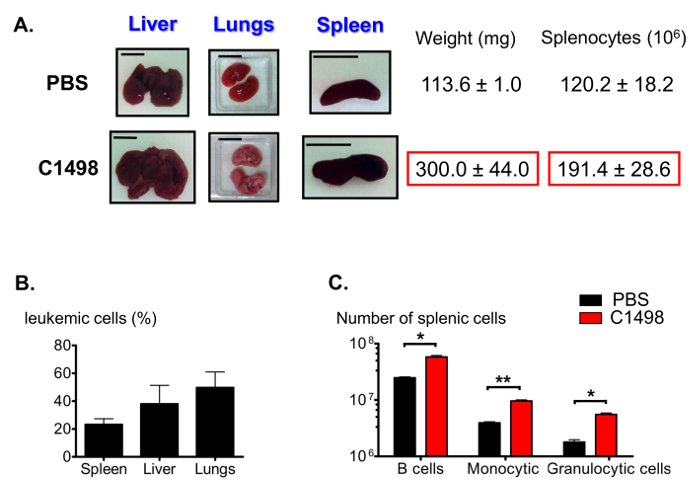
Рисунок 7. Оценка селезеночной популяций в лейкозных и контрольных мышей. (A) Характерные фотографии печени, легких и селезенки припухлость в лейкозных мышей по сравнению с контрольными мышами. Селезенки собирали и взвешивали, и спленоцитов были подсчитаны следующие разрушение ткани. (В) Гистограмма представляющих лейкозных клеточных частот в Diffпосле того, как органы различны иммунное проводили в течение CD45.2 + клеток , и результаты были проанализированы с помощью проточной цитометрии. (С) Оценки селезеночной B, гранулоцитарного и моноцитарного числа клеток после иммунологического окрашивания и проточной цитометрии анализа стробирования были выполнены , чтобы определить живой CD19 + B220 + , CD3 - CD11b + Ly6G +, CD3 - CD11b + Ly6C - и CD3 - CD11b + Ly6C высокие клетки. Масштабные бары показаны для легких, селезенке и печени указывают на 1 см. .. п = 5 - 8 мышей / группу, и данные представлены в виде гистограммы как среднее значение ± SEM *, р <0,05; **, p = 0,0033, t - тест непарный Студенческая сравнивая и C1498 PBS - инъецированных мышей Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Тип клетки | Мембрана или внутриклеточные молекулы |
| Предшественники и зрелые клетки | |
| NK-клетки | NK1.1 +, пан-NK + |
| НКТ-клеток | NK1.1 +, пан-NK +, TCR Vbeta + (8.2), CD3 + |
| Т-лимфоциты | ТКС Vbeta +, CD3 +, CD4 +, CD8 +, |
| В-клетки предшественники и В-лимфоциты | В220 +, CD19 +, CD21 / 35 + |
| гранулоцитов предшественники и гранулоциты | Ly6G +, Mac-1 +, CD11b + |
| моноцитов предшественники и моноциты / макрофаги | CD11b +, Mac-1 +, Mac-3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| Предшественники | |
| мультипотентных клетки-предшественники | CD117 + Sca-1+ CD34 + (лингвист CD150-) |
| лимфоидных загрунтованных клетки-предшественники мультипотентными | CD117hi Sca-1hi CD127 + (лингвист) |
| общие лимфоидные клетки-предшественники | CD117lo Sca-1LO CD127 + (лингвист) |
| общие миелоидные клетки-предшественники | CD16 / 32lo CD117 + CD34int (лингвист Sca-1-) |
| гранулоцитов-макрофагов клетки-предшественники | CD16 / 32hi CD117 + CD34hi (лингвист Sca-1-) |
| мегакариоцитов-эритроидных клеток-предшественников | CD16 / 32lo CD117 + CD34lo (лингвист Sca-1-) |
| Гемопоэтические стволовые клетки | CD117 + Sca-1 + CD150 + (лингвист CD34-) |
Таблица 1. Маркеры кроветворной клетки родословных и дифференцировку.
CD: кластер дифференцировки; Лин: маркеры зрелых клеток; Lo:низкая экспрессия; привет: высокая экспрессия; INT: промежуточное выражение; NK: естественные клетки-киллеры; TCR: Т-клеточного рецептора.
Обсуждение
В предыдущих исследованиях C1498 линия клеток была описана как индуктор острого гранулоцитарного 5, миеломоноцитарным 6 или НКТ 7 клеток лейкемии. Тем не менее, показательные данные в литературе были либо отсутствуют, либо неполна. Протокол, представленные здесь, используются различные методы, такие как проточной цитометрии, иммунофлюоресценции, МГГ окрашивания и цитохимических анализов для характеристики культивируемых клеток C1498 и определить характер лейкоза, индуцированный у мышей после их вводят.
Когда мы phenotyped в пробирке культивировали C1498 клеток после иммунным окрашиванием и проточной цитометрии проводили анализы, мы наблюдали некоторые ограничения , так как эти клетки экспрессируют несколько маркеров гемопоэтических клеточной поверхности , которые были ранее описаны в литературе , 6,7. В соответствии с нашими результатами, Лабелль и др. Не наблюдали экспрессию клеточной поверхности зрелого TCR на C1498 клеток с использованием cytomet потокачень окрашивание. Тем не менее, они считали их быть НКТ клеточную линию после того, как они обнаружили CD3ε и TCRVβ8.2 7 мРНК. Мы также наблюдали внутриклеточной экспрессии TCRVβ цепей и молекул CD3ε в большинстве клеток (> 70%), но их гематопоэтических клонов не может быть определено, потому что было также сопутствующее внутриклеточную экспрессию молекулы MAC-3.
Миелопероксидазы, МГГ окрашивание и оценки для анализа функциональных эстеразы с использованием ЦИТОХИМИЯ показал, что C1498 клеточная линия имела миелоидного происхождения и состоит из монобласт и миелобластов. Эти результаты были согласные с процентом MAC-3 + клетки , которые были получены в проточной цитометрии анализа окрашивание. Хотя это и не количественное, эти шаги представляют собой ключевые эксперименты, которые будут выполнены. На самом деле, они остаются, до сих пор, наилучшие существующие методы, характеризующие происхождение и степень дифференцировки гемопоэтических клеток, которые выражают отсутствие или пРЭБ специфические маркеры фенотипические.
Проточная цитометрия окрашивания было полезно для демонстрации развития острой лейкемии у мышей после конгенных C1498 клетки внутривенно вводили. В CD45.2 + C1498 клетки , которые проникали в периферической крови и различных органах были изолированы, и были определены их частоты. Количественное также была проведена для анализа присущей медуллярной и клеток селезенки после иммунофенотипирования. Ограничения были обнаружены , когда фенотип C1498 клеток исследовали в органах , как они выражены несколько гемопоэтических маркеров (лишь немногие из них были B220 +). Для того, чтобы определить характер наблюдаемого острого лейкоза, май-Грюнвальд Giemsa окрашивания и анализ деятельности моноцитов и гранулоцитов эстераз проводили с использованием костного мозга. Результаты показали, что C1498 клетки сохранили свою миелобластный и монобластный морфологии и функции, открывая начало миеломоноцитцарный лейкемии.
При рассмотрении для критических шагов, описанных в данном протоколе, особое внимание следует уделить рН при выполнении цитохимических реакций и МГГ окрашивания, так как ошибки в рН может привести к неверной интерпретации результатов. Например, α-нафтил бутират эстеразы активность специфично для моноцитов только при рН 6,0, так как гранулоциты и лимфоциты также могут испачкать положительным для этого испытания при более высоких значениях рН. Фиксируете клетки не рекомендуется перед проведением МГГ окрашивания, и мы показали, что только при условии фиксации CAF удовлетворительные результаты при выполнении эстераз цитохимических реакций с использованием C1498 клеток. Чтобы сохранить экспрессию молекулы CD115 и его обнаружение с помощью проточной цитометрии, как все образцы (например, кровь, костный мозг, и клетки селезенки) должны храниться на льду во время процедуры. Если нет окрашивания не наблюдается в проточной цитометрии или / и экспериментов иммунофлюоресценции, ссылки антител, их хранение повторнопохвал и их разведения должны быть проверены. Ссылки, указанные в таблице материалы / оборудование были выбраны для проточной цитометрии или иммунофлюоресценции приложений. Первичные / вторичные антитела или их сопряженными флуорофоры , возможно, потеряли свою активность из - за неправильного хранения (например, воздействием света или тепла), неправильного разбавления, обширные замораживания / оттаивания или использование загрязненных буферов. Запуск положительного контроля, чтобы убедиться, что они работают должным образом. С помощью мыши костного мозга или селезенки полученных клеток, которые, как известно, экспрессировать белки, представляющие интерес. Для того, чтобы избежать высокого фона и неспецифическое окрашивание, убедитесь, что клетки промывают должным образом и выдерживают при высокой влажности (для иммунофлуоресценции) и что антитела разводят в соответствии с инструкцией. С помощью той же концентрации и разбавления для контроля изотипа антитела и первичного антитела, чтобы точно определить уровень фона в образце. Для эстеразы ЦИТОХИМИЯ экспериментовРеагенты могут быть протестированы с помощью положительных и отрицательных слайдов управления , содержащие очищенный мыши селезеночной гранулоцитарного (Ly6G +) и моноцитарного (+ CD115) клеток.
Процедура , описанная в данном исследовании показали , что многие из лейкозных особенностей , наблюдаемых у мышей после инъекции C1498 клеток имеют общие признаки с человеческим острым лейкозом миеломоноцитцарный 11,12. Инфильтрации лейкозных клеток приводит к уменьшению зрелых и незрелых клеток-предшественников (прекурсоров) и сердцевинные кроветворных клеток. C1498 клетки присутствуют на высокой частоте (> 20%) в периферической крови, как и моноцитов. Гепатомегалии и спленомегалии наблюдались в результате инфильтрации лейкозных клеток, а также наблюдали значительное увеличение В-лимфоцитов и миелоидных клеток, чтобы сопровождать спленомегалии. Тромбопения также наблюдалось, когда количество тромбоцитов в крови были оценены с использованием гематологического анализатора.
Это было шоуп, используя в экспериментах пробирке, что C1498 клетки подавляют нормальную мышиную кроветворение секрецией растворимых факторов 13. В некоторых моделях опухолей мышей, незрелых миелоидных клеток ( в том числе моноцитов и гранулоцитов), также было показано , чтобы мигрировать из костного мозга в селезенке, где они ингибируют противоопухолевый специфической активации Т - клеток и пролиферацию 14. Таким образом, снижение кроветворных клеток, которые наблюдали в костном мозге может быть результатом либо недостатка в кроветворении, и / или из их эмиграции. Этот последний механизм мог бы объяснить наличие моноцитоз в периферической крови или наблюдение за увеличенных миелоидных фракций в селезенке. Можно также предположить, что эти клетки могут быть получены из улучшенной селезеночного кроветворения. Действительно, в стационарных условиях, некоторые подмножества селезеночных В - клеток были идентифицированы как предшественники зрелых В - лимфоцитов 15. Кроме того, при воспалительных состояниях, медullary стволовых и предшественниках клеток было показано , переместить в селезенке , чтобы индуцировать образование зрелых моноцитов 16. Этот протокол не позволяет сделать выводы относительно механизмов, которые участвуют в развитии лейкемии, а также дополнительные функциональные, а также молекулярные анализы должны быть использованы, чтобы сделать это. Тем не менее, эти данные включают в себя подробную информацию о клинических признаках острой лейкемии миеломоноцитцарный и поможет исследователям оценить и понять последствия новых терапевтических агентов.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
Материалы
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Ссылки
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены