Method Article
mikroakışkan Probe ile Canlı Hücre Katmanlar hızlı Subtractive Desenlendirme
Bu Makalede
Özet
We present a protocol to perform subtractive patterning of live cell monolayers on a surface. This is achieved by local and selective lysis of adherent cells using a microfluidic probe (MFP). The cell lysate retrieved from local regions can be used for downstream analysis, enabling molecular profiling studies.
Özet
mikroakışkan prob (MFP) sıvıların nanoliter hacimleri hapsederek biyolojik yüzeylerde lokal kimya performans kolaylaştırır. MFP hiyerarşik hidrodinamik akış hapsi (hHFC) arasında belirli bir uygulama kullanılarak, çok sayıda sıvı aynı zamanda bir alt-tabaka ile temas halinde getirilir. hHFC kullanarak yerel kimyasal eylem ve sıvı şekillendirme, yerel parçalama ve hücreleri ortadan kaldırarak hücre desenleri oluşturmak için yararlanılır. MFP tarama yeteneği kullanarak, hücre mono tabakaları kullanıcı tanımlı desenler oluşturulur. Bu protokol, hızlı, gerçek zamanlı ve seçici hücre-hücre ve hücre-matriks etkileşimi çalışmaları izin verebilir mekansal kontrollü hücre desenlendirme, sağlar.
Giriş
onların doğal ortamında, biyolojik dokularda hücrelerin büyüme, organizasyon ve gelişimini yönlendiren biyokimyasal ve fiziksel ipuçları bir dizi algılarlar. Bu işaretler anlama hücre-hücre ve hücre-matris etkileşimlerinin incelenmesinde seçici gerektirir. Bu desenlendirme hücre tek tabakalarında yöntemleri geliştirilmesini gerekli kılmaktadır. Yöntemler kültürü (desenleme) 'de geometrik ayrı farklı hücre tipleri, hücre biyolojisi fiziksel ve kimyasal ipuçları geniş çalışmalar etkinleştirin. Desenlendirme hücre katmanları güncel yaklaşımların çoğu 1-4 yüzeylerde hücre yapışma proteinleri yatırma veya yüzeylere seçici büyüme için microfabricated kalıpları kullanarak bağlıdır. Buna karşılık, burada tek tabaka seçilmiş bölgelerde hücreleri ortadan kaldırarak, kültürde hızla desen hücre yani yerinde mono tabakaları, hücreler bir yöntem mevcut. 9 usua - böyle Eksiltici desenlendirme 5 gerçekleştirmek YöntemlerLly yanlışlıkla canlı hücreleri etkileyen bir lazer kullanarak özel yüzeyler, yüzey işleme, karmaşık bir işlemdir, fiziksel temas veya ablasyon gerektirir. Burada mikro-akışkan prob (MFP) 10,11, hidrodinamik bir alt-tabaka üzerinde bir sıvı sınırlayan bir temassız tarama mikroakışkan teknolojiyi kullanır. MFP önemli bir bileşeni mikrokanalların içeren microfabricated kafa (Şekil 1). Ilişkili bir platform kontrol ve görselleştirme ve geribildirim (Şekil 2) için ters bir mikroskop taranması için enjektör sıvı kontrolü için pompa, aşamadan oluşmaktadır. Temel konfigürasyonunda, MFP kafası ile bir işleyici sıvı ve bazı daldırma sıvısı (Şekil 3A) ile birlikte enjekte işleme sıvısının emilmesi için diğer enjekte edilmesi için apekste açıklıklar, iki mikro kanallar, birini içerir. MFP işlemi sırasında, apeks alt-tabaka sabit bir mesafede yer almaktadır. Ne zaman aspirasyon debisi (Qa) sufficie olduğunuörneğin, enjeksiyon akış hızı (Q I), den diğer yönden başkaları baskın yüksek Q: içerisinde Q, ≥ 2.5, işlem bir sıvı alt tabaka üzerinde sınırlandırılmıştır. Bu hidrodinamik akış hapsi (HFC) ile sonuçlanır. işlem, sıvı alt-tabaka ile doğrudan temas halinde olan bölge ayak izi olarak adlandırılır. Tipik çalışma koşulları için, HFC içinde işleme sıvının akış düşük Reynolds sayısı ile karakterize edilir (≈ 10 -2 Re) ve yüksek Péclet numarası (Pe ≈ 10 2). Bu konveksiyon kimyasal türlerin kütle transferi primer modu olmak laminer rejimde sıvı akışlarını ifade eder. 14 - Akış hapsi için sayısal ve analitik modeller başka bir yerde 12 tarif edilmiştir.
Bu yazıda, hiyerarşik HFC (hHFC) 14 denir aynı anda hapsetmesi çoklu işlem sıvıların yaklaşımını kullanır. MFP ile hHFC uygulamak için, iki additional açıklıkları enjeksiyon ve aspirasyon ikincil kaynağı sağlamak için gereklidir. Bu, ikinci bir sıvı içinde bir sıvı sınırlandırmak için bize sağlar. , iç (işleme) sıvı faydaları dış (perdeleme) sıvı ile tabaka üzerinde başıboş enkaz korunmalı edilir. Buna ek olarak, hHFC iki mod işlemi sağlar: (i) iç içe mod, burada iç HFC temas yüzeyi (Şekil 3B), ve (ii) sıkışması mod, burada iç taraftaki sıvı kaybeder işlem sıvı temas ve yalnızca dıştaki sıvı alt-tabaka (Şekil 3C) ile temas halindedir. Iki mod arasında geçiş kullanıcılar etkileyecek veya alt tabakayı işleme durdurmak için izin verir ve baş-yüzey boşluğu kontrol ederek ya da enjeksiyon akışları arasındaki oranı (Q i2 / Q i1) değiştirerek elde edilir. Belirli bir kanal geometrisi için, alt-tabaka üzerinde işlem sıvısının izi akış koşulları (Şekil 3D) düzenlenmesiyle kontrol edilebilmektedir. sodyum hydroksit (NaOH) hücreleri lize etmek için bir iç işleme sıvısı olarak kullanılır, ve lizat sürekli yüzey aspire edilir. işleme sıvısının kimyasal etkileri, iç HFC kaplayan lokalize olduğundan, komşu hücreler, hücre-hücre etkileşimleri uzaysal çalışmaları sağlayan, soğukkanlı kalır. MFP tarama işlevselliği hücre modellerinin kullanıcı tanımlı geometriler (Şekil 4) oluşturulmasını sağlar. Bundan başka, işlem bir sıvı olarak NaOH seçimi alt DNA analizi (Şekil 7) barındırır.
Protokol
1. MFP Kafa ve Platform Temizleme ve Hazırlama
NOT: Bu protokol MFP 15,16 kafaları dikey yönelimli silikon-cam melez kullanır. kafa silikon bileşeni 100 um derinliğe kadar kazınmış olan mikro kanallar, içerir. kazınmış silikon anodik bağlama ile cama yapıştırılır. Kanal tasarım daldırma sıvı (Şekil 1) enjekte etmek için altı kanal, enjeksiyon ve aspirasyon için iki her iki kapsayan bir modeli ihtiva etmektedir. daldırma sıvısı enjekte etmek için kullanılan kanallar medya böylece nedeniyle aspirasyon ve buharlaşma kayıpları kaçınarak, biyolojik numune çevreleyen doldurmak. iç kanallar ve mevcut işlerinde kullanılan dış kanallar 100 × 100 mm ve sırasıyla 200 × 100 mikron bulunmaktadır. Mesaj imalat ve işleme, açık kanallar ve cilalı apexes ile MFP kafaları elde edilir.
- Pompa istasyonunun hazırlanması ve sıvı kullanımcihaz
- şırınga bağlı tüm boru donanımları için 1/16 '' (1.59 mm), dış çap ve 0.02 '(0.51 mm) iç çapı ile kılcal kullanın. uygulamaya göre kılcal boyutu değişir ve şırınga ile MFP kafasını arayüz uygun konnektörleri ve bağlantı parçaları edinin. seyreltmeler gerekli yerde ultra saf su kullanın.
- Temiz şırıngalar (250-500 ul hacmi) ve şırınga saf su önce to- içinde% 0.5 çamaşır suyu çözeltisi içinde sonikasyon ile pistonlara ve canlı hücre deneyleri kaymalı. suyla iyice durulayın. Bir su banyosu içinde tamamen kendi ipuçları çeker ve piston ile aspire su ile doldurun. ise şırınganın çıkışında mühür temas şırınga mili ile su banyosu içinde sıvı temizleyin. hiçbir hava kabarcığı kadar tekrarlayın aspirat ve tasfiye şırınga sütunlarda görülür.
- Luer-lock konnektörler kullanılarak şırınga pompaları dolu şırınga bağlayın. üzerine monte edilmiş bir anahtar vana kullanınPompalar (Şekil 6), MFP kafasına veya sıvı rezervuar ya giden iki kılcal bir şırınga sıvıyı doğrudan. (Anahtar yok vanası varsa bölüm 1.4.4 bakınız). Suyun yaklaşık 10 ul şırınga kalan kadar şırınga büyüklüğüne bağlı olarak, 50 ul / dk - 10 arasında bir akış hızında şırıngalardan su ile iki kılcal temizleyin.
- (- Malzemeleri görmek, örneğin, M1 konnektör) baş kanal yolların ile arayüzleri uygun bir mikroakışkan konnektör / adaptörüne temizlendi kılcal ön takın.
- MFP kafa hazırlığı
- 5 dakika boyunca, katı temizlik için standart temizleme veya% 0.5 ağartıcı bir cam deterjanla sonikasyonla MFP kafasını temizleyin. Suda apeks çeker ve yolların vakum uygulanarak, su ile kanal temizleyin.
- Potansiyel engel (tıkanma) ve yeniden bir stereomikroskop altında kanalları inceleyinönceki adımı gerekirse turba.
- Kafa tutucu temiz kafa monte ve baş üzerine önceden yerleştirilen ve tasfiye boru ile konnektör vida. baş ve hücre tek tabaka arasındaki boşluk mesafesi kontrolü için kullanılan Z-evre, baş tutucu vida.
- MFP platformunun tarama aşamalarını kalibrasyonu
- Uygun bir yazılım arayüzü ile üreticinin protokolüne göre, platforma baş bağlamadan önce X, Y ve Z-aşamalarının son nokta kalibrasyonunu gerçekleştirin. Kalibre aşamaları MFP kafa konumlandırma doğruluğunu sağlamak.
- hücreleri olmadan bir oda slayt üzerinde MFP kafa getirerek (sıfırlama) bir ham sıfır boşluk mesafesini elde etmek ve yavaş yavaş 5 mikron adımda inerler. alt-tabaka ile prob temas ettiği zaman, Newton halkaları dikkat edilmelidir. Bu ham tahmindir. Doğru pozisyon substrat prob apeks coplanarity ayarladıktan sonra elde edilecek olane.
- Prob apeksin coplanarity sağlamak için, (başın arayüzü ve Z'nin aşaması), bir gonyometre ile baş eğimini ayarlar. Oluştuğunda Newton halkaları simetrik (Şekil 1) olduğundan emin olun. alt tabakadan uzak MFP kafa 20 um Taşı ve gonyometre kullanılarak eğimini ayarlayın. Newton'un halkaları yineleyerek iniş, sıfırlama ve eğim ayarlama temas simetriktir. tilt ayarlanabilir ile, sıfır olarak simetrik Newton halkaları üretir z konumunu ayarlayın.
NOT: XY substrat tarama (Şekil 2) kontrol oysa Z-aşamalı, head-to-substrat mesafeyi kontrol eder. Ayrıntılı bir açıklama daha önceki çalışmalarında 14 bulunabilir.
- Hücre tabakalarının yerel çıkarma için kimyasal müstahzarlar
Dikkat: Uygun durumlarda, kullanım güvenlik ekipmanları (örneğin nitril eldiven, koruyucu gözlük) kimyasallar için hazırlanmaktadır. Bir duman hoo kullanınd çözümleri hazırlamak için gerekirse. seyreltici olarak saf su ile tüm kimyasalları ve tamponlar hazırlayın.- (Şekil 1 'de akımı Q I2 ile I2), iç enjeksiyon kanalı için işlem sıvısı olarak 50 mM NaOH solüsyonu hazırlayın.
- 1 mM etilendiamintetraasetik asit (EDTA),% 0.5 Tween 20 oluşmaktadır (Şekil 1 'de akımı Q I1 ile I1), dış enjeksiyon için gerekli ekstraksiyon tampon çözeltisi hazırlayın ve 10 uM rodamin B, 50 mM tris (hidroksimetil) aminometan olarak bölgesindeki tasfiye için pH 8, aspirasyon şırıngalar içinde su kullanın.
- 0.2 mikron şırınga filtresi kullanılarak tüm çözümleri filtre. Gazını çözündürüldü hava stop yüzeyine kabarcıklar kadar bir kurutucu kullanarak tüm filtre çözümler.
- şırınga pompaları bağlı tahliye hattı kullanarak, kalan su tasfiye ve şırıngalar (250 veya 500 ul) kadar dolu 40 ul / dk enjeksiyon şırınga içine gazı alınmış çözümler aspire.Bu şırıngalar, konektörler ve kılcal damarların balon ücretsiz dolum sağlar. şırınga anahtarı valf iki kılcal sistem şırınga orta deney doldurulmasını sağlar. Böyle bir anahtar valf yokluğunda, baş kısmından itibaren kılcal ayırın ve baş bunları yeniden bağlanmadan önce gazı alınmış solüsyonlar aspire kılcal ve şırınga doldurun.
- işlem aspirasyon ve kılcal sıvıların koruma işlemi sırasında küçük hacimlerde kullanılması içindir. kimyasal büyük hacimlerde hazırlanabilir ise, doğrudan gerekli çözümler ile şırınga doldurun. Örneğin, su içeren aspirasyon iğneleri Bu yaklaşım kullanılarak doldurulabilir.
- 1.4.1 ve 1.4.2 tanımlanan her bir kanal için ayrılan sıvı MFP kafasına kılcal temizleyin.
NOT: ekstraksiyon tampon çözeltisi iç lohusalık ve tamponda rodamin bileşeni NaOH kalkanlar th görüntülenmesini kolaylaştırırÇalışma sırasında hHFC e. - hücreler, hücre agrega kültür yüzeyinde görünen ile aşırı konfluent iseniz, bu lizat aspirasyon kanalları girdiğinde denatüre proteinler çözerek bu agrega NaOH eylemi tamamlayan 10% Proteinaz K. ile ekstraksiyon tamponu tamamlar. Bu işlem sırasında kanalların tıkanmasını engeller.
- Odacıklı slaytlar üzerinde hücre mono tabakaları hazırlanması
Dikkat: hücrelerin kültürlenmesi için bir hücre kültürü kaputu kullanın ve laboratuar biyogüvenlik görevlisi tarafından belirlenen düzenlemelere uygun olarak donanım işlemek. Spesifik hücre hatlarının özel gereksinimleri Not ve buna göre protokol ve ekipman uyum.- Kültür ve hücrelerin genişlemesi için kullanın hücre kültürü inkübatör (% 5 CO 2 ve 37 ºC'de) desenli edilecek. T şişelerinde standart hücre kültürü protokolleri 17,18 kullanarak genişleme gerçekleştirin. Belirli cel ihtiyaçlarına göre kültürleme ortamı kullanınl hattı (örneğin, serum ve antibiyotik MCF7 ve MDAMB 231 kültürleme için DMEM desteklenmiş).
- Kültür şişelerinde hücre izdiham ulaşan, trypsinize ve hücreleri ve tohum 2 x 10 5 hücre 48 saat boyunca desen ve kültürü için 2 odacıklı slaytlar her / cm2 toplamak. hücre büyümesi ve canlılığı için bir kontrol olarak bölmelerin birinde hücreleri kullanır.
- Oda slaytlar üzerinde hücre kaynaşmaya eriştikten üzerinde, 500 ul hücre izleyici boya çözeltisi ile 45 dakika inkübe hücreleri (örneğin, yeşil - CMRA - CMFDA veya turuncu) serumsuz ortam içinde hazırlanmış olan 10 uM konsantrasyonda. Bu desen sırasında hücre görünüm için yapılır. hafifçe bir pipet kullanarak her odasına kızarma ve desenlendirme deneyleri için serum takviye medyada sonradan kültür hücreleri tarafından PBS ile etiketlenmiş hücreleri yıkayın.
- hücre sayımı amacıyla hücre izci lekeli hücre yüzeyinde bir referans görüntü elde. Bunu sağlamak için yapılırhücre tabakasının birbirine karışmaya. Buna ek olarak, bu örnek kurtarma ve DNA analizi hedefleri ise ölçümü deneyleri için bir yardımcı olarak hizmet vermektedir.
NOT: hücre canlılığı desen sırasında değerlendirilecek olması durumunda, hücreler üreticinin talimatlarına uygun olarak bir Live / Dead sitotoksisite kiti ile boyanmış olabilir.
2. Oluşturma Hiyerarşik Hidrodinamik Akış Confinement (hHFC)
- Cam slayt 50 mikron boşluk mesafesi hücre tek tabaka üzerine MFP'yi taşıyın. hHFC temas sağlarken Bu boşluk mesafesi de tek tabaka yüzeyi ve kalınlık değişiminin oluşturmaktadır.
- i2 ile min / 6 veya 8 ul NaOH enjekte edilir. Diğer akış oranlarını değerlendirmek (yani, Q I1, Q A1 ve Q A2) Şekil 3'te akış kurallarını kullanarak.
- Enjeksiyon şırıngalar kullanılarak Q I2 / Q I1 oranını değiştirerek iç HFC boyutunu modüle eder.300 hücre - Örneğin, 150 NaOH kaplayan sonuçlanan 8 ul / dk sabit S I2 ile 1.3 ul / dk ve 4 ul / dk arasında bir S I1 kullanımı (100-200 mikron 2 / hücre) ( Şekil 3D).
- hHFC çalışması sırasında ortam ve aspirasyon buharlaşmanın hesaba 20 ul / dk'lık bir akış oranında, MFP kafasına en dış açıklıklardan tam orta enjekte edilir.
hHFC kullanılması 3. Desen hücre tekli katmanlarına
Not: Tarama deseni, belirli biyolojik soruları incelemek için kalan hücreleri bırakarak hücreler ayıklanır hücre tek tabaka (eksiltme desenlendirme) alanları belirler. Bu model, örneğin, düz çizgiler veya noktalar halindeki düzeni olabilir. Karmaşık desenler, uygun bir tarama yörüngesinin tasarım gerektirir. Örneğin, bir kareli tarama yörünge Şekil 4A, örneğin gösterilen hücre alanlarında ızgara (içerir ), yakın olurken farklı meydanlarda hücreler üzerinde farklı uyaranların etkisini incelemek sağlayacak olan. Bu modeller kontrol yazılımı hücre tek tabaka üzerinde MFP kafa tarama yörüngeleri komut dosyalarına izin veren bir platform, XY aşamalarında kontrol kullanılarak oluşturulabilir.
- 50 um arasında bir boşluk mesafesi 10 mm / s'lik bir tarama hızında (X, Y ve Z koordinatlarını belirleyerek), kullanıcı tanımlı desen hücre tek üzerinde sondaj kafası tarama aşaması yazılımı ayarlayın.
- İç içe hHFC işlemi ve tek tabaka ile temas halinde olan, desenli hücre çıkarılmasını sağlamak için arzu edilen modelin bir yörünge ile MFP tarar.
- İlk hücre tipi çıkarıldıktan sonra, bir ko-kültür için, bölüm 1.5'de tarif edilen yöntemler kullanılarak, boşlukları doldurmak için farklı bir hücre hattı tohum. Hücre kaldırma kontrol etmek için (örneğin, boşluk mesafesini artırarak) iç içe ve sıkışmak modlar arasında taşıyın.
NOT: Tarama hızı da inceledik olmak zorunda kalabilirsinizDiğer hücre çizgileri için kapı. kullanılan hücre hatları için taranan bölgeler üzerinde bu gösteri etkileri tam hücre çıkartılmasında kullanılan tarama hızı.
Örnekleme ve DNA Amplifikasyon 4. Alt İşleme
- lizat aşağı analizleri için numune alma istasyonu hazırlayın. Örnekleme istasyonu için, 3D 8-şerit PCR tüp tutucu baskılı kullanın. Alternatif olarak, alt tabakanın dışında kafa tarama aralığında monte edilebilen bu adaptör olarak hizmet verecek uygun bir tüp tutucu seçin. % 70 etanol ya da uygulama için istenen sertlik dayalı diğer yüzey dekontaminasyonlara tüp tutucu silin. substrat tutucu üzerine takmak için tüp tutucu üzerindeki manyetik klibi kullanın.
- örnekleme istasyonu hazırladıktan sonra, tek tabaka MFP kafası 100 mikron yerleştirin. 1 akış hızı, 6 iç enjeksiyon kanalı için işlem sıvısı olarak 50 mM NaOH çözeltisi ile hHFC işletim başlayın, -7 Ve -17,5 ul / sırasıyla S I1 Q I2 Q, A1 ve Q A2 dak.
- Akış sınırlayıcı (yaklaşık 10 saniye içinde) stabilize edildikten sonra hHFC hücrelerin seçilen alt nüfusun NaOH dayalı yerel lizizi gerçekleştirmek için 50 um arasında bir boşluk mesafesi sondaj kafası inerler. alt nüfusun lizis tamamlandı (ayak izi başına yaklaşık 30 sn) sonra, örnekleme istasyonunda tüpler doğru başını yönlendirin. PCR tüplerine toplanır lizat çıkarma doğrudan (Şekil 6).
- Lizat sonraki işlem, ilk Tris tamponu (1: 1) ile lisat karıştırılarak çözeltinin pH nötralize eder. Nötralize edilmesinden sonra, 30 dakika boyunca 95 ° C lizat ısıtın. Cihazın tedarikçisi tarafından belirlenen daha sonra doğrudan standart bir qPCR iş akışına lizat yükleyin.
Sonuçlar
Hücre mono tabakaları hızlı eksiltici desen için kullanılan protokol (Şekil 1 ve 2), bir çok bileşenli MFP platformu kullanılarak gösterilmiştir. Yerel tedavi ve işleme sıvısı olarak NaOH kullanılarak, hücre mono tabakaları hücreleri çıkarmak için (Şekil 3 hHFC) protokolü hiyerarşik hidrodinamik akış hapsi kullanır. hHFC yapılandırması, bir iç ve bir dış HFC HFC içerir. İç hHFC hapsedilmiş NaOH temas hücreleri üzerinde kimyasal eylem ve kesme tanıttı. Bu ayak izi içinde, hücreler homojen içinde ve lohusalık dışında bölgeye önemsiz difüzyon ile konveksiyon tahrik kütle transferi nedeniyle, NaOH kimyasal etkisine maruz kalmaktadır. Öte yandan hücreleri üzerinde kesilme, NaOH akış hızı değiştirilerek değiştirilebilir. Operasyonel parametreleri basitleştirmek için, biz kesme kıyasla kimyasal aksiyon hücre çıkarılması baskın mekanizma yapmayı tercih etmiştir. içinyüzeyde hHFC tarafından uygulanan kesme kuvveti tahmin sonlu eleman modeli Comsol Multiphysics 5.0 kullanılarak inşa edildi. Simülasyonlar laminer akışlar için CFD modülü kullanılarak yürütüldü. Enjeksiyon geometrisinin açıklıklar ve aspirasyon açıklıklanna iki çıkış sınır koşulları (Şekil 5), iki giriş sınır koşulları mevcut tasvirde kullanılan akış oranları ve açıklık boyutları aralığı için uygulanmıştır. debileri yüzeyde kesme büyüklüğünü tanımlanan oysa elde edilen modelde, akış kuralları, kesme profili dikte. hHFC temas eden yüzey ise pratik olarak, her ikisi de bir arada tespit eder. Akılda bu faktörler tutmak, biz kimyasal baskın hücre kaldırma elde etmek amacıyla operasyon için akış oranlarının bir dizi bulmak için yola çıktı. Bir hHFC oluşturmak için, biz 3.5 enjeksiyon debisi oranı toplam aspirasyon akış kuralı kullanın. kullanılan diğer akış kuralları aspirasyon kanalları içinde tıkanma en aza indirmek için tanımlanmıştır,hangi kanalı yüzeylere yapışmasını denatüre proteinlerin neden olabilir. Gelişmiş modeli kullanarak, 1 ve 3 N / m2 arasında bir kesme stresi 5 ile 10 ul / dk akış hızında çeviri bulundu. NaOH kimyasal etki olmadan, ekstraksiyon tamponu durumunda, örneğin, kayma gerilimi hücreleri 19 kaldırmak için yeterince yüksek değildir. Gözlenen aralığında, daha yüksek akış hızlarında bu işlemi nedeniyle kanallarda hücre artıkları düşük aspirasyon akış oranları (yani, Q, I2 <4 ul / dk), akış yolu içinde düzensizlikler nedeniyle daha pratik edin.
Çalışılan kesme profili ve pratik sorunlar, 6 ve 8 ul / dak NaOH akış hızını (Q I2) göz önüne alındığında desen deneyleri ve Şekil 3'te gösterilen akış kurallarına göre Q I1 Q A1 ve Q A2 kullanılmaktadır. Oranının enjeksiyon akımlarının (Q I2 / Q I1) u veriyors fazla Autebert ve ark., 14 tarafından ortaya yatan ilke, hHFC ayak izi (Şekil 3B ve Şekil 4B) boyutunu modüle etmek. MFP platformunun yüksek çözünürlüklü tarama yeteneği ile birleştiğinde hHFC sıvı şekillendirme yeteneğini kullanarak, birden fazla ölçeklerde canlı hücre ızgara nesil göstermek ve ayrıca eş-kültürleri (Şekil 4C) gelişmekte verilen protokolün uygulanmasını göstermektedir.
Platform ayrıca bize aşağı analiz için örnek lizat alımı gerçekleştirmek için olanak sağlar. Elde edilen lizat kalitesini göstermek için, yerel olarak lizat (Şekil 7) elde edilen DNA miktarlarda değişimini gösteren iki bağımsız deneyin bir beş ayak hücreleri lize örneklenmiş. GGATGCAGAAGGAGATCACT ve ters: Burada, DNA ileri (β-aktin primerler kullanılarak lizat bulunan yükseltildi CGATCCACACGGAGTACTTG ) Her PCR nötralize lizat 4 ul kullanılmıştır.
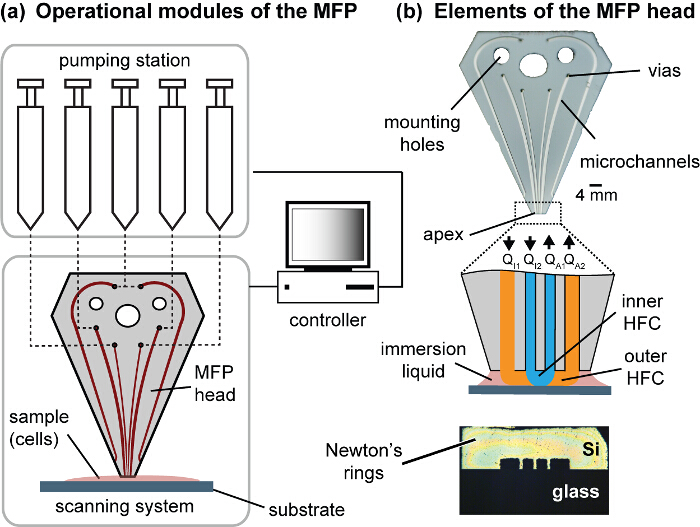
MFP platformu ve baş Şekil 1. Modüller. (A) platformu operasyonel modülleri şırıngalar, motorlu aşamaları ve bir kontrolör motorlu içermektedir. MFP baş ve alt-tabaka arasındaki boşluk mesafesi kontrol etmek için bir motorlu Z-aşamasına bağlıdır ve alt-tabaka tutucu X ve tarama sistemini oluşturan Y motorlu aşamaları bağlanır. Cilalı tepe çıkar MFP kafa Z-sahneye kafa monte etmek montaj delikleri pompalama istasyonunu bağlamak için akışkan VIAS vardır (B) ve kanallar. tepe hücre kültür alt-tabaka, ortak düzlemli ayarlanır. apeks ve yüzey ortak düzlemli ve temas olduğunda simetrik Newton halkaları görülebilir. p_upload / 54447 / 54447fig1large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
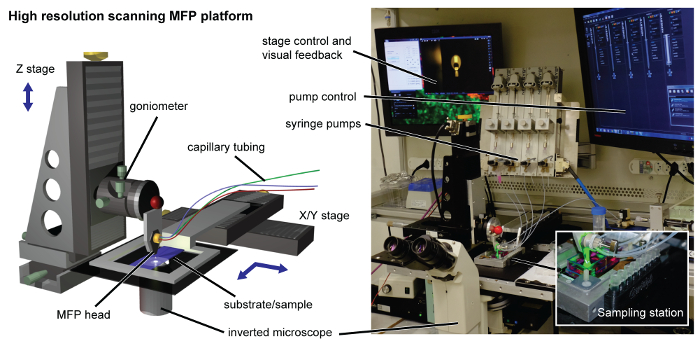
Şekil 2. MFP platformu. Yüksek çözünürlüklü tarama platformu işlenmiş kafa tutucu yüksek hassasiyetli motorlu Z-evre ile arabirim ile donatılmıştır. Alt tabaka tutucu amaçlı tarama için XY sahneye bağlanır. alt analiz için lizat elde edilmesi için, 3 boyutlu bir baskılı numune istasyonu (ust ilavesinde gösterilen) alt-tabaka tutucunun yanına manyetik kırpılır. Şırınga pompalar, ters mikroskop, kontrolörler ve görüntüler platformu çevresinde bulunmaktadır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
3 "src =" / files / ftp_upload / 54447 / 54447fig3.jpg "/>
Hücre kaldırma mekansal ve zamansal kontrol için Şekil 3. Hiyerarşik hidrodinamik akış hapsi (hHFC). (A) tek bir HFC şematik. (B) iç içe hHFC işlem (C) sıkışmasını modu. İki farklı enjeksiyon / aspirasyon akış oranları için ayak izi (D) Görüntü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
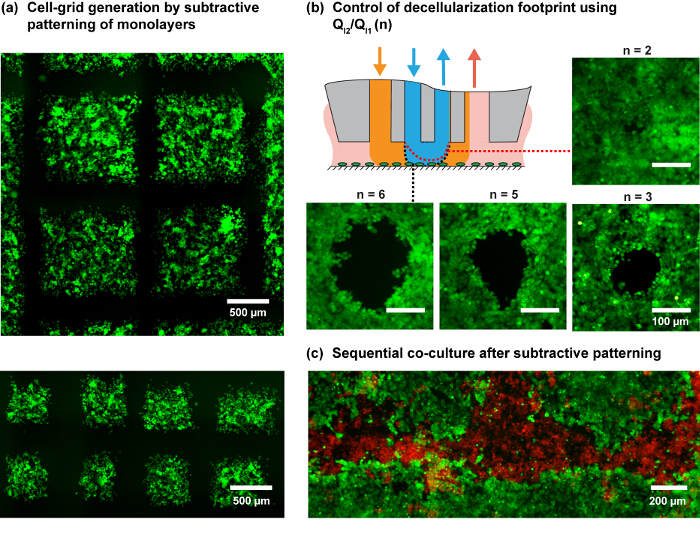
Şekil MFP'yi kullanarak hücre mono tabakaları 4. Desenler. Bir MDA-MB-231 hücre tek tabaka MFP programlı tarama ile (A) Hücre ızgara nesil. Hücreler yeşil hücre izci boya ile boyandı. (B) n farklı enjeksiyon oranları için ayak izi () Bir MCF7 hücre tek tabaka. Şematik bir N bir değişiklik ile, iç HFC şeklinde beklenen değişimini göstermektedir. (C) çıkarılır bölgelerde MDA-MB-231 hücrelerin ekim ardından MCF7 tek tabaka eksiltici desenlendirme ile ko-kültür Desenli. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
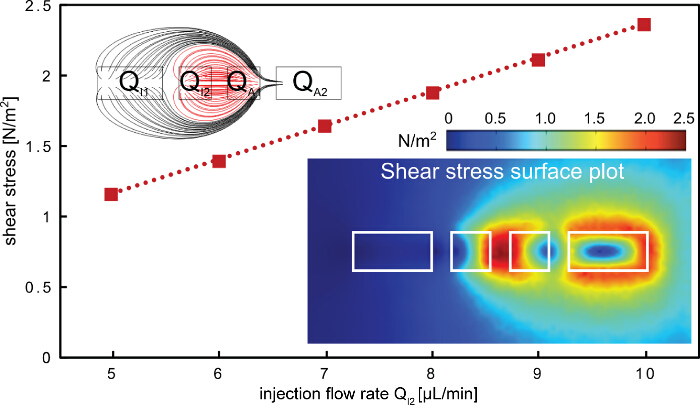
Yüzeyde Şekil 5. Kesme gerilmesi hHFC. Doğrusal iç enjeksiyon debisi ile yüzey kısma ilişkin kayma gerilimi uygulama. En yüksek kayma noktası iki iç işleme sıvı sınırlı delikler (sağ alt resim), (kırmızı akış hatları, sol üst içerlek) arasında bulunmuştur. sonlu eleman modeli kullanılan diyafram boyutları 200, 100, 100 ve I1 200 um olan, I2, A1ve a2, sırasıyla. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
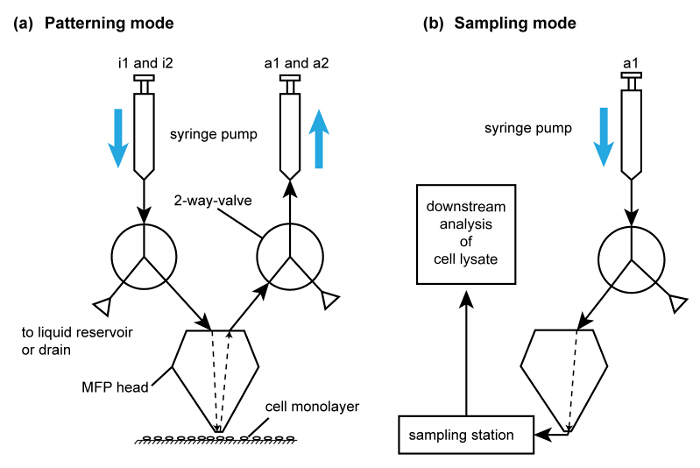
MFP platformu Şekil 6. Çalışma modları. Hücre çıkarma ve desenlendirme gerçekleştirmek hücre parçalama tarafından eksiltici desenlendirme için akış yolunun (A) şematik için. Kolaylık olması açısından, her enjeksiyon ve aspirasyon akış yolları tek gösterilmiştir. şırıngalar pompalarda tahliye vanasını kullanarak doldurulur. I1 ve I2 sırasıyla ekstraksiyon tamponu ve NaOH enjekte etmek için kullanılır. Lizat geri kazanımı için akış yolu (B) şematik. Bu akış yolu (A) 'daki akış yolunu kullanarak analiz için hücre lizatının toplandıktan sonra aktive edilir. Tiklayiniz lütfenBu rakamın büyük halini görmek için buraya k.
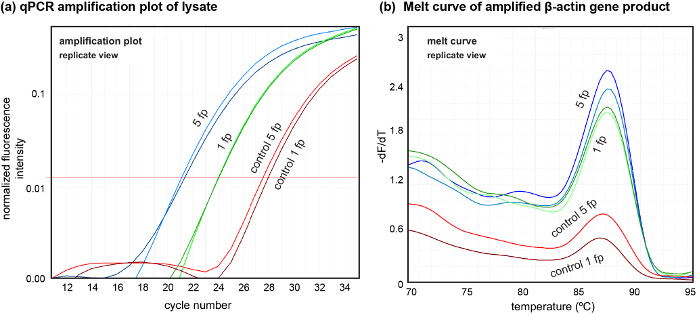
QPCR kullanılarak hücre lizatından DNA Şekil 7. Alt analizi. 5 ayak (5 FP) ve 1 ayak izi (1 FP) elde lizat DNA (A) amplifikasyon çizimini. Kontroller Her iki durum için lizat toplandıktan sonra çıkarıldı. (B) ile ekstre DNA kalitesini gösteren lizattan amplifiye DNA eğrileri eritin. qPCR yapılan (N = 2, n = 3). β-aktin gen yükseltmek için olan bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
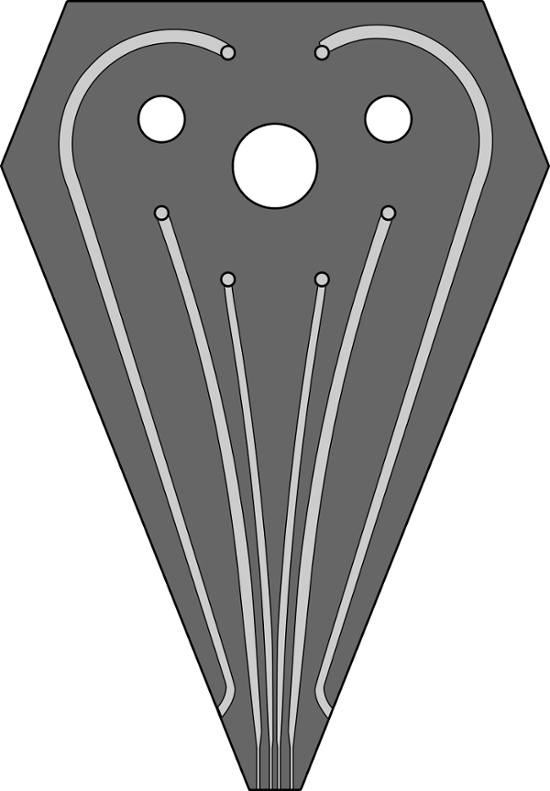
Şekil S1. 6-kanal MFP başı için kanal tasarımının bir ölçekli görüntühHFC performans desen deneylerde kullanılır. Kanallar, derin 200, 100, 200 um genişliğinde 100, ve 100 mikron. daldırma sıvı doldurmak iki dış kanal, 500 mikron genişliğinde ve 100 mikron derin. Aynı tasarım için bir GDS dosyası bu makaleye bir tamamlayıcısı olarak sağlanmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Biz mekansal tanımlanan hücre modellerinin hızlı nesil sağlar hücre mono tabakaları çıkartımsal desenlendirme için çok yönlü bir protokol mevcut. hücre mono tabakaları seçici parçalama hHFC işleme sıvısı olarak NaOH kullanılarak gerçekleştirilir. NaOH anında hücre zarında bulunan proteinleri denatüre. Biz lizat aşağı işlenmesini sağlamak için NaOH, 50 mM konsantrasyonu kullanılması tavsiye edilir. Bu konsantrasyon, Resim lizat akış aşağı işlem bir amaç değildir, daha hızlı hücre çıkarılması için arttırılabilir. hHFC hücre tek tabaka işlenmemiş çevresinde etkilenmeden kalır ve desen genişleterek veya diğer hücre özellikleri yoklamada biri için kullanılabilir olmasını sağlar.
Hücre çıkarılması akış oranı tarafından sunulan kimya ve kesme hem de bir fonksiyonudur. Biz kimya baskın hücre kaldırılmasını sahip akış oranlarının bir işletim aralığını seçin. 20 & # - 10 Tarama hızları181 m / 6 NaOH enjeksiyon akış hızı kullanılarak san - 8 ul / dak 'hızlı' eksiltici model vermenin kolaylaştırılması için kullanılır. Hücre çıkarılması hızlı kuruna dayalı desenlendirme 20,21 yaklaşımları yüzey baskı ile karşı karşıya bazı zorluklar giderir. Bu yöntemler, mikro temasla baskı ve kalıp elde etmek için hücrelerin daha sonra tohumlama yoluyla hücre yapışma proteinlerinin seçici çökelme, örneğin, mekansal olarak tanımlanan bir alanda hücrelerinin büyümesini sınırlamak için bir mekanizma gerekmektedir. Onlar düşük işlem hacmi ile sınırlı ve desen üretimi için birkaç sıralı adımları yanı sıra her bir model için yeni bir şablon / damgası gerektirir. Hücre kültürü substrat herhangi bir ek tedavi gerektiren değil ise açıklanan yöntem, belirlenen alanlarda hücrelerin seçici büyümesini gerektirir ve baskı aksine eksiltici desenlendirme yaparak çeşitli sınırlamalar üstesinden değildir.
Bu yazıda belirtilen protokol desenlendirme hücre mono tabakaları throughputOluşturulan modelin anında görsel geri bildirim elde ederken, artar. Bu desen gerçek zamanlı değişiklik kolaylaştırır. Bu kontrol bir yüzey üstünde hücre canlılığı, homojen olmadığı, senaryolarda önemli olabilir. Yöntemin diğer bir avantajı, aynı kafa ve kimya, böylece bir model verilmiş hücre tekli tabakası üreten aşama sayısı azalır birden desenleri oluşturmak için kullanılabilir olmasıdır.
baş kanalları ve baş geometri boyutları dolayısıyla desenlendirme kararı üzerinde kontrol sağlayan, uygulamanın gereklerine göre ölçeklendirilebilir. Mevcut çalışma bölgesindeki tüm deneyler 200 x 100 um 100 x 100 um ve dış delikler de, iç delikler ile özel olarak ise, sabit açıklık boyutları ile MFP kafası kullanılarak yapıldı. Daha büyük dış deliklere sahip Bu tasarım ile deliklerin tıkanmadan hHFC sürekli çalışmasını sağlamak için seçilmiştirbaşıboş hücre artıkları. Biz cep çıkarılması başarılı sonuçlarla, iç diyafram boyutları 50 × 50 um ve aralarında 50 mikron boşluk başlarını test ettik. aşağı 10 × 10 mm 10 mm aralıklı küçük açıklıklar kullanılması, böylece desen daha yüksek bir çözünürlük sağlayan küçük bir ayak izi boyutu (~ 30 × 30 mikron) için ölçekleme izin verebilir. diyafram nedeniyle parçacıklardan tıkanma daha küçük 10 mikron boyutlarında ile operasyonel sorunlar görülmektedir. Çünkü bu tür operasyonel zorlukların, 100 mikron çözünürlük mevcut limit ve açıklanan tekniğin böylece bir sınırlama yoktur. Ancak, biz hHFC sıvı şekillendirme yeteneğini kullanarak bu ele alabilir. Biz cep çıkarılması çözünürlük Q I2 / Q I1 kontrol ederek diyafram boyutları belirli bir kümesi için ayarlanmış olabilir olduğunu göstermiştir (Şekil 4b) ve apeks-to-substrat boşluğu 10,14. Mevcut çalışmada kullanılan aşamalar 100 nm en az bir adım boyutuna sahiptir.Bu kontrol parametrelerin kombinasyonu ayak izi boyutu ve tarama mesafe açısından hücre kaldırma uzaysal çözünürlüğü artırabilir.
desenli ko-kültürler farklı hücre tipleri arasında, belirli bir hücre-hücre etkileşimini incelemek arzu edilirse, sıralı tohumlama ve örnekleme tanımlanan protokol kullanılarak gerçekleştirilebilir. Son olarak, yüksek kalitede amplifikasyona tabi tutulabilen DNA DNA tekil zirve ile belirgin olarak, lizat elde edilebilir eğrisi (bakınız Şekil 7) eritin. Biz yaklaşık 1.6 teorik beklenti (6-8 pg / hücre) yakın qPCR kullanarak tek bir ayak izi (yaklaşık 300 hücre), ng DNA miktarını değerlendirdi. Bu, herhangi bir DNA izolasyon yöntemlerinin kullanımını kalmayabilir ise birkaç sonraki işlemler için uygun çıkarılan DNA miktarını gösterir. Bunun için yollar açılır kültür hücrelerinin sondalama yerel DNA analizi tabanlı. sıvı şekil hHFC kabiliyeti de AC canlı hücreleri ve proteinleri biriktirilmesi için kullanılabilirBu protokol sunulan eksiltici desen ve sıralı eş-kültür ile kombinasyon halinde kültür substratlar üzerinde karmaşık bir hücre ve hücre-matris modelleri oluşturulmasını sağlar genelinde ekili yüzeyler. çok yönlülük ve hHFC tabanlı Eksiltici hücre mono tabakaları desen ve çıkarılan hücrelerde DNA analizi gerçekleştirerek olasılığı tarafından sağlanan denetim, hücre etkileşimleri içeren mekansal çözülmesi çalışmaları gerçekleştirmek için biyologlar ayarlanmış yeni ve güçlü bir araç sağlar.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by the European Research Council (ERC) Starting Grant, under the 7th Framework Program (Project No. 311122, BioProbe). We thank Dr. Julien Autebert and Marcel Buerge for technical assistance and discussions during the development of the protocol and the platform. Prof. Petra Dittrich (ETH Zurich), Prof. Bradley Nelson (ETH Zurich), Dr. Bruno Michel and Dr. Walter Riess are acknowledged for their continuous support.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Microfluidic Probe (MFP) | Silicon/glass hybrid probe head with channels patterned in silicon. Fabrication done in-house at IBM Research - Zürich | ||
| Lab Tek II Chamber slides with 2 chambers | ThermoFisher scientific, USA | 154461 | 2 Chamber chamber slides for cell culture with each chamber providing an area of 4 cm2 and capable of holding up to 3 ml of media volume |
| Chemicals and cell lines | |||
| Sodium Hydroxide, Tris-Cl, Ethylenediaminetetraaceticacid, Rhodamine B | SigmaAldrich chemicals, USA | S5881, 252859, E9884, R6626 | Chemicals used for processing and shielding liquids |
| Proteinase K | Qiagen, Germany | 19131 | protease to digest denatuired proteins |
| Deconex 16 Plus | Bohrer Chemie, Switzerland | Universal cleaning agent for labaratory consumables. Used for non stringent cleaning. | |
| DNA away | ThermoFisher scientific, USA | 7010 | Surface decontaminant that denatures DNA and DNAases. |
| DMEM, high glucose, GLUTAMAX supplement | ThermoFisher scientific, USA | 10566-016 | Culturing medium for epithelial cells. |
| CellTracker Green CMFDA dye | ThermoFisher scientific, USA | C7025 | Membrane permeant live cell labeling dye. Dye active for 72 hours. |
| CellTracker Orange CMRA dye | ThermoFisher scientific, USA | C34551 | |
| β-actin genomic primers for qPCR | Integrated DNA technologies, USA | Custom oligos used for DNA quality validation and qPCR. | |
| MCF7 breast carcinoma cells | ATCC, USA | ATCC HTB-22 | Cell lines used to produce co-cultures. |
| MDA-MB-231 breast carcinoma cells | ATCC, USA | ATCC HTB-26 | |
| Equipment and fluidic connections | |||
| Motorized high precision stages | Custom machined components. Linear axis motors from LANG GmBH, Germany | Customized linear axis stages from LT series | 3 × LT for 3 axes. LSTEP controller used for interfacing stages and PC through RS 232 port. |
| Syringes | Hamilton, Switzerland | 1700 TLLX series | Interchangeable with syringes provided by other manufacturers with a 250-500 µl range. |
| Nemesys low pressure syringe pumps | cetoni GmbH, Germany | Component of pumping station. | |
| Circular M1-connector | Dolomite microfluidics, United Kingdom | 3000051 | Interface between vias in MFP head and tubing |
| Tilt/rotation stage Goniometer | OptoSigma, USA | KKD-25C | Goniometer to adjust coplanarity of MFP apex |
| DS Fi2 HD color camera (CCD) | Nikon, Switzerland | Controlled using DS-U3 controller unit | |
| Software | |||
| Win - Commander | LANG GmBH, Germany | Stage control software. | |
| Qmix Elements | cetoni GmbH, Germany | Pump control software. | |
| NIS Elements | Nikon, Switzerland | Basic research module for image acquisition and analysis. | |
Referanslar
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. J. Cell Sci. 123 (Pt 24), 4201-4213 (2010).
- Goubko, C. A., Cao, X. Patterning multiple cell types in co-cultures: A review. Mater. Sci. Eng. C. 29 (6), 1855-1868 (2009).
- Kaji, H., Camci-Unal, G., Langer, R., Khademhosseini, A. Engineering systems for the generation of patterned co-cultures for controlling cell-cell interactions. Biochim. Biophys. Acta. 1810 (3), 239-250 (2011).
- Cho, C. H., Park, J., Tilles, A. W., Berthiaume, F., Toner, M., Yarmush, M. L. Layered patterning of hepatocytes in co-culture systems using microfabricated stencils. Biotechniques. 48 (1), 47-52 (2010).
- Schütze, K., Lahr, G. Identification of expressed genes by laser-mediated manipulation of single cells. Nat. Biotechnol. 16 (8), 737-742 (1998).
- Salazar, G. T. A., Wang, Y., et al. Micropallet arrays for the separation of single, adherent cells. Anal. Chem. 79 (2), 682-687 (2007).
- Guillaume-Gentil, O., Zambelli, T., Vorholt, J. A. Isolation of single mammalian cells from adherent cultures by fluidic force microscopy. Lab Chip. 14 (2), 402-414 (2014).
- Iwata, F., Adachi, M., Hashimoto, S. A single-cell scraper based on an atomic force microscope for detaching a living cell from a substrate. J. Appl. Phys. 118 (13), (2015).
- Riahi, R., Yang, Y., Zhang, D. D., Wong, P. K. Advances in wound-healing assays for probing collective cell migration. J. Lab. Autom. 17 (1), 59-65 (2012).
- Juncker, D., Schmid, H., Delamarche, E. Multipurpose microfluidic probe. Nat. Mater. 4 (8), 622-628 (2005).
- Kaigala, G. V., Lovchik, R. D., Delamarche, E. Microfluidics in the "open space" for performing localized chemistry on biological interfaces. Angew. Chem. Int. Ed. Engl. 51 (45), 11224-11240 (2012).
- Qasaimeh, M. A., Gervais, T., Juncker, D. Microfluidic quadrupole and floating concentration gradient. Nat. Commun. 2 (May), 464 (2011).
- Christ, K. V., Turner, K. T. Design of hydrodynamically confined microfluidics: controlling flow envelope and pressure. Lab Chip. 11 (8), 1491-1501 (2011).
- Autebert, J., Kashyap, A., Lovchik, R. D., Delamarche, E., Kaigala, G. V. Hierarchical hydrodynamic flow confinement: efficient use and retrieval of chemicals for microscale chemistry on surfaces. Langmuir. 30 (12), 3640-3645 (2014).
- Kaigala, G. V., Lovchik, R. D., Drechsler, U., Delamarche, E. A Vertical Microfluidic Probe. Langmuir. 27 (9), 5686-5693 (2011).
- Cors, J. F., Lovchik, R. D., Delamarche, E., Kaigala, G. V. A compact and versatile microfluidic probe for local processing of tissue sections and biological specimens. Rev. Sci. Instrum. 85 (3), 034301 (2014).
- Pollard, J. W., Walker, J. M. . Basic Cell Culture Protocols. , (1997).
- Mitry, R. R., Hughes, D. R. Human cell culture protocols. Methods Mol. Biol. Springer. 531 (1), (2012).
- Sakai, K., Ushida, T., Nagase, T., Nakamigawa, H. Quantitative analysis of cell detachment by shear stress. Mater. Sci. Eng. C. 17 (1-2), 55-58 (2001).
- Rodriguez, N. M., Desai, R. A., Trappmann, B., Baker, B. M., Chen, C. S. Micropatterned multicolor dynamically adhesive substrates to control cell adhesion and multicellular organization. Langmuir. 30 (5), 1327-1335 (2014).
- Tasoglu, S., Demirci, U. Bioprinting for stem cell research. Trends Biotechnol. 31 (1), 10-19 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır