Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vitro DNA hasarı kuyruklu yıldız tahlil kullanarak değerlendirmek
Bu Makalede
Özet
Kuyruklu yıldız tahlil tek ve çift iplikçikli DNA içeren DNA hasarı tatili algılamak için verimli bir yöntemdir. Kemoterapi tedavi edici etkisini değerlendirmek için kanser hücrelerinin DNA hasarı ölçmek için alkali ve tarafsız kuyruklu yıldız deneyleri tarif.
Özet
DNA hasar her hücre için ortak bir fenomen onun ömrü ve genomik DNA'ın kimyasal yapısı bir değişiklik tanımlanır. Gibi radyo ve kemoterapi, kanser tedavileri kanser ilerleme sınırlamak için hücre döngüsü tutuklama ve Apoptozis yol ek DNA hasar çok büyük miktarda tanıtmak. DNA hasarı kantitatif değerlendirilmesi deneysel kanser tedavisi sırasında genotoksik aracısı etkinliğini haklı göstermek için önemli bir adımdır. Bu çalışmada, biz bir tek hücre elektroforez yöntemi, olarak da bilinen tek ölçmek kuyruklu yıldız tahlil odaklanmak ve iki iplikçikli DNA vitrotatili. Kuyruklu yıldız tahlil verimli ve gerçekleştirmek kolay bir DNA hasarı miktar yöntemidir ve düşük saat/bütçe talepleri ve yüksek tekrarlanabilirlik vardır. Burada, olaparib/temozolomide kombinasyon tedavisi U251 tümörü hücrelere genotoksik etkisini değerlendirerek kuyruklu yıldız tahlil preklinik bir çalışma için yardımcı programı vurgulayın.
Giriş
Kuyruklu yıldız tahlil ilk Ostling ve Johanson tarafından 1984 yılında çekirdeği bir nötr koşul1altında üzerinden göç DNA parçaları göstererek geliştirilmiştir. Teknik bir alkali durumu önemli ölçüde artan özgüllük ve tekrarlanabilirlik tahlil2gösterilen Singh vdtarafından daha sonra geliştirildi. O zamandan beri tarafsız kuyruklu yıldız tahlil çoğunlukla ise alkali kuyruklu yıldız tahlil DNA hasar, tek gibi küçük miktarlar için daha duyarlı ve Çift Kişilik iplikçik DNA tatili, alkali değişken siteler, DNA-DNA çift iplikçikli DNA tatili, algılamak için kullanılır veya DNA-protein cross-linking ve DNA tek iplikçikli kırılmalar eksik eksizyon ile ilişkili siteleri3,4onarın. Her iki deneyleri görselleştirme parçalanmış DNA'ın izin ve kantitatif DNA hasarı değerlendirmek için basit bir yol sağlar. Kuyruklu yıldız tahlil içinde in vitro ve in vivo genetik toksikolojik çalışmalar için hassas bir yöntemi olarak kabul edilir ve erken uyuşturucu-aday seçimi, çevresel izleme, insan biomonitoring gibi farklı araştırma alanları için geçerlidir, ve araştırma DNA hasarı ve5onarım temel.
Tahlil bir elektrik alanı altında parçalanmış DNA (olarak da bilinen "kuyruklu yıldız kafa") çevrili vücut dışına geçirir ve özel jel (olarak da bilinen "kuyruklu yıldız kuyruğu") bir DNA leke oluşturur ilkedir. Nükleotit boyama ile DNA hasar ölçüde "kuyruklu yıldızlar bu tek hücre Elektroforez tarafından kurulan" analiz ederek sayısal. Kuyruk an hesaplanması daha fazla DNA hasar farklı deneysel grupları arasında karşılaştırmak için yardımcı olabilir. DNA hasar tespiti geleneksel yöntemlere göre kuyruklu yıldız tahlil doğrudan, hassas, ucuz ve oldukça basit olduğunu.
Radyoterapi ve chemotherapies kanser tedavisi için ortak stratejiler tek iplikçik oluşturarak ve Çift Kişilik iplikçik DNA kromozom6' tatili. DNA onarım inhibitörleri son gelişme kombinasyon kemoterapi tarafından daha etkili bir genotoksik etkiyi sağlar ve bu nedenle, potansiyel olarak anemi, enfeksiyon ve kemik iliği baskılanması7, gibi sistemik yan etkileri azaltır 8. bu çalışmada, bir Poli (ADP-riboz) polimeraz (PARP) inhibitörü, olaparib (Ola)9incelenmesi gösterdik. PARP bol bir nükleer protein ve Poli (ADP-riboz) polimer10oluşturarak DNA baz eksizyon tamiri için sorumludur. Temozolomide (TMZ) sözlü olarak kullanılabilir bir bölücü ve yaygın olarak tümörü hasta tedavi için kullanılan. Kuyruklu yıldız tahlil DNA hasarı ölçmek için kullanarak, biz olaparib derinden temozolomide ile birleştirerek olaparib/temozolomide kombinasyon tedavisi tümörü, tedavi etmek için etkili bir strateji olduğunu göstermektedir DNA hasarı gliyom hücrelerdeki geliştirir göstermek temozolomide yalnız11ile karşılaştırıldığında.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. hazırlamak reaktifler
- 1 x PBS
- seyreltik 100 mL 10 x PBS 900 mL dH 2 O ile ve pH 7.4 pH metre kullanarak için ayarlayın. Mağaza oda sıcaklığında.
- Lizis çözüm (LS)
- 2.5 M NaCl, 100 mM disodyum EDTA, 10 mM Tris Bankası ve 900 mL dH 2 O 200 mM NaOH hazırlamak; genellikle tamamen erimesi karışım izin verin için yaklaşık 20 dakika sürer. PH pH metre kullanarak 10 için ayarlayın. % 1 sodyum loril sarcosinate ve % 1 eklemek Triton X-100 ve son ses seviyesini 1000 ml. 4 ° c için kullanmadan önce en az 30 dk serin.
- Alkali Elektroforez çözüm (AES), pH > 13
- 200 mM NaOH ve 1 mM disodyum EDTA 800 mL dH 2 O. ayarlama pH hazırlamak ve pH olduğundan emin olun > 13. 1000 ml nihai ses düzeyini ayarlayın. Kullanmadan önce taze olun ve serin 4 ° c kullanmadan önce en az 30 dk için.
- Tarafsız Elektroforez sollution (NES)
- hazırlamak 1000 mL tarafsız Elektroforez arabellek 100 mM Tris Bankası ve 300 mM sodyum asetat 1000 mL dH 2 O. ayarlama 9.0 için pH buzul Asetik asit ile karıştırma tarafından. 4 ° c için kullanmadan önce en az 30 dk serin.
- DNA yağış çözüm (DPS)
- 10 mL 7,5 M amonyum asetat stok hazırlanması. 50 mL için DNA yağış çözeltisi, 6.7 mL 7,5 M amonyum asetat 43.3 mL % 95 etanol ile karıştırın. Mağaza oda sıcaklığında.
- Staining çözüm
- ekleyin 1 µL 10.000 yeşil flüoresan nükleik asit leke (örneğin, SYBR yeşil) 30 mL Tris-EDTA arabellek (10 mM Tris-HCl, 1 mM disodyum EDTA, pH 7,4) ve store x 4 ° C. koru dan ışık.
- Özel %1 düşük erime
- % 1 düşük erime noktası özel (100 mL dH 2 O 1 g) bir mikrodalga eritebilir. Özel özel tamamen erimiş olduğundan emin olmak için her 15-20 s girdap. 37 ° C su banyosu için en az 20 dk kullanmadan önce özel yerleştirin.
- Önceden sıcak pipet ipuçları
- P200 pipet ipuçları dar uçları 3 mm ve 37 ° c sıcak özel pipetting önce kekemelik.
2. Kuyruklu yıldız slaytlar hazırlayın
- Melt % 1'özel (100 mL dH 2 O 1 g) 2-3 dk ya da özel tamamen erimiş olana bir mikrodalga kaplama kaydırın. Cam mikroskop slaytlar özel içine daldırma ve hav bırakmayan mendil kullanarak slayt bir tarafı yok.
- Slaytlar kuruması veya daha hızlı kurutma için 50 ° c ısı için düz bir yüzey üzerinde yatıyordu; şeffaf özel film kurutma sonra oluşmuş olmalıdır. Kaplamalı slaytlar 37 ° C kullanmadan önce yerleştirin.
- Tek hücre süspansiyonlar hazırlanması
- kültür ve tedavi gliyom hücre
- 10 ile desteklenmiş DMEM-Ham F-12 orta U251 MG hücrelerde kültür % FBS, 100 U/mL penisilin ve 10 µg/mL streptomisin, 37 ve # 176; C % 5 CO 2.
- 1 mL tripsin 3 dakikadır kullanarak hücreleri sindirmek ve tripsin FBS ile DMEM-Ham F-12 orta kullanarak etkisiz hale getirin. Toplamak 300 x g 4 dk de 15 mL tüp, spin, orta Aspire edin ve 2 x 10 5 hücre/mL 1 x PBS hücreleri askıya alma.
Not: Hücre örnek hemen tahlil başlamadan önce hazırlanmalı ve tüm örneklerini ortamda ışık DNA hasarları önlemek için bir koyu veya soluk işleneceğini. - 1:10 (v/v) oranında (37 ° C'de) %1 erimiş düşük erime noktası özel hücre süspansiyon birleştirin, karışımı yavaşça yukarı ve aşağı pipetting ve hemen bir slayda 30 µL pipet. Tarafını kullanıyorsunuz pipet ucu ince bir tabaka oluşumu sağlamak için özel/hücre karışımı spread.
- 10 dk. 30 dk jelleşme zaman artan yüksek nem içeren ortamlardan örneklerin yapışma geliştirir düz 4 ° C'de karanlık slayt yer.
- 4 ° c LS içinde belgili tanımlık karanlık bir gecede 1 h için slayt bırakın.
- kültür ve tedavi gliyom hücre
3. Tek hücre Elektroforez
- devam et alkalin (Adım 3.2) veya nötr (Adım 3.3) kuyruklu yıldız tahlil
- alkali kuyruklu yıldız tahlil için
- yavaşça slaytlar LS kaynağından çıkarın, aşırı arabellek drenaj ve yavaşça AES içinde 4'te 1 h için bırakın ° C DNA gevşemek izin vermek için. Slaytları karanlıkta bırakın.
- Ekle önceden soğutulmuş AES, Elektroforez slayt tepsisine (Bu Elektroforez birim boyutuna bağlıdır) slaytlar yukarıda 0.5 cm fazla, slaytlar içinde ve bir kap ile kapak yerleştirin. 1 V/cm (uzunluk elektrot arasındaki) güç Besleme gerilimi ayarlamak ve çalıştırmak için 30 dk 4'te ° C.
- Drenaj aşırı Elektroforez çözüm slayttan. DH 2 O oda sıcaklığında her 5 min için iki kez slaytları yavaşça bırakın.
- % 70 etanol oda sıcaklığında 5 min için slaytları yavaşça bırakın. Adım 4'e devam.
- Tarafsız kuyruklu yıldız tahlil için
- yavaşça slaytları LS kaynağından çıkarın, aşırı arabellek drenaj ve yavaşça NES içinde 4'te 30 dk için bırakın ° C. Keep slayt karanlıkta.
- Ekle önceden soğutulmuş tarafsız Elektroforez arabellek Elektroforez slayt tepsisinde (Bu Elektroforez birim boyutuna bağlıdır) slaytlar yukarıda 0.5 cm fazla, slaytlar içinde ve bir kap ile kapak yerleştirin. 1 V/cm (uzunluk elektrot arasındaki) güç Besleme gerilimi ayarlamak ve çalıştırmak için 45 dk 4'te ° C.
- Drenaj slaytları aşırı arabelleğinden. Yavaşça DPS slaytları, oda sıcaklığında 30 dakika bırakın.
- % 70 etanol, oda sıcaklığında 30 dk için slaytları yavaşça bırakın. Adım 4'e devam.
4. Kuyruklu yıldız slaytlar leke
- kuru slaytlar için 10-15 dk içinde belgili tanımlık karanlık 37 ° C'de.
- Yer 50-100 µL yeşil flüoresan nükleik asit çözüm her boyama kurutulmuş özel ve 15 dakika içinde belgili tanımlık karanlık oda sıcaklığında leke.
- Slaytları kısaca dH 2 içinde O durulayın ve tamamen 37 ° C'de karanlık kuru. Resim alma ve analiz için devam.
5. Görüntü toplama ve analizi
Not: görselleştirme ve miktar olan DNA epifluorescence mikroskobu ve kuyruklu yıldız tahlil yazılım dayalı (Tablo malzemeleri görmek) 12 .
- Yer slaytları bir slayt tutucu mikroskopla üstünde. Özel jel objektif lens dönük olduğundan emin olun. Rastgele bir floresan mikroskop ile 10 x objektif lens kullanarak lekeli kuyruklu yıldız slaytlardan çekim. Kenarları ve herhangi bir hava kabarcıkları çevresinde kaçının.
- Emin olun her kuyruklu yıldız kuyruk yatay olarak dağıtılır. Kuyruklu yıldız kafaları köken sol ve sağ kuyruk.
- Her resim parlak DNA leke ve koyu arka plan ile ikili bir TIF biçiminde kaydedin. Yüklemek için yazılım kullanarak görüntüleri " seçin dosyaları analiz etmek için " araç çubuğunun solunda bulunan düğme. ( şekil 1) bir görüntü görünüm pencere belirmelidir.
- Ölçüm çerçevesi ekrana çizdiğiniz ve boyutuna uygun olarak hücre kuyruklu yıldız ayarlayın. ' I tıklatın " ayarla " baş, kuyruklu yıldız ve kuyruk görüntü göre eşik ayarlamak için düğme, o zaman tıkırtı " başlatmak ölçümleri " düğmesini ( şekil 1).
- Çerçeve kullanarak bir hücre seçin ve fare ile tıklayarak ölçüm harekete geçirmek " kuyrukluyıldız tahlil " düğme; bir yoğunluk görüntü üzerinde gösterir " profiller " penceresi seçili ölçüm parametreleri ile. Sonuçlar'ı tıklatarak kaydedilebilmesi için " sonucu depolamak " düğmesini ( şekil 1).
Not: Yazılım kuyruklu yıldız kuyruk, kuyruklu DNA, kuyruk moment (TM) ve zeytin kuyruk an (OTM) yüzdesi dahil parametreleri hesaplar. Kuyruk anlar formüller tarafından takip hesaplanır:

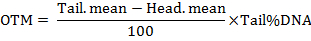
- en az 50 hücreleri analiz tedavi başına.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kuyruklu yıldız tahlil yürütme ve veri analizi (şekil 1) için adım adım iş akışı mevcut protokolünü açıklar. Alkali ve tarafsız kuyruklu yıldız deneyleri sonuçları doksorubisin tedavi U251 hücreler (1 µM, 20 h) kuyrukluyıldızın kuyruğunun daha uzun ve daha yüksek DNA şiddeti, parçalanmış DNA kemoterapi (Şekil 2) nedeniyle önemli bir birikimi düşündüren vardı gösterdi.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kuyruklu yıldız tahlil tek ve iki iplikçikli DNA sonları hücresel düzeyde ölçmek için etkili bir araçtır. Tahlil yaygın olarak13genotoxicity ve biomonitoring ile ilgili olarak, temel lezyonlar, DNA Glossar, ilaç geliştirme ve alkali hassas siteler arasında değişen çalışmalarda "altın standart" olarak uygulanmıştır. Bu da çalışmanın, sırasıyla alkali ve tarafsız kuyruklu yıldız deneyleri, iki ayrı adım adım protokollerde gösterdik. Tek hücre Elektroforez, flore...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu araştırma NIH, ncı ve CCR Intramural araştırma programı tarafından desteklenmiştir. Tüm yazarlar NIH, ncı ve CCR Intramural araştırma bursu aldı.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 10x PBS(Ca++, Mg++ free) | TEKnova | P0196 | |
| NaCl | Sigma | S5886 | |
| EDTA | TEKnova | E0308 | |
| Trizma base | Sigma | T1503 | |
| NaOH | Sigma | 72068 | |
| Sodium lauryl sarcosinate | Sigma | L7414 | |
| Triton X-100 | Sigma | 93443 | |
| Sodium acetate | Sigma | 32318 | |
| Glacial acetic acid | Sigma | 695092 | |
| Ammonium acetate | Sigma | A1542 | |
| SYBR Green | Invitrogen | S33102 | |
| Low melting point agarose | Invitrogen | 16520 | |
| Agarose | Invitrogen | 16500 | |
| 95% ethanol | WARNER-GRAHAM | #64-17-5 | |
| Trypsin | GIBICO | 25300-054 | |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Glass tissue slides | ELECTRON MICROSCOPY SCIENCES | 63422-11 | |
| Kimwipes | KIMberly-Clark | ||
| 1.5 mL Microcentrifuge Tubes | DENVILLE | ||
| Pipette Tips | SHARP | ||
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Microwave | Avanti | ||
| Waterbath | PRECISION | ||
| Horizontal electrophoresis chamber | TREVIGEN | Cometassay ES II | |
| Power supply | Bio-Rad | ||
| Incubator | Quincy Lab | Model 12-140E | |
| Fluorescent microscope | Zeiss | LSM700 | |
| Micropipettor | Eppendorf |
Referanslar
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem Biophys Res Commun. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 175 (1), 184-191 (1988).
- Tice, R. R., et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 35 (3), 206-221 (2000).
- Shah, A. J., Lakkad, B. C., Rao, M. V. Genotoxicity in lead treated human lymphocytes evaluated by micronucleus and comet assays. Indian J Exp Biol. 54 (8), 502-508 (2016).
- Azqueta, A., Collins, A. R. The essential comet assay: a comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 87 (6), 949-968 (2013).
- Goldstein, M., Kastan, M. B. The DNA damage response: implications for tumor responses to radiation and chemotherapy. Annu Rev Med. 66, 129-143 (2015).
- Gavande, N. S., et al. DNA repair targeted therapy: The past or future of cancer treatment? Pharmacol Ther. 160, 65-83 (2016).
- Torgovnick, A., Schumacher, B. DNA repair mechanisms in cancer development and therapy. Front Genet. 6, 157(2015).
- Weston, V. J., et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood. 116 (22), 4578-4587 (2010).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA Repair in Cancer: Beyond PARP Inhibitors. Cancer Discov. 7 (1), 20-37 (2017).
- Lu, Y., et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 77 (7), 1709-1718 (2017).
- Konca, K., et al. A cross-platform public domain PC image-analysis program for the comet assay. Mutat Res. 534 (1-2), 15-20 (2003).
- Valverde, M., Rojas, E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res. 681 (1), 93-109 (2009).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol Biotechnol. 26 (3), 249-261 (2004).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Sci Rep. 4, 7200(2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır