Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценки в Vitro повреждения ДНК, используя Assay комета
В этой статье
Резюме
Assay комета является эффективным методом для обнаружения повреждения ДНК, включая одиночные и двуцепочечной ДНК разрывами страниц. Мы описываем щелочных и нейтральных комета анализов для определения повреждения ДНК в раковых клетках оценить терапевтический эффект химиотерапии.
Аннотация
Повреждение ДНК является обычным явлением для каждой ячейки во время его жизни и определяется как изменение химического состава геномной ДНК. Лечения рака, такие как радио - и химиотерапии, ввести огромное количество дополнительных повреждений ДНК, ведущих к арест клеточного цикла и апоптоз ограничить прогрессии рака. Количественная оценка повреждения ДНК в ходе экспериментальной рака терапии является ключевым шагом для обоснования эффективности генотоксичных агента. В этом исследовании мы ориентируемся на одну ячейку электрофорез assay, также известный как assay кометы, которые могут количественно охарактеризовать одной и ДНК двухнитевые разрывы в пробирке. Assay комета является метод количественной оценки повреждения ДНК, который является эффективным и легко выполнять, и имеет низкий бюджет времени требованиями и высокую воспроизводимость. Здесь мы подчеркнуть полезность комета assay доклинические исследования, оценивая эффект генотоксичных olaparib/Темозоламид комбинированной терапии для U251 клеток глиомы.
Введение
Assay комета была впервые разработана Остлинг и Йохансон в 1984 году, продемонстрировав, что миграция ДНК фрагменты из ядер под нейтральной условие1. Техника позднее был разработан Singh et al., показаны, что щелочной значительно увеличила специфичность и воспроизводимость пробирного2. С тех пор, пробирного нейтральных кометы в основном используется для обнаружения двуцепочечные разрывы ДНК, в то время как assay щелочной комета является более чувствительным для небольших сумм повреждения ДНК, включая одноместные и двойной нити ДНК влезает, щелочно лабильного сайтов, ДНК-ДНК или ДНК белковых сшивки и разрывы сингл нить ДНК, связанные с неполной иссечение ремонт сайтов3,4. Оба анализы позволяют визуализации фрагментированных ДНК и предоставляют простой способ количественно оценить повреждение ДНК. Комета рассматривается как чувствительный метод для в пробирке и в vivo генетических токсикологических исследований и применим для различных научно-исследовательских областях, таких как раннего отбора наркотиков кандидат, мониторинг окружающей среды, человеческого биомониторинга, и фундаментальные исследования в повреждения ДНК и ремонт5.
Принцип анализа, что под электрического поля, раздробленной ДНК мигрирует из nucleoid тела (также известный как «голова кометы») и формирует пятно ДНК в агарозном геле (также известный как «хвост кометы»). С нуклеотидом окрашивание, степень повреждения ДНК может быть определена количественно, анализируя «кометы» сформировал электрофорезом этой одной ячейки. Далее расчет момента хвост может помочь сравнить повреждение ДНК среди различных экспериментальных групп. По сравнению с традиционными методами обнаружения повреждения ДНК, комета assay прямой, чувствительных, недорогой и относительно простой.
Лучевой терапии и химиотерапии являются общие стратегии для лечения рака, создавая одинарная и двойная нить ДНК перерывы в хромосом6. Недавние улучшения в ремонт Ингибиторы ДНК позволяет более эффективным генотоксичных эффект химиотерапии и поэтому потенциально сокращает системные побочные эффекты, такие как анемия, инфекции и костного подавления7, 8. в этом исследовании, мы показали расследования ингибитор поли (АДФ рибоза) полимеразы (ПАРП), olaparib (УПВ)9. ППА является обильным ядерных белков и отвечает за базовые иссечение репарации ДНК путем формирования поли (АДФ рибоза) полимер10. Темозоламид (ТМЗ) является алкилирующим агентом, устно доступных и широко используется для лечения пациентов глиомы. Используя комета assay для количественного определения повреждения ДНК, мы демонстрируем, что сочетание olaparib с Темозоламид глубоко повышает повреждение ДНК клеток глиомы, который предполагает, что olaparib/Темозоламид комбинированной терапии является эффективной стратегией для лечения глиомы, по сравнению с Темозоламид только11.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка реагентов
- ПБС разбавляют 100 мл 10 x PBS с 900 мл dH 2 O и скорректировать рН 7,4, с помощью рН метр. Хранить при комнатной температуре.
- Лизис раствор (LS)
- подготовить 2,5 М NaCl, ЭДТА динатрия 100 мм, 10 мм Tris база и 200 мм NaOH в 900 мл dH 2 O; это обычно занимает около 20 минут, чтобы позволить смесь полностью раствориться. Отрегулируйте пэ-аш до 10 с помощью рН метр. Добавить 1% натрия лауриловый sarcosinate и 1% тритон X-100 и окончательного громкость до 1000 мл. Прохладный до 4 ° C для по крайней мере 30 минут до использования.
- Электрофорез щелочной раствор (AES), рН > 13
- подготовить 200 мм NaOH и 1 мм динатриевой ЭДТА в 800 мл dH 2 O. Adjust pH и убедитесь, что это рН > 13. Окончательного громкость до 1000 мл. Сделать свежий перед использованием и охладите до 4 ° C для по крайней мере 30 минут до использования.
- Sollution нейтральных электрофорез (РЭШ)
- подготовить 1000 мл нейтральной электрофорез буфера путем смешивания 100 мм Tris база и 300 мм ацетат натрия до 1000 мл dH 2 O. Adjust pH 9.0 с уксусной кислоты кристаллизированной. Прохладный до 4 ° C для по крайней мере 30 минут до использования.
- ДНК осадков раствор (DPS)
- Подготовка аммония ацетат 7,5 М 10 мл бульона. Для 50 мл раствора осадков ДНК смешайте с 43.3 мл этанола 95% Ацетат аммония 6,7 мл 7,5 М. Хранить при комнатной температуре.
- Окрашивания раствора
- Добавить 1 мкл 10 000 x пятно зеленого флуоресцентного нуклеиновой кислоты (например, SYBR Грин) в 30 мл трис-ЭДТА буфер (10 мм трис-HCl, 1 мм динатриевой ЭДТА, рН 7,4) и хранить в 4 ° C. защитить от свет.
- 1% низких плавления агарозы
- расплава 1% Температура плавления агарозы (1 г на 100 мл dH 2 O) точки в микроволновую печь. Вихрем каждые 15-20 s, чтобы убедиться, что агарозы полностью расплавленного агарозы. Место агарозы в водяной бане 37 ° C для по крайней мере 20 минут перед употреблением.
- Предварительно теплой наконечники
- Cut off узкие концы Р200 наконечники 3 мм и тепло при 37 ° C перед закупорить агарозы.
2. Готовить слайды с кометой
- , слайд покрытие
- расплава агарозы 1% (1 г на 100 мл dH 2 O) в микроволновую печь для 2-3 мин, или до тех пор, пока агарозы полностью расплавленного. DIP стеклянных скольжениях микроскопа в агарозы и стереть одну сторону слайда с помощью безворсовой wipe.
- Заложить слайды на плоской поверхности для воздушно-сухой или тепла при 50 ° C для более быстрый сушки; прозрачный агарозы фильм должен быть сформирован после высыхания. Место с покрытием слайды в 37 ° C перед использованием.
- Подготовка единого клеточных суспензий
- культуры и лечить клеток глиомы
- культуры U251 мг клеток в среде DMEM-Хэм F-12 дополнена 10% FBS, пенициллин 100 ед/мл и 10 мкг/мл стрептомицина в 37 & # 176; C с 5% CO 2.
- Дайджест ячейки, используя 1 мл трипсина на 3 мин и нейтрализовать трипсина, используя среде DMEM-Хэм F-12 с FBS. Собирают в 15 мл трубки, спина на 300 g x 4 мин, аспирационная среднего и приостановить клетки на 2 x 10 5 клеток/мл в однократном ПБС.
Примечание: Образец клеток должен быть подготовлен непосредственно перед началом анализа и все образцы должны быть обработаны в среде темные или серым, чтобы предотвратить повреждение ДНК от света. - Сочетают суспензию клеток с агарозы 1% расплавленная низкую температуру плавления (при 37 ° C) в соотношении 1:10 (v/v), осторожно перемешать, закупорить вверх и вниз и сразу же Пипетка 30 мкл на слайд. Используйте сторону кончика пипетки распространить агарозы/ячейку смесь для обеспечения формирования тонкого слоя.
- Место слайда квартиры на 4 ° C в темноте за 10 мин, увеличивая гелеобразующего время 30 мин улучшает соблюдение образцов в условиях высокой влажности.
- Погрузите слайд в 4 ° C LS в темноте за 1 ч до ночевка.
- культуры и лечить клеток глиомы
3. Одноместный клеток электрофореза
- Перейти к щелочной (шаг 3.2) или нейтральные (шаг 3.3) комета пробирного
- для щелочных комета assay
- осторожно удалить слайды из LS, слить избыток буфера и аккуратно погрузить в AES на 1 ч в 4 ° C разрешить раскручивание ДНК. Хранить слайды в темноте.
- Добавить предварительно охлажденные AES в трее слайд электрофореза, не превышает 0,5 см выше слайды (это зависит от размера единиц электрофорез), место слайды внутри и накрыть крышкой. Установить 1 V/см (длина между электродами) напряжение питания и баллотироваться на 30 мин в 4 ° C.
- Слива избыток электрофорез решение от слайда. Аккуратно погрузите слайдов дважды в dH 2 O 5 минут при комнатной температуре.
- Мягко погрузите слайды в течение 5 мин при комнатной температуре на 70% спирте. Перейдите к шагу 4.
- Для нейтральных комета assay
- осторожно удалите слайды из LS, слить избыток буфера и аккуратно погрузить в РЭШ на 30 мин в 4 ° C. Держите слайд в темноте.
- Добавить предварительно охлажденные нейтральных электрофореза буфер электрофореза слайд лотка, не превышает 0,5 см выше слайды (это зависит от размера единиц электрофорез), место слайды внутри и накрыть крышкой. Установите напряжение питания 1 V/см (длина между электродами) и запустить за 45 мин на 4 ° C.
- Стока избыточной буфер из слайдов. Аккуратно погрузите слайды в DPS 30 мин при комнатной температуре.
- Мягко погрузите слайды в 70% этанол 30 мин при комнатной температуре. Перейдите к шагу 4.
4. Пятно кометы слайды
- сухие слайды при 37 ° C на 10-15 мин в темноте.
- Место 50-100 мкл Зеленый флуоресцентный нуклеиновой кислоты окрашивание раствора на каждую сушеные агарозы и пятно на 15 минут при комнатной температуре в темноте.
- Кратко промыть слайды в dH 2 O и высушить полностью при 37 ° C в темноте. Перейти к захвата изображений и анализа.
5. Приобретения и анализ изображений
Примечание: визуализации и количественной оценки разрывы ДНК основаны на эпифлуоресцентного и программное обеспечение пробирного Комета (см. Таблицу материалы) 12 .
- Место слайды на микроскопе с слайд владельца. Убедитесь, что гель агарозы сталкивается с объектива. Случайно захватить изображения из окрашенных комета слайдов с помощью микроскопа флуоресценции с 10-кратным объектив. Избегайте края и в районах вокруг любых воздушных пузырьков. Хвост кометы
- обеспечить каждого распространяется по горизонтали. Комета головы должна исходить от слева и хвост справа.
- Сохранить каждое изображение в двоичном формате TIF с ярким пятном ДНК и темным фоном. Загрузить изображения с помощью программного обеспечения " выбрать файлы для анализа " кнопку, которая находится в левой части панели инструментов. Окно Просмотр изображения должен появиться ( рис. 1).
- Нарисовать рамку измерения на экране и отрегулировать его размер в соответствии с кометой ячейки. Нажмите кнопку " Настройка " кнопку, чтобы настроить порог головы, кометы, и хвост согласно изображение, а затем нажмите " начать измерения " кнопку ( рис. 1). Выберите ячейку с помощью рамы
- и активировать измерения, нажав мышью на " Assay комета " кнопку; интенсивности изображение показывает вверх на " профили " окно с параметрами выбранного измерения. Результаты могут быть сохранены, нажав " хранить результат " кнопку ( рис. 1).
Примечание: Программа вычисляет параметры, включая длину хвоста кометы, процент хвостатых ДНК, хвост момент (TM) и момент хвост оливкового (ОТМ). Моментов оперения рассчитываются по формулам как следовать:

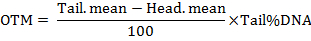
- анализ по крайней мере 50 ячеек за лечение.
Access restricted. Please log in or start a trial to view this content.
Результаты
Настоящий Протокол описывает шаг за шагом рабочего процесса для комета пробирного исполнения и анализа данных (рис. 1). Результаты анализов щелочных и нейтральных кометы показали, что хвост кометы доксорубицин лечение U251 клеток (1 мкм, 20 h) был длиннее и б...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Assay комета является эффективным инструментом для измерения одно и двухнитевые разрывы ДНК на клеточном уровне. Assay широко применяется как «золотой стандарт» в исследованиях о генотоксичности и биомониторинга13, начиная от базового поражений, сшивки ДНК, разработки лекарст...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Это исследование было поддержано интрамуральных исследовательской программы NIH, NCI и CCR. Все авторы получили интрамуральных исследовательский грант от НИЗ, NCI и CCR.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 10x PBS(Ca++, Mg++ free) | TEKnova | P0196 | |
| NaCl | Sigma | S5886 | |
| EDTA | TEKnova | E0308 | |
| Trizma base | Sigma | T1503 | |
| NaOH | Sigma | 72068 | |
| Sodium lauryl sarcosinate | Sigma | L7414 | |
| Triton X-100 | Sigma | 93443 | |
| Sodium acetate | Sigma | 32318 | |
| Glacial acetic acid | Sigma | 695092 | |
| Ammonium acetate | Sigma | A1542 | |
| SYBR Green | Invitrogen | S33102 | |
| Low melting point agarose | Invitrogen | 16520 | |
| Agarose | Invitrogen | 16500 | |
| 95% ethanol | WARNER-GRAHAM | #64-17-5 | |
| Trypsin | GIBICO | 25300-054 | |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Glass tissue slides | ELECTRON MICROSCOPY SCIENCES | 63422-11 | |
| Kimwipes | KIMberly-Clark | ||
| 1.5 mL Microcentrifuge Tubes | DENVILLE | ||
| Pipette Tips | SHARP | ||
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Microwave | Avanti | ||
| Waterbath | PRECISION | ||
| Horizontal electrophoresis chamber | TREVIGEN | Cometassay ES II | |
| Power supply | Bio-Rad | ||
| Incubator | Quincy Lab | Model 12-140E | |
| Fluorescent microscope | Zeiss | LSM700 | |
| Micropipettor | Eppendorf |
Ссылки
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem Biophys Res Commun. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 175 (1), 184-191 (1988).
- Tice, R. R., et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 35 (3), 206-221 (2000).
- Shah, A. J., Lakkad, B. C., Rao, M. V. Genotoxicity in lead treated human lymphocytes evaluated by micronucleus and comet assays. Indian J Exp Biol. 54 (8), 502-508 (2016).
- Azqueta, A., Collins, A. R. The essential comet assay: a comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 87 (6), 949-968 (2013).
- Goldstein, M., Kastan, M. B. The DNA damage response: implications for tumor responses to radiation and chemotherapy. Annu Rev Med. 66, 129-143 (2015).
- Gavande, N. S., et al. DNA repair targeted therapy: The past or future of cancer treatment? Pharmacol Ther. 160, 65-83 (2016).
- Torgovnick, A., Schumacher, B. DNA repair mechanisms in cancer development and therapy. Front Genet. 6, 157(2015).
- Weston, V. J., et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood. 116 (22), 4578-4587 (2010).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA Repair in Cancer: Beyond PARP Inhibitors. Cancer Discov. 7 (1), 20-37 (2017).
- Lu, Y., et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 77 (7), 1709-1718 (2017).
- Konca, K., et al. A cross-platform public domain PC image-analysis program for the comet assay. Mutat Res. 534 (1-2), 15-20 (2003).
- Valverde, M., Rojas, E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res. 681 (1), 93-109 (2009).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol Biotechnol. 26 (3), 249-261 (2004).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Sci Rep. 4, 7200(2014).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены