Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation In Vitro dommages à l’ADN à l’aide du test des comètes
Dans cet article
Résumé
Le test des comètes est une méthode efficace pour détecter les lésions de l’ADN dont l’ADN simple et double-brin se brise. Nous décrivons la comète neutres et alcalins des essais pour mesurer les lésions de l’ADN dans les cellules cancéreuses pour évaluer les effets thérapeutiques de la chimiothérapie.
Résumé
Dommages à l’ADN sont un phénomène commun pour chaque cellule pendant sa durée de vie et sont défini comme une altération de la structure chimique de l’ADN génomique. Les thérapies contre le cancer, tels que la radio - et chimiothérapie, introduisent une quantité énorme d’autres dommages à l’ADN, menant à l’arrêt du cycle cellulaire et l’apoptose pour limiter la progression du cancer. Évaluation quantitative des dommages à l’ADN au cours du traitement expérimental contre le cancer est une étape clé pour justifier l’efficacité d’un agent génotoxique. Dans cette étude, nous nous concentrons sur un essai d’électrophorèse unicellulaire, également connu sous le nom du test des comètes, qui permet de quantifier unique et ADN double-brin breaks in vitro. Le test des comètes est une méthode de quantification des dommages ADN qui est efficace et facile à exécuter, et a de faibles exigences de temps/budget et reproductibilité élevée. Ici, nous mettons en évidence l’utilité de l’essai de comet pour une étude préclinique en évaluant l’effet génotoxique de la polythérapie olaparib/témozolomide aux cellules de gliome U251.
Introduction
Le test des comètes a été tout d’abord développé par Ostling et Johanson en 1984 en démontrant que la migration de l’ADN de fragments de noyaux en vertu d’une condition neutre1. La technique a été développée plus tard par Singh et al., montrant qu’une condition alcaline a considérablement augmenté la spécificité et la reproductibilité du dosage2. Depuis lors, le test des comètes neutre est surtout utilisé pour détecter les cassures double brin d’ADN, alors que le test des comètes alcaline est plus sensible pour les petits montants de dommages à l’ADN, simples et doubles brins de l’ADN brise, sites alcali-labile, ADN ou ADN-protéines de réticulation et les cassures de l’ADN monocaténaire associées à l’excision incomplète réparation sites3,4. Les deux tests permettent la visualisation des fragments d’ADN et offrent un moyen simple d’évaluer quantitativement les dommages à l’ADN. Le test des comètes est considéré comme une méthode sensible pour des études toxicologiques in vitro et in vivo génétiques et s’applique à des domaines de recherche différents, tels que la sélection précoce de candidat-médicament, surveillance de l’environnement, la biosurveillance humaine, et aux droits fondamentaux dans les lésions de l’ADN de recherche et de réparation5.
Le principe de l’analyse est que dans un champ électrique, fragments d’ADN migre hors du corps de nucléoïde (également connu sous le nom la « tête de la comète ») et forment une tache d’ADN dans le gel d’agarose (également connu sous le nom la « queue de la comète »). Nucléotides de coloration, l’étendue des dommages à l’ADN peut être quantifié en analysant « comètes » formés par l’électrophorèse de cette cellule. Calcul du moment queue peut plus aider à comparer les dommages à l’ADN entre les différents groupes expérimentaux. Par rapport aux méthodes traditionnelles de détection des dommages de l’ADN, le test des comètes est directe, sensible, peu coûteux et relativement simple.
Radiothérapie et chimiothérapie est des stratégies communes pour le traitement du cancer en générant monocaténaire et ADN double brin ruptures dans les chromosomes6. La promotion récente en inhibiteurs de réparation de l’ADN permet un effet génotoxique plus efficace par la chimiothérapie de combinaison et donc potentiellement réduit les effets secondaires systémiques telles que l’anémie, infection et la moelle osseuse répression7, 8. dans la présente étude, nous avons montré l’enquête d’un inhibiteur de poly (ADP-ribose) polymérase (PARP), olaparib (Ola)9. PARP est une protéine nucléaire abondante et est responsable de la réparation d’excision de base de l’ADN en formant un polymère de poly (ADP-ribose)10. Témozolomide (TMZ) est un agent alkylant oralement disponible et a été largement utilisé pour le traitement des patients gliome. En utilisant le test des comètes pour quantifier les dommages à l’ADN, nous démontrons que combinant olaparib avec témozolomide profondément augmente les dommages à l’ADN dans les cellules de gliome, qui suggère la polythérapie olaparib/témozolomide est une stratégie efficace pour le traitement des gliomes, comparé avec le témozolomide seul11.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. préparer des réactifs
- 1 x PBS
- diluer à 100 mL de PBS 10 x avec 900 mL dH 2 O et ajuster le pH à 7.4 à l’aide d’un pH-mètre. Conserver à température ambiante.
- Solution de lyse (LS)
- préparer 2,5 M NaCl, EDTA de disodium de 100 mM, 10 mM Tris base et 200 mM NaOH dans 900 mL dH 2 O ; il prend généralement environ 20 min pour permettre le mélange dissoudre complètement. Ajuster le pH à 10 à l’aide d’un pH-mètre. Ajouter 1 % sodium lauryl sarcosinate et 1 % X-100 Triton et ajuster le volume final à 1 000 mL. Refroidir à 4 ° C pendant au moins 30 min avant utilisation.
- Solution alcaline électrophorèse (AES), pH > 13
- préparer 200 mM NaOH et 1 mM EDTA disodique dans 800 mL dH 2 O. ajuster le pH et assurez-vous qu’il s’agit de pH > 13. Ajuster le volume final à 1 000 mL. Faire des frais avant utilisation et refroidir à 4 ° C pendant au moins 30 min avant utilisation.
- Neutre électrophorèse sollution (NES)
- préparer 1 000 mL tampon d’électrophorèse neutre en mélangeant 100 mM Tris base et 300 mM de l’acétate de sodium à 1 000 mL dH 2 O. ajuster le pH à 9,0 avec l’acide acétique glacial. Refroidir à 4 ° C pendant au moins 30 min avant utilisation.
- Solution de précipitation d’ADN (DPS)
- préparation de 10 mL 7,5 M d’ammonium acétate stock. Pour 50 mL de solution de précipitation de l’ADN, mélanger 6,7 mL d’acétate d’ammonium 7,5 M avec 43,3 mL d’éthanol à 95 %. Conserver à température ambiante.
- Solution de coloration
- Ajouter 1 µL 10 000 x tache verte fluorescente d’acide nucléique (p. ex., SYBR Green) dans un tampon 30 mL Tris-EDTA (10 mM Tris-HCl, EDTA de disodium de 1 mM, pH 7,4) et magasin à 4 ° C. Protect de lumière.
- 1 % faible de fusion d’agarose
- faire fondre 1 % basse fusion point d’agarose (1 g dans 100 mL dH 2 O) dans un four à micro-ondes. Agiter l’agarose chaque 15-20 s pour s’assurer que l’agarose est complètement fondu. Placer l’agarose dans le bain-marie à 37 ° C pendant au moins 20 min avant utilisation.
- Pointes de pipette Préchauffez
- couper les extrémités étroites des pointes de pipette P200 de 3 mm et chaud à 37 ° C avant le pipetage agarose.
2. Préparer la comète glisse
- glisser le revêtement
- fonte agarose à 1 % (1 g dans 100 mL dH 2 O) dans un four à micro-ondes pendant 2-3 min ou jusqu'à ce que l’agarose est complètement fondu. Tremper les lames de microscope de verre dans l’agarose et essuyer un côté de la diapositive à l’aide d’un chiffon non pelucheux.
- Poser les lames sur une surface plane pour sécher ou chauffer à 50 ° C pour un séchage plus rapide ; un film transparent d’agarose doit être formé après le séchage. Déposer les lames revêtues à 37 ° C avant utilisation.
- Préparation des suspensions de cellules du même
- Culture et traiter les cellules de gliome
- Culture des cellules U251 MG dans un milieu DMEM-Ham F-12 additionné de 10 % FBS, 100 U/mL de pénicilline et 10 µg/mL de streptomycine à 37 & # 176 ; C avec 5 % de CO 2.
- Digérer les cellules à l’aide de la trypsine 1 mL pendant 3 min et neutraliser la trypsine, à l’aide de milieu DMEM-Ham F-12 avec FBS. Frais virés en tube de 15 mL, filer à 300 g pendant 4 min, aspirer le milieu et suspendre les cellules à 2 x 10 5 cellules/mL dans du PBS 1 x.
Remarque : L’exemple de la cellule doit être préparée immédiatement avant de commencer l’essai et tous les échantillons doivent être manipulés dans un environnement sombre ou grisé pour empêcher des dommages à l’ADN de la lumière. - Combiner la suspension cellulaire avec l’agarose à 1 % fondu bas point de fusion (à 37 ° C) à un ratio 01:10 (v/v) et mélanger doucement en pipettant également, Monte et descend immédiatement distribuer 30 µL sur une lame. Utilisez le côté de l’embout de la pipette pour étendre le mélange de gel d’agarose/cellule afin d’assurer la formation d’une mince couche.
- Mettre la lame plate à 4 ° C dans l’obscurité pour 10 min. augmenter le temps de gélifiant à 30 min améliore l’adhérence des échantillons dans des environnements de haute humidité.
- Plonger la lame à 4 ° C LS dans l’obscurité pendant 1 h à la nuit.
- Culture et traiter les cellules de gliome
3. Single Cell électrophorèse
- passer à alcaline (l’étape 3.2) ou comète neutre (étape 3.3) dosage
- pour le test des comètes alcaline
- retirer doucement les diapositives de la LS, égoutter l’excès de tampon et plonger doucement dans AES pendant 1 h à 4 ° C afin de permettre le déroulement d’ADN. Garder les lames dans l’obscurité.
- AES préalablement refroidi ajouter dans la barre de slide électrophorèse, n’excèdent pas 0,5 cm au-dessus de la glisse (cela dépend de la taille des unités électrophorèse), place de la glisse à l’intérieur et les recouvrir d’un chapeau. La valeur de la tension d’alimentation à 1 V/cm (la distance entre les électrodes) et courir pendant 30 min à 4 ° C.
- Solution d’électrophorèse excès drain de diapositive. Immerger doucement les lames deux fois en dH 2 O de 5 min chacun, à la température ambiante.
- Immerger doucement les lames dans l’éthanol à 70 % pendant 5 min à température ambiante. Passez à l’étape 4.
- Pour le test des comètes neutre
- retirer doucement les diapositives de la LS, égoutter l’excès de tampon et plongez doucement à NES pendant 30 min à 4 ° C. garder la lame dans l’obscurité. Tampon préalablement réfrigérées électrophorèse neutre
- Ajouter dans la barre de slide électrophorèse, n’excèdent pas 0,5 cm au-dessus de diapositives (cela dépend de la taille des unités électrophorèse), place de la glisse à l’intérieur et les recouvrir d’un chapeau. La valeur de la tension d’alimentation à 1 V/cm (la distance entre les électrodes) et faites fonctionner pendant 45 min à 4 ° C.
- Vidange excès de tampon de la glisse. Immerger doucement les lames de DPS pendant 30 min à température ambiante.
- Plonger doucement les lames dans l’éthanol à 70 % pendant 30 min à température ambiante. Passez à l’étape 4.
4. Tacher les diapositives de la comète
- sécher les lames à 37 ° C pendant 10-15 min dans le noir.
- Lieu 50-100 µL vert fluorescent acide nucléique coloration solution sur chaque séché agarose et tache pendant 15 min à température ambiante dans l’obscurité.
- Rincer les lames brièvement en dH 2 O et sécher complètement à 37 ° C dans l’obscurité. Procéder à l’acquisition d’images et analyse.
5. Acquisition et analyse d’images
Remarque : la visualisation et la quantification des cassures de l’ADN sont basées sur la microscopie à épifluorescence et le logiciel de test comète (voir Table des matières) 12 .
- Placez les glissières sur la loupe avec un support Dia. Assurez-vous que le gel d’agarose est face à l’objectif. Au hasard capturer des images de diapositives comète teinté à l’aide d’un microscope à fluorescence avec un objectif de 10 x. Éviter les bords et les zones entourant les bulles d’air.
- S’assurer que chaque queue de la comète est distribuée horizontalement. Têtes de comète doivent provenir de la queue de la droite et la gauche.
- Enregistrer chaque image dans un format binaire de TIF avec vif teinté d’ADN et le fond sombre. Charger des images dans le logiciel en utilisant le " sélectionnez les fichiers à analyser " bouton qui se trouve sur la gauche de la barre d’outils. Une fenêtre de vue image doit apparaître ( Figure 1).
- Dessiner un cadre de mesure sur l’écran et ajuster sa taille selon la comète de la cellule. Cliquez sur le " Adjust " bouton pour mettre en place le seuil de la tête, la comète et la queue selon l’image, puis cliquez sur le " commencer mesures " bouton ( Figure 1).
- Sélectionner une cellule en utilisant le cadre et activer la mesure en cliquant avec la souris sur le " la comète de dosage " bouton ; une intensité image apparaît sur le " profils " fenêtre avec les paramètres de mesure sélectionnée. Les résultats peuvent être sauvegardés en cliquant sur le " stocker résultat " bouton ( Figure 1).
Remarque : Le logiciel calcule les paramètres y compris la longueur de la queue de la comète, le pourcentage de l’ADN à queue, le moment de la queue (TM) et celui d’Olive queue (OTM). Les moments de la queue sont calculées par les formules comme suit :

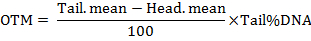
- analyser au moins 50 cases par traitement.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le présent protocole décrit un flux de travail étape par étape pour l’exécution de test comète et analyse de données (Figure 1). Résultats de dosages du comète alcalins et neutres ont montré que la queue de la comète de cellules d’U251 traités à la doxorubicine (1 µM, 20 h) était plus longue et a une plus forte intensité de l’ADN, ce qui suggère une accumulation importante de fragments d’ADN en raison de la chimiothérapie (
Access restricted. Please log in or start a trial to view this content.
Discussion
Le test des comètes est un outil efficace pour mesurer les cassures simples ou double brin de l’ADN au niveau cellulaire. L’essai a été largement appliquée comme un « étalon or » dans les études concernant la génotoxicité et biosurveillance13, allant des lésions base ADN crosslinks, développement de médicaments et sites sensibles d’alcali. Dans la présente étude, nous avons montré deux protocoles distincts d’étape par étape pour des dosages de comète neutres et alcalin...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par le programme de recherche intra-muros du NIH, NCI et CCR. Tous les auteurs provenant de subvention de recherche intra-muros NIH, NCI et CCR.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 10x PBS(Ca++, Mg++ free) | TEKnova | P0196 | |
| NaCl | Sigma | S5886 | |
| EDTA | TEKnova | E0308 | |
| Trizma base | Sigma | T1503 | |
| NaOH | Sigma | 72068 | |
| Sodium lauryl sarcosinate | Sigma | L7414 | |
| Triton X-100 | Sigma | 93443 | |
| Sodium acetate | Sigma | 32318 | |
| Glacial acetic acid | Sigma | 695092 | |
| Ammonium acetate | Sigma | A1542 | |
| SYBR Green | Invitrogen | S33102 | |
| Low melting point agarose | Invitrogen | 16520 | |
| Agarose | Invitrogen | 16500 | |
| 95% ethanol | WARNER-GRAHAM | #64-17-5 | |
| Trypsin | GIBICO | 25300-054 | |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Glass tissue slides | ELECTRON MICROSCOPY SCIENCES | 63422-11 | |
| Kimwipes | KIMberly-Clark | ||
| 1.5 mL Microcentrifuge Tubes | DENVILLE | ||
| Pipette Tips | SHARP | ||
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Microwave | Avanti | ||
| Waterbath | PRECISION | ||
| Horizontal electrophoresis chamber | TREVIGEN | Cometassay ES II | |
| Power supply | Bio-Rad | ||
| Incubator | Quincy Lab | Model 12-140E | |
| Fluorescent microscope | Zeiss | LSM700 | |
| Micropipettor | Eppendorf |
Références
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem Biophys Res Commun. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 175 (1), 184-191 (1988).
- Tice, R. R., et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 35 (3), 206-221 (2000).
- Shah, A. J., Lakkad, B. C., Rao, M. V. Genotoxicity in lead treated human lymphocytes evaluated by micronucleus and comet assays. Indian J Exp Biol. 54 (8), 502-508 (2016).
- Azqueta, A., Collins, A. R. The essential comet assay: a comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 87 (6), 949-968 (2013).
- Goldstein, M., Kastan, M. B. The DNA damage response: implications for tumor responses to radiation and chemotherapy. Annu Rev Med. 66, 129-143 (2015).
- Gavande, N. S., et al. DNA repair targeted therapy: The past or future of cancer treatment? Pharmacol Ther. 160, 65-83 (2016).
- Torgovnick, A., Schumacher, B. DNA repair mechanisms in cancer development and therapy. Front Genet. 6, 157(2015).
- Weston, V. J., et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood. 116 (22), 4578-4587 (2010).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA Repair in Cancer: Beyond PARP Inhibitors. Cancer Discov. 7 (1), 20-37 (2017).
- Lu, Y., et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 77 (7), 1709-1718 (2017).
- Konca, K., et al. A cross-platform public domain PC image-analysis program for the comet assay. Mutat Res. 534 (1-2), 15-20 (2003).
- Valverde, M., Rojas, E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res. 681 (1), 93-109 (2009).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol Biotechnol. 26 (3), 249-261 (2004).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Sci Rep. 4, 7200(2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon