Method Article
Dijital polimeraz zincir reaksiyonu tahlil için tüp içinde çip biçimini kullanarak bir sporadik ailesel Adenomatous poliposis hastada genetik varyasyon
Bu Makalede
Özet
Dijital polimeraz zincir tepkimesi (PCR) Tek nükleotid türevleri ve DNA kopyalama numara türevleri yüksek-duyarlı tespiti için yararlı bir araçtır. Burada, biz insan genomu digital PCR ile tüp içinde çip biçimini kullanarak nadir versiyonlarında ölçmek için kritik noktalar göstermek.
Özet
Kantitatif analiz insan genetik varyasyon tümörleri gibi ciddi tıbbi durumlar moleküler özelliklerini anlamak için önemlidir. Dijital polimeraz zincir reaksiyonları (PCR) kesin miktar DNA kopyalama numara versiyonlarının etkinleştirmek çünkü onlar gibi ilaca dirençli mutasyonlar nadir genetik varyasyonları tespit için gerekli bir araç gelmektedir. Moleküler tanı dijital PCR (dPCR) kullanarak yakın gelecekte klinik uygulamada kullanılabilir olmasını bekleniyor; Böylece, nasıl verimli bir şekilde dPCR insan genetik malzeme ile yapmak için sıcak bir konudur. Burada, aynı anda yapılacak sekiz dPCR tepkiler veren tüp içinde çip biçimine ile dPCR kullanarak Adenomatous poliposis coli (APC) somatik mozaizm algılamak için bir yöntem tanıtmak. Doldurma ve mühürleme tepki karışımı fişleri üzerinde zaman özen gösterilmelidir. Bu makalede, aşırı ve küçümseme olumlu bölümlerinin önlemek gösterilmiştir. Ayrıca, biz dPCR ürün--dan bölme sonra belirli amplifikasyon onaylamak için kullanılan fiş üzerinde toplamak için basit bir yordam mevcut. Biz bu yöntemleri rapor genetik araştırma tüp içinde çip yöntemiyle dPCR teşvik yardımcı olacağını umuyoruz.
Giriş
Kantitatif PCR (qPCR) sık sık tek nükleotid türevleri (SNVs) de dahil olmak üzere insan genetik varyasyon ve DNA kopyalama numara varyasyonları (CNVs) ölçmek için kullanılır. QPCR, bir polimeraz tepki geleneksel son nokta PCR olduğu gibi aynı şekilde her tüpün içinde gerçekleştirilir ve bir güçlendirme sinyali tüp sizden her termal döngüsü sonra kazanılır. Buna karşılık, dPCR, son nokta dPCR bu raporda anlam PCR karışımı birçok mikroskobik chambers, bölümleri olarak adlandırdığı yüklendiği, DNA şablonları olduğu mevcut veya sınırlayıcı bir seyreltme ve her bölüm içeren PCR karışımı olarak değerlendirilir mi yok negatif veya pozitif tam PCR sonra. Negatif bölümlerinde DNA şablon yok olduğunu tahmin etmek kolay olmakla birlikte, DNA şablonları kaç kopya olumlu bölümlerinde bulunan belli değil. Bu nedenle, DNA şablon olumlu bölümleri sayısı negatif bölümleri1count kullanarak Poisson dağılımı dayalı tahmin edilmektedir. dPCR daha pahalıdır ve bir daha küçük dinamik alan qPCR için karşılaştırıldığında, ancak bu yöntem mutlak bir miktar sağlar ve daha yüksek hassasiyet ve daha hassas2sunar.
DPCR ana uygulamaların yeni nesil sıralama (NGS) tarafından tanımlanan türevleri doğrulama olduğunu. Özellikle nadir türevleri durumunda anlamı düşük varyant kesirler, doğrulama NGS3' te ortaya çıkabilecek sıralama hataları nedeniyle önemlidir. Süre Sanger sıralama ve qPCR SNVs ve CNVs doğrulama için yararlı araçlar, onların duyarlılığı düşük dPCR için karşılaştırılır. Bu nedenle, dPCR nadir türevleri ile ilgili genetik çalışmalar için talep teknolojisidir. Son zamanlarda, nadir türevleri ilaç direnci gibi kanser özellikleri ile ilgili sıvı biyopsi tarafından tespiti moleküler tanı ve tedavisi4bir konu olmuştur. DPCR teknoloji sıvı biyopsi çalışmaları için uygun görünür ve önemli klinik uygulamaları yakın gelecekte, her ne kadar geliştirmeleri dinamik alanı ile ilgili ve maliyet yine uygulanması gerekir olması beklenir.
Piyasada bulunan dPCR teknoloji kabaca damlacık ve çip tabanlı platformlar sınıflandırılabilir; fark DNA şablonları bölümlenmiş5,6,7böyledir işte. Tüp içinde çip biçimiyle dPCR içinde PCR karışımı bir yonga üzerinde bölümlere kılcal eylem tarafından dağıtılır. Fişleri hangi birçok laboratuar personel zaten aşina olacak, sekiz-tüp şeritler içinde yerleşiktir ve böylece, sekiz örnekleri bir saat8' de tedavi edilebilir. Okuma adımda bu çip ve değil her bölümünün resmin tamamını algılayarak 96 örnekleri tedavisi için 1 < h alır. DPCR tüp içinde çip biçimi ile diğer dPCR sistemleri ile karşılaştırıldığında yüksek üretilen iş olduğundan, kullanılabilirlik ve verimlilik kullanıcıları için önemli avantajlar vardır.
Bu raporda, bir hastada sporadik ailesel adenomatous poliposis ile APC gen somatik mozaizm temsilcisi bir olgu olarak kullanılır ve dPCR ve NGS sonuçları karşılaştırılır. Bu raporu temel amacı açıkça dPCR ile tüp içinde çip biçimini kullanarak bir tek nükleotid değişken ölçmek etmektir. Bu rapor araştırmacılar kendi çalışmaları için dPCR platform onaylanmasında baktılar için yararlı olduğunu umuyoruz.
Protokol
Çalışma tasarım Hamamatsu Üniversitesi Tıp Fakültesi (G-260-4) kurumsal inceleme kurulları tarafından kabul edildi. Yazılı aydınlatılmış onam, hasta ve ailesi elde edildi.
1. kalite kontrol genomik DNA'ın
Not: Genomik DNA (gDNA) köklü silis-zar bazlı DNA arıtma yöntemini kullanarak periferik kandan ayıklandı. Öncesinde, yordamlar, bir spektrofotometre kullanarak gDNA konsantrasyonu tespit edildi.
- GDNA örneği 10-100 ng/µL bir konsantrasyon'hazırlayın.
- 10 µL DNA örnek arabelleği bir 8-boru striptiz kulübüne ekleyin.
- DNA merdiven veya gDNA 1 µL tüpler için ekleyin. Girdap karışımı 1dk Mikroplaka eki kullanarak için.
- Tüp, jel aygıt ve pipet ipuçları içine belgili tanımlık Elektroforez enstrüman (Malzemeler tablo) ve Başlat Çalıştır "Başlat" düğmesine basarak yük.
Not: Elektroforez sistemi otomatik olarak bir tıkırtı üstünde başlamak düğme ile faaliyet gösterecek. - DNA örneği arabellekte bulunan alt işaret electropherograms üzerinde doğru olarak atanır onaylayın. Yanlış atanırsa, el ile 'Electroherogram modu' yazılım işaretleyicisinde atayın.
Not: DNA bütünlük numarası (DIN) otomatik olarak hesaplanır. DIN değer DNA bütünlük gelir. Yüksek ve düşük DIN değerleri sırasıyla gDNA, son derece sağlam ve güçlü bozulmuş gösterir. - Bölge modu'gDNA (> 200 bp) boyutu bölge otomatik olarak gDNA (> 200 bp) konsantrasyonu hesaplamak için yazılımı türü belirtin.
2. astar ve sonda tasarım
- Aşağıdaki koşullar altında herhangi bir açık erişim aracını kullanarak erime sıcaklık (Tm) değerlerini hesaplamak: 10-25 üsleri, 50 mM Na+/K+, 0.80 mM dNTPs ve 3 mM Mg2 + (Malzemeler tablo). Tm değeri yaklaşık 60 ° C ve 100 – 300 bp, amplicon uzunluğu ile hedef gen içeren genomik bölge yükseltmek için ileriye ve geriye doğru astar tasarım.
Not: Oligonucleotides konsantrasyon için Tablo 1 ' e bakın. - Kilitli nükleik asit (LNA) probları için başvuru ve değişken gen tasarım aşağıdaki koşullara dayalı: (i) 1-6 eskimiş mevcut her sonda; (ii) bir floresan boya ve bir içki 5' mevcut- ve 3'-terminuses her inceleyebilirsek, sırasıyla; (III) > 10 ° C uyumlu ve uyumsuz probları Tm değerleri arasında fark vardır; (iv) Tm uyumlu ve uyumsuz probları değerleri daha yüksek ve astar, onlardan daha düşük sırasıyla [Örneğin, ileri astar: 60.8 ° C, ters astar: 59.8 ° C, başvuru alleli sonda (eşleşen/eşleşmeyen): 62.6/45.3 ° C, varyant alleli sonda (eşleşen/eşleşmeyen): 61.7/50.5 ° C]. Tm değerleri de adım 2.1 için kullanılan açık erişim aracı kullanılarak hesaplanır.
- Tasarlanmış astar ve sondalar veritabanlarından [Örneğin, tek nükleotit polimorfizmi veritabanı (dbSNP)] belirlenen > %0,1 frekans ile Tek nükleotid polimorfizmleri kapsayacak değil emin olun.
3. dijital PCR
- Astarlar, sondalar ve Tablo 1 ' de TE arabellek ile açıklanan konsantrasyonlarda gDNA hisse senedi çözümleri hazırlamak ve stok onları -20-4 ° C.
-
Son bir konsantrasyon için 15 µL toplam hacmi içinde oda sıcaklığında reaktifleri Tablo 1'de açıklandığı gibi karıştırın.
- 3 µL distile su gDNA yerine bir no-şablonu denetimi (NTC) ekleyin.
- 3.5 x nüsha pipetting hata için hesap PCR karışımı miktarı hazırlayın.
- Yukarı ve aşağı karıştırmak için PCR karışımı pipette.
- 8-boru şeridi'nde inşa fiş üzerine yükleme platformu ayarlayabilirsiniz ve onları üzerinde otomatik yükleyici. Çip ve yükleme platformu arasında bir kişi olduğundan emin olun.
- Bir yükleme kaydırıcı platformda uygun ve kaydırıcıyı Kapalı yükleyici tıpa ile tutun.
- Kaydırıcıyı (Şekil 1A) ucuna yakın platformda PCR karışımı 15 µL pipet.
- Yükleyici yükleyici (yaklaşık 1 dakika) düğmesini tıklatarak çalıştırın.
Not: PCR karışımı küçük bir miktar platformda devam ederse bu bir sorun değil. Sırayla yükleyiciyi yeniden çalıştırın mümkündür. - Chip-içinde-a-PCR karışımı mühürleme artırıcı yan yuvası ile dolu tüp ayarlayın. Slayt kapak ve üst kapak kenarı değil ara belgili tanımlık küçük parça (Şekil 1B) itin.
- Mühürleme artırıcı (yaklaşık 2 dk) çalıştırın. Tamamlanmamış bir sızdırmazlık çapraz bulaşma (rakamlar 1 c ve 1 D) olumlu sinyallerin nedeniyle sıvı birikintisi hala görünür durumdaysa sırayla 1 dk. için mühürleme artırıcı yeniden çalıştırın.
- Sızdırmazlık sıvısı, tüpler için yağ bazlı bir reaktif 230 µL ekleyin.
Not: Fişleri Şimdi sıvı dalmış. - Tüpler içinde termal cycler ayarlayın. Termal cycler (yaklaşık 2 h için) Tablo 2 ' de açıklandığı gibi çalıştırın. Pozitif bölümleri (Şekil 1E) dengesiz dağılımı ise sıcaklık veya PCR süresi ayarlamak.
Not: Bu rampa oranı yaklaşık 1 olarak ayarlamak için tavsiye edilir ° C/s. - Tüpler temel gürültüyü azaltmak için termal cycler içinde en az 15 dakika bırakın.
Not: Tüpler gecede de bırakılabilir. Floresan sinyallerini bile ertesi gün tespit edildi. - Tüpler algılama jig ayarla ve 6 mL distile su jig dökün. Hava kabarcıkları içindeki ve dışındaki tüpler görünür durumdaysa, onları (rakamlar 1F ve 1 G) temizleyin.
- Jig dedektörü yükleyemez ve çalıştıramaz o ile a tıkırtı belgili tanımlık bilgisayar yazılımı üstünde belgili tanımlık "koşmak" düğme Fluorescene, deney ve örnek/NTC sekmeleri (Tablo reçetesi) seçimden sonra.
Not: Varsayılan yoğunluğu ile sekiz örnekleri çift renk tespiti yaklaşık 4-5 dakika sürer. - Pozisyon arsa, çubuk grafik ve 2D dağılım çizim onaylayın.
Not: IIf negatif bölümleri floresan yoğunluğu yüksek, 30-70 aralığında düşüyor yoğunluğu Yazılım Ayarları düğmesinin tıklatılması ile ayarlayın. - Varyant alleli kesir (VAF) aşağıdaki formülü kullanarak hesaplar:
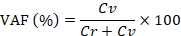
Burada, Cv ve Cr sırasıyla varyant ve referans gen kopya numaraları vardır.
Not: Poisson istatistik dayalı yazılım programında otomatik olarak hesaplanır.
4. PCR ürünü topluluğu
- Sızdırmazlık sıvısı tüpünden kaldırın.
- 100 µL TE tampon tüp ekleyin. 30 s ve kısaca santrifüj tüpü için şiddetle girdap.
- TE çözüm için başka bir tüp aktarmak ve 3 M sodyum asetat 30 µL ve etanol 200 µL ekleyin.
- -20 ° C'de çözüm gecede serin.
- Belgili tanımlık eriyik için 16.000 x g de 30 dk santrifüj kapasitesi ve süpernatant kaldırın.
- 300 µL % 80 etanol tüp ve girdap ekleyin.
- Çözüm için 16.000 x g de 15 dk santrifüj kapasitesi ve süpernatant kaldırın. Çökelti 5 min için kurumasını sağlar.
- 1 – 5 µL TE arabelleği çökelti air-drying sonra geçiyoruz.
- Gerekirse, adım 1 referansla Elektroforez enstrüman kullanarak ürün boyutunu değerlendirmek. 1 µL çözüm için yüksek hassasiyet (Tablo reçetesi) jel cihaza yükleyin.
Sonuçlar
Biz yukarıda açıklanan yordamlara göre belirleme yapılacağı sporadik ailesel adenomatous poliposis olan bir hastada APC gen somatik mozaizm gözden. Bir önceki çalışma, APC c.834 + 2T > C mutasyon bulundu hasta ama değil velileri Sanger kullanarak, sıralama ve NGS9. Astar ve sondalar temsilcisi sonuçlarında kullanılan tasarımların Tablo 3' te gösterilmektedir. Genomik DNA proband, veliler ve altı sağlıklı bağış kandan ayıklandı. -E doğru 6,7-7,9 (Şekil 2 ve Tablo 4) arasında değişiyordu dokuz gDNA örnekleri DIN değerleri. FAM ve HEX floresan boyalar sırasıyla C ve T gen için kullanılmıştır. Pozisyon araziler yeşil ve sarı lekeler FAM-pozitif ve HEX-pozitif bölümleri, sırasıyla temsil eder (Şekil 3A). Mavi lekeler FAM ve HEX için negatif bölümleri temsil eder. Siyah arka plan burada reaksiyon karışımı değil eklendi bölümleri için karşılık gelir. C ve T allelleri birçok olumlu bölümleri proband, C alleli kaç olumlu bölümlerini proband'ın babası veya NTC tespit edildi ve T ikinci, pozitif bölümlerinde alleli algılandı değil sırada algılandı. C ve T alelleri arasında sinyal ayrılık iki boyutlu (2B) scatterplot açıktı ve HEX ve FAM en olumlu sinyaller birbirlerine hariç (Şekil 3B) idi. NGS (% 12,7) kullanarak kararlı benzer olduğu % 13.2, proband, VAF yapıldı (Tablo 4). Proband'ın anne ve sağlıklı bağış VAFs < %0,1 idi. APC c.834 + 2T için algılama sınırı > C mutasyon %0,3 Toplam gDNA1010 – 11 ng ile tekrarlanan ölçüler için 3 x standart sapmayı kullanarak tahmini.
APC c.834 + 2T için dPCR tahlil amplicon boyutunda > C 123 olmak tahmin bp. DPCR ürün tek bir bant güçlendirilmiş doğrulamak için dPCR ürün bölümü küçük parça--dan toplanmıştır. Elektroforez kullanarak, tek bir bant açıkça tespit edildi ve ürün boyutu tahmin (Şekil 4) ile tutarlı.
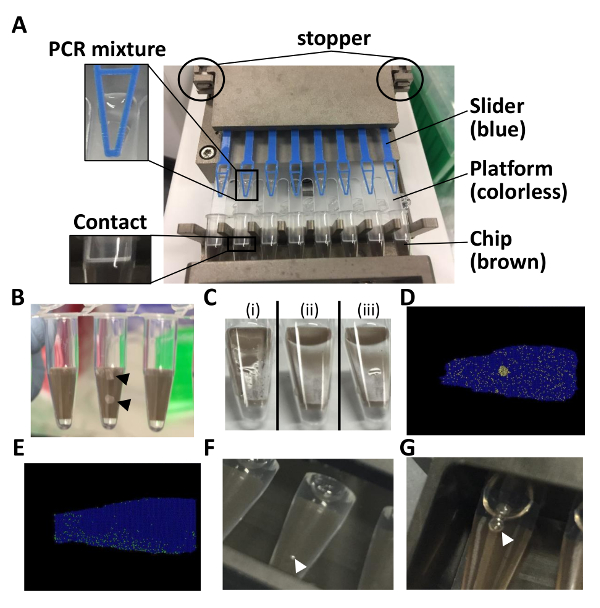
Resim 1 : Tüp içinde çip biçimiyle dPCR tahlil için dikkat edilmesi gereken noktaları. (A) Bu panel 8-boru şeridi'nde otomatik yükleyici kurmak nasıl gösterir. (B) Bu panel kırık cips gösterir. (C) Bu panel nasıl çip hemen sonra (ı) ve (ii) mühürleme yüzeyler gösterir. (III) sıvı su birikintisi eksik bir sızdırmazlık söz konusu olduğunda görünür. (D) Bu panel çapraz bulaşma durumunda pozisyon Arsa gösterir. (E) Bu panel pozisyon Arsa durumunda düzensiz bir dağılım gösterir. (F) Bu panel gösterir nasıl kabarcıklar suya batırma tüp yüzeyinde hava. (G) Bu panel tüp içinde hava kabarcıkları gösterir. Tüm şekil boyunca siyah ve beyaz ok uçları kırık yonga parçaları belirtmek ve hava kabarcıkları, anılan sıraya göre. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
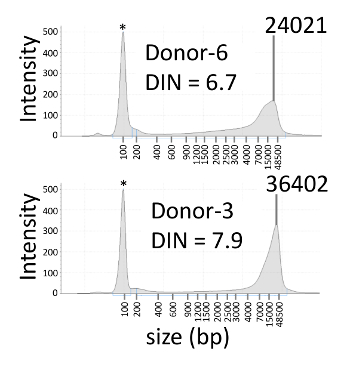
Resim 2 : Kan gDNA temsilcisi electropherograms. Kan gDNA Electropherograms 6,7 ve 7,9 DIN değerleri ile üst ve alt paneli, sırasıyla gösterilir. Yıldız işareti daha düşük bir işaretleyici gösterir. DIN: DNA bütünlük numarası. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
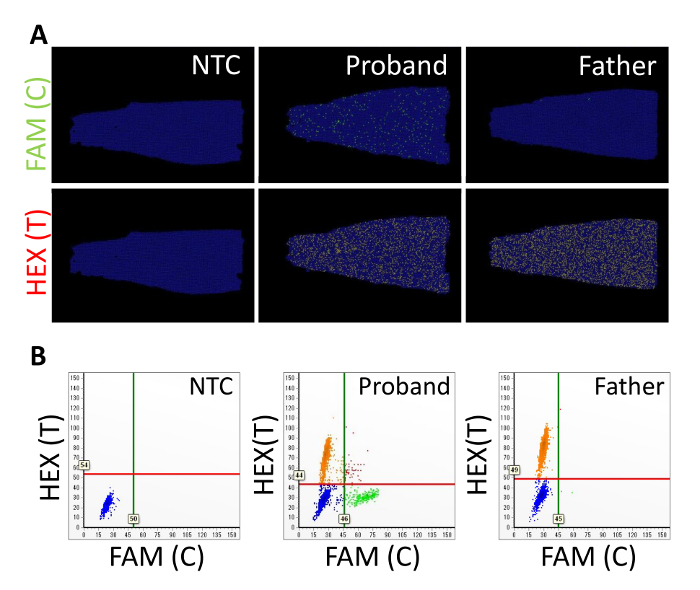
Şekil 3 : DPCR ile tüp içinde çip biçimini kullanarak APC somatik mozaizm temsilcisi sonuçlarını. (A) pozisyon çizer ve (B) scatterplots no-şablonu denetim (NTC), proband ve babası burada gösterilir. Başvuru ve değişken gen için sırasıyla HEX ve FAM karşılık gelir. Dikey ve yatay çizgiler sırasıyla HEX ve FAM yoğunluklarını, eşikleri belirtin. Bu rakam Kahyo ve ark. değiştirildi 10. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
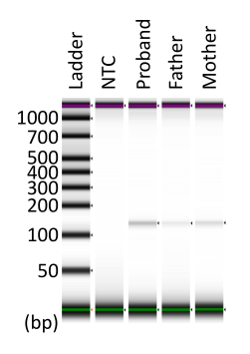
Şekil 4 : Koleksiyon bölümü çip urun dPCR. Toplanan ve konsantre dPCR ürünleri Elektroforez için tabi tutuldu. Öngörülen hedef boyutu 123 oldu bp. Bu rakam Kahyo ve ark. değiştirildi 10. NTC: Hayır-şablonu denetim. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Reaktif | Konsantrasyon hisse senedi çözümü | Birim (μL) | Son konsantrasyonu | Önerilen Son konsantrasyonu |
| DNaz/RNase-Alerjik distile su | - | 1.75 | - | - |
| 2 x PCR Master mix | - | 7.5 | - | - |
| Büyük alleli LNA prob | 2 MİKRON | 0,5 | 66,7 nM | 3,33 – 100 nM |
| Küçük alleli LNA prob | 2 MİKRON | 0,5 | 66,7 nM | 3,33 – 100 nM |
| İleri astar | 1 MİKRON | 0,5 | 33,3 nM | 3,33 – 50.0 nM |
| Ters astar | 1 MİKRON | 0,5 | 33,3 nM | 3,33 – 50.0 nM |
| 20 x dPCR çözüm | - | 0,75 | - | - |
| gDNA | 3.33 ng/μL | 3 | 666 pg/μL | 20 pg/μL – 2.000 pg/μL1 |
Tablo 1: dPCR tahlil için kullanılan reaktifler. 1 Beklenen hassas ve duyarlı bağlı olarak.
| Adım | Sıcaklık | Zaman | Döngüleri |
| İlk denatüre | 95 ° C | 5 m | 1 |
| Denatüre Tavlama ve uzantısı | 95 ° C 58 ° C | 50 s 90 s | 42 |
| Son uzantısı | 70 ° C | 5 m | 1 |
Tablo 2: Termal cycler koşulları.
| Adı | Sıra1 | Tm değer2 |
| İleri astar | 5'-GGTCAAGGAGTGGGAGAAATC-3 ' | 60.8 ° C |
| Ters astar | 5'-TCTTAGAACCATCTTGCTTCATACT-3 ' | 59.8 ° C |
| T alleli LNA prob | 5'-HEX-ATTT [A] CCTGACCA-IBFQ-3' | Bahisler: 62.6 ° C Uyumsuz: 45,3 ° C |
| C alleli LNA prob | 5'-FAM-TTT [G] CCTGACC-IBFQ-3' | Bahisler: 61,7 ° C Uyumsuz: 50,5 ° C |
Tablo 3: astar ve sondalar tasarımına. 1 Altı çizili ve bracketed LNA ve hedeflenen varyant, sırasıyla harflerdir. 2 Adım 2 protokol göre hesaplanır.
| NGS3 | dPCR4 | |||||||
| Örnek1 | Doku | Giriş DNA (ng) | DIN2 | VAF (%) | Varyant (kopya) | Başvuru (kopya) | VAF (%) | |
| Demek | RSD | |||||||
| NTC | - | - | - | - | 1.23 | 0 | N/A | N/A |
| Proband | Kan | 11,3 | 7,6 | 12,7 | 379 | 2,48 x 103 | 13,2 | 0.0353 |
| Baba | Kan | 10.3 | 7,7 | değerinin 0,0167 | 1,08 | 3.42 x 103 | 0.0341 | 0.439 |
| Anne | Kan | 10,8 | 7,6 | 0.0136 | 0.956 | 3,04 x 103 | 0.0313 | 0.637 |
| Donör-1 | Kan | 11,7 | 7.3 | - | 1.64 | 3.01 x 103 | 0.0543 | 0.414 |
| Donör-2 | Kan | 10,5 | 7,6 | - | 1.06 | 2,90 x 103 | 0.0406 | 0.539 |
| Donör-3 | Kan | 17,6 | 7.9 | - | 4.24 | 5.65 x 103 | 0.0713 | 0.783 |
| Donör-4 | Kan | 12,3 | 7,6 | - | 2.38 | 4.16 x 103 | 0.0666 | 0.557 |
| Donör-5 | Kan | 19,2 | 7 | - | 1.48 | 6,79 x 103 | 0.0213 | 0.571 |
| Donör-6 | Kan | 14,4 | 6,7 | - | 3,44 | 4,67 x 103 | 0.0728 | 0.729 |
Tablo 4: dPCR sonuçlarını tahlil için APC somatik mozaizm. 1 NTC: Hayır-şablonu kontrolü; Bağışçı: sağlıklı donör. 2 DIN: DNA bütünlük numarası. 3 Iwaizumi vd. 9, hum genom Var. 2 15057 (2015). 4 Deneyler onaylatılacak ve bağımsız olarak tekrar tekrar 3 x çalıştırılan; verileri ortalama değeri ifade edilir; MSB: göreli standart sapma; N/A: geçerli değil. Tablo Kahyo ve ark. değiştirildi 10.
Tartışmalar
GDNA gelişmiş bir bozulma düşük kaliteli verilerinin yol açabilir çünkü DIN değeri çoğunlukla miktar veya sıralama, önce hasarlı DNA (Örneğin, gDNA formalin sabit parafin gömülü dokusundan) değerlendirmek için kullanılır. Böylece, DIN değerlendirme insan gDNA11kalite kontrol önemli bir adım oluyor. Bu yana temsilcisi deneyde kullanılan gDNA 4 ° C'de kan onun çıkarma sonra 4-11 yıl saklanan, onun DIN değerleri dPCR tahlil önce kalite kontrol için belirlenmiştir. Bu adım özellikle önerilir Eğer malzemelerin hasar görmüş gibi şüphelisiniz. GDNA konsantrasyonu da Elektroforez tarafından tespit edilmiştir. DPCR dinamik aralığını qPCR bölümleri sınırlamaları nedeniyle gelince kadar geniş olmadığı için gDNA konsantrasyonu ölçümü başarılı dPCR tahlil için önemli bir adımdır. DNA dPCR tahlil varyant ve başvuru allelleri toplam kopya sayısı ile ilişkili giriş miktarı olarak (R-kare = 0.935; Tablo 4), Elektroforez gDNA konsantrasyon dPCR tahlil önce ölçmek için yararlıdır.
Yükleme ve süreçleri mühürleme başarılı sonuçlar için önemli adımlardır. Uygun montaj platformunda PCR karışımı onaylayın ve çip ve platform (Şekil 1A) arasında temas sağlamak çok önemlidir. Kaydırıcıyı PCR karışımı çıkıntı geçersiz dağıtım çip. neden olabilir Poisson istatistiklere DNA şablonları rastgele chambers1bölümlendirilir kabul edilir bir pozisyon arsa üzerinde olumlu ve olumsuz bölümleri dağıtım teyit de hassas bir analiz için gerekli çünkü. Temsilcisi sonuçlarda olumlu bölümleri çip (Şekil 3) dağıtıldı. Bu sonucu Poisson istatistikleri gereksinimini karşılayan ve yükleme ve yordamlar mühürleme etkili olduğunu yansıtır. Üst kapak orta bölümünü de kuvvetle itilir tüpler mühürleme artırıcı ayarlarken, çipler kırık olabilir (Şekil 1B). Bunu önlemek için üst kapak kenarını hafifçe itin. Pozitif bölümleri (Şekil 1D) yapay bir küme varsa, kopya numarası bölümleri arasında bir çapraz bulaşma nedeniyle abartmış. Bir su birikintisi bir sıvı (Şekil 1C) yüzeyinde görünür durumdaysa mühürleme işlemi geliştirilmiş (sırayla 1 dk. için mühürleme artırıcı yeniden çalıştırmadan tarafındanÖrneğin,). Pozitif bölümleri (Şekil 1E) dengesiz dağılımı ise, kopya sayısı yetersiz amplifikasyon ya da mühürleme sıvı ve su kirlenmesi nedeniyle hafife. PCR koşulları bu durumda [Örneğin, sıcaklık veya PCR (adım 3.11 Protokolü) süresi ayarlama veya sızdırmazlık sıvısı ve su jig dökülür temiz sağlama] ayarlanmalıdır. Floresan sinyallerini distile su içinde dalmış 8-boru şerit üzerinden tespit edilir. Hava kabarcıkları boru yüzey için uygun ise olasılığını onlar sinyal algılama (Şekil 1F) ile girişime neden olabilir. Bu nedenle, kabarcıklar iyi pipet ucu gibi bir araç kullanarak temizlenmiş olmalıdır. Ayrıca, jig (Şekil 1G) ayarladığınızda hava kabarcıkları tüpler içinde oluşabilir. Tüpler içinde baloncuklar çip karşılamak için yeterince büyük ise, onlar da temizlenmiş olmalıdır. Oda sıcaklığında birkaç dakika bırakılırsa baloncuklar temizleyebilirsiniz.
Olumlu bazı bölümleri NTC algılanması. DNA şablonları kirlenmesini önlemek için tezgah temiz tutmak ve eğer mümkünse, bir fan filtre ünitesi ile temiz yer açın. DNA şablonları bir kirlenme şüphesi varsa, iyice alanı temizlik ve/veya kullanılan reaktifler atmak. Başvuru alleli olumlu bölümlerini gDNA huzurunda tespit değil varsa, buna karşılık, gDNA, astar ve sondalar konsantrasyonları teyit. Özellikle, astar, geleneksel PCR (Tablo 1)12' ye göre temsilcisi deneyinde düşük yoğunluklu kullanılmıştır. Nadiren geleneksel PCR değiştirilmez rampa oranı onaylamak önemlidir.
DPCR tüp içinde çip biçimiyle benzersiz kılan evrensel 8-boru şerit8,13içinde PCR karışımı bölümleme olur. Bölümleme chambers transfer PCR tüp içine böylece kirlenme riski azaltarak bu sistemde gerekli değildir. Orada da tüp içinde çip biçimi dPCR sistemiyle bir avantaj olduğunu; Bu deneyleri, damlacık tabanlı dPCR14aynı sayıda bitirmek için en az 5 h alır iken 96 deneyleri o dPCR sisteminde, bitirmek için 4 < h alır. Ayrıca, evrensel 8-boru striptiz aksine düz bir blok ile termal cycler gerektiren başka bir çip tabanlı dPCR15, geleneksel bir termal cycler kullanımını etkinleştirir. Ayrıca, bilgi birikimi ve geleneksel PCR kimyasalları dPCR sisteme uygulanır. Bu dPCR uygulamaları genişletilmesi için yardımcı olabilir.
Bu o dPCR bazı sınırlamaları vardır belirtilmelidir. Tüp içinde çip biçimiyle dPCR içinde çip bölüm numarasını bu diğer dPCR platformları ile karşılaştırıldığında nispeten azdır. Çip aygıt için daha fazla geliştirme bölümleri sayısına bağlıdır dinamik aralığı artırmak için gereklidir. Evrensel tüpün iç alanı sınırlı olduğundan, çip aygıt için bir atılım tasarım bölüm sayısını artırmak için gereklidir. Otomasyon tüm dPCR yordam gelecekte insan hatası, daha güvenilir sonuçlar elde büyük ölçüde azaltacaktır. Yüksek performans ve yüksek-duyarlı doğası nedeniyle, tüp içinde çip biçimiyle dPCR sıvı biyopsi ve çevre DNA örnekleri bir dizi tedavi uygulanması bekleniyor.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu çalışma için--dan Japonya toplum için promosyon, bilim (JSP'ler) (No 15 K 08397) Scientific Research (C) Tomoaki Kahyo için bir Grant-in-Aid ve tıbbi araştırma ve geliştirme (AMED) (No. 927960719), Japonya Ajansı gelen hibe tarafından desteklenmiştir Grant-in-Aid araştırmacı araştırma (No. 16K 15256), bir Ulusal Üniversitesi Reform yönetim giderleri hibe (No. 1019253) ve sigara Araştırma Vakfı'na tanıtımı için bir teşvik özel bütçesinin ilişkilendirilmiş projeler için harcama Haruhiko Sugimura. Yazarlar Dr. Iwaizumi ve Dr. Kurachi klinik onların destek için teşekkür ederiz. Fon yazının hazırlanmasında herhangi bir rolü yoktu. Şekil 3, Şekil 4ve Tablo 4 uyarlanmış ve bir makale Kahyo vd tarafından yeniden basıldı. 10, Elsevier izniyle.
Malzemeler
| Name | Company | Catalog Number | Comments |
| QIAamp DNA Blood Maxi Kit | Qiagen | 51194 | Before Protocol 1: Extraction of genomic DNA |
| NanoDrop 1000 | ThermoFisher SCIENTIFIC | ND-8000 | Before Protocol 1: Spectrophotometer |
| 8-strip tube | Agilent Technologies | 401428 | Protocol 1 |
| Genomic DNA sample buffer | Agilent Technologies | 5067-5366 | Protocol 1: A component of Genomic DNA Screen Tape Assay |
| DNA ladder | Agilent Technologies | 5067-5366 | Protocol 1: A component of Genomic DNA Screen Tape Assay |
| MS3 Basic Small Shaker | IKA | 3617000 | Protocol 1: Vortex mixer |
| Genomic DNA ScreenTape | Agilent Technologies | 5067-5365 | Protocol 1: Gel device |
| 2200 TapeStation system | Agilent Technologies | G2965AA | Protocol 1: Electrophoresis instrument |
| TapeStation Analysis Software | Agilent Technologies | Bundled with G2965AA | Protocol 1: Analysis software |
| DNA oligo primers | IDT | Custom order | Protocol 2 |
| LNA probes | IDT | Custom order | Protocol 2 |
| Software tool | IDT | Web site: http://biophysics.idtdna.com/ | Protocol 2 |
| dbSNP database | NCBI | Web site: https://www.ncbi.nlm.nih.gov/projects/SNP/ | Protocol 2 |
| TE buffer | ThermoFisher SCIENTIFIC | 12090015 | Protocol 3 |
| DNase/RNase-Free Distilled Water | ThermoFisher SCIENTIFIC | 10977015 | Protocol 3 (Table 1) |
| Clarity Digital PCR Probe Mastermix | JN Medsys | 12013 | Protocol 3 (Table 1): 2xPCR Master Mix A component of #10011 |
| Clarity Sealing Fluid | JN Medsys | 12005 | Protocol 3: Sealing fluid A component of #10011 |
| Clarity JN Solution | JN Medsys | 12006 | Protocol 3 (Table 1): 20xdPCR solution A component of #10011 |
| Clarity Tube-strip | JN Medsys | 12007 | Protocol 3: Chip-in-a-tube A component of #10011 |
| Clarity Sample Loading Kit | JN Medsys | 12008 | Protocol 3: Loading platform and slider A component of #10011 |
| Clarity Auto Loader | JN Medsys | 11002 | Protocol 3: Auto loader A component of #10001 |
| Clarity Sealing Enhancer | JN Medsys | 11003 | Protocol 3: Sealing enhancer A component of #10001 |
| Clarity Reader | JN Medsys | 11004 | Protocol 3: Reader A component of #10001 |
| Life Eco Thermal Cycler | Bioer Technology | TC-96GHbC | Protocol 3: Thermal cycler |
| Clarity Software | JN Medsys | Bundled with #10001 | Protocol 3: Analysis software |
| High Sensitivity D1000 screen tape | Agilent Technologies | 5067-5584 | Protocol 4: Gel device for high sensitivity |
Referanslar
- Majumdar, N., Wessel, T., Marks, J. Digital PCR modeling for maximal sensitivity, dynamic range and measurement precision. PLoS One. 10 (3), 0118833(2015).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Chen, L., Liu, P., Evans, T. C., Ettwiller, L. M. DNA damage is a pervasive cause of sequencing errors, directly confounding variant identification. Science. 355 (6326), 752-756 (2017).
- Alix-Panabières, C., Pantel, K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy. Cancer Discovery. 6 (5), 479-491 (2016).
- Kiss, M. M., et al. High-throughput quantitative polymerase chain reaction in picoliter droplets. Analytical Chemistry. 80 (23), 8975-8981 (2008).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Analytical Chemistry. 83 (22), 8604-8610 (2011).
- Ottesen, E. A., Hong, J. W., Quake, S. R., Leadbetter, J. R. Microfluidic digital PCR enables multigene analysis of individual environmental bacteria. Science. 314 (5804), 1464-1467 (2006).
- Low, H., Chan, S. J., Soo, G. H., Ling, B., Tan, E. L. Clarity™ digital PCR system: a novel platform for absolute quantification of nucleic acids. Analytical and Bioanalytical Chemistry. 409 (7), 1869-1875 (2017).
- Iwaizumi, M., et al. A novel APC mosaicism in a patient with familial adenomatous polyposis. Human Genome Variation. 2, 15057(2015).
- Kahyo, T., et al. Application of digital PCR with chip-in-a-tube format to analyze Adenomatous polyposis coli (APC) somatic mosaicism. Clinica Chimica Acta. 475, 91-96 (2017).
- Kanai, Y., et al. The Japanese Society of Pathology Guidelines on the handling of pathological tissue samples for genomic research: Standard operating procedures based on empirical analyses. Pathology International. 68 (2), 63-90 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998(2012).
- Cao, L., et al. Advances in digital polymerase chain reaction (dPCR) and its emerging biomedical applications. Biosensors and Bioelectronics. 90, 459-474 (2017).
- Bio-Rad Laboratories. , Available from: https://www.bio-rad.com/webroot/web/pdf/Isr/literature/Bulletin_6311.pdf (2018).
- Thermo Fisher Scientific. , Available from: https://www.garvan.org.au/research/capabilities/molecular-genetics/documents/qs-3d-user-guide.pdf (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır