Method Article
Reazione a catena della polimerasi digitale per la variazione genetica in un paziente di poliposi adenomatosa familiare sporadica utilizzando il formato di Chip-in-a-tubo
In questo articolo
Riepilogo
Digitale per la catena della polimerasi (PCR) è uno strumento utile per la rilevazione di alto-sensibilità di singolo nucleotide varianti e varianti numeri di copia del DNA. Qui, dimostriamo considerazioni chiave per varianti rare nel genoma umano usando la PCR digitale con il formato di chip-in-a-tubo di misurazione.
Abstract
L'analisi quantitativa della variabilità genetica umana è fondamentale per la comprensione delle caratteristiche molecolari di patologie gravi, come i tumori. Perché le reazioni a catena digitale della polimerasi (PCR) permettono la quantificazione precisa delle varianti numeri di copia del DNA, stanno diventando uno strumento essenziale per la rilevazione di variazioni genetiche rare, quali mutazioni farmaco-resistenti. Si prevede che le diagnosi molecolare mediante PCR digitale (dPCR) saranno disponibili nella pratica clinica nel prossimo futuro; così, come condurre in modo efficiente dPCR con materiale genetico umano è un tema caldo. Qui, presentiamo un metodo per rilevare il mosaicism somatico utilizzando dPCR con il formato di chip-in-a-tubo, che permette le reazioni essere condotte contemporaneamente otto-dPCR poliposi del colon (APC). Deve prestare attenzione quando il riempimento e la chiusura la miscela di reazione sui chip. Questo articolo viene illustrato come evitare la sovra - e sottovalutazione delle partizioni positive. Inoltre, vi presentiamo una semplice procedura per la raccolta del prodotto dPCR da partizioni sui chip, che quindi può essere utilizzato per confermare l'amplificazione specifica. Ci auguriamo che questa relazione metodi contribuirà a promuovere il dPCR con il metodo del chip-in-a-tubo nella ricerca genetica.
Introduzione
PCR quantitativa (qPCR) viene spesso utilizzato per quantificare la variabilità genetica umana, comprese le varianti di singolo nucleotide (SNVs) e variazioni del numeri di copie del DNA (CNV). In qPCR, una reazione della polimerasi viene eseguita in ciascun tubo nello stesso modo come la PCR convenzionale punto finale e un segnale di amplificazione viene acquisito dal tubo dopo ogni ciclo termico. Al contrario, in dPCR, significato dPCR end-point in questo rapporto, la miscela PCR viene caricata in molte camere microscopiche, definito partizioni, dove modelli del DNA sono presenti o assenti a una diluizione limitante e ogni partizione contenente miscela PCR è valutato come negativo o positivo dopo la PCR completa. Mentre è facile stimare che non sono presenti modelli di DNA nelle partizioni negative, non è chiaro quante copie di modelli del DNA sono presenti nelle partizioni positive. Pertanto, il numero di modelli di DNA nelle partizioni positive è stimato sulla distribuzione di Poisson, utilizzando il conteggio dal negativo partizioni1base. dPCR è più costoso e ha una più piccola gamma dinamica rispetto al qPCR, ma questo metodo consente una quantificazione assoluta e offre una maggiore sensibilità e maggiore precisione2.
Una delle applicazioni principali di dPCR è la validazione delle varianti identificate mediante sequenziamento di nuova generazione (NGS). Soprattutto nel caso di varianti rare, le frazioni di variante bassa significato, la convalida è cruciale a causa di errori di sequenziamento che possono verificarsi in NGS3. Mentre Sanger qPCR e sequenziamento sono strumenti utili per la convalida di SNVs e CNVs, la loro sensibilità è bassa rispetto al dPCR. Quindi, la tecnologia dPCR è richiesta per gli studi genetici si occupano di varianti rare. Recentemente, la rilevazione di biopsia liquida di rare varianti legate alle caratteristiche del cancro, come farmaco-resistenza, è diventato un tema caldo nella diagnosi molecolare e terapia4. La tecnologia di dPCR sembra adatta per gli studi di biopsia liquida e dovrebbe avere applicazioni cliniche importanti nel prossimo futuro, anche se miglioramenti correlati alla gamma dinamica e costo sono ancora necessari per essere implementato.
Tecnologia dPCR disponibili in commercio possa essere suddivise approssimativamente in piattaforme basate su chip e gocciolina; la differenza è come i modelli di DNA sono partizionati5,6,7. In dPCR con formato di chip-in-a-tubo, la miscela PCR è distribuita dall'azione capillare in partizioni su un chip. I chip sono costruiti in tubo di otto strisce, che molti personale di laboratorio saranno già familiarità con, e, quindi, otto campioni possono essere trattati a un tempo8. Nella fase di lettura, ci vuole < 1h per trattare 96 campioni rilevando l'intera immagine del chip e non ogni partizione. Dal dPCR con il formato di chip-in-a-tubo ha un throughput elevato rispetto ad altri sistemi dPCR, usabilità e la produttività sono i vantaggi chiave per i suoi utenti.
In questo rapporto, mosaicism somatico del gene APC in un paziente con poliposi adenomatosa familiare sporadico è usato come un caso rappresentativo e vengono confrontati i risultati di dPCR e NGS. Lo scopo principale della presente relazione è quello di quantificare chiaramente una variante di singolo nucleotide con dPCR con il formato di chip-in-a-tubo. Ci auguriamo che questa relazione è utile per i ricercatori interessati ad adottare la piattaforma dPCR per il proprio lavoro.
Protocollo
Il disegno dello studio è stato approvato da Institutional Review Boards di Hamamatsu University School of Medicine (G-260-4). Consenso informato è stato ottenuto dal paziente e i suoi genitori.
1. controllo di qualità di DNA Genomic
Nota: Il DNA di Genomic (gDNA) è stata estratta dal sangue periferico utilizzando il metodo di purificazione del DNA basati su silice-membrana ben consolidato. In anticipo rispetto le procedure, che seguono la concentrazione di gDNA è stata determinata utilizzando uno spettrofotometro.
- Preparare il campione gDNA ad una concentrazione di 10-100 ng / µ l.
- Aggiungere 10 µ l di tampone del campione di DNA per una striscia di 8-tubo.
- Aggiungere 1 µ l di DNA ladder o gDNA ai tubi. Vortice la miscela per 1 min, utilizzando l'allegato di micropiastre.
- Il tubo di carico, i gel di dispositivo e puntali per pipette in elettroforesi dello strumento (Tabella materiali) e avviare l'esecuzione premendo il pulsante 'Start'.
Nota: Il sistema di elettroforesi funzionerà automaticamente con un clic sul pulsante Start. - Confermare che l'indicatore inferiore contenuta nel buffer del campione di DNA è assegnato correttamente sugli elettroferogrammi. Se è assegnato in modo non corretto, assegnare manualmente il marcatore in 'modalità di Electroherogram' del software.
Nota: Il numero di integrità del DNA (DIN) viene calcolato automaticamente. Il valore DIN deriva dall'integrità del DNA. Alta e bassa DIN valori indicano gDNA altamente intatto e fortemente degradata, rispettivamente. - Specificare l'area di dimensioni di gDNA (> 200 bp) in 'modalità di regione' del software per calcolare automaticamente la concentrazione di gDNA (> 200 bp).
2. primer e Design della sonda
- Calcolare i valori di temperatura (Tm) fusione utilizzando qualsiasi strumento di accesso aperto alle seguenti condizioni: 10 – 25 basi, 50mm Na+/k+, 0,80 mM dNTPs e 3 mM Mg2 + (Tabella materiali). Progettare il primer forward e reverse per amplificare la regione genomica contenente gli alleli di destinazione con il valore dim T intorno a 60 ° C e la lunghezza di amplicon a 100 – 300 bp.
Nota: Fare riferimento alla tabella 1 per la concentrazione di oligonucleotidi. - Disegno sonde di acido nucleico bloccato (LNA) per gli alleli di riferimento e la variante in base alle condizioni seguenti: (i): 1 – 6 LNA sono presenti in ogni sonda; (ii) un colorante fluorescente e un quencher sono presenti a 5'- e 3'-capolinea di ogni sonda, rispettivamente; (iii) la differenza tra i valori dim T delle sonde abbinati e non corrispondenti è > 10 ° C; (iv) Tm i valori delle sonde abbinati e non corrispondenti sono più alti e più bassi di quelli dei primer, rispettivamente [ad es., forward primer: 60,8 ° C, reverse primer: 59,8 ° C, sonda di riferimento allele (abbinato/non corrispondenti): 62.6/45.3 ° C, variante sonda di allele (abbinato/non corrispondenti): 61.7/50.5 ° C]. I valori dim T sono stati calcolati utilizzando lo strumento di accesso aperto utilizzato anche per passaggio 2.1.
- Assicurarsi che il progettato primer e sonde non comprendono i polimorfismi a singolo nucleotide con una frequenza di > 0.1% come determinato dalle basi di dati [ad esempio, il database di Single Nucleotide Polymorphism (dbSNP)].
3. digital PCR
- Preparare il primer e sonde gDNA soluzioni di riserva nelle concentrazioni indicate nella tabella 1 con un buffer di TE e conservarli a -20 – 4 ° C.
-
Mescolare i reagenti a temperatura ambiente in un volume totale di 15 µ l a una concentrazione finale come descritto nella tabella 1.
- Aggiungere 3 µ l di acqua distillata invece gDNA in un controllo di modello di no (NTC).
- Preparare 3,5 x la quantità della miscela PCR in triplice copia per tenere conto dell'errore di pipettaggio.
- Dispensare la miscela PCR su e giù per mescolarlo.
- Impostare la piattaforma di caricamento sul chip costruito nella striscia di 8-tubo e disporli sull'autoloader. Assicurarsi che vi sia un contatto tra il chip e il pianale di carico.
- Montare un dispositivo di scorrimento del carico sulla piattaforma e tenere premuto il cursore con il tappo fuori il caricatore.
- Pipettare 15 µ l della miscela PCR sulla piattaforma vicino alla punta del dispositivo di scorrimento (Figura 1A).
- Eseguire il loader premendo il pulsante del caricatore (per circa 1 min).
Nota: Non è un problema se una piccola quantità di miscela PCR rimane sulla piattaforma. È possibile eseguire in modo sequenziale nuovamente il caricatore. - Impostare il chip-in-a-tubo riempito di miscela PCR nello slot sul lato del rinforzatore di tenuta. Spingere il coperchio scorrevole e il bordo del coperchio superiore per non rompere il chip (Figura 1B).
- Eseguire il rinforzatore di tenuta (circa 2 min). In sequenza, eseguire nuovamente il rinforzatore di tenuta per 1 min se una pozza di liquido è ancora visibile, perché un sealing incompleto provoca una contaminazione incrociata dei segnali positivi (figure 1 e 1 D).
- Aggiungere 230 µ l di liquido, un reattivo a base di olio, ai tubi sigillante.
Nota: I chip dovrebbero ora essere immersa nel liquido. - Impostare i tubi nel termociclatore. Eseguire il termociclatore come descritto in tabella 2 (per circa 2 h). Ottimizzare la temperatura o la durata della PCR se c'è una distribuzione non uniforme delle partizioni positive (Figura 1E).
Nota: Si consiglia di impostare la velocità di rampa a circa 1 ° C/s. - Lasciare le provette nel termociclatore per almeno 15 min per ridurre il rumore della linea di base.
Nota: I tubi possono essere lasciati durante la notte pure. Segnali di fluorescenza sono stati rilevati anche il giorno seguente. - Impostare i tubi sull'asse di rilevamento e versare il jig 6 mL di acqua distillata. Se le bolle d'aria sono visibili all'interno e all'esterno dei tubi, eliminarle (figure 1F e 1 G).
- Caricare il jig nel rivelatore ed eseguirlo con un clic sul pulsante 'Esegui' del software dopo la selezione delle schede Fluorescene, esperimento e campione/NTC (Tabella materiali).
Nota: Il rilevamento del doppio colore di otto campioni con un'intensità di default dura circa 4-5 min. - Confermare la trama di posizione, istogramma e grafico a dispersione 2D.
Nota: l'intensità della fluorescenza delle partizioni negative iIf è alta, regolare l'intensità con un clic sul pulsante impostazioni del software, in modo che cade all'interno della gamma di 30 – 70. - Calcolare la frazione di allele variante (VAF) utilizzando la seguente formula:
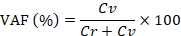
Qui, Cv e Cr sono i numeri di copia della variante e l'allele di riferimento, rispettivamente.
Nota: Sono calcolate automaticamente nel programma software basato su statistiche di Poisson.
4. raccolta del prodotto di PCR
- Rimuovere il liquido sigillante dal tubo.
- Aggiungere 100 µ l di buffer di TE al tubo. Vortexare vigorosamente per 30 s e brevemente Centrifugare la provetta.
- Trasferire la soluzione di TE in un'altra provetta e aggiungere 30 µ l di acetato di sodio 3 M e 200 µ l di etanolo.
- Raffreddare la soluzione a-20 ° C durante la notte.
- Centrifugare la soluzione a 16.000 x g per 30 minuti e rimuovere il surnatante.
- Aggiungere 300 µ l di etanolo di 80% per il tubo e il vortice.
- Centrifugare la soluzione per 15 min a 16.000 x g e rimuovere il surnatante. Consentire il precipitato asciugare all'aria per 5 min.
- Sciogliere il precipitato nel 1-5 µ l di tampone di TE dopo essiccazione all'aria.
- Se necessario, valutare la dimensione di prodotto utilizzando uno strumento di elettroforesi con riferimento al passaggio 1. Caricare 1 µ l della soluzione per il dispositivo di gel per un'elevata sensibilità (Tabella materiali).
Risultati
Abbiamo esaminato il mosaicism somatico del gene APC in un paziente con sporadici poliposi adenomatosa familiare secondo le modalità sopra descritte. In uno studio precedente, l'APC c.834 + 2T > C mutazione è stata trovata nel paziente, ma non nei loro genitori, utilizzando Sanger sequenziamento e NGS9. I disegni del primer e sonde utilizzate nei risultati rappresentativi sono mostrati nella tabella 3. Il DNA genomico è stato estratto dal sangue del proband, i genitori e sei donatori sani. I valori DIN di nove campioni gDNA variati a 6.7 – 7,9 (Figura 2 e tabella 4). FAM e HEX sono stati utilizzati come i coloranti di fluorescenza per gli alleli C e T, rispettivamente. Le macchie di verde e gialle i posti di posizione rappresentano partizioni FAM-positivo e HEX-positivi, rispettivamente (Figura 3A). I punti blu rappresentano partizioni negative per FAM e HEX. Lo sfondo nero corrisponde a partizioni dove non è stato aggiunto alla miscela di reazione. Molte partizioni positive degli alleli C e T sono state rilevate nel proband, mentre alcune partizioni positive dell'allele C sono state rilevate in padre di proband o la NTC e nelle partizioni quest'ultime, positive della T allele non sono stati rilevati. La separazione del segnale tra gli alleli C e T era chiara sul scatterplot bidimensionale (2D), e i segnali più positivi del HEX e FAM erano esclusa l'altro (Figura 3B). Il VAF del proband pari al 13,2%, che è simile a quella determinata utilizzando NGS (12,7%) (Tabella 4). Il VAFs di proband genitori e donatori sani erano < 0,1%. Il limite di rilevamento per l'APC c.834 + 2T > mutazione di C è stato stimato a 0,3% utilizzando 3 volte la deviazione standard per le misurazioni ripetute con 10 – 11 ng del gDNA totale10.
La dimensione di amplicon nell'analisi della dPCR per APC c.834 + 2T > C era stato previsto per essere 123 bp. Per confermare che il prodotto dPCR è stato amplificato come una singola banda, il prodotto dPCR è stato raccolto dal chip dosati. Usando l'elettroforesi, chiaramente è stata rilevata una singola banda, e il formato del prodotto era coerenza con la previsione (Figura 4).
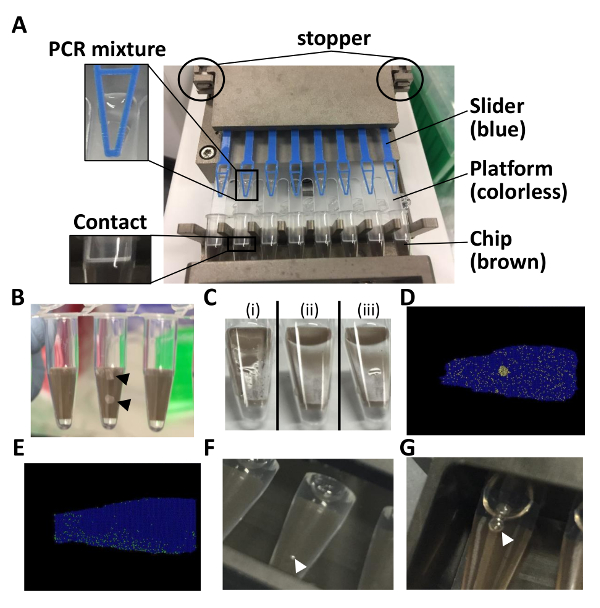
Figura 1 : Punti di nota per il dosaggio di dPCR con chip-in-a-tubo formato. (A), questo pannello viene illustrato come impostare la striscia 8-tubo nell'autoloader. (B), questo pannello mostra chip rotto. (C), questo pannello Mostra come il chip superfici carico subito dopo (i) e (ii) tenuta. (iii) una pozza di liquido è visibile nel caso di una chiusura incompleta. (D), questo pannello mostra la trama di posizione nel caso di una contaminazione incrociata. (E), questo pannello mostra la trama di posizione nel caso di una distribuzione non uniforme. (F), questo pannello spettacoli come aria bolle sulla superficie del tubo immerso nell'acqua. (G), questo pannello mostra le bolle d'aria all'interno del tubo. Tutta la figura intera, bianche e nero frecce indicano pezzi rotti chip e aria bolle, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
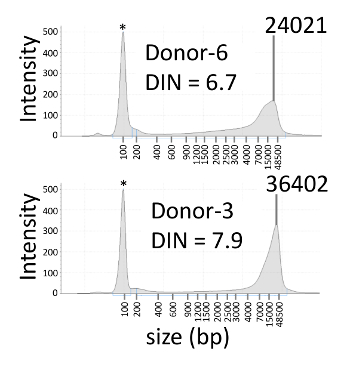
Figura 2 : Rappresentante elettroferogrammi di sangue gDNA. Elettroferogrammi di sangue gDNA con valori DIN di 6,7 e 7.9 sono mostrati nella superiore e inferiore del pannello, rispettivamente. L'asterisco indica un indicatore inferiore. DIN: Numero DNA integrità. Clicca qui per visualizzare una versione più grande di questa figura.
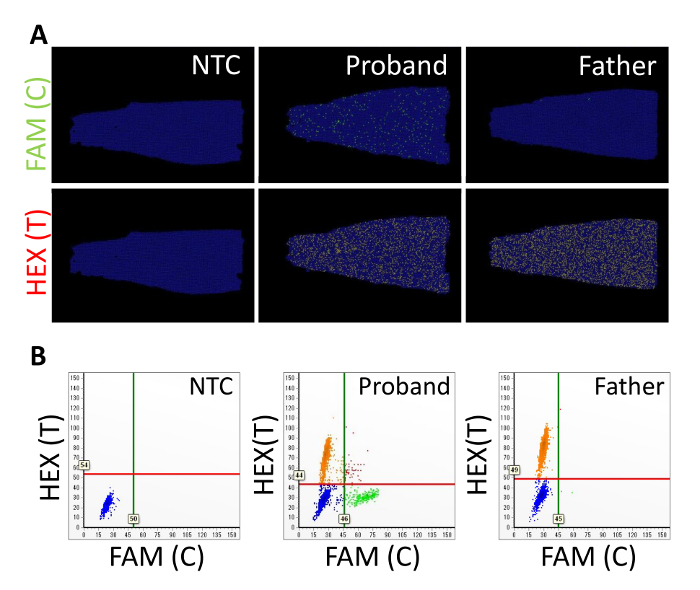
Figura 3 : Risultati rappresentativi del mosaicism somatico APC utilizzando dPCR con il chip-in-a-tubo formato. (A) la posizione trame e scatterplot (B) il controllo del no-modello (NTC), il proband, e il padre sono mostrati qui. HEX e FAM corrispondono gli alleli di riferimento e variante, rispettivamente. Linee orizzontali e verticali indicano le soglie di intensità HEX e FAM, rispettivamente. Questa figura è stata modificata da Kahyo et al. 10. per favore clicca qui per visualizzare una versione più grande di questa figura.
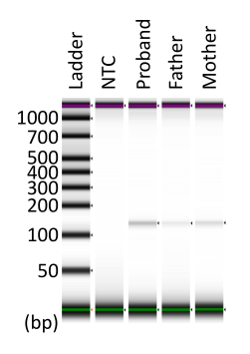
Figura 4 : Raccolta di prodotti dPCR dal chip dosati. I prodotti raccolti e concentrati dPCR sono stati sottoposti ad elettroforesi. Il formato di destinazione previsto era 123 bp. Questa figura è stata modificata da Kahyo et al. 10. NTC: no-modello di controllo. Clicca qui per visualizzare una versione più grande di questa figura.
| Reagente | Concentrazione della soluzione di riserva | Volume (µ l) | Concentrazione finale | Consigliato concentrazione finale |
| Privo di DNasi e RNasi acqua distillata | - | 1.75 | - | - |
| 2 x PCR Master mix | - | 7.5 | - | - |
| Sonda LNA per allele principali | 2 ΜM | 0,5 | 66,7 nM | 3.33 – 100 nM |
| Sonda LNA per minori allele | 2 ΜM | 0,5 | 66,7 nM | 3.33 – 100 nM |
| Forward primer | 1 ΜM | 0,5 | 33.3 nM | 3.33 – 50.0 nM |
| Reverse primer | 1 ΜM | 0,5 | 33.3 nM | 3.33 – 50.0 nM |
| dPCR soluzione 20x | - | 0,75 | - | - |
| gDNA | 3,33 ng/μL | 3 | 666 pg/μL | 20 pg/μL – 2.000 pg/μL1 |
Tabella 1: i reagenti utilizzati per il dosaggio di dPCR. 1 A seconda della sensibilità e precisione previsto.
| Passo | Temperatura | Tempo | Cicli |
| Denaturazione iniziale | 95 ° C | 5 m | 1 |
| Denaturare Ricottura ed estensione | 95 ° C 58 ° C | 50 s 90 s | 42 |
| Estensione finale | 70 ° C | 5 m | 1 |
Tabella 2: Condizioni di termociclatore.
| Nome | Sequenza1 | Tm valore2 |
| Forward primer | 5'-GGTCAAGGAGTGGGAGAAATC-3 ' | 60,8 ° C |
| Reverse primer | 5'-TCTTAGAACCATCTTGCTTCATACT-3 ' | 59,8 ° C |
| Sonda LNA per l'allele T | 5'-HEX-ATTT [A] CCTGACCA-IBFQ-3' | Abbinati: 62,6 ° C Non corrispondenti: 45,3 ° C |
| Sonda LNA per l'allele C | 5'-FAM-TTT [G] CCTGACC-IBFQ-3' | Abbinati: 61,7 ° C Non corrispondenti: 50,5 ° C |
Tabella 3: progettazione del primer e sonde. 1 Le lettere sottolineate e racchiuso tra parentesi quadre sono il LNA e variante di destinazione, rispettivamente. 2 Calcolato secondo la fase 2 del protocollo.
| NGS3 | dPCR4 | |||||||
| Esempio1 | Tessuto | Ingresso del DNA (ng) | DIN2 | VAF (%) | Variante (copie) | Riferimento (copie) | VAF (%) | |
| Significa | RSD | |||||||
| NTC | - | - | - | - | 1.23 | 0 | N/A | N/A |
| Proband | Sangue | 11.3 | 7.6 | 12,7 | 379 | 2,48 x 103 | 13.2 | 0.0353 |
| Padre | Sangue | 10.3 | 7.7 | 0.0167 | 1.08 | 3.42 x 103 | 0.0341 | 0,439 |
| Madre | Sangue | 10,8 | 7.6 | 0.0136 | 0.956 | 3.04 x 103 | 0.0313 | 0.637 |
| Donatore-1 | Sangue | 11,7 | 7.3 | - | 1.64 | 3.01 x 103 | 0,0543 | 0.414 |
| Donatore-2 | Sangue | 10.5 | 7.6 | - | 1.06 | 2.90 x 103 | 0.0406 | 0,539 |
| Donatore-3 | Sangue | 17,6 | 7.9 | - | 4,24 | 5,65 x 103 | 0.0713 | 0.783 |
| Donatore-4 | Sangue | 12.3 | 7.6 | - | 2,38 | 4,16 x 103 | 0,0666 | 0,557 |
| Donatore-5 | Sangue | 19,2 | 7 | - | 1,48 | 6,79 x 103 | 0.0213 | 0,571 |
| Donatore-6 | Sangue | 14,4 | 6.7 | - | 3.44 | 4,67 x 103 | 0.0728 | 0,729 |
Tabella 4: risultati del dPCR dosaggio per APC mosaicism somatico. 1 NTC: no-modello di controllo; Donatore: donatore sano. 2 DIN: Numero DNA integrità. 3 Iwaizumi et al. 9, hum genoma var. 2 15057 (2015). 4 Gli esperimenti sono stati eseguiti in triplice copia e in modo indipendente ripetuto x 3; i dati sono espressi come valore medio; RSD: deviazione standard relativa; N/a: non applicabile. La tabella è stata modificata da Kahyo et al. 10.
Discussione
Il valore DIN viene spesso utilizzato per valutare il DNA danneggiato (per esempio, gDNA dal tessuto paraffina-incastonato formalina-fisso) prima di quantificazione o sequenziamento, perché può causare un degrado avanzato di gDNA bassa qualità dati. DIN valutazione è, diventando così, un passo importante nel controllo della qualità di umano gDNA11. Poiché il gDNA utilizzato nell'esperimento rappresentanza aveva conservato a 4 ° C per 4 – 11 anni dopo la sua estrazione dal sangue, i suoi valori DIN sono stati determinati per un controllo di qualità prima del saggio dPCR. Questo passaggio è particolarmente consigliato se i materiali sono sospettati di essere danneggiato. La concentrazione di gDNA inoltre è stata determinata tramite l'elettroforesi. Poiché la gamma dinamica di dPCR non è così ampia come per qPCR a causa delle limitazioni delle partizioni, una misurazione della concentrazione gDNA è un passo importante per l'analisi di un successo dPCR. Come la quantità di input DNA è stato correlato con il numero totale delle copie degli alleli variante e riferimento nell'analisi della dPCR (R-squared = 0.935; Tabella 4), l'elettroforesi è utile per misurare la concentrazione di gDNA prima del saggio dPCR.
Il caricamento e processi di tenuta sono passi importanti per risultati di successo. È fondamentale confermare il montaggio appropriato della miscela PCR sulla piattaforma e assicurare un contatto tra il chip e la piattaforma (Figura 1A). Protrusione della miscela PCR dal cursore può causare distribuzione non valido sul chip. Confermando la distribuzione delle partizioni positive e negative su un terreno di posizione è anche necessario per un'analisi precisa, perché si presume nelle statistiche di Poisson che modelli di DNA in modo casuale sono suddivise in camere1. Nei risultati della rappresentativi, partizioni positive sono state distribuite in tutto il chip (Figura 3). Questo risultato soddisfa il requisito per la statistica di Poisson e riflette che il caricamento e la chiusura delle procedure erano efficaci. Quando si impostano i tubi nel rinforzatore di tenuta, il chip potrebbe essere rotto, se la parte centrale del coperchio superiore viene spinto troppo fortemente (Figura 1B). Per evitare questo, spingere delicatamente il bordo del coperchio superiore. Se c'è un ammasso artificiale delle partizioni positive (Figura 1D), il numero di copia può essere sopravvalutato a causa di una contaminazione incrociata tra partizioni. La procedura di tenuta dovrebbe essere migliorata se una pozza di liquido è visibile sulla superficie (Figura 1C) (ad es., rieseguendo sequenzialmente il rinforzatore di tenuta per 1 min). Se c'è una distribuzione non uniforme delle partizioni positive (Figura 1E), il numero di copia può essere sottostimato a causa di insufficiente amplificazione o contaminazione del fluido e l'acqua tenuta. Le condizioni PCR devono essere regolate in questo caso [ad esempio, regolando la temperatura o la durata del PCR (passo 3.11 del protocollo), o facendo in modo che il sigillante liquido e acqua versata nel jig sono pulite]. Segnali di fluorescenza sono rilevati dalla striscia 8-tubo immersa in acqua distillata. Se le bolle d'aria aderire alla superficie del tubo, c'è la possibilità che potrebbero interferire con il rilevamento del segnale (Figura 1F). Pertanto, devono essere deselezionate bolle utilizzando uno strumento, come un puntale bene. Inoltre, le bolle d'aria possono formare all'interno dei tubi quando sono impostate nell'attrezzatura (Figura 1G). Se le bolle all'interno dei tubi sono abbastanza grandi per coprire il chip, essi dovrebbero anche essere cancellati. Le bolle possono cancellare se vengono lasciati per alcuni minuti a temperatura ambiente.
Alcune partizioni positivi potrebbero essere rilevati in NTC. Per evitare una contaminazione dei modelli di DNA, tenere il banco pulito e, se possibile, fare uno spazio pulito con un'unità di filtro del ventilatore. Se si sospetta una contaminazione dei modelli di DNA, accuratamente pulire lo spazio e/o smaltire i reagenti usati. Al contrario, se le partizioni positive dell'allele del riferimento non vengono rilevate in presenza di gDNA, riconfermare le concentrazioni del gDNA, primer e sonde. In particolare, i primer sono stati utilizzati ad una concentrazione più bassa nell'esperimento rappresentativo, rispetto al convenzionale PCR (tabella 1)12. È anche fondamentale confermare la velocità di rampa, che raramente è alterata in PCR convenzionale.
Ciò che rende unico dPCR con il formato di chip-in-a-tubo è il partizionamento della miscela PCR all'interno dell'universale 8-tubo striscia8,13. Un trasferimento delle sezioni partizionamento in una provetta PCR non è necessaria in questo sistema, riducendo così il rischio di contaminazione. C'è anche un vantaggio nel sistema dPCR con formato di chip-in-a-tubo; si impiegano < 4 h alla fine 96 saggi in quel sistema di dPCR, mentre ci vogliono almeno 5 h alla fine lo stesso numero di saggi basati su goccia dPCR14. Inoltre, la striscia di 8-tubo universale consente l'utilizzo di un termociclatore convenzionale, a differenza di altri basati su chip dPCR15, che richiede un termociclatore con un blocco piatto. Inoltre, le conoscenze accumulate e reagenti per la PCR convenzionale possono essere applicati al sistema dPCR. Questo sarà utile per ampliare le applicazioni di dPCR.
Si noti che dPCR presenta diverse limitazioni. In dPCR con il formato di chip-in-a-tubo, il numero di partizione del chip è relativamente basso rispetto a quelli in altre piattaforme dPCR. Ulteriore miglioramento al dispositivo chip sarà necessario aumentare la gamma dinamica, che dipende dal numero di partizioni. Perché lo spazio interno del tubo universale è limitato, un design rivoluzionario che il dispositivo di chip è necessaria per aumentare il numero di partizioni. L'automazione della procedura intera dPCR in futuro sarebbe notevolmente ridurre l'errore umano, con conseguente risultati ancora più affidabili. A causa della sua natura ad alta velocità e ad alta sensibilità, il dPCR con chip-in-a-tubo formato dovrebbe essere applicato per curare un numero di campioni per le biopsie liquide e ambientale del DNA.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo studio è stato sostenuto da una sovvenzione per Scientific Research (C) della Japan Society per la promozione della scienza (JSPS) (No. 15 K 08397) a Tomoaki Kahyo e da sovvenzioni dall'Agenzia per la ricerca medica e sviluppo (AMED) (No. 927960719), Giappone Sovvenzione per ricerca esplorativa (n. 16K 15256), spese per progetti associati di un bilancio di speciale incentivo per la promozione di una riforma nazionale Università di sovvenzioni di spese di gestione (No. 1019253) e la Fondazione di ricerca fumatori a Haruhiko Sugimura. Gli autori ringraziano il Dr. Iwaizumi e Dr. Kurachi per il loro supporto clinico. I finanziatori non avevano alcun ruolo nella preparazione del manoscritto. Figura 3, Figura 4e nella tabella 4 sono adattati e ristampato da un articolo di Kahyo et al. 10, con il permesso di Elsevier.
Materiali
| Name | Company | Catalog Number | Comments |
| QIAamp DNA Blood Maxi Kit | Qiagen | 51194 | Before Protocol 1: Extraction of genomic DNA |
| NanoDrop 1000 | ThermoFisher SCIENTIFIC | ND-8000 | Before Protocol 1: Spectrophotometer |
| 8-strip tube | Agilent Technologies | 401428 | Protocol 1 |
| Genomic DNA sample buffer | Agilent Technologies | 5067-5366 | Protocol 1: A component of Genomic DNA Screen Tape Assay |
| DNA ladder | Agilent Technologies | 5067-5366 | Protocol 1: A component of Genomic DNA Screen Tape Assay |
| MS3 Basic Small Shaker | IKA | 3617000 | Protocol 1: Vortex mixer |
| Genomic DNA ScreenTape | Agilent Technologies | 5067-5365 | Protocol 1: Gel device |
| 2200 TapeStation system | Agilent Technologies | G2965AA | Protocol 1: Electrophoresis instrument |
| TapeStation Analysis Software | Agilent Technologies | Bundled with G2965AA | Protocol 1: Analysis software |
| DNA oligo primers | IDT | Custom order | Protocol 2 |
| LNA probes | IDT | Custom order | Protocol 2 |
| Software tool | IDT | Web site: http://biophysics.idtdna.com/ | Protocol 2 |
| dbSNP database | NCBI | Web site: https://www.ncbi.nlm.nih.gov/projects/SNP/ | Protocol 2 |
| TE buffer | ThermoFisher SCIENTIFIC | 12090015 | Protocol 3 |
| DNase/RNase-Free Distilled Water | ThermoFisher SCIENTIFIC | 10977015 | Protocol 3 (Table 1) |
| Clarity Digital PCR Probe Mastermix | JN Medsys | 12013 | Protocol 3 (Table 1): 2xPCR Master Mix A component of #10011 |
| Clarity Sealing Fluid | JN Medsys | 12005 | Protocol 3: Sealing fluid A component of #10011 |
| Clarity JN Solution | JN Medsys | 12006 | Protocol 3 (Table 1): 20xdPCR solution A component of #10011 |
| Clarity Tube-strip | JN Medsys | 12007 | Protocol 3: Chip-in-a-tube A component of #10011 |
| Clarity Sample Loading Kit | JN Medsys | 12008 | Protocol 3: Loading platform and slider A component of #10011 |
| Clarity Auto Loader | JN Medsys | 11002 | Protocol 3: Auto loader A component of #10001 |
| Clarity Sealing Enhancer | JN Medsys | 11003 | Protocol 3: Sealing enhancer A component of #10001 |
| Clarity Reader | JN Medsys | 11004 | Protocol 3: Reader A component of #10001 |
| Life Eco Thermal Cycler | Bioer Technology | TC-96GHbC | Protocol 3: Thermal cycler |
| Clarity Software | JN Medsys | Bundled with #10001 | Protocol 3: Analysis software |
| High Sensitivity D1000 screen tape | Agilent Technologies | 5067-5584 | Protocol 4: Gel device for high sensitivity |
Riferimenti
- Majumdar, N., Wessel, T., Marks, J. Digital PCR modeling for maximal sensitivity, dynamic range and measurement precision. PLoS One. 10 (3), 0118833 (2015).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Chen, L., Liu, P., Evans, T. C., Ettwiller, L. M. DNA damage is a pervasive cause of sequencing errors, directly confounding variant identification. Science. 355 (6326), 752-756 (2017).
- Alix-Panabières, C., Pantel, K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy. Cancer Discovery. 6 (5), 479-491 (2016).
- Kiss, M. M., et al. High-throughput quantitative polymerase chain reaction in picoliter droplets. Analytical Chemistry. 80 (23), 8975-8981 (2008).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Analytical Chemistry. 83 (22), 8604-8610 (2011).
- Ottesen, E. A., Hong, J. W., Quake, S. R., Leadbetter, J. R. Microfluidic digital PCR enables multigene analysis of individual environmental bacteria. Science. 314 (5804), 1464-1467 (2006).
- Low, H., Chan, S. J., Soo, G. H., Ling, B., Tan, E. L. Clarity™ digital PCR system: a novel platform for absolute quantification of nucleic acids. Analytical and Bioanalytical Chemistry. 409 (7), 1869-1875 (2017).
- Iwaizumi, M., et al. A novel APC mosaicism in a patient with familial adenomatous polyposis. Human Genome Variation. 2, 15057 (2015).
- Kahyo, T., et al. Application of digital PCR with chip-in-a-tube format to analyze Adenomatous polyposis coli (APC) somatic mosaicism. Clinica Chimica Acta. 475, 91-96 (2017).
- Kanai, Y., et al. The Japanese Society of Pathology Guidelines on the handling of pathological tissue samples for genomic research: Standard operating procedures based on empirical analyses. Pathology International. 68 (2), 63-90 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Cao, L., et al. Advances in digital polymerase chain reaction (dPCR) and its emerging biomedical applications. Biosensors and Bioelectronics. 90, 459-474 (2017).
- . Bio-Rad Laboratories Available from: https://www.bio-rad.com/webroot/web/pdf/Isr/literature/Bulletin_6311.pdf (2018)
- . Thermo Fisher Scientific Available from: https://www.garvan.org.au/research/capabilities/molecular-genetics/documents/qs-3d-user-guide.pdf (2013)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon