Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akustik Nanodispensing teknolojisini kullanarak yüksek verim DNA Plasmid multiplexing ve transfeksiyon
Bu Makalede
Özet
Bu protokol, akustik damlacık fırlatma teknolojisini kullanarak 384-Well plakasında memelinin hücrelerinin yüksek verim Plasmid transfeksiyonunu açıklar. Zaman alıcı, hataya eğilimli DNA dağıtımı ve çoğullama, aynı zamanda transfeksiyon reaktif dispenpleme, yazılım odaklı ve bir nanodispenser cihaz tarafından gerçekleştirilir. Hücreler daha sonra bu önceden doldurulmuş kuyuların içinde tohumlandı.
Özet
Birçok biyolojik çalışmada vazgeçilmez olan hücre transfeksiyonu, doğru ve başarılı bir başarı için birçok parametreyi kontrol etmesini gerektirir. Çoğu zaman düşük verim olarak gerçekleştirilen, dahası zaman alıcı ve hata eğilimli, hatta daha çok zaman çeşitli plazmids çoğulma. Akustik damlacık ejeksiyon (ADE) teknolojisini kullanarak 384-kuyu plaka mizanpajında hücre transfeksiyonunu gerçekleştirmek için kolay, hızlı ve doğru bir yöntem geliştirdik. Bu çalışmada kullanılan nanodispenser cihazı, bu teknolojiye dayanmaktadır ve kaynak kuyu plakasına kadar yüksek hızda hassas nanohacim teslimatını bir hedefe sağlar. Önceden tasarlanmış bir elektronik tabloya göre, DNA ve transfeksiyon reakajlarını dağıtabilir. Burada, ADE tabanlı yüksek verim Plasmid transfeksiyonunu gerçekleştirmek için optimal bir protokol sunuyoruz ve bu da% 90 ' e kadar bir verimliliğe ve cotransfection deneylerinde yaklaşık% 100 ' lik bir kotransfeksiyona ulaşmayı mümkün kılıyor. Biz bir Kullanıcı dostu elektronik tablo tabanlı makro, en fazla dört plazmids/kuyuları 1.536 farklı plazmids ve tablet tabanlı pipetleme Kılavuzu uygulaması içeren bir kütüphaneden yönetmek mümkün teklif ederek ilk işi uzatmak. Makro, kaynak plakanın gerekli şablonunu (s) tasarlar ve nanodispenser ve tablet tabanlı uygulama için kullanıma hazır dosyaları oluşturur. Dört adımda transfeksiyon protokolü, i) klasik bir sıvı işleyici, ii) Plasmid dağılımı ve multiplexing, iii) bir transfeksiyon reakajının nanodispenser tarafından dağıtılması ve iv) ön doldurulmuş kuyularda hücre kaplamasını içerir. Ade Plasmid çoğullama ve transfeksiyon açıklanan yazılım tabanlı kontrol, hızlı ve güvenli bir şekilde güvenilir bir hücre transfeksiyon gerçekleştirmek için alanında bile uzman olmayan sağlar. Bu yöntem, belirli bir hücre türü için en iyi ayarların hızlı tanımlanması sağlar ve daha yüksek ölçekli ve el ile yaklaşımlar aktarılabilir. Protokol, insan ORFeome proteini (genom açık okuma çerçeveleri [ORFs] seti) ifadesi veya CRISPR-Cas9 tabanlı gen fonksiyon doğrulama gibi uygulamaları, havuzlu tarama stratejilerinde kolaylaştırır.
Giriş
Burada sunulan yöntem, alanda uzman olmayan kişiler için bile 384-Well plakasında akustik bazlı sıvı nanodispenser kullanarak yüksek verim ile meme hücrelerinde DNA plazmid çoğullama ve transfeksiyon gerçekleştirme konusunda ayrıntılı olarak açıklanmaktadır. Bu son yayınlanan Yöntem1 ' den az 1 saat içinde bir deneyde 384 bağımsız plazmid DNA çoğullama ve transfeksiyon koşulları kadar performans sağlar. tek veya kotransfection deneyler başarılı oldu, yakın bir 100% ulaşan nakledilmiş hücreler nüfusu içinde cotransfection. Bu protokol transfeksiyon kolaylaştırır çünkü sıkıcı, zaman alıcı ve hataya eğilimli adımların çoğu artık yazılımla yönetilir (genel bir bakış için bkz. Şekil 1 ). Genel süreç boyunca insan hatalarının önlenmesi ve alanda uzman olmayan kişiler için bile başarılı transfeksiyon teşvik etmek amacıyla kullanım kolaylığı geliştirmek için özel araçlar geliştirmek için daha fazla çaba yapılmıştır. Açıklanan protokol, 384 bağımsız transfeksiyon koşullarını, her bir kuyunda dört plazmid 'e kadar olan çoğullama olanaklarla yönetmek için geliştirdiğimiz "Kullanıcı dostu" bir makro elektronik tablosu içerir. Makro otomatik olarak stok çözümleri ve girilen deneysel tasarım üzerine nanodispenser yazılım sürücü için gerekli dosyaları başlayarak beklenen DNA Plasmid hacmi yüklemek için kaynak plaka (ler) şablonları oluşturur. Bir 384-iyi kaynak plaka el ile DNA dağıtımı gibi sıkıcı ve hata eğilimli, biz de şablona göre DNA çözümü dağıtma sırasında Kullanıcı rehberlik için özel bir tablet tabanlı uygulama geliştirdi.
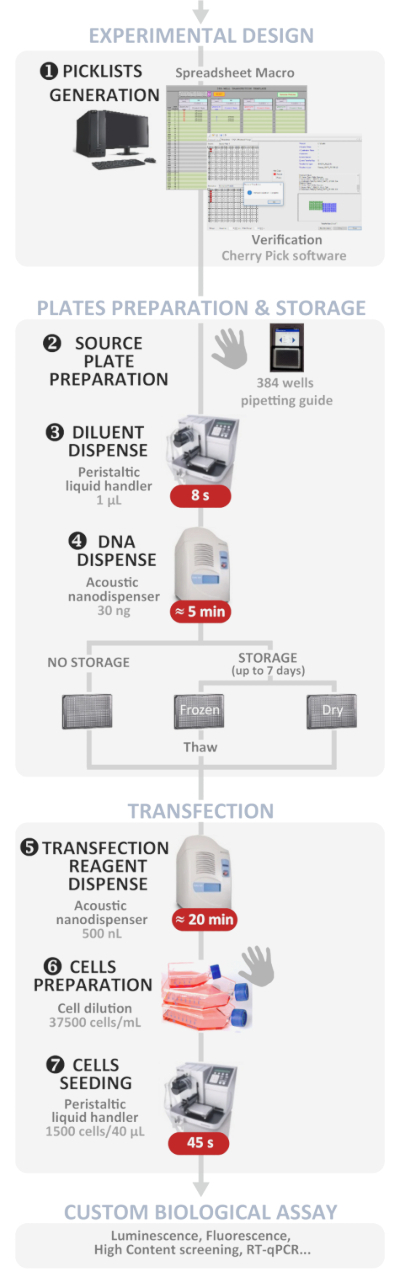
Şekil 1: deneysel iş akışı. Optimum otomatik yüksek verimlilik ters transfeksiyon protokolünün şematik gösterimi (deneysel tasarımdan özel biyolojik tahlil). Manuel adımlar el sembolüyle belirtilir ve her adım için yaklaşık süre kırmızı kutuda yazılır. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Birçok hücre tabanlı deneyler Plasmid DNA transfeksiyon ile başlar, ve hatta birçok adanmış reaktifler olmuştur ve hala transfeksiyon verimliliği artırmak ve/veya prosedürü kolaylaştırmak için geliştirilmiştir, çok2,3 yapılması kalır , 4. DNA plazmid hücreli transfeksiyon, ilk kompleks alımı, endosomal kaçış ve çekirdek5,6sitoplazmik taşıma gibi yüksek verimliliğe ulaşmak için birkaç adım içerir. Kalsiyum yağış veya özel cihazlar kullanarak mikroenjeksiyon gibi Elektroporasyon ya da fiziksel teknikler yanı sıra7, modern kimyasal yöntemler hücre sitoksisite azaltarak DNA hücre teslim artırılması üzerinde duruldu8, 9' a kadar. Lipozit benzeri kompleksleri oluşturan lipidler veya katyonik polimerlerin kullanımı ve daha son zamanlarda, nonliposomal polimerik Kimya sistemleri transfeksiyon daha kolay ve daha verimli hale gelmiştir10. Bu gelişmelere rağmen, hücre transfeksiyon hala bu fiziksel veya kimyasal transfeksiyon protokollerinin çoğunda bilim adamlarının her DNA transfeksiyon reaksiyonu durumunu el ile hazırlamalarına ihtiyaç duyması için belirli becerilerin doğru şekilde gerçekleştirilmesi gerekir, böylece verimliliği önler. Bu sorunu aşmak için, ters transfeksiyon protokolleri, kullanıcının birkaç plazmid 'i daha hızlı bir şekilde test etmesini veya birleştirmesini sağlayan kimyasal transfeksiyon reaktifler11,12,13kullanılarak geliştirilmiştir. Bu protokollerde, hücrelerde hücreler tohumlama yapmadan önce transfeksiyon reaktifleri ile nüklik asit kompleksler oluşur. Ancak, bu ters protokoller hala DNA çözümlerinin manuel olarak işlenmesi ve her bağımsız koşulların kombinasyonu ile sınırlıdır. Bir 96-Well plaka formatında bunları gerçekleştirmek için mümkün olmasına rağmen, DNA hazırlama ve dağıtır sıkıcı olacak ve orada büyük olasılıkla hata olacaktır. Çeşitli DNA plazmids farklı miktarlarda gerekli ve birbirleri ile Multiplexed olduğunda, hücre transfeksiyon elde etmek ve daha fazla zaman alıcı daha zor olur ve insan hataları oldukça kaçınılmaz hale gelir. Ters transfeksiyon yaklaşımında 384-Well plaka biçimine kadar ölçeklendirme, birkaç Multiplexed DNA transfeksiyon koşullarına rağmen, aşağıdaki nedenlerden dolayı imkansız bir sorun haline gelir. i) yönetmek için DNA miktarları, transfeksiyon reaksiyonu veya reaksiyon karışımı hacimleri her bir kuyu için 1 μL 'den daha düşüktür. ii) 384 için plazmids çoğullama bağımsız koşullar son derece karmaşık hale gelir. 384 kuyuların her birinde teslimat da iii) son derece zaman alıcı ve iv) hata eğilimli. Gerçekten de, beklenen kuyularda doğru çözeltinin dağıtımı, düşük hacimlerin zaten boşaltıldığından, boş ve zaten doldurulmuş kuyular arasında görsel izleme yapılmasına izin vermediğinden yönetmek zordur. v) son olarak, gerekli dağıtım adımlarını gerçekleştirmek için gereken süre nedeniyle hücreler eklenmeden önce buharlaşma ile karışımı kurutma riski yüksektir. Özetle, yüksek verimlilik sağlayan DNA plazmid transfeksiyonunun ayarlanması için sınırlama faktörü, düşük hacimli çoğullama ve el ile artık ele alınamaz ama aynı zamanda pek de ulaşılamaz bir şekilde yönetilebilen tahlil, minyatürleşme gibi görünüyor Klasik peristatik sıvı işleyicileri tarafından güvenilir bir şekilde.
Bir zorluk kanıtı olarak otomatize bu tür ve yüksek verim kazanmak için, sadece birkaç girişimi nakli otomatikleştirmek için şimdiye kadar yayınlandı: bir 96-iyi plaka formatında ticari bir sıvı taşıma cihazı ve kalsiyum fosfat yağış kullanarak14 ve, daha yakın zamanda, lipoplex reaktif ve mikroakışkan çip 280 bağımsız transfeksiyonları15 ancak bu alanda özel beceriler gerektiren sağlar. Başka bir yöntem, akustiği, sıvı Levitation izin ve sıvı manipülasyon ve karıştırma yol, 24-96-Well plaka formatları16DNA transfeksiyon gerçekleştirmek için kullanıldı. Mümkün olsa da, bu yaklaşım, DNA transfeksiyon karışımı olan hücrelerin karıştırılması gibi son derece düşük bir verim muzdarip, tohumlama öncesinde her bir nokta için 60 s inkübasyon gerektirir. Bu, tam bir 96-kuyu plakası için en az 96 dk süresi anlamına gelir. Ayrıca, bu protokol şu anda piyasada mevcut olmayan bir ev tasarımı ve üretilen cihaz ile yapılan bu iş olarak genel biyologlar ' seyirci için izin olmaktan uzak. Aksine, son birkaç yılda, kullanımı kolay bir yazılım odaklı akustik tabanlı dağıtım teknolojisi nano hacim dispenseri cihazları ile ortaya çıkmıştır. Bu cihazlar, odaklı akustik enerjiyi kullanarak, küçük sıvı hacimlerinin sıkı kontrollü şekilde çıkarılmasına 2,5 nL 'den 500 nL 'ye, kaynak plakalı bir17hedefe kadar izin verir. Akustik damlacık ejeksiyon (ADE) adı verilen bu teknolojinin sayısız avantajı vardır: tamamen otomatiktir, temassız, kesin, doğru, hassas ve son derece tekrarlanabilir ve yüksek verim18' e sahiptir. İlk olarak dimetil sulfoxid (DMSO) çözümleri sunmaya adamış, ayarlar sulu tamponlar19dağıtmak için geliştirilmiştir. Akustik nanodispensers, daha sonra, ters hücre transfeksiyon protokolleri için uygun görünüyor ve yukarıda belirtilen manuel sınırlamalar çoğunu aşmak olabilir. Hiçbir Plasmid transfeksiyon girişimleri daha önce bu teknoloji kullanılarak tanımlanmıştır olarak, son zamanlarda ters hücre transfeksiyon gerçekleştirmek için bir akustik tabanlı dağıtım sisteminin uygunluğu değerlendirilmiştir.
Nanodispenser verimi ve kullanım kolaylığı yararlanarak, biz bir 384 üzerinde DNA transfeksiyon etkileyebilecek çeşitli parametreler Cross-Testing ile HeLa hücreleri için bir ters transfeksiyon Protokolü optimize-iyi, tek plaka, yani, toplam DNA miktarı ve Kaynak DNA başlangıç konsantrasyonu, seyreltme hacmi, transfeksiyon reaktif, ve yayılma hücrelerinin sayısı. Gelişmiş protokol, hücre transfeksiyonunun yukarıda açıklanan manuel sınırlamalarını kısıtladı ve diğer otomatik transfeksiyon girişimleri üzerinde çeşitli avantajlar sunar. İlk olarak, bu minyatür, böylece DNA plazmid preparatları ve transfeksiyon reaktif tasarrufu ile maliyet-etkili transfeksiyon reaktif sağlar. İkincisi, bu çok daha yüksek verimlilik ve manuel protokol daha (yeni başlayanlar için bile), tüm 384-Well plaka transfeksiyon olarak daha az 1 saat içinde elde edilebilir daha tekrarlanabilir olduğunu. Son olarak, yazılım odaklı, dağıtılmaktadır DNA miktarı ve çeşitli plazmids çoğullama kontrol sağlar. Nitekim, nanodispenser yazılımı sayesinde (malzeme tablosu), Kullanıcı bir hedef bir tanımlanan kaynak iyi plaka dağıtılacak hacimleri kontrol etmek için bir çalışma planı ayrıntılı olabilir.
Burada sunulan protokol özellikle bir nanodispenser erişimi olanlar için tasarlanmıştır ve yüksek verim transfeksiyon deneyler kurmak istiyorum, aynı zamanda hızlı bir şekilde belirli bir hücre türü için transfeksiyon parametrelerini optimize etmek isteyenler için yüksek verimlilik çeşitli parametreler çapraz test etmek için bu protokol uygulama. Nitekim, bu nano protokolüyle tanımlanan optimize edilmiş parametrelerin daha büyük ölçekli ve manuel transfeksiyon deneylerine aktarılmasını gösteriyoruz. Son olarak, mevcut protokolde kullanılan transfeksiyon reakajının üreticiye göre DNA veya siRNA transfeksiyonuna izin vermesine bağlı olarak, protokol, gen ekspresyonu veya knockdown için dizi yaklaşımlarını amaçlayan kişilerin de ilgisini çekmekte. DNA ile önceden doldurulan hedef plakalar, bu tür bir uygulama için aşağıdaki protokolün başka bir avantajı olan, etkinlik kaybı olmaksızın transfeksiyon testinde kullanmadan önce 7 güne kadar koruyucu olabilir.
Protokol
1. önceden preparatlar
- Peristaltik sıvı işleyici programlarının hazırlanması
Not: protokolün seyreltilme ve hücre dağıtım adımları Için, dağıtım kafasının yüksekliğini kullanılan plakaya ve adım amacını dikkate alarak özel bir program hazırlanmalıdır.- 1 μL seyreltilme adımı için 1 μL kaset bağlayın ve 1.1.1.1 ve 1.1.1.2 adımlarında açıklandığı gibi ayarları içeren bir program hazırlayın.
- Akış hızı parametresini yüksek olarak ayarlayın bu adımda biyolojik malzeme hasarı beklense en iyi verim için. Dağıtım yüksekliğini 9,6 mm 'ye ayarlayın (kullanılan hücre kültürü plakasına göre, ek Şekil 1) 1 μL düşmesine izin verme sırasında kuyuların altına dokunmayın.
Not: Bu adım, damla yeterli bir hacim ulaşıncaya kadar dağıtım kafası damlacıklar tutulması önlemek için çok önemlidir. - Her bir satırı dağıttıktan sonra dağıtım kafasının plakanın üzerinde serbest yer değiştirmesine izin vermek için plaka açık yüksekliği 14,4 mm 'ye ayarlayın. Peristaltik sıvı işleyici kafa yüksekliğinin uygun ayarlarını görsel olarak kontrol edin: dağıtım sırasında hiçbir damla dağıtım ipuçları korunur emin olun ve kafası her satır dağıttıktan sonra kafa deplasman izin verecek kadar yüksek olduğunu doğrulayın.
Not: bırakma tutma önleme çok önemli bir parametredir, bu da dağıtmanın hacminin doğruluğunu zarar verecektir.
- Akış hızı parametresini yüksek olarak ayarlayın bu adımda biyolojik malzeme hasarı beklense en iyi verim için. Dağıtım yüksekliğini 9,6 mm 'ye ayarlayın (kullanılan hücre kültürü plakasına göre, ek Şekil 1) 1 μL düşmesine izin verme sırasında kuyuların altına dokunmayın.
- 40 μL hücre süspansiyonunu dağıtmak için, 10 μL kaset bağlayın ve 1.1.2.1-1.1.2.2 adımlarında açıklandığı gibi ayarlarla bir program hazırlayın.
- Akış hızı parametresini düşük olarak ayarlayın hücreleri düşük hızda dağıtmak için, hücrelerdeki olası hasarların kesme stres ve kuyuların alt kısmında yüksek etkisi ile teşvik edilmesini önlemek için. Dağıtım yüksekliği 11,43 mm (kullanılan hücre kültürü plakasına göre, ek Şekil 1), dağıtım işlemi sırasında kuyuların altındaki hücre etkisini düşürmek için yeterince yüksek ancak damlacıklar üzerinde tutulması önlemek için yeterli düşük ayarlayın dağıtma kafası. Her bir satırı dağıttıktan sonra dağıtım kafasının plaka üzerinde serbest yer değiştirmesine izin vermek için plaka açık yüksekliği 16 mm 'ye ayarlayın.
- Peristaltik sıvı işleyici kafa yüksekliğinin uygun ayarlarını görsel olarak kontrol edin: dağıtım sırasında hiçbir damla dağıtım ipuçları korunur emin olun ve kafası her satır dağıttıktan sonra kafa deplasman izin verecek kadar yüksek olduğunu doğrulayın.
Not: güvenilir olmayan bir hücre numarası dağıtmak için yol açacak gibi bırakma bekletme kaçınarak önemli bir parametresidir.
- 1 μL seyreltilme adımı için 1 μL kaset bağlayın ve 1.1.1.1 ve 1.1.1.2 adımlarında açıklandığı gibi ayarları içeren bir program hazırlayın.
- DNA plazmid hazırlığı (klasik Sage ekstraksiyon Protokolü)
- 125 μg/mL ampisilin seçim antibiyotiğiyle (malzeme tablosu) bir gecede 37 °c ' de ve bir orbital Shaker (malzeme tablosu) üzerinde nazik ajitasyon (200 rpm) altında takviye edilen lb orta olarak dönüştürülmüş DH5α bakteri gerilmesini büyütün.
- Kültür 2 ml hasat, 6.000 x g5 dakika santrifüpleme hücreleri Pelet ve supernatant atın.
- RNase A (malzeme tablosu) içeren 250 μL Resuspension tampon ile hücre Pelet resuspend. 250 μL liziz tamponu ekleyin ve üreticinin talimatlarına göre oda sıcaklığında 5 dakika boyunca inküye yapın.
- 300 μL nötralizasyon tamponu (malzeme tablosu) ekleyerek ve kısa bir süre içinde voronyalaştırarak liziz reaksiyonu durdurun. 11.000 x g'de 5 dakika boyunca tüpleri santrifüjün.
- 2 mL toplama tüpünde yeni bir Plasmid minicolumn (malzeme tablosu) yerleştirin ve 11.000 x g'de 1 dakika santrifügleme yaparak sütunda süpernatant koyun.
- Akış yoluyla atın ve minicolumn geri toplama tüpüne yerleştirin.
- Üreticinin talimatlarına göre, Plasmid minicolumn ile 500 μL opsiyonel yıkama tamponu (malzeme tablosu) ve 11.000 x g'de 1 dakika Santrifüjden yıkayın.
- Akış yoluyla atın ve Plasmid minicolumn geri toplama tüpü yerleştirin.
- Üreticinin talimatlarına göre, 11.000 x g'de 1 dakika boyunca etanol ve santrifüjlerle tamamlayıcı 700 μL yıkama tamponu (malzeme tablosu) ekleyin.
- Akış yoluyla atın ve Plasmid minicolumn ve onun toplama tüpü 1/2 dakika için 11.000 x g at silika membranı kurutmak için iki dakikada santrifüj.
- Kuru Plasmid minicolumn yeni bir 1,5 mL tüp yerleştirin ve 60 °C ' de prewarmed 30 μL distile su ekleyin, oda sıcaklığında 2 dakika boyunca inkük, ve sonra, 1 dakika için santrifüj 11.000 x g.
- Plasmid minicolumn atın ve arındırılmış DNA plazmid içeren yıkantıdaki tutun.
- Mikrohacim spektrofotometresi (malzeme tablosu) kullanarak ELTILMIŞ DNA 'nın DNA konsantrasyonunu ölçün.
- Spektrofotometreyi açın ve DNA ölçüm ayarlarını seçin.
- Boş bir kalibrasyon yapmak için spektrofotometre ve pipet 1 μL su ölçüm kaide üzerine örnekleme kolu yükseltin.
- Örnekleme kolunu azaltın, boş ölçümü başlatın ve tamamlama için bekleyin.
- Örnekleme kolunu kaldırın ve numuneyi üst ve alt Kaide 'lerden silin.
- Alt kaide üzerine DNA çözeltisi 1 μL pipet onu ölçmek için.
- Örnekleme kolunu azaltın, DNA konsantrasyon ölçümünü başlatın ve tamamlama için bekleyin.
- Örnekleme kolunu kaldırın ve numuneyi üst ve alt Kaide 'lerden silin.
- Daha fazla DNA konsantrasyonu ölçümleri için, 1.2.13.5-1.2.13.7 adımlarını tekrarlayın.
- Ölçümler bittikten sonra, DNA çözümlerini kullanıma kadar 4 °C ' de saklayın.
2. ADE tabanlı dispensleri sürmek için deneysel tasarım ve seçim listelerinin oluşturulması
Not: bir özel "Kullanıcı dostu" elektronik tablo makro DNA miktarları yönetmek ve bir 384-Well plaka formatında dört plazmid kadar karıştırmak için geliştirilmiştir. Girilen deneysel tasarıma dayanarak, bu makro nanodispenser tarafından ADE tabanlı DNA transfeksiyon protokolünü sürücü için gerekli dosyaları üretir. Bu dosyaları oluşturmak için, Şekil 2' de gösterildiği gibi çeşitli alanların Şablon sayfasında doldurulması gerekir.
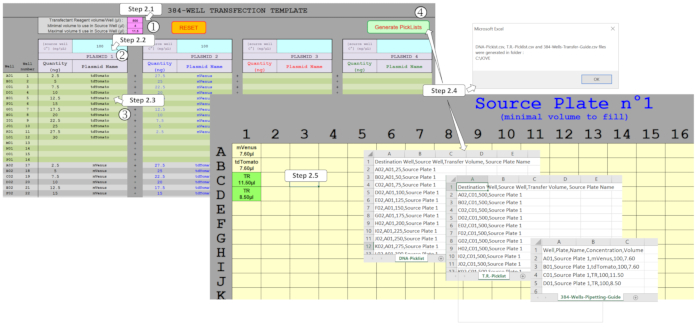
Şekil 2 : E-tablo makrosunu kullanarak Ade dağıtımında sürüş yapmak için seçim listelerinin oluşturulması. Çeşitli parametrelerin doldurulması gerekir, yani (1) TRANSFEKSIYON reaktif (tr) ve kaynak plakasında kullanılacak minimal/maksimal hacimler, (2) ilk Plasmid konsantrasyonları kaynak plakasında dağıtılacak ve (3) Tüm plaka tasarımı, beklenen Plasmid miktarları ve 384-Wells her birinde çoğullama dahil. (4) seçim listeleri oluşturma etkinleştirme farklı alanların doğrulanmasını sağlar ve bir kez düzgün doldurulur, DNA ve tr dağıtımı için seçim listeleri ve gerekli kaynak plakası şablonu otomatik olarak oluşturulur. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Pembe alanlara nanodispenser protokol parametrelerini girin. Transfeksiyon reakajının (TR) karışım değerini 500 nL olarak ayarlayın. Kaynak plaka kuyularında minimum hacim değerini 4 μL olarak ayarlayın. kaynak plaka kuyularında maksimum hacmi 11,25 μL 'ye ayarlayın.
Not: burada kullanılan nanodispenser sadece ADE bir çalışma içinde en fazla 500 nL transfer edebilirsiniz. Bu pembe alanlar önerilen değerlerle önceden doldurulur ancak kullanıcı gereksinimlerine göre değiştirilebilir. - Altta yatan DNA 'ya karşılık gelen mavi alanlarda 100 ng/μL DNA başlangıç konsantrasyonları girin.
Not: Bu değer daha önce tanımlanmış en iyi konsantrasyonudur, ancak farklı kullanıcı ihtiyaçları için değiştirilebilir. - İstenen DNA miktarını gri/yeşil alanlara girin. 384 kuyuları için tutarlar ve Plasmid adlarını girin, aynı Plasmid birkaç kuyularda kullanılırsa aynı yazım sağlanması.
- Kaynak plaka tasarımı, seçim listeleri dosyaları ve pipetleme Kılavuzu dosyasını oluşturun. Makro DNA-Picklist. csv, T. R.-Picklist. csv ve 384-Wells-Pipetting-Guide. csv dosyaları ilgili sayfada toplanan verilerden oluşturmak izin vermek için seçim listeleri oluşturmak tıklayın. İstenirse, Portakal Dolgulu hücre değerlerini, nanodispenser tarafından işlenemez hataları veya birimleri gösterir gibi düzeltin.
- Şablonu (s) kaynak plaka sayfasından yazdırın. Plasmid isimleri ve kuyu doldurmak için minimal hacim belirtilir. Aynı şekilde, sonraki kuyularda doldurulacak olan transfeksiyon reaktif karışım hacimleri tr olarak belirtilir ve yeşil renkte vurgulanır.
3.384-Well pipetleme Kılavuzu uygulamasını kullanarak DNA kaynak plakası hazırlığı
- Damıtılmış suyu kullanarak 1.2.14 ila 100 ng/μL 'den saklanan DNA Plasmid 'inden seyreltin.
- 384-kuyu ızgarasını plaka boyutlarına göre kalibre edin: bir tablette 384-Well pipetleme Kılavuzu uygulamasını açın (Şekil 3). Alt ekranda ızgarada kaynak plaka yerleştirin ve sol üst kalibrasyon menüsünde, + veya - (veya kırmızı imleci kullanın) geliştirmek veya plaka dört köşe kuyuları yeşil kuyuları ayarlamak için ızgara ve kuyuların boyutunu azaltmak için .

Şekil 3 : 384-Well pipetleme Kılavuzu uygulamasının kullanımı. (1) 384-kuyu ızgarasının plaka boyutuna kalibrasyonu; (2)) çift taraflı teyp kullanarak tablete evrensel 3B baskılı plaka adaptörünün montajı; (3) plakanın adaptörün üzerine yerleştirilmesi; (4) ızgaranın deplasman onu monte plaka merkezi. (5) kalibrasyon adımının kilidi. (6) 384 kuyuları pipetleme Guide. csv dosyasının açılması. (7) dosya listesi verildiğinde, uygulama beklenen kaynak plakası adını gösterecektir, REAKTIF (DNA veya transfeksiyon reaktif), konsantrasyon, ve ses hedef kuyuları içine dağıtmak için, tek tek aydınlatılmış olacak. (8) sol ve sağ ok düğmeleri Kullanıcı elektronik tablo makro kaynak plakası şablona göre reaktifler kolayca dağıtmak için pipetleme kılavuzu takip izin verir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Çift taraflı teyp kullanarak, dağıtım sırasında kaynak plaka hareketlerini önlemek için 3B baskılı plaka adaptörünü ekrana monte edin. Gerekirse, ekrandaki ızgarayı plaka konumuna ayarlamak için döndürme okları ve yukarı/aşağı/sağ/sol düğmelerini kullanarak kalibre edilmiş ızgarayı taşıyın. Izgara ve iyi boyutlar düzgün kalibre edilmiş ve bulunduktan sonra, kilit kalibrasyon kutusunu işaretleyin.
- Dosya tıklayın ve 384 Wells pipetleme Guide. csv dosyasını açın. Gösterilen Plasmid belirtilen hacminin, beklenen plakanın uygun hedef hedefine karşılık gelen beyaz renkte belirtilen konsantrasyonda el ile dağıtması için ekran talimatlarını izleyin. Kullanmak - veya + oklar GERI veya daha fazla DNA dağıtım sürecinde gitmek için. Yüklemek için ilk transfection reaktif çözeltisi ulaşıldığında dağıtım durdurun.
- DNA dispensasyonları bittiğinde, kaynak plakasını adaptörden çıkarın. Birkaç kaynak plakasının doldurulması gerekiyorsa, bağdaştırıcıya yeni bir kaynak plakası yerleştirin ve dağıtım talimatlarını izleyin. DNA dağıtımı bittikten sonra, uygun sıvı seviyelendirmeyi sağlamak ve ADE tabanlı aktarımların hatasına yol açan kabarcıkları kaldırmak için DNA dolu kaynak plakasını (s) (2 dk için 1.500 x g ) santrifüjler.
4. hedef plakasında peristaltik sıvı işleyici bazlı 1 μL seyreltme dağıtımı
Not: bir biyolojik Güvenlik kabininde 4.1-4.5 adımları gerçekleştirin.
- 1 μL kaset kafasını sprey dezenfektan (malzeme tablosu) ile püskürterek dezenfekte edin ve bu çözümün uç tutucuya girmesine izin verin. Emici kağıt üzerinde kalan dezenfektan absorbe. 1 μL kasetini peristaltik sıvı işleyici cihazına bağlayın. Cihazı açın ve kaset tipi ayarının doğru olduğundan (1 μL) ve plaka formatı (384 kuyuları) olduğundan emin olun.
- Tüpün tüm lümenini dezenfekte edin: tüp organizatörü (sekiz tüpü birlikte tutarak) steril bir damarla takın ve 5 mL% 70 alkol ile doldurun. Peristaltik sıvı işleyicinin astar fonksiyonunu kullanarak, ilk olarak tüpteki alkolü temizler ve 5 mL distile su ve 5 mL serum-serbest Orta (Dulbecco 'nun modifiye kartal orta [DMEM] 100 U/mL ile tamamlayıcı olarak geçerek durulayın. penisilin-streptomisin; Malzeme tablosu), aynı gemi içinde başarıyla doldurma. Tüm bunlardan sıvı akışını görsel olarak inceleyerek ucu hiçbiri tıkanmış olduğundan emin olun.
- Prewarmed serum-ücretsiz orta ve dalış içinde tüp Organizatör 10 mL ile yeni bir steril gemi doldurarak serum-ücretsiz orta ile boru Prime. Yaklaşık 10 s için peristaltik sıvı işleyici Prime düğmesine basın. Bir kez daha, herhangi bir ipucu görsel olarak tüm bunlardan sıvı akışını inceleyerek tıkanmış olduğundan emin olun.
- Plakayı 1 μL seyreltilme ile doldurun. Peristaltik sıvı iþleyici plaka taşıyıcısına steril 384-Well kültür plakası (hedef) yerleştirin ve kapağını çıkarın.
- 384-kuyu plakasının her bir kuyunda 1 μL dağıtmak için ön kalibre programı çalıştırın. Dağıtım süresi yaklaşık 8 sn. Ardından 384-kuyu plakasının kapağını değiştirin.
Not: Alternatif olarak, bu adım, bir emniyet kabininde, çok kanallı bir mikropipet kullanarak el ile ele alınabilir.
5. el ile Dağıtılmış birimleri kontrol etmek için bir anketin performansı
Not: Ayrıntılar Için Şekil 4' a bakın.
- Nanodispenser programı çalıştırın, tanılama sekmesine gidin, kaynak plaka Out Box Tick, plaka tutucu üzerinde kaynak plaka yük ve plaka girmek için ın kene. İstendiğinde, nanodispenser 'i sulu tampon dağıtım moduna ayarlamak için 384Ldv_aq_b2 öğesini seçin ve oktuşuna basın.
- Çeşitli menüde anket 'yi seçin ve Başlat'a tıklayın. Analiz etmek için önceden doldurulmuş kuyuları seçin ve Go düğmesine tıklayın. Ölçülen birimlerin beklenen olanlar ile eşleştiğinden emin olun ve bu transferlerden kaçınacak şekilde 12 μL 'den fazla hacmine sahip hiçbir kuyuların yüklenmemiş olmasını sağlayın.
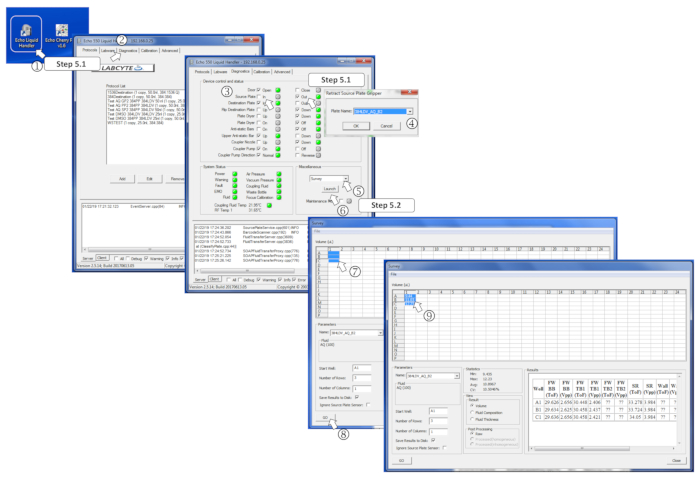
Şekil 4 : Anket yazılım parametrelerini tanımlama. (1) nanodispenser programını başlatın. (2) Tanılama sekmesini açın. (3) kaynak plakası için dışarı çıkarak kaynak plakayı yerleştirin ve sonra, içinde. (4) istendiğinde menüde kaynak plakası tipini tanımlayın. (5) sair kutusunda, açılır menüde anket 'yi seçin. (6) açılışa tıklayarak anket programını başlatın. (7) ölçmek için önceden doldurulan kuyuları seçin. (8) gitmek tıklayarak analiz başlatın. (9) anket yapıldıktan sonra, ölçülen hacimler ilgili seçilen kuyularda yazılır. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
6. hedef plakaya ADE Driven DNA dağıtımı
- Seçim listesi yazılımını çalıştırın, 384-Well kaynak ve hedef plaka türlerini sırasıyla 384_LDV ve Greiner 384PS_781096 olarak ayarlayın (Şekil 5). 384ldv_aq_b2seçerek cihazı sulu tampon dağıtım moduna ayarlayın ve "aktarım verimi en iyi duruma getir" işaretini kaldırın.

Şekil 5 : Seçim listesi tabanlı dispensasyonların performansı. (1) nanodispenser yazılımını başlatın. Protokol sekmesinde, (2) örnek plaka biçimini, (3) hedef plaka tipini ve (4) "aktarım verimi en iyi duruma getirme" seçeneğini belirleyin. (5) seçim listesi sekmesini seçin. (6) ithalat tıklayın ve uygun *. csv dosyasını seçin (DNA-seçim listesi veya t.c.-Picklist). (7) bir kez seçilen, ithalattıklayın. (8) tıkırtı üstünde çalmak ve kaydetmek belgili tanımlık protokol. (9) simülasyonutıklayarak bir dağıtım simülasyonu gerçekleştirin, ya da (10) Runtıklayarak programlanmış dağıtım başlatın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- "Seçim listesi" sekmesini seçin, ithalattıklayın, DNA-Picklist. csv dosyasını seçin. Oynat 'a tıklayın ve Protokolü kaydedin. Seçim listesinin beklenen deneysel tasarımla eşleştiğinden emin olmak için programlanmış dispensasyonların simülasyonunu gerçekleştirmek için simüle et üzerine tıklayın. Tamamlandığında, Kapat'ı tıklatın.
- Oynat'a tıklayın ve ardından çalıştırın, dağıtım programını başlatmak için: sorulduğunda, istenen kaynak plakasını (manuel olarak doldurulmuş DNA çözümleri) ve nanodispenser 'de hedef plakayı (seyreltilmeli) yerleştirin.
Not: dağıtım süresi, seçilen hacimlere ve deneysel tasarımdan toplam dispensasyon sayısına bağlı olarak tam 384-kuyu plakası için yaklaşık 5-20 dk 'dir. - Alternatif olarak, seyreltilmeli ve DNA dolu plakaları 7 güne kadar kuru veya dondurulmuş depolama işleyebilir burada protokol duraklatın. Kuru depolama için, plaka oda sıcaklığında bankta kuru ve sonra onları aynı şekilde saklamak sağlar. Transfeksiyon adımında (Bölüm 7) kullanmadan önce çözünen ve santrifüjün (2 dk için 1.500 x g 'de) dondurulmuş saklanan plakalar.
7. ADE Driven transfeksiyon reaktifin dağıtımı
- Biyo-Güvenlik kabininde, serum içermeyen orta ölçekli, 1 adet final konsantrasyonuna kadar olan lipopolyplex transfeksiyon reaktörünü seyreltmeli. Vortex ve hemen bu transfeksiyon reakajının karışımı, makro tarafından tasarlanan önceden tanımlanmış kaynak plakasına (s) göre ve 3,4 adımda açıklandığı gibi önceden kalibre edilmiş 384-Well pipetleme Kılavuzu uygulamasını kullanarak dağıtabilirsiniz.
Not: santrifüj işleminden sonra hiçbir transfeksiyon fark edildiğinden, reaktif ile birlikte yüklendikten sonra kaynak plakayı santrifüjleme. - 12 μL 'yi aşan birimler nedeniyle hataları dağıtmamak için kaynak plakalarının tüm manuel olarak doldurulmuş tr Wells hacimlerini kontrol etmek amacıyla, Bölüm 5 ' te açıklandığı gibi bir "anket" gerçekleştirmek için nanodispenser programını çalıştırın.
- Seçim listesi yazılımındaki DNA seçim listesinin örnek listesini temizlemek için Sıfırla 'ya tıklayın ve aygıt parametrelerinin hala sulu arabelleklere ve 6,1 adımda olduğu gibi kullanılan kaynak ve hedef plaka türlerine ayarlandığını doğrulayın.
- İthalat tıklayın ve tr-Picklist. csv dosyasını seçin. Oynat 'a tıklayın ve istendiğinde Protokolü kaydedin ve (Bu isteğe bağlı ama şiddetle tavsiye edilir), programlanabilir transfeksiyon reaktif karışımı dispensasyonların bir simülasyonunu kullanarak dispensasyonların uygun şekilde tasarlanması için Simüle düğmesi. Tamamlandığında, Kapat'ı tıklatın.
- Tıklayın Play, ve sonra Çalıştır düğmesini dağıtma programı başlatmak için: istenilen şekilde, kaynak plaka (ler) (tr-karışım dolu) ve hedef plaka (seyreltilme-ve DNA-dolu) nanodispenser yerleştirin.
Not: 500 nL TR karışımı dağıtırken, dağıtım süresi tam 384-kuyu plakası için 20 dakikadan az. - Üretici protokol tarafından belirtildiği gibi TR DNA 'ya ekledikten sonra oda sıcaklığında 15-30 dk inküye.
8. peristaltik sıvı işleyici tabanlı hücre dağıtımı
- Hücreleri dağıtmak için peristaltik sıvı işleyicisini hazırlayın. 10 μL kaset kafasını Aniospray Surf 29 dezenfektan ile püskürterek ve kalıntıları kağıda emici olarak dezenfekte edin. Kasedi peristaltik sıvı işleyici cihazına monte edin, kaset tipi ayarını 10 μL olarak değiştirin ve plaka biçiminin 384 kuyu olarak ayarlandığından emin olun.
- 10 μL kaset tüpünü, 4,2 adımda daha önce açıklandığı gibi dezenfekte edin. Steril bir gemi içinde tüp Organizatör dalış ve 5 ml 70% alkol ile tüp floş, sonra 5 ml distile su, ve son olarak, 5 mL serum-ücretsiz orta, sürekli aynı gemi içinde dolu ve her tüp boş kadar.
- Hücre süspansiyonunu dağıtmak için hazırlayın. Bir confluent HeLa hücresinden B10-kültür çanak, 1x fosfat-tamponlu tuz (PBS) çözeltisi ile hücreleri 1x yıkayın ve daha sonra 37 °C ' de 5 dakika için Trypsin/EDTA ile hücreleri ayırmak.
- Mikroskop altında hücre kesilmesini doğrulayın ve 10 mL tam orta ekleyerek tripsin/EDTA eylemini durdurun (DMEM 10% fetal sığır serumu ve 100 U/mL penisilin-Streptomycin ile tamamlayıcı; malzeme tablosunabakın) kültür çanak. Bir 50 mL tüp içinde hasat hücreleri ve mikroskop altında hücreleri saymak, bir Malassez hücre veya otomatik hücre sayacı kullanarak.
- En az 25 mL HeLa hücre süspansiyonu 37.500 hücre/mL tam orta (yani, 1.500 Cells/40 μL) tam bir 384-Well plaka için, tüp astar ve 40 μL/Well dağıtımı sağlamak için bir konsantrasyonda hazırlayın.
- Hücreleri dağıtmak için, hazırlanmış hücre süspansiyon ile yeni bir steril gemi doldurun ve dağıtım hücre yoğunluğunda indoğruluk yol sedimantasyon önlemek için karıştırın. Bu çözüme tüp düzenleyicisini takın ve hücre süspansiyonu dağıtım kafasından boşaltmaya başlayana kadar Prime düğmesine basın. İpin hiçbirinin, tüm bunların sıvı akışını görsel olarak incelediğinden ve her tüpün hücre süspansiyon ile birlikte yüklendiğinden emin olun.
- DNA ve TR dolu 384-kuyu hedef plakasını peristaltik sıvı iþleyici plaka taşıyıcısına yükleyin ve kapağını çıkarın. Tam 384-kuyu plakasında (örn., 1.500 hücreler/iyi) hücre süspansiyonunun 40 μL 'i dağıtmak için ön kalibre programı çalıştırın. Dağıtım süresi yaklaşık 8 s. 384-kuyu plakasının kapağını değiştirin.
Not: Alternatif olarak, 40 μL hücreli süspansiyon, çok kanallı bir mikropipet kullanılarak el ile dağıtılabilir.
9. özel biyolojik tahlil (hücre transfeksiyon verimliliği izleme)
Not: deneysel ayarları ve denemenin amacını Izleyerek, Işıksaçan, floresan, yüksek içerik taraması ve Ters transkripsiyon niceliksel polimeraz zincir reaksiyonu (RT-qPCR) için gerekli yöntemleri kullanın. Protokol bu bölümünde, hücre transfeksiyon verimliliği otomatik floresan mikroskobu ve görüntü analizi ile değerlendirilir.
- Plakayı 37 °C ' de, su doymuş bir atmosferde ve uygun protein ifadesine kadar% 5 CO2 ile kulbe etme.
Not: burada, bir 48 h inkübasyon süresi HeLa hücreleri için kullanılır transfeksiyon verimliliği izlemek için, kullanarak tdTomato-ve mVenus-ifade plazmids. - Kültür ortamını çıkarın 48 h sonrası transfeksiyon plakayı tersine çevirerek, peristaltik sıvı işleyici (10 μL kaset) kullanarak 30 μL/kuyu% 10 formalin ekleyin ve oda sıcaklığında 15 dakika boyunca inküye edin.
- Plakayı tersine çevirme yoluyla formalin çıkarın; sonra, 0,1 ng/mL Hoechst 1x PBS çözeltisi ile seyreltilmiş ile Oda sıcaklığında 15 dakika hücreleri inküt.
- Formalin çözelti inkübasyon adımının 6,9 pH 'Sı ile kaybolan yüksek floresan sinyalini kurtarmak için pH = 8 ' e ayarlanmış 1x PBS 80 μL ile 15 dakika için 3x hücrelerini yıkayın.
- Otomatik bir floresan mikroskop kullanarak, iki veya üç floresan kanalları (Hoechst, tdTomato ve mVenus) görüntüleri elde etmek için sırayla 10X hedefleri ve uygun bir emisyon filtre seti (4 ′, 6-diamidino-2-phenylindole [DAPI], dsRed ve fluorcein ısothiocyanate [FITC], sırasıyla).
- Transfeksiyon verimliliklerini değerlendirmek için, çekirdekler boyama tabanlı komut dosyası analizini kullanarak transfeksiyon verimliliğini belirlemek için görüntü analiz yazılımını kullanın.
Sonuçlar
ADE teknolojisi otomatik bir ters transfeksiyon protokolü için kullanılabilir olup olmadığını belirlemek için fIn sipariş, biz floresan microkopi ile hücre transfeksiyon verimliliği izlenen, kırmızı floresan tdTomato plazmid ifade kullanarak. İlk olarak en iyi transfeksiyon parametrelerinin belirlenmesine yönelik olarak, farklı seyreltme hacimleri ve toplam DNA miktarı çapraz test edildi. Seyreltme hacmi, bir kez dispensed DNA damlacıkları izin için kullanılan, ön ...
Tartışmalar
Belirli bir hücre hattı için doğru bir yüksek verimlilik transfeksiyon yönteminin kurulması ve optimizasyonu, bilim adamlarının bu bölümde açıklanan bazı anahtar parametreleri takip etmesini gerektirir. HeLa hücreleri için en iyi duruma getirilmiş bu ayarlar da HEK hücreleri için verimli olduğu kanıtlanmıştır gibi protokol boyunca önerilen değerlerle başlayarak şiddetle teşvik ediyoruz. Ancak, en iyi parametreler hücre hatları ve transfeksiyon reaktifler bağlı olabilir, optimum koşullar,...
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar, bu makalenin araştırma, yazarlık ve/veya yayınlanması için aşağıdaki mali destek makbuzunu açıkladı: ınekm, Lille Üniversitesi, Lille Pasteur Enstitüsü, Conseil régional du Nord, ve PRIM-HCV1 ve 2 (Pôle de Recherche Disiplinler arası sur le médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), Feder (12001407 (D-AL) Equipex ımaginex BioMed) ve Avrupa Topluluğu (ERC-STG ıNTRACELLTB n ° 260901). Yazarlar, Dr. S. Moureu, Dr. B. Villemagne, Dr. R. ferru-Clément ve Dr. H. Groult 'in kritik incelemelerini ve el yazmasını düzeltmeleri için teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder | 12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). | version 2.79b | used to design the plate adapter |
Referanslar
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific - FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source - A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır