JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
음향 나노 디스펜싱 기술을 사용한 고처리량 DNA 플라스미드 멀티플렉싱 및 트랜스펙션
요약
이 프로토콜은 음향 액적 배출 기술을 사용하여 384 웰 플레이트에서 포유류 세포의 고처리량 플라스미드 형질 감염을 설명합니다. 시간이 많이 소요되고 오류가 발생하기 쉬운 DNA 디스펜싱과 트랜스펙션 시약 디스펜싱은 나노 에스터디터 장치에 의해 소프트웨어 구동 및 수행됩니다. 세포는 다음 이 미리 채워진 우물에서 파종됩니다.
초록
많은 생물학적 연구에 필수적인 세포 형질감염은 정확하고 성공적인 성취를 위해 많은 매개 변수를 제어해야 합니다. 대부분의 경우 낮은 처리량에서 수행, 그것은 또한 시간이 많이 걸리고 오류가 발생하기 쉬운, 더 많은 그래서 여러 플라스미드를 다중화 할 때. 우리는 음향 액적 배출 (ADE) 기술을 사용하여 384 웰 플레이트 레이아웃에서 세포 변환을 수행하는 쉽고 빠르며 정확한 방법을 개발했습니다. 본 연구에 사용되는 나노 디스펜서 장치는 이 기술을 기반으로 하며 소스 웰 플레이트에서 대상 플레이트까지 고속으로 정밀한 나노부피 전달을 허용합니다. 미리 디자인된 스프레드시트에 따라 DNA 및 트랜스펙트 시약을 분배하고 분배할 수 있습니다. 여기에서 우리는 최대 90%의 효율과 cotransfection 실험에서 거의 100%의 연전율에 도달할 수 있게 하는 ADE 기반고처리량 플라스미드 형혈을 수행하기 위한 최적의 프로토콜을 제시합니다. 사용자 친화적인 스프레드시트 기반 매크로를 제안하여 최대 1,536개의 플라스미드를 포함하는 라이브러리에서 최대 4개의 플라스미드/웰을 관리할 수 있으며 태블릿 기반 파이펫팅 가이드 응용 프로그램을 제안하여 초기 작업을 확장합니다. 매크로는 소스 플레이트의 필요한 템플릿을 설계하고 나노 디스펜서 및 태블릿 기반 응용 프로그램에 대한 즉시 사용 파일을 생성합니다. 4단계 형질전환 프로토콜은 i) 고전적인 액체 처리기를 가진 희석제 디스펜스, ii) 플라스미드 분포 및 멀티플렉싱, iii) 나노디스펜서에 의한 트랜스펙션 시약 디스펜스, 및 iv) 미리 채워진 웰상에서의 세포 도금과 관련이 있다. ADE 플라스미드 멀티플렉싱 및 트랜스펙션의 기술된 소프트웨어 기반 제어를 통해 현장의 비전문가조차도 빠르고 안전한 방법으로 신뢰할 수 있는 세포 형질변환을 수행할 수 있습니다. 이 방법을 사용하면 지정된 셀 유형에 대한 최적의 설정을 신속하게 식별할 수 있으며 더 높은 규모및 수동 접근법으로 전환할 수 있습니다. 이 프로토콜은 비풀스닝 전략에서 인간 ORFeome 단백질(게놈에서 열린 판독 프레임 [ORFs] 세트) 발현 또는 CRISPR-Cas9 기반 유전자 기능 유효성 검사와 같은 응용을 용이하게 합니다.
서문
여기에 제시된 방법은 384웰 플레이트에서 음향 기반 액체 나노디스터를 사용하여 높은 처리량에서 포유류 세포에서 DNA 플라스미드 멀티플렉싱 및 트랜스펙션을 수행하는 방법을 자세히 설명하며, 심지어 현장의 비전문가를 위한 것입니다. 이 최근 발표된 방법 1은 한 실험에서 384개의 독립적인 플라스미드 DNA 다중화 및 형질전환 조건을 1시간 미만으로 수행할 수 있게 해주며, 단일 또는 배전 실험이 성공하여 거의 100%에 이르렀습니다. 형질 감염된 세포 집단 내의 환전. 이 프로토콜은 지루하고 시간이 많이 소요되며 오류가 발생하기 쉬운 대부분의 단계가 이제 소프트웨어 기반이기 때문에 더 쉽게 변환할 수 있습니다(일반적인 개요의 경우 그림 1 참조). 또한 전체 프로세스 중에 사람의 실수를 피하면서 사용 편의성을 높이고 현장의 비전문가에게도 성공적인 트랜스펙션을 촉진하기 위한 전용 도구를 개발하기 위해 더욱 노력했습니다. 설명된 프로토콜에는 384개의 독립적인 형질감염 조건을 관리하기 위해 개발한 "사용자 친화적인" 매크로 스프레드시트가 포함되어 있으며, 각 우물에서 최대 4개의 플라스미드의 다중화 가능성이 있습니다. 매크로는 소스 플레이트의 템플릿을 자동으로 생성하여 시작 스톡 솔루션에서 예상되는 DNA 플라스미드 볼륨을 로드하고 입력된 실험 설계에 나노 스테스터 소프트웨어를 구동하는 데 필요한 파일을 생성합니다. 384웰 소스 플레이트에서 DNA의 수동 분배는 지루하고 오류가 발생하기 쉽기 때문에 템플릿에 따라 DNA 솔루션을 분배하는 동안 사용자를 안내하는 전용 태블릿 기반 응용 프로그램을 개발했습니다.
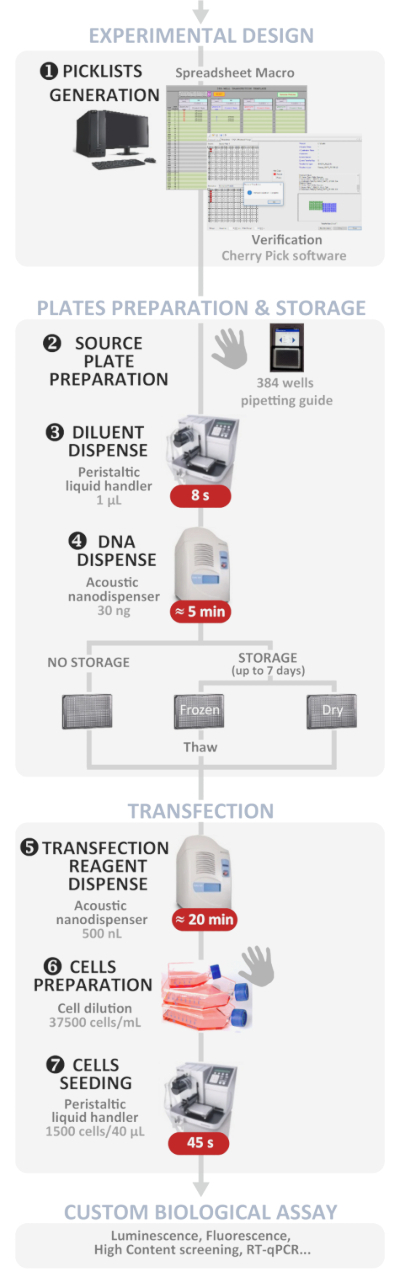
그림 1: 실험 워크플로우. 최적의 자동화 된 고처리량 역형 변환 프로토콜 (실험 설계에서 맞춤형 생물학적 분석)의 회로도 표현. 수동 단계는 손 기호로 표시되고 각 단계의 대략적인 시간은 빨간색 상자에 기록됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
많은 세포 기반 실험은 플라스미드 DNA 형혈로 시작하며, 많은 전용 시약이 형질 감염 효율을 향상시키고 절차를 용이하게하기 위해 여전히 개발되고 있더라도많은것이 2,3을 수행해야합니다. , 4.DNA 플라스미드 세포 형질감염은 초기 복합적인 흡기, 내인성 탈출, 및 핵으로의 세포질 수송과 같은 고효율에 도달하기 위한 여러 단계를 수반한다 5,6. 칼슘 침전 또는 전용 장치를 사용하여 전기 천공 또는 미세주입과 같은 물리적 기술 이외에 7, 현대 화학 적 방법은 세포 독성을 낮추면서 DNA 세포 전달을 향상시키는 데 중점을 두어8, 9. 지질 또는 양이온 폴리머를 사용하여 리포솜과 같은 복합체를 형성하고, 최근에는 비리포솜 중합체 화학 시스템을 사용하여 형질전환을 쉽고 효율적으로10. 이러한 발달에도 불구하고, 세포 형질감염은 여전히 이러한 물리적 또는 화학적 형질감염 프로토콜의 대부분이 과학자들이 각 DNA 형질감염 반응 상태를 수동으로 준비하도록 요구하기 때문에 정확하게 수행되어야 하는 특정 기술을 필요로 합니다. 처리량을 손상시게 할 수 있습니다. 이 문제를 우회하기 위해, 역형질 감염 프로토콜은 화학형질 감염 시약11,12,13을사용하여 개발되어 사용자가 더 빠른 방법으로 여러 플라스미드를 테스트하거나 결합할 수 있게 합니다. 이 프로토콜에서, 형질감염 시약을 가진 핵산 복합체는 복합체에 세포를 파종하기 전에 형성된다. 그러나, 이러한 역프로토콜은 DNA 솔루션의 수동 처리및 각각의 독립적인 조건의 조합에 의해 여전히 제한된다. 96 웰 플레이트 형식으로 수행하는 것이 가능하지만 DNA 준비 및 분배는 지루할 것이며 실수가 있을 것입니다. 여러 DNA 플라스미드의 다른 양이 필요하고 서로 다중화 될 때, 세포 형질전환은 달성하기 가 더욱 어려워지고 더 많은 시간이 소요되고, 인간의 오류는 매우 피할 수없게된다. 역형질 접근법에서 384 웰 플레이트 포맷까지 스케일링하면 다중화 된 DNA 형질 감염 조건에도 불구하고 다음과 같은 이유로 인해 불가능한 도전이됩니다. i) 관리해야 할 DNA 양, 형질감염 시약 또는 반응 혼합물 부피는 각각의 웰에 대해 1 μL 보다 낮다. ii) 384 개의 독립적 인 조건에 대한 플라스 미드의 멀티플렉싱은 매우 복잡해집니다. 각각의 384웰의 전달은 또한 iii) 매우 시간이 많이 소요되고 iv) 오류가 발생하기 쉽다. 실제로, 이미 분배된 낮은 볼륨은 빈 우물과 이미 채워진 웰 사이의 시각적 모니터링을 허용하지 않기 때문에 예상 웰에서 올바른 솔루션을 분배하는 것은 관리하기 가 어렵습니다. v) 마지막으로, 필요한 디스펜싱 단계를 수행하는 데 필요한 시간으로 인해 세포가 첨가되기 전에 증발에 의해 혼합물을 건조할 위험이 높다. 요약하면, 고처리량 DNA 플라스미드 형질감염 분석제를 설정하는 제한 요인은 더 이상 수동으로 처리할 수 없는 저용량 멀티플렉싱 및 관리를 의미하는 분석의 소형화로 보이지만, 고전적인 주압 액체 처리기에 의해 신뢰할 수있는 방법.
이러한 분석을 자동화하고 높은 처리량을 얻는 데 어려움을 입증하기 위해, 형혈을 자동화하는 몇 가지 시도만이 지금까지 발표되었습니다 : 상업용 액체 처리 장치 및 칼슘 인산염 침전물을 사용하는 96 웰 플레이트 형식14 그리고, 최근에는 리포플렉스 시약, 및 280개의 독립적인 형질전환15를 가능하게 하는 미세유체 칩이지만 이 분야에서 는 전문기술이 요구되고 있다. 또 다른 방법, acoustophoresis, 액체 부양을 허용하고 유체 조작 및 혼합으로 이어지는, 24- 96 웰 플레이트 포맷16에서DNA 형질 변환을 수행하는 데 사용되었다. 가능하지만, 이 접근법은 DNA 형질전환 혼합물과 세포의 혼합이 파종되기 전에 모든 단일 지점에 대해 60 초의 배양을 필요로 하기 때문에 매우 낮은 처리량을 겪습니다. 이것은 완전한 96 웰 플레이트에 대해 적어도 96 분의 지속 시간을 의미합니다. 또한,이 프로토콜은 이 작업이 현재 시장에서 사용할 수없는 사내 설계 및 제조 장치로 수행되었기 때문에 전체 생물학자의 청중에게 허용되지 않습니다. 반대로, 지난 몇 년 동안, 사용하기 쉬운 소프트웨어 기반 음향 기반 디스펜싱 기술은 나노 볼륨 디스펜서 장치와 함께 등장했다. 집중된 음향 에너지를 사용하여 이러한 장치는 소스 플레이트에서 목적지17까지2.5 nL ~ 500 nL의 작은 액체 볼륨을 엄격하게 제어할 수 있습니다. 음향 액적 배출 (ADE)이라고 불리는이 기술은 많은 장점을 가지고 있습니다 : 그것은 완전히 자동화되고, 비접촉식, 팁리스, 정확하고, 매우 재현 가능하며, 높은 처리량18을가지고 있습니다. 먼저 디메틸 설폭사이드(DMSO) 솔루션을 제공하는 데 전념하여 수성버퍼(19)를분배하도록 설정이 향상되었습니다. 그런 다음 음향 나노 에스터는 역세포 형질 감염 프로토콜에 적합한 것처럼 보이며 위에서 언급 한 대부분의 수동 제한 사항을 우회 할 수 있습니다. 이 기술을 사용하여 플라스미드 형질 전환 시도가 이전에 설명되지 않았던 것처럼, 우리는 최근에 역세포 형질변환을 수행하기 위한 음향 기반 디스펜싱 시스템의 적합성을 평가했습니다.
나노 에스터디스터 처리량과 사용 편의성을 활용하여 384 웰, 단일 플레이트, 즉 총 DNA 양에 대한 DNA 형질감염에 영향을 줄 수 있는 여러 매개 변수를 교차 테스트하여 HeLa 세포에 대한 역형질 감염 프로토콜을 최적화하고 소스 DNA 시작 농도, 희석제 볼륨, 형질 전환 시약, 및 확산 세포의 수. 개발된 프로토콜은 전술한 세포 형질감염의 수동 한계를 우회하고 다른 자동화된 형질감염 시도에 비해 몇 가지 이점을 제시한다. 첫째, 그것은 소형화되어 DNA 플라스미드 제제 및 형질감염 시약을 저장하여 비용 효율적인 형질 감염 시약을 허용합니다. 둘째, 전체 384 웰 플레이트의 트랜스펙션이 1시간 미만으로 달성될 수 있기 때문에 수동 프로토콜(초보자도 마찬가지)보다 훨씬 높은 처리량과 재현력이 있습니다. 마지막으로, 그것은 소프트웨어 구동, 디스펜싱 된 DNA 양의 제어 및 여러 플라스미드의 멀티플렉싱을 허용. 실제로, 나노에스터 소프트웨어(TableofMaterials)를 통해 사용자는 정의된 소스 웰 플레이트로부터 대상플레이트로 분배되는 부피를 제어하는 연구 계획을 정교하게 할 수 있다.
여기에 제시 된 프로토콜은 주로 나노 에이체에 액세스 할 수 있고 높은 처리량에서 형질 감염 실험을 설정하고자하는 사람들을 위한 것입니다, 뿐만 아니라 신속하게 주어진 세포 유형에 대한 자신의 형질 감염 매개 변수를 최적화하고자하는 사람들을 위해 처리량이 높은 여러 매개 변수를 교차 테스트하기 위해 이 프로토콜을 적용합니다. 실제로, 우리는 이 나노 스케일 프로토콜로 확인된 최적화된 파라미터가 더 큰 규모와 수동 형질전환 실험으로 전치될 수 있음을 보여주었습니다. 마지막으로, 본 프로토콜에 사용되는 형질감염 시약은 제조사에 따라 DNA 또는 siRNA 형질변환을 허용함에 따라, 프로토콜은 유전자 과발현 또는 녹다운에 대한 어레이 접근법을 수행하는 것을 목표로 하는 사람들에게도 관심이 있다. DNA로 미리 채워진 대상 플레이트는 효능의 손실 없이 형질전환 분석에서 사용하기 7일까지 보존될 수 있으며, 이는 이러한 종류의 적용에 대한 다음 프로토콜의 또 다른 장점이다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 사전 준비
- 연동 액 처리기 프로그램의 준비
참고: 프로토콜의 희석제 및 셀 디스펜싱 단계의 경우 사용된 플레이트에 대한 디스펜싱 헤드의 높이와 단계 의도를 고려하여 전용 프로그램을 준비해야 합니다.- 1 μL 희석제 디스펜스 단계의 경우, 1 μL 카세트를 장착하고 1.1.1.1 및 1.1.2 단계에 설명된 대로 설정이 있는 프로그램을 준비한다.
- 이 단계에서 생물학적 물질 손상이 예상되지 않는 최상의 처리량을 위해 유량 파라미터를 높음으로 조정합니다. 디스펜스 높이를 9.6 mm로 조정(사용된 세포 배양판에 따라, 보충 도1)을 1 μL 드롭이 경륜의 시대에 우물의 바닥에 닿을 수 있도록 한다.
참고: 이 단계는 떨어뜨릴 수 있는 충분한 양에 도달할 때까지 디스펜싱 헤드에 액적의 유지를 방지하는 데 중요합니다. - 각 행을 분배한 후 플레이트 위에 디스펜싱 헤드를 자유롭게 변위할 수 있도록 플레이트 클리어 높이를 14.4mm로 조정합니다. 연동 액상 핸들러 헤드 높이의 적절한 설정을 시각적으로 제어: 디스펜싱 하는 동안 디스펜싱 팁에 방울이 유지되지 않도록 하고 각 행을 분배한 후 헤드가 충분히 높은지 확인하십시오.
참고: 낙하 유지를 피하는 것은 경륜의 시대의 부피의 정확성을 떨어뜨리기 때문에 중요한 매개 변수입니다.
- 이 단계에서 생물학적 물질 손상이 예상되지 않는 최상의 처리량을 위해 유량 파라미터를 높음으로 조정합니다. 디스펜스 높이를 9.6 mm로 조정(사용된 세포 배양판에 따라, 보충 도1)을 1 μL 드롭이 경륜의 시대에 우물의 바닥에 닿을 수 있도록 한다.
- 40 μL 셀 서스펜션을 분배하기 위해 10 μL 카세트를 장착하고 1.1.2.1-1.2.2 단계에 설명된 대로 설정이 있는 프로그램을 준비합니다.
- 유량 매개변수를 낮은 으로 조정하여 낮은 속도로 셀을 분배하여 전단 응력과 웰 바닥에 대한 높은 충격으로 셀에 잠재적 손상을 주지 않도록 합니다. 경륜의 고이를 11.43 mm(사용된 세포 배양판에 따라, 보충도1)로 조정하여, 분배 과정에서 우물 바닥에 미치는 세포 충격을 낮출 수 있을 만큼 충분히 높지만, 액적의 유지를 피할 수 있을 만큼 충분히 낮습니다. 분배 헤드. 각 행을 분배한 후 플레이트 위에 디스펜싱 헤드를 자유롭게 변위할 수 있도록 플레이트 클리어 높이를 16mm로 조정합니다.
- 연동 액상 핸들러 헤드 높이의 적절한 설정을 시각적으로 제어: 디스펜싱 하는 동안 디스펜싱 팁에 방울이 유지되지 않도록 하고 각 행을 분배한 후 헤드가 충분히 높은지 확인하십시오.
참고: 낙하 유지를 피하는 것은 신뢰할 수 없는 셀 번호를 분배하는 중요한 매개 변수입니다.
- 1 μL 희석제 디스펜스 단계의 경우, 1 μL 카세트를 장착하고 1.1.1.1 및 1.1.2 단계에 설명된 대로 설정이 있는 프로그램을 준비한다.
- DNA 플라스미드 제제(고전적인 미니프렙 추출 프로토콜)
- 125 μg/mL ampicillin 선택 항생제(표)로 보충된 LB 배지에서형질전환된 DH5α 박테리아 균주를 37°C에서 하룻밤 동안 오비탈 셰이커(200 rpm)에서 부드럽게 교반(200 rpm)하여 성장시켰다(재료표).
- 배양의 2 mL을 수확하고, 6,000 x g에서 5 분 동안 원심분리하여 세포를 펠렛하고, 상류를 버린다.
- RNase A(재료표)를 함유 한 재서스펜션 버퍼 250 μL로 세포 펠릿을 다시 일시 중단하십시오. 제조업체의 지침에 따라 250 μL의 용해 버퍼를 추가하고 실온에서 5 분 동안 배양하십시오.
- 300 μL의 중성화 버퍼(재료 표)를 추가하고 곧 vortexting하여 lysis 반응을 중지합니다. 11,000 x g에서 5 분 동안 튜브를 원심 분리기.
- 새로운 플라스미드 미니컬럼(TableofMaterials)을 2mL 컬렉션 튜브에 놓고 11,000 x g에서1분 동안 원심분리하여 기둥에 상급자를 장식한다.
- 흐름을 버리고 미니컬럼을 컬렉션 튜브에 다시 놓습니다.
- 플라스미드 미니컬럼을 500 μL의 선택적세척 버퍼(재료 표)로 세척하고 원심분리기를 11,000 x g에서1분 동안 세척하십시오.
- 플로우스루를 버리고 플라스미드 미니컬럼을 수집 튜브에 다시 놓습니다.
- 제조업체의 지침에 따라 11,000 x g에서 1 분 동안 에탄올과 원심 분리기로 보충 된 700 μL의 세척 버퍼 (재료 표)를 추가하십시오.
- 플로우스루를 버리고 플라스미드 미니컬럼과 수집 튜브를 11,000 x g에서 2분 동안 1배 더 원심분리하여 실리카 멤브레인을 건조시킵니다.
- 말린 플라스미드 미니컬럼을 새로운 1.5 mL 튜브에 넣고 60°C에서 미리 데운 증류수 30 μL을 넣고 실온에서 2분 동안 배양한 다음 11,000 x g에서1분 동안 원심분리합니다.
- 플라스미드 미니컬럼을 버리고 정제된 DNA 플라스미드를 함유한 용루를 보관한다.
- 마이크로볼륨 분광광도계(물자 표)를 사용하여 용출된DNA의DNA 농도를 측정하였다.
- 분광광도계를 켜고 DNA 측정 설정을 선택합니다.
- 분광광도계와 파이펫 1 μL의 샘플링 암을 측정 받침대에 올려 빈 교정을 수행합니다.
- 샘플링 팔을 낮추고 빈 측정을 시작하고 완료될 때까지 기다립니다.
- 샘플링 팔을 들어 올리고 상부 및 하부 받침대에서 샘플을 닦습니다.
- 이를 측정하기 위해 하부 받침대에 DNA 용액의 피펫 1 μL.
- 샘플링 암을 내리고 DNA 농도 측정을 시작하고 완료될 때까지 기다립니다.
- 샘플링 팔을 들어 올리고 상부 및 하부 받침대에서 샘플을 닦습니다.
- 추가 DNA 농도 측정을 위해 1.2.13.5-1.2.13.7 단계를 반복합니다.
- 측정이 완료되면 DNA 용액을 사용할 때까지 4 °C에 보관하십시오.
2. ADE 기반 디스펜싱을 구동하는 픽리스트의 실험적 설계 및 생성
참고: DNA 양을 관리하고 384웰 플레이트 형식으로 최대 4개의 플라스미드를 혼합하기 위해 전용 "사용자 친화적인" 스프레드시트 매크로가 개발되었습니다. 입력된 실험 설계에 기초하여, 이 매크로는 나노에스터에 의해 ADE 기반 DNA 변환 프로토콜을 구동하는 데 필요한 파일을 생성한다. 이러한 파일을 생성하려면 그림2와 같이 템플릿 시트에 여러 필드를 채워야 합니다.
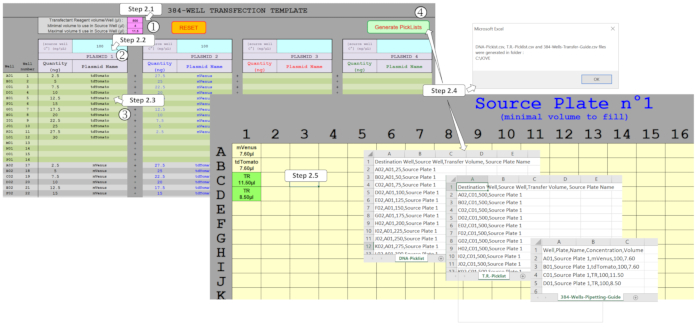
그림 2 : 스프레드시트 매크로를 사용하여 ADE 경륜을 구동하기 위한 픽리스트 생성. 소스 플레이트에 사용되는 형질감염시약(TR) 및 최소/최대 부피, (2) 소스 플레이트에서 분배되는초기 플라스미드 농도, 및 (3) 384웰의 각 플라스미드 양과 멀티플렉싱을 포함한 전체 플레이트 디자인. (4) Picklists 생성 활성화를 통해 다양한 필드를 확인할 수 있으며, 제대로 채워지면 DNA 및 TR 경륜에 대한 픽리스트와 필요한 소스 플레이트 템플릿이 자동으로 생성됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 분홍색 필드에 나노 디스터 프로토콜 매개 변수를 입력합니다. 형질감염 시약(TR) 혼합물 값을 500 nL로 설정합니다. 소스 플레이트 웰의 최소 부피 값을 4 μL로 설정합니다. 소스 플레이트 웰의 최대 부피를 11.25 μL로 설정합니다.
참고: 여기에 사용되는 나노 에스터제는 ADE의 한 번의 실행에서 최대 500 nL만 전송할 수 있습니다. 이러한 분홍색 필드는 권장값으로 미리 채워지지만 사용자 요구에 따라 수정할 수 있습니다. - 기본 DNA에 해당하는 파란색 필드에 100 ng/μL DNA 시작 농도를 입력합니다.
참고: 이 값은 이전에 정의된 최적의 농도이지만 사용자 요구에 따라 수정할 수 있습니다. - 회색/녹색 필드에 원하는 DNA 양을 입력합니다. 384 웰의 양과 플라스미드 이름을 입력하여 동일한 플라스미드가 여러 우물에서 사용되는 경우 동일한 철자를 보장합니다.
- 소스 플레이트 설계, 피리스트 파일 및 파이펫팅 가이드 파일을 생성합니다. 매크로가 DNA-Picklist.csv, T.R.-Picklist.csv 및 해당 시트에 수집된 데이터에서 384-Wells-Pipetting-Guide.csv 파일을 생성할 수 있도록 선택 목록 생성을 클릭합니다. 요청되는 경우 나노 에스터디스터에서 처리할 수 없는 오류 또는 볼륨을 나타내므로 주황색으로 채워진 셀 값을 수정합니다.
- 소스 플레이트 시트에서 템플릿을 인쇄합니다. 플라스미드 이름과 우물을 채우기 위한 최소한의 부피가 표시됩니다. 마찬가지로, 다음에 채워져야 할 형질감염 시약 혼합물 부피는 TR로 표시되고 녹색으로 강조 표시됩니다.
3. 384 웰 파이펫팅 가이드 응용 프로그램을 이용한 DNA 소스 플레이트 제조
- 저장된 DNA 플라스미드를 증류수를 사용하여 1.2.14 단계에서 100 ng/μL로 희석한다.
- 플레이트 치수에 384 웰 그리드를 보정: 태블릿에 384 웰 파이펫팅 가이드응용 프로그램을 엽니 다 (그림 3). 아래 화면의 그리드에 소스 플레이트를 놓고 왼쪽 상단 교정 메뉴에서 + 또는 클릭하십시오 - (또는 빨간색 커서를 사용하여) 그리드및 웰의 크기를 향상시키거나 줄이면 플레이트의 네 개의 코너 웰로 녹색 우물을 조정합니다. .

그림 3 : 384웰 파이펫팅 가이드 어플리케이션 사용. (1) 플레이트 크기로 384 웰 그리드의 교정; (2) 양면 테이프를 사용하여 태블릿에 범용 3D 프린팅 플레이트 어댑터를 장착; (3) 어댑터에 플레이트의 배치; (4) 격자의 변위가 장착 된 플레이트에 중심을 놓습니다. (5) 교정 단계의 잠금. (6) 384 웰 파이펫팅 guide.csv 파일의 개방. (7) 파일 리스트를 감안할 때, 응용 프로그램은 예상 소스 플레이트 이름, 시약 (DNA 또는 형질 감염 시약), 농도 및 대상 웰내로 분배하는 부피를 하나씩 표시할 것이다. (8) 좌우 화살표 버튼을 통해 사용자는 파이펫팅 가이드를 따라 스프레드시트 매크로 소스 플레이트 템플릿에 따라 시약을 쉽게 분배할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 양면 테이프를 사용하여 3D 인쇄 플레이트 어댑터를 화면에 장착하여 디스펜싱 하는 동안 소스 플레이트의 움직임을 방지합니다. 필요한 경우 회전 화살표와 위/아래/오른쪽/왼쪽 버튼을 사용하여 보정된 그리드를 이동하여 화면의 그리드를 플레이트 위치로 조정합니다. 그리드와 웰 사이즈가 제대로 보정되고 위치가 되면 잠금 보정 상자를 선택합니다.
- FILE을 클릭하고 384 웰 파이펫팅 guide.csv 파일을 엽니다. 화면 지시에 따라 표시된 플라스미드의 표시된 부피를 흰색으로 표시된 농도에서 수동으로 분배하여 예상 플레이트의 적절한 표적에 잘 부합하는 강조 를 강조한다. 사용 - 또는 + 화살표는 DNA 분배 과정에서 뒤로 또는 더 멀리 이동합니다. 로드할 첫 번째 트랜스펙션 시약 솔루션에 도달할 때 디스펜싱을 중지하십시오.
- DNA 경륜의 시대가 끝나면 어댑터에서 소스 플레이트를 제거합니다. 여러 소스 플레이트를 채워야 하는 경우 어댑터에 새 소스 플레이트를 놓고 디스펜싱 지침을 따르십시오. DNA 분배가 끝나면 DNA 로 채워진 소스 플레이트(1,500 x g에서 2분)를 원심분리하여 적절한 액체 평준화를 보장하고 ADE 기반 전달의 부정확성을 초래하는 기포를 제거합니다.
4. 대상 플레이트에서 연동 액 처리기 기반 1 μL 희석제 경륜의 시대
참고: 생물학적 안전 캐비닛에서 단계 4.1-4.5를 수행합니다.
- 1 μL 카세트 헤드를 스프레이 소독제(재료 표)로분사하여 소독하고 이 용액이 팁 홀더에 들어갈 수 있도록 합니다. 흡수 용지에 남은 소독제를 흡수합니다. 연동 액체 처리기 장치에 1 μL 카세트를 장착합니다. 장치를 켜고 카세트 유형 설정이 올바른지(1 μL), 플레이트 형식(384웰)이 올바른지 확인합니다.
- 튜브의 전체 루멘을 소독 : 튜브 주최자 (8 개의 튜브를 함께 들고)를 멸균 용기에 넣고 70 % 알코올 5 mL로 채웁니다. 연동 액 처리기의 프라이밍 기능을 사용하여 먼저 튜브에서 알코올을 씻어 내고 증류수 5 mL과 혈청이없는 배지 5 mL (덜베코의 수정 된 독수리 배지 [DMEM]을 100 U / mL로 보충하여 헹구습니다. 페니실린 - 스트렙토 마이신; 재료의표), 연속적으로 같은 용기에 충전. 모든 팁의 액체 흐름을 육안으로 검사하여 팁이 막히지 않았는지 확인하십시오.
- 10 mL의 미리 따뜻무우한 혈청이없는 매체로 새로운 멸균 용기를 채우고 튜브 주최자를 다이빙하여 무혈 청 배지로 튜브를 우두를 냅니다. 연동 액 핸들러의 프라임 버튼을 약 10초 동안 누릅니다. 다시 한번, 모든 액체 흐름을 육안으로 검사하여 팁이 막히지 않도록 하십시오.
- 희석제 1 μL로 접시를 채웁니다. 연동 액상 처리기 플레이트 캐리어에 멸균 된 384 웰 배양 플레이트 (대상)를 놓고 뚜껑을 제거하십시오.
- 384웰 플레이트의 각 웰에서 1 μL을 분배하기 위해 사전 보정된 프로그램을 실행합니다. 분배 시간은 약 8s입니다. 그런 다음 384 웰 플레이트의 뚜껑을 교체하십시오.
참고: 또는 이 단계는 다중 채널 마이크로파이펫을 사용하여 안전 캐비닛에서 수동으로 처리할 수 있습니다.
5. 수동으로 분배된 볼륨을 제어하는 설문조사의 성능
참고: 자세한 내용은 그림4를 참조하십시오.
- 나노 에스터디터 프로그램을 실행하고 진단 탭으로 이동하여 소스 플레이트 아웃 박스를 체크하고 플레이트 홀더에 소스 플레이트를로드한 다음 플레이트에 입력하려면 In을 선택합니다. 메시지가 표시되면 384LDV_AQ_B2를 선택하여 나노 디스펜서를 수성 버퍼 디스펜싱 모드로 설정하고 확인을누릅니다.
- 기타 메뉴에서 측량 측기를 선택하고 시작을 클릭합니다. 미리 채워진 웰을 선택하여 분석하고 이동 버튼을 클릭합니다. 측정된 볼륨이 예상 볼륨과 일치하는지 확인하고 전송을 방지할 수 있도록 12μL 이상의 부피가 있는 웰이 로드되지 않았는지 확인합니다.
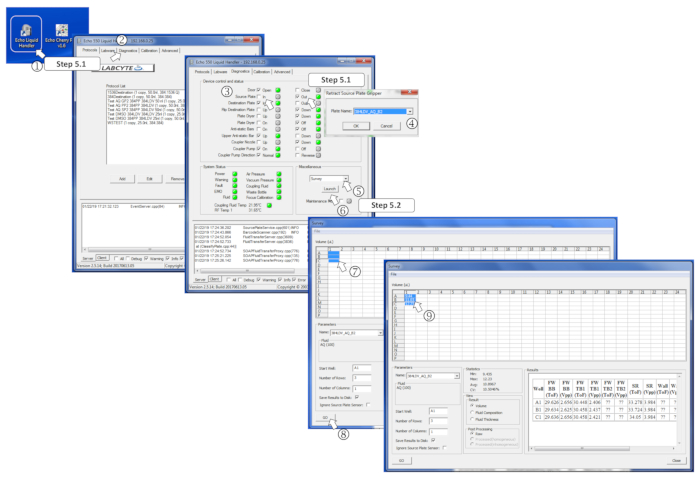
그림 4 : 측량 소프트웨어 매개변수 정의 (1) 나노 에스터디스터 프로그램을 시작합니다. (2) 진단 탭을 엽니다. (3) 소스 플레이트를 체크 아웃하여 소스 플레이트를 삽입한 다음 에서. (4) 메시지가 표시될 때 메뉴에서 소스 플레이트 유형을 정의합니다. (5) 기타 상자에서 드롭다운 메뉴에서 측량을 선택합니다. (6) 시작을 클릭하여 설문조사 프로그램을 시작합니다. (7) 측정할 미리 채워진 웰을 선택합니다. (8) 이동을 클릭하여 분석을 시작합니다. (9) 설문조사가 수행되면 측정된 부피가 해당 선택된 웰에 기록됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 대상 플레이트에 ADE 구동 DNA 경륜의 시대
- 선택 목록 소프트웨어를 실행하고 384웰 소스 및 대상 플레이트 유형을 각각 384_LDV 및 Greiner 384PS_781096으로 설정합니다(그림 5). 384LDV_AQ_B2를 선택하여 장치를 수성 버퍼 디스펜싱 모드로 설정하고 "전송 처리량 최적화"를 선택 취소합니다.

그림 5 : 픽리스트 기반 경륜의 시대의 성능. (1) 나노 에스터 디스펜서 소프트웨어를 시작합니다. 프로토콜 탭에서 샘플플레이트 형식을 선택(2) 대상 플레이트 유형 (4) "전송 처리량 최적화"를 선택합니다. (5) 목록 선택 탭을 선택합니다. (6) 가져오기를 클릭하고 적절한 *.csv 파일 (DNA-PickList 또는 T.R.-Picklist)을 선택합니다. (7) 일단 선택, 클릭 가져오기. (8) 재생을 클릭하고 프로토콜을 저장합니다. (9) 시뮬레이션을 클릭하여 경륜 시뮬레이션을 수행하거나 (10) 실행을클릭하여 프로그래밍된 분배를 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- "목록 선택" 탭을 선택하고 가져오기를 클릭하고 DNA-Picklist.csv 파일을 선택합니다. 재생을 클릭하고 프로토콜을 저장합니다. 시뮬레이션을 클릭하여 프로그래밍된 경륜의 시대의 시뮬레이션을 수행하여 선택 목록이 예상 실험 설계와 일치하는지 확인합니다. 완료되면 닫기를 클릭합니다.
- 재생을 클릭하고 실행하여디스펜싱 프로그램을 시작합니다: 요청된 소스 플레이트(DNA 용액을 수동으로 채워진)와 나노 디스펜서에 대상 플레이트(희석제 충전)를 삽입합니다.
참고: 디스펜싱 시간은 실험 설계에서 선택한 부량과 총 경륜의 시대 수에 따라 완전한 384웰 플레이트의 경우 약 5-20분입니다. - 또는 희석제 및 DNA 충전 플레이트가 최대 7일 동안 건조 또는 냉동 저장을 처리할 수 있기 때문에 여기서 프로토콜을 일시 중지합니다. 건조 보관을 위해 접시를 실온에서 벤치에서 건조시키고 동일한 방법으로 보관하십시오. 용형 단계 (섹션 7)에서 사용하기 전에 해동 및 원심 분리기 (2 분 동안 1,500 x g에서) 냉동 저장된 플레이트.
7. ADE 기반 의형 변환 시약 경륜의 시대
- 생체 안전성 캐비닛에서, 혈청이 없는 배지에서 1배 최종 농도로 극세적으로 희석된 리포폴리플렉스 형질감염 시약을. 소용돌이 및 매크로에 의해 설계된 미리 정의된 소스 플레이트에 따라 이러한 형질전환 시약 혼합물을 즉시 분배하고 3.4단계에서 설명한 바와 같이 사전 보정된 384 웰 파이펫팅 가이드 애플리케이션을 사용한다.
참고 : 원심 분리 후 형질전환이 발견되지 않기 때문에 시약으로 로드되면 소스 플레이트를 원심 분리하지 마십시오. - 나노에스터디스터 프로그램을 실행하여 섹션 5에 설명된 바와 같이"측량"을 실행하여, 12 μL을 초과하는 부피에 의한 디스펜싱 오류를 피하기 위해 소스 플레이트의 모든 수동으로 채워진 TR 웰의 부피를 제어한다.
- 리셋을 클릭하여 picklist 소프트웨어에서 DNA 선택 목록의 샘플 목록을 지우고 장치 매개 변수가 여전히 수성 버퍼로 설정되어 있는지 확인하고 6.1 단계에서와 같이 사용되는 소스 및 대상 플레이트 유형으로 설정되어 있는지 확인합니다.
- 가져오기를 클릭하고 TR-Picklist.csv 파일을 선택합니다. 재생을 클릭하고 메시지가 표시되면 프로토콜을 저장하고(선택사항이지만 강력하게 권장되는) 프로그래밍된 트랜스펙션 시약 혼합물 경륜의 시대를 시뮬레이션하여 버튼을 시뮬레이션합니다. 완료되면 닫기를 클릭합니다.
- 재생을 클릭하고 실행 버튼을 클릭하여 디스펜싱 프로그램을 시작합니다: 요청에 따라 소스 플레이트(들)(TR-혼합물 충전)와 대상 플레이트(희석제 및 DNA 충진)를 나노 에스터제에 놓습니다.
참고: TR 혼합물 500 nL를 분배할 때 완전한 384웰 플레이트의 디스펜싱 시간은 20분 미만입니다. - 제조자의 프로토콜에 의해 지시된 바와 같이 DNA에 TR을 첨가한 후 실온에서 15-30분 동안 인큐베이팅한다.
8. 연동 액체 처리기 기반 세포 경륜
- 디스펜싱 셀을 위해 연동 액 처리기를 준비합니다. Aniospray Surf 29 소독제로 10 μL 카세트 헤드를 소독하고 종이에 남은 것을 흡수합니다. 연동 액상 처리기 장치에 카세트를 장착하고 카세트 유형 설정을 10 μL로 변경하고 플레이트 형식이 384 웰로 설정되어 있는지 확인하십시오.
- 4.2단계에서 앞서 설명한 바와 같이 10 μL 카세트 튜브를 소독한다. 멸균 용기에 튜브 주최자를 다이빙하고 70 % 알코올의 5 mL로 튜브를 플러시 한 다음 증류수 5 mL로, 마지막으로 5 mL의 혈청이없는 배지로 동일한 용기에 연속적으로 채워지고 각 튜브가 비어 날 때까지.
- 셀 서스펜션을 분배할 준비를 합니다. 수렴된 HeLa 세포 B10 배양 접시에서 1x 인산완충식염수(PBS) 용액으로 세포를 1x 세척한 다음 37°C에서 트립신/EDTA로 세포를 해리합니다.
- 현미경으로 세포 해리를 확인하고 완전한 배지 10 mL (DMEM은 10 % 태아 소 혈청 및 100 U / mL 페니실린 - 스트렙 토마이신으로 보충) 배양 접시에 트립신/ EDTA 작용을 중지합니다. 50 mL 튜브에서 세포를 수확하고 Malassez 세포 또는 자동 세포 카운터를 사용하여 현미경으로 세포를 계산합니다.
- 튜브 프라이밍 및 40 μL/well 경륜을 보장하기 위해 완전한 배지(즉, 1,500개의 세포/40 μL)의 농도에서 HeLa 세포 현탁액의 최소 25mL를 준비합니다.
- 세포를 분배하기 위해, 준비된 셀 현탁액으로 새로운 멸균 용기를 채우고 침전을 피하여 경륜의 시대의 세포 밀도가 부정확해지도록 저어줍니다. 이 솔루션에 튜브 오거나이저를 삽입하고 셀 서스펜션이 디스펜싱 헤드에서 플러시되기 시작할 때까지 프라임 버튼을 누릅니다. 모든 부분의 액체 흐름을 육안으로 검사하여 팁이 막히지 않았는지 확인하고 각 튜브에 셀 서스펜션이 로드되었는지 확인하십시오.
- 연동 액상 처리기 플레이트 캐리어에 DNA 및 TR 충전 된 384 웰 대상 플레이트를로드하고 뚜껑을 제거합니다. 전체 384웰 플레이트(즉, 1,500개의 세포/웰)에서 셀 현탁액 40 μL을 분배하기 위해 사전 보정된 프로그램을 실행합니다. 디스펜싱 시간은 약 8s. 384 웰 플레이트의 뚜껑을 교체하십시오.
참고: 또는 40 μL 셀 서스펜션은 멀티채널 마이크로파이펫을 사용하여 수동으로 디스펜싱할 수 있습니다.
9. 사용자 정의 생물학적 분석 (세포 형질 감염 효율 모니터링)
참고: 실험의 설정 및 의도에 따라, 발광, 형광, 고함량 스크리닝 및 역전사 정량적 중합효소 연쇄 반응(RT-qPCR)에 필요한 방법을 사용한다. 프로토콜의이 섹션에서, 세포 형질 감염 효율은 자동 형광 현미경 및 이미지 분석에 의해 평가된다.
- 37°C에서 5% CO2로 플레이트를 수포화 분위기에서 적절한 단백질 발현이 될 때까지 배양합니다.
참고: 여기에서, 48 시간 배양 시간은 tdTomato- 및 mVenus 표현 플라스미드를 사용하여, 형질감염 효율을 감시하기 위하여 HeLa 세포를 위해 이용됩니다. - 배양 배지 48h 후 형질전환판을 제거하고, 연동액 처리기(10 μL 카세트)를 사용하여 30 μL/well 의 10% 포르말린을 추가하고, 실온에서 15분 동안 배양한다.
- 플레이트를 반전시킴으로써 포르말린을 제거하는; 그런 다음 1 x PBS 용액에서 희석 된 0.1 ng / mL Hoechst로 실온에서 15 분 동안 세포를 배양하십시오.
- 포르말린 용액 인큐베이션 단계의 6.9 pH에 의해 손실된 높은 형광 신호를 복구하기 위해 pH=8로 조정된 1x PBS의 80 μL로 세포를 15분 동안 3x 세척한다.
- 자동 형광 현미경을 사용하여 10배 의 목표와 적절한 방출 필터 세트(4′,6-diamidino-2-phenylindole [DAPI], dsRed 및 불소세인)로 2개 또는 3개의 형광 채널(Hoechst, tdTomato 및 mVenus)의 이미지를 순차적으로 획득합니다. [FITC])
- 형질감염 효율을 평가하려면 이미지 분석 소프트웨어를 사용하여 핵 염색을 기반으로 하는 스크립트 분석을 사용하여 형질감염 효율을 결정합니다.
Access restricted. Please log in or start a trial to view this content.
결과
fADE 기술이 자동 역형질 감염 프로토콜에 사용될 수 있는지 확인하기 위해 적색 형광 tdTomato 발현 플라스미드를 사용하여 형광 현미경으로 세포 형질 전환 효율을 모니터링했습니다. 먼저 최고의 형질 감염 파라미터를 결정하는 것을 목표로, 다른 희석제 부피 및 DNA의 총 양은 교차 시험되었다. 희석제 부피는 DNA 방울이 일단 분배되면, 예비 실험에서 관찰된 불균일성 형란...
Access restricted. Please log in or start a trial to view this content.
토론
주어진 세포주에 대한 정확한 고처리량 형벌 방법의 확립 및 최적화는 과학자들이 이 섹션에서 설명하는 몇 가지 주요 매개 변수를 따라야 합니다. HeLa 세포에 최적화된 이러한 설정도 HEK 세포에 대해 효율적이라는 것이 입증됨에 따라 프로토콜 전반에 걸쳐 권장값으로 시작하는 것이 좋습니다. 그러나, 최상의 파라미터는 세포주 및 형질감염 시약에 의존할 수 있기 때문에, 최적의 조건은 세포 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 이 문서의 연구, 저자 및/또는 출판에 대한 다음과 같은 재정적 지원의 영수증을 공개했다: Inserm, 릴 대학, 릴 파스퇴르 연구소, Conseil 레지오날 뒤 노르, PRIM-HCV1 과 2 (폴 드 레체 Interdisciplinaire sur le Médicament), 에이전시 내셔널 드 라 레체 (ANR-10-EQPX-04-01), 페더 (12001407 (D-AL) Equipex Imaginex BioMed) 및 유럽 공동체 (ERC-STG INTRACELLTB n° 260901). 저자는 원고의 비판적 검토와 수정에 대해 S. Moureu 박사, B. Villemagne 박사, R. 페루 클레멘트 박사, H. Groult 박사에게 감사를 표하고자 합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder | 12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). | version 2.79b | used to design the plate adapter |
참고문헌
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064(2018).
- Mirus Bio. Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. Factors Influencing Transfection Efficiency | Thermo Fisher Scientific - FR. , https://www.thermofisher.com/fr/fr/home/references/gibco-cell-culture-basics/transfection-basics/factors-influencing-transfection-efficiency.html (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36(2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4(2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. Reverse transfection method. , WO2001020015A1(2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937(2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023(2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- Transfection | TransIT Transfection Reagents | Mirus Bio. , https://www.mirusbio.com/products/transfection (2015).
- American Type Culture Collection. General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , https://www.atcc.org/~/media/Transfection%20protocols/TransfeX/TransfeX%20General%20Protocol%20on%20letterhead.ashx (2017).
- American Type Culture Collection. Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , http://www.lgcstandards-atcc.org/~/media/PDFs/Marketing%20Material/Cell%20Biology/Transfection%20reagents%20for%20nucleic%20acid.ashx (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. FuGENE® 6 Transfection Reagent. , https://www.promega.com/-/media/files/resources/protocols/technical-manuals/101/fugene-6-transfection-reagent-protocol.pdf (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Eliminating Endotoxin at the Source - A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. Mamat, U., et al. 28th Annual Symposium of the Protein Society, San Diego, CA, , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , https://www.labcyte.com/content/applications/high-precision-cell-dispensing-with-the-labcyte-echo-liquid-handler (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유