Method Article
Murine Mantar Sepsis Modelinde Verimli Kuyruk Damarı Enjeksiyonları için Çağdaş Isınma/Kısıtlama Cihazı
Bu Makalede
Özet
Burada, benzersiz bir şekilde tasarlanmış bir ısıtma / kısıtlama cihazı kullanarak kemirgen kuyruk damarı enjeksiyonları için etkili ve verimli bir yöntem sunuyoruz. Vazodilasyon ve kısıtlama süreçlerinin başlatılmasını kolaylaştırarak, bu protokol, en az sıkıntıya sahip büyük hayvan gruplarının doğru ve zamanında intravenöz enjeksiyonlarına izin verir.
Özet
Kemirgen modellerinde kuyruk damarı enjeksiyonları deneysel ajanların intravenöz yönetimi için önemli yöntemlerdir. Kuyruk damarı enjeksiyonları tipik olarak vazodilasyonu teşvik etmek için hayvanın ısınmasını içerir, bu da hem kan damarlarının tanımlanmasına hem de iğnenin damar lümenine yerleştirilmesine yardımcı olur ve hayvanı güvenli bir şekilde dizginler. Kuyruk damarı enjeksiyonları birçok protokolde yaygın prosedürler olmasına ve doğru yapılması durumunda son derece teknik olarak kabul edilmesine rağmen, doğru ve tutarlı enjeksiyonlar tekrarlanabilir sonuçlar elde etmek ve değişkenliği en aza indirmek için çok önemlidir. Kuyruk damarı enjeksiyonlarından önce vazodilasyonu teşvik etmek için geleneksel yöntemler genellikle ısı lambası, elektrik/şarj edilebilir ısı pedleri veya 37 °C'de önceden ısıtılmış su gibi bir ısı kaynağının kullanılmasına bağlıdır. Standart bir laboratuvar ortamında kolayca erişilebilen bu araçlar açıkça zayıf/sınırlı termo-düzenleyici kapasiteden muzdariptir. Benzer şekilde, çeşitli kısıtlama cihazları ticari olarak mevcut olmasına rağmen, hayvanlara travmayı önlemek için dikkatlice kullanılmalıdır. Mevcut yöntemlerin bu sınırlamaları deneylerde gereksiz değişkenler yaratır veya deneyler ve/veya laboratuvarlar arasında değişen sonuçlarla sonuçlanır.
Bu yazıda, bağımsız, termal olarak düzenlenmiş, ısıtma cihazını ayarlanabilir bir sınırlama ünitesiyle verimli bir şekilde kolaylaştırılmış kuyruk damarı enjeksiyonu için tek bir sistemde birleştiren yenilikçi bir cihaz kullanarak geliştirilmiş bir protokol gösteriyoruz. Kullandığımız örnek, sepsis ile sonuçlanan mantar kan dolaşımı enfeksiyonunun intravenöz bir modelidir. Isınma aparatı, iç sıcaklığı önceden ayarlanmış bir eşikte tutmak için ayarlanabilir otomatik termostat ile monte edilmiş ısı yansıtıcı akrilik bir kutudan oluşur. Aynı şekilde, koni sınırlama cihazının genişliği ve yüksekliği, çeşitli kemirgen boyutlarını güvenli bir şekilde barındıracak şekilde ayarlanabilir. Cihazın gelişmiş ve çok yönlü özellikleri ile burada gösterilen teknik, kuyruk damarı enjeksiyonları kullanan kemirgen modellerini içeren bir dizi araştırma alanında yararlı bir araç haline gelebilir.
Giriş
Kemirgenleri içeren hayvan modellerinin kullanımı biyomedikal araştırmaların temelini oluşturuyor. Dünya çapındaki laboratuvarlarda çok sayıda inbred ve outbred suşunun yanı sıra genetiği değiştirilmiş çizgiler mevcuttur ve rutin olarak kullanılmaktadır. Kuyruk damarı enjeksiyonu, kemirgen modellerinde deneysel ajanların intravenöz (yani) yönetimini gerektiren temel yöntemlerden biridir. Genel olarak, i.v. enjeksiyonları, yerel dokuları ve sindirim sistemini atlayarak yüksek emiciliği oranları ve çok çeşitli konsantrasyonların veya fizyolojik olmayan pH1,2,3,4çözeltilerine yüksek tolerans gibi diğer uygulama yollarına göre büyük avantajlara sahiptir. Diğer canlı i.v. rotaları (örneğin, saphenous damarlar, retro-orbital venöz sinüs), kuyruk damarları kemirgenlerde en güvenli ve en kolay erişilebilir kan damarı olarak kabul edilir2,3,5,6. Bu nedenle, kuyruk damarı enjeksiyonu, enfeksiyöz hastalık modelleri 7 ,8,9,biyolojik malzemelerin nakli10,11,klinik öncesi terapötiklerin değerlendirilmesi12,13 ve toksikolojik analizler14,15dahil olmak üzere bir dizi kemirgen modelinde yaygın olarak almıştır.
Başarılı kuyruk damarı enjeksiyonlarında dosingin tutarlılığı ve doğruluğu kritik bir gerekliliktir. Şaşırtıcı bir şekilde, literatürde kuyruk damarı enjeksiyonlarının nicel ve nitel değerlendirilmesi sık sık yanlış enjeksiyonları madde16,17. Bir çalışma, eğitimli enjektörler tarafından gerçekleştirilen otuz enjeksiyondan on ikisinin, enjekte edilen dozların% 10'undan fazlasını kuyruk içinde bıraktığını bildirdi18. Ek olarak, kuyruk damarı enjeksiyonları alan hayvanın güvenliği ve konforu işlem sırasında birincil endişe kaynağı olmalıdır. Yanlış kısıtlama yaralanmalara ve numune kalitesinde önemli değişkenler getirebilecek strese bağlı bir dizi patolojiye (örneğin, kilo kaybı, bağışıklık tepkilerinde bozulma) yol açabilir19,20. Bu hatalar verilerde değişkenliğin artmasına ve tekrarlanabilirliğin zayıflığına neden olabilir, böylece çalışma sonuçlarını olumsuz yönde etkiler.
Hayvanda damar genişlemesinin indüksiyonu, farelerde 300 μm olduğu tahmin edilen damarın küçük çapı nedeniyle kuyruk damarı enjeksiyonları yapılırken genellikle gereklidir21. Vazodilasyon kuyruk damarlarının görünürlüğünü arttırır ve venöz lümen içinde optimum iğne damarı hizalamasının sağlanmasına yardımcı olur. Kuyruğu ılık suya batırmak22,ılık bir örtü, lamba veya saç kurutma makinesi23 , 24kullanarak kuyruğa ısı uygulamak veya hayvanı bu ısı kaynaklarından biriyle birlikte bir ısıtma yastığı, inkübatör veya kutu kullanarak sıcak bir ortama yerleştirmek gibi çeşitli yöntemler laboratuvarlar tarafından bildirilmiştir25. Cihazlar belirli amaçlar için kendi kendine yapılabilir veya ticari tedarikçilerden temin edilebilir. Bununla birlikte, birçoğu thermoregulatory yeteneklerinden yoksundur ve varsa, cihaz sıcaklığı zayıf bir şekilde korunur ve genellikle oda sıcaklığındaki değişikliklere maruz kalır. Benzer şekilde, anestezi kullanımı önerilmediği için kuyruk damarı enjeksiyonları için bir kısıtlama cihazının kullanılması gereklidir26,27. Laboratuvara özgü veya ticari kısıtlama cihazlarının çeşitli türleri geliştirilmiştir. Tipik olarak, hayvan tek kullanımlık 50 ml konik tüp4, oluklu pleksiglas duvarlara, bir tünele veya koni28'e yerleştirilir , bunların hepsi hayvanın hareketlerini kısıtlarken kuyruğun bol miktarda maruz kalmasına izin verir. Bununla birlikte, çoğu kısıtlayıcı, malzemelerin sertliği nedeniyle boyut sınırlamalarına sahiptir. Ayrıca, modern yüksek karmaşıklıklı cihazlar, pratik ve sofistike tasarımlara rağmen, büyük hayvan gruplarını içeren enjeksiyonlar için mümkün görünmüyor22.
Kan dolaşımı enfeksiyonu ve ilişkili sepsis fare modelleri, bu tekniğin kullanılmasını gerektiren durumların en önemli örneğidir. Şiddetli klinik sepsisin tüm mikrobiyal etiyolojisi arasında, mantar sepsis genellikle antifungal tedaviye rağmen% >40 ölüm oranları ile ölümcül bir durumdur29. Aslında, Candida albicans enfeksiyonu, hastane tarafından edinilen kan dolaşımı enfeksiyonunun dördüncü önde gelen nedeni olarak bildirilmiştir (kandidiyemi)30,31. Karın içi kandidiyaziste, gastrointestinal sistemdeki mikroorganizmalar kan dolaşımı yoluyla yayılabilir ve daha da büyük mortalite ile polimikrobiyal sepsise neden olabilir32,33,34. Nozokomi vakalarının çoğu kontamine merkezi hat kateterlerinden veya indwelling tıbbi cihazlardan ortaya çıktığı için35,36,yani kuyruk damarı enjeksiyonu ile C. albicans ile aşılama insan sepsis gelişimini yakından yansıtabilir ve hematojen olarak yayılan kandidiyazis37,38'infare modelinde temel bir yöntem olmuştur. Bu modelde, günler içinde ortaya çıkan mortalite, C. albicans yani inoculum39,40,41ayarlanarak uzatılabilir veya kısaltılabilir.
Son zamanlarda laboratuvarımız, ayarlanabilir bir kısıtlama ünitesi ile eşleştirilmiş, uygun bir sistemde, temoregüle edilmiş bir ısıtma ünitesi ile donatılmış yenilikçi bir cihaz kullanarak en uygun şekilde kolaylaştırılmış kuyruk damarı enjeksiyonu için yenilikçi bir protokol geliştirmiştir. Bu protokol, araştırmacıların kuyruk damarı enjeksiyonlarını doğru ve zamanında yapmalarına izin verirken, hayvanlar prosedür için en az sıkıntıyla güvenli bir şekilde koşullandırılabilir ve kısıtlanabilir. Burada gösterilen teknikler, gelişmiş ısıtma ve kısıtlama cihazının kullanımıyla, kemirgen modellerini kullanan çeşitli araştırma alanlarında yararlı bir araç olarak hizmet edebilir.
Protokol
Kuyruk damarı enjeksiyonları ve ısınma/kısıtlama cihazının kullanımını içeren tüm hayvan protokolleri yerel Kurumsal Hayvan Bakım Komitesi (IACUC) tarafından gözden geçirildi ve onaylandı.
1. Hazırlık
- Hayvanları en az 1 hafta boyunca barınma ortamına alıştırın ve yiyecek ve su reklam libitumuna izin verin.
NOT: Bu enjeksiyon tekniğinin çoğu yeni kullanıcısı için, kuyruk damarları ciltte kolayca görülebildiğinden, beyaz veya açık renkli kürklü hayvan suşları tercih edilebilir. Farelerin koyu renkli suşları (örneğin, C57BL/6) veya sıçanlar (örneğin, Kahverengi Norveç) derin pigmentli kuyruklara sahiptir ve bu da damara karşı zayıf bir renk kontrastı ile sonuçlanır. Yeterlilik elde edilene kadar yeni kullanıcıların yeterli eğitim alması şiddetle tavsiye edilir. - Kuyruk damarı enjeksiyonu için ajanlar
- Tüm test ajanlarını ve çözümlerini aseptik olarak hazırlayın. Organizmaları veya hücresel malzemeleri uygularken, pirojen içermeyen koşulları korumak için tüm işlem adımları sırasında önlem alın.
- Kuyruk damarı enjeksiyonu için araç olarak sadece normal salin (%0,9 w/v sodyum klorür) veya fosfat tamponlu salin (PBS) gibi dengeli tuz çözeltileri kullanın.
DİkKAT: Potansiyel damar hasarı riski nedeniyle asla su, yağ veya viskoz çözeltiler kullanmayın. Kemirgenlerde kanın tamponlama etkisi ve hızlı kan akış hızları nedeniyle çok çeşitli pH (4.5–8.0) tolere edilebilir. Bununla birlikte, yüksek derecede asidik veya alkali çözeltiler enjeksiyon bölgesinde gereksiz doku hasarına neden olabilir ve kaçınılmalıdır. - Enjeksiyon hacmini ve sıklığını minimumla sınırlayın. Hayvana stresi en aza indirmek için enjeksiyondan önce vücut sıcaklığında fareler ve sıçanlar için önerilen hacimleri (sırasıyla ≤200 μL ve≤500μL) kullanın 3 .
- Şırınga ve iğnenin her preparatının çözeltideki hava kabarcıklarından arındırılmış olduğundan emin olun; kabarcıklar varsa, emboli riskini önlemek için tamamen temizleyin.
NOT: Tipik olarak, 27 G, 1/2 inç iğneli 1 mL şırıngalar çoğu kuyruk damarı enjeksiyonu için yeterlidir. - En az tek kullanımlık veya özel önlük ve lateks veya nitril eldiven ile yerel IACUC'un gerektirdiği uygun kişisel koruyucu ekipmanı (KKD) kullanın. Kuyruk damarı enjeksiyonu yapılırken güvenlik gözlüklerinin kullanılması şiddetle tavsiye edilir.
- Isınma ve kısıtlama cihazı
- Cihazın herhangi bir kusurdan arındırılmasını sağlamak için kullanmadan önce tüm bileşenleri dikkatlice inceleyin (Şekil 1).
- Isınma cihazı başlatma (Şekil 2A)
- Isınma ünitesini temiz düz bir tezgah üzerine yerleştirin ve cihazı açık tutun. Termostat güç göstergesi lambasının yeşil yandığından emin olun. Alanı kuru tutmak ve ısıyı korumak için yatak malzemelerini ısıtma odasının içine yerleştirin.
- Kısıtlama cihazı kurulumu (Şekil 2B)
- Kısıtlama ünitesini ısıtma ünitesinin yanına yerleştirin ve hayvan için uygun koni boyutlarını belirleyin. Gerekirse, hayvan için yeterli kısıtlama sağlamak için esnek alüminyum koninin taban genişliklerini manuel olarak ayarlayın. Alternatif olarak, koniyi, farklı vücut boyutlarındaki fareleri veya sıçanları barındırmak için özel olarak monte edilmiş modellerle değiştirin.
2. Kuyruk damarı enjeksiyonu
- Aparat ayarlamaları
- İç sıcaklığı ayarlama
- Kontrol kadranını kullanarak termostatı istediğiniz sıcaklığa ayarlayın. Isıtıcı göstergesinin kırmızı yandığından ve ampulnün yandığından emin olun. Ampul yanarken (ısıtma) iç sıcaklık göstergesini dikkatlice izleyin. Termostat, hedef sıcaklık ulaştığında ampulü yaklaşık 10-15 dakika içinde otomatik olarak devre dışı bırakmaz.
NOT: Ortam sıcaklığından daha yüksek bir sıcaklık ayarlamak ısıtıcıyı etkinleştirir. Genel olarak, standart vivaryum koşullarında önerilen muhafaza sıcaklığı 20 ila 26 ° C arasında değişirken, laboratuvar fareleri için nötr (yani rahat) sıcaklık 30 ila 32 ° C42arasında kabul edilir. Bu nedenle, ısınma odasının iç sıcaklığının termonötraliteden biraz daha yüksek, yaklaşık 32-36 ° C'de yükseltilmesi önerilir. Termostatı asla vücut sıcaklığının üzerine ayarlamayın.
- Kontrol kadranını kullanarak termostatı istediğiniz sıcaklığa ayarlayın. Isıtıcı göstergesinin kırmızı yandığından ve ampulnün yandığından emin olun. Ampul yanarken (ısıtma) iç sıcaklık göstergesini dikkatlice izleyin. Termostat, hedef sıcaklık ulaştığında ampulü yaklaşık 10-15 dakika içinde otomatik olarak devre dışı bırakmaz.
- Kısıtlama platformunun konumlandırılması
- Yükseklik ayarlama düğmesini kullanarak koni yüksekliğini kullanıcı için en uygun seviyeye ayarlayın.
- İç sıcaklığı ayarlama
- Isıl işlem (Şekil 3A)
- Hedef sıcaklığa (32-36 °C) ulaştıktan sonra, hayvanları konut kafesinden ısınma odasına hafifçe aktarın.
NOT: Vazodilasyona neden olmak ve kuyruk damarlarının görünürlüğünü artırmak için 5-10 dakika ısıl işlem yeterlidir. Bununla birlikte, hayvanlar prosedür süresince termoregüle odasında güvenle tutulabilir (tipik olarak hipertermi belirtisi olmadan 20-30 dk). Isınma odası güvenli bir şekilde 4-6 fare veya bir sıçan içerebilir. - Hayvanı akut ısı stresi belirtileri için izleyin (örneğin, hızlı solunum, uyuşukluk, atlama kaçış davranışı).
DİkKAT: Hipertermi belirtileri gösteren hayvanlar, yeniden kullanımdan önce normal aktiviteye devam edene kadar kafeslerine geri verilmeli ve izlenmelidir. Bunun nedeni iç sıcaklığın en uygun aralığı aşmasıysa, ısınma cihazının kapalı olduğundan emin olun.
- Hedef sıcaklığa (32-36 °C) ulaştıktan sonra, hayvanları konut kafesinden ısınma odasına hafifçe aktarın.
- Ekleme adımları
- Hayvanı kuyruğun tabanından kaldırın ve ısınma odasından çıkarın. Hayvanı kısıtlama ünitesinin koni açıklığı üzerine sokun.
DİkKAT: Fareleri asla kuyruk ucundan kaldırmayın; bu ciddi yaralanmalara neden olabilir. Obez veya hamile fareler için alternatif yol tutuş yöntemleri kullanılmalıdır28. - Hayvan koninin uzak kenarında forelegleriyle kavrarken, kuyruğu yavaşça geriye doğru çekin ve kuyruğu açık yarıktan geçirin. Hayvanın arka ucunu koninin tabanına, bir arka bacağı koniden çıkıntı yaparak sabitleyin, böylece yanal damar saat 12 pozisyonunda gösterilir. Her iki tarafta bir tane olmak üzere iki yanal damar olduğu için arka bacaktan biri çıkıntı yapılabilir (Şekil 3B).
- Kuyruğu orta ila üçte iki uzunluğunda başparmak ve işaret parmağı arasındaki baskın olmayan el ile kavrayın, kuyruk konumlandırmasını ve vazodilasyonunu korumak için yanal damara hafif bir gerginlik koyarak.
NOT: Isıl işlemle genişlemiş damarların gelişmiş görünürlüğü, kullanıcının en iyi sonuçlar için hızlı bir şekilde bir enjeksiyon bölgesi belirlemesini sağlar (Şekil 4). - Enjeksiyon bölgesinin derisini% 70 alkolle nemlendirilmiş bir gazlı bez süngeri veya ped ile silin. Kuyruğun tahrişini önlemek için mümkün olduğunca nazikçe ve hızlı bir şekilde temizleyin.
NOT: Bu prosedür kurumsal IACUC'nin takdirine bağlı olarak atlanabilir. - Şırıngayı baskın el ile tutun ve iğneyi kuyruğa paralel yerleştirin. İğneyi kan akışının yönüne doğru yerleştirin, 10-15° açıyla(Şekil 5A–B)eğimli olun ve 2–4 mm(Şekil5C-D)nüfuz ederek damarın lümenine daha da ilerleyin. Çözeltiyi yavaşça enjekte edin.
NOT: Enjeksiyon başarılı olursa pistonda direnç hissedilmemeli ve sıvı damarda hareket ederken görülebilir. Enjeksiyon bölgesinin üzerinde direnç veya beyaz kabarcıklar olması durumunda, iğneyi çıkarın ve orijinal iğne yerleşiminin üzerindeki bir bölgeye ikinci bir enjeksiyon girişiminde bulunun. Sıvı ilk bölgeden geçeceğinden, ilk enjeksiyon bölgesinin altına enjekte etmeye çalışmayın. Bir lateral damar enjeksiyonu başarısız olursa, hayvanı karşı tarafa yeniden konumlandırın ve kontralatör damar üzerinde daha fazla girişimde bulunun. Maksimum deneme sayısı, damar boyunca enjeksiyon girişimine nereden başladığına ve kaçırılan girişimlerle oluşabilecek şişmeye bağlı olacaktır. Yanlış enjeksiyonlar ve ilişkili yaralanmalar için kurumsal IACUC düzenlemelerine danışın. - İğneyi çıkarın ve enjekte edilen çözeltinin ve/veya kanın geri akışını önlemek için başparmakla sıkıca bastırın. Kanama durana kadar temiz bir gazlı bez/mendil veya doku ile nazik sıkıştırma uygulamaya devam edin (Şekil 6).
- Hayvanı kafesine geri koyun ve en az 5 dakika izleyin. Hayvanın daha fazla kanama olmadan normal aktiviteye devam etmesine emin olun.
- Hayvanı kuyruğun tabanından kaldırın ve ısınma odasından çıkarın. Hayvanı kısıtlama ünitesinin koni açıklığı üzerine sokun.
3. Mantar kan dolaşımı enfeksiyonu ve sepsis bir murine modeli
- Fare suşları
- Dişi swiss Webster, kurumsal olarak önerilen yönergeler başına 6 haftalıkken fareleri yetiştirdi. Alternatif olarak, değiştirilmiş inocula ile bu protokol için inbred/genetiği değiştirilmiş suşlar (örneğin, C57BL/6 arka plan) kullanın (bkz. NOT).
NOT (bkz. Ayrıntı için tartışma): Koyu kürklü farelerin kuyruk damarları, derin pigmentli kuyruk nedeniyle genellikle daha hafif kürklü olanlara göre daha az görünür (Şekil 4). Farklı fare suşları arasında mantar sepsis / öldürücülüğüne karşı değişen duyarlılık vardır. Swiss Webster dışındaki fare suşlarının kullanımı, konak bağışıklık durumunu etkileyebilecek ilgili faktörleri (örneğin, genetik arka plan, yaş, cinsiyet, vücut büyüklüğü) göz önünde bulundurarak ek protokol optimizasyonu gerektirebilir. Örneğin, C57BL/ 6 farelerde ölümcül bir zorluk, İsviçre Webster farelerinde görülen ölüm seviyesine ulaşmak için tipik olarak daha yüksek inokula (10x'e kadar) gerektirir.
- Dişi swiss Webster, kurumsal olarak önerilen yönergeler başına 6 haftalıkken fareleri yetiştirdi. Alternatif olarak, değiştirilmiş inocula ile bu protokol için inbred/genetiği değiştirilmiş suşlar (örneğin, C57BL/6 arka plan) kullanın (bkz. NOT).
- Mikroorganizma -lar
- Ölümcül bir meydan okuma (sepsis) için, Candida albicans'ın donmuş stokları DAY185'i (veya tercih ettikleri suşları) Sabouraud dekstroz agarına zorlar ve 2 gün boyunca 30 ° C'de kuluçkaya yatır.
- Tek bir koloniyi 10 mL maya özü-peptone-dekstroz suyuna ve kültürü sallanarak 30 ° C'de 18 saat boyunca sabit büyüme aşamasına aktarın.
- Inoculum çözümleri
- Ölümcül bir meydan okuma gününde, et suyu kültürünü toplayın ve peleti steril PBS'de santrifüjleme (800 × g)ile 3 kez yıkayın.
- Canlı maya hücrelerini trypan mavi boya dışlama ile tanımlayın ve bir hemositometre kullanarak numaralandırır. Oda sıcaklığında steril PBS'de hücre konsantrasyonu 1 x10 6 hücre/mL olarak ayarlayın.
NOT: Her hayvan 100 μL inoculum çözeltisi alacaktır. Enjeksiyon işlemi sırasında potansiyel kayba izin vermek için fazla miktarda inoculum (>500 μL) hazırlayın. Son inoculum fare başına 1 x 105 hücredir. Hücre konsantrasyonu buna göre ayarlanarak inokülum hacmi 200 μL'ye kadar arttırılabilir.
DİkKAT: Mantar inoculum çözeltisi enjeksiyondan önce oda sıcaklığında tutulmalıdır. Inoculum çözeltisinin vücut sıcaklığına ısıtması maya hücrelerinden hyphae'ye morfolojik bir değişikliğe neden olabilir. Aksine, soğuk çözeltilerin bolus i.v yönetimi hayvanın vücut sıcaklığını hızla düşürebilir ve kaçınılmalıdır.
- İntravenöz aşılama
- Hayvanları ısıtın ve bölüm 2'deki prosedürleri izleyerek vazodilasyona neden olan.
- 27 G, 1/2 inç iğne ile 1 mL şırınga kullanarak kuyruk damarına 100 μL inoculum çözeltisi enjekte edin.
- Aşı sonrası izleme
- Hayvanları aşağıdaki sepsis kaynaklı morbidite belirtileri için izleyin: i) kürk yönü (örneğin, pürüzsüz, fırfırlı), ii) aktivite (örneğin, serbestçe hareket eden, tepkisiz), iii) duruş (örneğin, kambur, sert), iv) davranış (örneğin, yavaş, yer değiştirme yok), v) göğüs hareketleri (örneğin, normal solunum, dispne), vi) göz kapakları (örneğin, açık, kapalı)43.
- Sepsis puanlama
- Sepsis için değiştirilmiş fare klinik değerlendirme puanına (M-CASS) göre gözlemlenen morbiditeyi her kategoride 0'dan 3'e dört puanlık bir derecelendirme ölçeğinde puanlamak: 0, normal; 1, hafif; 2, ılımlı; 3, şiddetli43.
- İsteğe bağlı protokol: Mantar sepsisine karşı aşılama
- Ölümcül bir meydan okumadan on dört gün önce, C. albicans DAY185 yerine 3.2-3.4 bölümlerinde açıklandığı gibi, Candida dubliniensis suşu Wü284 veya Δefg1/Δcph1 mutant (fare başına 1x105 hücre) gibi zayıflatılmış C. albicans suşları ile fareleri aşılayın.
- 3.2–3.4 bölümlerinde açıklandığı gibi aşılanmış farelerde ölümcül bir zorluk meydana gelir ve 3.5-3.6 bölümlerinde açıklanan sepsis kaynaklı morbidite belirtilerini izleyin.
Sonuçlar
Isınma odasının içindeki sıcaklık, iç sensör tarafından sürekli olarak algılanır ve termostat tarafından otomatik olarak düzenlenir. İlk olarak, termostatın kontrol kadranı ayarlanan sıcaklıkları seçmek için 78, 85, 90 veya 95 °F (26, 29, 32 veya 95 °C) olarak konumlandırılmıştır. Isıtıcı etkinleştirildikten sonra(Şekil 7, sarı noktalar), ampul tarafından ısı emisyonu, ayarlanan sıcaklığa bağlı olarak ilk 5-15 dakika boyunca iç sıcaklığı hızla yükseltti. Isıtıcı, tespit edilen iç sıcaklığın ayarlanan sıcaklığı (gri noktalar) aşması durumunda ampulü devre dışı bırakmıştır. İlk pik sıcaklıklar, hayvan transferi sırasında sıcaklık kaybını dengelemek için tüm gruplarda belirlenen sıcaklıkların 5-7 ° C üzerine çıkmalıdır. Daha sonra, cihaz ısı döngüsünü otomatik olarak tekrarlamaya devam eder ve ısınma odasını ayarlanan sıcaklıkta tutar.
Mevcut protokol kullanılarak başarılı kuyruk damarı enjeksiyonları ile elde edilen deneysel verilere bir örnek Şekil 8'de gösterilmiştir. Sepsis ile sonuçlanan bir kan dolaşımı kan dolaşımı kandidiyazis fare modelinde, İsviçre Webster farelerinde Candida albicans (fare başına 1 x10 5 hücre) ile yapılan bir i.v. meydan okuması, sepsisin hızlı bir şekilde başlamasına ve organizmaların yayılmasına neden oldu ve 3-4 gün içinde yüksek mortaliteye yol açtı (açık noktalar) (Şekil 8A). Buna karşılık, hayvanlar önceki i.v. ön bağışıklama / aşı ile avirulent maya suşu, Candida dubliniensis, virülan C. albicans (katı noktalar) ile ölümcül i.v. meydan okumasından sonra% >95 hayatta kalma elde ederek sepsisten korunabilir. Progresif mortalite ve aşı aracılı koruma ile ilgili bu sonuçlar dört bağımsız deneyde tekrarlanabilir olarak elde edilmiştir(Ek Şekil 1). Benzer koruma, zayıflatılmış C. albicans mutantları (Δefg1/Δcph1) (veriler gösterilmez) gibi diğer avirulent maya suşları kullanılarak elde edilebilir. Sepsis de izlenebilir ve mortalite ile ilişkili olabilir; ölümcül enfeksiyona sahip aşılanmamış hayvanlar sepsis kaynaklı morbiditede önemli bir artış gösterirken, aşılanan grup ölümcül meydan okumanın ardından minimum semptomlar gösterdi (Şekil 8B).

Şekil 1: Kemirgen ısıtma ve kısıtlama cihazının açıklaması. (A) aşağıdakilerden oluşan ısıtma cihazının dış görünümünü gösterir:
- Termostat kapağı – termostatı açığa çıkarmak için tutamak tarafından yukarı doğru kaldırın
- Elektrik muhafazası – koruma için kalıcı olarak kapatılmış
- Oda kapağı – hayvan transferi sırasında yukarı doğru kaldırın/buradan
- Isınma odası – çıkarılabilir, kullanmadan önce zemini yataklarla kaplayın
- Kısıtlama aparatı – kullanılmazken ısıtma cihazıyla birlikte yerleştirilebilir
- Güç anahtarı – ana açma/kapama işlevleri için satır içi rocker anahtarı
- Güç kablosu – gerilim/akım: 120V/10A
(B) ısıtma cihazının içini gösterir:
- Akkor ampul – 100 Watt'ta ışık çıkışı
- Ampul koruyucu kalkan – ampul değişimi için çıkarılabilir
- Sıcaklık sensörü probu – odanın içinde bulunur
- İç sıcaklık termometresi - sıcaklığı izlemek için haznenin içine yerleştirin
(C) ısıtma cihazı termostatının bileşenlerini gösterir:
- İç sıcaklık termometresi
- Termostat – ısıtıcıyı otomatik olarak düzenler
- Setpoint kontrol kolu – minimum/maksimum: 78 °F/108 °F (25 °C/42 °C)
- Termostat güç göstergesi – yeşil ışık normal çalışma gösterir
- Termostat ısıtıcı göstergesi – ısıtma döngüsü sırasında kırmızı yanar
(D) sınırlama cihazının bileşenlerini gösterir:
- Koni – kemirgen kısıtlaması için tasarlanmış esnek alüminyum levha
- Kuyruk kanalı – kuyruğun düzgün konumlandırılmasına izin vermek için şekillendirildi
- Koni kaldırma platformu - koni tabanının sağlam bir şekilde kaldırılmasını sağlar
- Yükseklik ayarlama düğmesi – manuel yükseklik ayarı için tasarlanmıştır
- Makas jakı – yükseklik aralığı 45–140 mm (1,77-5,52")
- Destek plakası – stabilite sağlamak için kauçuk ayaklarla monte edilmiş Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kemirgen ısıtma ve kısıtlama cihazı. (A) Kullanmadan önce, cihazın iki parçası temiz bir tezgah üstüne yan yana yerleştirilir. (B) Isınma cihazı açıldıktan sonra, termostat ısıtıcıyı etkinleştirir. Ampul yanmaya devam eder ve ısınma odası ayarlanan sıcaklığa ulaşana kadar ısı yayar. Isınma cihazı, iç sıcaklığı korumak için ısı döngüsünü otomatik olarak tekrarlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Isınma ve kısıtlama cihazına yerleştirilen fareler (C57BL/6). (A) Vazodilasyon için ısıl işlem gören fareler. Hayvanlar (tedavi başına 4-6 fare) barınma kafeslerinden cihazın ısınma odasına aktarılır ve en az 5-10 dakika ısıl işlemden geçirilir. Fare, ısınma odasından, kuyruğu açık yarıktan geçen sınırlama cihazının koni açıkına aktarılır. Fare, kuyruğun tabanı koninin ucuna ulaşana kadar koninin uzak kenarına hafifçe geri çekilir. Hayvan hafif bir yanal dönüşle koninin tabanına doğru çekilirken, bir arka bacak yukarı doğru konumlandırılmıştır, böylece açık yarıktan çıkıntı yaparak yanal kuyruk damarının saat 12'de konumlandırılmasını sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Farelerde lateral kuyruk damarlarının tanımlanması. (A) Tedavi edilmemiş bir İsviçre Webster faresinin kuyruğu. Fare, vazodilasyon için önceden ısıl işlem yapılmadan kısıtlama cihazına yerleştirilir. Yanal kuyruk damarı, cildin altından geçen ince koyu bir damar olarak tanımlanabilir. (B) 10 dakika boyunca ısıtma cihazı ile tedavi edilen İsviçreli bir Webster faresinin kuyruğu. Isıl işlem görmüş fare kuyruk damarı enjeksiyonu için kısıtlanmıştır. Lateral kuyruk damarı, vazodilasyonun neden olduğu genişlemiş damar çapı nedeniyle ciltten kolayca görülebilir. (C) Bir C57BL / 6 farenin kuyruğu 10 dakika boyunca ısıtma cihazı ile tedavi edilir ve kuyruk damarı enjeksiyonu için kısıtlanır. Vazodilasyon, damara karşı zayıf bir renk kontrastı nedeniyle damar açık renkli İsviçre Webster farelerindeki kadar kolay görünmese de, derin pigmentli ciltten kuyruk damarının görünürlüğünü arttırır. Kırmızı oklar yanal kuyruk damarının yerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Isıl işlem görmüş farelerde (Swiss Webster) yapılan kuyruk damarı enjeksiyonu. (A–B) Enjeksiyon yerindeki lateral kuyruk damarına iğne yerleştirilmesi. İğne (27 G, 1/2-in) kuyruk damarına paralel olarak eğim yukarı doğru konumlandırılmış ve kan akışına doğru yönlendirilmiş ve yerleştirilmiştir. (C–D) Kuyruk damarında iğne yerleşimi ve enjeksiyon. İğnenin ucu damarın lümenine 2-4 mm daha ilerlemiş. Başparmak şırınnanın pistonu üzerine yerleştirilmiştir ve istenen hacim yavaş ve sabit basınçla dağıtılmıştır. Oval daireler enjeksiyon bölgelerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
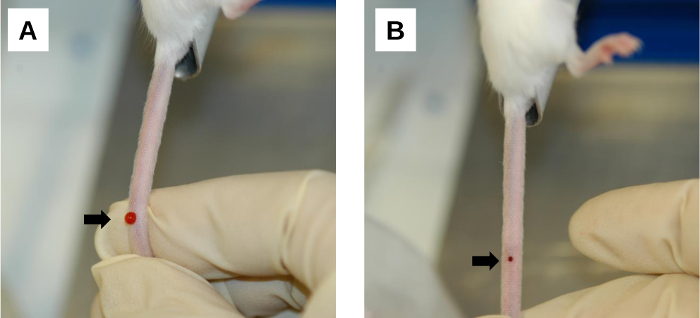
Şekil 6: Enjeksiyon sonrası prosedür. (A) Enjeksiyon bölgesinde kanama bölgesi. Enjekte edilen çözeltinin kanaması ve geri akışı iğne çıkarıldıktan hemen sonra meydana gelir. Bu, başparmakla enjeksiyon bölgesine sıkı sıkıştırma uygulanarak en aza indirilebilir. (B) Enjeksiyon yerinde kan pıhtısı oluşumu. Temiz bir gazlı bez/silme ile nazik sıkıştırma, enjeksiyon yarası üzerinde kanın pıhtılaşmasını kolaylaştırır. Oklar ekleme alanlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
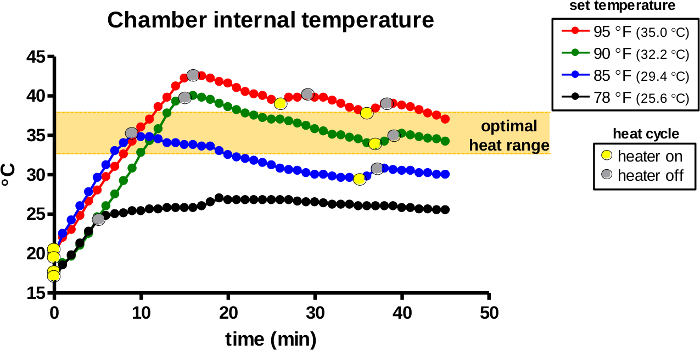
Şekil 7: Kullanım sırasında ısınma odasının iç sıcaklığı. Isınma cihazı belirlenen sıcaklıklarda ısınmak için etkinleştirildi. Cihazın ısınma odası iç hava sıcaklığı için izlendi ve ısı döngüleri (ampul açık / sarı noktalar, kapalı / gri noktalar) 45 dakika boyunca kaydedildi. Turuncu alan, kemirgenlerde vazodilasyonun indüksiyonu için en uygun sıcaklık aralığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
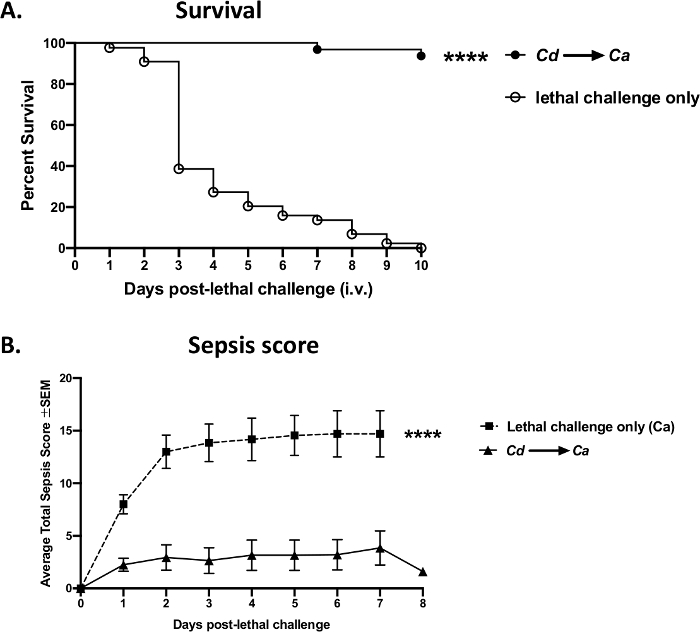
Şekil 8: Sepsis mortalitesi, Candida albicansile ölümcül bir meydan okumanın ardından aşı aracılı korumaya karşı . Fareler (8 haftalık İsviçre Webster dişileri) 14 gün sonra avirulent live Candida dubliniensis Wü284(Cd)ile intravenöz olarak aşılandı ve ardından vahşi tip C. albicans DAY 185 (fare başına 1 x 105 hücre) ile ölümcül bir intravenöz meydan okuma yapıldı. (A)Mortalite, ölümcül meydan okumadan sonraki 10 gün boyunca değerlendirildi. (B) Hayvanlar sepsis morbiditesi açısından izlendi ve Sepsis için değiştirilmiş Fare Klinik Değerlendirme Puanına göre puanlandı (M-CASS)43. Veriler, grup başına 10 fare ile yapılan 4 bağımsız deneyden kümülatiftir ve Mantel-Cox log-rank testi kullanılarak analiz edilir. s < 0.0001. SEM, ortalamanın standart hatası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Kan dolaşımı Candida albicans mücadelesinden sepsis mortalitesinin tekrarlanabilirliği ve aşı aracılı sağkalım. Her panel, Şekil 8A'dagösterilen kümülatif bir sonuca dahil edilen dört bağımsız denemeden elde edilen verileri temsil eder. Her deney grup başına 10 fare kullanılarak yapıldı ve Mantel-Cox log-rank testi kullanılarak analiz edildi. Ca, Candida albicans. Cd, Candida Dubliniensis. s < 0.0001. s < 0.01. Bu rakamı indirmek için lütfen tıklayınız.
Tartışmalar
Tutarlı ve doğru dosing, hayvan modellerinde deneysel güvenilirlik için temel gereksinimlerdir. Bu, enjekte edilen ajanların sistemik biyoyararlanımının diğer yönetim yollarına göre önemli ölçüde daha yüksek / daha hızlı olduğu i.v. yönetimi durumlarında özellikle önemlidir3. Bu nedenle, kuyruk damarı enjeksiyonundaki hatalar çalışma sonuçları üzerinde zararlı bir etkiye sahip olabilir. Tarihsel olarak, i.v. yerine intraperitoneal (i.p.) enjeksiyonu, teknik basitlik ve kolaylık nedeniyle kemirgenlerde sistemik erişim için en yaygın yöntem olmuştur. Bununla birlikte, hayvanlardan klinik ortamlara preklinik okumaları çevirirken yönetim yolları daha önemli hale gelir. Bu nedenle, başarılı kuyruk damarı enjeksiyonu kolaylaştırabilecek kemirgen protokollerinde sürekli iyileştirmeye ihtiyaç vardır.
Mevcut protokoldeki temel ilerleme, kemirgenlerde vazodilasyonun etkili bir şekilde indüksiyonunu sağlayan ve kuyruk damarlarının ve iğne hizalamasının görünürlüğünü önemli ölçüde artıran yenilikçi teergüle edilmiş ısıtma cihazıdır. Kötü şekilde terrigüle edilmiş ısıtma yöntemleri (örneğin, lambalar), topikal vazodilatörler veya cilt tahriş edicileri (örneğin, ksilenler) sadece güvenilmez değildir, aynı zamanda hayvan için de güvenli değildir ve kaçınılmalıdır44. Kuyruğu ılık suya batırmak gibi diğer geleneksel yöntemlerin aksine, bu cihazın otomatikgülasyon yeteneği aynı anda birden fazla hayvanı güvenli bir şekilde koşullayabilir. Ek olarak, bu protokol en uygun şekilde tasarlanmış kısıtlama cihazı kullanılarak ve hayvanın yanal kuyruk damarını en iyi şekilde görüntüleyen bir pozisyonda hızlı ve güvenli hareketsiz hale getirilmesine izin vererek daha da güçlendirilir.
Birçok mevcut kısıtlayıcıda görülen şeffaf tubal formatlar, pratik olarak iyi tasarlanmış olsa da, her hayvanla daha fazla kullanım süresi gerektirir, böylece kısıtlama işlemi45. Bu, sınırlı işbirliği sunan agresif özelliklere sahip kemirgen suşlarında daha sorunlu olabilir46,47. Buna karşılık, kısıtlama cihazının yarı kapalı koni yapısı, hayvanın hızlı bir şekilde konumlandırılmasına izin eder ve kısıtlama süresini en aza indirmeye yardımcı olur. Birlikte, yenilikçi, son derece optimize edilmiş ısıtma/kısıtlama sistemini kullanan kolaylaştırılmış protokol enjeksiyon prosedürünü hızlandırarak büyük hayvan gruplarının hızlı ve etkili bir şekilde dolanmasını sağlar. Laboratuvarımızda, genellikle bu protokolü kullanarak 1 saat içinde ısı tedavisinden enjeksiyon sonrası izlemeye kadar 30 farenin tüm enjeksiyon prosedürünü tamamlıyoruz.
Gelişmiş özelliklere rağmen, bu cihazın bazı belirgin dezavantajları vardır: birincisi cihazın maliyeti ve ısınma odasında rutin ampul değişimidir. Bununla birlikte, enjeksiyonların verimliliğine ve hızına ek olarak, cihaz tekrarlanan kullanım için dayanıklıdır ve en yaygın dezenfektanlarla uyumludur ve cihazın kullanımlar arasında kapsamlı bir şekilde temizlenmesine izin eder. Birlikte, bu ilk yatırımıdengeler. Second, sınırlı çalışma alanı olan durumlarda, bu protokole bir dezavantaj, enjeksiyonu gerçekleştirirken iki birimi yan yana yerleştirilecek kadar büyük bir tezgah alanı için gereklilik olabilir. Bununla birlikte, cihaz, i.v. enjeksiyonlarını içeren birkaç kemirgen protokolünde yaygın olarak kullanılabildiğinden, cihazın izofluran buharlaştırıcılar gibi diğer ortak vivarium ekipmanlarına benzer bir çekirdek cihaz olarak hizmet etmesi mümkündür. Ne olursa olsun, iki ünite kolayca taşınabilir ve kullanılmadığı halde paketlenebilir ve yerle bir edilebilir.
Bu protokolde açıklanan murine mantar sepsisinin i.v. ölümcül meydan okuma modeli, insanlarda C. albicans kan dolaşımı enfeksiyonlarını yakından taklit eder ve mantar virülansını incelemek, antifungal tedavilerin etkinliğini test etmek ve enfeksiyona konak immün yanıtları karakterize etmek için yaygın olarak kullanılmıştır37,39,48. Tekrarlanabilir bir enfeksiyon elde etmek için, yani kuyruk damarı enjeksiyonu yoluyla aşılama, organizmaların kan dolaşımına doğru bir şekilde teslimini sağlamak için protokolün en hayati adımıdır. Aslında, hayvanlar Candida yani zorlukların değişen seviyelerine çok farklı yanıt verirler; çok düşük miktarlarda inoculum verilmesi istenmeyen spontan iyileşmelere neden olurken, çok yüksek doz alan hayvanlar erken yenik düşer. Belirli bir organizmanın tutarlı bir sepsis/mortalite seviyesine neden olmak için spesifik inoculum boyutları penceresi büyük ölçüde hem mantar suşlarına hem de fare suşlarına bağlıdır.
1 x 105 vahşi tip C. albicans inoculum'da İsviçre Webster farelerini kullanan mevcut protokol, 1 gün içinde sepsis morbiditesinin başlangıcını tekrar tekrar indükler, ardından 5-7 gün% 100 öldürücülükle sonuçlanan progresif mortalite. Buna karşılık, 1 x 105'ten yüksek inocula tipik olarak hızlandırılmış ölümlere yol açar (yani, 1 x 10'da 1-2 gün6, 5 x 105'te 3-4gün ) ve 1 x 105'ten düşük olanlar alt öldürücüdür. Literatürdeki çok sayıda rapor doğrultusunda, C. albicans yerine albicans olmayan Candida türlerinin kullanımı önemli ölçüde azalmış ölümcüllük ile sonuçlanır40,49. Ek olarak, fare suşlarının seçimi, hatta kolonilerin kökeni, diğerleri tarafından bildirildiği gibi, fare suşları arasındaki değişen duyarlılıklar nedeniyle enfeksiyon sonuçları üzerinde önemli bir etkiye sahip olabilir39,40,41,50,51,52,53,54,55. Bu nedenle, deneyler tasarlanırken her ikisi de dikkate alınmalıdır.
Ölümcül bir i.v. meydan okumasının ardından, mantar hücreleri kan dolaşımına hızla yayılır ve en çok etkilenen böbrekler41olan birden fazla organı istila etmeye başlar. Etkilenen diğer organlar beyin, dalak ve kemik iliği48,56. Ne olursa olsun, akut sepsis erken zaman noktalarında nihai ölüm nedenidir37. Temsili sonuçlarda gösterildiği gibi, sepsis şiddeti, meydan okuyan hayvanlarda sepsis durumunun sergilenen belirtilerine dayanarak Sepsis için Fare Klinik Değerlendirme Puanı (M-CASS) ile nicel olarak değerlendirilebilir43,57. Ölümcül sepsisin çeşitli taşıyıcı belirteçleri arasında, hipotermi hem klinik hem de deneysel sepsis43,58,59'da yakın ölüm için kritik bir tahmin edici olarak önerilmiştir.
Bu modelde, bu modeldeki doğuştan gelen farelere karşı doğrudan karşılaştırmak için resmi bir çalışma yapılmamış olsa da, yetiştirilmiş İsviçre Webster fareleri kullanılarak mevcut protokolden elde edilen veriler, tahmin edilen genetik heterojenliğe rağmen, çeşitli sepsis parametrelerinde son derece tekrarlanabilir. Genel olarak, 3-5 gün içinde düşen bir mortalite modeli, sepsis morbiditesinde hızlı yükselme ve ölümcül meydan okumadan sonraki saatler içinde enflamatuar belirteçlerin seviyeleri ile kanıtlanan sağlam bir akut sepsis modelidir50,51. Daha uzun sağkalım süreleri (7-10 gün) için mortalite, muhtemelen hedef organlarda ve merkezi sinir sisteminde ölümcül doku hasarına yol açan mikrobiyal yükün sonucudur. Sepsis veya mikrobiyal yük seçimi, kullanılan inoculum tarafından belirlenen bağışıklık fonksiyonlarının veya antienflamatuar rejimlere veya antifungal tedavilere/aşılara verilen yanıtların değerlendirilmesi için gerektiği şekilde uygulanabilir.
İ.v. ölümcül meydan okuma modeline ek olarak, farelerde C. albicans ile bir i.p. meydan okuma yoluyla karın içi enfeksiyon da yaygın kandidiyazis ve sonraki sepsis yol açabilir, ancak bakteriyel patojen Staphylococcus aureus ile ortak aşılama, sinerjik olarak C. albicans mono-enfeksiyonu51,60,61ile karşılaştırıldığında mortaliteyi arttırır. I.p. ölümcül meydan okuma modelinde, polimikrobiyal peritonitlere ve organizmalarınkarın boşluğundan kan dolaşımına yayılmasına neden olmak için önemli ölçüde daha yüksek mikrobiyal inocula (fare başına1.75x 10 7C. albicans/8 x 10 7S. aureus) gereklidir. Benzer şekilde, bağışıklık sistemini baskılayıcı ve/veya mukozaya zarar veren ajanlarla tedavi edilen farelerde C. albicans ile gastrointestinal enfeksiyon mantar hücrelerinin kan dolaşımına geçişine yol açar ve mantar sepsis62,63ile sonuçlanır. Ayırt edici aşılama yollarına rağmen, mantar sepsisini verme mekanizması, organ yetmezliğine yol açan Candida'ya kontrolsüz sistemik proinflamatuar bir yanıt içeren üç hastalık modeli arasında büyük ölçüde benzerdir37,51,61. Benzer şekilde, insanlarda, sadece kandidiyemi değil, konakçı yanıtının bu sürecidir, sağlık hizmetleri ayarlarında edinilen hematojen olarak yayılan kandidiyazis ile ilişkili yüksek morbidite / mortaliteye neden olur64,65.
Mevcut mantar sepsis modelini kullanarak, burada ölümcül C. albicans enfeksiyonuna karşı korumanın, sepsis morbiditesinde önemli bir azalma ile birlikte C. dubliniensis (avirulent) veya zayıflatılmış C. albicans mutantları ile aşılanma / aşılama ile elde edilebileceğini gösteriyoruz. Koruma, kemik iliğinde eğitilmiş doğuştan gelen bağışıklık formu olarak indüklenmiş gibi görünen doğuştan gelen Gr-1+ miyeloid türevi baskılayıcı hücreler tarafından aracılık edilir66,67. C. albicans kan dolaşımı enfeksiyonlarına karşı doğuştan gelen bu bağışıklık aracılı koruma biçiminin anlaşılmasını genişletme çabaları devam etmektedir.
Sonuç olarak, yenilikçi kemirgen ısıtma / kısıtlama cihazı, büyük ölçekli çok gruplu hayvan çalışmalarının i.v. enjeksiyonlarını verimli ve etkili bir şekilde gerçekleştirme yeteneğimizi ilerletmemizde etkili olmuştur. Bu nedenle, cihaz için Mouse a Minute terimini icat ettik. Cihaz özellikleri, benzer bir cihazın satın alınması talebi üzerine ilgili yazardan temin edilebilir. Burada gösterilen teknikler, çok çeşitli araştırma alanlarında kuyruk damarı enjeksiyonları kullanan kemirgen modellerinde yararlı bir araç olarak hizmet edebilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma LSUHSC Vakfı (PLF) ve kısmen Louisiana Klinik ve Çeviri Bilim Merkezi'ni finanse eden Ulusal Sağlık Enstitüleri Ulusal Genel Tıp Bilimleri Enstitüsü'nden U54 GM104940 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Candida albicans strain DAY185 | Carnegie Melon University | N/A | provided by the laboratory of Aaron Mitchell |
| Candida albicans strain efg1Δ/Δ cph1Δ/Δ | University of Tennessee Health Sciences Center | N/A | provided by the laboratory of Glen Palmer |
| Candida dubliniensis strain Wü284 | Trinity College, Dublin, Ireland | N/A | provided by the laboratory of Gary Moran |
| Mice | Charles River Laboratories | 551NCICr:SW | Female Swiss Webster; 6-8 weeks old |
| Mice | Charles River Laboratories | 556NCIC57BL/6 | Female C57BL/6; 6-8 weeks old |
| Needles, 27G, ½-in | Becton Dickinson | 305109 | can be substituted from other vendors |
| Phosphate buffered saline (PBS) | GE | SH30028.02 | can be substituted from other vendors |
| Rodent warming and restraining device (Mouse a Minute) | LSU Health | custom order | Mouse a Minute is available for custom ordering from LSU Health |
| Sabouraud dextrose agar (SDA) | Becton Dickinson | 211584 | can be substituted from other vendors |
| Syringes, 1 mL | Becton Dickinson | 309659 | can be substituted from other vendors |
| Trypan blue solution | Sigma | T8154 | |
| Yeast peptone dextrose (YPD) broth | Fisher Scientific | BP2469 | can be substituted from other vendors |
Referanslar
- Woodard, G. Methods of animal experimentation. Gay, W. J. 1, 343-359 (1965).
- Shimizu, S. The laboratory mouse The handbook of experimental animals. Hedrich, H. J. , Elsevier Academic Press. Ch. 32 527-541 (2004).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. Journal of the American Association for Laboratory Animal Science. 50 (5), 614-627 (2011).
- Donovan, J., Brown, P. Parenteral injections. Current Protocols in Immunology. 73 (1), Chapter 1, Unit 1 6(2006).
- Schoch, A., Thorey, I. S., Engert, J., Winter, G., Emrich, T. Comparison of the lateral tail vein and the retro-orbital venous sinus routes of antibody administration in pharmacokinetic studies. Lab Animal. 43 (3), 95-99 (2014).
- Jarneborn, A., et al. Tofacitinib treatment aggravates Staphylococcus aureus septic arthritis, but attenuates sepsis and enterotoxin induced shock in mice. Scientific Reports. 10 (1), 10891(2020).
- Bussey, K. A., et al. Endosomal Toll-like receptors 7 and 9 cooperate in detection of murine Gammaherpesvirus 68 infection. Journal of Virology. 93 (3), (2019).
- Pitts, M. G., D'Orazio, S. E. F. A Comparison of oral and intravenous mouse models of listeriosis. Pathogens. 7 (1), (2018).
- Jespersen, H., et al. Clinical responses to adoptive T-cell transfer can be modeled in an autologous immune-humanized mouse model. Nature Communications. 8 (1), 707(2017).
- Gomez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Srinageshwar, B., et al. Surface-modified G4 PAMAM dendrimers cross the blood-brain barrier following multiple tail-vein injections in C57BL/6J mice. ACS Chemical Neuroscience. 10 (9), 4145-4150 (2019).
- Channabasappa, S., et al. Efficacy of novel antistaphylococcal ectolysin P128 in a rat model of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Sadeghi, B., et al. Preclinical toxicity evaluation of clinical grade placenta-derived decidua stromal cells. Frontiers in Immunology. 10, 2685(2019).
- Boquet, M. P., Wonganan, P., Dekker, J. D., Croyle, M. A. Influence of method of systemic administration of adenovirus on virus-mediated toxicity: focus on mortality, virus distribution, and drug metabolism. Journal of Pharmacological and Toxicological Methods. 58 (3), 222-232 (2008).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39 (4), 264-270 (2011).
- Lasnon, C., Dugue, A. E., Briand, M., Dutoit, S., Aide, N. Quantifying and correcting for tail vein extravasation in small animal PET scans in cancer research: is there an impact on therapy assessment. EJNMMI Research. 5 (1), 61(2015).
- Groman, E. V., Reinhardt, C. P. Method to quantify tail vein injection technique in small animals. Contemporary Topics in Laboratory Animal Science. 43 (1), 35-38 (2004).
- Aller, M. A., et al. Neuro-immune-endocrine functional system and vascular pathology. Medical Hypotheses. 57 (5), 561-569 (2001).
- McEwen, B. S., et al. The role of adrenocorticoids as modulators of immune function in health and disease: neural, endocrine and immune interactions. Brain Research. Brain Research Reviews. 23 (1-2), 79-133 (1997).
- Callewaert, B. L., et al. Absence of arterial phenotype in mice with homozygous slc2A10 missense substitutions. Genesis. 46 (8), 385-389 (2008).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods in Enzymology. 479, 397-411 (2010).
- Carlson, R. P. J., Peer, B. In Vivo Models of Inflammation Progress in Inflammation Research. Morgan, D. W., Marshall, L. , Birkhäuser, Basel. 1-50 (1999).
- Flecknell, P. Laboratory Animals: An Introduction for New Experimenters. Tuffery, A. A. , John Wiley and Sons. 225-260 (1987).
- Kim, M. J., Ahituv, N. The hydrodynamic tail vein assay as a tool for the study of liver promoters and enhancers. Methods in Molecular Biology. 1015, 279-289 (2013).
- Bargellini, A., et al. Effects of chronic exposure to anaesthetic gases on some immune parameters. Science of The Total Environment. 270 (1-3), 149-156 (2001).
- Elena, G., et al. Inhalatory anesthetic (halothane) associated changes in the immune response in mice. International Journal of Immunopharmacology. 19 (11-12), 699-707 (1998).
- Buerge, T. The Laboratory Mouse The handbook of experimental animals. Hedrich, H. J., Bullock, G. , Elsevier Academic Press. Ch. 31 517-526 (2004).
- Cohen, J., Cristofaro, P., Carlet, J., Opal, S. New method of classifying infections in critically ill patients. Critical Care Medicine. 32 (7), 1510-1526 (2004).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Magill, S. S., et al. Multistate point-prevalence survey of health care-associated infections. The New England Journal of Medicine. 370 (13), 1198-1208 (2014).
- Dupont, H., et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Archives of Surgery. 137 (12), 1341-1346 (2002).
- Montravers, P., et al. Candida as a risk factor for mortality in peritonitis. Critical Care Medicine. 34 (3), 646-652 (2006).
- Calandra, T., Bille, J., Schneider, R., Mosimann, F., Francioli, P. Clinical significance of Candida isolated from peritoneum in surgical patients. Lancet. 2 (8677), 1437-1440 (1989).
- Kojic, E. M., Darouiche, R. O. Candida infections of medical devices. Clinical Microbiology Reviews. 17 (2), 255-267 (2004).
- Ramage, G., Martinez, J. P., Lopez-Ribot, J. L. Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Research. 6 (7), 979-986 (2006).
- Spellberg, B., Ibrahim, A. S., Edwards, J. E., Filler, S. G. Mice with disseminated candidiasis die of progressive sepsis. Journal of Infectious Diseases. 192 (2), 336-343 (2005).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L. Animal models for candidiasis. Current Protocols in Immunology. 105 (1), (2014).
- Lionakis, M. S., Lim, J. K., Lee, C. C., Murphy, P. M. Organ-specific innate immune responses in a mouse model of invasive candidiasis. Journal of Innate Immunity. 3 (2), 180-199 (2011).
- Segal, E., Frenkel, M. Experimental in vivo models of candidiasis. Journal of Fungi. 4 (1), (2018).
- MacCallum, D. M., Odds, F. C. Temporal events in the intravenous challenge model for experimental Candida albicans infections in female mice. Mycoses. 48 (3), 151-161 (2005).
- Gordon, C. J. The mouse thermoregulatory system: Its impact on translating biomedical data to humans. Physiology & Behavior. 179, 55-66 (2017).
- Mai, S. H. C., et al. Body temperature and mouse scoring systems as surrogate markers of death in cecal ligation and puncture sepsis. Intensive Care Medicine Experimental. 6, 20(2018).
- Catty, D., Lehmann, P. F. A simple low-cost restrainer for the intravenous injection of mice. Sabouraudia. 16 (2), 89-90 (1978).
- Donovan, J., Brown, P. Handling and restraint. Current Protocols in Immunology. 73 (1), Chapter 1 Unit 1 (2006).
- Dow, H. C., et al. Genetic dissection of intermale aggressive behavior in BALB/cJ and A/J mice. Genes Brain and Behavior. 10 (1), (2010).
- Pugh, P. L., Ahmed, S. F., Smith, M. I., Upton, N., Hunter, A. J. A behavioural characterisation of the FVB/N mouse strain. Behavioural Brain Research. 155 (2), 283-289 (2004).
- MacCallum, D. M., Odds, F. C. Need for early antifungal treatment confirmed in experimental disseminated Candida albicans infection. Antimicrobial Agents and Chemotherapy. 48 (12), 4911-4914 (2004).
- Fakhim, H., et al. Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine model. Mycoses. 61 (6), 377-382 (2018).
- Remick, D. G., Newcomb, D. E., Bolgos, G. L., Call, D. R. Comparison of the mortality and inflammatory response of two models of sepsis: lipopolysaccharide vs. cecal ligation and puncture. Shock. 13 (2), 110-116 (2000).
- Nash, E. E., Peters, B. M., Palmer, G. E., Fidel, P. L., Noverr, M. C. Morphogenesis is not required for Candida albicans-Staphylococcus aureus intra-abdominal infection-mediated dissemination and lethal sepsis. Infection and Immunity. 82 (8), 3426-3435 (2014).
- Rogers, T., Balish, E. Experimental Candida albicans infection in conventional mice and germfree rats. Infection and Immunity. 14 (1), 33-38 (1976).
- Marquis, G., Montplaisir, S., Pelletier, M., Auger, P., Lapp, W. S. Genetics of resistance to infection with Candida albicans in mice. The British Journal of Experimental Pathology. 69 (5), 651-660 (1988).
- Ashman, R. B., Fulurija, A., Papadimitriou, J. M. Strain-dependent differences in host response to Candida albicans infection in mice are related to organ susceptibility and infectious load. Infection and Immunity. 64 (5), 1866-1869 (1996).
- Ashman, R. B., Bolitho, E. M., Papadimitriou, J. M. Patterns of resistance to Candida albicans in inbred mouse strains. Immunology & Cell Biology. 71 (3), 221-225 (1993).
- Liu, Y., Mittal, R., Solis, N. V., Prasadarao, N. V., Filler, S. G. Mechanisms of Candida albicans trafficking to the brain. PLoS Pathogens. 7 (10), 1002305(2011).
- Huet, O., et al. Ensuring animal welfare while meeting scientific aims using a murine pneumonia model of septic shock. Shock. 39 (6), 488-494 (2013).
- Kushimoto, S., et al. The impact of body temperature abnormalities on the disease severity and outcome in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis. Critical Care. 17 (6), 271(2013).
- Wiewel, M. A., et al. Risk factors, host response and outcome of hypothermic sepsis. Critical Care. 20 (1), 328(2016).
- Peters, B. M., Noverr, M. C. Candida albicans-Staphylococcus aureus polymicrobial peritonitis modulates host innate immunity. Infection and Immunity. 81 (6), 2178-2189 (2013).
- Nash, E. E., Peters, B. M., Fidel, P. L., Noverr, M. C. Morphology-Independent Virulence of Candida Species during Polymicrobial Intra-abdominal Infections with Staphylococcus aureus. Infection and Immunity. 84 (1), 90-98 (2016).
- Hirayama, T., et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation. Scientific Reports. 10 (1), 3814(2020).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal damage and neutropenia are required for Candida albicans dissemination. PLoS Pathogens. 4 (2), 35(2008).
- Vergidis, P., et al. Intra-abdominal candidiasis: The importance of early source control and antifungal treatment. PLoS One. 11 (4), 0153247(2016).
- Parker, J. C., McCloskey, J. J., Knauer, K. A. Pathobiologic features of human candidiasis. A common deep mycosis of the brain, heart and kidney in the altered host. American Journal of Clinical Pathology. 65 (6), 991-1000 (1976).
- Esher, S. K., Fidel, P. L., Noverr, M. C. Candida/Staphylococcal Polymicrobial Intra-Abdominal Infection: Pathogenesis and Perspectives for a Novel Form of Trained Innate Immunity. Journal of Fungi. 5 (2), (2019).
- Lilly, E. A., Ikeh, M., Nash, E. E., Fidel, P. L., Noverr, M. C. Immune protection against lethal fungal-bacterial intra-abdominal infections. mBio. 9 (1), (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır