Method Article
Un dispositivo contemporáneo de calentamiento / restricción para inyecciones eficientes de venas de la cola en un modelo de sepsis fúngica murina
En este artículo
Resumen
Aquí, presentamos un método efectivo y eficiente para las inyecciones de venas de la cola de roedores utilizando un dispositivo de calentamiento / restricción de diseño único. Al agilizar el inicio de los procesos de vasodilatación y restricción, este protocolo permite inyecciones intravenosas precisas y oportunas de grandes grupos de animales con una angustia mínima.
Resumen
En modelos de roedores, las inyecciones de venas de la cola son métodos importantes para la administración intravenosa de agentes experimentales. Las inyecciones de la vena de la cola generalmente implican el calentamiento del animal para promover la vasodilatación, lo que ayuda tanto en la identificación de los vasos sanguíneos como en la colocación de la aguja en la luz del vaso mientras se restringe de forma segura al animal. Aunque las inyecciones de la vena de la cola son procedimientos comunes en muchos protocolos y no se consideran altamente técnicas si se realizan correctamente, las inyecciones precisas y consistentes son cruciales para obtener resultados reproducibles y minimizar la variabilidad. Los métodos convencionales para inducir la vasodilatación antes de las inyecciones de la vena de la cola generalmente dependen del uso de una fuente de calor como una lámpara de calor, almohadillas térmicas eléctricas / recargables o agua precalentada a 37 ° C. A pesar de ser fácilmente accesibles en un entorno de laboratorio estándar, estas herramientas evidentemente sufren de una capacidad termorreguladora deficiente / limitada. Del mismo modo, aunque existen diversas formas de dispositivos de sujeción disponibles comercialmente, deben usarse con cuidado para evitar traumas a los animales. Estas limitaciones de los métodos actuales crean variables innecesarias en los experimentos o dan lugar a resultados variables entre experimentos y/o laboratorios.
En este artículo, demostramos un protocolo mejorado utilizando un dispositivo innovador que combina un dispositivo de calentamiento independiente, regulado térmicamente con una unidad de restricción ajustable en un sistema para una inyección eficiente de venas de la cola aerodinámicas. El ejemplo que utilizamos es un modelo intravenoso de infección fúngica del torrente sanguíneo que resulta en sepsis. El aparato de calentamiento consiste en una caja acrílica reflectante de calor instalada con un termostato automático ajustable para mantener la temperatura interna en un umbral preestatalado. Del mismo modo, el ancho y la altura del aparato de restricción de conos se pueden ajustar para acomodar de manera segura varios tamaños de roedores. Con las características avanzadas y versátiles del dispositivo, la técnica que se muestra aquí podría convertirse en una herramienta útil en una variedad de áreas de investigación que involucran modelos de roedores que emplean inyecciones de venas de la cola.
Introducción
El uso de modelos animales con roedores ha sido un elemento básico de la investigación biomédica. Numerosas cepas endogámicas y desanguada, así como líneas modificadas genéticamente, están disponibles y se utilizan de forma rutinaria en laboratorios de todo el mundo. La inyección de la vena de la cola es uno de los métodos esenciales en modelos de roedores que requieren la administración intravenosa (i.v.) de agentes experimentales. En general, las inyecciones intravenosas tienen grandes ventajas sobre otras vías de administración, como altas tasas de absorbancia al eludir los tejidos locales y el tracto digestivo y una alta tolerancia a soluciones de una amplia gama de concentraciones o pH no fisiológico1,2,3,4. Entre otras rutas viables de I.V. (por ejemplo, venas safenas, seno venoso retroorbital), las venas de la cola se consideran los vasos sanguíneos más seguros y de más fácil acceso en roedores2,3,5,6. Por lo tanto, la inyección de la vena de la cola se ha empleado ampliamente en una variedad de modelos deroedores,incluidos los modelos de enfermedades infecciosas7,8,9,trasplante de materiales biológicos10,11,evaluación deterapias preclínicas12,13y análisis toxicológicos14,15.
La consistencia y la precisión de la dosificación son un requisito crítico en las inyecciones exitosas de la vena de la cola. Sorprendentemente, la evaluación cuantitativa y cualitativa de las inyecciones de venas de la cola en la literatura implica frecuentes inyecciones erróneas16,17. Un estudio informó que doce de cada treinta inyecciones realizadas por inyectores entrenados dejaron más del 10% de las dosis inyectadas dentro de la cola18. Además, la seguridad y la comodidad del animal que recibe inyecciones en las venas de la cola debe ser una preocupación principal durante el procedimiento. La restricción inadecuada puede conducir a lesiones y una variedad de patologías relacionadas con el estrés (por ejemplo, pérdida de peso, respuestas inmunes deterioradas) que podrían introducir variables sustanciales en la calidad de la muestra19,20. Estos errores pueden causar una mayor variabilidad en los datos y una reproducibilidad deficiente, lo que afecta negativamente los resultados del estudio.
La inducción de la dilatación vascular en el animal es a menudo necesaria cuando se realizan inyecciones de venas de la cola debido al pequeño diámetro del vaso, estimado en 300 μm en ratones21. La vasodilatación mejora la visibilidad de las venas de la cola y ayuda a lograr una alineación óptima de la vena de la aguja dentro de la luz venosa. Los laboratorios han reportado una variedad de métodos, como sumergir la cola en agua tibia22,aplicar calor a la cola usando una cortina, lámpara o secador de pelo caliente23,24,o colocar al animal en un ambiente cálido usando una almohadilla térmica, incubadora o caja combinada con una de estas fuentes de calor25. Los dispositivos pueden ser de fabricación propia para fines específicos o disponibles en proveedores comerciales. Sin embargo, muchos carecen de capacidades termorreguladoras y, si las hay, la temperatura del dispositivo está mal mantenida y, a menudo, sujeta a variaciones en la temperatura ambiente. Del mismo modo, el uso de un dispositivo de sujeción es necesario para las inyecciones de la vena de la cola, ya que no se recomienda el uso de anestesia26,27. Se han desarrollado varios tipos de dispositivos de restricción comerciales o específicos de laboratorio. Por lo general, el animal se coloca en un tubo cónico desechable de 50 ml4,paredes de plexiglás ranuradas, un túnel o cono28,todos los cuales permiten una amplia exposición de la cola al tiempo que restringen los movimientos del animal. Sin embargo, la mayoría de los sujetadores tienen limitaciones de tamaño debido a la rigidez de los materiales. Además, los dispositivos modernos de alta complejidad, a pesar de los diseños prácticos y sofisticados, no parecen ser factibles para inyecciones que involucran a grandes grupos de animales22.
Los modelos de ratón de infección del torrente sanguíneo y sepsis asociada son un excelente ejemplo de situaciones que requieren el uso de esta técnica. Entre toda la etiología microbiana de la sepsis clínica grave, la sepsis fúngica es a menudo una condición fatal con tasas de mortalidad de >40% a pesar de la terapia antifúngica29. De hecho, la infección por Candida albicans ha sido reportada como la cuarta causa principal de infección del torrente sanguíneo adquirida en el hospital (candidemia)30,31. En la candidiasis intraabdominal, los microorganismos en el tracto gastrointestinal pueden diseminarse a través del torrente sanguíneo y causar sepsis polimicrobial con una mortalidad aún mayor32,33,34. Como la mayoría de los casos de candidemia nosocomial surgen de catéteres de línea central contaminados o dispositivos médicos permanentes35,36, i.v. la inoculación con C. albicans por inyección de vena de la cola puede reflejar de cerca el desarrollo de sepsis humana y ha sido un método básico en un modelo de ratón de candidiasis diseminada hematógenamente37,38. En este modelo, la mortalidad que se produce en días puede ampliarse o acortarse ajustando el C. albicans i.v. inóculo39,40,41.
Recientemente, nuestro laboratorio ha desarrollado un protocolo innovador para una inyección de vena de cola optimizada utilizando un dispositivo innovador equipado con una unidad de calentamiento termorregulada, emparejada con una unidad de restricción ajustable, en un sistema conveniente. Este protocolo permite a los investigadores realizar inyecciones en las venas de la cola de manera precisa y oportuna, mientras que los animales pueden ser acondicionados y restringidos de manera segura para el procedimiento con una angustia mínima. Las técnicas demostradas aquí, con el uso del dispositivo avanzado de calentamiento y restricción, podrían servir como una herramienta útil en diversas áreas de investigación que emplean modelos de roedores.
Protocolo
Todos los protocolos de animales que involucran inyecciones en las venas de la cola y el uso del dispositivo de calentamiento / restricción fueron revisados y aprobados por el Comité Institucional de Cuidado de Animales (IACUC) local.
1. Preparación
- Aclimatar a los animales en el entorno de la vivienda durante al menos 1 semana y permitir la comida y el agua hasta el libitum.
NOTA: Para la mayoría de los nuevos usuarios de esta técnica de inyección, las cepas animales con pelaje blanco o de color claro pueden ser preferibles ya que las venas de la cola son fácilmente visibles a través de la piel. Las cepas de color oscuro de ratones (por ejemplo, C57BL / 6) o ratas (por ejemplo, Brown Norway) tienen colas profundamente pigmentadas, lo que resulta en un contraste de color débil contra la vena. Se recomienda encarecidamente que los nuevos usuarios reciban una formación adecuada hasta que se alcance la competencia. - Agentes para la inyección de la vena de la cola
- Prepare todos los agentes de prueba y soluciones asépticamente. Al administrar organismos o materiales celulares, tome precauciones durante todos los pasos del procesamiento para mantener condiciones libres de pirógenos.
- Use solo solución salina normal (cloruro de sodio al 0.9% p/v) o soluciones salinas equilibradas como solución salina tamponada con fosfato (PBS) como vehículos para la inyección de la vena de la cola.
PRECAUCIÓN: Nunca use agua, aceite o soluciones viscosas debido al riesgo potencial de daño vascular. Un amplio rango de pH (4.5-8.0) es tolerable debido al efecto amortiguador de la sangre y las tasas de flujo sanguíneo rápido en roedores. Sin embargo, las soluciones altamente ácidas o alcalinas pueden provocar daños tisulares innecesarios en el sitio de inyección y deben evitarse. - Limite el volumen y la frecuencia de la inyección al mínimo. Use los volúmenes recomendados para ratones y ratas (≤200 μL y ≤500 μL, respectivamente) a temperatura corporal antes de la inyección para minimizar el estrés al animal3.
- Asegúrese de que cada preparación de la jeringa y la aguja esté libre de burbujas de aire en la solución; si hay burbujas presentes, purgarlas por completo para prevenir el riesgo de embolia.
NOTA: Por lo general, las jeringas de 1 ml con agujas de 27 G y 1/2 in son adecuadas para la mayoría de las inyecciones de venas de la cola. - Use el equipo de protección personal (EPP) apropiado requerido por el IACUC local con el mínimo de batas desechables o dedicadas y guantes de látex o nitrilo. El uso de gafas de seguridad es muy recomendable al realizar la inyección de la vena de la cola.
- El dispositivo de calentamiento y sujeción
- Inspeccione cuidadosamente todos los componentes antes de su uso para asegurarse de que el dispositivo está libre de defectos (Figura 1).
- Inicialización del dispositivo de calentamiento (Figura 2A)
- Coloque la unidad de calentamiento en un banco plano limpio y encienda el dispositivo. Asegúrese de que la luz indicadora de encendido del termostato esté encendida en verde. Coloque los materiales de la ropa de cama dentro de la cámara de calentamiento para mantener el área seca y retener el calor.
- Configuración del dispositivo de retención (Figura 2B)
- Coloque la unidad de sujeción junto a la unidad de calentamiento y determine los tamaños de cono apropiados para el animal. Si es necesario, ajuste manualmente los anchos de la base del cono de aluminio flexible para proporcionar una sujeción adecuada para el animal. Alternativamente, reemplace el cono con modelos personalizados para acomodar ratones o ratas de diferentes tamaños de cuerpo.
2. Inyección de la vena de la cola
- Ajustes de aparatos
- Ajuste de la temperatura interna
- Con el dial de control, ajuste el termostato a la temperatura deseada. Asegúrese de que el indicador del calentador esté encendido en rojo y que la bombilla se ilumine. Controle cuidadosamente la pantalla de temperatura interna mientras la bombilla está iluminada (calefacción). El termostato inactiva la bombilla automáticamente una vez que se ha alcanzado una temperatura objetivo, aproximadamente en 10-15 min.
NOTA: Establecer una temperatura superior a la temperatura ambiente activa el calentador. En general, la temperatura de alojamiento recomendada en condiciones de vivero estándar varía, oscilando entre 20 y 26 ° C, mientras que la temperatura neutra (es decir, cómoda) para ratones de laboratorio se considera entre 30 y 32 ° C42. Por lo tanto, se recomienda que la temperatura interna de la cámara de calentamiento sea ligeramente superior a la termoneutralidad, aproximadamente a 32-36 ° C. Nunca ajuste el termostato por encima de la temperatura corporal.
- Con el dial de control, ajuste el termostato a la temperatura deseada. Asegúrese de que el indicador del calentador esté encendido en rojo y que la bombilla se ilumine. Controle cuidadosamente la pantalla de temperatura interna mientras la bombilla está iluminada (calefacción). El termostato inactiva la bombilla automáticamente una vez que se ha alcanzado una temperatura objetivo, aproximadamente en 10-15 min.
- Posicionamiento de la plataforma de sujeción
- Usando la perilla de ajuste de altura, ajuste la altura del cono al nivel óptimo para el usuario.
- Ajuste de la temperatura interna
- Tratamiento térmico (Figura 3A)
- Una vez que se haya alcanzado la temperatura objetivo (32-36 ° C), transfiera suavemente los animales de la jaula de alojamiento a la cámara de calentamiento.
NOTA: El tratamiento térmico durante 5-10 min es suficiente para inducir vasodilatación y mejorar la visibilidad de las venas de la cola. Sin embargo, los animales pueden ser mantenidos de forma segura en la cámara termorregulada durante la duración del procedimiento (típicamente 20-30 min sin signos de hipertermia). La cámara de calentamiento puede contener con seguridad de 4 a 6 ratones o una rata. - Monitoree al animal para detectar cualquier signo de estrés por calor agudo (por ejemplo, respiración rápida, letargo, comportamiento de escape de salto).
PRECAUCIÓN: Los animales que presenten signos de hipertermia deben ser devueltos a su jaula y monitoreados hasta que reanuden su actividad normal antes de la reutilización. Si esto se debe a que la temperatura interna excede el rango óptimo, asegúrese de que el dispositivo de calentamiento esté apagado.
- Una vez que se haya alcanzado la temperatura objetivo (32-36 ° C), transfiera suavemente los animales de la jaula de alojamiento a la cámara de calentamiento.
- Pasos de inyección
- Levante al animal por la base de la cola y retírelo de la cámara de calentamiento. Introduzca al animal en la abertura del cono de la unidad de sujeción.
PRECAUCIÓN: Nunca levante ratones del extremo de la cola; esto puede resultar en lesiones graves. Se deben utilizar métodos alternativos de manipulación para ratones obesos opreñados 28. - A medida que el animal se agarra al borde lejano del cono con sus patas delanteras, tire suavemente de la cola hacia atrás y pase la cola a través de la hendidura abierta. Asegure el extremo posterior del animal en la base del cono con una pata trasera que sobresale del cono para que la vena lateral se muestre en una posición de 12 en punto. Cualquiera de las patas traseras puede sobresalir ya que hay dos venas laterales, una a cada lado(Figura 3B).
- Agarre la cola en la longitud media a dos tercios con la mano no dominante entre el pulgar y el índice, poniendo una ligera tensión en la vena lateral para mantener la posición de la cola y la vasodilatación.
NOTA: La visibilidad mejorada de las venas dilatadas mediante tratamiento térmico permite al usuario determinar rápidamente un sitio de inyección para obtener los mejores resultados(Figura 4). - Limpie la piel del lugar de la inyección con una esponja de gasa o una almohadilla humedecida con alcohol al 70%. Limpie lo más suave y rápidamente posible para evitar la irritación de la cola.
NOTA: Este procedimiento puede omitirse a discreción de la IACUC institucional. - Sostenga la jeringa con la mano dominante y coloque la aguja paralela a la cola. Inserte la aguja hacia la dirección del flujo sanguíneo, bisele hacia arriba en un ángulo de 10-15 °(Figura 5A-B)y avance más hacia el lumen de la vena penetrando 2-4 mm(Figura 5C-D). Inyecte lentamente la solución.
NOTA: Si la inyección es exitosa, no se debe sentir resistencia en el émbolo y se puede ver que el líquido se mueve a través de la vena. En caso de resistencia o ampollas blancas por encima del sitio de inyección, retire la aguja e intente una segunda inyección en un sitio por encima de la colocación original de la aguja. No intente inyectarse por debajo del sitio de inyección inicial, ya que el líquido se liberará a través del sitio inicial. Si la inyección de una vena lateral no tiene éxito, reposicione al animal en el lado opuesto y haga más intentos en la vena contralateral. El número máximo de intentos dependerá de dónde se inicia el intento de inyección a lo largo de la vena y la hinchazón que puede ocurrir con los intentos perdidos. Consulte las regulaciones institucionales de la IACUC para inyecciones erróneas y lesiones asociadas. - Retire la aguja y presione firmemente con el pulgar para evitar el reflujo de la solución inyectada y/o la sangre. Continúe aplicando una compresión suave con una gasa/toallita limpia o un pañuelo desechable hasta que el sangrado haya cesado (Figura 6).
- Devuelva al animal a su jaula y monitoree durante al menos 5 minutos. Asegúrese de que el animal reanude su actividad normal sin más sangrado.
- Levante al animal por la base de la cola y retírelo de la cámara de calentamiento. Introduzca al animal en la abertura del cono de la unidad de sujeción.
3. Un modelo murino de infección fúngica del torrente sanguíneo y sepsis
- Cepas de ratón
- Aclimatar a las hembras de ratones suizos Webster superados a las 6 semanas de edad según las pautas recomendadas institucionalmente. Alternativamente, use cepas consanguadas / modificadas genéticamente (por ejemplo, fondo C57BL / 6) para este protocolo con inóculos modificados (ver NOTA).
NOTA (ver Discusión para más detalles): Las venas de la cola de los ratones con pelaje oscuro son a menudo menos visibles que las de pelaje más claro debido a la cola profundamente pigmentada (Figura 4). Existe una susceptibilidad variable a la sepsis / letalidad fúngica entre las diferentes cepas de ratón. El uso de cepas de ratón distintas de Swiss Webster puede requerir una optimización adicional del protocolo al considerar factores relevantes (por ejemplo, antecedentes genéticos, edad, sexo, tamaño corporal) que podrían influir en el estado inmunológico del huésped. Por ejemplo, un desafío letal en ratones C57BL / 6 generalmente requiere inóculos más altos (hasta 10x) para lograr el nivel de mortalidad observado en ratones Webster suizos.
- Aclimatar a las hembras de ratones suizos Webster superados a las 6 semanas de edad según las pautas recomendadas institucionalmente. Alternativamente, use cepas consanguadas / modificadas genéticamente (por ejemplo, fondo C57BL / 6) para este protocolo con inóculos modificados (ver NOTA).
- Microorganismos
- Para un desafío letal (sepsis), raye las existencias congeladas de Candida albicans cepa DAY185 (o cepas de elección) en el agar dextrosa Sabouraud e incube a 30 °C durante 2 días.
- Transfiera una sola colonia en caldo de extracto de levadura-peptona-dextrosa de 10 ml, y cultivo a la fase estacionaria de crecimiento durante 18 h a 30 °C con agitación.
- Soluciones Inoculum
- El día de un desafío letal, recoja el cultivo de caldo y lave el pellet 3 veces por centrifugación (800 × g)en PBS estéril.
- Identifique las células de levadura viables mediante la exclusión del colorante azul tripano y enumere utilizando un hemocitómetro. Ajuste la concentración celular a 1 x 106 células/ml en PBS estéril a temperatura ambiente.
NOTA: Cada animal recibirá 100 μL de la solución de inóculo. Prepare un exceso de volumen del inóculo (>500 μL) para permitir una posible pérdida durante el procedimiento de inyección. El inóculo final es de 1 x 105 células por ratón. El volumen del inóculo se puede aumentar hasta 200 μL ajustando la concentración celular en consecuencia.
PRECAUCIÓN: La solución de inóculo fúngico debe mantenerse a temperatura ambiente antes de la inyección. El calentamiento de la solución de inóculo a la temperatura corporal puede inducir un cambio morfológico de las células de levadura a las hifas. Por el contrario, la administración en bolo i.v de soluciones frías puede reducir rápidamente la temperatura corporal del animal y debe evitarse.
- Inoculación intravenosa
- Calentar a los animales e inducir vasodilatación siguiendo los procedimientos de la sección 2.
- Inyecte 100 μL de la solución de inóculo en la vena de la cola usando una jeringa de 1 ml con una aguja de 27 G, 1/2 in.
- Monitoreo posterior a la inoculación
- Monitoree a los animales para detectar los siguientes signos de morbilidad inducida por sepsis: i) aspecto del pelaje (por ejemplo, liso, con volantes), ii) actividad (por ejemplo, moverse libremente, no responder), iii) postura (por ejemplo, encorvado, rígido), iv) comportamiento (por ejemplo, lento, sin reubicación), v) movimientos en el pecho (por ejemplo, respiración normal, disnea), vi) párpados (por ejemplo, abiertos, cerrados)43.
- Puntuación de sepsis
- Puntúe la morbilidad observada de acuerdo con una puntuación de evaluación clínica modificada del ratón para la sepsis (M-CASS) en una escala de calificación de cuatro puntos de 0 a 3 en cada categoría: 0, normal; 1, leve; 2, moderado; 3, grave43.
- Protocolo facultativo: Vacunación contra la sepsis fúngica
- Catorce días antes de un desafío letal, inocular ratones con Candida dubliniensis cepa Wü284 o cepas atenuadas de C. albicans, como Δefg1/Δcph1 mutante (1x105 células por ratón), como se describe en las secciones 3.2–3.4 en lugar de C. albicans DAY185.
- Realizar un desafío letal en los ratones vacunados, como se describe en las secciones 3.2-3.4, y controlar los signos de morbilidad inducida por sepsis descritos en las secciones 3.5-3.6.
Resultados
La temperatura dentro de la cámara de calentamiento es detectada continuamente por el sensor interno y autorregulada por el termostato. Primero, el dial de control del termostato se colocó a 78, 85, 90 o 95 ° F (26, 29, 32 o 95 ° C) para seleccionar las temperaturas establecidas. Una vez que se activó el calentador(Figura 7,puntos amarillos), la emisión de calor por la bombilla elevó rápidamente la temperatura interna durante los primeros 5-15 minutos, dependiendo de la temperatura establecida. El calentador inactivó la bombilla si la temperatura interna detectada excedía la temperatura establecida (puntos grises). Las temperaturas máximas iniciales deben aumentar a 5-7 ° C por encima de las temperaturas establecidas en todos los grupos para compensar la pérdida de temperatura durante la transferencia de animales. Posteriormente, el dispositivo continúa repitiendo el ciclo de calor automáticamente y mantiene la cámara de calentamiento a la temperatura establecida.
Un ejemplo de datos experimentales obtenidos por inyecciones exitosas de venas de cola utilizando el protocolo actual se muestra en la Figura 8. En un modelo de ratón de candidiasis del torrente sanguíneo que resultó en sepsis, un desafío i.v. con Candida albicans (1 x 105 células por ratón) en ratones Webster suizos causó un rápido inicio de sepsis y diseminación de los organismos, lo que llevó a una alta mortalidad en 3-4 días (puntos abiertos)(Figura 8A). Por el contrario, los animales podrían estar protegidos de la sepsis mediante la prein inmunización/vacunación previa con una cepa de levadura aviruenta, Candida dubliniensis,logrando una supervivencia >95% después del desafío i.v. letal con C. albicans virulentos (puntos sólidos). Estos resultados en mortalidad progresiva vs. protección mediada por vacunación se obtuvieron de manera reproducible en cuatro experimentos independientes(Figura Suplementaria 1). Una protección similar podría lograrse utilizando otras cepas de levadura avirulentas como los mutantes atenuados de C. albicans (Δefg1/ Δcph1) (datos no mostrados). La sepsis también podría ser monitoreada y correlacionada con la mortalidad; los animales no vacunados con infección letal tuvieron un aumento significativo en la morbilidad inducida por sepsis, mientras que el grupo vacunado mostró síntomas mínimos después del desafío letal(Figura 8B).

Figura 1: Descripción del dispositivo de calentamiento y restricción de roedores. (A) muestra la vista exterior del dispositivo de calentamiento, que consiste en:
- Cubierta del termostato: levántela hacia arriba por el mango para exponer el termostato
- Carcasa eléctrica – sellada permanentemente para protección
- Tapa de la cámara: levántese hacia arriba durante la transferencia del animal hacia / desde
- Cámara de calentamiento: extraíble, cubra el piso con ropa de cama antes de usarla
- Aparato de sujeción: estibable con el dispositivo de calefacción mientras no esté en uso
- Interruptor de encendido: interruptor basante en línea para las funciones principales de encendido / apagado
- Cable de alimentación – voltaje / corriente: 120V / 10A
(B) muestra el interior del dispositivo de calentamiento:
- Bombilla incandescente – salida de luz a 100 vatios
- Escudo protector de la bombilla: extraíble para el reemplazo de la bombilla
- Sonda de sensor de temperatura: ubicada dentro de la cámara
- Termómetro de temperatura interno: colóquelo dentro de la cámara para monitorear la temperatura
(C) muestra los componentes del termostato del dispositivo de calentamiento:
- Termómetro de temperatura interna
- Termostato: regula automáticamente el calentador
- Palanca de control de consigna – mínima/máxima: 78 °F/108 °F (25 °C/42 °C)
- Indicador de potencia del termostato: la luz verde indica el funcionamiento normal
- Indicador del calentador del termostato: se ilumina en rojo durante el ciclo de calentamiento
D) muestre los componentes del dispositivo de sujeción:
- Cono – lámina de aluminio flexible diseñada para la contención de roedores
- Canal de la cola: formado para permitir un posicionamiento suave de la cola
- Plataforma elevadora de cono: proporciona una elevación robusta de la base del cono
- Perilla de ajuste de altura: diseñada para el ajuste manual de altura
- Gato de tijera: rango de altura de 45 a 140 mm (1.77-5.52")
- Placa de soporte: instalada con patas de goma para proporcionar estabilidad Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El dispositivo de calentamiento y restricción de roedores. (A) Antes de su uso, las dos partes del dispositivo se colocan una al lado de la otra en una mesa de trabajo limpia. (B) Una vez que se enciende el dispositivo de calentamiento, el termostato activa el calentador. La bombilla permanece encendida y emite calor hasta que la cámara de calentamiento ha alcanzado la temperatura establecida. El dispositivo de calentamiento repite automáticamente el ciclo de calor para mantener la temperatura interna. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ratones (C57BL/6) colocados en el dispositivo de calentamiento y restricción. (A) Ratones que reciben tratamiento térmico para la vasodilatación. Los animales (4-6 ratones por tratamiento) son transferidos de su jaula de alojamiento a la cámara de calentamiento del dispositivo y tratados térmicamente durante un mínimo de 5-10 min. (B) Un ratón restringido para la inyección de la vena de la cola. El ratón se transfiere de la cámara de calentamiento a la abertura del cono del dispositivo de restricción con su cola pasando a través de la hendidura abierta. El ratón se tira suavemente hacia atrás hasta el borde lejano del cono hasta que la base de la cola llega a la punta del cono. A medida que el animal es atraído hacia la base del cono con una suave rotación lateral, una pata trasera se coloca hacia arriba para que sobresala de la hendidura abierta permitiendo que la vena lateral de la cola se coloque a las 12 en punto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Identificación de las venas laterales de la cola en ratones. (A) La cola de un ratón Webster suizo sin tratar. El ratón se coloca en el dispositivo de sujeción sin tratamiento térmico previo para la vasodilatación. La vena lateral de la cola se puede identificar como un vaso delgado y oscuro que se curso debajo de la piel. (B) La cola de un ratón Webster suizo tratado con el dispositivo de calentamiento durante 10 min. El ratón tratado térmicamente está restringido para la inyección de la vena de la cola. La vena lateral de la cola es fácilmente visible a través de la piel debido al diámetro agrandado del vaso inducido por la vasodilatación. (C) La cola de un ratón C57BL/6 tratada con el dispositivo de calentamiento durante 10 min y restringida para la inyección de la vena de la cola. La vasodilatación mejora la visibilidad de la vena de la cola a través de la piel profundamente pigmentada, aunque la vena no es tan fácilmente visible como en los ratones Webster suizos de color claro debido a un débil contraste de color contra la vena. Las flechas rojas denotan la ubicación de la vena lateral de la cola. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Inyección de la vena de la cola realizada en ratones tratados térmicamente (Swiss Webster). (A–B) Inserción de la aguja en la vena lateral de la cola en el lugar de la inyección. La aguja (27 G, 1/2 in) se coloca paralela a la vena de la cola con el bisel hacia arriba y apunta hacia el flujo sanguíneo y se inserta. (C–D) Colocación de aguja en la vena de la cola e inyección. La punta de la aguja se avanza aún más 2-4 mm en la luz de la vena. El pulgar se coloca en el émbolo de la jeringa, y el volumen deseado se dispensa con una presión lenta y constante. Los círculos ovalados indican los sitios de inyección. Haga clic aquí para ver una versión más grande de esta figura.
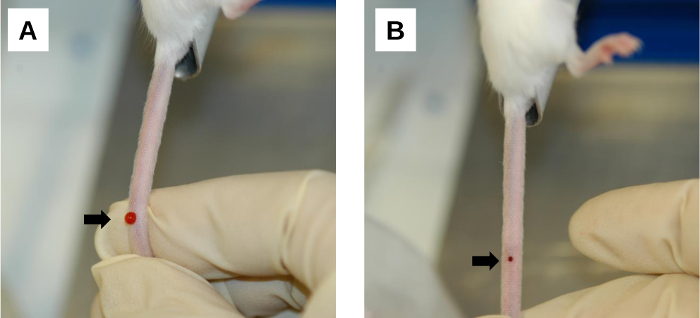
Figura 6: Procedimiento posterior a la inyección. (A) Un área de sangrado en el sitio de inyección. El sangrado y el reflujo de la solución inyectada ocurren inmediatamente después de la extracción de la aguja. Esto se puede minimizar aplicando una compresión firme en el sitio de inyección con el pulgar. (B) Formación de coágulos sanguíneos en el lugar de la inyección. La compresión suave con una gasa / toallita limpia facilita la coagulación de la sangre en la herida de inyección. Las flechas denotan sitios de inyección. Haga clic aquí para ver una versión más grande de esta figura.
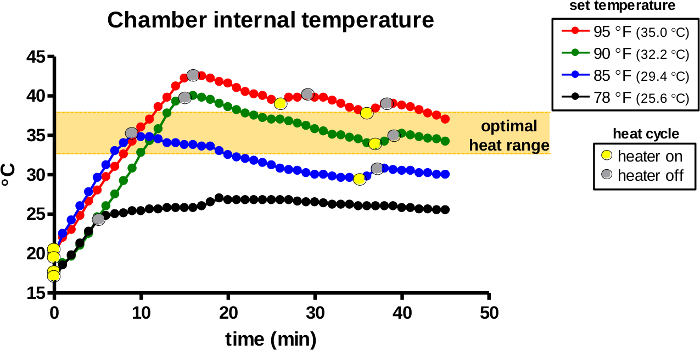
Figura 7: La temperatura interna de la cámara de calentamiento durante el uso. El dispositivo de calentamiento se activó para el calentamiento a las temperaturas establecidas designadas. La cámara de calentamiento del dispositivo fue monitoreada para la temperatura interna del aire y los ciclos de calor (bombilla encendida / puntos amarillos, puntos apagados / grises) se registraron durante 45 minutos. El área naranja indica el rango de temperatura óptimo para la inducción de vasodilatación en roedores. Haga clic aquí para ver una versión más grande de esta figura.
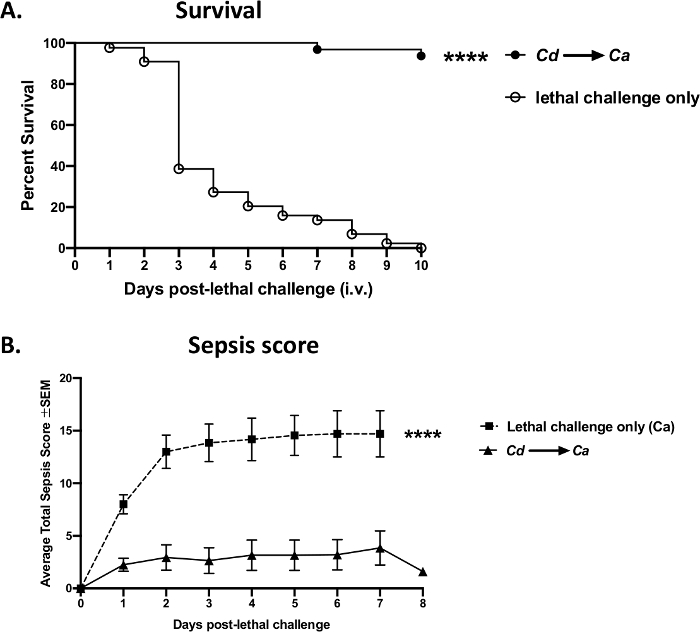
Figura 8: Mortalidad por sepsis vs. protección mediada por vacunación después de un desafío letal con Candida albicans. Los ratones (hembras Suizas Webster de 8 semanas de edad) fueron vacunados por vía intravenosa con Candida dubliniensis Wü284 viva aviruenta Wü284(Cd),seguido de un desafío intravenoso letal con C. albicans day 185 de tipo salvaje (1 x 105 células por ratón) 14 días después. (A) La mortalidad se evaluó durante 10 días después del desafío letal. (B) Los animales fueron monitoreados para detectar morbilidad por sepsis y calificados de acuerdo con una puntuación de evaluación clínica modificada en ratones para sepsis (M-CASS)43. Los datos son acumulativos de 4 experimentos independientes con 10 ratones por grupo y analizados utilizando la prueba de rango logarítndular de Mantel-Cox. p < 0,0001. SEM, error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Reproducibilidad de la mortalidad por sepsis y supervivencia mediada por vacunación de un desafío de Candida albicans en el torrente sanguíneo. Cada panel representa datos de cuatro experimentos independientes incluidos en un resultado acumulativo que se muestra en la Figura 8A. Cada experimento se realizó utilizando 10 ratones por grupo y se analizó utilizando la prueba de rango logarítnic de Mantel-Cox. Ca, Candida albicans. Cd, Candida dubliniensis. p < 0,0001. p < 0,01. Haga clic aquí para descargar esta figura.
Discusión
La dosificación consistente y precisa son requisitos clave para la confiabilidad experimental en modelos animales. Esto es especialmente importante en los casos de administración i.v. donde la biodisponibilidad sistémica de los agentes inyectados es considerablemente mayor/más rápida que con otras vías de administración3. Por lo tanto, los errores en la inyección de la vena de la cola podrían tener un impacto perjudicial en los resultados del estudio. Históricamente, la inyección intraperitoneal (i.p.), en lugar de i.v., ha sido el método más común para el acceso sistémico en roedores debido a la simplicidad técnica y la conveniencia. Sin embargo, las vías de administración se vuelven más cruciales cuando se traducen las lecturas preclínicas de los animales a los entornos clínicos. Por lo tanto, existe la necesidad de una mejora continua en los protocolos de roedores que podrían facilitar la inyección exitosa de la vena de la cola.
El avance clave en el protocolo actual es el innovador dispositivo de calentamiento termorregulado que permite la inducción efectiva de la vasodilatación en roedores, lo que mejora drásticamente la visibilidad de las venas de la cola y la alineación de las agujas. Los métodos de calentamiento que están mal termorregulados (por ejemplo, lámparas), vasodilatadores tópicos o irritantes de la piel (por ejemplo, xilenos) no solo no son confiables, sino que también son inseguros para el animal y deben evitarse44. Contrariamente a otros métodos convencionales, como sumergir la cola en agua tibia, la capacidad de autorregulación de este dispositivo puede acondicionar de forma segura a múltiples animales simultáneamente. Además, este protocolo se fortalece aún más mediante el uso del dispositivo de sujeción diseñado de manera óptima y permite la inmovilización rápida y segura del animal en una posición que mejor muestre la vena lateral de la cola.
Los formatos de trompa transparentes que se ven en muchos sujetadores actuales, aunque prácticamente bien diseñados, requieren más tiempo de manejo con cada animal, prolongando así el proceso de sujeción45. Esto puede ser más problemático en cepas de roedores con rasgos agresivos que ofrecen una cooperación limitada46,47. Por el contrario, la estructura de cono semicerrada del dispositivo de sujeción permite un posicionamiento rápido del animal y ayuda a minimizar la duración de la restricción. En conjunto, el protocolo simplificado que utiliza el innovador sistema de calentamiento / restricción altamente optimizado acelera el procedimiento de inyección, lo que permite una dosificación rápida y efectiva de grandes grupos de animales. En nuestro laboratorio, normalmente completamos un procedimiento de inyección completo de 30 ratones, desde el tratamiento térmico hasta el monitoreo posterior a la inyección dentro de 1 h utilizando este protocolo.
A pesar de las características avanzadas, este dispositivo tiene algunas desventajas aparentes: la primera es el costo del dispositivo y el reemplazo rutinario de la bombilla en la cámara de calentamiento. Sin embargo, además de la eficiencia y la velocidad de las inyecciones, el dispositivo es duradero para uso repetido y compatible con los desinfectantes más comunes, lo que permite una limpieza exhaustiva del dispositivo entre usos. En conjunto, esto compensa la inversióninicial. Second, en situaciones con espacio de trabajo limitado, un inconveniente de este protocolo puede ser el requisito de un área de banco dedicada lo suficientemente grande como para colocar las dos unidades, una al lado de la otra, mientras se realiza la inyección. Sin embargo, debido a que el dispositivo se puede utilizar ampliamente en varios protocolos de roedores que involucran inyecciones intravenosas, es posible que el dispositivo pueda servir como un instrumento central similar a otros equipos de vivero comunales, como los vaporizadores de isoflurano. De todos modos, las dos unidades son fácilmente portátiles y se pueden empaquetar y guardar mientras no están en uso.
El modelo de desafío letal i.v. de sepsis fúngica murina descrito en este protocolo imita de cerca las infecciones del torrente sanguíneo por C. albicans en humanos y se ha utilizado ampliamente para estudiar la virulencia fúngica, probar la eficacia de las terapias antifúngicas y caracterizar las respuestas inmunes del huésped a la infección37,39,48. Para lograr una infección reproducible, la inoculación intravenosa a través de la inyección de la vena de la cola es el paso más vital del protocolo para garantizar la entrega precisa de los organismos en el torrente sanguíneo. De hecho, los animales responden de manera muy diferente a los diferentes niveles de desafíos de Candida i.v.; la administración de cantidades demasiado bajas de inóculo dará lugar a recuperaciones espontáneas no deseadas, mientras que los animales que reciben dosis demasiado altas sucumbirán prematuramente. La ventana específica de los tamaños de inóculo para un organismo dado para inducir un nivel constante de sepsis / mortalidad depende en gran medida tanto de las cepas de hongos como de las cepas de ratón.
El protocolo actual que utiliza ratones Webster suizos en el inóculo de 1 x 105 C. albicans de tipo salvaje indujo de manera reproducible la aparición de la morbilidad de la sepsis dentro de 1 día, seguida de una mortalidad progresiva que resultó en una letalidad del 100% en 5-7 días. Por el contrario, los inóculos superiores a 1 x10 5 suelen conducir a muertes aceleradas (es decir, 1-2 días a 1 x 106, 3-4 días a 5 x 105), y los inferiores a 1 x 105 son subletácimos. En línea con numerosos informes en la literatura, el uso de especies de Candida noalbicans en lugar de C. albicans resulta en una letalidad significativamente disminuida40,49. Además, la elección de las cepas de ratón, o incluso el origen de las colonias, puede tener un impacto considerable en los resultados de la infección debido a las diferentes susceptibilidades entre las cepas de ratón, según lo informado por otros39,40,41,50, 51,52,53,54,55. Por lo tanto, ambos deben tenerse en cuenta al diseñar experimentos.
Tras un desafío i.v. letal, las células fúngicas se propagan rápidamente por el torrente sanguíneo y comienzan a invadir múltiples órganos, entre los cuales los más afectados son los riñones41. Otros órganos afectados son el cerebro, el bazo y la médula ósea48,56. En cualquier caso, la sepsis aguda es la causa última de muerte en los primeros puntos de tiempo37. Como se muestra en los resultados representativos, la gravedad de la sepsis puede evaluarse cuantitativamente mediante el Mouse Clinical Assessment Score for Sepsis (M-CASS) basado en signos exhibidos de una afección de sepsis en animales desafiados43,57. Entre los varios marcadores sustitutos de sepsis letal, la hipotermia se ha sugerido como un predictor crítico de muerte inminente en sepsis clínica y experimental43,58,59.
Aunque no se han realizado estudios formales para comparar directamente los ratones endogámicos frente a los superconsanguidos en este modelo, los datos obtenidos del protocolo actual utilizando ratones Webster suizos de raza son excepcionalmente reproducibles en varios parámetros de sepsis, a pesar de la presunta heterogeneidad genética. En general, un patrón de mortalidad que cae dentro de los 3-5 días es un modelo firme de sepsis aguda, como lo demuestra la rápida elevación de la morbilidad de la sepsis y los niveles de marcadores inflamatorios a las pocas horas del desafío post-letal50,51. Para tiempos de supervivencia más largos (7-10 días), la mortalidad es probablemente el resultado de la carga microbiana que conduce a un daño tisular letal en los órganos diana y el sistema nervioso central. La elección de la sepsis o la carga microbiana se puede aplicar según sea necesario para evaluar las funciones inmunes o las respuestas a los regímenes antiinflamatorios o las terapias / vacunas antifúngicas, según lo determine el inóculo utilizado.
Además del modelo de desafío letal i.v., la infección intraabdominal con C. albicans en ratones a través de un desafío i.p. también puede conducir a candidiasis diseminada y sepsis posterior, aunque la coinoculación con el patógeno bacteriano, Staphylococcus aureus, aumenta sinérgicamente la mortalidad en comparación con la mono-infección por C. albicans 51,60,61. En el modelo de desafío letal i.p., se requieren inóculos microbianos sustancialmente más altos (1.75 x10 7C. albicans/ 8 x 107S. aureus por ratón) para causar peritonitis polimicrobiana y diseminación de los organismos desde la cavidad abdominal al torrente sanguíneo. Del mismo modo, la infección gastrointestinal con C. albicans en ratones tratados con agentes inmunosupresores y / o dañinos para la mucosa conduce a la translocación de las células fúngicas en el torrente sanguíneo y da lugar a sepsis fúngica62,63. A pesar de las rutas de inoculación distintivas, el mecanismo de sepsis fúngica subsiguiente es en gran medida análogo entre los tres modelos de enfermedad, que implica una respuesta proinflamatoria sistémica no controlada a Candida que conduce a la insuficiencia orgánica37,51,61. Del mismo modo, en los seres humanos, es este proceso de la respuesta del huésped, no simplemente la candidemia, lo que causa la alta morbilidad / mortalidad asociada con la candidiasis diseminada hematógenamente adquirida en entornos de atención médica64,65.
Utilizando el modelo actual de sepsis fúngica, demostramos aquí que la protección contra la infección letal por C. albicans se puede lograr mediante la inmunización/ vacunación i.v. previa a la inmunización con C. dubliniensis (avirulent) o mutantes atenuados de C. albicans, concomitante con una reducción significativa de la morbilidad por sepsis. La protección está mediada por células supresoras innatas derivadas de Mieloides Gr-1+ que parecen ser inducidas en la médula ósea como una forma de inmunidad innata entrenada66,67. Se están realizando esfuerzos para ampliar la comprensión de esta nueva forma de protección innata inmunomedida contra las infecciones del torrente sanguíneo por C. albicans.
En conclusión, el innovador dispositivo de calentamiento / restricción de roedores ha sido fundamental para avanzar en nuestra capacidad de realizar inyecciones intravenosas de estudios multigrupo en animales a gran escala de una manera eficiente y efectiva. Como tal, hemos acuñado el término, Mouse a Minute, para el dispositivo. Las especificaciones del dispositivo están disponibles del autor correspondiente previa solicitud de adquisición de un dispositivo similar. Las técnicas demostradas aquí podrían servir como una herramienta útil en modelos de roedores que emplean inyecciones de venas de la cola en una amplia gama de áreas de investigación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación LSUHSC (PLF), y en parte por U54 GM104940 del Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud, que financia el Centro de Ciencias Clínicas y Traslacionales de Louisiana.
Materiales
| Name | Company | Catalog Number | Comments |
| Candida albicans strain DAY185 | Carnegie Melon University | N/A | provided by the laboratory of Aaron Mitchell |
| Candida albicans strain efg1Δ/Δ cph1Δ/Δ | University of Tennessee Health Sciences Center | N/A | provided by the laboratory of Glen Palmer |
| Candida dubliniensis strain Wü284 | Trinity College, Dublin, Ireland | N/A | provided by the laboratory of Gary Moran |
| Mice | Charles River Laboratories | 551NCICr:SW | Female Swiss Webster; 6-8 weeks old |
| Mice | Charles River Laboratories | 556NCIC57BL/6 | Female C57BL/6; 6-8 weeks old |
| Needles, 27G, ½-in | Becton Dickinson | 305109 | can be substituted from other vendors |
| Phosphate buffered saline (PBS) | GE | SH30028.02 | can be substituted from other vendors |
| Rodent warming and restraining device (Mouse a Minute) | LSU Health | custom order | Mouse a Minute is available for custom ordering from LSU Health |
| Sabouraud dextrose agar (SDA) | Becton Dickinson | 211584 | can be substituted from other vendors |
| Syringes, 1 mL | Becton Dickinson | 309659 | can be substituted from other vendors |
| Trypan blue solution | Sigma | T8154 | |
| Yeast peptone dextrose (YPD) broth | Fisher Scientific | BP2469 | can be substituted from other vendors |
Referencias
- Woodard, G. Methods of animal experimentation. Gay, W. J. 1, 343-359 (1965).
- Shimizu, S. The laboratory mouse The handbook of experimental animals. Hedrich, H. J. , Elsevier Academic Press. Ch. 32 527-541 (2004).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. Journal of the American Association for Laboratory Animal Science. 50 (5), 614-627 (2011).
- Donovan, J., Brown, P. Parenteral injections. Current Protocols in Immunology. 73 (1), Chapter 1, Unit 1 6(2006).
- Schoch, A., Thorey, I. S., Engert, J., Winter, G., Emrich, T. Comparison of the lateral tail vein and the retro-orbital venous sinus routes of antibody administration in pharmacokinetic studies. Lab Animal. 43 (3), 95-99 (2014).
- Jarneborn, A., et al. Tofacitinib treatment aggravates Staphylococcus aureus septic arthritis, but attenuates sepsis and enterotoxin induced shock in mice. Scientific Reports. 10 (1), 10891(2020).
- Bussey, K. A., et al. Endosomal Toll-like receptors 7 and 9 cooperate in detection of murine Gammaherpesvirus 68 infection. Journal of Virology. 93 (3), (2019).
- Pitts, M. G., D'Orazio, S. E. F. A Comparison of oral and intravenous mouse models of listeriosis. Pathogens. 7 (1), (2018).
- Jespersen, H., et al. Clinical responses to adoptive T-cell transfer can be modeled in an autologous immune-humanized mouse model. Nature Communications. 8 (1), 707(2017).
- Gomez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Srinageshwar, B., et al. Surface-modified G4 PAMAM dendrimers cross the blood-brain barrier following multiple tail-vein injections in C57BL/6J mice. ACS Chemical Neuroscience. 10 (9), 4145-4150 (2019).
- Channabasappa, S., et al. Efficacy of novel antistaphylococcal ectolysin P128 in a rat model of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Sadeghi, B., et al. Preclinical toxicity evaluation of clinical grade placenta-derived decidua stromal cells. Frontiers in Immunology. 10, 2685(2019).
- Boquet, M. P., Wonganan, P., Dekker, J. D., Croyle, M. A. Influence of method of systemic administration of adenovirus on virus-mediated toxicity: focus on mortality, virus distribution, and drug metabolism. Journal of Pharmacological and Toxicological Methods. 58 (3), 222-232 (2008).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39 (4), 264-270 (2011).
- Lasnon, C., Dugue, A. E., Briand, M., Dutoit, S., Aide, N. Quantifying and correcting for tail vein extravasation in small animal PET scans in cancer research: is there an impact on therapy assessment. EJNMMI Research. 5 (1), 61(2015).
- Groman, E. V., Reinhardt, C. P. Method to quantify tail vein injection technique in small animals. Contemporary Topics in Laboratory Animal Science. 43 (1), 35-38 (2004).
- Aller, M. A., et al. Neuro-immune-endocrine functional system and vascular pathology. Medical Hypotheses. 57 (5), 561-569 (2001).
- McEwen, B. S., et al. The role of adrenocorticoids as modulators of immune function in health and disease: neural, endocrine and immune interactions. Brain Research. Brain Research Reviews. 23 (1-2), 79-133 (1997).
- Callewaert, B. L., et al. Absence of arterial phenotype in mice with homozygous slc2A10 missense substitutions. Genesis. 46 (8), 385-389 (2008).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods in Enzymology. 479, 397-411 (2010).
- Carlson, R. P. J., Peer, B. In Vivo Models of Inflammation Progress in Inflammation Research. Morgan, D. W., Marshall, L. , Birkhäuser, Basel. 1-50 (1999).
- Flecknell, P. Laboratory Animals: An Introduction for New Experimenters. Tuffery, A. A. , John Wiley and Sons. 225-260 (1987).
- Kim, M. J., Ahituv, N. The hydrodynamic tail vein assay as a tool for the study of liver promoters and enhancers. Methods in Molecular Biology. 1015, 279-289 (2013).
- Bargellini, A., et al. Effects of chronic exposure to anaesthetic gases on some immune parameters. Science of The Total Environment. 270 (1-3), 149-156 (2001).
- Elena, G., et al. Inhalatory anesthetic (halothane) associated changes in the immune response in mice. International Journal of Immunopharmacology. 19 (11-12), 699-707 (1998).
- Buerge, T. The Laboratory Mouse The handbook of experimental animals. Hedrich, H. J., Bullock, G. , Elsevier Academic Press. Ch. 31 517-526 (2004).
- Cohen, J., Cristofaro, P., Carlet, J., Opal, S. New method of classifying infections in critically ill patients. Critical Care Medicine. 32 (7), 1510-1526 (2004).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Magill, S. S., et al. Multistate point-prevalence survey of health care-associated infections. The New England Journal of Medicine. 370 (13), 1198-1208 (2014).
- Dupont, H., et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Archives of Surgery. 137 (12), 1341-1346 (2002).
- Montravers, P., et al. Candida as a risk factor for mortality in peritonitis. Critical Care Medicine. 34 (3), 646-652 (2006).
- Calandra, T., Bille, J., Schneider, R., Mosimann, F., Francioli, P. Clinical significance of Candida isolated from peritoneum in surgical patients. Lancet. 2 (8677), 1437-1440 (1989).
- Kojic, E. M., Darouiche, R. O. Candida infections of medical devices. Clinical Microbiology Reviews. 17 (2), 255-267 (2004).
- Ramage, G., Martinez, J. P., Lopez-Ribot, J. L. Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Research. 6 (7), 979-986 (2006).
- Spellberg, B., Ibrahim, A. S., Edwards, J. E., Filler, S. G. Mice with disseminated candidiasis die of progressive sepsis. Journal of Infectious Diseases. 192 (2), 336-343 (2005).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L. Animal models for candidiasis. Current Protocols in Immunology. 105 (1), (2014).
- Lionakis, M. S., Lim, J. K., Lee, C. C., Murphy, P. M. Organ-specific innate immune responses in a mouse model of invasive candidiasis. Journal of Innate Immunity. 3 (2), 180-199 (2011).
- Segal, E., Frenkel, M. Experimental in vivo models of candidiasis. Journal of Fungi. 4 (1), (2018).
- MacCallum, D. M., Odds, F. C. Temporal events in the intravenous challenge model for experimental Candida albicans infections in female mice. Mycoses. 48 (3), 151-161 (2005).
- Gordon, C. J. The mouse thermoregulatory system: Its impact on translating biomedical data to humans. Physiology & Behavior. 179, 55-66 (2017).
- Mai, S. H. C., et al. Body temperature and mouse scoring systems as surrogate markers of death in cecal ligation and puncture sepsis. Intensive Care Medicine Experimental. 6, 20(2018).
- Catty, D., Lehmann, P. F. A simple low-cost restrainer for the intravenous injection of mice. Sabouraudia. 16 (2), 89-90 (1978).
- Donovan, J., Brown, P. Handling and restraint. Current Protocols in Immunology. 73 (1), Chapter 1 Unit 1 (2006).
- Dow, H. C., et al. Genetic dissection of intermale aggressive behavior in BALB/cJ and A/J mice. Genes Brain and Behavior. 10 (1), (2010).
- Pugh, P. L., Ahmed, S. F., Smith, M. I., Upton, N., Hunter, A. J. A behavioural characterisation of the FVB/N mouse strain. Behavioural Brain Research. 155 (2), 283-289 (2004).
- MacCallum, D. M., Odds, F. C. Need for early antifungal treatment confirmed in experimental disseminated Candida albicans infection. Antimicrobial Agents and Chemotherapy. 48 (12), 4911-4914 (2004).
- Fakhim, H., et al. Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine model. Mycoses. 61 (6), 377-382 (2018).
- Remick, D. G., Newcomb, D. E., Bolgos, G. L., Call, D. R. Comparison of the mortality and inflammatory response of two models of sepsis: lipopolysaccharide vs. cecal ligation and puncture. Shock. 13 (2), 110-116 (2000).
- Nash, E. E., Peters, B. M., Palmer, G. E., Fidel, P. L., Noverr, M. C. Morphogenesis is not required for Candida albicans-Staphylococcus aureus intra-abdominal infection-mediated dissemination and lethal sepsis. Infection and Immunity. 82 (8), 3426-3435 (2014).
- Rogers, T., Balish, E. Experimental Candida albicans infection in conventional mice and germfree rats. Infection and Immunity. 14 (1), 33-38 (1976).
- Marquis, G., Montplaisir, S., Pelletier, M., Auger, P., Lapp, W. S. Genetics of resistance to infection with Candida albicans in mice. The British Journal of Experimental Pathology. 69 (5), 651-660 (1988).
- Ashman, R. B., Fulurija, A., Papadimitriou, J. M. Strain-dependent differences in host response to Candida albicans infection in mice are related to organ susceptibility and infectious load. Infection and Immunity. 64 (5), 1866-1869 (1996).
- Ashman, R. B., Bolitho, E. M., Papadimitriou, J. M. Patterns of resistance to Candida albicans in inbred mouse strains. Immunology & Cell Biology. 71 (3), 221-225 (1993).
- Liu, Y., Mittal, R., Solis, N. V., Prasadarao, N. V., Filler, S. G. Mechanisms of Candida albicans trafficking to the brain. PLoS Pathogens. 7 (10), 1002305(2011).
- Huet, O., et al. Ensuring animal welfare while meeting scientific aims using a murine pneumonia model of septic shock. Shock. 39 (6), 488-494 (2013).
- Kushimoto, S., et al. The impact of body temperature abnormalities on the disease severity and outcome in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis. Critical Care. 17 (6), 271(2013).
- Wiewel, M. A., et al. Risk factors, host response and outcome of hypothermic sepsis. Critical Care. 20 (1), 328(2016).
- Peters, B. M., Noverr, M. C. Candida albicans-Staphylococcus aureus polymicrobial peritonitis modulates host innate immunity. Infection and Immunity. 81 (6), 2178-2189 (2013).
- Nash, E. E., Peters, B. M., Fidel, P. L., Noverr, M. C. Morphology-Independent Virulence of Candida Species during Polymicrobial Intra-abdominal Infections with Staphylococcus aureus. Infection and Immunity. 84 (1), 90-98 (2016).
- Hirayama, T., et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation. Scientific Reports. 10 (1), 3814(2020).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal damage and neutropenia are required for Candida albicans dissemination. PLoS Pathogens. 4 (2), 35(2008).
- Vergidis, P., et al. Intra-abdominal candidiasis: The importance of early source control and antifungal treatment. PLoS One. 11 (4), 0153247(2016).
- Parker, J. C., McCloskey, J. J., Knauer, K. A. Pathobiologic features of human candidiasis. A common deep mycosis of the brain, heart and kidney in the altered host. American Journal of Clinical Pathology. 65 (6), 991-1000 (1976).
- Esher, S. K., Fidel, P. L., Noverr, M. C. Candida/Staphylococcal Polymicrobial Intra-Abdominal Infection: Pathogenesis and Perspectives for a Novel Form of Trained Innate Immunity. Journal of Fungi. 5 (2), (2019).
- Lilly, E. A., Ikeh, M., Nash, E. E., Fidel, P. L., Noverr, M. C. Immune protection against lethal fungal-bacterial intra-abdominal infections. mBio. 9 (1), (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados