Method Article
Um dispositivo de aquecimento/contenção contemporâneo para injeções eficientes de veia de cauda em um modelo de sepse fúngica murina
Neste Artigo
Resumo
Aqui, apresentamos um método eficaz e eficiente para injeções de veias da cauda de roedores usando um dispositivo de aquecimento/contenção exclusivamente projetado. Ao simplificar o início dos processos de vasodilatação e contenção, este protocolo permite injeções intravenosas precisas e oportunas de grandes grupos de animais com o mínimo de angústia.
Resumo
Nos modelos de roedores, as injeções de veias traseiras são métodos importantes para a administração intravenosa de agentes experimentais. As injeções da veia traseira normalmente envolvem o aquecimento do animal para promover a vasodilatação, que auxilia tanto na identificação dos vasos sanguíneos quanto no posicionamento da agulha no lúmen do vaso, ao mesmo tempo em que restringe o animal com segurança. Embora as injeções de veias da cauda sejam procedimentos comuns em muitos protocolos e não sejam consideradas altamente técnicas se realizadas corretamente, injeções precisas e consistentes são cruciais para obter resultados reprodutíveis e minimizar a variabilidade. Os métodos convencionais para induzir a vasodilatação antes das injeções da veia da cauda geralmente dependem do uso de uma fonte de calor, como uma lâmpada de calor, almofadas de calor elétrica/recarregáveis ou água pré-aquecida a 37 °C. Apesar de serem facilmente acessíveis em um ambiente laboratorial padrão, essas ferramentas evidentemente sofrem de capacidade termo-regulatória fraca/limitada. Da mesma forma, embora várias formas de dispositivos de contenção estejam disponíveis comercialmente, elas devem ser usadas cuidadosamente para evitar traumas nos animais. Essas limitações dos métodos atuais criam variáveis desnecessárias em experimentos ou resultam em resultados variados entre experimentos e/ou laboratórios.
Neste artigo, demonstramos um protocolo aprimorado usando um dispositivo inovador que combina um dispositivo de aquecimento independente, termicamente regulado, com uma unidade de contenção ajustável em um sistema para injeção eficiente de veias traseiras simplificadas. O exemplo que usamos é um modelo intravenoso de infecção fúngica da corrente sanguínea que resulta em sepse. O aparelho de aquecimento consiste em uma caixa de acrílico reflexiva ao calor instalada com um termostato automático ajustável para manter a temperatura interna em um limiar pré-definido. Da mesma forma, a largura e a altura do aparelho de contenção do cone podem ser ajustadas para acomodar com segurança vários tamanhos de roedores. Com as características avançadas e versáteis do dispositivo, a técnica mostrada aqui pode se tornar uma ferramenta útil em uma gama de áreas de pesquisa envolvendo modelos de roedores que empregam injeções de veias traseiras.
Introdução
O uso de modelos animais envolvendo roedores tem sido um marco da pesquisa biomédica. Numerosas cepas de raça e raça, bem como linhas geneticamente modificadas, estão disponíveis e rotineiramente utilizadas em laboratórios em todo o mundo. A injeção de veias traseiras é um dos métodos essenciais em modelos de roedores que requerem administração intravenosa (i.v.) de agentes experimentais. Geralmente, as injeções i.v. têm grandes vantagens sobre outras vias de administração, como altas taxas de absorção, contornando tecidos locais e o trato digestivo e alta tolerância a soluções de uma ampla gama de concentrações ou pH não fisiológico1,2,3,4. Entre outras rotas viáveis (por exemplo, veias safenas, sinuso venoso retro-orbital), as veias traseiras são consideradas o vaso sanguíneo mais seguro e facilmente acessível em roedores2,3,5,6. Assim, a injeção de veias traseiras tem sido amplamente utilizada em uma série de modelos de roedores, incluindo modelos de doenças infecciosas7,8,9, transplante de materiais biológicos10,11, avaliação de terapêutica pré-clínica12,13, e análises toxicológicas14,15.
Consistência e precisão da dosagem são um requisito crítico em injeções bem sucedidas da veia traseira. Surpreendentemente, a avaliação quantitativa e qualitativa das injeções de veias da cauda na literatura implica injeções erradas frequentes16,17. Estudo relatou que doze das trinta injeções realizadas por injetores treinados deixaram mais de 10% das doses injetadas dentro da cauda18. Além disso, a segurança e o conforto do animal que recebe injeções de veias da cauda devem ser uma preocupação primária durante o procedimento. A contenção inadequada pode levar a lesões e uma série de patologias relacionadas ao estresse (por exemplo, perda de peso, respostas imunes prejudicadas) que poderiam introduzir variáveis substanciais na qualidade da amostra19,20. Esses erros podem causar maior variabilidade nos dados e baixa reprodutibilidade, afetando negativamente os resultados do estudo.
A indução da dilatação vascular no animal é frequentemente necessária ao realizar injeções de veias traseiras devido ao pequeno diâmetro do vaso, estimado em 300 μm em camundongos21. A vasodilatação aumenta a visibilidade das veias da cauda e auxilia na obtenção de um alinhamento ideal entre agulha e veia dentro do lúmen venoso. Uma variedade de métodos foram relatados por laboratórios, como mergulhar a cauda em água morna22,aplicar calor na cauda usando uma cortina quente, lâmpada ou secador de cabelo23,24, ou colocar o animal em um ambiente quente usando uma almofada de aquecimento, incubadora ou caixa combinada com uma dessas fontes de calor25. Os dispositivos podem ser auto-fabricados para fins específicos ou disponíveis em fornecedores comerciais. No entanto, muitos não possuem capacidades termoreguladoras e, se houver, a temperatura do dispositivo é mal conservada e muitas vezes sujeita a variações na temperatura ambiente. Da mesma forma, o uso de um dispositivo de contenção é necessário para injeções de veias traseiras, pois o uso de anestesia não é recomendado26,27. Vários tipos de dispositivos de contenção específicos ou comerciais específicos de laboratório foram desenvolvidos. Normalmente, o animal é colocado em um tubo conônico descartável de 50 ml4, paredes de plexiglass ranhuted, um túnel ou cone28, todos os quais permitem ampla exposição da cauda enquanto restringe os movimentos do animal. No entanto, a maioria dos contentores tem limitações de tamanho devido à rigidez dos materiais. Além disso, os modernos dispositivos de alta complexidade, apesar dos designs práticos e sofisticados, não parecem ser viáveis para injeções envolvendo grandes grupos de animais22.
Modelos de camundongos de infecção da corrente sanguínea e sepse associada são um exemplo primordial de situações que requerem o uso desta técnica. Entre todas as etiologia microbiana de sepse clínica grave, a sepse fúngica é frequentemente uma condição fatal com taxas de mortalidade de >40% apesar da terapia antifúngica29. De fato, a infecção por Candida albicans foi relatada como a quarta principal causa de infecção por corrente sanguínea adquirida pelo hospital (candidemia)30,31. Na candidíase intra-abdominal, microrganismos no trato gastrointestinal podem se disseminar através da corrente sanguínea e causar sepse polimicrobiana com mortalidade ainda maior32,33,34. Como a maioria dos casos de candidemia nosocomial emerge de cateteres de linha central contaminados ou dispositivos médicos em habitação35,36, i.v. inoculação com C. albicans por injeção de veia de cauda pode espelhar de perto o desenvolvimento de sepse humana e tem sido um método básico em um modelo de camundongo de candidíase hematógenadisseminada 37,38. Neste modelo, a mortalidade que ocorre em dias pode ser estendida ou encurtada ajustando os C. albicans i.v. inoculum39,40,41.
Recentemente, nosso laboratório desenvolveu um protocolo inovador para uma injeção de veia traseira otimizamente simplificada usando um dispositivo inovador equipado com uma unidade de aquecimento termoregulada, emparelhado com uma unidade de contenção ajustável, em um sistema conveniente. Este protocolo permite que os pesquisadores realizem injeções de veias traseiras de forma precisa e oportuna, enquanto os animais podem ser condicionados e contidos com segurança para o procedimento com o mínimo de angústia. As técnicas aqui demonstradas, com o uso do dispositivo avançado de aquecimento e contenção, poderiam servir como uma ferramenta útil em diversas áreas de pesquisa que empregam modelos de roedores.
Protocolo
Todos os protocolos animais envolvendo injeções de veias traseiras e uso do dispositivo de aquecimento/contenção foram revisados e aprovados pelo Comitê De Cuidados Institucionais de Animais (IACUC) local.
1. Preparação
- Aclimar animais no ambiente habitacional por pelo menos 1 semana, e permitir comida e água ad libitum.
NOTA: Para a maioria dos novos usuários desta técnica de injeção, cepas animais com pele branca ou de cor clara podem ser preferíveis, pois as veias da cauda são facilmente visíveis através da pele. Cepas de cor escura de camundongos (por exemplo, C57BL/6) ou ratos (por exemplo, A Noruega Marrom) têm caudas profundamente pigmentadas, resultando em um contraste de cor fraco contra a veia. É altamente recomendável que novos usuários recebam treinamento adequado até que a proficiência seja alcançada. - Agentes para injeção da veia traseira
- Prepare todos os agentes de teste e soluções asepticamente. Ao administrar organismos ou materiais celulares, tome precauções durante todas as etapas de processamento para manter as condições livres de pirógenos.
- Utilize apenas solução salina normal (cloreto de sódio de 0,9% w/v) ou soluções de sal balanceadas, como soro fisiológico tamponado com fosfato (PBS) como veículos para injeção de veia traseira.
ATENÇÃO: Nunca use água, óleo ou soluções viscosas devido ao risco potencial de danos vasculares. Uma ampla gama de pH (4.5-8.0) é tolerável devido ao efeito tamponante do sangue e taxas de fluxo sanguíneo rápido em roedores. No entanto, soluções altamente ácidas ou alcalinas podem resultar em danos desnecessários nos tecidos no local da injeção e devem ser evitadas. - Limitar o volume e a frequência da injeção ao mínimo. Use os volumes recomendados para camundongos e ratos (≤200 μL e ≤500 μL, respectivamente) à temperatura corporal antes da injeção para minimizar o estresse ao animal3.
- Certifique-se de que cada preparação da seringa e agulha esteja livre de bolhas de ar na solução; se bolhas estiverem presentes, purgue-as completamente para evitar o risco de embolia.
NOTA: Normalmente, as seringas de 1 mL com agulhas de 27 G e 1/2 polegadas são adequadas para a maioria das injeções de veias da cauda. - Utilize equipamentos de proteção individual (EPI) adequados exigidos pela IACUC local com o mínimo de vestidos descartáveis ou dedicados e luvas de látex ou nitrito. O uso de óculos de segurança é altamente recomendado na realização de injeção de veia traseira.
- O dispositivo de aquecimento e contenção
- Inspecione cuidadosamente todos os componentes antes de usar para garantir que o dispositivo esteja livre de quaisquer defeitos(Figura 1).
- Inicialização do dispositivo de aquecimento (Figura 2A)
- Coloque a unidade de aquecimento em uma bancada plana limpa e ligue o dispositivo. Certifique-se de que a lâmpada indicadora de energia do termostato esteja verde. Coloque materiais de cama dentro da câmara de aquecimento para manter a área seca e reter o calor.
- Configuração do dispositivo de contenção(Figura 2B)
- Coloque a unidade de contenção ao lado da unidade de aquecimento e determine os tamanhos de cone apropriados para o animal. Se necessário, ajuste manualmente as larguras básicas do cone de alumínio flexível para fornecer contenção adequada para o animal. Alternativamente, substitua o cone por modelos personalizados para acomodar ratos ou ratos de tamanhos corporais variados.
2. Injeção de veia de cauda
- Ajustes do aparelho
- Definindo a temperatura interna
- Usando o mostrador de controle, coloque o termostato na temperatura desejada. Certifique-se de que o indicador do aquecedor está aceso em vermelho, e que a lâmpada se ilumine. Monitore o visor de temperatura interna cuidadosamente enquanto a lâmpada estiver iluminada (aquecimento). O termostato inativa a lâmpada automaticamente uma vez que uma temperatura-alvo tenha atingido, aproximadamente em 10-15 min.
NOTA: A definição de uma temperatura mais alta do que a temperatura ambiente ativa o aquecedor. Em geral, a temperatura de habitação recomendada em condições de vivarium padrão varia, variando de 20 a 26 °C, enquanto a temperatura neutra (ou seja, confortável) para ratos de laboratório é considerada entre 30 e 32 °C42. Portanto, recomenda-se que a temperatura interna da câmara de aquecimento seja elevada ligeiramente acima da termoneutralidade, aproximadamente entre 32 e 36 °C. Nunca coloque o termostato acima da temperatura corporal.
- Usando o mostrador de controle, coloque o termostato na temperatura desejada. Certifique-se de que o indicador do aquecedor está aceso em vermelho, e que a lâmpada se ilumine. Monitore o visor de temperatura interna cuidadosamente enquanto a lâmpada estiver iluminada (aquecimento). O termostato inativa a lâmpada automaticamente uma vez que uma temperatura-alvo tenha atingido, aproximadamente em 10-15 min.
- Posicionamento da plataforma de contenção
- Usando o botão de ajuste de altura, ajuste a altura do cone para o nível ideal para o usuário.
- Definindo a temperatura interna
- Tratamento térmico (Figura 3A)
- Uma vez atingida a temperatura-alvo (32-36 °C), transfira suavemente os animais da gaiola de habitação para a câmara de aquecimento.
NOTA: O tratamento térmico de 5 a 10 minutos é suficiente para induzir a vasodilatação e aumentar a visibilidade das veias da cauda. No entanto, os animais podem ser mantidos com segurança na câmara termoregulada durante a duração do procedimento (tipicamente 20-30 min sem sinal de hipertermia). A câmara de aquecimento pode conter com segurança 4-6 ratos ou um rato. - Monitore o animal para obter qualquer sinal de estresse térmico agudo (por exemplo, respiração rápida, letargia, comportamento de fuga de saltos).
ATENÇÃO: Os animais que apresentam sinais de hipertermia devem ser devolvidos à gaiola e monitorados até que retomem a atividade normal antes do reaproveitamento. Se isso for por causa da temperatura interna que excede a faixa ideal, certifique-se de que o dispositivo de aquecimento seja desligado.
- Uma vez atingida a temperatura-alvo (32-36 °C), transfira suavemente os animais da gaiola de habitação para a câmara de aquecimento.
- Etapas de injeção
- Levante o animal pela base da cauda, e remova-o da câmara de aquecimento. Introduza o animal na abertura do cone da unidade de contenção.
ATENÇÃO: Nunca levante ratos da extremidade da cauda; isso pode resultar em ferimentos graves. Métodos alternativos de manuseio devem ser utilizados para camundongos obesos ou gestantes28. - À medida que o animal agarra na borda distante do cone com suas pernas dianteiras, puxe suavemente a cauda para trás e passe a cauda através da fenda aberta. Fixar a extremidade traseira do animal na base do cone com uma perna traseira saindo do cone para que a veia lateral seja mostrada em uma posição de 12 horas. Qualquer perna traseira pode ser salientes, pois há duas veias laterais, uma de cada lado(Figura 3B).
- Segure a cauda no comprimento médio a dois terços com a mão não dominante entre o polegar e o indicador, colocando leve tensão na veia lateral para manter o posicionamento da cauda e a vasodilatação.
NOTA: A visibilidade aprimorada das veias dilatadas pelo tratamento térmico permite ao usuário determinar rapidamente um local de injeção para obter os melhores resultados(Figura 4). - Limpe a pele do local da injeção com uma esponja de gaze ou almofada umedecida com 70% de álcool. Limpe o mais suave e rápido possível para evitar irritação na cauda.
NOTA: Este procedimento pode ser omitido a critério do IACUC institucional. - Segure a seringa com a mão dominante e posicione a agulha paralela à cauda. Insira a agulha em direção à direção do fluxo sanguíneo, bisbifique-se em um ângulo de 10-15°(Figura 5A-B),e avance ainda mais no lúmen da veia penetrando 2-4 mm(Figura 5C-D). Injete lentamente a solução.
NOTA: Se a injeção for bem sucedida, nenhuma resistência no êmbolo deve ser sentida, e o fluido pode ser visto se movendo através da veia. Em caso de resistência ou bolhas brancas acima do local da injeção, remova a agulha e tente uma segunda injeção em um local acima da colocação original da agulha. Não tente injetar abaixo do local de injeção inicial, pois o fluido será liberado através do local inicial. Se a injeção de uma veia lateral não for bem sucedida, reposicione o animal para o lado oposto e faça mais tentativas na veia contralateral. O número máximo de tentativas dependerá de onde se inicia a tentativa de injeção ao longo da veia e o inchaço que pode ocorrer com tentativas perdidas. Consulte os regulamentos institucionais da IACUC para injeções erradas e lesões associadas. - Remova a agulha e pressione firmemente com o polegar para evitar o escoamento da solução injetada e/ou sangue. Continue a aplicar compressão suave com uma gaze/limpeza limpa ou tecido até que o sangramento tenha parado(Figura 6).
- Devolva o animal para sua gaiola, e monitore por pelo menos 5 minutos. Certifique-se de que o animal retome a atividade normal sem maior sangramento.
- Levante o animal pela base da cauda, e remova-o da câmara de aquecimento. Introduza o animal na abertura do cone da unidade de contenção.
3. Um modelo murino de infecção fúngica da corrente sanguínea e sepse
- Cepas de rato
- Aclimate feminino Suíço Webster superou camundongos com 6 semanas de idade por diretrizes institucionalmente recomendadas. Alternativamente, use cepas inbred/geneticamente modificadas (por exemplo, fundo C57BL/6) para este protocolo com inocula modificada (ver NOTA).
NOTA (ver Discussão para detalhes): Veias traseiras de camundongos com pele escura são muitas vezes menos visíveis do que aquelas com peles mais claras devido à cauda profundamente pigmentada(Figura 4). Há uma suscetibilidade variada à sepse fúngica/letalidade entre diferentes cepas de camundongos. O uso de cepas de camundongos além do Swiss Webster pode exigir otimização adicional do protocolo, considerando fatores relevantes (por exemplo, antecedentes genéticos, idade, sexo, tamanho do corpo) que podem influenciar o status imunológico do hospedeiro. Por exemplo, um desafio letal em camundongos C57BL/6 normalmente requer maior inocula (até 10x) para alcançar o nível de mortalidade visto em camundongos webster suíços.
- Aclimate feminino Suíço Webster superou camundongos com 6 semanas de idade por diretrizes institucionalmente recomendadas. Alternativamente, use cepas inbred/geneticamente modificadas (por exemplo, fundo C57BL/6) para este protocolo com inocula modificada (ver NOTA).
- Microorganismos
- Para um desafio letal (sepse), os estoques congelados de candida albicans coam DAY185 (ou cepas de escolha) em Sabouraud dextrose ágar e incubam a 30 °C por 2 dias.
- Transfira uma única colônia para o caldo extrato-peptone-dextrose de 10 mL e cultura para a fase estacionária de crescimento por 18h a 30 °C com agitação.
- Soluções inóculos
- No dia de um desafio letal, colete a cultura do caldo e lave a pelota 3 vezes por centrifugação (800 × g) em PBS estéril.
- Identifique células viáveis de leveduras por exclusão de corante azul trypan e enumerar usando um hemócito. Ajuste a concentração celular para 1 x 106 células/mL em PBS estéril à temperatura ambiente.
NOTA: Cada animal receberá 100 μL da solução inóculo. Prepare um volume excessivo do inóculo (>500 μL) para permitir uma perda potencial durante o procedimento de injeção. O inóculo final é 1 x 105 células por mouse. O volume do inóculo pode ser aumentado até 200 μL ajustando a concentração celular de acordo.
ATENÇÃO: A solução de inóculo fúngico deve ser mantida à temperatura ambiente antes da injeção. O aquecimento da solução inóculo à temperatura corporal pode induzir uma mudança morfológica das células de levedura para a hifa. Ao contrário, a administração de soluções frias pode reduzir rapidamente a temperatura corporal do animal e deve ser evitada.
- Inoculação intravenosa
- Aqueça os animais e induza a vasodilatação seguindo os procedimentos na seção 2.
- Injete 100 μL da solução inóculo na veia traseira usando uma seringa de 1 mL com uma agulha de 27 G, 1/2 polegadas.
- Monitoramento pós-inoculação
- Monitore os animais para obter os seguintes sinais de morbidade induzida pela sepse: i) aspecto da pele (por exemplo, postura suave, babada), ii) atividade (por exemplo, movendo-se livremente, sem resposta), iii) postura (por exemplo, curvado, rígido), iv) comportamento (por exemplo, lento, sem realocação), v) movimentos torácculos (por exemplo, respiração normal, dispneia), vi) pálpebras (por exemplo, aberto, fechado)43.
- Pontuação de sepse
- Escore a morbidade observada de acordo com um Escore de Avaliação Clínica de Camundongos modificado para Sepse (M-CASS) em uma escala de classificação de quatro pontos de 0 a 3 em cada categoria: 0, normal; 1, leve; 2, moderado; 3, grave43.
- Protocolo opcional: Vacinação contra sepse fúngica
- Quatorze dias antes de um desafio letal, camundongos inoculados com cepa candida dubliniensis Wü284 ou cepas atenuadas de C. albicans, como Δefg1/Δcph1 mutante (1x105 células por rato), conforme descrito nas seções 3.2-3.4 em vez de C. albicans DAY185.
- Realizar um desafio letal nos camundongos vacinados, conforme descrito nas seções 3.2-3.4, e monitorar os sinais de morbidade induzida por sepse descrita nas seções 3.5-3.6.
Resultados
A temperatura dentro da câmara de aquecimento é continuamente detectada pelo sensor interno e autorregulada pelo termostato. Primeiro, o mostrador de controle do termostato foi posicionado em 78, 85, 90 ou 95 °F (26, 29, 32 ou 95 °C) para selecionar temperaturas definidas. Uma vez que o aquecedor foi ativado(Figura 7, pontos amarelos), a emissão de calor pela lâmpada rapidamente elevou a temperatura interna durante os primeiros 5-15 min, dependendo da temperatura definida. O aquecedor inativava a lâmpada se a temperatura interna detectada excedesse a temperatura definida (pontos cinzentos). As temperaturas máximas iniciais devem subir para 5-7 °C acima das temperaturas definidas em todos os grupos para compensar a perda de temperatura durante a transferência de animais. Posteriormente, o dispositivo continua a repetir o ciclo de calor automaticamente e mantém a câmara de aquecimento na temperatura definida.
Um exemplo de dados experimentais obtidos por injeções bem sucedidas de veias traseiras usando o protocolo atual é mostrado na Figura 8. Em um modelo de candidíase da corrente sanguínea resultando em sepse, um desafio i.v. com candida albicans (1 x 105 células por rato) em camundongos webster suíços causou um rápido aparecimento de sepse e disseminação dos organismos, levando à alta mortalidade dentro de 3-4 dias (pontos abertos) (Figura 8A). Em contrapartida, os animais poderiam ser protegidos da sepse por pré-imunização/vacinação prévia com uma cepa de levedura avirulenta, Candida dubliniensis, alcançando >95% de sobrevivência após o desafio letais i.v. com albicanos virulentos (pontos sólidos). Estes resultados em mortalidade progressiva versus proteção mediada por vacinas foram obtidos de forma reprodutílica em quatro experimentos independentes (Figura Suplementar 1). Proteção semelhante poderia ser alcançada usando outras cepas de levedura avirulent, como mutantes atenuados C. albicans (Δefg1/Δcph1) (dados não mostrados). A sepse também pode ser monitorada e correlacionada com a mortalidade; os animais não vacinados com infecção letal apresentaram aumento significativo da morbidade induzida pela sepse, enquanto o grupo vacinado apresentou sintomas mínimos após o desafio letal(Figura 8B).

Figura 1: Descrição do dispositivo de aquecimento e contenção de roedores. (A) mostra a visão exterior do dispositivo de aquecimento, que consiste em:
- Tampa do termostato – levante para cima pela alça para expor o termostato
- Gabinete elétrico – selado permanentemente para proteção
- Tampa da câmara – levante para cima durante a transferência de animais para/de
- Câmara de aquecimento – removível, cubra o chão com roupa de cama antes de usar
- Aparelho de contenção – armazenado com o dispositivo de aquecimento enquanto não está em uso
- Interruptor de alimentação – interruptor de roqueiro inline para funções principais de ligar/desligar
- Cabo de alimentação – tensão/corrente: 120V/10A
(B) mostra o interior do dispositivo de aquecimento:
- Lâmpada incandescente – saída de luz a 100 Watts
- Escudo protetor de lâmpadas – removível para substituição de lâmpadas
- Sonda de sensor de temperatura – localizada dentro da câmara
- Termômetro de temperatura interna – coloque dentro da câmara para monitorar a temperatura
(C) mostra componentes do termostato do dispositivo de aquecimento:
- Termômetro de temperatura interna
- Termostato – regula automaticamente o aquecedor
- Alavanca de controle de ponto de configuração – mínima/máxima: 78 °F/108 °F (25 °C/42 °C)
- Indicador de energia do termostato – luz verde indica operação normal
- Indicador de aquecedor de termostato – vermelho aceso durante o ciclo de aquecimento
(D) mostra componentes do dispositivo de contenção:
- Cone – folha de alumínio flexível projetada para contenção de roedores
- Canal de cauda – moldado para permitir o posicionamento suave da cauda
- Plataforma de elevação de cone – fornece elevação robusta da base do cone
- Botão de ajuste de altura – projetado para ajuste manual de altura
- Jack tesoura – faixa de altura de 45 a 140 mm (1,77-5,52")
- Placa de suporte – instalada com pés de borracha para proporcionar estabilidade Clique aqui para ver uma versão maior desta figura.

Figura 2: O dispositivo de aquecimento e contenção de roedores. (A) Antes de usar, as duas partes do dispositivo são colocadas lado a lado em uma parte superior limpa do banco. (B) Uma vez que o dispositivo de aquecimento é ligado, o termostato ativa o aquecedor. A lâmpada permanece acesa e emite calor até que a câmara de aquecimento tenha atingido a temperatura definida. O dispositivo de aquecimento repete automaticamente o ciclo de calor para manter a temperatura interna. Clique aqui para ver uma versão maior desta figura.

Figura 3: Ratos (C57BL/6) colocados no dispositivo de aquecimento e contenção. (A) Camundongos que recebem tratamento térmico para vasodilatação. Os animais (4-6 camundongos por tratamento) são transferidos de sua gaiola de alojamento para a câmara de aquecimento do dispositivo e tratados com calor por um mínimo de 5-10 min. (B) Um rato contido para injeção de veia traseira. O rato é transferido da câmara de aquecimento para a abertura do cone do dispositivo de contenção com sua cauda passando pela fenda aberta. O mouse é puxado suavemente para trás para a borda distante do cone até que a base da cauda atinja a ponta do cone. À medida que o animal é atraído para a base do cone com uma suave rotação lateral, uma perna traseira é posicionada para cima para que ele se projeto para fora da fenda aberta permitindo que a veia traseira lateral seja posicionada às 12 horas. Clique aqui para ver uma versão maior desta figura.

Figura 4: Identificação das veias traseiras laterais em camundongos. ACauda de um rato webster suíço não tratado. O mouse é colocado no dispositivo de contenção sem tratamento térmico prévio para vasodilatação. A veia traseira lateral pode ser identificada como um vaso escuro fino que gira sob a pele. (B) A cauda de um rato Webster suíço tratado com o dispositivo de aquecimento por 10 minutos. O camundongo tratado com calor é contido para injeção de veia da cauda. A veia lateral da cauda é facilmente visível através da pele devido ao diâmetro do vaso induzido pela vasodilatação. (C) A cauda de um rato C57BL/6 tratado com o dispositivo de aquecimento por 10 minutos e contido para injeção da veia traseira. A vasodilatação aumenta a visibilidade da veia traseira através da pele profundamente pigmentada, embora a veia não seja tão facilmente visível quanto nos camundongos suíços de cor clara webster devido a um fraco contraste de cor contra a veia. Flechas vermelhas denotam a localização da veia traseira lateral. Clique aqui para ver uma versão maior desta figura.

Figura 5: Injeção de veia de cauda realizada em camundongos tratados com calor (Swiss Webster). (A-B) Inserção da agulha na veia lateral da cauda no local da injeção. A agulha (27 G, 1/2-in) é posicionada paralelamente à veia traseira com o bisel para cima e apontada para o fluxo sanguíneo e inserida. (C-D) Colocação da agulha na veia da cauda e injeção. A ponta da agulha é ainda mais avançada 2-4 mm no lúmen da veia. O polegar está posicionado sobre o êmbolo da seringa, e o volume desejado é dispensado com pressão lenta e constante. Círculos ovais indicam locais de injeção. Clique aqui para ver uma versão maior desta figura.
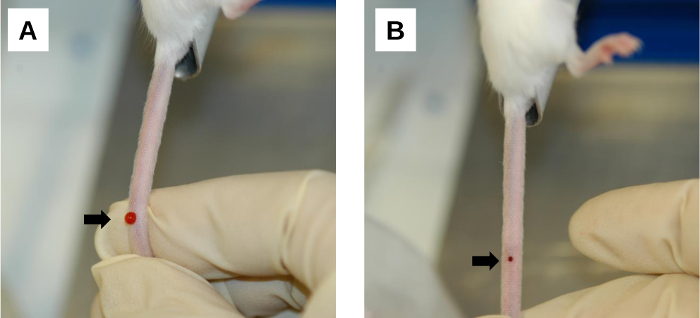
Figura 6: Procedimento pós-injeção. Umaárea de sangramento no local da injeção. O sangramento e o fluxo de retorno da solução injetada ocorrem imediatamente após a remoção da agulha. Isso pode ser minimizado aplicando compactação firme no local da injeção com o polegar. (B) Formação de coágulos sanguíneos no local da injeção. A compressão suave com uma gaze/limpeza limpa facilita a coagulação sanguínea na ferida de injeção. Setas denotam locais de injeção. Clique aqui para ver uma versão maior desta figura.
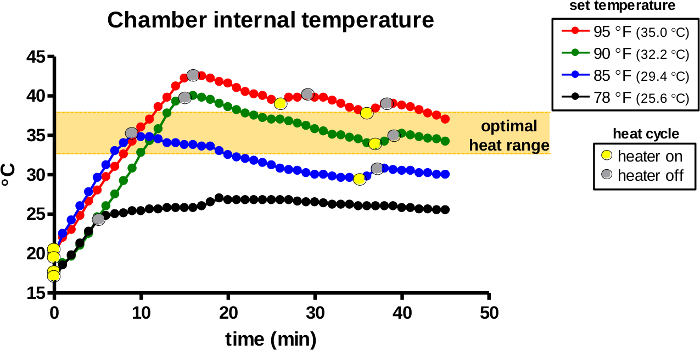
Figura 7: A temperatura interna da câmara de aquecimento durante o uso. O dispositivo de aquecimento foi ativado para aquecimento nas temperaturas definidas designadas. A câmara de aquecimento do dispositivo foi monitorada para a temperatura interna do ar e os ciclos de calor (lâmpadas acesas/pontos amarelos, pontos off/cinza) foram registrados ao longo de 45 min. A área laranja indica a faixa de temperatura ideal para indução de vasodilatação em roedores. Clique aqui para ver uma versão maior desta figura.
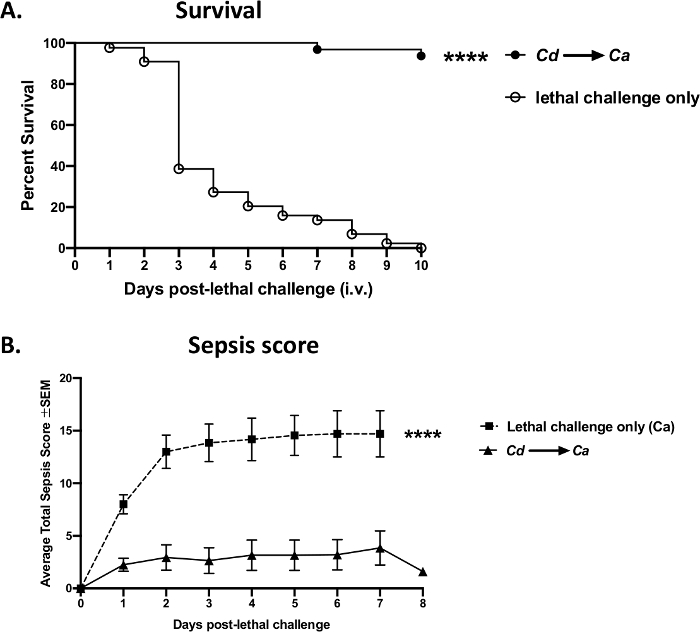
Figura 8: Mortalidade por sepse versus proteção mediada por vacinas após um desafio letal com os albicanos candida. Camundongos (fêmeas suíças Webster de 8 semanas) foram vacinados por via intravenosa com candida dubliniensis Wü284(Cd),seguido por um desafio intravenoso letal com c. albicans tipo selvagem DIA 185 (1 x 105 células por rato) 14 dias depois. (A) A Mortalidade foi avaliada ao longo de 10 dias após o desafio letal. (B) Os animais foram monitorados para morbidade de sepse e pontuados de acordo com um Escore de Avaliação Clínica de Camundongos modificado para Sepse (M-CASS)43. Os dados são cumulativos de 4 experimentos independentes com 10 ratos por grupo e analisados usando o teste de classificação de troncos de Mantel-Cox. p < 0,0001. SEM, erro padrão da média. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Reprodutibilidade da mortalidade por sepse e sobrevivência mediada por vacinas a partir de um desafio candida albicans da corrente sanguínea. Cada painel representa dados de quatro experimentos independentes incluídos em um resultado cumulativo mostrado na Figura 8A. Cada experimento foi realizado utilizando 10 camundongos por grupo e analisado utilizando-se o teste de log-rank de Mantel-Cox. Ca, Cândida albicans. Cd, Candida dubliniensis. p < 0,0001. p < 0,01. Clique aqui para baixar este número.
Discussão
A dosagem consistente e precisa são requisitos fundamentais para a confiabilidade experimental em modelos animais. Isso é especialmente importante em casos de administração i.v. onde a biodisponibilidade sistêmica de agentes injetados é consideravelmente maior/mais rápida do que com outras rotasadministrativas 3. Assim, erros na injeção da veia traseira podem ter um impacto prejudicial nos resultados do estudo. Historicamente, a injeção intraperitoneal (i.p.), em vez de i.v., tem sido o método mais comum para acesso sistêmico em roedores devido à simplicidade técnica e conveniência. No entanto, as rotas de administração tornam-se mais cruciais ao traduzir leituras pré-clínicas de animais para ambientes clínicos. Portanto, há a necessidade de melhoria contínua nos protocolos de roedores que poderiam facilitar a injeção bem sucedida da veia traseira.
O principal avanço no presente protocolo é o inovador dispositivo de aquecimento termoregulado que permite a indução efetiva da vasodilatação em roedores, o que melhora drasticamente a visibilidade das veias da cauda e do alinhamento da agulha. Métodos de aquecimento que são mal termregulados (por exemplo, lâmpadas), vasodilatadores tópicos ou irritantes de pele (por exemplo, xilenos) não só não são confiáveis, mas também são inseguros para o animal e devem ser evitados44. Ao contrário de outros métodos convencionais, como mergulhar a cauda em água morna, a capacidade de autoregulação deste dispositivo pode condicionar com segurança vários animais simultaneamente. Além disso, este protocolo é reforçado ainda mais usando o dispositivo de contenção idealmente projetado e permitindo uma imobilização rápida e segura do animal em uma posição que melhor exibe a veia traseira lateral.
Os formatos tubais transparentes vistos em muitos contentores atuais, embora praticamente bem desenhados, requerem mais tempo de manuseio com cada animal, prolongando assim o processo de contenção45. Isso pode ser mais problemático em cepas de roedores com traços agressivos que oferecem cooperação limitada46,47. Em contrapartida, a estrutura do cone semi-fechado do dispositivo de contenção permite o posicionamento rápido do animal e auxilia na minimização da duração da contenção. Em conjunto, o protocolo simplificado utilizando o inovador e altamente otimizado sistema de aquecimento/contenção acelera o procedimento de injeção, permitindo uma dosagem rápida e eficaz de grandes grupos de animais. Em nosso laboratório, normalmente completamos todo um procedimento de injeção de 30 camundongos desde o tratamento térmico até o monitoramento pós-injeção dentro de 1h usando este protocolo.
Apesar das características avançadas, este dispositivo tem algumas desvantagens aparentes: o primeiro é o custo do dispositivo e a substituição de lâmpadas de rotina na câmara de aquecimento. No entanto, além da eficiência e velocidade das injeções, o dispositivo é durável para uso repetido e compatível com desinfetantes mais comuns, permitindo uma limpeza completa do dispositivo entre os usos. Juntos, isso compensa o investimentoinicial. Second, em situações com espaço de trabalho limitado, uma desvantagem para este protocolo pode ser a exigência de uma área de banco dedicada grande o suficiente para colocar as duas unidades, lado a lado, durante a execução da injeção. No entanto, como o dispositivo pode ser utilizado amplamente em vários protocolos de roedores envolvendo injeções intravenosas, é possível que o dispositivo possa servir como um instrumento central semelhante a outros equipamentos de vivarium comunitários, como vaporizadores de isoflurane. Independentemente disso, as duas unidades são facilmente portáteis e podem ser empacotadas e armazenadas enquanto não estão em uso.
O modelo de desafio letal i.v. de sepse fúngica murina descrita neste protocolo imita de perto infecções da corrente sanguínea C. albicans em humanos e tem sido amplamente utilizado para estudar virulência fúngica, testar a eficácia de terapias antifúngicas e caracterizar respostas imunes hospedeiras à infecção37,39,48. Para alcançar uma infecção reprodutível, a inoculação intravenosa via injeção de veia traseira é o passo mais vital do protocolo para garantir a entrega precisa dos organismos na corrente sanguínea. Na verdade, os animais respondem de forma muito diferente a diferentes níveis de desafios de Candida i.v.; a administração de quantidades muito baixas de inóculo resultará em recuperações espontâneas indesejadas, enquanto os animais que recebem doses muito altas sucumbirão prematuramente. A janela específica de tamanhos inóculos para um determinado organismo para induzir um nível consistente de sepse/mortalidade depende em grande parte de cepas fúngicas e de camundongos.
O protocolo atual usando camundongos Webster suíços no inóculo de 1 x 105 tipos selvagens C. albicans induziu reproduivelmente o início da morbidade de sepse dentro de 1 dia, seguido pela mortalidade progressiva resultando em 100% de letalidade em 5-7 dias. Em contraste, inocula superior a 1 x 105 normalmente levam a mortes aceleradas (ou seja, 1-2 dias em 1 x 106, 3-4 dias em 5 x 105), e aqueles inferiores a 1 x 105 são sub-letais. Em consonância com inúmeros relatos na literatura, o uso de espécies candida nãoalbicanas no lugar de C. albicans resulta em significativa redução da letalidade40,49. Além disso, a escolha de cepas de camundongos, ou mesmo a origem das colônias, pode ter um impacto considerável nos desfechos de infecção devido a diferentes suscetibilidades entre as cepas de camundongos, conforme relatado por outros39,40,41,50,51,52,53,54,55. Portanto, ambos devem ser levados em consideração ao projetar experimentos.
Após um desafio letal, as células fúngicas se espalham rapidamente pela corrente sanguínea e começam a invadir múltiplos órgãos, entre os quais os mais afetados são os rins41. Outros órgãos afetados são o cérebro, o baço e a medula óssea48,56. Independentemente disso, a sepse aguda é a causa final da morte no início dos pontos37. Como mostrado nos resultados representativos, a gravidade da sepse pode ser avaliada quantitativamente pelo Escore de Avaliação Clínica do Camundongo para Sepse (M-CASS) com base em sinais expostos de condição de sepse em animais desafiados43,57. Entre os vários marcadores substitutos da sepse letal, a hipotermia tem sido sugerida como um preditor crítico para a morte iminente em sepse clínica e experimental43,58,59.
Embora não tenham sido realizados estudos formais para comparar diretamente camundongos de raça e raça neste modelo, os dados obtidos do protocolo atual usando camundongos webster suíços de raça superada são excepcionalmente reprodutíveis em vários parâmetros de sepse, apesar da suposta heterogeneidade genética. Geralmente, um padrão de mortalidade que se enquadra dentro de 3 a 5 dias é um modelo firme de sepse aguda, evidenciado pela rápida elevação na morbidade de sepse e níveis de marcadores inflamatórios dentro de horas do desafio pós-letal50,51. Por mais tempo de sobrevivência (7 a 10 dias), a mortalidade é provavelmente o resultado de uma carga microbiana que leva a danos teciduais letais em órgãos alvo e no sistema nervoso central. A escolha da sepse ou da carga microbiana pode ser aplicada conforme necessário para avaliar funções imunológicas ou respostas a regimes anti-inflamatórios ou terapias/vacinas antifúngicas, conforme determinado pelo inóculo utilizado.
Além do modelo de desafio letal i.v., a infecção intra-abdominal com C. albicans em camundongos através de um desafio i.p. também pode levar à candidíase disseminada e sepse subsequente, embora a co-inoculação com o patógeno bacteriano, Staphylococcus aureus, sinergicamente aumenta a mortalidade em comparação com c. albicans mono-infecção51,60,61. No modelo de desafio letal i.p., inocula microbiana substancialmente maior (1,75 x 107C. albicans/8 x 107S. aureus por camundongo) são necessários para causar peritonite polimicrobiana e disseminação dos organismos da cavidade abdominal para a corrente sanguínea. Da mesma forma, a infecção gastrointestinal com C. albicans em camundongos tratados com agentes imunossupressores e/ou prejudiciais à mucosa leva à translocação das células fúngicas para a corrente sanguínea e resulta em sepse fúngica62,63. Apesar das distintas rotas de inoculação, o mecanismo de sepse fúngica é em grande parte análogo entre os três modelos da doença, envolvendo uma resposta proinflamatória sistêmica descontrolada à Candida que leva à falência de órgãos37,51,61. Da mesma forma, em humanos, é esse processo de resposta do hospedeiro, não apenas a candidemia, que causa a alta morbidade/mortalidade associada à candidíase hematógena difundida adquirida nos estabelecimentos de saúde64,65.
Utilizando o modelo atual de sepse fúngica, demonstramos aqui que a proteção contra a infecção letal de C. albicans pode ser alcançada por i.v. pré-imunização/vacinação com C. dubliniensis (avirulent) ou mutantes atenuados de C. albicans, concomitante com redução significativa na morbidade de sepse. A proteção é mediada por células supressoras inatas Gr-1+ derivadas de mielóides que parecem ter sido induzidas na medula óssea como uma forma de imunidade inata treinada66,67. Esforços estão em andamento para estender a compreensão desta nova forma de proteção imuno-mediada inata contra infecções da corrente sanguínea de C. albicans.
Em conclusão, o inovador dispositivo de aquecimento/contenção de roedores tem sido fundamental para avançar nossa capacidade de realizar injeções i.v. de estudos em vários grupos em animais de forma eficiente e eficaz. Como tal, nós criamos o termo, Mouse a Minute, para o dispositivo. As especificações do dispositivo estão disponíveis no autor correspondente mediante solicitação de aquisição de um dispositivo semelhante. As técnicas aqui demonstradas poderiam servir como uma ferramenta útil em modelos de roedores que empregam injeções de veias traseiras em uma ampla gama de áreas de pesquisa.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela LSUHSC Foundation (PLF), e em parte pelo U54 GM104940 do Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde, que financia o Centro de Ciência Clínica e Translacional da Louisiana.
Materiais
| Name | Company | Catalog Number | Comments |
| Candida albicans strain DAY185 | Carnegie Melon University | N/A | provided by the laboratory of Aaron Mitchell |
| Candida albicans strain efg1Δ/Δ cph1Δ/Δ | University of Tennessee Health Sciences Center | N/A | provided by the laboratory of Glen Palmer |
| Candida dubliniensis strain Wü284 | Trinity College, Dublin, Ireland | N/A | provided by the laboratory of Gary Moran |
| Mice | Charles River Laboratories | 551NCICr:SW | Female Swiss Webster; 6-8 weeks old |
| Mice | Charles River Laboratories | 556NCIC57BL/6 | Female C57BL/6; 6-8 weeks old |
| Needles, 27G, ½-in | Becton Dickinson | 305109 | can be substituted from other vendors |
| Phosphate buffered saline (PBS) | GE | SH30028.02 | can be substituted from other vendors |
| Rodent warming and restraining device (Mouse a Minute) | LSU Health | custom order | Mouse a Minute is available for custom ordering from LSU Health |
| Sabouraud dextrose agar (SDA) | Becton Dickinson | 211584 | can be substituted from other vendors |
| Syringes, 1 mL | Becton Dickinson | 309659 | can be substituted from other vendors |
| Trypan blue solution | Sigma | T8154 | |
| Yeast peptone dextrose (YPD) broth | Fisher Scientific | BP2469 | can be substituted from other vendors |
Referências
- Woodard, G. Methods of animal experimentation. Gay, W. J. 1, 343-359 (1965).
- Shimizu, S. The laboratory mouse The handbook of experimental animals. Hedrich, H. J. , Elsevier Academic Press. Ch. 32 527-541 (2004).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. Journal of the American Association for Laboratory Animal Science. 50 (5), 614-627 (2011).
- Donovan, J., Brown, P. Parenteral injections. Current Protocols in Immunology. 73 (1), Chapter 1, Unit 1 6(2006).
- Schoch, A., Thorey, I. S., Engert, J., Winter, G., Emrich, T. Comparison of the lateral tail vein and the retro-orbital venous sinus routes of antibody administration in pharmacokinetic studies. Lab Animal. 43 (3), 95-99 (2014).
- Jarneborn, A., et al. Tofacitinib treatment aggravates Staphylococcus aureus septic arthritis, but attenuates sepsis and enterotoxin induced shock in mice. Scientific Reports. 10 (1), 10891(2020).
- Bussey, K. A., et al. Endosomal Toll-like receptors 7 and 9 cooperate in detection of murine Gammaherpesvirus 68 infection. Journal of Virology. 93 (3), (2019).
- Pitts, M. G., D'Orazio, S. E. F. A Comparison of oral and intravenous mouse models of listeriosis. Pathogens. 7 (1), (2018).
- Jespersen, H., et al. Clinical responses to adoptive T-cell transfer can be modeled in an autologous immune-humanized mouse model. Nature Communications. 8 (1), 707(2017).
- Gomez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Srinageshwar, B., et al. Surface-modified G4 PAMAM dendrimers cross the blood-brain barrier following multiple tail-vein injections in C57BL/6J mice. ACS Chemical Neuroscience. 10 (9), 4145-4150 (2019).
- Channabasappa, S., et al. Efficacy of novel antistaphylococcal ectolysin P128 in a rat model of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Sadeghi, B., et al. Preclinical toxicity evaluation of clinical grade placenta-derived decidua stromal cells. Frontiers in Immunology. 10, 2685(2019).
- Boquet, M. P., Wonganan, P., Dekker, J. D., Croyle, M. A. Influence of method of systemic administration of adenovirus on virus-mediated toxicity: focus on mortality, virus distribution, and drug metabolism. Journal of Pharmacological and Toxicological Methods. 58 (3), 222-232 (2008).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39 (4), 264-270 (2011).
- Lasnon, C., Dugue, A. E., Briand, M., Dutoit, S., Aide, N. Quantifying and correcting for tail vein extravasation in small animal PET scans in cancer research: is there an impact on therapy assessment. EJNMMI Research. 5 (1), 61(2015).
- Groman, E. V., Reinhardt, C. P. Method to quantify tail vein injection technique in small animals. Contemporary Topics in Laboratory Animal Science. 43 (1), 35-38 (2004).
- Aller, M. A., et al. Neuro-immune-endocrine functional system and vascular pathology. Medical Hypotheses. 57 (5), 561-569 (2001).
- McEwen, B. S., et al. The role of adrenocorticoids as modulators of immune function in health and disease: neural, endocrine and immune interactions. Brain Research. Brain Research Reviews. 23 (1-2), 79-133 (1997).
- Callewaert, B. L., et al. Absence of arterial phenotype in mice with homozygous slc2A10 missense substitutions. Genesis. 46 (8), 385-389 (2008).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods in Enzymology. 479, 397-411 (2010).
- Carlson, R. P. J., Peer, B. In Vivo Models of Inflammation Progress in Inflammation Research. Morgan, D. W., Marshall, L. , Birkhäuser, Basel. 1-50 (1999).
- Flecknell, P. Laboratory Animals: An Introduction for New Experimenters. Tuffery, A. A. , John Wiley and Sons. 225-260 (1987).
- Kim, M. J., Ahituv, N. The hydrodynamic tail vein assay as a tool for the study of liver promoters and enhancers. Methods in Molecular Biology. 1015, 279-289 (2013).
- Bargellini, A., et al. Effects of chronic exposure to anaesthetic gases on some immune parameters. Science of The Total Environment. 270 (1-3), 149-156 (2001).
- Elena, G., et al. Inhalatory anesthetic (halothane) associated changes in the immune response in mice. International Journal of Immunopharmacology. 19 (11-12), 699-707 (1998).
- Buerge, T. The Laboratory Mouse The handbook of experimental animals. Hedrich, H. J., Bullock, G. , Elsevier Academic Press. Ch. 31 517-526 (2004).
- Cohen, J., Cristofaro, P., Carlet, J., Opal, S. New method of classifying infections in critically ill patients. Critical Care Medicine. 32 (7), 1510-1526 (2004).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Magill, S. S., et al. Multistate point-prevalence survey of health care-associated infections. The New England Journal of Medicine. 370 (13), 1198-1208 (2014).
- Dupont, H., et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Archives of Surgery. 137 (12), 1341-1346 (2002).
- Montravers, P., et al. Candida as a risk factor for mortality in peritonitis. Critical Care Medicine. 34 (3), 646-652 (2006).
- Calandra, T., Bille, J., Schneider, R., Mosimann, F., Francioli, P. Clinical significance of Candida isolated from peritoneum in surgical patients. Lancet. 2 (8677), 1437-1440 (1989).
- Kojic, E. M., Darouiche, R. O. Candida infections of medical devices. Clinical Microbiology Reviews. 17 (2), 255-267 (2004).
- Ramage, G., Martinez, J. P., Lopez-Ribot, J. L. Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Research. 6 (7), 979-986 (2006).
- Spellberg, B., Ibrahim, A. S., Edwards, J. E., Filler, S. G. Mice with disseminated candidiasis die of progressive sepsis. Journal of Infectious Diseases. 192 (2), 336-343 (2005).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L. Animal models for candidiasis. Current Protocols in Immunology. 105 (1), (2014).
- Lionakis, M. S., Lim, J. K., Lee, C. C., Murphy, P. M. Organ-specific innate immune responses in a mouse model of invasive candidiasis. Journal of Innate Immunity. 3 (2), 180-199 (2011).
- Segal, E., Frenkel, M. Experimental in vivo models of candidiasis. Journal of Fungi. 4 (1), (2018).
- MacCallum, D. M., Odds, F. C. Temporal events in the intravenous challenge model for experimental Candida albicans infections in female mice. Mycoses. 48 (3), 151-161 (2005).
- Gordon, C. J. The mouse thermoregulatory system: Its impact on translating biomedical data to humans. Physiology & Behavior. 179, 55-66 (2017).
- Mai, S. H. C., et al. Body temperature and mouse scoring systems as surrogate markers of death in cecal ligation and puncture sepsis. Intensive Care Medicine Experimental. 6, 20(2018).
- Catty, D., Lehmann, P. F. A simple low-cost restrainer for the intravenous injection of mice. Sabouraudia. 16 (2), 89-90 (1978).
- Donovan, J., Brown, P. Handling and restraint. Current Protocols in Immunology. 73 (1), Chapter 1 Unit 1 (2006).
- Dow, H. C., et al. Genetic dissection of intermale aggressive behavior in BALB/cJ and A/J mice. Genes Brain and Behavior. 10 (1), (2010).
- Pugh, P. L., Ahmed, S. F., Smith, M. I., Upton, N., Hunter, A. J. A behavioural characterisation of the FVB/N mouse strain. Behavioural Brain Research. 155 (2), 283-289 (2004).
- MacCallum, D. M., Odds, F. C. Need for early antifungal treatment confirmed in experimental disseminated Candida albicans infection. Antimicrobial Agents and Chemotherapy. 48 (12), 4911-4914 (2004).
- Fakhim, H., et al. Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine model. Mycoses. 61 (6), 377-382 (2018).
- Remick, D. G., Newcomb, D. E., Bolgos, G. L., Call, D. R. Comparison of the mortality and inflammatory response of two models of sepsis: lipopolysaccharide vs. cecal ligation and puncture. Shock. 13 (2), 110-116 (2000).
- Nash, E. E., Peters, B. M., Palmer, G. E., Fidel, P. L., Noverr, M. C. Morphogenesis is not required for Candida albicans-Staphylococcus aureus intra-abdominal infection-mediated dissemination and lethal sepsis. Infection and Immunity. 82 (8), 3426-3435 (2014).
- Rogers, T., Balish, E. Experimental Candida albicans infection in conventional mice and germfree rats. Infection and Immunity. 14 (1), 33-38 (1976).
- Marquis, G., Montplaisir, S., Pelletier, M., Auger, P., Lapp, W. S. Genetics of resistance to infection with Candida albicans in mice. The British Journal of Experimental Pathology. 69 (5), 651-660 (1988).
- Ashman, R. B., Fulurija, A., Papadimitriou, J. M. Strain-dependent differences in host response to Candida albicans infection in mice are related to organ susceptibility and infectious load. Infection and Immunity. 64 (5), 1866-1869 (1996).
- Ashman, R. B., Bolitho, E. M., Papadimitriou, J. M. Patterns of resistance to Candida albicans in inbred mouse strains. Immunology & Cell Biology. 71 (3), 221-225 (1993).
- Liu, Y., Mittal, R., Solis, N. V., Prasadarao, N. V., Filler, S. G. Mechanisms of Candida albicans trafficking to the brain. PLoS Pathogens. 7 (10), 1002305(2011).
- Huet, O., et al. Ensuring animal welfare while meeting scientific aims using a murine pneumonia model of septic shock. Shock. 39 (6), 488-494 (2013).
- Kushimoto, S., et al. The impact of body temperature abnormalities on the disease severity and outcome in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis. Critical Care. 17 (6), 271(2013).
- Wiewel, M. A., et al. Risk factors, host response and outcome of hypothermic sepsis. Critical Care. 20 (1), 328(2016).
- Peters, B. M., Noverr, M. C. Candida albicans-Staphylococcus aureus polymicrobial peritonitis modulates host innate immunity. Infection and Immunity. 81 (6), 2178-2189 (2013).
- Nash, E. E., Peters, B. M., Fidel, P. L., Noverr, M. C. Morphology-Independent Virulence of Candida Species during Polymicrobial Intra-abdominal Infections with Staphylococcus aureus. Infection and Immunity. 84 (1), 90-98 (2016).
- Hirayama, T., et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation. Scientific Reports. 10 (1), 3814(2020).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal damage and neutropenia are required for Candida albicans dissemination. PLoS Pathogens. 4 (2), 35(2008).
- Vergidis, P., et al. Intra-abdominal candidiasis: The importance of early source control and antifungal treatment. PLoS One. 11 (4), 0153247(2016).
- Parker, J. C., McCloskey, J. J., Knauer, K. A. Pathobiologic features of human candidiasis. A common deep mycosis of the brain, heart and kidney in the altered host. American Journal of Clinical Pathology. 65 (6), 991-1000 (1976).
- Esher, S. K., Fidel, P. L., Noverr, M. C. Candida/Staphylococcal Polymicrobial Intra-Abdominal Infection: Pathogenesis and Perspectives for a Novel Form of Trained Innate Immunity. Journal of Fungi. 5 (2), (2019).
- Lilly, E. A., Ikeh, M., Nash, E. E., Fidel, P. L., Noverr, M. C. Immune protection against lethal fungal-bacterial intra-abdominal infections. mBio. 9 (1), (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados