Method Article
Современное согревающее/удерживающее устройство для эффективных инъекций хвостовых вен в модели грибкового сепсиса мышей
В этой статье
Резюме
Здесь мы представляем эффективный и действенный метод инъекций вен хвоста грызуна с использованием уникально разработанного согревающего / сдерживающего устройства. Оптимизируя инициирование сосудорасширяющих и сдерживающих процессов, этот протокол позволяет точно и своевременно внутривенно вливать большие группы животных с минимальным дистрессом.
Аннотация
В моделях грызунов инъекции хвостовой вене являются важными методами внутривенного введения экспериментальных агентов. Инъекции хвостовой вены обычно включают в себя согревание животного, чтобы способствовать расширению сосудов, что помогает как в идентификации кровеносных сосудов, так и в позиционировании иглы в просвете сосуда, надежно удерживая животное. Хотя инъекции в хвостовые вены являются распространенными процедурами во многих протоколах и не считаются высокотехническими, если они выполняются правильно, точные и последовательные инъекции имеют решающее значение для получения воспроизводимых результатов и минимизации изменчивости. Традиционные способы индуцирования вазодилатации перед инъекциями хвостовой веной обычно зависят от использования источника тепла, такого как тепловая лампа, электрические/перезаряжаемые грелки или предварительно нагретая вода при 37 °C. Несмотря на то, что эти инструменты легко доступны в стандартных лабораторных условиях, они, очевидно, страдают от плохого/ограниченного потенциала терморегуляторного регулирования. Аналогичным образом, хотя различные формы удерживающих устройств коммерчески доступны, их необходимо использовать осторожно, чтобы избежать травмирования животных. Эти ограничения современных методов создают ненужные переменные в экспериментах или приводят к различным результатам между экспериментами и/или лабораториями.
В этой статье мы демонстрируем улучшенный протокол с использованием инновационного устройства, которое сочетает в себе независимое, термически регулируемое, нагревающее устройство с регулируемым удерживающим блоком в одну систему для эффективного впрыска хвостовой вен. Пример, который мы используем, представляет собой внутривенную модель грибковой инфекции кровотока, которая приводит к сепсису. Согревательный аппарат состоит из теплоотражающей акриловой коробки, установленной с регулируемым автоматическим термостатом для поддержания внутренней температуры на заданном пороге. Аналогичным образом, ширина и высота конусного удерживающего устройства могут быть отрегулированы для безопасного размещения различных размеров грызунов. Благодаря передовым и универсальным функциям устройства, показанная здесь техника может стать полезным инструментом в ряде областей исследований, связанных с моделями грызунов, которые используют инъекции хвостовых вен.
Введение
Использование животных моделей с участием грызунов было основным продуктом биомедицинских исследований. Многочисленные инбредные и внеродные штаммы, а также генетически модифицированные линии доступны и регулярно используются в лабораториях по всему миру. Инъекция хвостовой вене является одним из основных методов в моделях грызунов, требующих внутривенного (т.е.в.) введения экспериментальных агентов. Как правило, внутривенные инъекции имеют значительные преимущества перед другими путями введения, такими как высокая скорость всасывания при обходе местных тканей и пищеварительного тракта и высокая толерантность к растворам широкого диапазона концентраций или нефизиологического рН1,2,3,4. Среди других жизнеспособных i.v. маршрутов (например, подкожно-подкожное вено, ретроорбитальное венозное синус) хвостовые вены считаются самым безопасным и наиболее доступным кровеносным сосудом у грызунов2,3,5,6. Следовательно, инъекция хвостовой вены широко используется в ряде моделей грызунов, включая модели инфекционных заболеваний7,8,9,трансплантацию биологических материалов10,11,оценку доклинических терапевтических средств12,13и токсикологические анализы14,15.
Последовательность и точность дозирования являются критическим требованием при успешной инъекции в хвостовую вену. Удивительно, но количественная и качественная оценка инъекций в хвостовые вены в литературе означает частые неправильные инъекции16,17. Исследование показало, что двенадцать из тридцати инъекций, выполненных обученными инъекторами, оставили более 10% введенных доз в хвосте18. Кроме того, безопасность и комфорт животного, получающего инъекции хвостовой вене, должны быть главной заботой во время процедуры. Неправильное ограничение может привести к травмам и ряду патологий, связанных со стрессом (например, потеря веса, нарушение иммунных реакций), которые могут внести существенные изменения в качество выборки19,20. Эти ошибки могут привести к повышенной изменчивости данных и плохой воспроизводимости, что негативно влияет на результаты исследования.
Индукция расширения сосудов у животного часто необходима при выполнении инъекций в хвостовую вену из-за малого диаметра сосуда, оцениваемого в 300 мкм у мышей21. Вазодилатация улучшает видимость хвостовых вен и помогает в достижении оптимального выравнивания иглы и вены в венозном просвете. Лаборатории сообщали о различных способах, таких как погружение хвоста в теплую воду22,применение тепла к хвосту с использованием теплой драпировки, лампы или фена23,24или помещение животного в теплую среду с использованием грелки, инкубатора или коробки в сочетании с одним из этих источников тепла25. Устройства могут быть как самодельными для конкретных целей, так и доступными у коммерческих поставщиков. Тем не менее, многим из них не хватает терморегуляторных возможностей, и если таковые имеются, температура устройства плохо поддерживается и часто подвержена изменениям комнатной температуры. Аналогично, использование удерживающего устройства необходимо для инъекций в хвостовую вену, так как применение анестезии не рекомендуется26,27. Было разработано несколько типов лабораторных или коммерческих удерживающих устройств. Как правило, животное помещают в одноразовую коническую трубку 50 мл4,щелевые стенки из плексигласа, туннель или конус28,все из которых позволяют достаточно обнажить хвост при ограничении движений животного. Однако большинство ограничительных средств имеют ограничения по размеру из-за жесткости материалов. Кроме того, современные устройства высокой сложности, несмотря на практичные и сложные конструкции, по-видимому, не под возможны для инъекций с участием больших групп животных22.
Мышиные модели инфекции кровотока и связанного с ней сепсиса являются ярким примером ситуаций, требующих использования этого метода. Среди всех микробных этиологий тяжелого клинического сепсиса грибковый сепсис часто является смертельным состоянием с показателями смертности >40%, несмотря на противогрибковую терапию29. Фактически, инфекция Candida albicans была зарегистрирована как четвертая ведущая причина больничной инфекции кровотока (кандидемия)30,31. При внутрибрюшном кандидозе микроорганизмы в желудочно-кишечном тракте могут распространяться по кровотоку и вызывать полимикробный сепсис с еще большей смертностью32,33,34. Поскольку большинство случаев внутрикуманной кандидемии возникают из загрязненных катетеров центральной линии или встроенных медицинских устройств35,36, т.е.инокуляция C. albicans путем инъекции в хвостовую вену может близко отражать развитие сепсиса человека и является основным методом в мышиной модели гематогенно диссеминированного кандидоза37,38. В этой модели смертность, которая происходит в днях, может быть увеличена или сокращена путем корректировки C. albicans i.v. inoculum39,40,41.
Недавно наша лаборатория разработала инновационный протокол для оптимально оптимизированного впрыска хвостовой вен с использованием инновационного устройства, оснащенного терморегулируемым нагревательным блоком, в паре с регулируемым удерживающим блоком, в одной удобной системе. Этот протокол позволяет исследователям выполнять инъекции хвостовых вен точно и своевременно, в то время как животные могут быть безопасно обусловлены и ограничены для процедуры с минимальным стрессом. Методы, продемонстрированные здесь, с использованием передового устройства для нагрева и сдерживания, могут служить полезным инструментом в различных областях исследований с использованием моделей грызунов.
протокол
Все протоколы для животных, включающие инъекции хвостовых вен и использование согревающего / удерживающего устройства, были рассмотрены и одобрены местным Институциональным комитетом по уходу за животными (IACUC).
1. Подготовка
- Акклиматизуйте животных в условиях содержания не менее 1 недели, а также допускайте пищу и воду ad libitum.
ПРИМЕЧАНИЕ: Для большинства новых пользователей этой инъекционной техники штаммы животных с белым или светлым мехом могут быть предпочтительными, поскольку хвостовые вены легко видны через кожу. Темные штаммы мышей (например, C57BL/6) или крыс (например, Brown Norway) имеют глубоко пигментированные хвосты, что приводит к слабому цветовой контрасту против вен. Настоятельно рекомендуется, чтобы новые пользователи проходили надлежащую подготовку до тех пор, пока не будет достигнут уровень квалификации. - Средства для инъекций в хвостовую вену
- Подготовьте все тестовые агенты и растворы асептически. При введении организмов или клеточных материалов принимайте меры предосторожности на всех этапах обработки для поддержания условий, свободных от пирогенов.
- Используйте только обычный физиологический раствор (0,9% мас./об.хлорида натрия) или сбалансированные солевые растворы, такие как фосфат-буферный физиологический раствор (PBS), в качестве носителей для инъекции хвостовой веной.
ВНИМАНИЕ: Никогда не используйте воду, масло или вязкие растворы из-за потенциального риска повреждения сосудов. Широкий диапазон рН (4,5–8,0) терпим из-за буферного эффекта крови и быстрых темпов кровотока у грызунов. Тем не менее, очень кислые или щелочные растворы могут привести к ненужному повреждению тканей в месте инъекции, и их следует избегать. - Ограничьте объем и частоту инъекций до минимума. Используйте рекомендуемые объемы для мышей и крыс (≤200 мкл и ≤500 мкл соответственно) при температуре тела перед инъекцией, чтобы свести к минимуму стресс для животного3.
- Следите за тем, чтобы каждый препарат шприца и иглы был свободен от пузырьков воздуха в растворе; если пузырьки присутствуют, очистите их полностью, чтобы предотвратить риск эмболии.
ПРИМЕЧАНИЕ: Как правило, шприцы 1 мл с иглами 27 г, 1/2 дюйма достаточны для большинства инъекций в хвостовую вену. - Используйте соответствующие средства индивидуальной защиты (СИЗ), требуемые местным IACUC, с минимумом одноразовых или специальных халатов и латексных или нитриловых перчаток. Использование защитных очков настоятельно рекомендуется при выполнении инъекций в хвостовую вену.
- Устройство подогрева и удерживающее устройство
- Тщательно осмотрите все компоненты перед использованием, чтобы убедиться, что устройство не имеет каких-либо дефектов(рисунок 1).
- Инициализация нагревательного устройства(рисунок 2А)
- Поместите нагреватель на чистую плоскую столешницу и включите устройство. Убедитесь, что индикатор питания термостата горит зеленым цветом. Поместите постельные материалы внутрь согревающей камеры, чтобы сохранить область сухой и сохранить тепло.
- Установка удерживающего устройства(рисунок 2B)
- Поместите удерживающее устройство рядом с нагревающим блоком и определите подходящие размеры конуса для животного. При необходимости вручную отрегулируйте ширину основания податливого алюминиевого конуса, чтобы обеспечить адекватную удерживаемую чувствительность для животного. В качестве альтернативы, замените конус на специально подобранные модели для размещения мышей или крыс различных размеров тела.
2. Инъекция в хвостовую вену
- Регулировка аппарата
- Установка внутренней температуры
- С помощью контрольного циферблата установите термостат на нужную температуру. Убедитесь, что индикатор нагревателя горит красным цветом и что лампочка загорается. Внимательно следите за внутренним дисплеем температуры, пока лампа горит (нагревается). Термостат автоматически активирует колбу после достижения целевой температуры, примерно через 10–15 мин.
ПРИМЕЧАНИЕ: Установка температуры выше температуры окружающей среды активирует нагреватель. В целом, рекомендуемая температура корпуса в стандартных условиях вивария варьируется в диапазоне от 20 до 26 °C, в то время как нейтральная (т.е. комфортная) температура для лабораторных мышей считается между 30 и 32 °C42. Поэтому рекомендуется, чтобы внутренняя температура нагревательной камеры была повышена несколько выше термонейтральности, примерно при 32–36 °C. Никогда не устанавливайте термостат выше температуры тела.
- С помощью контрольного циферблата установите термостат на нужную температуру. Убедитесь, что индикатор нагревателя горит красным цветом и что лампочка загорается. Внимательно следите за внутренним дисплеем температуры, пока лампа горит (нагревается). Термостат автоматически активирует колбу после достижения целевой температуры, примерно через 10–15 мин.
- Позиционирование удерживающей платформы
- С помощью регулятора высоты отрегулируйте высоту конуса до оптимального уровня для пользователя.
- Установка внутренней температуры
- Термообработка(Рисунок 3А)
- Как только целевая температура будет достигнута (32–36 °C), осторожно перенесите животных из клетки в камеру нагрева.
ПРИМЕЧАНИЕ: Термической обработки в течение 5–10 мин достаточно, чтобы вызвать расширение сосудов и улучшить видимость хвостовых жилок. Тем не менее, животных можно безопасно удерживать в терморегулируемой камере в течение всего периода процедуры (обычно 20-30 минут без признаков гипертермии). Согревающая камера может безопасно содержать 4–6 мышей или одну крысу. - Следите за животным на наличие любых признаков острого теплового стресса (например, быстрое дыхание, вялость, прыжковое поведение).
ВНИМАНИЕ: Животные, проявляющие признаки гипертермии, должны быть возвращены в свою клетку и контролироваться до тех пор, пока они не возобновят нормальную активность перед повторным использованием. Если это происходит из-за внутренней температуры, превышающей оптимальный диапазон, убедитесь, что нагревательное устройство выключено.
- Как только целевая температура будет достигнута (32–36 °C), осторожно перенесите животных из клетки в камеру нагрева.
- Этапы инъекции
- Поднимите животное за основание хвоста, и выньте его из согревающей камеры. Введите животное в отверстие конуса удерживающего устройства.
ВНИМАНИЕ: Никогда не поднимайте мышей с хвостового конца; это может привести к серьезным травмам. Альтернативные методы обработки следует использовать для тучных или беременных мышей28. - Когда животное хватается за дальний край конуса передними ногой, осторожно потяните хвост назад и пройдите хвостом через открытую щель. Закрепите задний конец животного у основания конуса одной задней ножкой, выступающей из конуса, чтобы боковая вена показывалась в положении 12 часов. Любая задняя нога может быть выпячена, так как есть две боковые вены, по одной с каждой стороны(рисунок 3B).
- Захватите хвост в середине до двух третей длины недоминирующей рукой между большим и указательным пальцами, оказывая небольшое напряжение на боковую вену, чтобы сохранить положение хвоста и расширение сосудов.
ПРИМЕЧАНИЕ: Улучшенная видимость расширенных вен путем термической обработки позволяет пользователю быстро определить место инъекции для достижения наилучших результатов(рисунок 4). - Протрите кожу места инъекции марлевой губкой или прокладкой, смоченной 70% спиртом. Чистите как можно мящнее и быстрее, чтобы избежать раздражения хвоста.
ПРИМЕЧАНИЕ: Эта процедура может быть опущена по усмотрению институционального IACUC. - Держите шприц доминирующей рукой и расположите иглу параллельно хвосту. Вставьте иглу в направлении кровотока, скосните вверх под углом 10–15°(рисунок 5A–B)и продляйтесь дальше в просвет вены, проникая на 2–4 мм(рисунок 5C–D). Медленно вводят раствор.
ПРИМЕЧАНИЕ: Если инъекция прошла успешно, не следует ощущать сопротивления на плунжере, и можно увидеть, как жидкость движется через вену. В случае сопротивления или белых волдырей над местом инъекции, удалите иглу и попробуйте повторную инъекцию в месте выше первоначального размещения иглы. Не пытайтесь вводить ниже начального места инъекции, так как жидкость будет высвобождаться через начальный участок. Если инъекция одной боковой вены не увенчалась успехом, переставьте животное в противоположную сторону и сделайте больше попыток на контралатеральной вене. Максимальное количество попыток будет зависеть от того, где начинается попытка инъекции вдоль вену и отека, который может возникнуть при пропущенных попытках. Ознакомьтесь с институциональными правилами IACUC для неправильных инъекций и связанных с ними травм. - Извлеките иглу и плотно надавите большим пальцем, чтобы предотвратить обратный поток введенного раствора и / или крови. Продолжайте наносить мягкое сжатие чистой марлей/салфеткой или салфеткой до тех пор, пока кровотечение не прекратится(рисунок 6).
- Верните животное в клетку и на мониторе не менее 5 минут. Убедитесь, что животное возобновляет нормальную деятельность без дальнейшего кровотечения.
- Поднимите животное за основание хвоста, и выньте его из согревающей камеры. Введите животное в отверстие конуса удерживающего устройства.
3. Мышиная модель грибковой инфекции кровотока и сепсиса
- Штаммы мыши
- Акклиматизируйте самок швейцарских вебстеров, переродив мышей в возрасте 6 недель в соответствии с институционально рекомендованными рекомендациями. В качестве альтернативы для этого протокола используются инбредные/генетически модифицированные штаммы (например, C57BL/6 background) с модифицированной инокулой (см. ПРИМЕЧАНИЕ).
ПРИМЕЧАНИЕ (см. Обсуждение для деталей): Хвостовые жилки мышей с темным мехом часто менее заметны, чем у мышей с более светлым мехом из-за глубоко пигментированного хвоста(рисунок 4). Существует различная восприимчивость к грибкового сепсису / летальности среди различных штаммов мышей. Использование штаммов мышей, отличных от Swiss Webster, может потребовать дополнительной оптимизации протокола путем рассмотрения соответствующих факторов (например, генетического фона, возраста, пола, размера тела), которые могут влиять на иммунный статус хозяина. Например, смертельная проблема у мышей C57BL/6 обычно требует более высокой инокулы (до 10x) для достижения уровня смертности, наблюдаемого у швейцарских мышей Вебстера.
- Акклиматизируйте самок швейцарских вебстеров, переродив мышей в возрасте 6 недель в соответствии с институционально рекомендованными рекомендациями. В качестве альтернативы для этого протокола используются инбредные/генетически модифицированные штаммы (например, C57BL/6 background) с модифицированной инокулой (см. ПРИМЕЧАНИЕ).
- Микроорганизмов
- Для смертельного вызова (сепсиса) полоса замороженных запасов Candida albicans штамма DAY185 (или штаммов по выбору) на агару декстрозы Сабуро и инкубируют при 30 ° C в течение 2 дней.
- Переложить одну колонию в 10 мл дрожжевого экстракта - пептон-декстрозный бульон и культивировать в стационарную фазу роста в течение 18 ч при 30 °C с встряхиванием.
- Растворы инокулята
- В день смертельного испытания соберите бульонную культуру и промыть гранулу 3 раза центрифугированием (800 × г)в стерильном ПБС.
- Идентифицируйте жизнеспособные дрожжевые клетки путем исключения красителя трипан-синего цвета и перечисляйте с помощью гемоцитометра. Отрегулируйте концентрацию клеток до 1 x 106 клеток/мл в стерильном PBS при комнатной температуре.
ПРИМЕЧАНИЕ: Каждое животное получит 100 мкл раствора инокулята. Подготовьте избыточный объем инокулята (>500 мкл), чтобы обеспечить потенциальную потерю во время процедуры инъекции. Конечная инокулятум составляет 1 х 105 клеток на мышь. Объем инокулятума может быть увеличен до 200 мкл путем соответствующей регулировки концентрации клеток.
ВНИМАНИЕ: Раствор грибкового инокулята необходимо хранить при комнатной температуре перед инъекцией. Нагревать раствор инокулята до температуры тела может вызвать морфологическое изменение от дрожжевых клеток к гиф. Напротив, болюсное введение холодных растворов может быстро снизить температуру тела животного и его следует избегать.
- Внутривенная инокуляция
- Согрейте животных и индуцируете расширение сосудов, следуя процедурам, описанным в разделе 2.
- Ввести 100 мкл раствора инокулятума в хвостовую вену с помощью шприца 1 мл с иглой 27 г, 1/2 дюйма.
- Пост-инокуляционный мониторинг
- Следите за животными на наличие следующих признаков заболеваемости, вызванной сепсисом: i) меховой аспект (например, гладкий, взъерошенный), ii) активность (например, свободное движение, невосприимчивость), iii) осанка (например, сгорбленная, жесткая), iv) поведение (например, медленное, без перемещения), v) движения грудной клетки (например, нормальное дыхание, одышка), vi) веки (например, открытые, закрытые)43.
- Оценка сепсиса
- Оценка наблюдаемой заболеваемости в соответствии с модифицированным показателем клинической оценки сепсиса мышей (M-CASS) по четырехпублочной шкале от 0 до 3 в каждой категории: 0, нормально; 1, мягкий; 2, умеренный; 3, тяжелая43.
- Факультативный протокол: Вакцинация против грибкового сепсиса
- За четырнадцать дней до смертельного вызова прививайте мышей штаммом Candida dubliniensis Wü284 или ослабленными штаммами C. albicans, такими как мутант Δefg1/ Δcph1 (1x105 клеток на мышь), как описано в разделах 3,2–3,4 вместо C. albicans DAY185.
- Проведите летальный вызов у вакцинированных мышей, как описано в разделах 3.2–3.4, и следите за признаками заболеваемости, вызванной сепсисом, описанными в разделах 3.5–3.6.
Результаты
Температура внутри нагревательной камеры непрерывно определяется внутренним датчиком и автоматически регулируется термостатом. Во-первых, контрольный диск термостата был расположен при 78, 85, 90 или 95 ° F (26, 29, 32 или 95 ° C) для выбора заданных температур. После того, как нагреватель был активирован(рисунок 7,желтые точки), тепло, испускаемое лампочкой, быстро повышало внутреннюю температуру в течение первых 5–15 мин, в зависимости от заданной температуры. Нагреватель инактивировал лампочку, если обнаруженная внутренняя температура превышала установленную температуру (серые точки). Начальные пиковые температуры должны подняться на 5-7 °C выше заданных температур во всех группах, чтобы компенсировать потерю температуры во время переноса животных. Впоследствии устройство продолжает автоматически повторять тепловой цикл и поддерживает нагревательную камеру при заданной температуре.
Пример экспериментальных данных, полученных путем успешных инъекций хвостовой вены с использованием текущего протокола, показан на рисунке 8. В мышиной модели кандидоза кровотока, приводящего к сепсису, внутривенный вызов Candida albicans (1 х 105 клеток на мышь) у швейцарских мышей Вебстера вызвал быстрое начало сепсиса и распространение организмов, что привело к высокой смертности в течение 3-4 дней (открытыеточки) (рисунок 8A). Напротив, животные могут быть защищены от сепсиса путем предварительной иммунизации / вакцинации авирулентным штаммом дрожжей, Candida dubliniensis,достигая >95% выживаемости после смертельного в/в испытания с вирулентными C. albicans (твердые точки). Эти результаты по прогрессивной смертности и вакцинопосредопосредоцированной защите были получены воспроизводимо в четырех независимых экспериментах(дополнительный рисунок 1). Аналогичная защита может быть достигнута с использованием других штаммов авирулентных дрожжей, таких как ослабленные мутанты C. albicans (Δefg1/ Δcph1) (данные не показаны). Сепсис также можно контролировать и коррелировать со смертностью; у невакцинированных животных со смертельной инфекцией наблюдалось значительное увеличение заболеваемости, вызванной сепсисом, тогда как у вакцинированной группы наблюдались минимальные симптомы после летального вызова(рисунок 8B).

Рисунок 1: Описание согревающего и удерживающего устройства грызунов. (A) показывает внешний вид нагревательного устройства, которое состоит из:
- Крышка термостата – поднимите вверх ручкой, чтобы обнажить термостат
- Электрический корпус – герметичный для защиты
- Крышка камеры – подъем вверх во время транспортировки животных в/из
- Утеплительная камера – съемная, перед использованием накрываем пол постельным бельем
- Удерживающее устройство – укладывается вместе с нагревательным устройством, пока не используется
- Выключатель питания – встроенный кулисный переключатель для функций основного включения/выключения
- Шнур питания – напряжение/ток: 120 В/10 А
(B) показывает внутреннюю часть нагревательного устройства:
- Лампа накаливания – светоотдача 100 Вт
- Защитный экран лампочки – съемный для замены лампы
- Датчик температуры – расположен внутри камеры
- Внутренний термометр температуры – поместите внутрь камеры для контроля температуры
(C) показывает компоненты термостата нагревательного устройства:
- Внутренний термометр температуры
- Термостат – автоматически регулирует нагреватель
- Рычаг управления заданным значением – минимум/максимум: 78 °F/108 °F (25 °C/42 °C)
- Индикатор питания термостата – зеленый индикатор указывает на нормальную работу
- Индикатор нагревателя термостата – горит красным во время цикла нагрева
D) показывает компоненты удерживающего устройства:
- Конус – податливый алюминиевый лист, предназначенный для сдерживания грызунов
- Хвостовой канал – имеет форму, позволяющую плавно расположить хвост
- Конусная подъемная платформа – обеспечивает прочный подъем основания конуса
- Ручка регулировки высоты – предназначена для ручной регулировки высоты
- Ножничный домкрат – диапазон высот от 45 до 140 мм (1,77-5,52")
- Опорная пластина - установлена с резиновыми ножками для обеспечения стабильности Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Устройство для подогрева и сдерживания грызунов. (A)Перед использованием две части устройства размещаются бок о бок на чистой столешницы. (B) Как только нагревательное устройство включено, термостат активирует нагреватель. Лампочка остается горяной и излучает тепло до тех пор, пока нагревательная камера не достигнет заданной температуры. Нагревательное устройство автоматически повторяет тепловой цикл для поддержания внутренней температуры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Мыши (C57BL/6), помещенные в нагревательное и удерживающее устройство. (A) Мыши, получающие термическую обработку для вазодилатации. Животных (4-6 мышей на обработку) переносят из клетки в согревательную камеру устройства и подвергают термической обработке в течение как минимум 5-10 мин.(B)Мышь, удерживаемая для инъекции хвостовой венки. Мышь переносится из нагревательной камеры в конусное отверстие удерживающего устройства, а ее хвост проходит через открытую щель. Мышь осторожно тянут назад к дальнему краю конуса до тех пор, пока основание хвоста не достигнет кончика конуса. Когда животное притягивается к основанию конуса с мягким боковым вращением, одна задняя нога позиционируется вверх так, чтобы она выступала из открытой щели, позволяя боковой хвостовой вене быть расположенной в положении «12 часов». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Идентификация боковых хвостовых жилок у мышей. (A) Хвост необработанная швейцарская мышь Вебстера. Мышь помещают в удерживающее устройство без предварительной термической обработки для вазодилатации. Боковая хвостовая вена может быть идентифицирована как тонкий темный сосуд, который протекает под кожей. (B) Хвост швейцарской мыши Webster, обработанной согревающим устройством в течение 10 минут. Термически обработанная мышь удерживается для инъекции хвостовой венки. Боковая хвостовая вена легко видна через кожу из-за увеличенного диаметра сосуда, вызванного вазодилатации. (C)Хвост мыши C57BL/6, обработанный нагревательным устройством в течение 10 мин и удерживаемый для инъекции хвостовой венки. Вазодилатация улучшает видимость хвостовой вены через глубоко пигментированную кожу, хотя вена не так хорошо видна, как у светлых мышей Swiss Webster из-за слабого цветового контраста против вен. Красными стрелками обозначают расположение боковой хвостовой венки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Инъекция хвостовой вены, выполненная у термически обработанных мышей (Swiss Webster). (А–Б) Введение иглы в боковую хвостовую вену в месте инъекции. Игла (27 G, 1/2-in) расположена параллельно хвостовой вене со скосом вверх и направлена в сторону кровотока и вставлена. (С–Д) Размещение иглы в хвостовой вене и инъекция. Кончик иглы далее продвигается на 2–4 мм в просвет вены. Большой палец позиционируется на поршени шприца, а нужный объем обходится без медленного и устойчивого давления. Овальные круги указывают на места инъекций. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
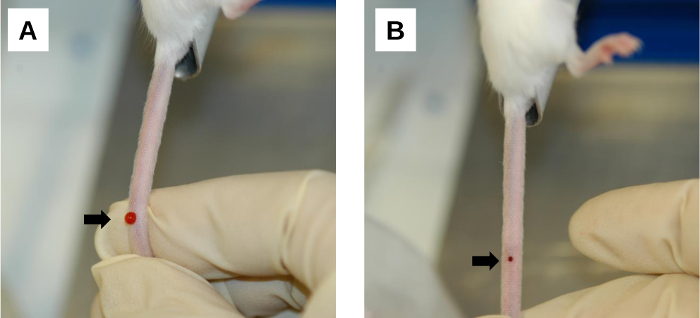
Рисунок 6: Процедура после инъекции. (А)Область кровотечения в месте инъекции. Кровотечение и обратный поток вводимого раствора возникают сразу после удаления иглы. Это можно свести к минимуму, применяя твердую компрессию на место инъекции большим пальцем. (B) Образование сгустка крови в месте инъекции. Мягкое сжатие чистой марлей/салфеткой облегчает свертывание крови на инъекционной ране. Стрелки обозначают места инъекций. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
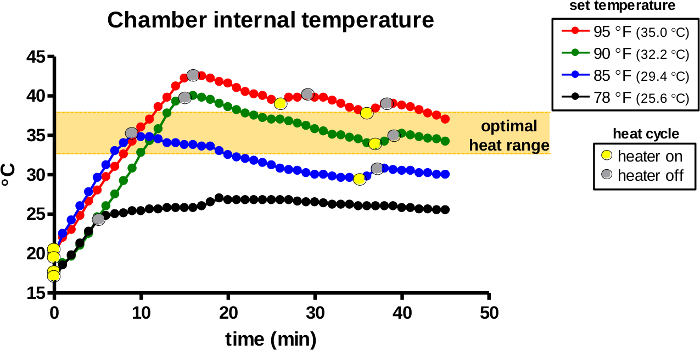
Рисунок 7: Внутренняя температура нагревательной камеры во время использования. Согревающее устройство было активировано для согревания при заданных заданных температурах. Нагревательная камера устройства контролировалась на внутреннюю температуру воздуха, а тепловые циклы (лампочка включена / желтые точки, выключены / серые точки) были зарегистрированы в течение 45 минут. Оранжевая область указывает на оптимальный температурный диапазон для индукции вазодилатации у грызунов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
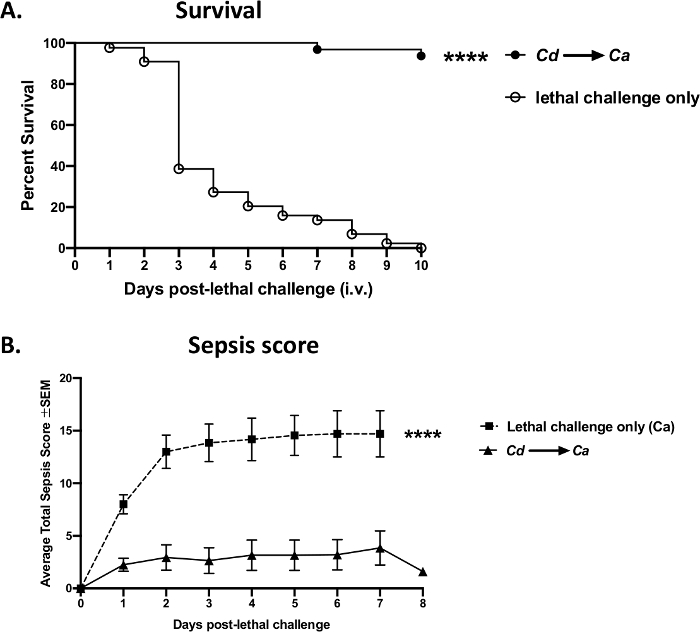
Рисунок 8: Смертность от сепсиса по сравнению с вакцинопосредоточной защитой после смертельного вызова с Candida albicans. Мышей (8-недельные самки швейцарского Вебстера) вакцинировали внутривенно авирулентной живой Candida dubliniensis Wü284(Cd),после чего через 14 дней проводился смертельный внутривенный вызов с диким типом C. albicans DAY 185 (1 x 105 клеток на мышь). (A) Смертность оценивалась в течение 10 дней после смертельного вызова. (B)Животные контролировались на заболеваемость сепсисом и оценивались в соответствии с модифицированным показателем клинической оценки сепсиса мыши (M-CASS)43. Данные суммируются из 4 независимых экспериментов с 10 мышами в группе и анализируются с использованием теста Mantel-Cox log-rank. p < 0,0001. SEM, стандартная погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Воспроизводимость смертности от сепсиса и выживаемость, опосредованная вакциной, из кровотока Candida albicans. Каждая панель представляет данные четырех независимых экспериментов, включенных в кумулятивный результат, показанный на рисунке 8A. Каждый эксперимент проводился с использованием 10 мышей на группу и анализировался с использованием теста Mantel-Cox log-rank. Ca, Candida albicans. Cd, Candida dubliniensis. p < 0,0001. p < 0,01. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Обсуждение
Последовательное и точное дозирование является ключевыми требованиями к экспериментальной надежности на животных моделях. Это особенно важно в случаях в/в введения, когда системная биодоступность вводимых агентов значительно выше/быстрее, чем при других путях введения3. Таким образом, ошибки в инъекции хвостовой вены могут оказать пагубное влияние на результаты исследования. Исторически сложилось так, что внутрибрюшинная (i.p.) инъекция, а не внутривенная, была наиболее распространенным методом системного доступа у грызунов из-за технической простоты и удобства. Тем не менее, пути введения становятся более важными при переводе доклинических считывания от животных в клинические условия. Следовательно, существует необходимость в постоянном улучшении протоколов грызунов, которые могли бы способствовать успешной инъекции хвостовой вене.
Ключевым достижением в настоящем протоколе является инновационное терморегулируемый согревающее устройство, которое позволяет эффективно индукции вазодилатации у грызунов, что значительно улучшает видимость хвостовых вен и выравнивание игл. Методы нагрева, которые плохо терморегулированы (например, лампы), местные сосудорасширяющие средства или раздражители кожи (например, ксилолы) не только ненадежны, но и небезопасны для животного и их следует избегать44. В отличие от других традиционных методов, таких как погружение хвоста в теплую воду, способность авторегуляции этого устройства может безопасно кондиционировать несколько животных одновременно. Кроме того, этот протокол дополнительно усиливается за счет использования оптимально спроектированного удерживающего устройства и позволяет быстро и безопасно иммобилизировать животное в положении, которое наилучшим образом отображает боковую хвостовую вену.
Прозрачные трубные форматы, наблюдаемые во многих современных ограничителях, хотя и практически хорошо спроектированы, требуют большего времени обработки с каждым животным, тем самым продлевая процесс сдерживания45. Это может быть более проблематичным у штаммов грызунов с агрессивными чертами, которые предлагают ограниченное сотрудничество46,47. Напротив, полузакрытая конусная структура удерживающего устройства позволяет быстро позиционировать животное и помогает свести к минимуму продолжительность удерживания. В совокупности оптимизированный протокол с использованием инновационной, высоко оптимизированной системы нагревания /сдерживания ускоряет процедуру инъекции, позволяя быстро и эффективно дозировать большие группы животных. В нашей лаборатории мы обычно завершаем всю процедуру инъекции 30 мышей от термической обработки до мониторинга после инъекции в течение 1 ч с использованием этого протокола.
Несмотря на расширенные возможности, данное устройство имеет некоторые очевидные недостатки: первое – это стоимость устройства и плановая замена лампочки в нагревательной камере. Однако, в дополнение к эффективности и скорости инъекций, устройство долговечно для повторного использования и совместимо с большинством распространенных дезинфицирующих средств, что позволяет тщательно очищать устройство между использованием. Вместе это компенсирует первоначальныеинвестиции. Second, в ситуациях с ограниченным рабочим пространством, недостатком этого протокола может быть требование к выделенной площади стенда, достаточно большой, чтобы разместить два блока, бок о бок, при выполнении инъекции. Однако, поскольку устройство может широко использоваться в нескольких протоколах грызунов, включающих инъекции в/в, возможно, что устройство может служить основным инструментом, аналогичным другому коммунальному оборудованию вивария, такому как испарители изофлурана. Несмотря на это, эти два блока легко переносятся и могут быть упакованы и уложены, пока они не используются.
Модель летального вызова мышиного грибкового сепсиса, описанная в этом протоколе, близко имитирует инфекции кровотока C. albicans у людей и широко используется для изучения грибковой вирулентности, проверки эффективности противогрибковой терапии и характеристики иммунных реакций хозяина на инфекцию37,39,48. Для достижения воспроизводимой инфекции, в том же время, инокуляция с помощью инъекции хвостовой вене является наиболее важным шагом протокола для обеспечения точной доставки организмов в кровоток. На самом деле, животные очень по-разному реагируют на различные уровни вызовов Candida i.v.; введение слишком низких количеств инокулятума приведет к нежелательному спонтанному выздоровлению, в то время как животные, получающие слишком высокие дозы, будут преждевременно погибать. Конкретное окно размеров инокулятов для данного организма, чтобы вызвать постоянный уровень сепсиса / смертности, во многом зависит как от грибковых штаммов, так и от штаммов мышей.
Текущий протокол с использованием швейцарских мышей Вебстера при инокуляте 1 х 105 диких C. albicans воспроизводимо индуцировал начало заболеваемости сепсисом в течение 1 дня, за которым следовала прогрессирующая смертность, приводящая к 100% летальности через 5-7 дней. Напротив, инокулы выше 1 х 105 обычно приводят к ускоренной смерти (т. Е. 1-2 дня при 1 х 106,3-4 дня при 5 х 105),а те, которые ниже 1 х 105, являются сублетальными. В соответствии с многочисленными сообщениями в литературе, использованиенеальбиканских видов Candida вместо C. albicans приводит к значительному снижению летальности40,49. Кроме того, выбор штаммов мышей или даже происхождение колоний может оказать значительное влияние на исходы инфекции из-за различной восприимчивости между штаммами мышей, о чем сообщают другие39,40,41,50,51,52,53,54,55. Следовательно, при разработке экспериментов следует учитывать и то, и другое.
После смертельного вызова в/в грибковые клетки быстро распространяются по кровотоку и начинают вторгаться в несколько органов, среди которых наиболее пострадавшими являются почки41. Другими пораженными органами являются мозг, селезенка и костный мозг48,56. Несмотря на это, острый сепсис является конечной причиной смерти в ранних временных точках37. Как показано в репрезентативных результатах, тяжесть сепсиса может быть количественно оценена по шкале клинической оценки сепсиса мыши (M-CASS) на основе проявленных признаков состояния сепсиса у проблемных животных43,57. Среди нескольких суррогатных маркеров летального сепсиса гипотермия была предложена в качестве критического предиктора неминуемой смерти как при клиническом, так и при экспериментальном сепсисе43,58,59.
Хотя не было проведено никаких официальных исследований для прямого сравнения инбредных и беспородных мышей в этой модели, данные, полученные из текущего протокола с использованием беспородных швейцарских мышей Вебстера, исключительно воспроизводимы в различных параметрах сепсиса, несмотря на предполагаемую генетическую гетерогенность. Как правило, картина смертности, которая падает в течение 3-5 дней, является твердой моделью острого сепсиса, о чем свидетельствует быстрое повышение заболеваемости сепсисом и уровней воспалительных маркеров в течение нескольких часов после постлетального вызова50,51. Для более длительного времени выживания (7-10 дней) смертность, вероятно, является результатом микробной нагрузки, приводящей к смертельному повреждению тканей в органах-мишенях и центральной нервной системе. Выбор сепсиса или микробной нагрузки может быть применен по мере необходимости для оценки иммунных функций или реакций на противовоспалительные схемы или противогрибковую терапию / вакцины, как определено используемым инокулятом.
В дополнение к модели летального вызова i.v., внутрибрюшная инфекция C. albicans у мышей через I.p. challenge также может привести к диссеминированному кандидозу и последующему сепсису, хотя ко-инокуляция с бактериальным патогеном, Staphylococcus aureus, синергетически повышает смертность по сравнению с моноинфекцией C. albicans 51,60,61. В модели летального вызова i.p. требуется значительно более высокая микробная инокула (1,75 x10 7C. albicans/8 x 107S. aureus на мышь) требуется для того, чтобы вызвать полимикробный перитонит и распространение организмов из брюшной полости в кровоток. Аналогичным образом, желудочно-кишечная инфекция C. albicans у мышей, получавших иммуносупрессивные и/или повреждающие слизистую оболочку агенты, приводит к транслокации грибковых клеток в кровоток и приводит к грибковому сепсису62,63. Несмотря на отличительные пути инокуляции, механизм последующего грибкового сепсиса во многом аналогичен между тремя моделями заболевания, включающими неконтролируемый системный провоспалительный ответ на Candida, который приводит к органной недостаточности37,51,61. Аналогичным образом, у людей именно этот процесс реакции хозяина, а не просто кандидемия, вызывает высокую заболеваемость/смертность, связанную с гематогенно диссеминированным кандидозом, приобретенным в медицинских учреждениях64,65.
Используя текущую модель грибкового сепсиса, мы демонстрируем здесь, что защита от смертельной инфекции C. albicans может быть достигнута путем в/в предварительной иммунизации / вакцинации C. dubliniensis (avirulent) или ослабленными мутантами C. albicans, что сопровождается значительным снижением заболеваемости сепсисом. Защита опосредована врожденными клетками-супрессорами Gr-1+ миелоидными клетками, которые, по-видимому, индуцируются в костном мозге как форма тренированной врожденной врожденной непривязанности66,67. В настоящее время предпринимаются усилия по расширению понимания этой новой формы врожденной иммуноопосредоченной защиты от инфекций кровотока C. albicans.
В заключение, инновационное устройство для подогрева / сдерживания грызунов сыграло важную роль в повышении нашей способности эффективно и действенно выполнять инъекции крупномасштабных многогрупповых исследований на животных. Таким образом, мы придумали термин Mouse a Minute для устройства. Спецификации устройства доступны у соответствующего автора по запросу на приобретение аналогичного устройства. Методы, продемонстрированные здесь, могут служить полезным инструментом в моделях грызунов, использующих инъекции хвостовых вен в широком спектре областей исследований.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Фондом LSUHSC (PLF) и частично U54 GM104940 из Национального института общих медицинских наук Национальных институтов здравоохранения, который финансирует Центр клинических и трансляционных наук Луизианы.
Материалы
| Name | Company | Catalog Number | Comments |
| Candida albicans strain DAY185 | Carnegie Melon University | N/A | provided by the laboratory of Aaron Mitchell |
| Candida albicans strain efg1Δ/Δ cph1Δ/Δ | University of Tennessee Health Sciences Center | N/A | provided by the laboratory of Glen Palmer |
| Candida dubliniensis strain Wü284 | Trinity College, Dublin, Ireland | N/A | provided by the laboratory of Gary Moran |
| Mice | Charles River Laboratories | 551NCICr:SW | Female Swiss Webster; 6-8 weeks old |
| Mice | Charles River Laboratories | 556NCIC57BL/6 | Female C57BL/6; 6-8 weeks old |
| Needles, 27G, ½-in | Becton Dickinson | 305109 | can be substituted from other vendors |
| Phosphate buffered saline (PBS) | GE | SH30028.02 | can be substituted from other vendors |
| Rodent warming and restraining device (Mouse a Minute) | LSU Health | custom order | Mouse a Minute is available for custom ordering from LSU Health |
| Sabouraud dextrose agar (SDA) | Becton Dickinson | 211584 | can be substituted from other vendors |
| Syringes, 1 mL | Becton Dickinson | 309659 | can be substituted from other vendors |
| Trypan blue solution | Sigma | T8154 | |
| Yeast peptone dextrose (YPD) broth | Fisher Scientific | BP2469 | can be substituted from other vendors |
Ссылки
- Woodard, G. Methods of animal experimentation. Gay, W. J. 1, 343-359 (1965).
- Shimizu, S. The laboratory mouse The handbook of experimental animals. Hedrich, H. J. , Elsevier Academic Press. Ch. 32 527-541 (2004).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. Journal of the American Association for Laboratory Animal Science. 50 (5), 614-627 (2011).
- Donovan, J., Brown, P. Parenteral injections. Current Protocols in Immunology. 73 (1), Chapter 1, Unit 1 6(2006).
- Schoch, A., Thorey, I. S., Engert, J., Winter, G., Emrich, T. Comparison of the lateral tail vein and the retro-orbital venous sinus routes of antibody administration in pharmacokinetic studies. Lab Animal. 43 (3), 95-99 (2014).
- Jarneborn, A., et al. Tofacitinib treatment aggravates Staphylococcus aureus septic arthritis, but attenuates sepsis and enterotoxin induced shock in mice. Scientific Reports. 10 (1), 10891(2020).
- Bussey, K. A., et al. Endosomal Toll-like receptors 7 and 9 cooperate in detection of murine Gammaherpesvirus 68 infection. Journal of Virology. 93 (3), (2019).
- Pitts, M. G., D'Orazio, S. E. F. A Comparison of oral and intravenous mouse models of listeriosis. Pathogens. 7 (1), (2018).
- Jespersen, H., et al. Clinical responses to adoptive T-cell transfer can be modeled in an autologous immune-humanized mouse model. Nature Communications. 8 (1), 707(2017).
- Gomez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Srinageshwar, B., et al. Surface-modified G4 PAMAM dendrimers cross the blood-brain barrier following multiple tail-vein injections in C57BL/6J mice. ACS Chemical Neuroscience. 10 (9), 4145-4150 (2019).
- Channabasappa, S., et al. Efficacy of novel antistaphylococcal ectolysin P128 in a rat model of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Sadeghi, B., et al. Preclinical toxicity evaluation of clinical grade placenta-derived decidua stromal cells. Frontiers in Immunology. 10, 2685(2019).
- Boquet, M. P., Wonganan, P., Dekker, J. D., Croyle, M. A. Influence of method of systemic administration of adenovirus on virus-mediated toxicity: focus on mortality, virus distribution, and drug metabolism. Journal of Pharmacological and Toxicological Methods. 58 (3), 222-232 (2008).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39 (4), 264-270 (2011).
- Lasnon, C., Dugue, A. E., Briand, M., Dutoit, S., Aide, N. Quantifying and correcting for tail vein extravasation in small animal PET scans in cancer research: is there an impact on therapy assessment. EJNMMI Research. 5 (1), 61(2015).
- Groman, E. V., Reinhardt, C. P. Method to quantify tail vein injection technique in small animals. Contemporary Topics in Laboratory Animal Science. 43 (1), 35-38 (2004).
- Aller, M. A., et al. Neuro-immune-endocrine functional system and vascular pathology. Medical Hypotheses. 57 (5), 561-569 (2001).
- McEwen, B. S., et al. The role of adrenocorticoids as modulators of immune function in health and disease: neural, endocrine and immune interactions. Brain Research. Brain Research Reviews. 23 (1-2), 79-133 (1997).
- Callewaert, B. L., et al. Absence of arterial phenotype in mice with homozygous slc2A10 missense substitutions. Genesis. 46 (8), 385-389 (2008).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods in Enzymology. 479, 397-411 (2010).
- Carlson, R. P. J., Peer, B. In Vivo Models of Inflammation Progress in Inflammation Research. Morgan, D. W., Marshall, L. , Birkhäuser, Basel. 1-50 (1999).
- Flecknell, P. Laboratory Animals: An Introduction for New Experimenters. Tuffery, A. A. , John Wiley and Sons. 225-260 (1987).
- Kim, M. J., Ahituv, N. The hydrodynamic tail vein assay as a tool for the study of liver promoters and enhancers. Methods in Molecular Biology. 1015, 279-289 (2013).
- Bargellini, A., et al. Effects of chronic exposure to anaesthetic gases on some immune parameters. Science of The Total Environment. 270 (1-3), 149-156 (2001).
- Elena, G., et al. Inhalatory anesthetic (halothane) associated changes in the immune response in mice. International Journal of Immunopharmacology. 19 (11-12), 699-707 (1998).
- Buerge, T. The Laboratory Mouse The handbook of experimental animals. Hedrich, H. J., Bullock, G. , Elsevier Academic Press. Ch. 31 517-526 (2004).
- Cohen, J., Cristofaro, P., Carlet, J., Opal, S. New method of classifying infections in critically ill patients. Critical Care Medicine. 32 (7), 1510-1526 (2004).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Magill, S. S., et al. Multistate point-prevalence survey of health care-associated infections. The New England Journal of Medicine. 370 (13), 1198-1208 (2014).
- Dupont, H., et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Archives of Surgery. 137 (12), 1341-1346 (2002).
- Montravers, P., et al. Candida as a risk factor for mortality in peritonitis. Critical Care Medicine. 34 (3), 646-652 (2006).
- Calandra, T., Bille, J., Schneider, R., Mosimann, F., Francioli, P. Clinical significance of Candida isolated from peritoneum in surgical patients. Lancet. 2 (8677), 1437-1440 (1989).
- Kojic, E. M., Darouiche, R. O. Candida infections of medical devices. Clinical Microbiology Reviews. 17 (2), 255-267 (2004).
- Ramage, G., Martinez, J. P., Lopez-Ribot, J. L. Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Research. 6 (7), 979-986 (2006).
- Spellberg, B., Ibrahim, A. S., Edwards, J. E., Filler, S. G. Mice with disseminated candidiasis die of progressive sepsis. Journal of Infectious Diseases. 192 (2), 336-343 (2005).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L. Animal models for candidiasis. Current Protocols in Immunology. 105 (1), (2014).
- Lionakis, M. S., Lim, J. K., Lee, C. C., Murphy, P. M. Organ-specific innate immune responses in a mouse model of invasive candidiasis. Journal of Innate Immunity. 3 (2), 180-199 (2011).
- Segal, E., Frenkel, M. Experimental in vivo models of candidiasis. Journal of Fungi. 4 (1), (2018).
- MacCallum, D. M., Odds, F. C. Temporal events in the intravenous challenge model for experimental Candida albicans infections in female mice. Mycoses. 48 (3), 151-161 (2005).
- Gordon, C. J. The mouse thermoregulatory system: Its impact on translating biomedical data to humans. Physiology & Behavior. 179, 55-66 (2017).
- Mai, S. H. C., et al. Body temperature and mouse scoring systems as surrogate markers of death in cecal ligation and puncture sepsis. Intensive Care Medicine Experimental. 6, 20(2018).
- Catty, D., Lehmann, P. F. A simple low-cost restrainer for the intravenous injection of mice. Sabouraudia. 16 (2), 89-90 (1978).
- Donovan, J., Brown, P. Handling and restraint. Current Protocols in Immunology. 73 (1), Chapter 1 Unit 1 (2006).
- Dow, H. C., et al. Genetic dissection of intermale aggressive behavior in BALB/cJ and A/J mice. Genes Brain and Behavior. 10 (1), (2010).
- Pugh, P. L., Ahmed, S. F., Smith, M. I., Upton, N., Hunter, A. J. A behavioural characterisation of the FVB/N mouse strain. Behavioural Brain Research. 155 (2), 283-289 (2004).
- MacCallum, D. M., Odds, F. C. Need for early antifungal treatment confirmed in experimental disseminated Candida albicans infection. Antimicrobial Agents and Chemotherapy. 48 (12), 4911-4914 (2004).
- Fakhim, H., et al. Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine model. Mycoses. 61 (6), 377-382 (2018).
- Remick, D. G., Newcomb, D. E., Bolgos, G. L., Call, D. R. Comparison of the mortality and inflammatory response of two models of sepsis: lipopolysaccharide vs. cecal ligation and puncture. Shock. 13 (2), 110-116 (2000).
- Nash, E. E., Peters, B. M., Palmer, G. E., Fidel, P. L., Noverr, M. C. Morphogenesis is not required for Candida albicans-Staphylococcus aureus intra-abdominal infection-mediated dissemination and lethal sepsis. Infection and Immunity. 82 (8), 3426-3435 (2014).
- Rogers, T., Balish, E. Experimental Candida albicans infection in conventional mice and germfree rats. Infection and Immunity. 14 (1), 33-38 (1976).
- Marquis, G., Montplaisir, S., Pelletier, M., Auger, P., Lapp, W. S. Genetics of resistance to infection with Candida albicans in mice. The British Journal of Experimental Pathology. 69 (5), 651-660 (1988).
- Ashman, R. B., Fulurija, A., Papadimitriou, J. M. Strain-dependent differences in host response to Candida albicans infection in mice are related to organ susceptibility and infectious load. Infection and Immunity. 64 (5), 1866-1869 (1996).
- Ashman, R. B., Bolitho, E. M., Papadimitriou, J. M. Patterns of resistance to Candida albicans in inbred mouse strains. Immunology & Cell Biology. 71 (3), 221-225 (1993).
- Liu, Y., Mittal, R., Solis, N. V., Prasadarao, N. V., Filler, S. G. Mechanisms of Candida albicans trafficking to the brain. PLoS Pathogens. 7 (10), 1002305(2011).
- Huet, O., et al. Ensuring animal welfare while meeting scientific aims using a murine pneumonia model of septic shock. Shock. 39 (6), 488-494 (2013).
- Kushimoto, S., et al. The impact of body temperature abnormalities on the disease severity and outcome in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis. Critical Care. 17 (6), 271(2013).
- Wiewel, M. A., et al. Risk factors, host response and outcome of hypothermic sepsis. Critical Care. 20 (1), 328(2016).
- Peters, B. M., Noverr, M. C. Candida albicans-Staphylococcus aureus polymicrobial peritonitis modulates host innate immunity. Infection and Immunity. 81 (6), 2178-2189 (2013).
- Nash, E. E., Peters, B. M., Fidel, P. L., Noverr, M. C. Morphology-Independent Virulence of Candida Species during Polymicrobial Intra-abdominal Infections with Staphylococcus aureus. Infection and Immunity. 84 (1), 90-98 (2016).
- Hirayama, T., et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation. Scientific Reports. 10 (1), 3814(2020).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal damage and neutropenia are required for Candida albicans dissemination. PLoS Pathogens. 4 (2), 35(2008).
- Vergidis, P., et al. Intra-abdominal candidiasis: The importance of early source control and antifungal treatment. PLoS One. 11 (4), 0153247(2016).
- Parker, J. C., McCloskey, J. J., Knauer, K. A. Pathobiologic features of human candidiasis. A common deep mycosis of the brain, heart and kidney in the altered host. American Journal of Clinical Pathology. 65 (6), 991-1000 (1976).
- Esher, S. K., Fidel, P. L., Noverr, M. C. Candida/Staphylococcal Polymicrobial Intra-Abdominal Infection: Pathogenesis and Perspectives for a Novel Form of Trained Innate Immunity. Journal of Fungi. 5 (2), (2019).
- Lilly, E. A., Ikeh, M., Nash, E. E., Fidel, P. L., Noverr, M. C. Immune protection against lethal fungal-bacterial intra-abdominal infections. mBio. 9 (1), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены