Method Article
Mısır Planthopper Mikroenjeksiyonu, Peregrinus maidis, CRISPR / Cas9 Genom Düzenleme için Embriyolar
Bu Makalede
Özet
Burada, CRISPR / Cas9 tabanlı genom düzenlemesi yoluyla genomlarını değiştirmek veya germline dönüşümü yoluyla işaretli transpoze edilebilir elementlerin eklenmesi amacıyla hücre öncesi mısır planthopper embriyolarının toplanması ve mikroenjekte edilmesi için protokoller bulunmaktadır.
Özet
Mısır planthopper, Peregrinus maidis, bir mısır zararlısı ve birkaç mısır virüsünün bir vektörüdür. Daha önce yayınlanmış yöntemler, P. maidis'te RNA girişiminin (RNAi) çift sarmallı RNA'ların (dsRNA'lar) nimflere ve yetişkinlere mikroenjeksiyonu yoluyla tetiklenmesini tanımlamaktadır. RNAi'nin gücüne rağmen, bu teknikle üretilen fenotipler geçicidir ve uzun süreli Mendel kalıtımından yoksundur. Bu nedenle, P. maidis alet kutusunun, kararlı mutant suşların üretimini sağlayacak fonksiyonel genomik araçları içerecek şekilde genişletilmesi ve araştırmacıların bu ekonomik açıdan önemli haşere üzerinde yeni kontrol yöntemleri getirmeleri için kapıyı açması gerekmektedir. Bununla birlikte, RNAi için kullanılan dsRNA'ların aksine, CRISPR / Cas9 tabanlı genom düzenleme ve germline transformasyonunda kullanılan bileşenler hücre zarlarını kolayca geçmez. Sonuç olarak, plazmid DNA'ları, RNA'lar ve / veya proteinler, embriyo hücreselleşmeden önce embriyolara mikroenjekte edilmelidir, bu da enjeksiyonun zamanlamasını başarı için kritik bir faktör haline getirir. Bu amaçla, embriyoların P. maidis dişilerinden nispeten kısa aralıklarla toplanmasını sağlamak için agaroz bazlı bir yumurta bırakma yöntemi geliştirilmiştir. Burada, CRISPR bileşenlerine sahip hücre öncesi P. maidis embriyolarının (kılavuz RNA'larla kompleksleştirilmiş Cas9 nükleazı) toplanması ve mikroenjekte edilmesi için ayrıntılı protokoller sağlanmıştır ve beyaz bir P. maidis göz rengi geninin Cas9 bazlı gen nakavtının sonuçları sunulmaktadır. Her ne kadar bu protokoller P. maidis'te CRISPR / Cas9-genom düzenlemesini tanımlasa da, enjeksiyon çözeltisinin bileşimini değiştirerek germline dönüşümü yoluyla transgenik P. maidis üretmek için de kullanılabilirler.
Giriş
Mısır planthopper, Peregrinus maidis, mısırın ekonomik açıdan önemli bir zararlısıdır 1,2,3. Hem delici emici ağız kısımlarıyla beslenirken hem de üreme sırasında embriyolarını doğrudan bitki dokusuna bıraktıklarında bitkiye doğrudan fiziksel zarar verirler 2,4. Mahsullere doğrudan zarar veren çoklu yollara rağmen, bu böceklerin mahsul sağlığı üzerindeki en büyük etkisi, mısır mozaik virüsü (MMV) ve mısır şerit virüsü 5,6'nın vektörü olarak hareket ederek dolaylıdır. MMV, P. maidis vektörünün gövdesinde çoğalma yeteneğine sahiptir ve virüsün yaşamlarının tamamı boyunca bireysel böceklerde kalmasına izin verir, böylece virüsü yeni konakçı bitkilere yaymaya devam edebilirler 7,8. P. maidis'i ve dolayısıyla vektörleştirdiği virüsleri kontrol etmek için en yaygın yöntemler insektisitlerdir.
Ne yazık ki, bu ürünlerin yanlış yönetilmesi, hedef haşere içinde direnç gelişmesine ve çevrenin kirlenmesine neden olmuştur9. Bu nedenle, bu böcek/virüs-haşere kombinasyonundan kaynaklanan ürün kayıplarını azaltmak için yeni stratejilere ihtiyaç vardır. Önceki çalışmalar, RNA girişiminin (RNAi) P. maidis için etkili bir kontrol yöntemi olabileceğini, çünkü çift sarmallı RNA'yı (dsRNA) yutarken bile gen ekspresyonunda aşağı regülasyona duyarlı olduklarını göstermiştir10. Bununla birlikte, dsRNA'yı sahada yönetmenin en etkili yolu, böceklerin beslendiği bitkiler aracılığıyla olacaktır; Bu nedenle, mahsuller böceklerin zaten taşıdığı herhangi bir virüse karşı hala duyarlı olabilir. CRISPR / Cas9 genom düzenlemesinin ortaya çıkmasıyla, bir haşere popülasyonunun boyutunu azaltmak veya söz konusu popülasyonu vektörleştirdikleri virüslere dirençli bireylerle değiştirmek için kullanılabilecek Cas9 tabanlı gen sürücüsü11,12 de dahil olmak üzere yeni haşere kontrol stratejileri mümkündür.
Bununla birlikte, her türlü gen tahrik sisteminin geliştirilmesi ve konuşlandırılması, transgenik tekniklerin geliştirilmesini gerektirecektir. Bu tür yöntemler P. maidis'te RNAi deneylerini gerçekleştirmek için gerekli değildi, çünkü dsRNA'ların ve / veya siRNA'ların, RNAi'nin P. maidis10,13'teki etkinliği nedeniyle hücre zarlarını geçebildiği varsayılmaktadır. Bu, geleneksel transgenezde veya Cas9 tabanlı gen düzenlemede kullanılan DNA'lar ve / veya proteinler için geçerli değildir; bunlardan herhangi biri, bir gen sürücüsü taşıyan böceklerin yaratılmasının öncüsü olacaktır. Gen düzenlemeyi veya diğer germline transformasyon formlarını gerçekleştirmek için, bu DNA'lar ve proteinler, sinsityal blastoderm aşamasında, böcek embriyosunun hücreselleşmesinden önce ideal olarak embriyolara mikroenjekte edilir. Zamanlama kritiktir, çünkü sinsityal aşama gelişimin en erken kısmıdır14,15. P. maidis dişileri tercihen yumurtalarını bitki dokusuna bıraktıklarından, mikroenjeksiyonlar için yeterli miktarda hücre öncesi embriyonun çıkarılması emek yoğun ve zaman alıcı olabilir. Bu nedenle, hücreselleşmeden önce P. maidis embriyolarını hızlı bir şekilde toplamak ve mikroenjekte etmek için yeni teknikler geliştirilmiştir.
Protokol
1. P. maidis yetişkinlerinin koloni düzeyinde yetiştirilmesi
- Yetiştirme kafesi başına haftada en az dört saksı mısır ekin, saksı başına 3-4 tohum ekin. Böceksiz bir ortamda büyüyün.
- Bitkiler ~ 5 haftalık olduğunda, 30 cm x 30 cm x 60 cm'lik bir kafesin içine yerleştirin.
- Bir araştırma laboratuvarından veya vahşi doğadan yeterli miktarda P. maidis yetişkini (~ 500) elde edin ve 9-12 mısır bitkisi (3-4 saksı) içeren böceklere dayanıklı bir kafese yerleştirin.
- Koloniyi, böcek yetiştiren bir inkübatörde 25 ° C'de (± 1 ° C), en az% 70 nem ve 14: 10 ışık döngüsü ile tutun.
- Yaşa göre kalibre edilmiş bir koloni oluşturmak için, dört günlük yumurtlamadan sonra tüm ilk yetişkinleri çıkarın ve kafese yerleştirilen embriyoların doğal olarak yumurtadan çıkmasına ve yaşlanmasına izin verin.
- 5 haftalık P. maidis böceklerini (yetişkinler) bir aspiratör ile toplayarak haftalık alt kültür için taze mısır bitkilerine taşıyın (Şekil 1). Ardından, yetişkinleri taze mısır bitkileri ile temiz bir kafese bırakın. Deneysel amaçlar için sürekli bir genç yetişkin kaynağı sağlamak için, her hafta taze yaş kalibre edilmiş kafesler hazırlayın.
- Saksıları kafeslerde günde iki kez sulayın. Sapları periyodik olarak kırpın, çürüyen bitki materyalini çıkarın ve gerektiğinde taze mısır saksılarıyla değiştirin.
NOT: Uygun bakımla, bir koloni ~ 5 hafta sürebilir (yani, kafese yerleştirilen embriyoların yetişkin olması için yeterince uzun).
2. Agaroz bazlı yumurtlama odası
- Temiz 100 mm x 15 mm Petri kaplarına suya %1 w/v agaroz dökerek yumurta toplama tabakları (yumurtlama ortamı) yapın. Yumurtlama ortamını katılaştıktan sonra 4 ° C'de saklayın.
- Yetişkinleri beslemek için% 10 w / v sakkaroz çözeltisi hazırlayın. Sakkaroz çözeltisini -20 ° C'de bir aya kadar saklayın.
- 1 oz'luk bir bardağın dibinde bir delik açarak ( Malzeme Tablosuna bakınız) ve hava değişimi için deliğin üzerine bir ekran yapıştırarak yetişkinleri tutmak için bir oda yapın (Şekil 2).
- Plastik parafin balmumu filmini 5 cm x 5 cm kareler halinde kesin; Her fincan için 2 kare ayırın.
- Yaş ayarlı bir P. maidis kolonisinden ~ 15 1 haftalık yetişkin dişi toplayın. Kadınları seçmek için, karnın ventral tarafını inceleyin ve tipik olarak karnın geri kalanından daha koyu olan ovipozitörü arayın (Şekil 3). Birden fazla yumurtlama odası kuruyorsanız, yetişkinleri 15 mL'lik bir konik şişede bir saate kadar tutun. Böcekleri seks yapmadan önce buz üzerinde kısaca soğutun ve yetişkin kabına aktarın.
NOT: Bu inceleme mikroskop olmadan da yapılabilir. Beslenmek ve çiftleşmek için zamanı olan yetişkin dişiler de tipik olarak yetişkin erkeklerden daha büyük karınlara sahiptir ve daha uysaldır; Bu nedenle, bir kafes popülasyonundan daha kolay seçilebilirler. - Dişileri yetişkin bir kaba aktarın ve bardağı orijinal boyutunun 3-4 katı kadar eşit şekilde gererek 1 kat plastik parafin balmumu filmi ile kapatın (Şekil 4A, B).
- Plastik parafin balmumu film contasının üstüne 400 μL% 10 w / v sakkaroz çözeltisi uygulayın ve plastik parafin balmumu filmini tam olarak yukarıdaki gibi gererek ikinci bir plastik parafin balmumu filmi tabakası ekleyin (Şekil 4C, D).
NOT: Gerilmiş plastik parafin balmumu filminin sandviçinin, yetişkin beslenmesi için çok önemli olan sakkaroz çözeltisini basınçlandırır, ancak dişilerin ovipozitörlerini yumurtlama ortamına kadar delmelerini engellemez. - Yetişkin odasını, plastik parafin balmumu film tarafı doğrudan yumurtlama ortamı üzerinde olacak şekilde bir yumurta toplama kabına yerleştirin ve tüm yumurtlama odasını, hava değişimi için gerekli olduğundan, hava deliklerini örtmeden plastik sargı ile sarın (Şekil 5).
- Her yumurtlama odasını 25 ° C'de% 70 nem ve 14:10 ışık döngüsü ile inkübe edin.
- Plastik parafin balmumu filmi sandviçini ve% 10 w / v sakkaroz çözeltisini günlük olarak değiştirin ve kabın içinde biriken suyu çıkarın.
3. Yüksek nemli bir ortamda embriyo toplanması ve hizalanması
- Stereomikroskop tabanlı bir mikroenjeksiyon sistemini nemlendirilmiş bir alanda veya başlıkta (nemlendirilmiş başlık; Şekil 6) Mikroenjeksiyon işlemi boyunca çalışma ortamının en az %70 nem elde etmesini sağlamak.
- İstenilen yumurtlama süresinden sonra yumurtalar için yumurtlama ortamını kontrol edin. Bunu nemlendirilmiş bir başlıkta veya başka bir nemli ortamda yapın.
NOT: Tipik olarak kullanılan yumurtlama süresi gece boyunca, akşam 6'dan sabah 10'a kadar, ~ 16 saat sürdü. - Agarozun içine herhangi bir yumurta serilirse, dikkatlice kazmak için ince forseps kullanın ve nemli tutmak için agarozun yüzeyine yerleştirin (Şekil 7A).
- 22 mm x 30 mm'lik bir kapak kayması üzerine 1 mm x 15 mm çift taraflı banttan oluşan bir şerit uygulayın (Şekil 7B). Kapak kayması bant tarafını yumurtlama ortamına yukarı doğru yerleştirin (Şekil 7C).
- Her bir yumurtayı agar yüzeyinden alın ve ince bir fırça kullanarak çift taraflı banda geçin. Tamamen beyaz olan veya üzerlerinde siyah renklenme olan yumurtaları çıkarın. Sağlıklı yumurtalar yarı şeffaf olacaktır.
- Muz şeklindeki yumurtaları, daha büyük ucu çift taraflı bant üzerine sıkışmış şekilde yanlarına yerleştirin (Şekil 7D).
NOT: Yumurtaları daima yüksek nemli bir ortamda saklayın, örneğin dibinde% 1'lik bir agar tabakası bulunan bir Petri kabı dökümü gibi.
4. CRISPR reaktiflerinin ve enjeksiyon iğnelerinin hazırlanması
- Alevleyici/Kahverengi tipi mikropipet çektirme makinesi kullanarak kuvars iğnelerini çekin.
- Kuvars iğnelerini bir mikropipet beveler kullanarak eğimlendirin.
- Çekilen iğneleri kullanıma hazır olana kadar Petri kabı gibi şeffaf bir kapta sabitlemek için çift taraflı yapışkan bant kullanın.
- 0.5 μL Cas9 proteini (5 μg / μL stok çözeltisi) ve 0.5 μL sgRNA (4 μg / μL stok çözeltisi; Malzeme Tablosuna bakınız) ile 1 μL fenol kırmızı tamponu 5 μL'lik son hacimde birleştirerek enjeksiyon çözeltisini hazırlayın. İğneyi tıkayabilecek parçacıkları çökeltmek için, çözeltiyi kısa bir süre vorteks edin ve maksimum hızda 3 dakika boyunca santrifüj yapın.
- Enjeksiyon iğnesini doldurun, enjeksiyon karışımını iğnenin konik ucuna yakın bırakmaya dikkat edin. Varsa iğnenin ucundan kabarcıkları çıkarın.
- Geri dolgulu iğneyi dikkatlice iğne tutucuya yerleştirin ve mikroenjeksiyon sırasında iğneyi güvenli bir şekilde yerinde tutmak için paslanmaz çelik yakayı sıkın.
- Enjeksiyon sistemi ile iğneye hava basıncı patlamaları verirken, eğimli ucu ince, nemlendirilmiş bir boya fırçasıyla hafifçe okşayarak iğneden güvenilir bir enjeksiyon çözeltisi akışı oluşturun.
NOT: Enjeksiyon karışımı ucu küçük miktarlarda bırakabildiğinde iğne enjeksiyon için hazırdır.
5. Mikroenjeksiyon ve enjeksiyon sonrası bakım
- Temiz bir 100 mm x 15 mm Petri kabını% 1 agar ile doldurarak bir mikroenjeksiyon platformu hazırlayın ve kabın üst kısmı ile aynı hizada düz bir agar tabakası oluşturun.
- Agar platformuna ~25 embriyo içeren önceden hazırlanmış bir kapak fişi yerleştirin (Şekil 8A).
NOT: Tüm enjeksiyon adımları nemlendirilmiş bir başlık içinde gerçekleştirilmelidir (~% 70 nem). - İğne ucunu bir damla suya yerleştirerek ve enjeksiyon döngüsünü başlatarak enjeksiyon basıncını kontrol edin.
NOT: Basınç ayarı doğruysa, az miktarda enjeksiyon çözeltisi suya dağılmalıdır (Şekil 8B). - İğneyi embriyonun daha büyük ucuna, kapak kaymasının sol tarafından yaklaşarak yerleştirin (Şekil 8C). Enjeksiyon solüsyonunu yumurtaya verin ve iğneyi hızla çekin.
- Tüm yumurtalar enjekte edildikten sonra, kapak kaymasını yeni% 1'lik bir agar kabının yüzeyine yerleştirin ve kabı bir nem odasına aktarın (Şekil 9).
6. Embriyoların kuluçkalanması ve kuluçkalanması
- Kuluçka odasını 6 gün boyunca 25 ° C'lik bir inkübatöre koyun.
- Hayatta kalan embriyoları, temiz su ve ince bir fırça kullanarak, kabın tabanını kaplayan suyla nemlendirilmiş filtre kağıdı ile 35 mm x 10 mm'lik bir Petri kabına aktarın. Petri kabını plastik parafin balmumu filmi ile kapatın ve embriyoların yumurtadan çıkmasına izin vermek için 25 ° C'de tutun. Hayatta kalmak için enjeksiyondan 6 gün sonra embriyoları kontrol etmeye başlayın.
NOT: İlk instar perileri 8. gün civarında yumurtadan çıkmaya başlayacaktır. - Perileri ince bir fırça kullanarak yaprak kırpıntıları içeren bir Petri kabına aktarın. Çanağı örtün ve plastik parafin balmumu filmi ile kapatın.
- Mühürlü yavru tabağını yaprak kesimleri üzerinde 25 ° C'de 48 saat boyunca inkübe edin.
- Tüm 2 günlük nimfleri bir enjeksiyon turundan ince bir fırça kullanarak mısır bitkileri içeren bir yetiştirme kafesine aktarın. Görünür fenotipe sahip enjekte edilenler yeterli sayıda geri kazanılırsa, bir sonraki nesilde hedef özelliğin geri kazanılmasını en üst düzeye çıkarmak için bunları ayrı ayrı destekleyin. Aksi takdirde, tüm enjekte edenlerin kütle çiftleşmesini gerçekleştirin.
NOT: Yavruları, sığınak sağlamak ve yakın çevrelerinin uygun nemini sağlamak için mısır bitkisinin fahişesine nazikçe yerleştirin. - Böcekleri yukarıda açıklanan koşullarda destekleyin, uygun sıcaklık, nem ve taze mısır bitkilerine düzenli transferler sağlayın.
- Beklenen fenotipler için tarama soyundan. İstenilen fenotipi sergileyen bireyleri homozigot çizgiler oluşturmak için kendi kafeslerine yerleştirin.
Sonuçlar
Yumurtlama odası, P. maidis dişilerinin, yumurtalarının kolayca geri kazanılabileceği koruyucu bir ortamda yumurtlarken beslenmelerini sağlamak için özel olarak tasarlanmıştır. Bu yöntem kullanılarak, DNA, RNA ve / veya proteinlerle mikroenjeksiyon için yeterli miktarda hücre öncesi embriyo geri kazanıldı. Yetişkin P. maidis dişileri genellikle mısır bitkilerinin yaprak dokusunun içine yumurta bırakır, bu da kısa sürede yeterli miktarda yumurta almayı zorlaştırır, çünkü çok fazla yaprak diseksiyonu gerektirir. Yapay yumurtlama ortamı bu sorunların üstesinden gelmek için bir çözüm sunar. Tablo 1'de gösterildiği gibi, 4 haftada toplam 645 dişiden 6.483 yumurta toplanmıştır. Dişiler genellikle 2. günden sonra yumurta bırakmaya başlar ve 4. günden 6. güne kadar çoğu yumurta sağlar. Yumurtlama aktivitesi 9. günde yavaşladı. Her yumurtlama odası Cuma günü kuruldu ve Pazar gününden bir sonraki Pazar gününe kadar yumurta olup olmadığı kontrol edildi. Bu programı takiben, çoğu yumurtanın çalışma haftası boyunca mikroenjeksiyonlar için toplanmasına izin verildi.
Bu yumurtlama sisteminin ilk pratik uygulaması, Cas9 aracılı gen nakavtının etkinliğini, göz rengi geninin P. maidis ortoloğunu, beyaz (Pmw) bir hedef olarak kullanarak test etmekti. Beyazdaki mutasyonların diğer böcek türlerinde önemli ölçüde göz pigmentasyonu kaybına neden olduğu bilinmektedir ve Beyaz hücre özerktir ve enjekte edilen bireylerde mutasyonların tespit edilmesine izin verir16,17. Küçük bir mutasyonun bile fonksiyon kaybına neden olma olasılığını artırmak için, kılavuz RNA'lar, Beyaz fonksiyon16 için gerekli olan ATP bağlama kaseti bölgesinde kesmek üzere tasarlanmıştır. P. maidis embriyolarına ya %20 fenol kırmızısı (enjeksiyon tamponu), 800 ng/μL (Cas9 kontrolü) nihai konsantrasyonda Cas9 enjeksiyon tamponu veya enjeksiyon tamponuna Cas9 enjekte edildi ve her biri 400 ng/μL konsantrasyonda eklenen üç kılavuz RNA ile birlikte enjekte edildi. Bir enjeksiyon karışımı içindeki üç kılavuzun kombinasyonu, hem büyük bir silme oluşturarak hem de herhangi bir kılavuzun kesim için etkisiz olabileceği olasılığını telafi ederek mutant üretme şansını en üst düzeye çıkarmayı amaçlıyordu. Her tedavi için gelişim oranları karşılaştırılabilir düzeydeydi (Tablo 2), enjekte edilen bireylerin% 50-60'ı gelişim belirtileri gösteriyordu. Tampon ve Cas9 kontrolleri için tarama hızları da karşılaştırılabilirdi; Bununla birlikte, üç kılavuzlu karışımı alan bireylerin tarama oranları nispeten daha düşüktü. Şu anda, azalan sağkalımın beyaz fonksiyon kaybının sonucu mu yoksa hedef dışı etkiler gibi üç kılavuzlu karışımın istenmeyen sonuçlarının sonucu mu olduğu belirsizdir (tartışma bölümüne bakınız). Bununla birlikte, göz pigmentasyonunun tamamen kaybı olan bireylerin hiçbiri (yani tam nakavt) yumurtadan çıkmadı ve enjekte edilen bireylerin soylarının hiçbirinin beyaz gözleri yoktu. Cas9 bazlı mutajenezin hedefteki etkinliği iki şekilde doğrulandı. İlk olarak, enjekte edilenler göz pigmentasyonu kaybı açısından tarandı.
Gelişen 71 kılavuz enjeksiyonlu bireyden 23'ü bir dereceye kadar pigment kaybı gösterdi (Şekil 10) ve bu bireylerin 9'u yumurtadan çıktı ve% ≥32'lik bir nakavt oranıyla sonuçlandı. Her iki kontrol tedavisinde de göz pigmenti kaybı gözlenmedi. İkincisi, kromozomal mutasyonlar polimeraz zincir reaksiyonu (PCR)18 ve dizileme19 ile doğrulandı. Mutant bir çizgi geri kazanılamadığından, genomik DNA, üç kılavuzlu karışım veya tampon ile enjekte edilen embriyo havuzlarından analiz edildi. Üç kılavuzlu karışımın beyaz lokustan ~ 180 baz çiftini çıkarması bekleniyor. Bu, enjekte edilen bireylerden izole edilen genomik DNA'dan çoğaltılan PCR ürünlerinde ve bu ürünlerden üretilen ilişkili sekans verilerinde görülebilir (Şekil 11). Bu kombine kanıt, embriyoların hücreselleşme gerçekleşmeden önce enjekte edildiğini göstermektedir.

Resim 1: Aspiratör. Etkili bir aspiratör, girişte bir vakum pompasının, plastik boru aracılığıyla, 15 mL'lik plastik bir konik tüpe bağlanmasından monte edilebilir. Konik tüpün dibinden yaklaşık 0,5 cm dikkatlice çıkarılmalıdır. P. maidis yetişkinlerini toplanırken yakalamak ve vakum pompasından uzak tutmak için konik tüpe plastik borunun açıklığı üzerine bir pamuk topu yerleştirilmelidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Yetişkin kapların yapımı. (A) Gerekli malzemeler (sol üstten saat yönünde): ekran, sıcak tutkal tabancası, tıraş bıçağı, 1 oz kap. (B) 1 oz kabın dibinde büyük bir delik açılmalı ve bu deliği kapatacak kadar büyük bir ekran karesi kesilmelidir. (C) Ekran daha sonra sıcak tutkal kullanılarak deliğin üzerine yapıştırılır. (D) Tutkal ayarlandıktan sonra, fazla ağ çıkarılmalıdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: P. maidis yetişkinlerinin cinsiyeti. Erkek (solda) ve dişi (sağda) P. maidis yetişkinlerinin ventral tarafları gösterilmiştir. Kadın karnının üzerinde görülebilen ovipozitör, bir bireyin cinsiyetinin en açık göstergesidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Yetişkinlerin kaplara kapatılması . (A) 5 cm x 5 cm kare plastik parafin balmumu filmi. (B) Film, orijinal boyutunun 3-4 katına kadar eşit şekilde gerilmelidir. (C) Yetişkinler yetişkin kabına konduktan sonra, gerilmiş film yetişkinleri sabitlemek için açıklığın üzerine yerleştirilmelidir. Daha sonra filmin üzerine %10'luk %10'luk bir 400 μL'lik bir damla yerleştirilmelidir. (D) Yetişkinler için yeterli beslenme basıncını sağlamak için, ikinci bir 5 cm x 5 cm kare plastik parafin film benzer şekilde gerilmeli ve sakkaroz damlasının üzerine yerleştirilmelidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
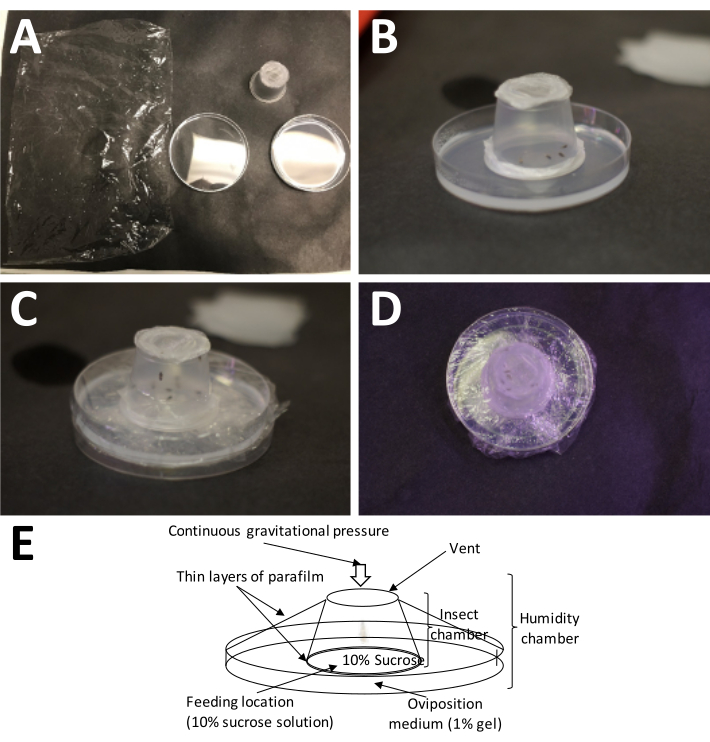
Şekil 5: Bir yumurtlama odası kurmak. (A) İhtiyaç duyulan malzemeler (sol üstten saat yönünde): plastik ambalaj, tamamlanmış bir yetişkin kabı (yetişkinlerle birlikte) ve% 1 agarozlu bir Petri kabı (yumurtlama ortamı). (B) Yetişkin kap, doğrudan yumurtlama ortamına yerleştirilen plastik parafin film/%10 sakkaroz 'sandviç' ile agarozun üzerine yerleştirilmelidir. (C) Yetişkin kabı yumurtlama ortamına sabitlemek için plastik ambalaj kullanılır. Bu, ortamın çok çabuk kurumasını önler. (D) Hava değişiminin devam edebilmesi için yetişkin kabın ekranının örtülmemesine özen gösterilmelidir. (E) Yumurtlama odasının diyagramı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Resim 6: Nemlendirilmiş başlık. Hava akımlarını en aza indirmek ve embriyolar işlenirken nemi korumak için enjeksiyon kapsamının etrafına nemlendirici ile donatılmış bir başlık yerleştirilmiştir. Kanatlar, uygun nem seviyelerinin korunmasına yardımcı olmak için işçi yerleştirildikten sonra girişin üzerine katlanabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
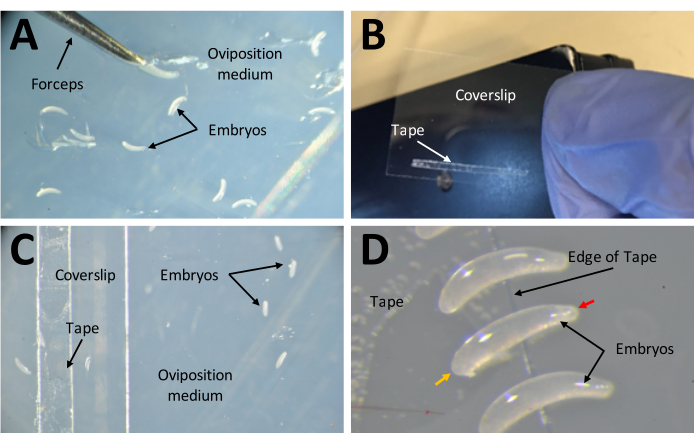
Şekil 7: Enjeksiyonlara hazırlık aşamasında embriyoların toplanması . (A) Yumurtlama ortamında biriktirilen embriyolar. Embriyoları ortamdan çıkarmak ve yüzeyine yerleştirmek için bir çift ince forseps kullanılır. (B) 22 mm x 30 mm'lik bir kapak kayması üzerinde 1 mm x 15 mm çift taraflı banttan oluşan dar bir şerit. (C) Embriyoların ortamın yüzeyinden kapak kayması üzerindeki banda aktarılmasını kolaylaştırmak için örtü kayması, yumurtlama ortamına yerleştirilebilir. (D) P. maidis embriyoları muz şeklindedir, bir ucu diğerinden daha dardır (dar uç kırmızı ok başı ile gösterilir; daha geniş uç örnek embriyoda sarı ok başı ile gösterilir). Embriyonun geniş ucu bant üzerine yerleştirilmelidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
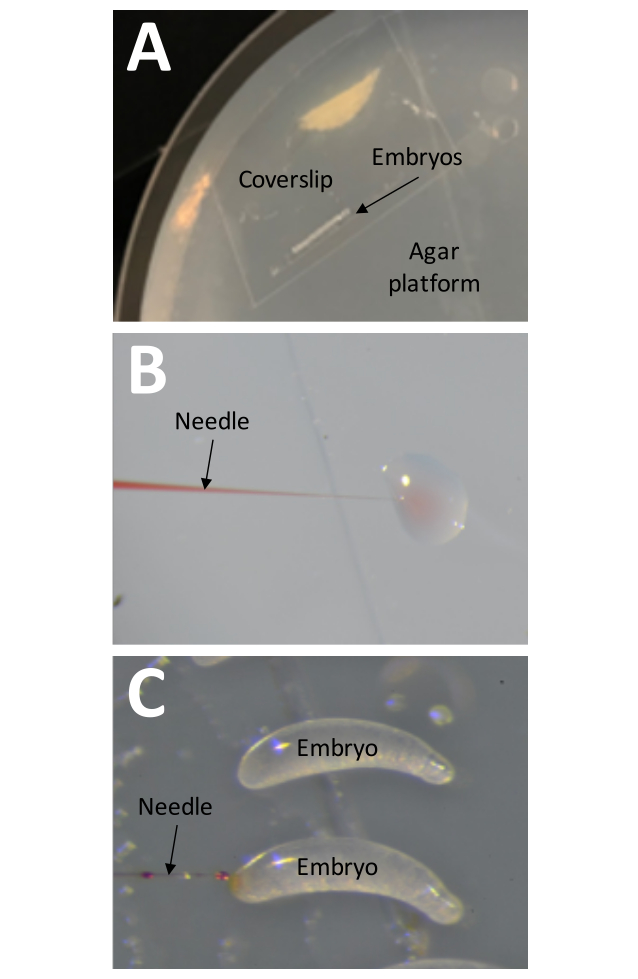
Şekil 8: Enjeksiyon . (A) Enjeksiyon platformu, ağzına kadar %1 agar ile doldurulmuş bir Petri kabıdır. Embriyoları tutan bir bant şeridi ile kapak kayması, doğrudan enjeksiyon platformunun yüzeyine yerleştirilmelidir. (B) Enjeksiyon basıncı, embriyolara bir damla suya az miktarda enjeksiyon çözeltisi 'enjekte edilerek' enjekte edilmeden önce test edilmelidir. Bu yöntem, iğneyi tıkanıklıklara karşı kontrol etmek için enjeksiyon işlemi sırasında herhangi bir zamanda da kullanılabilir. (C) İğne embriyonun daha büyük ucuna sokularak embriyolara enjekte edilmelidir. Enjeksiyon başarılı olduysa enjeksiyon çözeltisi görünür olmalıdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 9: Enjeksiyon sonrası bakım . (A) Bir kapak kapağındaki tüm embriyolar enjekte edildikten sonra, kapak kayması% 1 agaroz içeren taze bir Petri kabına yerleştirilmelidir. (B) Kapak kaymalı Petri kabı daha sonra embriyolar yumurtadan çıkana kadar bir nem odasında (gösterildiği gibi) tutulabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
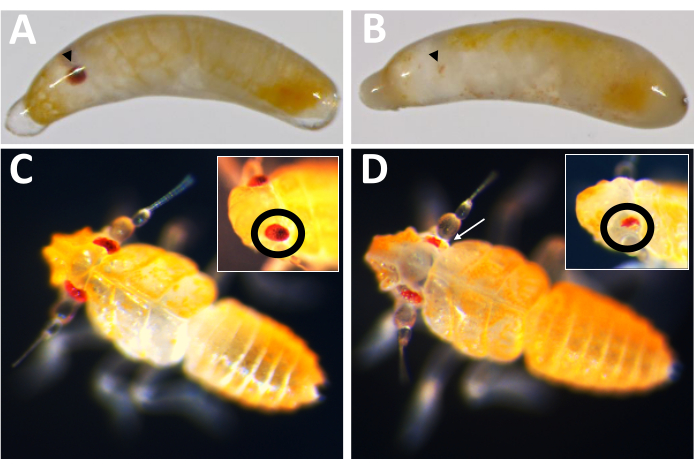
Şekil 10: Pmw nakavt fenotipi. (A) Yaşa uygun kontrol ve (B) Pmw nakavt embriyoları, gelişmekte olan gözler siyah ok uçlarıyla gösterilir. B'deki embriyo mozaiktir, çünkü küçük bir pigmentasyon şeridi görülebilir. (C) Yaşa uygun kontrol ve (D) Pmw nakavt yavruları, gözlerde farklı bir açı gösteren iç kısımlar. D'deki yavru da mozaiktir. Beyaz bir ok, ana resimde pigmentasyon kaybını gösteren bir alana işaret eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
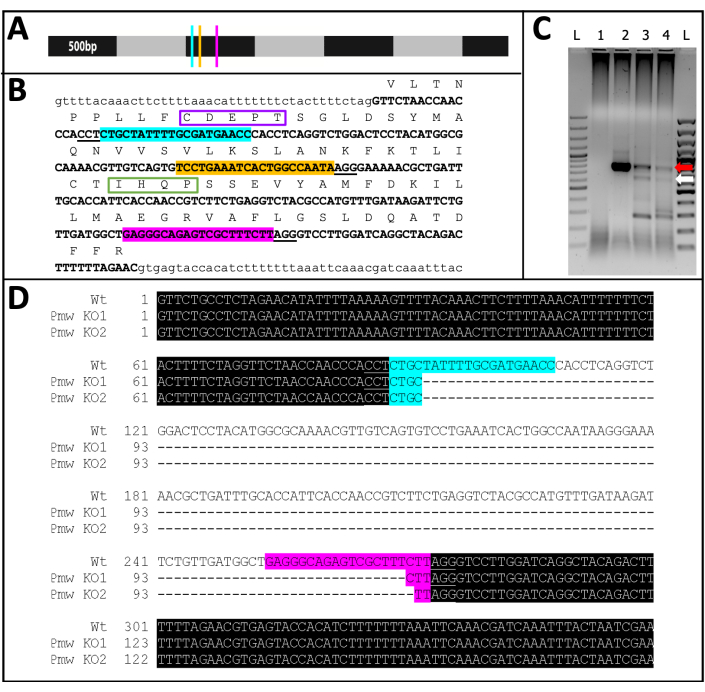
Şekil 11: Pmw nakavt sırası. (A) Pmw mRNA'nın 500-bp'lik artışlarla işaretlenmiş, gRNA bağlanma bölgelerinin yerleri belirtilmiş olarak ölçeklendirilecek modeli: G1, mavi; G2, sarı; G3, pembe. Bu noktada üretilen herhangi bir çerçeve kaydırma mutasyonu, çeviri ürününün çoğunu bozacaktır. (B) gRNA bölgelerinin genomik bağlamı, hepsi tek bir ekzonda (kalın büyük harfle yazılmış metin). Kılavuz bağlama siteleri A ile aynı renklerde vurgulanır ve PAM'lerin altı çizilir. Açıklık ~ 300 bp'dir. Ekzonun çerçeve içi çevirisi yukarıda büyük metinde tek harfli kısaltmalar olarak gösterilmiştir. Göz pigment taşıyıcılarına özgü iki motif işaretlenmiştir. Walker B fonksiyonel alanının CDEPT motifi mor renktedir ve H-loop alanının IHQP motifi yeşil renkte kutulanmıştır. Her iki etki alanı da ATP-taşıyıcı işlevi için kritik öneme sahiptir. (C) Pmw hedef bölgesi iki tur PCR kullanılarak güçlendirildi. İkinci yuvarlak ürün, kılavuzlar arasındaki bölgenin başarılı bir şekilde çıkarılması nedeniyle boyut kayması kanıtı için bir jel üzerinde incelendi. Şeritler: L = 100 bp merdiven; 1 = PCR su kontrolü; 2 = Tampon enjekte edilen yumurtalar; 3-4 = üç kılavuzlu karışımla enjekte edilen iki ayrı yumurta seti. Sadece üç kılavuzlu karışımı alan embriyolar hem WT bandını (kırmızı ok) hem de tam eksizyondan (beyaz ok) kaynaklanan bandı üretti. (D) Alt (beyaz ok) bandın kimliğini doğrulamak için, bu DNA saflaştırıldı, klonlandı ve sıralandı. En üst satır, vahşi tip dizidir. Diğer iki çizgi iki klondan gelen dizilerdir. Üç ek klon alt diziyle eşleşti. Mavi vurgu Kılavuz 1'in bağlama yerini, pembe vurgu ise Kılavuz 3'ün bağlama yerini gösterir. Her iki alelde de, bu iki kılavuz bölge arasındaki tüm bölge silinmiştir. Kısaltmalar: Pmw = Peregrinus maidis beyaz gen; gRNA = kılavuz RNA; PAM = protospacer bitişik motif; ATP = adenozin trifosfat; PCR = polimeraz zincir reaksiyonu; WT = vahşi tip; KO = nakavt. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Ayarlamak | # bardak sayısı | Her fincandaki kadın sayısı # | # yumurta | Toplam # yumurta | |||||||
| 2. Gün | 3. Gün | 4. Gün | 5. Gün | 6. Gün | 7. Gün | 8. Gün | 9. Gün | ||||
| 1 | 10 | 15 | 0 | 26 | 166 | 355 | 530 | 193 | 91 | 37 | 1398 |
| 2 | 15 | 15 | 22 | 238 | 489 | 699 | 520 | 379 | 203 | 58 | 2608 |
| 3 | 8 | 15 | 0 | 57 | 230 | 190 | 116 | 80 | 34 | 1 | 708 |
| 4 | 10 | 15 | 0 | 226 | 446 | 519 | 301 | 179 | 24 | 15 | 1710 |
| Toplam | 43 | 15 | 23 | 547 | 1331 | 1763 | 1467 | 831 | 352 | 111 | 6483 |
Tablo 1: Yapay yumurtlama ortamından temsili yumurta koleksiyonları. Dört set yumurta toplama kabından elde edilen veriler, kurulumdan sonraki ikinci günde başlayan ve dokuzuncu güne kadar devam eden yumurta boyları ile gösterilmiştir.
| Enjeksiyon Tedavisi | Toplam Enjekte Edilen | Toplam Geliştirilmiş | Toplam Yumurtadan Çıkmış | Gelişme Hızı (%) | Tarama Hızı (%) |
| Arabellek | 39 | 20 | 12 | 51 | 31 |
| Cas9 | 39 | 24 | 14 | 61 | 36 |
| Cas9 +Pmw gRNA'lar | 121 | 71 | 28 | 59 | 28 |
Tablo 2: 3 farklı enjeksiyon karışımının enjeksiyonlarından hayatta kalma ve nakavt oranları.
Tartışmalar
Yumurta bırakma kalitesi ve beslenmesi
Son zamanlarda, ilgili bir tür olan Nilaparvata lugens ile çalışan araştırmacılar, mikroenjeksiyonlar için kullandıkları yumurtaları doğrudan yapraktan elde ettiler ve enjekte edilen yumurtaları yumurtadan çıkana kadar yaprak dokusunda tuttular17. Bu yaprak bazlı yöntem, embriyonik gelişim için daha doğal bir ortam sağlarken, aynı zamanda çıkarma işlemi sırasında enfeksiyon ve yumurta hasarı olasılığını da arttırdı. Burada sunulan yapay yumurtlama sistemi daha düzgün bir ortam sağlar ve yumurtaların taşınmasından kaynaklanan hasar olasılığını azaltır. Cuma günü yumurtlama kaplarını kurarak, ovipozitlenmiş yumurtaların çoğu, mikroenjeksiyon işini yapanların yararına tipik bir çalışma haftası boyunca toplandı. Bununla birlikte, bu yönteme bir uyarı,% 10 sakkaroz çözeltisi diyetindeki besin eksikliğinin sonunda böceklerin sağlığını etkileyeceği ve bardaklardaki dişilerin genellikle sadece 10 gün sonra ölmeye başlamasıdır. Yumurta kalitesi, ölü veya sağlıksız görünümlü yumurtalardaki artışla kanıtlandığı gibi, 6 gün sonra düşmeye başlar. Sonuç olarak mikroenjeksiyon için kullanılan yumurtaların seçici olması ve dişilerin 6. günden sonra tutulmaması önemlidir.
Hayatta kalma oranı ve nem
Mikroenjeksiyon işlemi ile embriyonik sağkalım için iki faktör kritik görünmektedir. P. maidis embriyolarının işlenmesinin en zorlu yönü, yumurtlama ortamından çıkarıldıktan sonra ve mikroenjeksiyon boyunca kurumasını önlemektir. Yumurtalar tipik olarak bitki dokusunun içine serildiğinden, dehidrasyonu önlemek için yeterli bir kabuktan yoksundurlar. Nemlendirilmiş başlıkta bile bütün yumurta setleri kuruma nedeniyle kayboldu. Bununla birlikte, aşırı yüksek nem, çift taraflı bantta veya kapsamda su birikmesi durumunda mikroenjeksiyonları da etkileyebilir. Ne yazık ki, yumurta dehidrasyonunun mikroenjeksiyon işlemi sırasında fark edilmesi genellikle kolay değildi ve 2 veya 3 gün sonra, tamamen şeffaf hale geldiklerinde, hiçbir gelişme belirtisi göstermediklerinde sıklıkla normal görünüyorlardı.
İğne kalitesinin de hayatta kalmada önemli bir rol oynadığı görülmektedir. Yumurtaya gereksiz hasarı en aza indirmek için iğne eğimli olmalıdır. İğne bloke edildiğinde, iğnenin ucunu nemlendirilmiş bir boya fırçasıyla hafifçe okşarken enjektör üzerindeki temizleme işlevini kullanarak (bkz. adım 4.7) tipik olarak iğneyi işlevsel bir duruma döndürür. Ne olursa olsun, enjeksiyon işlemi boyunca iğne kalitesinin korunmasını sağlamak için her iğneye sadece az miktarda enjeksiyon çözeltisi (~ 0.25 μL) koymak ve her birkaç slaytta bir (~ 50-60 yumurta) yeni bir iğneye geçmek önerilir.
Nakavt fenotipinin başarılı bir şekilde üretilmesi
Germ hücrelerini başarılı bir şekilde dönüştürmek için, embriyo mikroenjeksiyonları genellikle hücreselleşmeden önce mümkün olduğunca erken yapılmalıdır. Böcek türlerine bağlı olarak, mikroenjeksiyonların tamamlanması için zaman aralığı sadece birkaç saatten tam bir gün 14,15,20'ye kadar değişmektedir. P. maidis embriyolarının ne zaman hücreselleşmeye uğradığı hala belirsizdir. Cas9 aracılı nakavt, yumurtlama sonrası 4 saat (pel) ila 16 saat pel kadar genç embriyolar üzerinde test edildi ve tüm deneylerde beklenen fenotipler gözlendi, bu da tüm mikroenjeksiyonların hücre öncesi pencere içinde gerçekleştirildiğini düşündürdü.
Göz rengi geninin P. maidis ortoloğu olan beyaz, seçildi, çünkü nakavt fenotipinin, hücre özerk doğası nedeniyle enjekte edenlerde taranmasının kolay olması bekleniyordu. Gerçekten de, beklendiği gibi, Cas9 ve kılavuz RNA'ları içeren enjeksiyon karışımını alan embriyolar arasında hem mozaik hem de toplam nakavtlar açıkça tanımlanabilirdi. Ne yazık ki, tam nakavtlı hiçbir enjekte yumurtadan çıkmadı ve hayatta kalan enjekte edenlerin kitlesel çiftleşmesi beyaz gözlü soy üretemedi. Bununla birlikte, mutant bir çizgi daha sonra farklı bir geni (Klobasa ve ark., devam ediyor) hedefleyerek başarılı bir şekilde üretildi. Bu, beyaz bir mutant çizginin oluşturulamamasının büyük olasılıkla ya hedef dışı etkilerden (yani, Cas9'un genomun başka bir yerindeki önemli bölgeleri kesmesi) yakından bağlantılı ölümcül bir mutasyon oluşturmasından ya da P. maidis'te beyaz için öngörülemeyen kritik bir rolden kaynaklandığını düşündürmektedir.
Fenotipik ve moleküler veriler (Şekil 8 ve Şekil 9), enjekte edilen embriyoların bir örneğinde beyaz lokusta önemli bir nakavt oluştuğunu ve bunun da gen fonksiyonunun toplam kaybına neden olacağını doğrulamaktadır. Dahası, beyazdaki mutasyonlar bazı türlerde uygulanabilir olsa da, azalmış beyaz aktivitenin zararlı olduğu için emsal vardır21,22. Bununla birlikte, hedef dışı etkiler tamamen göz ardı edilemez. Muhtemel hedef dışı hedefleri tahmin etmek, P. maidis'teki genomik kaynakların mevcut durumunun şu anda yapmayı imkansız kıldığı doğru genom dizisi verileri23 gerektirir. Ne olursa olsun, bu yeni yöntemlerle, diğer hedef genlerin test edilmesi güvenle yapılabilir, hatta bu zararlı zararlıya yeni genetik araçlar getirmek için daha geleneksel transgeneze doğru ilerleyebilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Kuzey Carolina Eyalet Üniversitesi, Entomoloji ve Bitki Patolojisi Bölümü, DARPA'nın Böcek Müttefikleri Programını destekleyen bir ekibin parçasıdır. İfade edilen görüşler, görüşler ve/veya bulgular yazarlara aittir ve Savunma Bakanlığı veya ABD Hükümeti'nin resmi görüşlerini veya politikalarını temsil ettiği şeklinde yorumlanmamalıdır. Yazarlar birbiriyle çelişen çıkarlar olmadığını beyan ederler. MDL, DR ve AEW projeyi tasarladı ve finansman edinimi, proje yönetimi ve kaynakları sağladı. FC, WK, NG ve MDL, mikroenjeksiyon deneylerini tasarladı ve tasarladı; OH, yumurtlama yöntemini tasarladı ve tasarladı. FC ve WK deneyleri gerçekleştirdi; FC ve WK sonuçları analiz etti; ve FC, WK, NG ve MDL makaleyi yazdı. Yazarlar, Kyle Sozanski ve Victoria Barnett'e P. maidis kolonilerinin korunmasındaki yardımları için özel teşekkürlerini sunmak isterler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 oz Containers | Dart | P100N | Adult container for egg-laying setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-103 | Serves as collection tube on vacuum aspirator setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-106 | For making 10% sucorose solution and for holding adults when chilling before screening |
| Aspirator | Bioquip | 1135A | For handling planthoppers |
| Vacuum Aspirator | Fischer Technical | LAV-3 | Vacuum for aspirating larger numbers of insects |
| Blue Spectrum LED Lights | Home Depot | GLP24FS/19W/LED | Grow lights for potted corn plants hoppers are feeding on |
| Cas9 | TrueCut Cas9 Protein v2 | A36498 | Endonuclease for cutting planthopper genes |
| Clear Vinyl Tubing | Home Depot | 3/8 in. I.D. x 1/2 in. O.D. x 10 ft. | Connects collection tube to pump on vacuum aspirator setup |
| Corn planthoppers | North Carolina State University | N/A | Request from Dr. Anna Whitfield's lab |
| Cotton balls | Genessee | 51-101 | Serves as a filter/insect catcher in collection tube on vacuum aspirator setup |
| Double sided tape | Scotch Double Sided Tape | NA | Holding eggs for microinjection |
| Early Sunglow corn | Park Seed Company | 05093-PK-N | Corn for rearing planthoppers |
| epTIPS Microloader Tips | Eppendorf | C2554691 | Backfilling needle loading tips |
| Femtojet Microinjection System | Eppendorf | 5247 | Controls injection pressure (12-20 psi, depending on needle bore size) |
| Nutri-Fly Drosophila Agar | Genessee | 66-103 | Substrate for everything except egg-laying dish |
| Fine forceps | Bioquip | 4731 | Egg handling |
| General Purpose LE Agarose | Apex | 20-102 | Substrate inn egg-laying dish (oviposition medium) |
| Guide RNA 1 - GGUUCAUCGCAAAAUAGCAG | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 2 - UCUGAAAUCACUGGCCAAUA | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 3 - GAGGGCAGAGUCGCUUUCUU | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Humidifyer | Homedics | UHE-CM45 | For providing humidity in humidified hood |
| Humidity chamber | Billups-Rothenberg | MIC-101 | For holding injected embryos until hatching |
| Insect rearing cages | Bioquip (special order) | Close to 1450 L (has plastic front and mesh fabric sides) | Cage for planthoppers on corn |
| Laser-based Micropipiette Puller | Sutter Instruments | P-2000/G | For making injection needles / Heat = 700, FIL = 4, VEL = 40, DEL = 170, PUL = 160 |
| Leica M165 FC Fluorescence Stereomicroscope | Leica | M165 FC | Planthopper screening |
| Microinjection Scope | Leica | MZ12-5 | Microinjection scope outfited with an XY stage |
| Micromanipulator | Narishige | MN-151 | For positioning microinjection needle |
| Micropipette beveler | Sutter Instruments | FG-BV10-D | For beveling injection needles / Used 'fine' graded plate at 20° angle |
| Microscope Stage | AmScope | GT100 X-Y Gliding Table | For positioning and moving embryos under microscope |
| Miniature Paint Brush | Testor #2 8733 | Sold in 3 pack 281206 | Fine paintbrushes for embryo handling |
| Needle Holder | Narishige | HI-7 | For holding the microinjection needle |
| Percival Incubator | Percival | I41VLH3C8 | Rearing injectees until hatch |
| Petri Dishes (100 x 15 mm) | VWR | 89038-968 | Making agar dish for egg-lay |
| pGEM-T Easy Vector System I cloning kit | Promega | A1360 | Cloning Pm white target site |
| Phenol Red | Sigma | 143-78-8 | Microinjection buffer |
| Plain Microscope Slides or coverslip | Fisher Scientific | 12-549-3 | Hold eggs for microinjection |
| Plasmid DNA Midi Kit | Zymo | D4200 | Purification of injection-ready plasmid DNAs |
| Plastic paraffin film | Pechiney Plastic Packaging | PM-996 | Roll size 4 in. x 125 ft |
| Plastic wrap | Glad ClingWrap Plastic Wrap | NA | Wrap the entire egg-laying chamber |
| Primer - PmW CRISPR check F1 - AAGGAATTTCTGGAGGTGAAA | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R1 - GATTCCTCGCTGTTGGGT | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check F3 - TCACAGACCCTGGTGCTAATC | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R3 - GTCCACAATCCACACTTCTGA | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Quartz capillaries | Sutter Instruments | QF100-50-10 | For making microinjection needles / O.D. 1 mm, I.D. 0.7 mm, 10 cm length |
| Screen (White Organza Fabric) | Joann Fabrics | 16023889 | For covering the adult container |
| Sparkleen | Fisher Scientific | 04-320-4 | Wash dishes |
| Sucrose | Fisher Scientific | BP220-1 | To make 10% sucorose solution |
Referanslar
- Namba, R., Higa, S. Y. Host plant studies of the corn planthopper, Peregrinus maidis (Ashmead) in Hawaii. Proceedings of the Hawaiian Entomological Society. 21, 105-108 (1971).
- Singh, B. U., Seetharama, N. Host plant interactions of the corn planthopper, Peregrinus maidis Ashm.(Homoptera: Delphacidae) in maize and sorghum agroecosystems. Arthropod-Plant Interactions. 2 (3), 163-196 (2008).
- Tsai, J. Occurrence of a corn disease in Florida transmitted by Peregrinus maidis. Plant Disease Reporter. 59 (10), 830-833 (1975).
- Chelliah, S., Basheer, M. Biological studies of Peregrinus maidis (Ashmead) (Araeopidae: Homoptera) on sorghum. Indian Journal of Entomology. 27, 466-471 (1965).
- Lastra, J., Esparza, J. Multiplication of vesicular stomatitis virus in the leafhopper Peregrinus maidis (Ashm.), a vector of a plant rhabdovirus. Journal of General Virology. 32 (1), 139-142 (1976).
- Nault, L. R., Ammar, E. -. D. Leafhopper and planthopper transmission of plant viruses. Annual Review of Entomology. 34 (1), 503-529 (1989).
- Ammar, E. -. D., Tsai, C. -. W., Whitfield, A. E., Redinbaugh, M. G., Hogenhout, S. A. Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annual Review of Entomology. 54, 447-468 (2009).
- Barandoc-Alviar, K., Ramirez, G. M., Rotenberg, D., Whitfield, A. E. Analysis of acquisition and titer of Maize mosaic rhabdovirus in its vector, Peregrinus maidis (Hemiptera: Delphacidae). Journal of Insect Science. 16 (1), 14 (2016).
- Tsai, J. H., Steinberg, B., Falk, B. W. Effectiveness and residual effects of seven insecticides on Dalbulus maidis (Homoptera: Cicadellidae) and Peregrinus maidis (Homoptera: Delphacidae). Journal of Entomological Science. 25 (1), 106-111 (1990).
- Yao, J., Rotenberg, D., Afsharifar, A., Barandoc-Alviar, K., Whitfield, A. E. Development of RNAi methods for Peregrinus maidis, the corn planthopper. PloS One. 8 (8), 70243 (2013).
- Esvelt, K. M., Smidler, A. L., Catteruccia, F., Church, G. M. Emerging technology: concerning RNA-guided gene drives for the alteration of wild populations. Elife. 3, 03401 (2014).
- Gantz, V. M., Bier, E. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348 (6233), 442-444 (2015).
- Yao, J., Rotenberg, D., Whitfield, A. E. Delivery of maize mosaic virus to planthopper vectors by microinjection increases infection efficiency and facilitates functional genomics experiments in the vector. Journal of Virological Methods. 270, 153-162 (2019).
- Kimelman, D., Martin, B. L. Anterior-posterior patterning in early development: three strategies. Wiley Interdisciplinary Reviews: Developmental Biology. 1 (2), 253-266 (2012).
- Mito, T., Nakamura, T., Noji, S. Evolution of insect development: to the hemimetabolous paradigm. Current Opinion in Genetics & Development. 20 (4), 355-361 (2010).
- Grubbs, N., Haas, S., Beeman, R. W., Lorenzen, M. D. The ABCs of eye color in Tribolium castaneum: orthologs of the Drosophila white, scarlet, and brown Genes. Genetics. 199 (3), 749-759 (2015).
- Xue, W. H., et al. CRISPR/Cas9-mediated knockout of two eye pigmentation genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae). Insect Biochemistry and Molecular Biology. 93, 19-26 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94 (3), 441-448 (1975).
- Chu, F. C., Wu, P. S., Pinzi, S., Grubbs, N., Lorenzen, M. D. Microinjection of Western Corn Rootworm, Diabrotica virgifera virgifera, embryos for germline transformation, or CRISPR/Cas9 genome editing. Journal of Visualized Experiments: JoVE. (134), e57497 (2018).
- Brent, C. S., Hull, J. J. RNA interference-mediated knockdown of eye coloration genes in the western tarnished plant bug (Lygus hesperus Knight). Archives of Insect Biochemistry and Physiology. 100 (2), 21527 (2019).
- Khan, S. A., Reichelt, M., Heckel, D. G. Functional analysis of the ABCs of eye color in Helicoverpa armigera with CRISPR/Cas9-induced mutations. Scientific Reports. 7 (1), 1-14 (2017).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır