Method Article
Microinjeção de cigarrinha de milho, Peregrinus maidis, Embriões para edição do genoma CRISPR/Cas9
Neste Artigo
Resumo
Trata-se de protocolos de coleta e microinjeção de embriões pré-celulares de cigarrinhas de milho com a finalidade de modificar seu genoma via edição genômica baseada em CRISPR/Cas9 ou para a adição de elementos transponíveis marcados por meio de transformação germinativa.
Resumo
A cigarrinha do milho, Peregrinus maidis, é praga do milho e vetor de vários vírus do milho. Métodos publicados anteriormente descrevem o desencadeamento de RNA de interferência (RNAi) em P. maidis através da microinjeção de RNAs de fita dupla (dsRNAs) em ninfas e adultos. Apesar do poder do RNAi, os fenótipos gerados por essa técnica são transitórios e carecem de herança mendeliana a longo prazo. Portanto, a caixa de ferramentas de P. maidis precisa ser expandida para incluir ferramentas genômicas funcionais que permitam a produção de linhagens mutantes estáveis, abrindo as portas para que os pesquisadores tragam novos métodos de controle para essa praga economicamente importante. No entanto, ao contrário dos dsRNAs usados para RNAi, os componentes usados na edição do genoma baseada em CRISPR/Cas9 e transformação germinativa não atravessam facilmente as membranas celulares. Como resultado, DNAs, RNAs e/ou proteínas plasmidiais devem ser microinjetados em embriões antes que o embrião se celularize, tornando o momento da injeção um fator crítico para o sucesso. Para esse fim, um método de oviposição à base de agarose foi desenvolvido para permitir a colheita de embriões de fêmeas de P. maidis em intervalos relativamente curtos. Neste trabalho são fornecidos protocolos detalhados para coleta e microinjeção de embriões pré-celulares de P. maidis com componentes CRISPR (nuclease Cas9 complexada com RNAs-guia), e resultados de knockout genético baseado em Cas9 de um gene cor de olho de P. maidis, branco, são apresentados. Embora esses protocolos descrevam a edição do genoma CRISPR/Cas9 em P. maidis, eles também podem ser usados para produzir P. maidis transgênico via transformação germinativa simplesmente alterando a composição da solução de injeção.
Introdução
A cigarrinha-do-milho, Peregrinus maidis, é uma praga economicamente importante do milho 1,2,3. Causam danos físicos diretos à planta, tanto durante a alimentação com suas partes bucais sugadoras de piercing, quanto durante a reprodução, quando depositam seus embriões diretamente no tecido vegetal 2,4. Apesar das múltiplas rotas de danos diretos às culturas, o maior impacto desses insetos na sanidade das culturas é indireto, atuando como vetor do vírus do mosaico do milho (MMV) e do vírus da listra do milho 5,6. A MMV é capaz de se replicar no organismo de seu vetor P. maidis, permitindo que o vírus persista em insetos individuais durante toda a sua vida, para que eles possam continuar a espalhar o vírus para novas plantas hospedeiras 7,8. Os métodos mais comuns para o controle da P. maidis e, portanto, dos vírus por ela vetores, são os inseticidas.
Infelizmente, o mau manejo desses produtos tem ocasionado o desenvolvimento de resistência na praga-alvo, bem como a poluição do meio ambiente9. Portanto, novas estratégias são necessárias para reduzir as perdas nas culturas por essa combinação inseto/vírus-praga. Trabalhos anteriores demonstraram que a interferência de RNA (RNAi) pode ser um método de controle eficaz para P. maidis, pois eles são suscetíveis a downregulation na expressão gênica mesmo quando ingerem RNA de fita dupla (dsRNA)10. No entanto, a maneira mais eficaz de administrar dsRNA no campo seria através das plantas das quais os insetos se alimentam; Assim, as lavouras ainda podem ser suscetíveis a quaisquer vírus que os insetos já estejam carregando. Com o advento da edição do genoma CRISPR/Cas9, novas estratégias de controle de pragas são possíveis, incluindo a unidade gênica baseada em Cas911,12, que poderia ser usada para reduzir o tamanho de uma população de pragas, ou para substituir essa população por indivíduos resistentes aos vírus que eles vetam.
No entanto, o desenvolvimento e a implantação de qualquer tipo de sistema de acionamento de genes exigirá o desenvolvimento de técnicas transgênicas. Tais métodos não foram necessários para a realização de experimentos de RNAi em P. maidis, pois presume-se que os dsRNAs e/ou siRNAs sejam capazes de atravessar as membranas celulares devido à eficiência do RNAi em P. maidis10,13. Isso não é verdade para os DNAs e/ou proteínas empregadas na transgênese tradicional ou na edição genética baseada em Cas9, qualquer uma das quais seria um precursor para a criação de insetos portadores de uma unidade gênica. Para realizar a edição de genes ou outras formas de transformação germinativa, esses DNAs e proteínas são idealmente microinjetados em embriões durante o estágio de blastoderma sincicial, antes de quando o embrião do inseto se celulariza. O tempo é crítico, pois o estágio sincicial é a parte mais precoce do desenvolvimento14,15. Como as fêmeas de P. maidis colocam preferencialmente seus ovos no tecido vegetal, a extração de quantidades suficientes de embriões pré-celulares para microinjeções pode ser trabalhosa e demorada. Assim, novas técnicas foram desenvolvidas para coletar e microinjetar rapidamente embriões de P. maidis antes da celularização.
Protocolo
1. Criação em nível de colônia de adultos de P. maidis
- Plantar um mínimo de quatro vasos de milho por semana por gaiola de criação, com 3-4 sementes por vaso. Cresça em um ambiente livre de insetos.
- Quando as plantas tiverem ~5 semanas de idade, coloque dentro de uma gaiola de 30 cm x 30 cm x 60 cm.
- Obter uma quantidade suficiente de adultos de P. maidis (~500) de um laboratório de pesquisa ou da natureza, e colocar em uma gaiola à prova de insetos com 9-12 plantas de milho (3-4 vasos).
- Manter a colônia em incubadora de insetos a 25 °C (± 1 °C), com umidade mínima de 70% e ciclo de luz de 14:10.
- Para gerar uma colônia calibrada pela idade, remova todos os adultos iniciais após quatro dias de postura de ovos e permita que os embriões colocados na gaiola eclodam e envelheçam naturalmente.
- Mover insetos P. maidis (adultos) com 5 semanas de idade para plantas frescas de milho para subcultivo semanal, coletando com um aspirador (Figura 1). Em seguida, solte os adultos em uma gaiola limpa com plantas de milho frescas. Para manter um suprimento constante de adultos jovens para fins experimentais, prepare gaiolas frescas calibradas para a idade todas as semanas.
- Regue as panelas nas gaiolas duas vezes ao dia. Periodicamente cortar talos, remover material vegetal em decomposição e substituir por vasos de milho frescos, conforme necessário.
NOTA: Com a manutenção adequada, uma colônia pode durar ~5 semanas (ou seja, tempo suficiente para que os embriões colocados na gaiola se tornem adultos).
2. Câmara de postura de ovos à base de agarose
- Faça pratos de coleta de ovos (meio de oviposição) despejando 1% p/v de agarose em água em placas de Petri limpas de 100 mm x 15 mm. Conservar o meio de oviposição a 4 °C após a sua solidificação.
- Preparar solução de sacarose a 10% p/v para alimentar os adultos. Conservar a solução de sacarose a -20 °C durante um mês.
- Faça uma câmara para segurar os adultos cortando um buraco no fundo de um copo de 1 oz (veja a Tabela de Materiais) e colando uma tela sobre o orifício para troca de ar (Figura 2).
- Corte o filme plástico de cera de parafina em quadrados de 5 cm x 5 cm; Separe 2 quadrados para cada xícara.
- Coletar ~15 fêmeas adultas de 1 semana de idade de uma colônia de P. maidis calibrada por idade. Para selecionar as fêmeas, examine o lado ventral do abdome e procure o ovipositor, que é tipicamente mais escuro que o resto do abdome (Figura 3). Segure os adultos por até uma hora em um frasco cônico de 15 mL se instalar várias câmaras de postura de ovos. Resfriar os insetos brevemente no gelo antes da sexagem e transferir para o recipiente adulto.
NOTA: Este exame pode ser feito sem um microscópio. As fêmeas adultas que tiveram tempo para se alimentar e acasalar também normalmente têm abdômen maior do que os machos adultos e são mais dóceis; portanto, eles podem ser mais facilmente selecionados de uma população de gaiolas. - Transfira as fêmeas para um recipiente adulto e sele o copo com 1 camada de filme plástico de cera de parafina, esticando uniformemente 3-4 vezes seu tamanho original (Figura 4A,B).
- Aplicar 400 μL de solução de sacarose a 10% p/v na parte superior do selo do filme plástico de parafina e adicionar uma segunda camada de filme plástico de cera de parafina, esticando o filme plástico de cera de parafina exatamente como acima (Figura 4C,D).
NOTA: O sanduíche de filme plástico esticado de cera de parafina pressuriza a solução de sacarose, o que é muito importante para a alimentação de adultos, mas não impede que as fêmeas perfurem seus ovipositores até o meio de oviposição. - Coloque a câmara de adultos em uma placa de coleta de ovos com o lado do filme plástico de parafina diretamente sobre o meio de oviposição e envolva toda a câmara de postura de ovos com filme plástico sem cobrir os orifícios de ar, pois estes são necessários para a troca de ar (Figura 5).
- Incubar cada câmara de oviposição a 25 °C com 70% de humidade e um ciclo de luz de 14:10.
- Troque diariamente o sanduíche de filme plástico de cera de parafina e solução de sacarose a 10% p/v e retire a água que se acumula dentro do copo.
3. Coleta e alinhamento de embriões em ambiente de alta umidade
- Montar um sistema de microinjeção baseado em estereomicroscópio em um espaço ou exaustor umidificado (exaustor umedecido; Gráfico 6) para garantir que o ambiente de trabalho atinja pelo menos 70% de umidade durante todo o processo de microinjeção.
- Verificar o meio de oviposição dos ovos após o período desejado de oviposição. Faça isso em uma coifa umidificada ou em outro ambiente úmido.
OBS: O período de oviposição normalmente utilizado foi durante a noite, das 18h às 10h, com duração de ~16 h. - Se algum ovo for colocado na agarose, use pinças finas para desenterrá-los cuidadosamente e coloque-os na superfície da agarose para mantê-los úmidos (Figura 7A).
- Aplique uma tira de fita dupla face de 1 mm x 15 mm sobre uma lamínula de 22 mm x 30 mm (Figura 7B). Coloque a fita de deslizamento sobre o meio de oviposição (Figura 7C).
- Pegue cada ovo individual da superfície do ágar e passe para a fita dupla face usando um pincel fino. Remova os ovos que são completamente brancos ou têm coloração preta sobre eles. Ovos saudáveis serão os semitransparentes.
- Coloque os ovos em forma de banana de lado, com a extremidade maior presa na fita dupla face (Figura 7D).
OBS: Mantenha sempre os ovos em um ambiente de alta umidade, como uma placa de Petri fundida com uma camada de 1% de ágar no fundo.
4. Preparação de reagentes CRISPR e agulhas de injeção
- Puxe agulhas de quartzo usando um puxador de micropipeta tipo Flaming/Brown.
- Bifure as agulhas de quartzo usando um bisel de micropipeta.
- Use fita adesiva dupla face para fixar agulhas puxadas em um recipiente transparente, como uma placa de Petri, até que estejam prontas para uso.
- Preparar a solução injetável combinando 0,5 μL de proteína Cas9 (5 μg/μL de solução-mãe) e 0,5 μL de sgRNA (solução-mãe de 4 μg/μL; ver Tabela de Materiais) com 1 μL de tampão vermelho de fenol num volume final de 5 μL. Para precipitar partículas que poderiam entupir a agulha, agite a solução brevemente e centrifugue por 3 min na velocidade máxima.
- Encha novamente a agulha de injeção, tomando o cuidado de deixar a mistura de injeção perto da extremidade cônica da agulha. Remova as bolhas, se houver, da ponta da agulha.
- Coloque cuidadosamente a agulha cheia de costas no suporte da agulha e aperte o colar de aço inoxidável para manter a agulha firmemente no lugar durante a microinjeção.
- Gere um fluxo confiável de solução de injeção a partir da agulha acariciando suavemente a ponta chanfrada com um pincel fino e umedecido, enquanto fornece explosões de pressão de ar à agulha com o sistema de injeção.
NOTA: A agulha está pronta para injeção quando a mistura de injeção pode deixar a ponta em pequenas quantidades.
5. Microinjeção e cuidados pós-injeção
- Prepare uma plataforma de microinjeção enchendo uma placa de Petri limpa de 100 mm x 15 mm com ágar a 1% para formar uma camada nivelada de ágar que é nivelada com a parte superior da placa.
- Coloque uma lamínula previamente preparada com ~25 embriões sobre a plataforma de ágar (Figura 8A).
NOTA: Todas as etapas de injeção devem ser realizadas dentro de uma coifa umidificada (~70% de umidade). - Verifique a pressão de injeção colocando a ponta da agulha em uma gota de água e iniciando o ciclo de injeção.
NOTA: Uma pequena quantidade de solução de injeção deve dispersar-se na água se a regulação da pressão estiver correcta (Figura 8B). - Inserir a agulha na extremidade maior do embrião, aproximando-se do lado esquerdo da lamínula (Figura 8C). Entregue a solução injetável no ovo e retire a agulha rapidamente.
- Depois que todos os ovos forem injetados, coloque a lamínula na superfície de uma nova placa de ágar a 1% e transfira a placa para uma câmara de umidade (Figura 9).
6. Incubação e eclosão de embriões
- Colocar a câmara de eclosão numa incubadora a 25 °C durante 6 dias.
- Transfira os embriões sobreviventes, usando água limpa e uma escova fina, para uma placa de Petri de 35 mm x 10 mm com papel de filtro umedecido em água cobrindo o fundo da placa. Selar a placa de Petri com película plástica de parafina e segurar a 25 °C para permitir que os embriões eclodam. Comece a verificar os embriões 6 dias após a injeção para sobreviver.
NOTA: As ninfas de primeiro ínstar começarão a eclodir por volta do dia 8. - Transfira as ninfas, usando um pincel fino, para uma placa de Petri contendo recortes foliares. Tampe o prato e sele com filme plástico de cera de parafina.
- Incubar o prato selado dos filhotes em estacas foliares durante 48 h a 25 °C.
- Transfira todas as ninfas de 2 dias de uma rodada de injeções para uma gaiola de criação com plantas de milho usando uma escova fina. Se os injetados com fenótipo visível forem recuperados em número suficiente, crie-os separadamente para maximizar a recuperação do traço alvo na próxima geração. Caso contrário, realize o acasalamento em massa de todos os injetados.
OBS: Coloque os filhotes suavemente na espiral da planta de milho para fornecer refúgio e garantir a umidade adequada de seu ambiente imediato. - Crie os insetos nas condições descritas acima, garantindo temperatura, umidade e transferências regulares para plantas de milho fresco.
- Triagem de progênie para fenótipos esperados. Colocar os indivíduos que exibem o fenótipo desejado em sua própria gaiola para estabelecer linhas homozigotas.
Resultados
A câmara de oviposição foi projetada especificamente para permitir que as fêmeas de P. maidis se alimentassem enquanto ovipositavam em um meio protetor do qual seus ovos pudessem ser facilmente recuperados. Usando este método, quantidades suficientes de embriões pré-celulares foram recuperadas para microinjeção com DNA, RNA e/ou proteínas. Fêmeas adultas de P. maidis geralmente colocam ovos dentro do tecido foliar das plantas de milho, o que torna a obtenção de ovos suficientes em um curto período de tempo um desafio, pois requer muita dissecção foliar. O ambiente artificial de oviposição fornece uma solução para superar esses problemas. Como mostrado na Tabela 1, 6.483 ovos foram coletados de um total de 645 fêmeas em 4 semanas. As fêmeas geralmente começam a colocar ovos após o dia 2 e fornecem a maioria dos ovos do dia 4 ao dia 6. A atividade de oviposição diminuiu no dia 9. Cada câmara de oviposição foi montada na sexta-feira e verificada a presença de ovos de domingo até o domingo seguinte. Seguir esse cronograma permitiu que a maioria dos ovos fosse coletada para microinjeções durante a semana de trabalho.
A primeira aplicação prática deste sistema de oviposição foi testar a eficácia do knockout gênico mediado por Cas9, utilizando como alvo o ortólogo de P. maidis do gene da cor dos olhos, branco (Pmw). Sabe-se que mutações na cor branca resultam em perda substancial da pigmentação ocular em outras espécies de insetos, e a branca é autônoma para células, permitindo que mutações sejam detectadas em indivíduos injetados16,17. Para aumentar a chance de que mesmo uma pequena mutação possa resultar em perda de função, os RNAs guia foram projetados para cortar dentro da região do de ligação ao ATP, o que é necessário para a função branca16. Embriões de P. maidis foram injetados com 20% de vermelho de fenol (tampão de injeção), tampão de injeção com Cas9 na concentração final de 800 ng/μL (controle Cas9) ou Cas9 em tampão de injeção juntamente com três RNAs guia adicionados a uma concentração de 400 ng/μL cada. A combinação de três guias dentro de uma mistura de injeção teve como objetivo maximizar ainda mais as chances de gerar mutantes, tanto criando uma grande deleção, quanto compensando a possibilidade de que qualquer guia possa ser ineficaz para o corte. As taxas de desenvolvimento para cada tratamento foram comparáveis (Tabela 2), com 50-60% dos indivíduos injetados apresentando sinais de desenvolvimento. As taxas de eclosão para os controles tampão e Cas9 também foram comparáveis; no entanto, as taxas de eclosão dos indivíduos que receberam a mistura de três guias foi relativamente menor. Neste momento, não está claro se a sobrevivência reduzida é o resultado da perda da função branca ou o resultado de consequências não intencionais da mistura de três guias, como efeitos fora do alvo (veja a seção de discussão). No entanto, nenhum dos indivíduos com perda completa da pigmentação ocular (isto é, knockout completo) eclodiu, e nenhum dos indivíduos da progênie dos indivíduos injetados tinha olhos brancos. A eficácia no alvo da mutagênese baseada em Cas9 foi verificada de duas maneiras. Primeiro, os injetados foram triados para perda de pigmentação ocular.
Dos 71 indivíduos injetados com guia que desenvolveram, 23 apresentaram algum grau de perda de pigmento (Figura 10), e 9 desses indivíduos eclodiram, resultando em uma taxa de knockout de ≥32%. Não foi observada perda de pigmento ocular em nenhum dos tratamentos controle. Em segundo lugar, mutações cromossômicas foram confirmadas por reação em cadeia da polimerase (PCR)18 e sequenciamento19. Como uma linhagem mutante não pôde ser recuperada, o DNA genômico foi analisado a partir de pools de embriões injetados com a mistura de três guias ou tampão. Espera-se que a mistura de três guias remova ~180 pares de base do locus branco . Isso pode ser visto nos produtos de PCR amplificados a partir do DNA genômico isolado de indivíduos injetados, bem como nos dados de sequência associados gerados a partir desses produtos (Figura 11). Essas evidências combinadas indicam que os embriões foram injetados antes da celularização.

Figura 1: Aspirador. Um aspirador eficaz pode ser montado a partir da fixação de uma bomba de vácuo na admissão, através de tubos plásticos, a um tubo cônico de plástico de 15 mL. Aproximadamente 0,5 cm deve ser cuidadosamente removido do fundo do tubo cônico. Uma bola de algodão deve ser colocada no tubo cônico, sobre a abertura da tubulação plástica, para capturar adultos de P. maidis enquanto são coletados e mantê-los fora da bomba de vácuo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Construção de recipientes para adultos. (A) Os suprimentos necessários (no sentido horário a partir do canto superior esquerdo): tela, pistola de cola quente, lâmina de barbear, recipiente de 1 oz. (B) Um grande orifício deve ser cortado no fundo do recipiente de 1 oz, e um quadrado de tela é cortado apenas grande o suficiente para cobrir esse buraco. (C) A tela é então colada sobre o orifício usando cola quente. (D) Uma vez fixada a cola, deve-se retirar o excesso de malha. Clique aqui para ver uma versão maior desta figura.

Figura 3: Sexagem de adultos de P. maidis. Os lados ventrais dos adultos machos (esquerda) e fêmeas (direita) de P. maidis são mostrados. O ovipositor, visível sobre o abdome feminino, é o indicador mais claro do sexo de um indivíduo. Clique aqui para ver uma versão maior desta figura.

Figura 4: Vedação de adultos em recipientes . (A) Um quadrado de 5 cm x 5 cm de filme plástico de cera de parafina. (B) O filme deve ser esticado uniformemente até 3-4 vezes o seu tamanho original. (C) Uma vez que os adultos tenham sido colocados no recipiente adulto, a película esticada deve ser colocada sobre a abertura para prender os adultos. Uma gota de 400 μL de solução de sacarose a 10% p/v deve então ser colocada sobre o filme. (D) Para fornecer pressão de alimentação adequada para os adultos, um segundo quadrado de 5 cm x 5 cm de filme plástico de parafina deve ser igualmente esticado e colocado sobre a gota de sacarose. Clique aqui para ver uma versão maior desta figura.
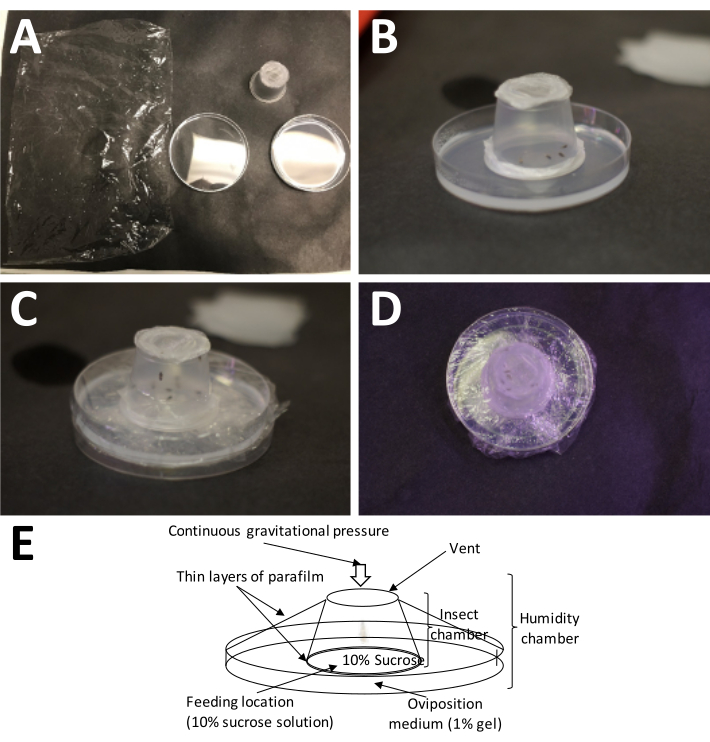
Figura 5: Instalação de uma câmara de oviposição. (A) Os suprimentos necessários (no sentido horário a partir do canto superior esquerdo): filme plástico, um recipiente adulto preenchido (com adultos) e uma placa de Petri com 1% de agarose (meio de oviposição). (B) O recipiente adulto deve ser colocado sobre a agarose com o filme plástico de parafina/"sanduíche" de sacarose a 10% colocado diretamente no meio de oviposição. (C) O filme plástico é usado para fixar o recipiente adulto ao meio de oviposição. Isso evita que o meio seque muito rapidamente. (D) Deve-se tomar cuidado para evitar cobrir a tela do recipiente adulto, para que a troca de ar ainda possa continuar. (E) Diagrama da câmara de oviposição. Clique aqui para ver uma versão maior desta figura.

Figura 6: Capuz umedecido. Um capuz equipado com um umidificador foi montado ao redor do escopo de injeção para minimizar as correntes de ar e manter a umidade enquanto os embriões estão sendo manuseados. Os retalhos podem ser dobrados sobre a entrada após o trabalhador estar no local, para ajudar a manter os níveis adequados de umidade. Clique aqui para ver uma versão maior desta figura.
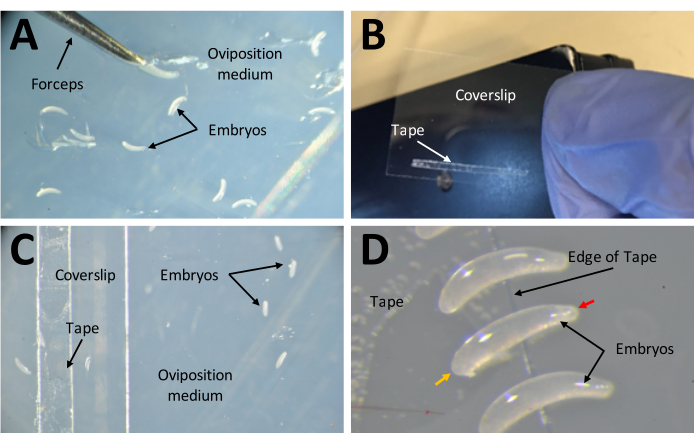
Figura 7: Colheita de embriões em preparação para injecções . (A) Embriões depositados no meio de oviposição. Um par de pinças finas são usadas para extrair embriões do meio e colocá-los em sua superfície. (B) Uma tira estreita de fita dupla face de 1 mm x 15 mm sobre uma lamínula de 22 mm x 30 mm. (C) A lamínula pode ser colocada no meio de oviposição para facilitar a transferência de embriões da superfície do meio para a fita na lamínula. (D) Os embriões de P. maidis são em forma de banana, com uma extremidade mais estreita que a outra (extremidade estreita indicada com cabeça de seta vermelha; extremidade mais larga indicada com cabeça de seta amarela em exemplo embrião). A extremidade larga do embrião deve ser colocada sobre a fita. Clique aqui para ver uma versão maior desta figura.
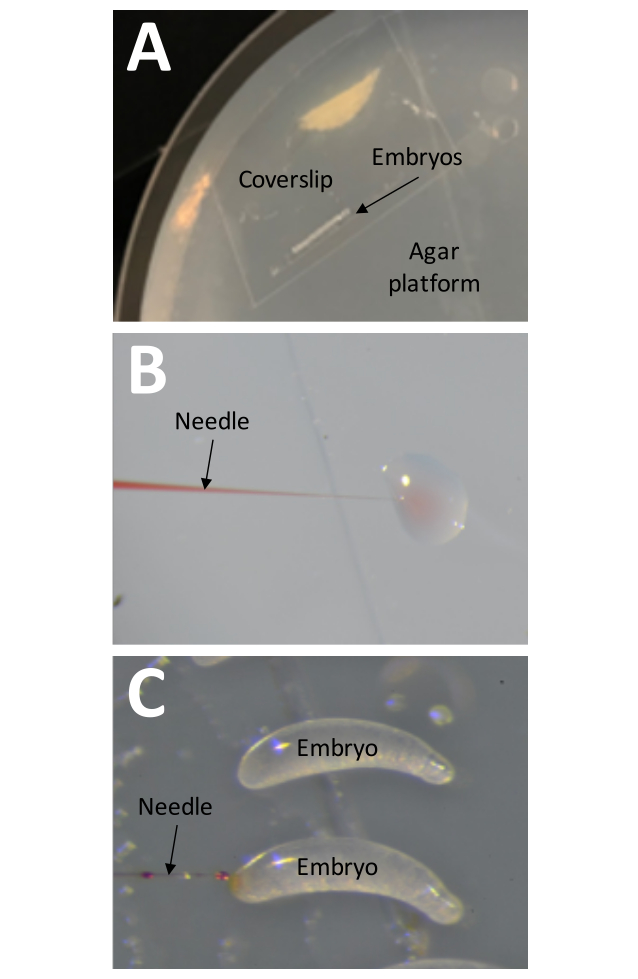
Figura 8: Injeção . (A) A plataforma de injeção é uma placa de Petri preenchida até a borda com 1% de ágar. A lamínula com uma tira de fita adesiva contendo embriões deve ser colocada diretamente na superfície da plataforma de injeção. (B) A pressão de injeção deve ser testada antes de os embriões serem injetados "injetando" uma pequena quantidade de solução injetável numa gota de água. Este método também pode ser usado a qualquer momento durante o processo de injeção para verificar se há entupimentos na agulha. (C) Os embriões devem ser injetados inserindo a agulha na extremidade maior do embrião. A solução injetável deve ser visível se a injeção tiver sido bem-sucedida. Clique aqui para ver uma versão maior desta figura.

Figura 9: Cuidados pós-injeção . (A) Uma vez injetados todos os embriões de uma lamínula, a lamínula deve ser colocada em uma placa de Petri fresca contendo 1% de agarose. (B) A placa de Petri com a lamínula pode então ser mantida em uma câmara de umidade (como a mostrada) até que os embriões eclodam. Clique aqui para ver uma versão maior desta figura.
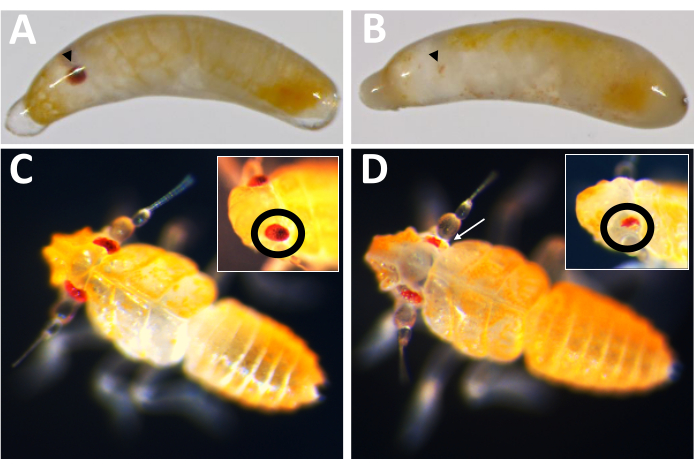
Figura 10: Fenótipo knockout de Pmw . (A) Controle pareado por idade e (B) Embriões knockout de Pmw , com olhos em desenvolvimento indicados por pontas de setas pretas. O embrião em B é mosaico, como uma pequena faixa de pigmentação pode ser vista. (C) Controle pareado por idade e (D) Filhotes knockout de PMW , com inserções mostrando um ângulo diferente nos olhos. O filhote em D também é mosaico. Uma seta branca aponta para uma área na imagem principal mostrando perda de pigmentação. Clique aqui para ver uma versão maior desta figura.
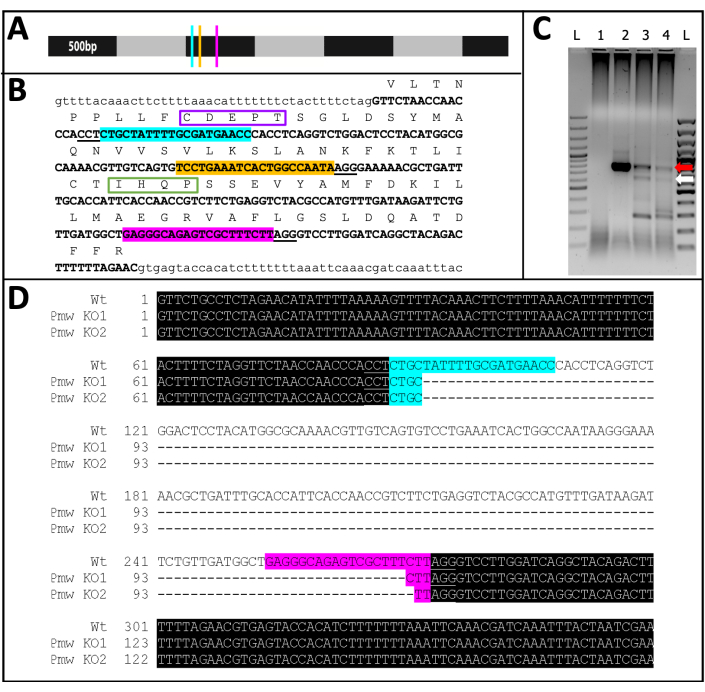
Figura 11: Sequência de nocaute Pmw . (A) Modelo em escala to de mRNA de Pmw , marcado em incrementos de 500 pb, com localização dos sítios de ligação do gRNA indicada: G1, azul; G2, amarelo; G3, rosa. Quaisquer mutações de mudança de quadro geradas neste ponto interromperão a maioria do produto de tradução. (B) Contexto genômico dos sítios de gRNA, tudo em um exon (negrito em maiúsculas). Os sites de vinculação de guia são realçados nas mesmas cores que A e os PAMs são sublinhados. O intervalo é de ~300 bp. A tradução in-frame do éxon é mostrada acima, como abreviações de letra única em texto maiúsculo. Dois motivos específicos para transportadores de pigmentos oculares são marcados. O motivo CDEPT do domínio funcional Walker B é encaixotado em roxo, e o motivo IHQP do domínio H-loop é encaixotado em verde. Ambos os domínios são críticos para a função ATP-transportador. (C) A região alvo de Pmw foi amplificada usando duas rodadas de PCR. O produto de segunda rodada foi examinado em gel em busca de evidências de mudança de tamanho devido à remoção bem-sucedida da região entre os guias. Pistas: L = escada de 100 pb; 1 = PCR controle hídrico; 2 = Ovos injetados em tampão; 3-4 = dois conjuntos separados de ovos injetados com mistura de três guias. Apenas os embriões que receberam a mistura de três guias produziram tanto a banda WT (seta vermelha) quanto a banda resultante de uma excisão completa (seta branca). (D) Para confirmar a identidade da banda inferior (seta branca), esse DNA foi purificado, clonado e sequenciado. A linha superior é a sequência de tipo selvagem. As outras duas linhas são sequências de dois clones. Três clones adicionais corresponderam à sequência inferior. O realce azul indica o local de vinculação do Guia 1, enquanto o realce rosa indica o local de vinculação do Guia 3. Em ambos os alelos, toda a região entre esses dois locais guia foi excluída. Abreviações: Pmw = Peregrinus maidis gene branco ; gRNA = RNA-guia; PAM = motivo adjacente do protoespaçador; ATP = trifosfato de adenosina; PCR = reação em cadeia da polimerase; WT = selvagem-tipo; KO = nocaute. Clique aqui para ver uma versão maior desta figura.
| Pôr | # de copos | # de fêmeas em cada copo | # de ovos | Total # de ovos | |||||||
| Dia 2 | Dia 3 | Dia 4 | Dia 5 | Dia 6 | Dia 7 | Dia 8 | Dia 9 | ||||
| 1 | 10 | 15 | 0 | 26 | 166 | 355 | 530 | 193 | 91 | 37 | 1398 |
| 2 | 15 | 15 | 22 | 238 | 489 | 699 | 520 | 379 | 203 | 58 | 2608 |
| 3 | 8 | 15 | 0 | 57 | 230 | 190 | 116 | 80 | 34 | 1 | 708 |
| 4 | 10 | 15 | 0 | 226 | 446 | 519 | 301 | 179 | 24 | 15 | 1710 |
| Total | 43 | 15 | 23 | 547 | 1331 | 1763 | 1467 | 831 | 352 | 111 | 6483 |
Tabela 1: Coletas representativas de ovos do ambiente de oviposição artificial. Dados de quatro conjuntos de copos de coleta de ovos são mostrados, com a contagem de ovos começando no segundo dia após a instalação e indo até o nono dia.
| Tratamento de injeção | Total Injetado | Total Desenvolvido | Total de eclosões | Taxa de Desenvolvimento (%) | Taxa de eclosão (%) |
| Buffer | 39 | 20 | 12 | 51 | 31 |
| Cássio9 | 39 | 24 | 14 | 61 | 36 |
| Cas9 +Pmw gRNAs | 121 | 71 | 28 | 59 | 28 |
Tabela 2: Sobrevivência e taxas de knockout de injeções de 3 misturas de injeção diferentes.
Discussão
Qualidade e nutrição da postura de ovos
Recentemente, pesquisadores que trabalharam com uma espécie relacionada, Nilaparvata lugens, obtiveram os ovos que usaram para microinjeções diretamente da folha, mantendo os ovos injetados no tecido foliar até eclodirem17. Embora esse método à base de folhas tenha proporcionado um ambiente mais natural para o desenvolvimento embrionário, também aumentou as chances de infecções e danos aos ovos durante o processo de remoção. O sistema de oviposição artificial aqui apresentado proporciona um ambiente mais uniforme e reduz as chances de danos aos ovos decorrentes do manuseio. Ao montar as taças de oviposição na sexta-feira, a maioria dos ovos ovipositados foi coletada durante uma semana de trabalho típica, em benefício daqueles que fazem o trabalho de microinjeção. Uma ressalva a esse método, no entanto, é que a falta de nutrientes na dieta com solução de sacarose a 10% acabará afetando a saúde dos insetos, e as fêmeas nas xícaras geralmente começam a morrer após apenas 10 dias. A qualidade dos ovos também começa a cair após 6 dias, como evidenciado por um aumento de ovos mortos ou com aparência insalubre. Como resultado, é importante ser seletivo dos ovos usados para microinjeções e não manter as fêmeas após o dia 6.
Taxa de sobrevivência e umidade
Dois fatores parecem ser críticos para a sobrevivência embrionária através do processo de microinjeção. O aspecto mais desafiador do manuseio de embriões de P. maidis é evitar que eles se dessecem após a remoção do meio de oviposição e durante a microinjeção. Como os ovos são normalmente colocados dentro do tecido vegetal, eles não têm uma casca adequada para evitar a desidratação. Mesmo na capuz umidificada, conjuntos inteiros de ovos foram perdidos devido à dessecação. No entanto, umidade excessivamente alta também pode afetar as microinjeções se a água se acumular na fita dupla face ou no escopo. Infelizmente, a desidratação dos ovos geralmente não era fácil de notar durante o processo de microinjeção, e eles frequentemente pareciam normais até 2 ou 3 dias depois, quando se tornaram completamente transparentes, não mostrando sinais de desenvolvimento.
A qualidade da agulha também parece desempenhar um papel importante na sobrevivência. A agulha deve ser chanfrada para minimizar danos desnecessários ao ovo. Quando a agulha é bloqueada, utilizar a função de limpeza no injetor enquanto acaricia suavemente a ponta da agulha com um pincel humedecido (ver passo 4.7) normalmente devolveu a agulha a um estado funcional. Independentemente disso, recomenda-se colocar apenas pequenas quantidades de solução de injeção (~0,25 μL) em cada agulha e mudar para uma nova agulha a cada poucas lâminas (~50-60 ovos) para garantir que a qualidade da agulha seja mantida durante todo o processo de injeção.
Geração bem-sucedida de um fenótipo nocaute
Para transformar com sucesso as células germinativas, as microinjeções embrionárias geralmente precisam ser feitas o mais cedo possível antes da celularização. Dependendo da espécie de inseto, a janela de tempo para completar as microinjeções varia de apenas algumas horas a até um dia inteiro14,15,20. Ainda não está claro quando os embriões de P. maidis sofrem celularização. O knockout mediado por Cas9 foi testado em embriões de até 4 h pós-oviposição (pel) a até 16 h pel, e os fenótipos esperados foram observados em todos os experimentos, sugerindo que todas as microinjeções foram realizadas dentro da janela de pré-celurização.
O ortólogo de P. maidis do gene da cor dos olhos, branco, foi selecionado porque se esperava que o fenótipo knockout fosse fácil de rastrear em injetados devido à sua natureza celular-autônoma. De fato, como esperado, tanto o mosaico quanto o knockout total foram claramente identificáveis entre os embriões que receberam a mistura injetável contendo Cas9 e RNAs guia. Infelizmente, nenhum injetado com nocaute completo eclodiu, e um acasalamento em massa de injetados sobreviventes não conseguiu gerar descendência de olhos brancos. No entanto, uma linhagem mutante foi posteriormente gerada com sucesso ao atingir um gene diferente (Klobasa et al., em andamento). Isso sugere que a falha em estabelecer uma linhagem mutante branca é provavelmente devido a efeitos fora do alvo (ou seja, Cas9 cortando regiões importantes em outras partes do genoma) gerando uma mutação letal intimamente ligada, ou a um papel crítico imprevisível para o branco em P. maidis.
Dados fenotípicos e moleculares (Figura 8 e Figura 9) afirmam que um knockout significativo no locus branco foi criado em uma amostra de embriões injetados, o que resultaria em perda total da função gênica. Além disso, embora mutações em branco sejam viáveis em algumas espécies, há precedentes para que a redução da atividade branca seja prejudicial21,22. Dito isso, efeitos fora do alvo não podem ser completamente descartados. A previsão de prováveis off-targets requer dados precisos de sequência do genoma23, o que o estado atual dos recursos genômicos em P. maidis torna impossível de fazer neste momento. Independentemente disso, com esses novos métodos, o teste de outros genes-alvo pode ser feito com confiança, até mesmo avançando para a transgênese mais tradicional, em um esforço para trazer novas ferramentas genéticas para essa praga perniciosa.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A Universidade Estadual da Carolina do Norte, Departamento de Entomologia e Fitopatologia, faz parte de uma equipe que apoia o Programa de Aliados de Insetos da DARPA. Os pontos de vista, opiniões e/ou descobertas expressas são dos autores e não devem ser interpretados como representando os pontos de vista ou políticas oficiais do Departamento de Defesa ou do Governo dos EUA. Os autores declaram não haver interesses concorrentes. MDL, DR e AEW conceberam o projeto e forneceram financiamento, administração do projeto e recursos. FC, WK, NG e MDL conceberam e projetaram os experimentos de microinjeção; OH concebeu e projetou o método de oviposição. FC e WK realizaram os experimentos; FC e WK analisaram os resultados; e FC, WK, NG e MDL escreveram o manuscrito. Os autores gostariam de fazer um agradecimento especial a Kyle Sozanski e Victoria Barnett por sua ajuda na manutenção das colônias de P. maidis.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 oz Containers | Dart | P100N | Adult container for egg-laying setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-103 | Serves as collection tube on vacuum aspirator setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-106 | For making 10% sucorose solution and for holding adults when chilling before screening |
| Aspirator | Bioquip | 1135A | For handling planthoppers |
| Vacuum Aspirator | Fischer Technical | LAV-3 | Vacuum for aspirating larger numbers of insects |
| Blue Spectrum LED Lights | Home Depot | GLP24FS/19W/LED | Grow lights for potted corn plants hoppers are feeding on |
| Cas9 | TrueCut Cas9 Protein v2 | A36498 | Endonuclease for cutting planthopper genes |
| Clear Vinyl Tubing | Home Depot | 3/8 in. I.D. x 1/2 in. O.D. x 10 ft. | Connects collection tube to pump on vacuum aspirator setup |
| Corn planthoppers | North Carolina State University | N/A | Request from Dr. Anna Whitfield's lab |
| Cotton balls | Genessee | 51-101 | Serves as a filter/insect catcher in collection tube on vacuum aspirator setup |
| Double sided tape | Scotch Double Sided Tape | NA | Holding eggs for microinjection |
| Early Sunglow corn | Park Seed Company | 05093-PK-N | Corn for rearing planthoppers |
| epTIPS Microloader Tips | Eppendorf | C2554691 | Backfilling needle loading tips |
| Femtojet Microinjection System | Eppendorf | 5247 | Controls injection pressure (12-20 psi, depending on needle bore size) |
| Nutri-Fly Drosophila Agar | Genessee | 66-103 | Substrate for everything except egg-laying dish |
| Fine forceps | Bioquip | 4731 | Egg handling |
| General Purpose LE Agarose | Apex | 20-102 | Substrate inn egg-laying dish (oviposition medium) |
| Guide RNA 1 - GGUUCAUCGCAAAAUAGCAG | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 2 - UCUGAAAUCACUGGCCAAUA | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 3 - GAGGGCAGAGUCGCUUUCUU | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Humidifyer | Homedics | UHE-CM45 | For providing humidity in humidified hood |
| Humidity chamber | Billups-Rothenberg | MIC-101 | For holding injected embryos until hatching |
| Insect rearing cages | Bioquip (special order) | Close to 1450 L (has plastic front and mesh fabric sides) | Cage for planthoppers on corn |
| Laser-based Micropipiette Puller | Sutter Instruments | P-2000/G | For making injection needles / Heat = 700, FIL = 4, VEL = 40, DEL = 170, PUL = 160 |
| Leica M165 FC Fluorescence Stereomicroscope | Leica | M165 FC | Planthopper screening |
| Microinjection Scope | Leica | MZ12-5 | Microinjection scope outfited with an XY stage |
| Micromanipulator | Narishige | MN-151 | For positioning microinjection needle |
| Micropipette beveler | Sutter Instruments | FG-BV10-D | For beveling injection needles / Used 'fine' graded plate at 20° angle |
| Microscope Stage | AmScope | GT100 X-Y Gliding Table | For positioning and moving embryos under microscope |
| Miniature Paint Brush | Testor #2 8733 | Sold in 3 pack 281206 | Fine paintbrushes for embryo handling |
| Needle Holder | Narishige | HI-7 | For holding the microinjection needle |
| Percival Incubator | Percival | I41VLH3C8 | Rearing injectees until hatch |
| Petri Dishes (100 x 15 mm) | VWR | 89038-968 | Making agar dish for egg-lay |
| pGEM-T Easy Vector System I cloning kit | Promega | A1360 | Cloning Pm white target site |
| Phenol Red | Sigma | 143-78-8 | Microinjection buffer |
| Plain Microscope Slides or coverslip | Fisher Scientific | 12-549-3 | Hold eggs for microinjection |
| Plasmid DNA Midi Kit | Zymo | D4200 | Purification of injection-ready plasmid DNAs |
| Plastic paraffin film | Pechiney Plastic Packaging | PM-996 | Roll size 4 in. x 125 ft |
| Plastic wrap | Glad ClingWrap Plastic Wrap | NA | Wrap the entire egg-laying chamber |
| Primer - PmW CRISPR check F1 - AAGGAATTTCTGGAGGTGAAA | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R1 - GATTCCTCGCTGTTGGGT | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check F3 - TCACAGACCCTGGTGCTAATC | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R3 - GTCCACAATCCACACTTCTGA | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Quartz capillaries | Sutter Instruments | QF100-50-10 | For making microinjection needles / O.D. 1 mm, I.D. 0.7 mm, 10 cm length |
| Screen (White Organza Fabric) | Joann Fabrics | 16023889 | For covering the adult container |
| Sparkleen | Fisher Scientific | 04-320-4 | Wash dishes |
| Sucrose | Fisher Scientific | BP220-1 | To make 10% sucorose solution |
Referências
- Namba, R., Higa, S. Y. Host plant studies of the corn planthopper, Peregrinus maidis (Ashmead) in Hawaii. Proceedings of the Hawaiian Entomological Society. 21, 105-108 (1971).
- Singh, B. U., Seetharama, N. Host plant interactions of the corn planthopper, Peregrinus maidis Ashm.(Homoptera: Delphacidae) in maize and sorghum agroecosystems. Arthropod-Plant Interactions. 2 (3), 163-196 (2008).
- Tsai, J. Occurrence of a corn disease in Florida transmitted by Peregrinus maidis. Plant Disease Reporter. 59 (10), 830-833 (1975).
- Chelliah, S., Basheer, M. Biological studies of Peregrinus maidis (Ashmead) (Araeopidae: Homoptera) on sorghum. Indian Journal of Entomology. 27, 466-471 (1965).
- Lastra, J., Esparza, J. Multiplication of vesicular stomatitis virus in the leafhopper Peregrinus maidis (Ashm.), a vector of a plant rhabdovirus. Journal of General Virology. 32 (1), 139-142 (1976).
- Nault, L. R., Ammar, E. -. D. Leafhopper and planthopper transmission of plant viruses. Annual Review of Entomology. 34 (1), 503-529 (1989).
- Ammar, E. -. D., Tsai, C. -. W., Whitfield, A. E., Redinbaugh, M. G., Hogenhout, S. A. Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annual Review of Entomology. 54, 447-468 (2009).
- Barandoc-Alviar, K., Ramirez, G. M., Rotenberg, D., Whitfield, A. E. Analysis of acquisition and titer of Maize mosaic rhabdovirus in its vector, Peregrinus maidis (Hemiptera: Delphacidae). Journal of Insect Science. 16 (1), 14 (2016).
- Tsai, J. H., Steinberg, B., Falk, B. W. Effectiveness and residual effects of seven insecticides on Dalbulus maidis (Homoptera: Cicadellidae) and Peregrinus maidis (Homoptera: Delphacidae). Journal of Entomological Science. 25 (1), 106-111 (1990).
- Yao, J., Rotenberg, D., Afsharifar, A., Barandoc-Alviar, K., Whitfield, A. E. Development of RNAi methods for Peregrinus maidis, the corn planthopper. PloS One. 8 (8), 70243 (2013).
- Esvelt, K. M., Smidler, A. L., Catteruccia, F., Church, G. M. Emerging technology: concerning RNA-guided gene drives for the alteration of wild populations. Elife. 3, 03401 (2014).
- Gantz, V. M., Bier, E. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348 (6233), 442-444 (2015).
- Yao, J., Rotenberg, D., Whitfield, A. E. Delivery of maize mosaic virus to planthopper vectors by microinjection increases infection efficiency and facilitates functional genomics experiments in the vector. Journal of Virological Methods. 270, 153-162 (2019).
- Kimelman, D., Martin, B. L. Anterior-posterior patterning in early development: three strategies. Wiley Interdisciplinary Reviews: Developmental Biology. 1 (2), 253-266 (2012).
- Mito, T., Nakamura, T., Noji, S. Evolution of insect development: to the hemimetabolous paradigm. Current Opinion in Genetics & Development. 20 (4), 355-361 (2010).
- Grubbs, N., Haas, S., Beeman, R. W., Lorenzen, M. D. The ABCs of eye color in Tribolium castaneum: orthologs of the Drosophila white, scarlet, and brown Genes. Genetics. 199 (3), 749-759 (2015).
- Xue, W. H., et al. CRISPR/Cas9-mediated knockout of two eye pigmentation genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae). Insect Biochemistry and Molecular Biology. 93, 19-26 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94 (3), 441-448 (1975).
- Chu, F. C., Wu, P. S., Pinzi, S., Grubbs, N., Lorenzen, M. D. Microinjection of Western Corn Rootworm, Diabrotica virgifera virgifera, embryos for germline transformation, or CRISPR/Cas9 genome editing. Journal of Visualized Experiments: JoVE. (134), e57497 (2018).
- Brent, C. S., Hull, J. J. RNA interference-mediated knockdown of eye coloration genes in the western tarnished plant bug (Lygus hesperus Knight). Archives of Insect Biochemistry and Physiology. 100 (2), 21527 (2019).
- Khan, S. A., Reichelt, M., Heckel, D. G. Functional analysis of the ABCs of eye color in Helicoverpa armigera with CRISPR/Cas9-induced mutations. Scientific Reports. 7 (1), 1-14 (2017).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados