Method Article
Microinyección de saltamontes de maíz, Peregrinus maidis, embriones para la edición del genoma CRISPR/Cas9
En este artículo
Resumen
Aquí hay protocolos para recolectar y microinyectar embriones precelulares de saltamontes de maíz con el fin de modificar su genoma a través de la edición del genoma basada en CRISPR / Cas9 o para la adición de elementos transponibles marcados a través de la transformación de la línea germinal.
Resumen
El saltamontes de maíz, Peregrinus maidis, es una plaga del maíz y un vector de varios virus del maíz. Los métodos publicados anteriormente describen el desencadenamiento de la interferencia de ARN (ARNi) en P. maidis a través de la microinyección de ARN bicatenario (dsRNA) en ninfas y adultos. A pesar del poder del ARNi, los fenotipos generados a través de esta técnica son transitorios y carecen de herencia mendeliana a largo plazo. Por lo tanto, la caja de herramientas de P. maidis debe ampliarse para incluir herramientas genómicas funcionales que permitan la producción de cepas mutantes estables, abriendo la puerta para que los investigadores introduzcan nuevos métodos de control para influir en esta plaga económicamente importante. Sin embargo, a diferencia de los dsRNAs utilizados para el ARNi, los componentes utilizados en la edición del genoma basada en CRISPR / Cas9 y la transformación de la línea germinal no cruzan fácilmente las membranas celulares. Como resultado, los ADN, ARN y / o proteínas plásmidos deben microinyectarse en embriones antes de que el embrión se celularice, lo que hace que el momento de la inyección sea un factor crítico para el éxito. Con ese fin, se desarrolló un método de puesta de huevos a base de agarosa para permitir que los embriones se cosechen de hembras de P. maidis a intervalos relativamente cortos. Aquí se proporcionan protocolos detallados para recolectar y microinyectar embriones precelulares de P. maidis con componentes CRISPR (nucleasa Cas9 que ha sido complejada con ARN guía), y se presentan los resultados de la eliminación del gen basado en Cas9 de un gen del color de ojos de P. maidis, blanco. Aunque estos protocolos describen la edición del genoma CRISPR/Cas9 en P. maidis, también se pueden utilizar para producir P. maidis transgénico a través de la transformación de la línea germinal simplemente cambiando la composición de la solución inyectable.
Introducción
El saltamontes de maíz, Peregrinus maidis, es una plaga económicamente importante del maíz 1,2,3. Causan daño físico directo a la planta, tanto mientras se alimentan con sus piezas bucales perforadoras-chupadoras, como durante la reproducción cuando ponen sus embriones directamente en el tejido vegetal 2,4. A pesar de las múltiples rutas de daño directo a los cultivos, el mayor impacto que estos insectos tienen en la salud de los cultivos es indirecto, al actuar como vector del virus del mosaico del maíz (MMV) y del virus de la raya del maíz 5,6. MMV es capaz de replicarse en el cuerpo de su vector P. maidis, permitiendo que el virus persista en insectos individuales durante toda su vida, por lo que pueden continuar propagando el virus a nuevas plantas huésped 7,8. Los métodos más comunes para controlar P. maidis, y por lo tanto los virus que transmite, son los insecticidas.
Desafortunadamente, el mal manejo de estos productos ha causado el desarrollo de resistencia en la plaga objetivo, así como la contaminación del medio ambiente9. Por lo tanto, se necesitan nuevas estrategias para reducir las pérdidas de cultivos de esta combinación de insectos / virus y plagas. Trabajos previos demostraron que la interferencia de ARN (ARNi) podría ser un método de control efectivo para P. maidis porque son susceptibles a la regulación negativa en la expresión génica incluso cuando se ingiere ARN bicatenario (dsRNA)10. Sin embargo, la forma más efectiva de administrar dsRNA en el campo sería a través de las plantas de las que se alimentan los insectos; Por lo tanto, los cultivos aún podrían ser susceptibles a cualquier virus que los insectos ya estén portando. Con el advenimiento de la edición del genoma CRISPR / Cas9, son posibles nuevas estrategias de control de plagas, incluido el impulsor genético basado en Cas911,12, que podría usarse para reducir el tamaño de una población de plagas o para reemplazar dicha población con individuos resistentes a los virus que transmiten.
Sin embargo, el desarrollo y despliegue de cualquier tipo de sistema de impulsores genéticos requerirá el desarrollo de técnicas transgénicas. Tales métodos no fueron necesarios para llevar a cabo experimentos de ARNi en P. maidis porque se presume que los dsRNAs y/o siRNAs pueden atravesar las membranas celulares debido a la eficiencia del RNAi en P. maidis10,13. Esto no es cierto para los ADN y / o proteínas empleadas en la transgénesis tradicional o en la edición de genes basada en Cas9, cualquiera de los cuales sería un precursor de la creación de insectos portadores de un impulso genético. Para lograr la edición de genes u otras formas de transformación de la línea germinal, estos ADN y proteínas se microinyectan idealmente en embriones durante la etapa de blastodermo sincitial, antes de que el embrión del insecto se celularice. El tiempo es crítico, porque la etapa sincitial es la primera parte del desarrollo14,15. Como las hembras de P. maidis ponen preferentemente sus huevos en el tejido vegetal, la extracción de cantidades suficientes de embriones precelulares para microinyecciones puede ser laboriosa y llevar mucho tiempo. Por lo tanto, se desarrollaron nuevas técnicas para recolectar y microinyectar rápidamente embriones de P. maidis antes de la celularización.
Protocolo
1. Crianza a nivel de colonia de adultos de P. maidis
- Plante un mínimo de cuatro macetas de maíz por semana por jaula de cría, con 3-4 semillas por maceta. Cultiva en un ambiente libre de insectos.
- Cuando las plantas tengan ~ 5 semanas de edad, colóquelas dentro de una jaula de 30 cm x 30 cm x 60 cm.
- Obtenga una cantidad suficiente de adultos de P. maidis (~ 500) de un laboratorio de investigación o de la naturaleza, y colóquela en una jaula a prueba de insectos con 9-12 plantas de maíz (3-4 macetas).
- Mantener la colonia en una incubadora de cría de insectos a 25 °C (± 1 °C), con al menos un 70% de humedad y un ciclo de luz de 14:10.
- Para generar una colonia calibrada por edad, retire a todos los adultos iniciales después de cuatro días de puesta de huevos y permita que los embriones depositados en la jaula eclosionen y envejezcan naturalmente.
- Mueva los insectos P. maidis (adultos) de 5 semanas de edad a plantas de maíz frescas para su subcultivo semanal recolectando con un aspirador (Figura 1). Luego, libere a los adultos en una jaula limpia con plantas de maíz frescas. Para mantener un suministro constante de adultos jóvenes con fines experimentales, prepare jaulas frescas calibradas por edad cada semana.
- Riegue las macetas en las jaulas dos veces al día. Recorte periódicamente los tallos, retire el material vegetal en descomposición y reemplácelos con macetas de maíz frescas según sea necesario.
NOTA: Con un mantenimiento adecuado, una colonia puede durar ~ 5 semanas (es decir, el tiempo suficiente para que los embriones colocados en la jaula se conviertan en adultos).
2. Cámara de puesta de huevos a base de agarosa
- Haga platos de recolección de huevos (medio de oviposición) vertiendo 1% p/v agarosa en agua en placas de Petri limpias de 100 mm x 15 mm. Conservar el medio de oviposición a 4 °C después de solidificarse.
- Prepare una solución de sacarosa al 10% p/v para alimentar a los adultos. Guarde la solución de sacarosa a -20 °C durante un máximo de un mes.
- Haga una cámara para sostener a los adultos cortando un agujero en el fondo de una taza de 1 oz (consulte la Tabla de materiales) y pegando una pantalla sobre el orificio para el intercambio de aire (Figura 2).
- Corte la película de cera de parafina plástica en cuadrados de 5 cm x 5 cm; Reserva 2 cuadrados para cada taza.
- Recolecte ~ 15 hembras adultas de 1 semana de edad de una colonia de P. maidis calibrada por edad. Para seleccionar hembras, examine el lado ventral del abdomen y busque el ovipositor, que generalmente es más oscuro que el resto del abdomen (Figura 3). Mantenga a los adultos hasta por una hora en un vial cónico de 15 ml si instala varias cámaras de puesta de huevos. Enfríe los insectos brevemente en hielo antes del sexado y transfiéralos al recipiente para adultos.
NOTA: Este examen se puede hacer sin un microscopio. Las hembras adultas que han tenido tiempo de alimentarse y aparearse también suelen tener abdómenes más grandes que los machos adultos y son más dóciles; Por lo tanto, se pueden seleccionar más fácilmente de una población de jaulas. - Transfiera las hembras a un recipiente para adultos y selle la taza con 1 capa de película de cera de parafina plástica estirándola uniformemente 3-4 veces su tamaño original (Figura 4A, B).
- Aplique 400 μL de solución de sacarosa al 10% p/v en la parte superior del sello de la película de cera de parafina plástica y agregue una segunda capa de película de cera de parafina plástica, estirando la película de cera de parafina plástica exactamente como se indica arriba (Figura 4C, D).
NOTA: El sándwich de película de cera de parafina de plástico estirado presuriza la solución de sacarosa, que es muy importante para la alimentación de adultos, pero no evitará que las hembras perforen sus ovipositores hasta el medio de oviposición. - Coloque la cámara para adultos en un plato de recolección de huevos con el lado de la película de cera de parafina de plástico directamente sobre el medio de oviposición, y envuelva toda la cámara de puesta de huevos con una envoltura de plástico sin cubrir los orificios de aire, ya que son necesarios para el intercambio de aire (Figura 5).
- Incubar cada cámara de puesta de huevos a 25 °C con un 70% de humedad y un ciclo de luz de 14:10.
- Cambie el sándwich de película de cera de parafina de plástico y la solución de sacarosa al 10% p/v diariamente, y elimine el agua que se acumule dentro de la taza.
3. Recolección y alineación de embriones en un ambiente de alta humedad
- Instale un sistema de microinyección basado en un microscopio estereoscópico en un espacio o campana humidificados (campana humidificada; Figura 6) para garantizar que el entorno de trabajo alcance al menos un 70% de humedad durante todo el proceso de microinyección.
- Verifique el medio de oviposición para ver si hay huevos después del período deseado de puesta de huevos. Haga esto en una campana humidificada u otro ambiente húmedo.
NOTA: El período de puesta de huevos típicamente utilizado fue durante la noche, de 6 PM a 10 AM, con una duración de ~ 16 h. - Si se ponen huevos en la agarosa, use pinzas finas para desenterrarlos cuidadosamente y colóquelos en la superficie de la agarosa para mantenerlos húmedos (Figura 7A).
- Aplique una tira de cinta de doble cara de 1 mm x 15 mm sobre un cubreobjetos de 22 mm x 30 mm (Figura 7B). Coloque el cubreobjetos con el lado de la cinta hacia arriba en el medio de oviposición (Figura 7C).
- Recoja cada huevo individual de la superficie del agar y muévase a la cinta de doble cara con un cepillo fino. Retire los huevos que sean completamente blancos o que tengan coloración negra. Los huevos sanos serán los semitransparentes.
- Coloque los huevos en forma de plátano de lado, con el extremo más grande pegado en la cinta de doble cara (Figura 7D).
NOTA: Siempre mantenga los huevos en un ambiente de alta humedad, como una placa de Petri moldeada con una capa de agar al 1% en la parte inferior.
4. Preparación de reactivos CRISPR y agujas de inyección
- Tire de las agujas de cuarzo con un extractor de micropipetas tipo Flaming/Brown.
- Biselar las agujas de cuarzo con un biselado de micropipeta.
- Use cinta adhesiva de doble cara para asegurar las agujas tiradas en un recipiente transparente, como una placa de Petri, hasta que estén listas para usar.
- Preparar la solución inyectable combinando 0,5 μL de proteína Cas9 (solución madre de 5 μg/μL) y 0,5 μL de ARNg (solución madre de 4 μg/μL; véase la tabla de materiales) con 1 μL de tampón rojo fenol en un volumen final de 5 μL. Para precipitar partículas que podrían obstruir la aguja, haga un vórtice breve de la solución y centrifugar durante 3 minutos a velocidad máxima.
- Rellene la aguja de inyección, teniendo cuidado de dejar la mezcla de inyección cerca del extremo cónico de la aguja. Retire las burbujas, si las hay, de la punta de la aguja.
- Coloque cuidadosamente la aguja rellena en el soporte de la aguja y apriete el collar de acero inoxidable para mantener la aguja firmemente en su lugar durante la microinyección.
- Genere un flujo confiable de solución inyectable de la aguja acariciando suavemente la punta biselada con un pincel fino y humedecido, mientras administra ráfagas de presión de aire a la aguja con el sistema de inyección.
NOTA: La aguja está lista para la inyección cuando la mezcla de inyección puede salir de la punta en pequeñas cantidades.
5. Microinyección y cuidados posteriores a la inyección
- Prepare una plataforma de microinyección llenando una placa de Petri limpia de 100 mm x 15 mm con agar al 1% para formar una capa nivelada de agar que se enrasa con la parte superior del plato.
- Coloque un cubreobjetos previamente preparado con ~25 embriones sobre la plataforma de agar (Figura 8A).
NOTA: Todos los pasos de inyección deben realizarse dentro de una campana humidificada (~70% de humedad). - Compruebe la presión de inyección colocando la punta de la aguja en una gota de agua e iniciando el ciclo de inyección.
NOTA: Una pequeña cantidad de solución inyectable debe dispersarse en el agua si el ajuste de presión es correcto (Figura 8B). - Inserte la aguja en el extremo más grande del embrión, acercándose desde el lado izquierdo del cubreobjetos (Figura 8C). Administre la solución inyectable en el huevo y saque la aguja rápidamente.
- Después de inyectar todos los huevos, coloque el cubreobjetos en la superficie de un nuevo plato de agar al 1% y transfiera el plato a una cámara de humedad (Figura 9).
6. Incubación y eclosión de embriones
- Coloque la cámara de eclosión en una incubadora a 25 °C durante 6 días.
- Transfiera los embriones supervivientes, utilizando agua limpia y un cepillo fino, a una placa de Petri de 35 mm x 10 mm con papel de filtro humedecido en agua que cubra el fondo del plato. Selle la placa de Petri con una película de cera de parafina de plástico y mantenga a 25 °C para permitir que los embriones eclosionen. Comience a revisar la supervivencia de los embriones 6 días después de la inyección.
NOTA: Las primeras ninfas del estadio comenzarán a eclosionar alrededor del día 8. - Transfiera las ninfas, usando un cepillo fino, a una placa de Petri que contenga recortes de hojas. Cubra el plato y selle con una película de cera de parafina de plástico.
- Incubar el plato sellado de las crías en esquejes de hojas durante 48 h a 25 °C.
- Transfiera todas las ninfas de 2 días de edad de una ronda de inyecciones a una jaula de cría con plantas de maíz usando un cepillo fino. Si los inyectados con fenotipo visible se recuperan en cantidades suficientes, criarlos por separado para maximizar la recuperación del rasgo objetivo en la próxima generación. De lo contrario, realice el apareamiento masivo de todos los inyectados.
NOTA: Coloque las crías suavemente en el verticilo de la planta de maíz para proporcionar refugio y garantizar la humedad adecuada de su entorno inmediato. - Criar los insectos en las condiciones descritas anteriormente, asegurando la temperatura adecuada, la humedad y las transferencias regulares a las plantas de maíz fresco.
- Progenie de detección de fenotipos esperados. Coloque a los individuos que exhiben el fenotipo deseado en su propia jaula para establecer líneas homocigóticas.
Resultados
La cámara de puesta de huevos fue diseñada específicamente para permitir que las hembras de P. maidis se alimenten mientras oviponen en un medio protector del cual sus huevos podrían recuperarse fácilmente. Usando este método, se recuperaron cantidades suficientes de embriones precelulares para microinyección con ADN, ARN y / o proteínas. Las hembras adultas de P. maidis generalmente ponen huevos dentro del tejido foliar de las plantas de maíz, lo que hace que obtener suficientes huevos en un corto período de tiempo sea un desafío porque requiere mucha disección de hojas. El entorno artificial de puesta de huevos proporciona una solución para superar estos problemas. Como se muestra en la Tabla 1, se recolectaron 6,483 huevos de un total de 645 hembras en 4 semanas. Las hembras generalmente comienzan a poner huevos después del día 2 y proporcionan la mayoría de los huevos desde el día 4 hasta el día 6. La actividad de oviposición se desaceleró para el día 9. Cada cámara de oviposición se instaló el viernes y se verificó si había huevos desde el domingo hasta el domingo siguiente. Seguir este horario permitió que la mayoría de los huevos se recolectaran para microinyecciones durante la semana laboral.
La primera aplicación práctica de este sistema de puesta de huevos fue probar la eficacia del gen knockout mediado por Cas9, utilizando el ortólogo de P. maidis del gen del color de ojos, blanco (Pmw), como objetivo. Se sabe que las mutaciones en blanco resultan en una pérdida sustancial de la pigmentación ocular en otras especies de insectos, y el blanco es autónomo de células, lo que permite detectar mutaciones en individuos inyectados16,17. Para aumentar la posibilidad de que incluso una pequeña mutación pueda resultar en la pérdida de la función, se diseñaron ARN guía para cortar dentro de la región del casete de unión a ATP, que es necesaria para la función White16. Los embriones de P. maidis se inyectaron con rojo de fenol al 20% (tampón de inyección), tampón de inyección con Cas9 a una concentración final de 800 ng / μL (control de Cas9) o Cas9 en tampón de inyección junto con tres ARN guía agregados a una concentración de 400 ng / μL cada uno. La combinación de tres guías dentro de una mezcla de inyección tenía la intención de maximizar aún más las posibilidades de generar mutantes, tanto creando una gran eliminación como compensando la posibilidad de que cualquier guía pudiera ser ineficaz para el corte. Las tasas de desarrollo para cada tratamiento fueron comparables (Tabla 2), con 50-60% de los individuos inyectados mostrando signos de desarrollo. Las tasas de escotilla para el amortiguador y los controles Cas9 también fueron comparables; Sin embargo, las tasas de eclosión de los individuos que recibieron la mezcla de tres guías fueron relativamente más bajas. En este momento, no está claro si la reducción de la supervivencia es el resultado de la pérdida de la función blanca o el resultado de consecuencias no deseadas de la mezcla de tres guías, como los efectos fuera del objetivo (consulte la sección de discusión). Sin embargo, ninguno de los individuos con pérdida completa de pigmentación ocular (es decir, nocaut completo) eclosionó, y ninguno de los descendientes de individuos inyectados tenía ojos blancos. La eficacia en el objetivo de la mutagénesis basada en Cas9 se verificó de dos maneras. Primero, los inyectados fueron examinados para detectar la pérdida de pigmentación ocular.
De los 71 individuos inyectados por guía que se desarrollaron, 23 mostraron algún grado de pérdida de pigmento (Figura 10), y 9 de esos individuos eclosionaron, lo que resultó en una tasa de eliminación de ≥32%. No se observó pérdida de pigmentación ocular en ninguno de los tratamientos de control. En segundo lugar, las mutaciones cromosómicas se confirmaron mediante reacción en cadena de la polimerasa (PCR)18 y secuenciación19. Debido a que no se pudo recuperar una línea mutante, se analizó el ADN genómico de grupos de embriones inyectados con la mezcla de tres guías o el amortiguador. Se espera que la mezcla de tres guías elimine ~ 180 pares de bases del locus blanco . Esto se puede ver en los productos de PCR amplificados a partir de ADN genómico aislado de individuos inyectados, así como en los datos de secuencia asociados generados a partir de esos productos (Figura 11). Esta evidencia combinada indica que los embriones fueron inyectados antes de que ocurriera la celularización.

Figura 1: Aspirador. Se puede ensamblar un aspirador efectivo conectando una bomba de vacío en la admisión, a través de un tubo de plástico, a un tubo cónico de plástico de 15 ml. Aproximadamente 0,5 cm deben retirarse cuidadosamente del fondo del tubo cónico. Se debe colocar una bola de algodón en el tubo cónico, sobre la abertura del tubo de plástico, para atrapar a los adultos de P. maidis a medida que se recogen y mantenerlos fuera de la bomba de vacío. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Construcción de contenedores para adultos. (A) Los suministros necesarios (en el sentido de las agujas del reloj desde la parte superior izquierda): pantalla, pistola de pegamento caliente, hoja de afeitar, recipiente de 1 oz. (B) Se debe cortar un agujero grande en el fondo del recipiente de 1 oz, y se corta un cuadrado de pantalla lo suficientemente grande como para cubrir este agujero. (C) La pantalla se pega sobre el orificio con pegamento caliente. (D) Una vez que el pegamento está fijado, se debe eliminar cualquier exceso de malla. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Sexado de P. maidis adultos. Se muestran los lados ventrales de los adultos machos (izquierda) y hembras (derecha) de P. maidis. El ovipositor, visible sobre el abdomen femenino, es el indicador más claro del sexo de un individuo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Sellado de adultos en contenedores . (A) Un cuadrado de 5 cm x 5 cm de película plástica de cera de parafina. (B) La película debe estirarse uniformemente a 3-4 veces su tamaño original. (C) Una vez que los adultos se han puesto en el recipiente para adultos, la película estirada debe colocarse sobre la abertura para asegurar a los adultos. Luego se debe colocar una gota de 400 μL de solución de sacarosa al 10% p/v sobre la película. (D) Para proporcionar una presión de alimentación adecuada para los adultos, un segundo cuadrado de 5 cm x 5 cm de película plástica de parafina debe estirarse de manera similar y colocarse sobre la gota de sacarosa. Haga clic aquí para ver una versión más grande de esta figura.
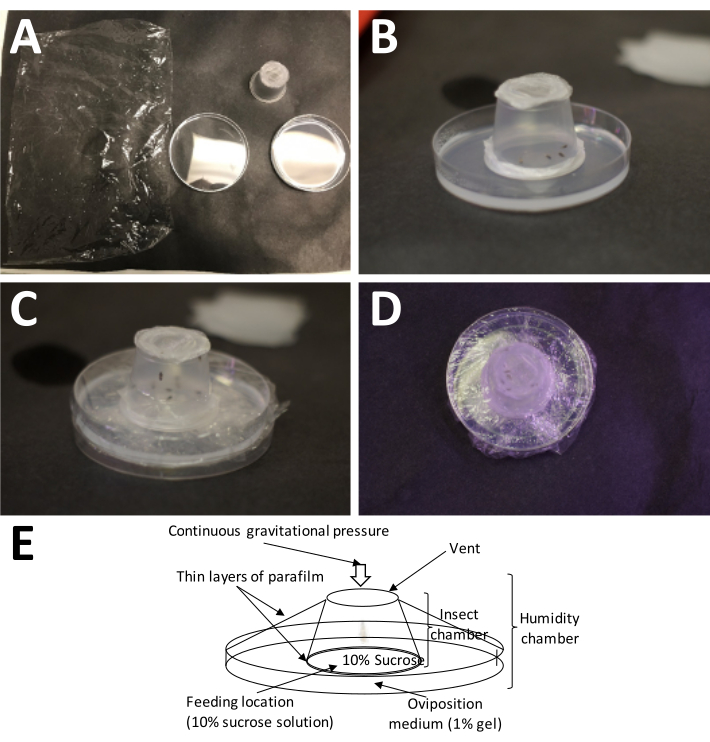
Figura 5: Configuración de una cámara de oviposición. (A) Los suministros necesarios (en el sentido de las agujas del reloj desde la parte superior izquierda): envoltura de plástico, un recipiente para adultos completo (con adultos) y una placa de Petri con 1% de agarosa (medio de oviposición). (B) El recipiente para adultos debe colocarse sobre la agarosa con la película de parafina de plástico/sándwich de sacarosa al 10% colocada directamente sobre el medio de oviposición. (C) La envoltura de plástico se utiliza para asegurar el recipiente adulto al medio de oviposición. Esto evita que el medio se seque demasiado rápido. (D) Se debe tener cuidado de evitar cubrir la pantalla del contenedor para adultos, de modo que el intercambio de aire pueda continuar. (E) Diagrama de la cámara de oviposición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Campana humidificada. Se ha instalado una campana equipada con un humidificador alrededor del endoscopio de inyección para minimizar las corrientes de aire y mantener la humedad mientras se manipulan los embriones. Las solapas se pueden plegar sobre la entrada después de que el trabajador esté en su lugar, para ayudar a mantener los niveles adecuados de humedad. Haga clic aquí para ver una versión más grande de esta figura.
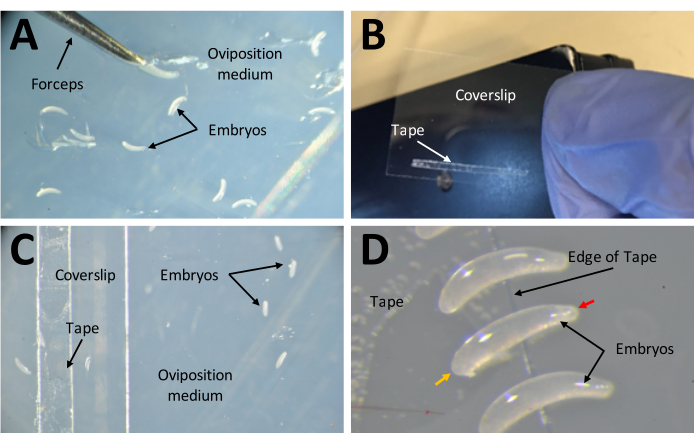
Figura 7: Recolección de embriones en preparación para inyecciones . (A) Embriones que han sido depositados en el medio de oviposición. Se utilizan un par de pinzas finas para extraer embriones del medio y colocarlos en su superficie. (B) Una tira estrecha de cinta de doble cara de 1 mm x 15 mm en un cubreobjetos de 22 mm x 30 mm. (C) El cubreobjetos puede colocarse en el medio de oviposición para facilitar la transferencia de embriones desde la superficie del medio a la cinta en el cubreobjetos. (D) Los embriones de P. maidis tienen forma de plátano, con un extremo más estrecho que el otro (extremo estrecho indicado con punta de flecha roja; extremo más ancho indicado con punta de flecha amarilla en el embrión de ejemplo). El extremo ancho del embrión debe colocarse en la cinta. Haga clic aquí para ver una versión más grande de esta figura.
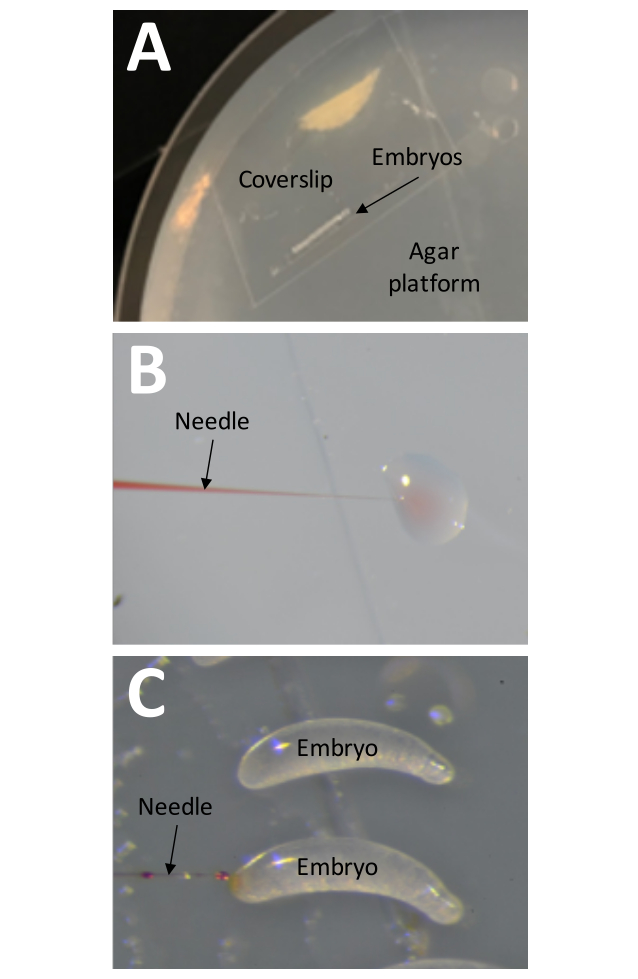
Figura 8: Inyección. (A) La plataforma de inyección es una placa de Petri llena hasta el borde con agar al 1%. El cubreobjetos con una tira de cinta adhesiva que contiene embriones debe colocarse directamente sobre la superficie de la plataforma de inyección. (B) La presión de inyección debe probarse antes de inyectar embriones mediante "inyectar" una pequeña cantidad de solución inyectable en una gota de agua. Este método también se puede utilizar en cualquier momento durante el proceso de inyección para comprobar si la aguja está obstruida. (C) Los embriones deben inyectarse insertando la aguja en el extremo más grande del embrión. La solución inyectable debe ser visible si la inyección fue exitosa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Cuidados posteriores a la inyección . (A) Una vez que se hayan inyectado todos los embriones en un cubreobjetos, el cubreobjetos debe colocarse en una placa de Petri fresca que contenga un 1% de agarosa. (B) La placa de Petri con el cubreobjetos se puede mantener en una cámara de humedad (como la que se muestra) hasta que los embriones eclosionen. Haga clic aquí para ver una versión más grande de esta figura.
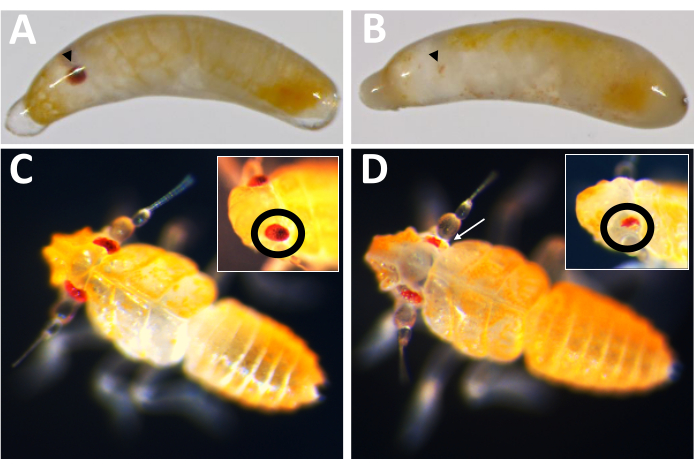
Figura 10: Fenotipo knockout de Pmw . (A) Control de la misma edad y (B) embriones knockout de Pmw , con ojos en desarrollo indicados por puntas de flecha negras. El embrión en B es mosaico, ya que se puede ver una pequeña franja de pigmentación. (C) Control de la misma edad y (D) crías knockout Pmw , con recuadros que muestran un ángulo diferente en los ojos. La cría en D también es mosaico. Una flecha blanca apunta a un área en la imagen principal que muestra pérdida de pigmentación. Haga clic aquí para ver una versión más grande de esta figura.
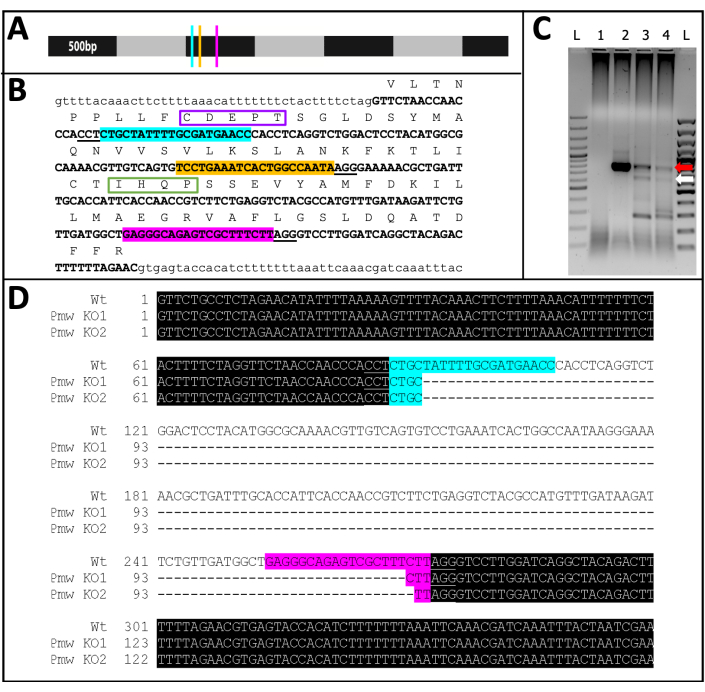
Figura 11: Secuencia de eliminación de PMW . (A) Modelo a escala del ARNm de Pmw , marcado en incrementos de 500 pb, con ubicaciones de sitios de unión de ARNg indicadas: G1, azul; G2, amarillo; G3, rosa. Cualquier mutación de cambio de marco generada en este punto interrumpirá la mayor parte del producto de traducción. (B) Contexto genómico de sitios de ARNg, todo en un exón (texto en mayúscula en negrita). Los sitios de enlace de guía se resaltan en los mismos colores que A y los PAM están subrayados. El lapso es ~ 300 pb. La traducción en el marco del exón se muestra arriba, como abreviaturas de una sola letra en texto mayúscula. Se marcan dos motivos específicos para los transportadores de pigmento ocular. El motivo CDEPT del dominio funcional Walker B está encuadrado en púrpura, y el motivo IHQP del dominio H-loop está encuadrado en verde. Ambos dominios son críticos para la función del transportador ATP. (C) La región objetivo de Pmw se amplificó utilizando dos rondas de PCR. El producto de segunda ronda se examinó en un gel en busca de evidencia de cambio de tamaño debido a la eliminación exitosa de la región entre las guías. Carriles: L = escalera de 100 pb; 1 = control de agua por PCR; 2 = Huevos con inyección tampón; 3-4 = dos juegos separados de huevos inyectados con una mezcla de tres guías. Solo los embriones que recibieron la mezcla de tres guías produjeron tanto la banda WT (flecha roja) como la banda resultante de una escisión completa (flecha blanca). (D) Para confirmar la identidad de la banda inferior (flecha blanca), este ADN fue purificado, clonado y secuenciado. La línea superior es la secuencia de tipo salvaje. Las otras dos líneas son secuencias de dos clones. Tres clones adicionales coincidían con la secuencia inferior. El resaltado azul indica el sitio de enlace de la Guía 1, mientras que el resaltado rosa indica el sitio de enlace de la Guía 3. En ambos alelos, se ha eliminado toda la región entre estos dos sitios guía. Abreviaturas: Pmw = gen blanco Peregrinus maidis ; ARNg = ARN guía; PAM = motivo adyacente protoespaciador; ATP = trifosfato de adenosina; PCR = reacción en cadena de la polimerasa; WT = tipo salvaje; KO = nocaut. Haga clic aquí para ver una versión más grande de esta figura.
| Poner | # de tazas | # de hembras en cada taza | # de huevos | Total # de huevos | |||||||
| Día 2 | Día 3 | Día 4 | Día 5 | Día 6 | Día 7 | Día 8 | Día 9 | ||||
| 1 | 10 | 15 | 0 | 26 | 166 | 355 | 530 | 193 | 91 | 37 | 1398 |
| 2 | 15 | 15 | 22 | 238 | 489 | 699 | 520 | 379 | 203 | 58 | 2608 |
| 3 | 8 | 15 | 0 | 57 | 230 | 190 | 116 | 80 | 34 | 1 | 708 |
| 4 | 10 | 15 | 0 | 226 | 446 | 519 | 301 | 179 | 24 | 15 | 1710 |
| Total | 43 | 15 | 23 | 547 | 1331 | 1763 | 1467 | 831 | 352 | 111 | 6483 |
Tabla 1: Colecciones representativas de huevos de ambiente de oviposición artificial. Se muestran los datos de cuatro juegos de tazas de recolección de huevos, con recuentos de huevos que comienzan el segundo día después de la configuración y se extienden hasta el noveno día.
| Tratamiento de inyección | Total inyectado | Total Desarrollado | Total de eclosiones | Tasa de desarrollo (%) | Tasa de eclosión (%) |
| Búfer | 39 | 20 | 12 | 51 | 31 |
| Cas9 | 39 | 24 | 14 | 61 | 36 |
| ARNg Cas9 +Pmw | 121 | 71 | 28 | 59 | 28 |
Tabla 2: Tasas de supervivencia y knockout de inyecciones de 3 mezclas de inyección diferentes.
Discusión
Calidad de la puesta de huevos y nutrición
Recientemente, los investigadores que trabajan con una especie relacionada, Nilaparvata lugens, obtuvieron los huevos que usaron para microinyecciones directamente de la hoja, manteniendo los huevos inyectados en el tejido de la hoja hasta que eclosionaron17. Si bien este método basado en hojas proporcionó un entorno más natural para el desarrollo embrionario, también aumentó las posibilidades de infecciones y daños en los huevos durante el proceso de eliminación. El sistema de oviposición artificial presentado aquí proporciona un ambiente más uniforme y reduce las posibilidades de daño a los huevos por la manipulación. Al instalar las copas de oviposición el viernes, la mayoría de los huevos ovipositos se recolectaron durante una semana de trabajo típica, en beneficio de quienes realizan el trabajo de microinyección. Una advertencia a este método, sin embargo, es que la falta de nutrientes en la dieta de solución de sacarosa al 10% eventualmente afectará la salud de los insectos, y las hembras en las copas generalmente comienzan a morir después de solo 10 días. La calidad del huevo también comienza a disminuir después de 6 días, como lo demuestra un aumento en los huevos muertos o de aspecto poco saludable. Como resultado, es importante ser selectivo de los huevos utilizados para microinyecciones y no mantener a las hembras después del día 6.
Tasa de supervivencia y humedad
Dos factores parecen ser críticos para la supervivencia embrionaria a través del proceso de microinyección. El aspecto más desafiante del manejo de embriones de P. maidis es evitar que se desecen después de la extracción del medio de oviposición y durante la microinyección. Como los huevos generalmente se ponen dentro del tejido vegetal, carecen de una cáscara adecuada para prevenir la deshidratación. Incluso en la campana humidificada se perdieron juegos enteros de huevos debido a la desecación. Sin embargo, una humedad excesivamente alta también podría afectar las microinyecciones si se acumula agua en la cinta de doble cara o en el endoscopio. Desafortunadamente, la deshidratación del huevo generalmente no era fácil de notar durante el proceso de microinyección, y con frecuencia parecían normales hasta 2 o 3 días después, cuando se volvieron completamente transparentes, sin mostrar signos de desarrollo.
La calidad de la aguja también parece desempeñar un papel importante en la supervivencia. La aguja debe ser biselada para minimizar el daño innecesario al huevo. Cuando la aguja está bloqueada, el uso de la función de limpieza en el inyector mientras se acaricia suavemente la punta de la aguja con un pincel humedecido (ver paso 4.7) normalmente devuelve la aguja a un estado funcional. En cualquier caso, se recomienda colocar solo pequeñas cantidades de solución inyectable (~0.25 μL) en cada aguja y cambiar a una aguja nueva cada pocos portaobjetos (~50-60 huevos) para garantizar que la calidad de la aguja se mantenga durante todo el proceso de inyección.
Generación exitosa de un fenotipo knockout
Para transformar con éxito las células germinales, las microinyecciones embrionarias generalmente deben realizarse lo antes posible antes de la celularización. Dependiendo de la especie de insecto, la ventana de tiempo para completar las microinyecciones varía de solo un par de horas hasta un día completo14,15,20. Todavía no está claro cuándo los embriones de P. maidis se someten a celularización. El knockout mediado por Cas9 se probó en embriones tan jóvenes como 4 h después de la puesta de huevos (pel) hasta 16 h pel, y los fenotipos esperados se observaron en todos los experimentos, lo que sugiere que todas las microinyecciones se realizaron dentro de la ventana de precelurización.
El ortólogo de P. maidis del gen del color de ojos, blanco, fue seleccionado porque se esperaba que el fenotipo knockout fuera fácil de detectar en inyectores debido a su naturaleza autónoma celular. De hecho, como era de esperar, tanto los knockouts en mosaico como los totales fueron claramente identificables entre los embriones que recibieron la mezcla de inyección que contenía Cas9 y ARN guía. Desafortunadamente, ningún inyectado con nocaut completo eclosionó, y un apareamiento masivo de inyectados sobrevivientes no logró generar progenie de ojos blancos. Sin embargo, más tarde se generó con éxito una línea mutante dirigida a un gen diferente (Klobasa et al., en progreso). Esto sugeriría que el fracaso para establecer una línea mutante blanca es más probable debido a efectos fuera del objetivo (es decir, Cas9 cortando regiones importantes en otras partes del genoma) generando una mutación letal estrechamente vinculada, o a un papel crítico imprevisto para el blanco en P. maidis.
Los datos fenotípicos y moleculares (Figura 8 y Figura 9) afirman que se creó un knockout significativo en el locus blanco en una muestra de embriones inyectados, lo que resultaría en la pérdida total de la función génica. Además, aunque las mutaciones en blanco son viables en algunas especies, existe un precedente de reducción de la actividad blanca que es perjudicial21,22. Dicho esto, los efectos fuera del objetivo no se pueden descartar por completo. La predicción de posibles objetivos fuera de los objetivos requiere datos precisos de la secuencia del genoma23, lo que el estado actual de los recursos genómicos en P. maidis hace imposible de hacer en este momento. En cualquier caso, con estos nuevos métodos, las pruebas de otros genes objetivo se pueden hacer con confianza, incluso avanzando hacia una transgénesis más tradicional en un esfuerzo por traer nuevas herramientas genéticas a esta plaga perniciosa.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El Departamento de Entomología y Fitopatología de la Universidad Estatal de Carolina del Norte es parte de un equipo que apoya el Programa de Aliados de Insectos de DARPA. Los puntos de vista, opiniones y / o hallazgos expresados son los de los autores y no deben interpretarse como representativos de los puntos de vista o políticas oficiales del Departamento de Defensa o del Gobierno de los Estados Unidos. Los autores declaran que no hay intereses contrapuestos. MDL, DR y AEW concibieron el proyecto y proporcionaron fondos para la adquisición, administración del proyecto y recursos. FC, WK, NG y MDL concibieron y diseñaron los experimentos de microinyección; OH concibió y diseñó el método de puesta de huevos. FC y WK realizaron los experimentos; FC y WK analizaron los resultados; y FC, WK, NG y MDL escribieron el manuscrito. Los autores desean ofrecer un agradecimiento especial a Kyle Sozanski y Victoria Barnett por su ayuda en el mantenimiento de las colonias de P. maidis.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 oz Containers | Dart | P100N | Adult container for egg-laying setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-103 | Serves as collection tube on vacuum aspirator setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-106 | For making 10% sucorose solution and for holding adults when chilling before screening |
| Aspirator | Bioquip | 1135A | For handling planthoppers |
| Vacuum Aspirator | Fischer Technical | LAV-3 | Vacuum for aspirating larger numbers of insects |
| Blue Spectrum LED Lights | Home Depot | GLP24FS/19W/LED | Grow lights for potted corn plants hoppers are feeding on |
| Cas9 | TrueCut Cas9 Protein v2 | A36498 | Endonuclease for cutting planthopper genes |
| Clear Vinyl Tubing | Home Depot | 3/8 in. I.D. x 1/2 in. O.D. x 10 ft. | Connects collection tube to pump on vacuum aspirator setup |
| Corn planthoppers | North Carolina State University | N/A | Request from Dr. Anna Whitfield's lab |
| Cotton balls | Genessee | 51-101 | Serves as a filter/insect catcher in collection tube on vacuum aspirator setup |
| Double sided tape | Scotch Double Sided Tape | NA | Holding eggs for microinjection |
| Early Sunglow corn | Park Seed Company | 05093-PK-N | Corn for rearing planthoppers |
| epTIPS Microloader Tips | Eppendorf | C2554691 | Backfilling needle loading tips |
| Femtojet Microinjection System | Eppendorf | 5247 | Controls injection pressure (12-20 psi, depending on needle bore size) |
| Nutri-Fly Drosophila Agar | Genessee | 66-103 | Substrate for everything except egg-laying dish |
| Fine forceps | Bioquip | 4731 | Egg handling |
| General Purpose LE Agarose | Apex | 20-102 | Substrate inn egg-laying dish (oviposition medium) |
| Guide RNA 1 - GGUUCAUCGCAAAAUAGCAG | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 2 - UCUGAAAUCACUGGCCAAUA | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 3 - GAGGGCAGAGUCGCUUUCUU | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Humidifyer | Homedics | UHE-CM45 | For providing humidity in humidified hood |
| Humidity chamber | Billups-Rothenberg | MIC-101 | For holding injected embryos until hatching |
| Insect rearing cages | Bioquip (special order) | Close to 1450 L (has plastic front and mesh fabric sides) | Cage for planthoppers on corn |
| Laser-based Micropipiette Puller | Sutter Instruments | P-2000/G | For making injection needles / Heat = 700, FIL = 4, VEL = 40, DEL = 170, PUL = 160 |
| Leica M165 FC Fluorescence Stereomicroscope | Leica | M165 FC | Planthopper screening |
| Microinjection Scope | Leica | MZ12-5 | Microinjection scope outfited with an XY stage |
| Micromanipulator | Narishige | MN-151 | For positioning microinjection needle |
| Micropipette beveler | Sutter Instruments | FG-BV10-D | For beveling injection needles / Used 'fine' graded plate at 20° angle |
| Microscope Stage | AmScope | GT100 X-Y Gliding Table | For positioning and moving embryos under microscope |
| Miniature Paint Brush | Testor #2 8733 | Sold in 3 pack 281206 | Fine paintbrushes for embryo handling |
| Needle Holder | Narishige | HI-7 | For holding the microinjection needle |
| Percival Incubator | Percival | I41VLH3C8 | Rearing injectees until hatch |
| Petri Dishes (100 x 15 mm) | VWR | 89038-968 | Making agar dish for egg-lay |
| pGEM-T Easy Vector System I cloning kit | Promega | A1360 | Cloning Pm white target site |
| Phenol Red | Sigma | 143-78-8 | Microinjection buffer |
| Plain Microscope Slides or coverslip | Fisher Scientific | 12-549-3 | Hold eggs for microinjection |
| Plasmid DNA Midi Kit | Zymo | D4200 | Purification of injection-ready plasmid DNAs |
| Plastic paraffin film | Pechiney Plastic Packaging | PM-996 | Roll size 4 in. x 125 ft |
| Plastic wrap | Glad ClingWrap Plastic Wrap | NA | Wrap the entire egg-laying chamber |
| Primer - PmW CRISPR check F1 - AAGGAATTTCTGGAGGTGAAA | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R1 - GATTCCTCGCTGTTGGGT | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check F3 - TCACAGACCCTGGTGCTAATC | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R3 - GTCCACAATCCACACTTCTGA | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Quartz capillaries | Sutter Instruments | QF100-50-10 | For making microinjection needles / O.D. 1 mm, I.D. 0.7 mm, 10 cm length |
| Screen (White Organza Fabric) | Joann Fabrics | 16023889 | For covering the adult container |
| Sparkleen | Fisher Scientific | 04-320-4 | Wash dishes |
| Sucrose | Fisher Scientific | BP220-1 | To make 10% sucorose solution |
Referencias
- Namba, R., Higa, S. Y. Host plant studies of the corn planthopper, Peregrinus maidis (Ashmead) in Hawaii. Proceedings of the Hawaiian Entomological Society. 21, 105-108 (1971).
- Singh, B. U., Seetharama, N. Host plant interactions of the corn planthopper, Peregrinus maidis Ashm.(Homoptera: Delphacidae) in maize and sorghum agroecosystems. Arthropod-Plant Interactions. 2 (3), 163-196 (2008).
- Tsai, J. Occurrence of a corn disease in Florida transmitted by Peregrinus maidis. Plant Disease Reporter. 59 (10), 830-833 (1975).
- Chelliah, S., Basheer, M. Biological studies of Peregrinus maidis (Ashmead) (Araeopidae: Homoptera) on sorghum. Indian Journal of Entomology. 27, 466-471 (1965).
- Lastra, J., Esparza, J. Multiplication of vesicular stomatitis virus in the leafhopper Peregrinus maidis (Ashm.), a vector of a plant rhabdovirus. Journal of General Virology. 32 (1), 139-142 (1976).
- Nault, L. R., Ammar, E. -. D. Leafhopper and planthopper transmission of plant viruses. Annual Review of Entomology. 34 (1), 503-529 (1989).
- Ammar, E. -. D., Tsai, C. -. W., Whitfield, A. E., Redinbaugh, M. G., Hogenhout, S. A. Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annual Review of Entomology. 54, 447-468 (2009).
- Barandoc-Alviar, K., Ramirez, G. M., Rotenberg, D., Whitfield, A. E. Analysis of acquisition and titer of Maize mosaic rhabdovirus in its vector, Peregrinus maidis (Hemiptera: Delphacidae). Journal of Insect Science. 16 (1), 14 (2016).
- Tsai, J. H., Steinberg, B., Falk, B. W. Effectiveness and residual effects of seven insecticides on Dalbulus maidis (Homoptera: Cicadellidae) and Peregrinus maidis (Homoptera: Delphacidae). Journal of Entomological Science. 25 (1), 106-111 (1990).
- Yao, J., Rotenberg, D., Afsharifar, A., Barandoc-Alviar, K., Whitfield, A. E. Development of RNAi methods for Peregrinus maidis, the corn planthopper. PloS One. 8 (8), 70243 (2013).
- Esvelt, K. M., Smidler, A. L., Catteruccia, F., Church, G. M. Emerging technology: concerning RNA-guided gene drives for the alteration of wild populations. Elife. 3, 03401 (2014).
- Gantz, V. M., Bier, E. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348 (6233), 442-444 (2015).
- Yao, J., Rotenberg, D., Whitfield, A. E. Delivery of maize mosaic virus to planthopper vectors by microinjection increases infection efficiency and facilitates functional genomics experiments in the vector. Journal of Virological Methods. 270, 153-162 (2019).
- Kimelman, D., Martin, B. L. Anterior-posterior patterning in early development: three strategies. Wiley Interdisciplinary Reviews: Developmental Biology. 1 (2), 253-266 (2012).
- Mito, T., Nakamura, T., Noji, S. Evolution of insect development: to the hemimetabolous paradigm. Current Opinion in Genetics & Development. 20 (4), 355-361 (2010).
- Grubbs, N., Haas, S., Beeman, R. W., Lorenzen, M. D. The ABCs of eye color in Tribolium castaneum: orthologs of the Drosophila white, scarlet, and brown Genes. Genetics. 199 (3), 749-759 (2015).
- Xue, W. H., et al. CRISPR/Cas9-mediated knockout of two eye pigmentation genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae). Insect Biochemistry and Molecular Biology. 93, 19-26 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94 (3), 441-448 (1975).
- Chu, F. C., Wu, P. S., Pinzi, S., Grubbs, N., Lorenzen, M. D. Microinjection of Western Corn Rootworm, Diabrotica virgifera virgifera, embryos for germline transformation, or CRISPR/Cas9 genome editing. Journal of Visualized Experiments: JoVE. (134), e57497 (2018).
- Brent, C. S., Hull, J. J. RNA interference-mediated knockdown of eye coloration genes in the western tarnished plant bug (Lygus hesperus Knight). Archives of Insect Biochemistry and Physiology. 100 (2), 21527 (2019).
- Khan, S. A., Reichelt, M., Heckel, D. G. Functional analysis of the ABCs of eye color in Helicoverpa armigera with CRISPR/Cas9-induced mutations. Scientific Reports. 7 (1), 1-14 (2017).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados