Method Article
Dejeneratif Retina Hastalıkları için İnsan Dışı Primat Modelinde Retina Pigment Epitel Transplantasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
İnsan olmayan primat (NHP), anatomik ve genetik benzerlikler nedeniyle insan retina hücresel terapötiklerini incelemek için ideal bir modeldir. Bu makalede, NHP gözündeki retina pigment epitel hücrelerinin submaküler nakli için bir yöntem ve makula manipülasyonu ile ilişkili intraoperatif komplikasyonları önleme stratejileri açıklanmaktadır.
Özet
Retina pigment epitel (RPE) transplantasyonu kalıtsal ve edinilmiş retina dejeneratif hastalıkların tedavisi için büyük umut vaat etmektedir. Bu durumlar arasında retinitis pigmentosa (RP) ve coğrafi atrofi (GA) gibi yaşa bağlı makula dejenerasyonu (AMD) ileri formları bulunur. Birlikte, bu bozukluklar küresel olarak şu anda tedavi edilemeyen körlüğün önemli bir bölümünü temsil eder. Karşılanmayan bu tıbbi ihtiyaçlar, RPE değiştirme yöntemlerinin geliştirilmesine akademik ilginin artmasına neden oldu. Terapötiklerin preklinik testleri için yaygın olarak kullanılan hayvan modelleri arasında, insan olmayan primat (NHP) makulaya sahip tek hayvan modelidir. Bu anatomik benzerliği insan gözü ile paylaştığı için NHP gözü, RPE hücre tedavisi gibi ileri tedavi tıbbi ürünlerinin (ATMP' ler) geliştirilmesi için önemli ve uygun bir preklinik hayvan modelidir.
Bu makalede, bir polietilen tereftalat (PET) hücre taşıyıcısı üzerinde kültürlenen bir RPE monolayerinin, makulanın altında, bağışıklığı baskılanmış NHP'lerde cerrahi olarak oluşturulan bir RPE yarasına altmaküler nakli için bir yöntem açıklanmaktadır. Makulanın fovea-merkezi avasküler kısmı-transplantasyon sırasında en büyük mekanik zayıflığın yaşandığı yerdir. foveal travma, ilk subretinal sıvı enjeksiyonu retina üzerinde aşırı bir güç oluşturursa ortaya çıkacaktır. Bu nedenle, perflorokarbon sıvı (PFCL) vitreus tamponade altında yavaş enjeksiyon, retinal bleb oluşturmak için düşük göz içi basıncı (Gİb) ayarlarında çift delikli subretinal enjeksiyon kanül ile önerilir.
Parafoveal RPE-fotoreceptör yapışıklıklarını serbest bırakmak için intravitreal plazminojen enjeksiyon ile ön işlem de önerilir. Bu kombine stratejiler, geleneksel tekniklerle karşılaştırıldığında foveal gözyaşı olasılığını azaltabilir. NHP, RPE hücre tedavisi gelişiminin preklinik aşamasında önemli bir hayvan modelidir. Bu protokol, NHP gözünde RPE hücresel tedavisinin sunumuyla ilgili teknik zorlukları ele almaktadır.
Giriş
RPE transplantasyonu kalıtsal ve edinilmiş retina dejeneratif hastalıkların tedavisi için büyük umut vaat etmektedir. Bu durumlar retinitis pigmentosa (RP, rod-koni distrofisi) ve GA gibi amd ileri formlarını içerir. AMD'nin ileri aşamaları neovasküler AMD (nAMD) ve GA olarak kategorize edilir. NAMD için anti-vasküler endotel büyüme faktörü (anti-VEGF) enjeksiyonları gibi etkili tedavi seçenekleri bulunurken, GA'lı hastaların tedavi seçenekleri sınırlıdır. RP, ilerleyici retina fotoreceptör dejenerasyonu ile karakterize kalıtsal retina bozukluklarının son derece heterojen bir grubudur. Bazı hastalarda, etken genetik defekt fotoreceptörler yerine RPE içinde bulunur; bu nedenle, gen tedavisi mümkün değilse RPE replasman tedavisi alternatif bir strateji olabilir.
Bu durumlar için etkili tedaviler geliştirmeye önemli bir ilgi vardır. Özellikle RPE transplantasyonu potansiyel bir terapötik yaklaşım olarak ilgi görmeye devam etmektedir3,4,5,6,7,8. RPE transplantasyonu ile ilgili ilk raporlar 1980'lerde ortaya çıktığından beri, alan çeşitli RPE hücre kaynaklarını, doğum stratejilerini ve deneysel hastalık ve transplantasyon modellerini içerecek şekilde genişlemiştir10,11,12,13,14. Çeşitli hayvan modelleri arasında, sadece NHP'de insanlarla paylaşılan retinanın arka kutbunda anatomik bir uzmanlık olan 'fovea centralis' ile bir 'makula lutea' vardır. Fovea, yüksek çözünürlüklü merkezi görüş sağlayan çok yüksek yoğunluklu koni fotoreceptörleri içerir15. NHP ayrıca insanlara kıyasla benzer bir genomik ve proteomik makyaj16'ya sahiptir. Bu benzerlikler onu insan retinasını etkileyen oküler hastalıkların incelenmesi için önemli ve uygun bir hayvan modeli haline getirmektedir17,18.
Bu makalede, pet hücre taşıyıcısı tarafından desteklenen bir RPE ksinograftının immünsüprese NHP'lerde submaküler nakli için bir yöntem açıklanmaktadır. Tavşanlarda subretinal RPE transplantasyonu için transvitreal bir teknik daha önceki bir el yazmasında tanımlanmıştır19. Bununla birlikte, NHP'lerde, fovea varlığı intraoperatif manipülasyon sırasında özel bakım gerektirir20. Özellikle, subretinal sıvı enjeksiyon yöntemleri retina üzerinde aşırı bir güç oluşturuyorsa foveal yırtılma riski yüksektir20. Bu nedenle, bu makalenin odak noktası, NHP'de yanlışlıkla foveal travma riskini azaltmaya yönelik stratejilerdir.
Bunlar arasında parafoveal yapışıklıkların salınımı için preoperatif intravitreal plazminojen enjeksiyonu ve foveal anatominin gerçek zamanlı görselleştirilmesi için intraoperatif olarak cerrahi mikroskop entegre optik koherens tomografisi (miOCT) yer almaktadır. Düşük GOP ayarları altında göz içi PFCL tampona sahip özel yapım 25/41 G çift delikli alt sahra kanül, daha kontrollü bir foveal kopuş sürecine izin vermek için önerilir. Ayrıca, nakledilen RPE hücreleri ve konak fotoreceptörleri arasında daha iyi entegrasyon sağlamak için implantasyondan önce lokal RPE'nin cerrahi olarak çıkarılması önerilir. Son olarak, RPE xenograft transplantasyon sonrası sağkalını iyileştirmek için NHP modelleri için peri ve postoperatif sistemik immünosupresyon protokolü tanımlanmıştır11,21.
Protokol
NOT: Tüm hayvan deneyleri Oftalmik ve Görme Araştırmalarında Hayvanların Kullanımı için Görme ve Oftalmoloji Araştırma Derneği (ARVO) uyarınca yapılmıştır. Etik onayı, SingHealth, Singapur Kurumsal Hayvan Bakım ve Kullanım Komitesi'nden alınmıştır. Hayvanlar, Laboratuvar Hayvan Bakımını Değerlendirme ve Akreditasyon Derneği (AAALAC) tarafından onaylanan SingHealth Deneysel Tıp Merkezi'nde barındırıldı. Bu onay, tüm hayvan deneylerinin Singapur Tarım-Gıda ve Veterinerlik Otoritesi tarafından belirlenen Laboratuvar Hayvanları Araştırma Ulusal Danışma Komitesi yönergelerinin standartlarına uygun olduğunu vurgulamaktadır. Aşağıdaki deneysel protokol, 6 Macaca fasicularis'in (4 erkek ve 2 kadın, 4 ila 6 yaş, 2,8 ila 4,0 kg) 6 gözünde yapılan deneylere dayanarak oluşturulmuştur .
1. NHP modelinde immünosupresyon elde etmek
- İmmünsüpresyona ameliyattan 7 gün önce başlayın ve takip süresi boyunca immünsüpresyona devam edin.
- Doğru ilaç dozajı sağlamak için sistemik immünosupresyon uygulamasından önce NHP'yi tartın. Hayvan temel ve bundan sonra haftalık olarak tartılmıştır.
- Sistemik immünosupresyon elde etmek için oral sirolimus, doksiksin ve minosiklin kullanın.
- 2 mg oral sirolimus yükleme dozu ve ardından günlük 1 mg bakım dozlama yapın. Uygulamadan önce temel kan sirolimus seviyesini elde edin ve takip süresi boyunca bunu izleyin. Yeterli immünosupresyon için en az 5 μg/L konsantrasyon sağlayın.
NOT: Sirolimus dozu kiloya uyarlanmış değildir. - Günde iki kez günde 7,5 mg / kg oral doksiklin dozu uygulayın.
- Günde iki kez günde 7,5 mg / kg oral minosiklin dozu uygulayın.
- 2 mg oral sirolimus yükleme dozu ve ardından günlük 1 mg bakım dozlama yapın. Uygulamadan önce temel kan sirolimus seviyesini elde edin ve takip süresi boyunca bunu izleyin. Yeterli immünosupresyon için en az 5 μg/L konsantrasyon sağlayın.
- İmmünsüpresyon sırasında, tüm NHP'leri olumsuz sistemik etkiler için izleyin. Önemli vücut kilo kaybı (%>10), iştah ve su tüketiminda azalma, boş saç dökülmesi ve saldırganlık ve uyuşukluk gibi anormal davranışlar arayın. Değerlendirmeler 3, 14 ve 1.
2. Cihaz sterilizasyonu
- Damıtılmış su kullanarak cerrahi aletleri durulayın.
- Aletleri 500 mL damıtılmış su ve 2 mL alet dezenfektanı ile dolu ultrasonik bir banyoya yerleştirin. Ultrasonik banyonun süpürme işlevini kullanarak aletleri 15 dakika boyunca temizleyin.
- Aletleri ultrasonik banyodan çıkarın. Her durulamada 5 dakika boyunca damıtılmış su ile iki kez iyice durulayın. Durulamadan sonra aletleri havayla kurulayın.
- Enstrümanları bir enstrüman kutusuna yerleştirin. Evrensel program ayarını kullanarak kutuyu otoklavlayın (50 dakika boyunca 134 °C'de aletlerin sterilizasyonu: otomatik kapanma için 30 dk, kurutma için 20 dk).
3. Koruyucu içermeyen triamsinolon hazırlanması (40 mg/mL)
- 1 mL şırıng kullanarak, 1 mL triamsinolon çözeltisini (10 mg/ mL) çekin. 15 mL konik bir tüpe aktarın ve 4 mL steril dengeli tuz çözeltisi (BSS) ile karıştırın.
- Çözeltiyi 5 dakika boyunca 120 × g'da santrifüj edin. Tüm triamsinolon parçacıklarının konik tüpün dibinde olduğundan emin olun. Konik tüpten süpernatant (BSS) atın.
- Triamsinolon parçacıklarını konik tüpte 5 mL steril BSS ile yeniden askıya alın. Çözeltiyi 5 dakika boyunca 120 × g'da santrifüj edin. Üsttant'ı tekrar atın.
- Triamsinolon parçacıklarının BSS (3x) ile yıkanmasını tamamlamak için 3.3 adımını tekrarlayın.
- 40 mg/mL konsantrasyon elde etmek için triamsinolon parçacıklarını 0,25 mL steril BSS ile yeniden askıya alın.
- Yeniden askıya alınan triamsinolonu (40 mg/mL) yeni bir 1 mL şırıng ile aspire edin. 25 G künt uçlu flüt iğnesi takın ve triamsinolon çözeltisi ile şırıngayı intraoperatif kullanıma hazır tutun.
4. NHP gözlerinin intravitreal plazminojen (0,25 μg/μL) ile ön işlemden önce
- Ameliyattan bir hafta önce, intravitreal enjeksiyon (20 μL) maymun plazminojeni (0.25 μg/ μL) sürün.
- İşlemden önce NHP'yi ketamin intramüsküler enjeksiyonu (10-20 mg/kg BW) ve deri altı atropin enjeksiyonu (0,05 mg/kg BW) ile yatıştırın. Lokal anestezi için tetrasain damlaları sürün.
- intravitreal enjeksiyondan önce, periorbital bölgeyi% 10 povidon-iyot ile dezenfekte edin. NHP'nin konjonktival fornices'ine% 5 povidon-iyot uygulayarak gözü dezenfekte edin. Steril BSS ile iyice durulamadan önce çözeltinin en az 1 dakika fornices'te kaldığından emin olun.
- Önceden seyreltilmiş maymun plazminojenini (0,25 μg/μL) şişeden aspire etmek için 250 μL şırınna kullanın. Şırıngaya 30 G'lik bir iğne takın ve maymun plazminojenini intravitreal uygulama için hazır tutun.
- Gözdeki enjeksiyon bölgesini tanımlamak için bir çift kaliper kullanın. İntravitreal enjeksiyonu uzuvdan 3 mm uzağa uygulayın.
- Enjeksiyona dünyanın merkezine doğru yönlendirilen iğne ile devam edin. İğnenin küreden çıkarılmasından sonra, enjeksiyon bölgesini tamponlamak ve göz içi içeriğinin reflüsünü önlemek için bir pamuk aplikatör çubuğu kullanın.
- Hemen ameliyat sonrası oküler yüzey tahrişini azaltmak için bir yağlayıcı jel veya merhem sunun.
5. Cerrahi masa ve ekipman kurulumu
- Steril bir alan oluşturun. Steril alandayken, her zaman cerrahi önlük, maske ve saç örtüsü giyin.
- Vitreus intraoperatif görselleştirmesi için koruyucu içermeyen triamsinolon (40 mg/mL) hazırlayın (bkz. bölüm 3). Steril BSS'yi 10 mL şırınna ve yağı 5 mL şırınna hazırlayın. Onları bir örtüye yerleştirin.
- 3-0 ipek, 7-0 vicryl dikişler, pamuk aplikatör çubukları, yara kapatma şeritleri ve avize endoilluminasyon fiber tel dahil olmak üzere diğer aletleri bir örtü üzerinde hazır tutun.
- Yüksek hızlı vitrector, Venturi kaseti ve 25 G avize endokilluminatör dahil olmak üzere vitrektomi setini steril teknik kullanarak vitrektomi makinesine bağlayın.
- 500 mL oftalmik sınıf BSS şişesi açın ve üreticinin talimatlarına göre Venturi kasetine bağlayın. Sistemi astarlama işlemine devam edin.
- MiOCT/cerrahi mikroskobu aç. Arka segment cerrahisi ve aydınlatma için cerrahi mikroskobun önceden ayarlanmış konfigürasyonlarını seçin. Kimlik, cinsiyet, hayvan gözünün yanallığı ve prosedürün adı dahil olmak üzere prosedürün ayrıntılarını girin.
- Temassız, geniş açılı, 128 derecelik bir fundus lens tak.
- Cerrahi mikroskop/miOCT üzerine steril tek kullanımlık el parçası kapakları takın. Ayak pedalını kullanarak mikroskop konumunu ve netlemini ayarlayın. Ameliyata devam edin.
6. Anestezinin hazırlanması ve hayvanın konumlandırılması (tercihen veteriner ekibi tarafından gerçekleştirilir)
- Kusma ve kusmayı önlemek için anestezinin indüksiyonu öncesinde NHP'nin en az 8 saat oruçlu olduğundan emin olun. Anestezinin indüksiyonu öncesi NHP'yi yatıştırın (sedasyon talimatları için 4.2. adıma bakın).
- Gözbebeği genişlemesini sağlamak için 5 dakika aralıklarla en az 3x% tropikamid ve% 2.5 fenilefrin damla damlaları uygulayın.
- Analjeziye ulaşmak için ameliyattan 30 dakika önce buprenorfin intramüsküler enjeksiyonu (0.005-0.03 mg/kg BW) sürün.
- NHP'yi genellikle 3-5 mm boyutunda bir endotrakeal tüple entübe edin. Entübasyon denerken, birkaç boyutun kullanılabilir olduğundan emin olun. Travmaya neden olmadan larinksten geçirilebilecek en büyük boyutu kullanın. Endotrakeal tüpün uygun yerleşimini sağlamak için uç gelgit CO2'yi ölçün.
- Genel anesteziyi teşvik etmek için endotrakeal tüpten% 2 izofluoran gazı verin. NHP'nin sesler ve dokunma da dahil olmak üzere çevredeki uyaranlara verdiği yanıtı değerlendirerek genel anestezi durumunu (dokunmaya yanıt verme eksikliği) onaylayın. Genel anestezi durumunu korumak için% 0.5-2 izofluoran gazı kullanın.
- Tüm ameliyat boyunca NHP elektrokardiyogramını, solunum hızını, kan basıncını ve oksijen doygunluğunu sürekli izleyin.
- NHP'yi cerrahi masaya, gözün cerrahi mikroskopa dik olacak şekilde yerleştirin. Anestezi sırasında göz yüzey tahrişini azaltmak için çalıştırılmamış bir yağlayıcı jel veya merhem göze sürtün.
- Enfeksiyon olasılığını azaltmak için kirpikleri makas kullanarak kesin.
- Periorbital bölgeyi% 10 povidon-iyot ile dezenfekte edin. NHP'nin konjonktival fornices'ine% 5 povidon-iyot uygulayarak gözü dezenfekte edin. Steril BSS ile iyice durulamadan önce çözeltinin en az 1 dakika fornices'te kaldığından emin olun.
- Steril bir örtü yerleştirin, böyle ki ön kesim açıklığı ameliyat olmak için gözün üzerine ortalanır. Gözü yapışkan bir cerrahi kesi örtüsü ile kapatın.
- Ameliyat olmak için göze lateral bir metotomi gerçekleştirin.
- Gözün görselleştirilmesi için göz kapaklarının yeterli açılmasını sağlamak için Lieberman spekulumunu takın.
7. Vitrektomi
NOT: PET-iskele RPE greftinin teslimi için alt alana erişmek için, bu protokol standart bir vitreoretinal cerrahi kurulum ve temassız, geniş açılı, 128 ° fundus lens kullanılarak gerçekleştirilecek 4 portlu (valfli) 25 G vitrektomi önermektedir. Protokol ayrıca foveal dekrenin indüksiyonu, RPE greftinin implantasyonu ve subretinal sıvı drenajı da dahil olmak üzere çeşitli kritik cerrahi adımlara rehberlik etmek için miOCT ile donatılmış bir cerrahi mikroskop kullanılmasını önermektedir.
- Bir çift vannas makası kullanarak konjonktivayı limbus yakınında keserek 360° konjonktival peritomi gerçekleştirin. Künt bir diseksiyon yaparak peritomiyi büyütin.
- 25 G mikrovitreoretinal bıçak kullanarak, sağ göz için saat 8'de veya sol göz için saat 4'te sklerotomi gerçekleştirin. Sklerotomiyi gözün limbusundan 3 mm uzakta gerçekleştirin.
- 7-0 vicryl dikiş kullanarak 25 G özel yan port-infüzyon kanül takın ve dikin. İntravitreal konumu onayladıktan sonra, BSS infüzyonunu başlatın ve sistemi 20 mmHg'lik bir Gİb koruyacak şekilde ayarlayın.
- 25 G düz kafa trochar kullanarak, adım 7.2'de olduğu gibi sağ göz için saat 2'de veya sol göz için saat 10'da sklerotomi gerçekleştirin.
- 25 G avize ışığını düz kafa trochar'ın içine yerleştirin ve yapışkan bantla sabitleyin. Işık kaynağını yaklaşık %60'a ayarlayın.
- Sağ göz için saat 10'da veya sol göz için saat 2'de 7.2 adımına benzer başka bir sklerotomi gerçekleştirin. Düğümleri takmadan sklerotomi etrafında U şeklinde vicryl 7-0 dikişleri yerleştirin. Vitrektomi kesici ucunu bu sklerotomiden geçirin.
- Giriş portlarının etrafındaki vitrektomiyi başlatın, ardından aşağıdaki ayarlarla kısa bir çekirdek vitrektomi yapın: dakikada maksimum 5000 kesim, 400 mmHg'de maksimum aspirasyon.
- Daha iyi vitreus görselleştirme için 20-50 μL triamsinolon (40 mg/mL) enjekte edin.
- Vitreus vücudu retinadan ayırarak arka vitreus dekolmanı (PVD) başlatın.
- PVD'nin hafifçe indüksiyonunu sağlamak için vitrektörü optik diskin üzerine yerleştirin. Vitrekörü herhangi bir kesmeye dahil olmadan sadece 400 mmHg maksimum ayarda aspirasyonda tutun.
- Gerekirse, diskin kenar boşluğundaki vitreusu manipüle etmek için 25 G göz içi forseps kullanarak, kopuşu kolaylaştırmak için vitreus korteksinde bir yırtık oluşturun.
NOT: Triamsinolon kristalleri retina yüzeyi üzerinde engelsiz süzülürse PVD başarılı olarak kabul edilir.
- Arka hyaloid zarı kesici ile açın ve kopuk vitreus eteğini vitreus tabanına kadar (retina ekvatorda) çıkarın. Retina yüzeyinde kalan triamsinolonları aspire edin.
8. miOCT güdümlü foveal müfreze
- Arka direği ön, orta periferik retinaya kadar örtmek için 1-2 mL PFCL enjekte edin.
- Subretinal enjeksiyonlu bir canül ile göze girin. Vitrektomi makinesinde Gİb'i 0-4 mmHg olarak ayarlayın (mükemmel su geçirmez sistem sağlayın; gerekirse dikişleri bağlantı noktalarının etrafına bağlayın).
- 25/41 G özelleştirilmiş çift delikli subretinal enjeksiyon cannula veya 250 μL şırınmaya bağlı 25/38 G alt enjeksiyonlu kanolü kullanarak, lokalize bir retina dekolmanını teşvik etmek için BSS'nin subretinal enjeksiyonu hafifçe gerçekleştirilir. Bleb foveayı geçtikten sonra enjeksiyonu durdurun. Ayrı bir yönden ikinci bir bleb oluşturun. Foveayı tamamen ayırmak için her iki lekeyi de birleştirin.
- Bleb oluşumunu görselleştirmek için miOCT işlevini etkinleştirin. Fovea'da görüntü elde etmek için çizgi ve küp taramalarının ayarlarla (512 x 128 piksel, tarama genişliği 4 mm) HD modunda olduğundan emin olun. Nöral retinanın foveadaki RPE katmanından tamamen kopuş için miOCT görüntüsünü gözlemleyin.
- Nakil için alt alana erişim sağlamak için bir çift dikey 25 G vitreoretinal makasla retinotomiyi 1,5 mm'ye büyütün.
9. Yerel RPE'nin kaldırılması
- Vitrektomi makinesinde Gİb'i 50 mmHg olarak ayarlayın.
- Fırçalanmış silikon uçlu bir kanonül kullanarak pfcl'yi aktif ekstrüzyon yoluyla çıkarın.
- Sklerotomiyi 20 G'lık bir aletin girişine izin vermek için 1,4 mm'lik bir kesi bıçağıyla uzatın.
- Özel bir 20 G genişletilebilir döngü cihazı kullanarak, submaküler ana bilgisayar RPE'yi çıkarmak için kazıyın. En az 2 x 3 mm ölçülerinde bir alanı kazıyın.
10. RPE hücre monolayer naklinin teslimi için atıcının yüklenmesi
- PET hücre taşıyıcılarına RPE kültürlerinden kesilmiş mermi şeklindeki greftin yüklenmesiyle ilgili genel talimatlar için önceki bir yayına bakın22.
11. miOCT güdümlü greft implantasyonu ve pozisyon ayarlaması
- Shooter cihazının ucunu 20 mmHg'lik bir Gİb'de sklerotomiden geçirin. Retina yüzeyinden oluşturulan retinotomi kenarı ile implantı subretinal boşluğa doğru enjekte edin.
- İmplantı Bruch'un zarını bakan hücre taşıyıcı tarafı ve fotoreceptörlere bakan RPE xenograft tarafı ile enjekte edin.
- İmplant konumunu görselleştirmek için miOCT işlevini etkinleştirin. İmplantın bruch'un alt alandaki zarında düz bir şekilde, sağlam bir retina ile dinlenerek olduğundan emin olun. Oluşturulan retinotomiden makul bir mesafe uzakta olduğundan ve retinotomi bölgesinde engel olmadığından emin olun.
- Maculanın altına iyi yerleştirildiğinden emin olmak için alt enjeksiyonlu kanonül veya 25 G kavisli göz içi makası ile implant pozisyonunu ayarlayın.
12. Subretinal sıvının miOCT güdümlü drenajı
- Fırçalanmış silikon uçlu bir kanolü kullanarak, sıvı-hava değişimi ve dikkatli bir subretinal sıvı drenajı gerçekleştirin. Bleb retina dekolmanı ve retinotomi kenar apsasyonundan nazik subretinal sıvı aspirasyonu dener.
- Retina implantın üzerine yeniden takılana kadar yeterli subretinal sıvı drenajının gerçek zamanlı görselleştirilmesi için miOCT işlevini etkinleştirin.
13. Operasyonu sonlandırmak
- Önceden yerleştirilmiş 7-0 vicryl dikişi kullanarak çalışma portu sklerotomisini kapatın. 25 G avize ve 25 G infüzyon kanülunu çıkarın. Bu sklerotomileri 7-0 vicryl dikiş ile kapatın.
- Dikişten önce saat 8 sklerotomisinde 0.05 ml intravitreal koruyucu serbest triamsinolonda (40 mg/ml) 2 mg kullanın.
- Gİb'in kabul edilebilir aralıkta olduğundan emin olmak için gözü palpate edin. Gerekirse filtrelenmiş havayı (veya BSS) 30 G iğne ile enjekte edin.
- Konjonktivayı 7-0 vicryl dikiş ve 5-0 prolen ile kaval kemiği ile dikin (10-14 gün sonra çıkarın).
14. Ameliyat sonrası hayvan bakımı
- Ameliyat sonrası NHP'i 1 saat boyunca yüzüstü yerleştirin. Bilinç geri gelene kadar hayvanı başıboş bırakmayın. Ameliyat sonrası süreçte bir veteriner hekim ve hayvan bakım teknisyeninin gözlem ve destek için hazır olduğundan emin olun.
- Topikal antibiyotik (tobramisin), steroid (deksametazon) merhem ve homatropin göz damlalarını ameliyat sonrası 5 gün boyunca günde iki kez uygulayın.
- Yeterli ağrı kontrolü için ameliyattan 6 saat sonra başka bir deri altı buprenorfin (0.005-0.03 mg/kg BW) enjeksiyonu uygular.
- NHP'yi diğer hayvanların şirketine sadece bilinci tamamen yerine geldiğinde iade edin.
- İşlemden sonra 3, 14 ve 1. İşlemden sonra her ay ERG gerçekleştirin. 14. günde cantomi için 5-0 prolene dikişleri multimodal görüntüleme için kullanılan sedasyon süresi ile eş zamanlı olarak çıkarın. Kalan dikişler, çıkarılmasını gerektirmeyen resorbable, 7-0 vicryl dikişlerdir.
15. Multimodal görüntüleme için postoperatif izleme yöntemleri
- NHP'ye bir gecede oruç tut. Görüntülemeden hemen önce NHP'yi yatıştırın (ilaç için adım 4.2'ye ve sedasyon için konsantrasyona bakın). Sedasyon göz hareketini durdurmak için yetersizse, genel anestezi kullanımını düşünün.
- Görüntülemeden önce gözbebeği genişlemesini elde etmek için %1 tropikamid ve %2,5 fenilefrin damlası uygulayın (bkz. adım 6.2).
- 55° alan lensi ve 30° alan lensi ile yüksek çözünürlüklü bir OCT makinesi kullanarak otofluoresans (AF), fundus floresan anjiyografi (FFA) ve optik tutarlılık tomografisi (OCT) gerçekleştirin.
- FFA için intravenöz %10 floresan (0,1 mL/kg BW) sürün. Erken faz görüntüsü elde etmek için, enjeksiyondan 30 s içinde bir görüntü yakalayın. Geç faz görüntüsü için, enjeksiyondan 5-10 dakika sonra bir görüntü yakalayın.
- FFA'nın erken ve geç aşamaları arasında fundus kamera kullanarak fundus fotoğrafçılığı gerçekleştirin.
16. Tam alan elektroretinogram (ERG) çalışmaları için postoperatif izleme yöntemleri
- NHP'leri bir gecede hızlandırın. ERG çalışmalarından önce NHP'yi yatıştırın (ilaç için adım 4.2'ye ve sedasyon için konsantrasyona bakın). ERG kayıtları boyunca, uygun olduğunda sedasyonu yeniden uygulayın.
- Multimodal görüntüleme ve ERG kayıtlarını en az 2-3 gün arayla ayırın.
- Yatıştırıldıktan sonra, ERG kaydından önce NHP'nin 30 dakika boyunca koyu renkli olarak uyarlandığından emin olun.
- Paslanmaz çelik deri altı iğne elektrotlarını sol ve sağ yanal kanthi (referans elektrotlar) ve NHP gövdesinin arkasına (yer elektrodu) yerleştirin. Erg kontakt lens elektrotlarını temas ve yapışıklıklara yardımcı olmak için vidisik jel kullanarak NHP korneasına yerleştirin.
- Tüm ERG testlerini Uluslararası Görme Klinik ElektrofizyolojiSi Derneği (ISCEV) tarafından önerilen insan protokollerine dayandırın 14. ERG kaydına scotopik koşullar altında başlayın ve dimmer yanıp sönmeleriyle başlayın. Önerilen interstimulus aralıkları için ISCEV önerilerine uyun.
- NHP'nin fotopik testten önce 10 dakika boyunca ışıkla uyarlanarak, arka plan gücü için standart ISCEV önerilerini kullanarak uyarlansın.
17. NHP Ötenazisi
- NHP'yi enükleasyon için ötenazi yapmak için, Amerikan Veteriner Hekimleri Birliği Ötanazi Paneli tarafından önerildiği gibi intravenöz sodyum pentobarbital (75 mg/ kg) uygulayın.
Sonuçlar
Multimodal görüntüleme yöntemleri (fundus fotoğrafçılığı, fundus otofluoresans görüntüleme (FAF), fundus floresan anjiyografi (FFA)-erken evre ve geç evre ve optik koherens tomografisi (OCT)) başarılı bir submaküler RPE greft naklinin özelliklerini vurgulamaktadır (Şekil 1). Fundus fotoğrafçılığı, RPE greft naklinin zaman içinde göç etmeden foveadaki konumunu gösterir. FAF görüntüleme, RPE grefti ile örtüşen hiper otofluoresansta (beyaz, yüksek yoğunluklu alanlarda gösterilmiştir) minimum değişiklik gösterir. Erken ve geç faz FFA, RPE greftini çevreleyen belirgin bir sızıntı (zamanla genişleyen beyaz, yüksek yoğunluklu alanlar tarafından gösterilmiştir) göstermez. 3. Gündeki ilk görüntüler, greft implantasyonundan önce doğal RPE'nin çıkarılması nedeniyle pencere kusurunu göstermektedir. Maküler OCT görüntüleri, zaman ilerledikçe RPE grefti üzerinde dış retina katmanlarının (özellikle fotoreceptör tabakası) korunmasını gösterir. Hematoksilin ve eozin lekeleme mikrotear kanıtı olmadan bozulmamış retina katmanları gösterir. Dış nükleer tabakanın greftin çevrelerinin üzerinde korunması, RPE hücrelerinin fotoreceptör sağlığını korumanın fizyolojik işlevlerini yerine getirmelerini göstermektedir.
25/41 G çift delikli kanolün göz içi ve dış görünümleri, alt enjeksiyon sırasında Gİb'in kontrol edilen mekanizmasını vurgular (Şekil 2). BSS, subretinal sıvı enjeksiyonu sırasında subretinal boşluğa merkezi uzun kavun yoluyla girer. Göz içi basıncındaki önemli artışlar, vitreus boşluğu içindeki BSS'nin kanülün daha büyük metal deliği yoluyla gözden çıkmasına neden olur. BSS daha sonra canül boyunca ilerler ve sonunda cannula hub yakınındaki çıkış bağlantı noktasından çıkarılır. Canül'ün beklendiği gibi çalışıp çalışmadığını değerlendirmek için, sıvının cannula hub yakınındaki çıkış portundan aktığından emin olun.
MiOCT, foveal kopma sırasında bleb boyutlarının ve potansiyel bir foveal yırtığın intraoperatif olarak görselleştirilmesini sağlar (Şekil 3). Şekil 3A1-A3 foveal yırtık ile bleb bir vaka vurgulamak. Şekil 3A1'de, alt bleb cerrahi mikroskop altında görünürken, yırtığın görselleştirilmesi zordur. Şekil 3A2, bir bleb'in boyuna bölümünü herhangi bir gözyaşı olmadan gösterir. Şekil 3A3, bleb'in dikey bölümünü değerlendirirken foveal yırtık gösterir. Şekil 3B1-B3, herhangi bir gözyaşı olmadan başarıyla oluşturulmuş bir bleb göstermektedir.
ERG dalga formlarında önemli bozulma olmaması, hem çubuk hem de koni fotoreceptörlerinin küresel işlevinin subretinal RPE ksinograftlarla korunduğunu göstermektedir (Şekil 4). ERG dalga formları retinanın genel işlevini gösterir. Özellikle, fotoreceptör fonksiyonunun herhangi bir kaybını belirlemek için A dalgalarına dikkat edilmelidir.

Şekil 1: Multimodal görüntüleme ile postoperatif in vivo analiz. (A) Sol göz submaküler RPE greft naklinin (fundus fotoğrafçılığında sarı) çeşitli görüntüleme yöntemleri üzerinde in vivo görüntülenmesi (soldan sağa: fundus fotoğrafçılığı, otoflüoresans, fundus floresan anjiyografi-erken evre, fundus floresan anjiyografi-geç evre, optik koherens tomografisi) 3 aya kadar zaman noktaları (yukarıdan alt sıralara: Gün 3, 14; Ay 1, 3). Fundus fotoğrafındaki yıldız işareti retinotomi bölgesini gösterir; beyaz kesikli ok çizgi taramasının yönünü gösterir. Fundus otofluoresans görüntülemesinde sarı çizilmiş şekil naklin yerini vurgular. OCT görüntülerindeki beyaz üçgenler greftin ilgili yan kenarlarını gösterir (renkli fundus görüntüsündeki çizgi taramasına göre). (B) Atrofik fovea altında (intraoperatif yırtılma nedeniyle) katmanlar etiketli naklin hematoksilin ve eozin lekesi. Ölçek çubukları = A'da 1 mm (otomatik düzenleme ve SK görüntüleri), A'da 200 μm (OCT görüntüleri) ve B'de 100 μm. Kısaltmalar: SK = fundus anjiyografisi; OCT = optik tutarlılık tomografisi; RGC = retina ganglion hücre tabakası; INL = iç nükleer katman; ONL = dış nükleer katman; RPE = retina pigment epitel. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
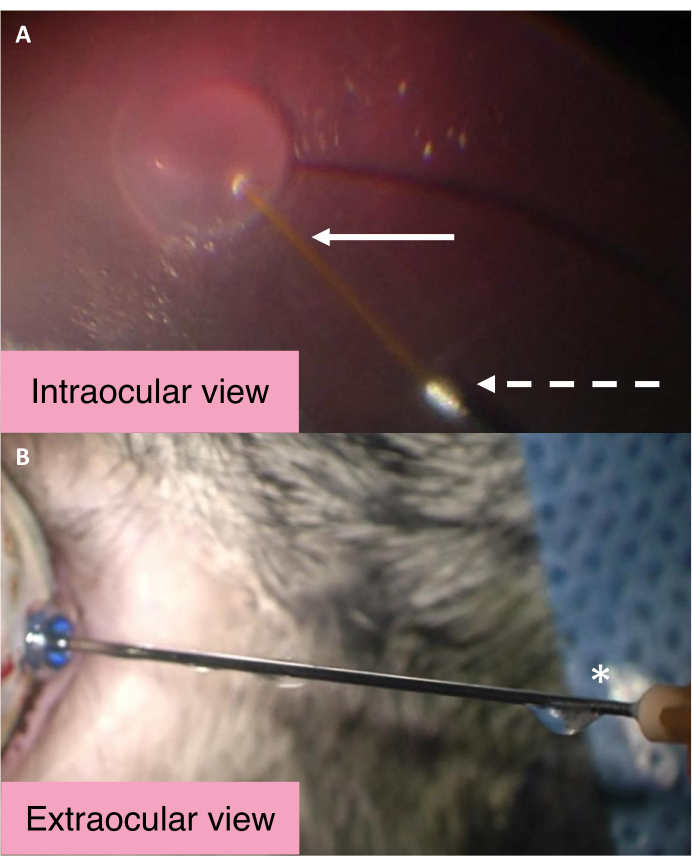
Şekil 2: 25/41 G çift delikli kanülün göz içi ve dış görünümleri. (A) Subretinal bleb oluşturma sırasında 25/41 G çift delikli kanülün göz içi görünümü. Beyaz ok, subretinal enjeksiyon için daha uzun merkezi canüle işaret eder. Kesikli ok, BSS'nin gözden çıkmak için geçtiği çıkışak kavununun açılmasına işaret eder. (B) 25/41 G çift delikli kanolün dış görünümü. Yıldız işareti, göz içi BSS'nin boşaltıldığı kanolan göbeğinin yakınındaki çıkış bağlantı noktasını işaretler. Kısaltma: BSS = dengeli tuz çözeltisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
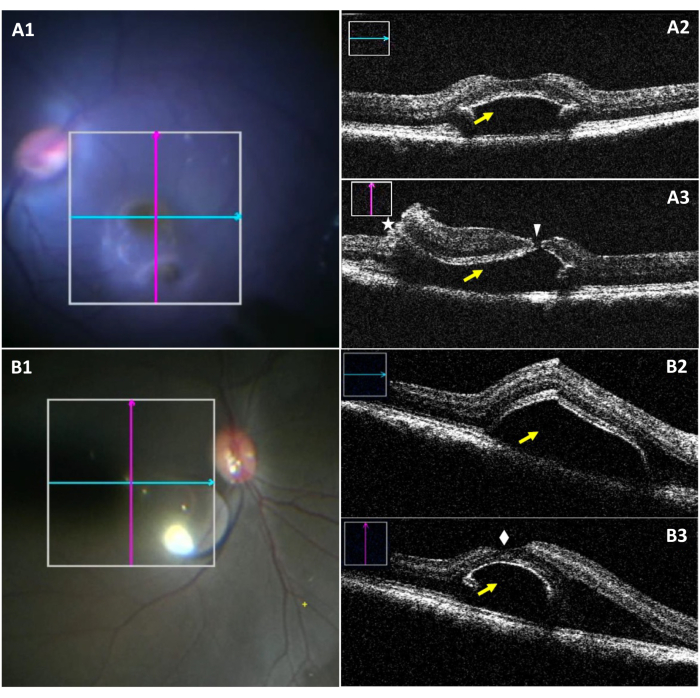
Şekil 3: Foveal yırtık ile komplike subretinal bleb'in intraoperatif mikroskop görüntüleri ve miOCT görüntüleri. (A1) Foveal yırtığı olan bir bleb'de boyuna (mavi) ve enine (kırmızı) taramaların konumunu gösteren intraoperatif mikroskop görüntüsü. (A2) Foveal bölgede (sarı ok) bir subretinal bleb gösteren boyuna miOCT taraması. (A3) Foveal yırtığı (beyaz ok ucu) yakalayan enine miOCT taraması, retinotomi (yıldız ve subretinal bleb (sarı ok). (B1) Başarıyla oluşturulmuş bir bleb'de boyuna (mavi) ve enine (kırmızı) taramaların konumunu gösteren intraoperatif mikroskobik bir görüntü. (B2) Foveal bölgede (sarı ok) bir subretinal bleb gösteren boyuna miOCT taraması. (B3) Başarılı bir şekilde oluşturulmuş bir altretinal bleb'i üstün bir şekilde sağlam bir fovea (beyaz elmas) ile gösteren enine miOCT taraması. Kısaltma: miOCT = mikroskop entegre optik koherens tomografisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
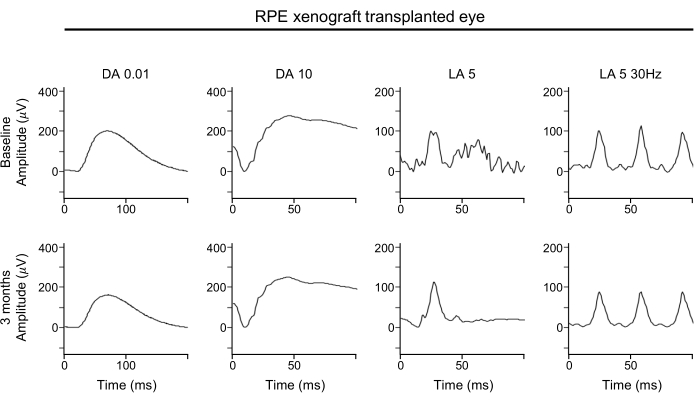
Şekil 4: RPE xenograft nakledilen gözün ERG'si. Retinanın fonksiyonel değerlendirmesi için, RPE-ksinografted gözün taban çizgisi (üst sıra) ve 3 ay transplantasyon sonrası (alt sıra) tam alan ERG değerlendirmeleri, RPE ksinograft transplantasyonunun koyu veya ışığa uyarlanmış koşullar altında herhangi bir yanıt genliği, zamanlama veya dalga formu üzerinde önemli bir etkisi olmadığını göstermektedir. Kısaltmalar: RPE = retina pigment epitel; ERG = elektroretinogram; DA = koyu uyarlanmış; LA = ışığa uyarlanmış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Submaküler RPE transplantasyonu-RPE süspansiyonunun enjeksiyonu ve monolayer RPE greftinin nakli için değerlendirilen iki ana yaklaşım vardır. İki yöntem arasında ayrıntılı bir karşılaştırma bu makalenin kapsamı dışındadır. Bununla birlikte, RPE hücreleri bir monolayerde süspansiyona göre daha düzenli olduğu için monolayer RPE greftinin nakli avantajlı olabilir. Greftteki RPE hücreleri, fizyolojik RPE hücre tabakasının organizasyonuna benzeyen ve nakledilen RPE hücrelerinin fizyolojik işlevlerini yerine getirmelerini sağlayan bir konfüçyüs monolayerde düzenlenir. Bu, düzenleyici çalışmalar ve endüstriyel ölçek büyütme için son derece alakalı olan hücre süspansiyonlarına kıyasla daha hassas dosing parametreleri sağlar.
RPE yama greftinin alt alana teslimi, makulanın dikkatli bir şekilde manipülesini ve greftin alt alana doğru yerleştirilmesini gerektirir. MiOCT gibi mikrocerrahideki teknolojik gelişmeler ve intraoperatif retina doku dinamiklerinin daha iyi anlaşılması bu prosedürün öğrenme eğrisini azaltmıştır. Bu tartışmada, aşağıdaki hususların rasyonelleri açıklanacaktır: i) ameliyat öncesi plazminojen enjeksiyonu; ii) intraoperatif miOCT kullanımı; iii) subretinal bleb oluşturma için özel 41 G çift delikli kanül, düşük Gop ayarları ve PFCL kullanımı; iv) transplantasyondan önce yerel RPE hücre tabakasının kazınmış; v) immünojenik greft reddini azaltmak için sirolimus, triamsinolon, doksiksin ve minosiklin kullanımı.
Preoperatif plazminojen enjeksiyonları parafoveal retinal yapışıklıkları serbest bırakır
İlk deneylerde, foveayı tek bir sıvı dalgasıyla ayırmak zordu. MiOCT ile yapılan değerlendirmede, görüntüler intraretinal travma20 kanıtı ile birlikte doğal RPE'ye parafoveal dış retina yapışıklıklarının varlığını ortaya koydu. Bu yapışıklıklar retina konturuna yayılan subretinal sıvı dalgası yerine bleb'in dikey genişlemesine yol açmış ve foveal travmaya yol açmış olabilir. Plazminojen, fibronektin ve laminin hedefleyen bir proteaz olan plazomin inaktif öncüsüdür. Ocriplasmin, eşlik eden maküler delikli veya eşlik eden bir makula deliği olan veya olmayan semptomatik vitreomaküler çekişin tedavisi için Gıda ve İlaç İdaresi (FDA) ve Avrupa İlaç Ajansı (EMA) tarafından onaylanan insan plazmininin biyomühendislik bir çeşididir. Bununla birlikte, ocriplasmin enjeksiyonundan sonra sistoid makula ödemi gelişiminin postapproval raporları, enzimin retina üzerinde daha geniş bir etkisini önermektedir23.
Kesin mekanizmalar tanımlanmamış olsa da, plazmin fotoreceptör-RPE yapışıklığından sorumlu interfotofoseptör matris elemanlarının bozulması yoluyla retina yapışıklığına neden olabileceği ileri sürüldü24. Bu protokolde NHP gözleri ameliyattan 1 hafta önce intravitreal plazminojen ile tedavi edilerek parafoveal dış retina yapışıklıkları serbest bırakıldı. Fotoreceptör-RPE yapıştırmasının zayıfladığı varsayımı altında, tipik olarak subretinal sıvı dalgasına direnen distal parafoveal halka da dahil olmak üzere nörosensör retinayı ayırmak için daha düşük bir kuvvet gerekir20. Böylece retina bleb müfrezesi sırasında uygulanan kuvvet, retinayı teğet olarak germek yerine bleb'in retina konturu boyunca genişlemesine neden olur. Bu foveal gözyaşı riskini azaltır. Ancak plazminojenin uzun süreli greft sağkalım üzerindeki etkisinin bu protokolde incelenmediği unutulmamalıdır. Gelecekteki çalışmalar bu etkiyi belirlemeye çalışmalıdır.
miOCT, subretinal bleb oluşturma, greft implantasyonu ve subretinal sıvı drenajını yönlendirmek için anatomik geri bildirim sağlar
Makulanın intraoperatif, atrömatik manipülasyonu iyi transplantasyon sonuçları elde etmenin anahtarıdır. Bununla birlikte, manipülasyona bağlı makulanın mikroyapısal değişiklikleri her zaman çalışma mikroskopunda belirgin olmayabilir. Bu tür prosedürlerde, miOCT makula yapısının gerçek zamanlı, üç boyutlu, intraoperatif geri bildirimini sağlayan önemli bir araçtır. miOCT özellikle foveal dekrechment, greft implantasyonu ve sıvı-hava değişimi kullanılarak alt sıvının drenajı sırasında yararlıdır. Foveal dekupchment sırasında, miOCT bleb'in dikey ve yatay boyutlarını belirleyebilir. Cerrahi mikroskopta net olarak görselleştirilemeyen foveal mikrotearlar miOCT ile doğrulanabilir (Şekil 3). Greft implantasyonu sırasında miOCT görüntüleri, greftin yerini veya foveaya yakınlığını göstererek, genellikle daha az şeffaf, kopuk retina aracılığıyla kılavuzluk sağlar. miOCT ayrıca zorlu bir transplantasyon sürecinde retinal yapıştırma olası bölgelerini vurgulayabilir25. Son olarak, subretinal sıvı drenaj işleminde miOCT, retinal-RPE greft teması tam olana kadar subretinal sıvı drenajını güvenilir bir şekilde yönlendirebilir.
Çift delikli kanül, düşük Gİb ayarları ve PFCL vitreus tamponade kombinasyonu, subretinal bleb oluşturma sırasında makula travmasını sinerjik olarak azaltır
İstenmeyen foveal yırtıklara yol açan foveal kopma için subretinal BSS enjeksiyonu sırasında teğetsel retina germe ve sıvı türbülansı oluşabilir. Bu fenomenlere karşı koymak için, enjeksiyonun başlatıldığı foveal merkezden göreceli konum ve mesafe, enjeksiyon hacmi ve hızı, vitreus tamponade, subretinal enstrümantasyon seçimi ve Gİb gibi faktörlerin hepsinin ilgili olduğu gösterilmiştir20,26,27. Foveal kopma için subretinal bleb, foveadan yeterince uzak bir yerde yerleştirilmelidir, çünkü retina germe bleb başlangıç bölgesinde en yüksek olabilir27. Gİb ayrıca subretinal bleb'in oluşturulması boyunca düşük tutulmalıdır. Gözün Gİb'i yüksek olduğunda, retinanın konturu boyunca genişleme yerine bleb boyutunda daha yüksek bir dikey artış gözlenirken, daha düşük basınçlarda blebler daha sığdır20. Ayrıca, 50 μL'lik intravitreal bir enjeksiyon insanlarda Gİb'i etkili bir şekilde iki katına çıkarsa da28, NHP'lerdeki daha kısa göz uzunluğu göz önüne alındığında, alt enjeksiyon sırasında Gİb yükselişi muhtemelen insanlardan daha yüksek ve daha hızlı olacaktır. Çoğu vitrektomi makinesi Gİb dalgalanmasına uyum sağlarken, ayarlama eşzamanlı değil, subretinal enjeksiyon ilerledikçe ortaya çıkan reaktif bir işlemdir. Bu nedenle, Gİb ne kadar yüksekse, retina aşırı uzaması ve bunun sonucunda foveal travma riski de o kadar yüksektir. Bu nedenle, subretinal enjeksiyon sırasında kararlı bir düşük Gİb'in korunması esastır.
Subretinal enjeksiyon için ticari 20/41 G (DORC) veya özel yapım 25/41 G çift delikli alt sanayi alt damarı önerilir. Kanı, alt alana enjekte edilen BSS karşılığında sıvının vitreus boşluğundan çıkmasını sağlar. Bu, alt enjeksiyon sırasında Gİb'in 'eşzamanlı' düzenlenmesini sağlar. Şekil 2'de çift delikli canülün şeması görülmektedir. Son olarak, PFCL foveal gözyaşı riskini azaltmak için kullanılır20,26,27. Oktalin gibi PFCL'ler daha yüksek özgül yerçekimine sahip olduklarından, foveal dekolman29 sırasında retina üzerinde aşağı doğru bir kuvvet uygularlar. Bu, foveal dekolman bleb oluşturma sürecini daha da stabilize eder ve bleb'in retina konturu boyunca genişlemesini arttırır. Bu teknik, nAMD30'a bağlı masif submaküler kanama ayarında rtPA'nın subretinal enjeksiyonu için başarıyla kullanılmıştır.
Yerel RPE'nin ön iletim kaldırması, RPE-fotoreceptör kompleksinin restorasyonunu sağlar
Greft naklinden önce konak RPE çıkarılmalıdır. Bunun nedeni, RPE naklinin fotoreceptörleri destekleme fizyolojik işlevlerini yerine getirebilmesi için RPE-fotoreceptör kompleksinin restorasyonu gerektiğidir21. Ana bilgisayar RPE, kaldırılmazsa, bu kompleksin restorasyonunu önleyen mekanik bir bariyer olarak poz verebilir. RPE toksik kimyasalların kullanılması veya fiziksel çıkarma araçları kullanılarak çıkarılabilir. Kimyasal kaldırma yöntemleri sodyum iodate31,32'nin sistemik veya subretinal yönetimini içerir. Sodyum iyolat uygulandığında fotoreceptörlerin, RPE hücrelerinin ve Choriocapillaris'in yaygın dejenerasyonuna neden olduğundan, retina ve sistemik toksisitesi insan deneyleri için kullanılmasını engellemez32,33. Bu nedenle fiziksel intraoperatif teknikler tercih edilmektedir. Çeşitli fiziksel yöntemler kavramsallaştırılmıştır. Fiziksel yöntemlerden yararlanıldığında, Bruch'un zarı hasarsız kalması çok önemlidir. Birçok in vitro çalışma, RPE greft sağkalımının sağlam bir Bruch zarı üzerinde bağımlılığını göstermiştir34,35,36.
Hidrolik debridman girişimleri Bruch'un zarındaki kırılmalar, epiretinal membran gelişiminin artması ve proliferatif vitreoretinopati ile ilişkiliydi ve bu da çekiş retina dekolmanı37 ile sonuçlandı. RPE debridmanı için önerilen elmas tozlu bir spatula da Bruch'un zarında kırılmalara yol açtı ve bu da koroidden subretinal uzaya hücresel çoğalmaya neden oldu38. İlginçtir ki, özel yapım uzatılabilir bir döngü cihazı, Bruch'un zarının tavşan ve domuzların gözünde korunmasıyla overlying RPE'yi kaldırabilir11,39. Alttaki RPE'nin çıkarılması, AMD'nin gelişmiş atrofik formuna benzer şekilde RPE ve dış retina atrofisi ile hayvan modelleri oluşturmak için de yararlıdır. Makuladan RPE odak alanı çıkarıldığında, RPE yarası kalan RPE hücrelerinin hipertrofisi yoluyla kapanır. Bununla birlikte, bu yara iyileşme yanıtı dış nükleer tabakanın atrofisi ile ilişkilidir40. Bir hayvan modelinin oluşturulması bu makalenin kapsamı dışında olsa da, benzer bir prosedür RPE türevi hücre terapötiklerinin testi için gelişmiş bir atrofik AMD fenotipinin hayvan modelini oluşturabilir.
İmmünojenik greft reddini azaltmak için sirolimus, triamsinolon, doksiksin ve minosiklin kullanımı
Subretinal alanın, bozulmamış bir kan retina bariyeri ve diğer faktörlerle korunan bağışıklık ayrıcalıklı bir bölge olduğu düşünülmektedir41. Kök hücre türevlerinin sağlam bir kan-retina bariyeri ile subretinal naklini içeren birçok çalışmada, immünsüpresif ilaçlar greft sağkalımında ihmal edilebilir bir rol oynamaktadır42. Dış kan retina bariyerinin, doğal RPE tabakası ve RPE hücreleri arasındaki sıkı kavşaklar tarafından oluştuğu düşünülmektedir. Doğal RPE çıkarılması, nakledilen RPE ve konak fotoreceptörlerinin daha iyi entegrasyonunu sağlarken, kan-retina bariyeri süreçte bozulur ve bağışıklık reddi olasılığını artırır. Klasik olarak, T hücreleri böbrek ve karaciğer gibi diğer organların nakil reddi sürecinin merkezindedir43. Bu nedenle, retinal doku nakli için ilk immünsüpresif rejimler bu adaptif immün yanıtları azaltmaya yönelik hedeflenmiştir.
Rapamycin inhibitörünün mekanistik bir hedefi olan Sirolimus ve kalsinörin inhibitörü olan tacrolimus, adaptif immün yanıtları hedefleyen immünsüpresif ilaçlara örnektir. Bununla birlikte, yeterli T hücre baskılamasına rağmen greft sağkalım oranları düşük kalır. Ek olarak, RPE hücrelerinin inhibitör faktörlerin salınımı yoluyla T hücre aktivasyonunu bastırdığı ve düzenleyici T hücrelerinin neslini teşvik etmesi bilinmektedir44. Bu nedenle, adaptif bağışıklığın greft reddine tek katkıda bulunmayabileceği giderek daha belirgin hale gelmiştir42. Hücresel ürünlerin subretinal nakli mikroglia45 birikimine ve aktivasyonuna neden olabilir.
Mikroglia retinanın makrofajlarıdır. İki ana popülasyondan oluşurlar: 1) iç retinal vaskülatın pervasküler mikrogliası ve 2) retina dokusu parenkim içindeki mikroglia. Mikroglia doğuştan gelen immün yanıtın bir parçası olduğundan, triamsinolon gibi intravitreal glukokortikoidler sitokin aracılı çoğalmasını baskılayabilir46. Doksiksin ve minosiklin de mikroglial aktivasyonu baskılayabilir ve 47,48 olarak düşünülmelidir. Son olarak, RPE allograftlarının ksinograftlara karşı immün reddinde farklılıklar eksik anlaşılmaktadır49. Örneğin in vivo immün ret modellerinin serumunda indüklenmiş pluripotent kök hücre türevi RPE hücrelerine karşı alloantibodlar bildirilmiştir. Ancak greft sağkalımında bu antikorların rolü ve antikor aracılı reddin önemi bilinmemektedir50. Bu nedenle, adaptif bağışıklığın bastırılması için sirolimus kullanan bir multidrug rejimi ve doğuştan gelen bağışıklık bastırma için triamsinolon, doksiksin ve minosiklin kombinasyonu önerilir. Bu rejim, iyi greft sağkalım sonuçlarına ve minimum sistemik etkilere sahip tavşanlarda başarıyla kullanılmıştır11.
Bu cerrahi tekniğin sınırlamaları
Bu makalede, NHP'nin alt alanına bir RPE greft tabakası teslim etmek için olası bir cerrahi yöntem açıklanmaktadır; ancak, bu en iyi duruma getirilmiş tek yol olduğu anlamına gelmez. Farklı vitreo-retina cerrahlarının enstrümantasyon ve teknik için başka tercihleri olabilir. Örneğin, bu implantasyon cihazı tasarımı sadece daha sert bir hücre taşıyıcı ile desteklenen düz implantlar sağlayabilir ve bu nedenle nispeten esnek (veya haddelenmiş) implantlar için uygun olmayabilir. RPE süspansiyon nakilleri bu tekniğin çoğunu atlayabilir. Buna göre, cerrahi detaylar her doğum stratejisine göre değişiklik gerektirecektir.
Dejeneratif retina hastalıklarının tedavisi için hücresel terapötiklere olan ilgi artmaya devam ettikçe, RPE greft sağkalımını etkileyen faktörlerin incelenmesi için preklinik çalışmalarda NHP hayvan modeli esas olacaktır. Bu yazıda, NHP gözünde bir submaküler monolayer RPE greftinin daha sorunsuz bir şekilde verilmesini sağlayacak stratejiler önerilmektedir. İntraoperatif komplikasyonların daha iyi görselleştirilmesi için yöntemler de önerilmektedir. Hücresel terapötiklerin kullanımı genişledikçe bu yöntemlerin iyileşmeye devam edeceği öngörülmektedir. Gelecekteki yöntem makaleleri, greftin çeşitli yapısal ve işlevsel yönlerini değerlendirmek için kapsamlı bir araştırma listesi önermeyi de düşünmelidir.
Açıklamalar
Boris Stanzel, bu çalışmada kullanılan bir enstrüman (RPE kazıyıcı) üzerinde ABD Patent 9980851 sahiptir. C. Zeiss Meditec ve Geuder'den Boris Stanzel'e konuşmacı onur ödülü. Diğer yazarların beyan edecekleri bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma IAF-PP (HMBS Domain) (OrBID) tarafından desteklenmiştir: OculaR BIomaterials and Device, A*STAR, Singapore (H17/01/a0/013), NUS Start-up hibeSI NUHSRO/2016/100/SU/01, NUHS Klinik Bilimci Programı (NCSP) hibesi ve Ulusal Araştırma Vakfı Rekabetçi Araştırma Programı, Singapur (NRF-CRP21-2018-0008) X.S.'ye, Hong Leong Profesörlük fonlarını G.E.H. ve B.V.S.'ye bağışladı. ÇeviriSel Klinik Öncesi Model Platformu'ndaki (Singapur Göz Araştırma Enstitüsü, Singapur) veteriner ekibini NHP cerrahisi hazırlama ve hayvan takibi konusunda destek sağladığı için kabul etmek istiyoruz. Entegre intraoperatif OCT cihazına sahip OPMI-Lumera 700'e teknik destek için Jill Teo'ya ve C. Zeiss Meditec Singapore'dan meslektaşlarımıza teşekkürlerimizi iletiyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
Referanslar
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır