Method Article
퇴행성 망막 질병을 위한 비인간 영장류 모형에 있는 망막 안료 상피 이식
* 이 저자들은 동등하게 기여했습니다
Erratum Notice
요약
비인간 영장류 (NHP)는 해부학적 및 유전적 유사성으로 인해 인간의 망막 세포 치료법을 연구하기위한 이상적인 모델입니다. 이 원고는 NHP 눈의 망막 색소 상피 세포의 피하 학적 이식 방법과 황반 조작과 관련된 수술 내 합병증을 방지하기위한 전략을 설명합니다.
초록
망막 색소 상피 (RPE) 이식은 상속되고 취득 된 망막 퇴행성 질환의 치료에 대한 큰 약속을 보유하고 있습니다. 이러한 조건에는 망막염 색소증(RP) 및 고령황변성(AMD)의 고급 형태(AMD)가 포함되며, 이는 지리적 위축(GA)과 같은 것이다. 함께, 이러한 장애는 전 세계적으로 현재 치료 할 수없는 실명의 상당한 비율을 나타냅니다. 이러한 충족되지 않은 의료 요구는 RPE 교체 의 개발 방법에 대한 높은 학문적 관심을 생성했다. 일반적으로 치료법의 전임상 테스트에 사용되는 동물 모델 중, 비인간 영장류 (NHP)는 황반이있는 유일한 동물 모델입니다. 이러한 해부학적 유사성을 인간의 눈과 공유함에 따라, NHP 눈은 RPE 세포 치료와 같은 고급 요법 의약제품(ATMP)의 개발을 위한 중요하고 적절한 전임상 동물 모델이다.
이 원고는 면역 억제 된 NHP에서 외과적으로 생성된 RPE 상처에 황반 (PET) 세포 캐리어 에서 배양 된 RPE 단층의 피하 이식 방법을 설명합니다. 황반의 중앙 변안 부분인 포베아(fovea)는 이식 중 가장 큰 기계적 약점의 부위입니다. 초기 피관 유체 주입이 망막에 과도한 힘을 생성하는 경우 포벨 외상이 발생합니다. 따라서, 퍼플루오로카본 액체(PFCL) 유리체 탐포네이드 하에서 느린 분사는 낮은 내압(IOP) 설정에서 이중 보어 침전 물 주입 캐뉼라로 권장되어 망막 결점을 생성한다.
파라포벨 RPE-광수용체 유착을 방출하기 위해 인트라비탈 플라스미노겐 주입을 전처리하는 것도 좋습니다. 이러한 결합된 전략은 기존의 기술과 비교할 때 포약 눈물의 가능성을 줄일 수 있습니다. NHP는 RPE 세포 치료 개발의 전임상 상에서 핵심 동물 모델이다. 이 프로토콜은 NHP 눈에서 RPE 세포 치료의 전달과 관련된 기술적 과제를 해결합니다.
서문
RPE 이식은 상속되고 취득한 망막 퇴행성 질환의 치료에 큰 약속을 보유하고 있습니다. 이러한 조건은 망막색소침착증(RP, 로드콘 이영양증) 및 GA와 같은 고급 형태의 AMD를 포함하며, 이러한 장애는 전 세계적으로 현재 치료할 수 없는 실명의 상당한 비율을 나타낸다1,2. AMD의 고급 단계는 신생 혈관 AMD (nAMD) 및 GA로 분류됩니다. 항 혈관 내피 성장 인자 (anti-VEGF) 주사와 같은 nAMD에 대한 효과적인 치료 옵션이 있지만 GA 환자는 제한된 치료 옵션이 있습니다. RP는 진행성 망막 광수용체 변성을 특징으로 하는 유전망 질환의 고이질 성 그룹이다. 일부 환자에서, 원인 유전 적 결함은 광수용체보다는 RPE 내에 위치; 따라서, RPE 대체 요법은 유전자 치료가 가능하지 않다면 대체 전략일 수 있다.
이러한 조건에 대 한 효과적인 치료 개발에 중요 한 관심이 있다. 특히, RPE 이식은 잠재적인 치료 접근법으로 견인력을 얻고 있다3,4,5,6,7,8. 1980년대 RPE 이식에 대한 첫 번째 보고서가 등장한 이래, 이 분야는 다양한 RPE 세포 공급원, 전달 전략 및 질병 및 이식의 실험 모델을 포함하도록 확장되었습니다10,11,12,13,14. 다양한 동물 모델 중 NHP만이 인간과 공유하는 망막의 후방 극에 해부학 적 전문화인 '포베아 중앙 집중식'이있는 '황반 루테아'를 가지고 있습니다. 포베아는 고해상도 중앙 vision15를 가능하게 하는 매우 높은 밀도의 콘 광수용체를 함유하고 있습니다. NHP는 또한 인간에 비해 유사한 게놈 및 proteomic 메이크업16이 있습니다. 이러한 유사성은 인간의 망막17,18에 영향을 미치는 안구 질환의 연구를 위한 중요하고 적절한 동물 모델입니다.
이 원고는 면역 억제 된 NHP에서 PET 세포 캐리어에 의해 지원되는 RPE xenograft의 피황 이식 방법을 설명합니다. 토끼에서 피하 RPE 이식을 위한 경외 기술은 이전 원고19에서 기술되었다. 그러나, NHP에서, fovea의 존재는 수술 중 조작 20 도중 특정 주의가 필요합니다. 특히, 피하 유체 주입 방법이 망막20에 과도한 힘을 생성하는 경우 포벨 파열의 위험이 높다. 따라서 이 원고의 초점은 NHP에서 의도하지 않은 포약 외상의 위험을 줄이기위한 전략에 있습니다.
여기에는 포약 해부학의 실시간 시각화를 위해 수술 전 수술 전 비트라비탈 플라스미노겐 주입 및 수술 현미경 통합 광학 일관성 단층 촬영(miOCT)의 방출을 위한 사용이 포함됩니다. 낮은 IOP 설정에서 내막 PFCL 탐포네이드를 가진 맞춤형 25/41 G 이중 보어 침전 캐뉼라가 제안되어 foveal 분리의 보다 제어된 공정을 허용합니다. 또한 이식된 RPE 세포와 숙주 광수용체 간의 더 나은 통합을 허용하기 위해 이식 전에 네이티브 RPE를 외과적 제거하는 것이 좋습니다. 마지막으로, NHP 모델에 대한 peri-및 수술 후 전신 면역 억제 프로토콜은 이식 후 RPE xenograft의 생존을 개선하기 위해 기재된다11,21.
프로토콜
참고: 모든 동물 실험은 안과 및 시력 연구에서 동물의 사용을 위한 비전 및 안과 연구 협회(ARVO)에 따라 수행되었습니다. 윤리 승인은 기관 동물 관리 및 사용위원회에서 얻은, SingHealth, 싱가포르. 동물은 실험실 동물 관리 (AAALAC)의 평가 및 인증 협회에 의해 승인 된 SingHealth 실험 의학 센터에 보관되었다. 이 승인은 모든 동물 실험이 싱가포르 농식품 수의학 당국이 정한 실험실 동물 연구 지침에 대한 국가 자문위원회의 기준을 준수한다는 것을 강조합니다. 다음 실험 프로토콜은 마카카 근막 6개 (남성 4개, 여성 2명, 4~6세, 2.8~4.0kg)의 6눈에서 실시된 실험에 기초하여 확립되었다 .
1. NHP 모델에서 면역 억제 달성
- 수술 7일 전에 면역억제를 시작하고 후속 기간 동안 면역억제를 계속한다.
- 정확한 약물 투여량을 보장하기 위해 전신 면역 억제를 투여하기 전에 NHP를 계량합니다. 동물은 그 후 기준선과 매주 무게.
- 경구 시롤리무스, 독시사이클린 및 미노사이클린을 사용하여 전신 면역 억제를 달성하십시오.
- 2 mg의 경구 시롤리무스를 투여한 다음 1 mg의 일일 유지 보수 투약이 투여됩니다. 투여 전에 기준선 혈액 시롤리무스 수준을 얻고 후속 기간 동안 이를 모니터링하십시오. 적절한 면역 억제를 위해 최소 5 μg/L의 농도를 보장합니다.
참고: 시롤리무스 용량은 무게에 적응되지 않습니다. - 하루에 7.5 mg/kg의 구강 독시사이클린을 투여하되 하루에 두 번 투여하십시오.
- 하루에 7.5 mg/kg의 구강 미노사이클린을 투여하되 하루에 두 번 투여하십시오.
- 2 mg의 경구 시롤리무스를 투여한 다음 1 mg의 일일 유지 보수 투약이 투여됩니다. 투여 전에 기준선 혈액 시롤리무스 수준을 얻고 후속 기간 동안 이를 모니터링하십시오. 적절한 면역 억제를 위해 최소 5 μg/L의 농도를 보장합니다.
- 면역 억제 하는 동안, 불리 한 전신 효과 대 한 모든 NHP를 모니터링. 상당한 체중 감량 (>10%), 감소 된 식욕과 물 소비, 탈모, 침략과 혼수 와 같은 비정상적인 행동을 찾습니다. 평가는 3일, 14일, 1개월에 진행되며, 월별 평가가 진행됩니다.
2. 기기 살균
- 증류수를 사용하여 수술 기구를 헹구는 다.
- 500mL의 증류수와 2mL의 기기 소독제로 가득찬 초음파 욕조에 장비를 놓습니다. 초음파 목욕의 스윕 기능을 사용하여 15 분 동안 악기를 청소하십시오.
- 초음파 욕조에서 악기를 제거합니다. 각 헹구기 5 분 동안 증류수를 두 번 헹구십시오. 헹구기 후에 악기를 공기 건조시십시오.
- 악기상자를 놓습니다. 범용 프로그램 설정을 사용하여 상자를 자동 클락 (50 분 동안 134 °C에서 악기의 살균 : 자동 복제30 분, 건조 20 분).
3. 방부제 프리 트라이암시놀론 준비 (40 mg/mL)
- 1 mL 주사기를 사용하여 트리암시놀론 용액 1mL (10 mg /mL)를 철회하십시오. 15mL 원상 관으로 옮기고 멸균 균형 소금 용액(BSS)의 4mL과 혼합합니다.
- 120 × g 에서 5분 동안 원심분리. 모든 트리암시놀론 입자가 원뿔 관의 맨 아래에 있는지 확인합니다. 원적 튜브에서 상체(BSS)를 폐기합니다.
- 원뿔관에서 멸균 BSS의 5mL로 트리암시놀론 입자를 다시 중단한다. 원심 분리는 5 분 동안 120 × g 에서 용액을 원심 분리합니다. 상부체를 다시 버리십시오.
- BSS(3배)를 가진 트리암시놀론 입자의 세척을 완료하기 위해 3.3단계를 반복한다.
- 40 mg/mL의 농도를 달성하기 위해 멸균 BSS의 0.25 mL로 트리암시놀론 입자를 다시 중단한다.
- 다시 중단 트리암시놀론 (40 mg/mL) 새로운 1 mL 주사기와 흡인. 25G 무딘 플루트 바늘을 부착하고 수술 중 사용을 위해 트리암시놀론 용액으로 주사기를 보관하십시오.
4. NHP 눈의 전처리 에트라비트 플라스미노겐 (0.25 μg/μL)
- 수술 1주일 전에 원숭이 플라스미노겐(0.25 μg/μL)의 인트라비트 주입(20 μL)을 투여한다.
- 케타민 (10-20 mg/kg BW)의 근육 주사와 atropine의 피하 주입 (0.05 mg/kg BW)의 절차 전에 NHP를 진정. 국소 마취를 위한 테트라카인 점안액을 관리하십시오.
- 인트라비탈 주사 전에, 10% 포비도요오드로 회리궤도 영역을 소독한다. NHP의 결막 용오리에 5 % 포비도요오드를 투여하여 눈을 소독. 멸균 BSS로 완전히 헹구기 전에 용액이 적어도 1 분 동안 요새에 머물러 있는지 확인하십시오.
- 250 μL 주사기를 사용하여 유리병에서 미리 희석된 원숭이 플라스미노겐(0.25 μg/μL)을 흡인시합니다. 30 G 바늘을 주사기에 부착하고 원숭이 플라스미노겐을 인트라비티리얼 투여에 대비하십시오.
- 한 쌍의 캘리퍼를 사용하여 눈에 주입 부위를 식별하십시오. 림두에서 3mm 떨어진 인트라비테리얼 주사를 관리한다.
- 세계의 중심을 향한 바늘로 주사를 진행합니다. 세계에서 바늘을 제거하면 면 어플리케이터 스틱을 사용하여 주입 부위를 탐포나데드하고 안구 내 내용물의 역류를 방지하십시오.
- 윤활유 젤 또는 연고를 투여하여 즉각적인 수술 후 안구 표면 자극을 줄입니다.
5. 외과 테이블 및 장비 설정
- 멸균 필드를 설정합니다. 멸균 장에있을 때, 항상 수술 스크럽, 마스크 및 헤어 커버를 착용하십시오.
- 유리체의 수술 내 시각화를 위해 방부제 프리 트리암시놀론(40 mg/mL)을 준비한다(섹션 3 참조). 멸균 BSS를 10mL 주사기로 준비하고 윤활유를 5mL 주사기로 준비합니다. 커튼에 놓습니다.
- 3-0 실크, 7-0 비릴 봉합사, 면 어플리케이터 스틱, 상처 폐쇄 스트립, 샹들리에 엔탈루니션 섬유 와이어 등 다른 악기를 드레이프에 준비하십시오.
- 고속 비트레토르, 벤투리 카세트, 25 G 샹들리에 엔토루네이터를 멸균 기술을 사용하여 비트레토미 머신에 연결합니다.
- 500mL 안과급 BSS 병을 열고 제조업체의 지시에 따라 벤투리 카세트에 연결합니다. 시스템을 프라이밍으로 진행합니다.
- miOCT/수술 현미경을 켭분. 후방 세그먼트 수술 및 조명을 위한 외과 현미경의 사전 설정된 구성을 선택합니다. 신분증, 성별, 동물의 눈의 측면, 절차의 이름을 포함한 절차의 세부 사항을 입력합니다.
- 비접촉식, 넓은 각도, 128도 fundus 렌즈를 장착합니다.
- 멸균 일회용 핸드피스 커버를 수술 현미경/miOCT에 부착합니다. 발 페달을 사용하여 현미경 위치와 초점을 조정합니다. 수술을 진행합니다.
6. 동물의 마취 및 위치 의 준비 (바람직하게는 수의사 팀에 의해 수행)
- NHP가 역류 및 구토를 방지하기 위해 마취를 유도하기 전에 적어도 8 시간 동안 금식되었는지 확인하십시오. 마취의 유도 전에 NHP를 진정 (진정 지침에 대한 단계 4.2 참조).
- 1% 트로피아미드와 2.5% 페닐레프린 점안액을 5분 간격으로 최소 3배 이상 바르면 동공 팽창을 달성하십시오.
- 부프레노르핀 (0.005-0.03 mg/kg BW)의 근육 주사를 투여하 30 분 전에 진통을 달성하기 위해 수술.
- NHP를 엔트라큐아힐 튜브로 삽관, 일반적으로 3-5 mm 크기. 삽관을 시도할 때여러 가지 크기를 사용할 수 있는지 확인합니다. 외상을 일으키지 않고 후두를 통과 할 수있는 가장 큰 크기를 사용합니다. 최종 조수 CO2를 측정하여 엔오트라큐리 튜브의 적절한 배치를 보장합니다.
- 전신 마취를 유도하기 위해 엔오트라세이힐 튜브를 통해 2% 이소플루오란 가스를 전달합니다. 소리와 터치를 포함하여 주변 자극에 대한 NHP의 반응을 평가하여 전신 마취 상태 (터치에 대한 응답 부족)를 확인하십시오. 전신 마취 상태를 유지하기 위해 0.5-2 % 이소플루오란 가스를 사용합니다.
- NHP 심전도, 호흡속도, 혈압 및 산소 포화도를 수술 전체 에서 지속적으로 모니터링합니다.
- NHP를 수술대에 배치하여 눈이 수술 현미경에 수직이 될 수 있도록 합니다. 마취 중 안구 표면 자극을 줄이기 위해 작동하지 않는 윤활유 젤 또는 연고를 눈에 투여하십시오.
- 가위를 사용하여 속눈썹을 잘라 감염의 기회를 감소시십시오.
- 10% 포비도네-요오드로 회리궤도 영역을 소독합니다. NHP의 결막 용오리에 5 % 포비도요오드를 투여하여 눈을 소독. 멸균 BSS로 완전히 헹구기 전에 용액이 적어도 1 분 동안 요새에 머물러 있는지 확인하십시오.
- 사전 컷 개구부가 눈 위에 중심이 되어 수술을 받을 수 있도록 멸균 드레이프를 배치합니다. 접착제 수술 절개 드레이프로 눈을 가다.
- 수술을 받기 위해 눈에 측면 교정을 수행합니다.
- 눈의 시각화를 위해 눈꺼풀을 적절하게 열어 두도록 Lieberman 스펙럼을 삽입합니다.
7화 비트레토미
참고: PET-스캐폴드 RPE 이식편 을 전달하기 위한 적재 공간에 액세스하려면 이 프로토콜은 표준 바이트레오레티날 수술 설정 및 비접촉식, 넓은 각도, 128° 펀더러스 렌즈를 사용하여 4포트(valved) 25G 비크레상절제술을 수행할 것을 권장합니다. 이 프로토콜은 또한 편골 분리유도, RPE 이식편 이식, 하수액 배수 등 몇 가지 중요한 수술 단계를 안내하기 위해 miOCT가 장착된 수술 현미경의 사용을 권장합니다.
- 한 쌍의 반나스 가위를 사용하여 림푸스 근처의 결막 절제술을 절개하여 360 ° 결막 절제술을 수행합니다. 무딘 해부를 수행하여 peritomy를 확대합니다.
- 25G 미세병칼날을 사용하여 오른쪽 눈을 위해 8시 또는 왼쪽 눈을 위해 4시에 경화증을 수행합니다. 눈의 림부에서 3mm 경화증을 수행합니다.
- 7-0 비릴 봉합사를 사용하여 25 G 커스텀 사이드 포트 주입 캐뉼라를 삽입하고 봉합합니다. 인트라비탈 위치를 확인한 후 BSS 주입을 시작하고 시스템을 설정하여 20mmHg의 IOP를 유지합니다.
- 25 G 플랫 헤드 트로카를 사용하여 오른쪽 눈의 경우 2시 또는 왼쪽 눈의 경우 10시, 7.2 단계에서와 같이 경화증을 수행합니다.
- 25 G 샹들리에 라이트를 플랫 헤드 트로차에 삽입하고 끈적 끈적한 테이프로 고정하십시오. 광원을 약 60%로 조정합니다.
- 오른쪽 눈을 위해 10시 또는 왼쪽 눈을 위해 2시 방향에 7.2 단계와 유사한 또 다른 경화증을 수행하십시오. 매듭을 묶지 않고 경화절제술 주위에 U자형 비릴 7-0 봉합사를 놓습니다. 이 경화증을 통해 vitrectomy 커터 팁을 삽입합니다.
- 엔트리 포트 주변의 vitrectomy를 시작하고 다음 설정으로 짧은 코어 vitrectomy: 분당 최대 5000 컷, 최대 포부 400 mmHg.
- 더 나은 유리체 시각화를 위해 트리암시놀론 (40 mg/mL)의 20-50 μL을 주입하십시오.
- 망막으로부터 유리체 체체를 분리하여 후방 유리체 분리(PVD)를 유도한다.
- PVD의 부드러운 유도를 허용하도록 광학 디스크 위에 비트레스터를 배치합니다. 비트레토르는 절단없이 400mmHg의 최대 설정에서 만 포부에 보관하십시오.
- 필요한 경우 25G 내구 집게를 사용하여 디스크 여백에서 유리체를 조작하여 유리체 피질에 찢어져 분리를 용이하게 합니다.
참고: 삼각골 결정망 면에 방해받지 않고 미끄러지면 PVD가 성공한 것으로 간주됩니다.
- 커터로 후방 히알로이드 멤브레인을 열고 분리된 유리체 스커트를 유리체 베이스(망막 적도)까지 제거합니다. 망막 표면에 남아있는 트리암시놀론을 흡인시합니다.
8. miOCT 유도 포벨 분리
- PFCL의 1-2 mL을 주입하여 전방, 중간 주변 망막까지 후방 극을 덮습니다.
- 피망 주사 캐뉼라로 눈을 입력합니다. Vitrectomy 기계에 IOP를 0-4 mmHg로 설정합니다 (완벽하게 방수 시스템을 보장; 필요한 경우, 포트 주위에 봉합사를 묶어).
- 25/41 G 사용자 정의 이중 보어 사수 주입 캐뉼라 또는 250 μL 주사기에 연결된 25/38 G 감전 주사 캐뉼라를 사용하여 BSS의 피하 주사를 부드럽게 수행하여 국소화 된 망막 분리를 유도합니다. 일단 흠이 포베아를 교차하면 주사를 중단하십시오. 별도의 방향에서 두 번째 블레브를 만듭니다. 두 블을 병합하여 포베아를 완전히 분리합니다.
- miOCT 함수를 사용하여 bleb 형성을 시각화합니다. 라인과 큐브 스캔이 설정(512 x 128픽셀, 스캔 폭 4mm)을 사용하여 HD 모드로 되어 있는지 확인하여 포베아에서 이미지를 수집합니다. 포베아의 RPE 층에서 신경 망막의 완전한 분리를 위해 miOCT 이미지를 관찰한다.
- 망막 절제술을 수직 25 G 유리석 가위로 1.5mm로 확대하여 이식을 위한 피망 공간에 접근할 수 있도록 합니다.
9. 네이티브 RPE 제거
- Vitrectomy 기계에 IOP를 50mmHg로 설정합니다.
- 브러시 실리콘 팁 캐뉼라를 사용하여 활성 압출을 통해 PFCL을 제거합니다.
- 20G 악기의 입구를 허용하도록 1.4mm 절개 칼로 경화증을 확장합니다.
- 사용자 지정 20 G 확장 루프 계측기를 사용하여 제거를 위해 서브카반 호스트 RPE를 긁어냅니다. 적어도 2 x 3mm를 측정하는 영역을 긁어 냅니다.
10. RPE 세포 단층 이식의 전달을위한 슈팅 게임의 적재
- PET 세포 캐리어의 RPE 배양에서 절단된 총알 모양의 이식편의 적재에 대한 일반적인 지침은 이전 간행물22를 참조하십시오.
11. miOCT 유도 이식 이식 및 위치 조정
- 20mmHg의 IOP에서 경화증을 통해 슈터 장치의 끝을 삽입합니다. 망막 표면에서 생성된 망막 에지를 통해 임플란트를 적층 공간쪽으로 주입합니다.
- 브뤼우의 멤브레인을 향한 세포운반선 측과 광수용체를 향한 RPE xenograft 측으로 임플란트를 주입한다.
- miOCT 함수를 사용하여 임플란트 위치를 시각화합니다. 임플란트가 그대로 오버레이링된 망막과 함께 무수공간에서 브루치의 막에 평평하게 놓여 있는지 확인합니다. 생성된 망토절제술에서 멀리 떨어져 있고 망토절제술 부위에 방해가 되지 않는 적절한 거리에 있는지 확인하십시오.
- 혈관 분사 캐뉼라 또는 25G 곡선 안구 가위로 임플란트 위치를 조정하여 황반 아래에 잘 배치되도록 합니다.
12. miOCT 유도 감하 유체의 배수
- 브러시 실리콘 팁 캐뉼라를 사용하여 유체 공기 교환 및 신중한 하수액 배수를 수행합니다. 연실 망막 분리 및 망막 가장자리 압착에서 부드러운 감하 유체 포부를 시도합니다.
- 망막이 임플란트 위에 다시 부착될 때까지 적절한 침전유체 배수의 실시간 시각화를 위한 miOCT 기능을 활성화합니다.
13. 작업 종료
- 교체된 7-0 비릴 봉합사를 사용하여 작업 포트 경화증을 닫습니다. 25 G 샹들리에와 25 G 주입 캐뉼라를 제거합니다. 7-0 비릴 봉합사로 이 경화증을 닫습니다.
- 2 mg에서 0.05 ml의 인트라비티 방부제 프리 트리암시놀론 (40 mg/ml)을 봉합하기 전에 8시 경화증에서 투여하십시오.
- IOP가 허용 범위 내에 있는지 확인하기 위해 눈을 찌르고 있습니다. 필요한 경우 30G 바늘을 통해 여과 된 공기 (또는 BSS)를 주입하십시오.
- 결막은 7-0 비릴 봉합사와 5-0 프롤렌으로 캔토절제술을 당부합니다(10-14일 후 제거).
14. 수술 후 동물 관리
- NHP는 수술 후 1시간 동안 얼굴을 아래로 향하게 한다. 의식이 회복될 때까지 동물을 방치하지 마십시오. 수술 후 과정에서 수의사와 동물 관리 기술자가 관찰 및 지원을 받을 수 있는지 확인합니다.
- 국 소 항생제를 적용 (토브라마이신), 스테로이드 (덱사메타손) 연고, 호마트로핀 점안액은 수술 후 5 일 동안 하루에 두 번.
- 다른 피하 부프레노르핀 (0.005-0.03 mg/kg BW) 주사 6 시간 수술 후 적절한 통증 조절을 관리하십시오.
- NHP를 다른 동물회사에 반환하는 것은 의식이 완전히 회복된 경우에만 가능합니다.
- 절차 후 3일, 14일 및 1개월째에 다중 모달 이미징 후속 조치를 실시하고 매월 검진을 실시합니다. 절차 후 매달 ERGs를 수행합니다. 다모달 이미징에 사용되는 퇴사 기간과 동시에 14일째에 칸토절제술을 위한 5-0 prolene 봉합사를 제거하십시오. 나머지 봉합사는 제거가 필요하지 않은 7-0 비릴 봉합사를 다시 굴절할 수 있습니다.
15. 멀티모달 이미징을 위한 수술 후 모니터링 방법
- 하룻밤 사이에 NHP를 빠르게. 이미징 직전에 NHP를 진정시하십시오(약물 및 진정농도의 경우 4.2단계 참조). 식증이 눈의 움직임을 멈추기에 충분하지 않은 경우 전신 마취의 사용을 고려하십시오.
- 1% 트로피아미드와 2.5% 페닐레프린 점안액을 적용하여 이미징 전에 동공 팽창을 달성하십시오(6.2단계 참조).
- 55° 필드 렌즈와 30° 필드 렌즈가 있는 고해상도 OCT 기계를 사용하여 자동 불피성(AF), 펀더플루오레세신 혈관 조영술(FFA), 광학 일관성 단층 촬영(OCT)을 수행합니다.
- FFA에 대한 정맥 내 10 % 형광실 (0.1 mL / kg BW)을 투여하십시오. 초기 위상 이미지를 얻으려면 30초 이내에 있는 이미지를 캡처합니다. 후반 단계 이미지의 경우 주입 후 5-10분 후에 이미지를 캡처합니다.
- FFA의 초기 단계와 후반 단계 사이의 fundus 카메라를 사용하여 fundus 사진을 수행합니다.
16. 전장 전전경(ERG) 연구를 위한 수술 후 모니터링 방법
- 하룻밤 사이에 NHP를 빠르게 할 수 있습니다. ERG 연구 전에 NHP를 진정시하십시오(약물 및 진정농도의 경우 4.2단계 참조). ERG 녹음 전체에서 적절한 경우 식기를 다시 관리합니다.
- 최소 2-3일 간격으로 다중 모달 이미징 및 ERG 레코딩을 분리합니다.
- 진정되면 ERG 녹화 전에 NHP가 30분 동안 어둡게 조정되었는지 확인합니다.
- 스테인레스 스틸 피하 바늘 전극을 왼쪽및 오른쪽 측면 캔티(참조 전극)와 NHP 본체(접지 전극)의 뒷면에 배치합니다. 접촉 및 접착력을 돕기 위해 vidisic 젤을 사용하여 NHP 각막에 ERG 콘택트 렌즈 전극을 배치합니다.
- 비전의 임상 전기 생리학을 위한 국제 학회 (ISCEV)14에 대한 국제 학회에 의해 추천된 인간 프로토콜에 모든 ERG 시험을 기초하십시오. scotopic 조건에서 ERG 레코딩을 시작하고 조광홍색 깜박임부터 시작합니다. 권장되는 상호 자극 간격에 대한 ISCEV 권장 사항을 따르십시오.
- 배경 강도에 대한 표준 ISCEV 권장 사항을 사용하여 광사진 테스트 전에 10 분 동안 NHP가 빛으로 조정되었는지 확인하십시오.
17. NHP의 안락사
- enucleationNHP를 안락사시키기 위하여는, 미국 수의학 협회의 안락사에 위원회에 의해 추천된 대로 정맥 성 나트륨 pentobarbital (75 mg/kg)를 관리하십시오.
결과
다모달 이미징 양식(fundus 사진, fundus 자동 불발 성 이미징 (FAF), 펀더스 형광성 혈관 조영술 (FFA)-초기 단계 및 후기 단계, 광학 일관성 단층 촬영 (OCT)) 성공적인 하반신 RPE 이식이식의 특징을 강조한다 (도 1). Fundus 사진은 시간이 지남에 따라 이동없이 fovea에서 RPE 이식 이식의 위치를 보여줍니다. FAF 이미징은 RPE 접목과 겹치는 하이퍼 오토플루오레션(흰색, 고강도 영역에 의해 입증된)의 최소한의 변화를 보여줍니다. 초기 및 후기 단계 FFA는 RPE 접목을 둘러싼 명백한 누출 (시간이 지남에 따라 확대되는 흰색, 고강도 영역에 의해 입증)을 표시하지 않습니다. 3일째의 초기 이미지는 이식 이식 전에 네이티브 RPE를 제거하기 때문에 창 결함을 보여줍니다. 황반 OCT 이미지는 시간이 지남에 따라 RPE 이식편위에 외부 망막 층 (특히, 광수용체 층)의 보존을 보여줍니다. 헤마톡클린과 에오신 염색은 미세눈물의 증거가 없는 망막 층을 보여줍니다. 접목 의 주변 위의 외부 핵 층의 보존은 RPE 세포가 광수용체 건강을 유지하는 그들의 생리적 기능을 수행하고 있음을 시사한다.
25/41 G 이중 보어 캐뉼라의 내피 및 외부 뷰는 IOP가 피하 주사 중에 제어되는 메커니즘을 강조합니다(그림 2). BSS는 중앙 긴 캐뉼라를 통해 침전유체 주입 시 하수 공간에 진입한다. 혈관 내 압력의 상당한 증가는 유리체 캐비티 내의 BSS가 캐뉼라의 더 큰 금속 보어를 통해 눈을 빠져나갈 수 있도록 합니다. 그런 다음 BSS는 캐뉼라를 따라 이동하여 결국 캐뉼라 허브 근처의 퇴신 항구에서 배출됩니다. 캐뉼라가 예상대로 작동하는지 여부를 평가하려면 캐뉼라 허브 근처의 송신 포트에서 유체가 흐르는지 확인합니다.
miOCT는 포브 분리 중에 작업 할 수있는 출혈 치수와 잠재적 인 포약 파열의 시각화를 허용합니다 (그림 3). 그림 3A1-A3는 포약 눈물로 결속의 경우를 강조한다. 도 3A1에서는, 열등한 결점이 외과 현미경의 밑에 보이는 동안, 눈물의 시각화는 어렵습니다. 그림 3A2는 눈물없이 출혈의 세로 부분을 보여줍니다. 도 3A3은 블렙의 수직 부분을 평가할 때 포브 라브를 나타낸다. 그림 3B1-B3는 눈물이 없는 채 성공적으로 생성된 결재를 보여줍니다.
ERG 파형에 상당한 열화가 없다는 것은 로드와 콘 광수용체 모두의 글로벌 기능이 피하 RPE xenografts로 유지된다는 것을 시사한다(도 4). ERG 파형은 망막의 전반적인 기능을 보여줍니다. 특히, 광수용체 기능의 손실을 결정하기 위해 A-waves에 주의를 기울여야 한다.

그림 1: 멀티모달 이미징을 통해 생체 내 분석. (A) 다양한 이미징 양식에 대한 왼쪽 눈 형하반 RPE 이식이식(좌측에서 오른쪽 컬럼: fundus 사진, 자동 불경, 펀더스 형광학-초기 단계, fundus 형광학 후기 단계, 광학 일관성 단층 촬영)의 생체 내 이미징에서 3개월까지 의 외형 편도 촬영(14일, 14일 까지) 개월 1, 3). fundus 사진의 별표는 망토절제술의 부위를 나타냅니다. 흰색 파선 화살표는 선 스캔 방향을 나타냅니다. fundus 자동 발광 이미징에 노란색 그려진 모양은 이식의 위치를 강조합니다. OCT 이미지의 흰색 삼각형은 접목의 각각의 측면 가장자리를 나타냅니다(색상 fundus 이미지의 선 스캔에 따라). (B) 헤마톡슬린과 위축포하에서 이식의 에신 염색 (수술 내 눈물로 인해) 층이 표지되어 있습니다. 스케일 바 = A (자동 형광 및 FA 이미지)의 1mm, A (OCT 이미지)의 200 μm, B의 100 μm. 약어: FA = 기금 혈관 조영술; OCT = 광학 일관성 단층 촬영; RGC = 망막 신경절 세포 층; INL = 내부 핵층; ONL = 외부 핵층; RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
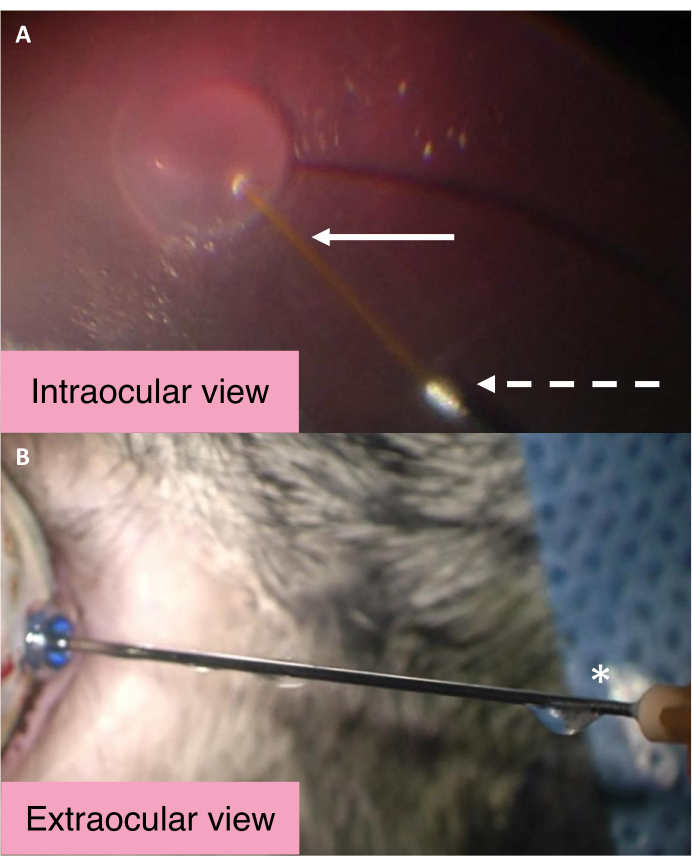
그림 2: 25/41 G 이중 보어 캐뉼라의 내피 및 외부 보기. (A) 25/41 G 이중 보어 캐뉼라의 내부 뷰는 피연 생성 시. 흰색 화살표는 침전 주사를 위해 더 긴 중앙 캐뉼라를 가리킵니다. 대시 된 화살표는 BSS가 눈을 빠져 나가는 데 통과하는 회귀 캐뉼라의 개구부를 가리킵니다. (B) 25/41 G 이중 보어 캐뉼라의 외부 보기. 별표는 혈관 내 BSS가 배수되는 캐뉼라 허브 근처의 송신 포트를 표시합니다. 약어: BSS = 균형 잡힌 염액. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
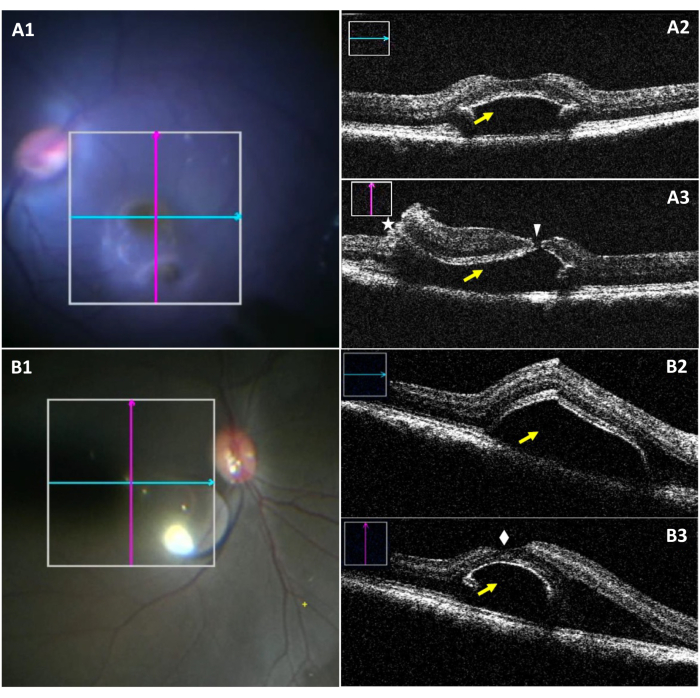
도 3: 수술 중 현미경 이미지와 궤적 눈물로 복잡한 피흘의 miOCT 이미지. (A1) 포약 눈물로 출혈로 세로(파란색) 및 횡방향(red)의 위치를 보여주는 수술 내 현미경 영상. (A2) 포발 영역(노란색 화살표)에서 피하 출혈을 나타내는 세로 miOCT 스캔. (A3) 망막 절제술(별표 및 피하 출혈(노란색 화살표)과 함께 포팔 눈물(흰색 화살촉)을 캡처하는 횡방향 miOCT 스캔. (B1) 성공적으로 형성된 결면에서 세로(파란색) 및 횡방향(red) 스캔의 위치를 보여주는 수술 내 현미경 이미지. (B2) 포발 영역(노란색 화살표)에서 피하 출혈을 나타내는 세로 miOCT 스캔. (B3) 횡방향 miOCT 스캔은 그대로 포베아(화이트 다이아몬드)로 성공적으로 생성된 감전 블B를 보여 주는 스캔입니다. 약어: miOCT = 현미경 통합 광학 일관성 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
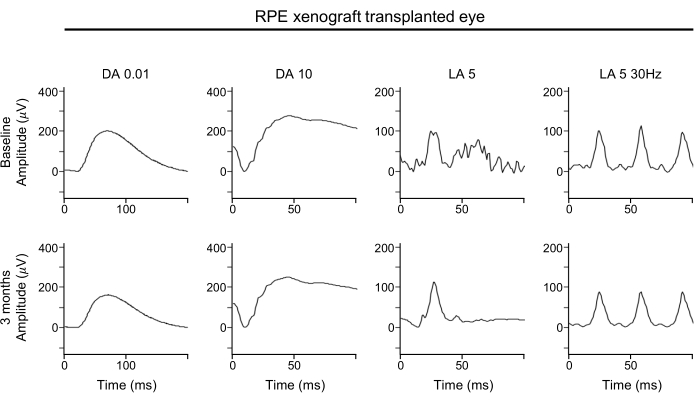
그림 4: RPE 이노이식 이식 눈의 ERG. 망막의 기능적 평가를 위해, 베이스라인(위행)과 3개월 후 이식 후(아래 줄)에서 수행된 RPE-xenografted 눈의 전체 필드 ERG 평가는 어두운 적응 또는 밝은 적응 조건하에서 임의의 반응 진폭, 타이밍 또는 파형에 대한 RPE 제노이식 이식의 유의한 효과를 나타내지 않습니다. 약어: RPE = 망막 색소 상피; ERG = 전기 전도사; DA = 어두운 적응; LA = 빛 으로 조정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
하반신 RPE 이식에 대한 평가되는 두 가지 주요 접근법이 있습니다 - RPE 현탁액의 주입 및 단층 RPE 이식편이식의 이식. 두 메서드 간의 자세한 비교는 이 원고의 범위를 벗어납니다. 그러나, 단층 RPE 이식편의 이식은 RPE 세포가 현탁액보다 단층에서 더 조직되기 때문에 유리할 수 있다. 접목에 있는 RPE 세포는 생리적인 RPE 세포 층의 조직을 닮은 confluent 단층에서 조직되고 이식된 RPE 세포가 그들의 생리적 기능을 능력을 발휘할 수 있게 합니다. 이를 통해 셀 서스펜션에 비해 보다 정밀한 투약 매개 변수를 사용할 수 있으며, 이는 규제 작업 및 산업 확장과 매우 관련이 있습니다.
경전 공간에 RPE 패치 이식편을 전달하려면 황반의 신중한 조작과 피하 공간에서 이식편을 정확하게 삽입해야 합니다. miOCT와 같은 미세 수술의 기술적 진보와 수술 내 망막 조직 역학에 대한 더 나은 이해는이 절차의 학습 곡선을 감소시었습니다. 이 토론에서, 다음 측면의 근거가 설명 될 것이다: i) 수술 전 플라스미노겐 주입; ii) 수술 중 miOCT의 사용; iii) 사용자 정의 41 G 듀얼 보어 캐뉼러, 낮은 IOP 설정 및 PFCL을 사용하여 침전 물 생성을 위한; iv) 이식 전에 네이티브 RPE 세포 층의 긁힘; v) 면역원성 이식 거부를 줄이기 위해 시롤리무스, 트리암시놀론, 독시사이클린 및 미노사이클린을 사용한다.
수술 전 플라스미노겐 주사는 파라포벨 망막 접착을 방출합니다.
초기 실험에서는 단일 유체 파로 포베아를 분리하는 것이 어려웠습니다. miOCT를 사용하여 평가에, 이미지는 intraretinal 외상20의 기록과 더불어 네이티브 RPE에 파라포벨 외부 망막 접착의 존재를 밝혔습니다. 이러한 접착력은 망막 윤곽을 가로질러 퍼지는 하수 유체 파가 아닌 출혈의 수직 팽창으로 이어질 수 있으며, 그 결과 포브 외상이 발생할 수 있습니다. 플라스미노겐은 플라스민의 비활성 전구체이며, 섬유네틴과 라미닌을 표적으로 하는 프로테아제이다. Ocriplasmin은 인간 플라스민의 생체 공학 된 변종입니다, 식품 의약국 (FDA)과 유럽 의약품 기구 (EMA)에 의해 승인 또는 수반되는 황반 구멍없이 증상 진동성 견인의 치료를위해. 그러나, ocriplasmin 주입 후 낭포성 황반 부 종 개발의 사후 승인 보고서 retina23에 효소의 더 광범위 한 효과 제안 했다.
정확한 메커니즘은 확인되지 않았지만, 플라스민은 광수용체-RPE 접착을 담당하는 광수용체 매트릭스 원소의 분해를 통해 망막 접착력을 약화시킬 수 있음을 시사했다24. 이 프로토콜에서, NHP 눈은 파라포벨 외부 망막 접착을 풀어 주기 위하여 수술 1 주 전에 intravitreal plasminogen로 취급되었습니다. 광수용체-RPE 접착력이 약화된다는 가정 하에, 일반적으로 피하 유체 파20에 저항하는 탈발성 파라포벨 링을 포함한 신경 감각 망막을 분리하는 데 더 낮은 힘이 요구된다. 따라서 망막 결막 분리 중에 투여된 힘은 망막을 접선으로 스트레칭하는 대신 망막 윤곽을 가로질러 출혈을 확대하는 결과를 낳는다. 이것은 포브 눈물의 위험을 감소시킵니다. 그러나, 장기간 이식 생존에 플라스미노겐의 효과는이 프로토콜에서 공부되지 않았다는 점에 유의해야한다. 향후 연구는 이 효과를 결정하려고 시도해야 합니다.
miOCT는 무형 의 반응을 제공하여 침전물 분담 생성, 이식 이식 및 피하 유체 배수를 안내합니다.
수술 중, 황반의 외상성 조작은 좋은 이식 결과를 달성하는 열쇠입니다. 그러나, 조작과 관련된 황반의 미세 구조적 변화는 항상 작동 현미경에 분명하지 않을 수 있습니다. 이러한 절차에서 miOCT는 황반 구조의 실시간 3차원, 수술 중 피드백을 제공하는 중요한 도구입니다. miOCT는 유체 공기 교환을 사용하여 양골 분리, 이식 이식 및 침전물의 단계 중에 특히 유용합니다. foveal 분리 하는 동안, miOCT 는 bleb의 수직 및 수평 치수를 결정할 수 있습니다. 수술 현미경에 명확하게 시각화되지 않을 수 있는 포벨 미세 눈물은 miOCT에 의해 확인될 수 있다(도 3). 이식 이식 중에 miOCT 이미지는 종종 덜 투명하고 분리 된 망막을 통해 접목의 위치 또는 포베아에 대한 근접성을 보여 줌으로써 안내합니다. miOCT는 또한 어려운 이식 과정 25 도중 망막 접착의 가능한 지역을 강조할 수 있습니다25. 마지막으로, 하수 유체 배수 과정에서 miOCT는 완전한 망막-RPE 접목 접촉이 이루어질 때까지 침전유체 배수를 안정적으로 유도할 수 있습니다.
이중 보어 캐뉼라, 낮은 IOP 설정 및 PFCL 유리체 탐포네이드의 조합은 피망 분 결분 생성 시 황반 외상을 시너지 효과적으로 감소시킵니다.
접선 망막 스트레칭 및 유체 난류는 원치 않는 포골 눈물로 이어지는 포벨 분리를 위한 상하 BSS 주입 도중 생길 수 있습니다. 이러한 현상에 대응하기 위해, 주사가 시작되는 포팔 센터로부터의 상대적 위치 및 거리, 사출 부피 및 속도, 유리체 탐포나데, 피하 계측기의 선택, IOP 와 같은 요인들은 모두 20,26,27로 나타났다. 망막 스트레칭은 bleb 개시 부위27에서 가장 높을 수 있으므로 포베아에서 적절히 먼 위치에 배치되어야 합니다. 또한 IOP는 피망 블블을 만드는 동안 낮게 유지되어야 합니다. 눈의 IOP가 높을 때, 망막의 윤곽을 따라 팽창보다는 bleb 크기의 더 높은 수직 증가가 관찰되는 반면, 출혈은 낮은 압력20에서 얕습니다. 더욱이, 50 μL의 내트라비탈 주사는 NHP의 짧은 눈 길이를 감안할 때, 인간28에서 IOP를 효과적으로 두 배로 할 것이지만, 감하 주사 중 IOP 상승은 아마 인간보다 더 높고 더 빠를 것이다. 대부분의 Vitrectomy 기계는 IOP 변동에 대해 조정하는 동안, 조정은 동시가 아니라 오히려 부신 주사가 진행됨에 따라 발생하는 반응성 과정입니다. 따라서 IOP가 높을수록 망막 오버스트레칭 및 그 결과 포브 외상의 위험이 높아지습니다. 따라서, 침전 주입 시 안정적인 낮은 IOP를 유지하는 것이 필수적이다.
상용 20/41 G(DORC) 또는 주문 제작된 25/41 G 듀얼 보어 부레티날 캐뉼라가 사수 주입에 권장됩니다. 캐뉼라를 사용하면 유체가 지하 공간에 주입된 BSS에 대한 대가로 유리체 구멍을 빠져나갈 수 있습니다. 이것은 피하 주사 도중 IOP의 '동시' 규정을 보장합니다. 도 2에서는 이중 보어 캐뉼라의 회로도가 보입니다. 마지막으로, PFCL은 포골 눈물의 위험을 줄이기 위해 활용20,26,27. 옥탈린과 같은 PFCLs는 더 높은 특정 중력을 가지므로, 그들은 포벨 분리29 도중 망막에 하향 힘을 발휘합니다. 이것은 또한 포탈 분리 블블 생성 과정을 안정화하고 망막 윤곽을 따라 bleb의 확장을 향상시킵니다. 이 기술은 nAMD30으로 인해 대규모 하반출혈의 설정에서 rtPA의 피하 주사에 성공적으로 사용되었습니다.
네이티브 RPE의 사전 이식 제거는 RPE-광수용체 복합체의 복원을 가능하게 합니다.
호스트 RPE는 이식 이식 전에 제거되어야 합니다. 이는 RPE-광수용체 복합체의 복원이 요구되기 때문에 RPE 이식이 광수용체21을 지원하는 생리적 기능을 수행할 수 있도록 하기 때문이다. 호스트 RPE를 제거하지 않으면 기계적 장벽으로 포즈가 있어 이 단지의 복원을 방지할 수 있습니다. 그것은 RPE 독성 화학 물질의 관리를 통해 또는 제거의 물리적 수단을 사용 하 여 제거 될 수 있습니다. 화학적 제거 방법은 iodate31,32 나트륨의 전신 또는 적정 투여를 포함한다. 나트륨 iodate는 투여 시 광수용체, RPE 세포 및 Choriocapillaris의 광범위한 변성을 유발하므로 망막 및 전신 독성은 인체 실험에 대한 사용을 배제합니다32,33. 따라서, 물리적 인 수술 내 기술이 바람직하다. 다양한 물리적 방법이 개념화되었습니다. 물리적 인 방법을 활용하면 브루치의 멤브레인이 손상되지 않은 상태로 유지하는 것이 중요합니다. 많은 시험관 내 연구는 그대로 브루흐의 막에 RPE 이식 생존의 의존성을 입증했다34,35,36.
유압 탈면에 대한 시도는 브루흐의 막의 휴식, epiretinal 막 개발의 증가 속도 및 증식 유리체 병증과 관련이 있었으며, 그 결과 견인 망막 분리37이 발생했습니다. RPE 신부를 위해 제안된 다이아몬드 먼지주걱은 또한 브루치의 막에서 휴식으로 이어졌고, 그 결과 choroid에서 체하 공간으로세포 증식이 발생했습니다38. 흥미롭게도, 사용자 정의 확장 루프 악기는 토끼와 돼지의 눈에 브루치의 막의 보존과 과열 RPE를 제거 할 수 11,39. 기본 RPE의 제거는 AMD의 고급 위축 형태와 유사한 RPE 및 외부 망막 위축을 가진 동물 모델을 확립하는 데에도 유용합니다. RPE의 초점 영역이 황반에서 제거되면, RPE 상처는 나머지 RPE 세포의 비대를 통해 닫힙다. 그러나, 이러한 상처 치유 반응은 외부 핵층40의 위축과 연관된다. 동물 모델의 생성은이 원고의 범위를 벗어난 동안, 유사한 절차는 RPE 유래 세포 치료제의 시험을위한 고급 위축 AMD 표현형의 동물 모델을 만들 수 있습니다.
면역원생 이식 거부를 줄이기 위해 시롤리무스, 트리암시놀론, 독시사이클린 및 미노사이클린을 사용하여
감하 공간은 면역 특권 사이트로 생각된다, 그대로 혈액 망막 장벽 및 기타 요인에 의해 유지41. 줄기 세포 유도체의 피망 이식과 관련된 많은 연구에서 는 혈액 망막 장벽이 있는 면역 억제 약물이 이식 생존42에서 무시할 만한 역할을 합니다. 외부 혈액 망막 장벽은 RPE 세포 사이의 기본 RPE 층과 단단한 접합에 의해 형성될 것으로 생각됩니다. 네이티브 RPE 제거는 이식된 RPE 및 호스트 광수용체의 더 나은 통합을 허용하는 동안, 혈액 망막 장벽은 그 과정에서 중단되어 면역 거부의 가능성을 증가시킵니다. 고전적으로, T 세포는 신장과 liver43과 같은 그밖 기관의 이식 거부의 프로세스에 중심입니다. 따라서 망막 조직 이식을 위한 초기 면역 억제 요법은 이러한 적응성 면역 반응을 감소시키는 쪽으로 표적으로 삼았습니다.
라파엘린 억제제의 기계론적 표적인 시롤리무스와 칼시뉴린 억제제인 타크롤리무스는 적응형 면역 반응을 표적으로 하는 면역억제제의 예입니다. 그러나, 적당한 T 세포 억제에도 불구하고, 접목 생존율은 낮게 남아 있습니다. 또한, RPE 세포는 억제인의 방출을 통해 T 세포 활성화를 억제하고 조절T-cells44의 생성을 촉진하는 것으로 알려져 있다. 따라서 적응성 면역이 이식 거부에 유일한 기여자가 아닐 수 있다는 것이 점점 더 명백해지고 있습니다42. 셀룰러 제품의 부수 이식은 microglia45의 축적 및 활성화를 초래할 수 있습니다.
마이크로글리아는 망막의 대식세포입니다. 그(것)들은 2개의 주요 인구로 이루어져 있습니다: 1) 내부 망막 혈관증의 경피 현미경 및 2) 망막 조직 parenchyma 내의 microglia. microglia는 타고난 면역 반응의 일부이기 때문에 트리암시놀론과 같은 인트라비티리얼 글루코코르티코이드는 사이토카인 매개 증식46을 억제할 수 있습니다. 독시사이클린과 미노사이클린은 또한 마이크로글리아활성화를 억제할 수 있으며 47,48로 간주되어야 한다. 마지막으로, 접이식 대 RPE 동종 이식의 면역 거부의 차이는 불완전하게 이해된다49. 예를 들어, 유도된 다능줄기 세포 유래 RPE 세포에 대한 동산항체는 생체 내 면역 거부 모델의 혈청에서 보고되었다. 그러나, 이들 항체의 역할과 이식 생존에 있는 항체 중재거부의 중요성은 알려지지 않은 남아 있다50. 따라서 적응면역 억제를 위한 시롤리무스를 이용한 다약물 요법과 트리암시놀론, 독시사이클린 및 미노사이클린의 결합을 통해 타고난 면역 억제를 위한 약물 요법이 제안된다. 이 처방은 성공적으로 좋은 이식 생존 결과와 최소한의 전신 효과 토끼에서 사용되었습니다11.
이 수술 기술의 한계
이 논문은 NHP의 하수 공간에 RPE 이식 시트를 전달하는 가능한 수술 방법을 설명합니다. 그러나 이것이 유일한 최적화된 방법이라는 것을 의미하지는 않습니다. 다른 vitreo 망막 외과 의사는 계측 및 기술에 대한 다른 환경 설정을 가질 수 있습니다. 예를 들어, 이 이식 장치 설계는 더 단단한 세포담체로 서포트되는 평평한 임플란트만 제공할 수 있으므로 상대적으로 유연한(또는 압연) 임플란트에 적합하지 않을 수 있습니다. RPE 서스펜션 이식은 이 기술의 대부분을 생략할 수 있습니다. 따라서, 수술 세부 사항은 각 전달 전략에 따라 수정이 필요합니다.
퇴행성 망막 질환의 치료를 위한 세포 치료제에 대한 관심이 계속 증가함에 따라 NHP 동물 모델은 RPE 이식 생존에 영향을 미치는 요인을 연구하기 위한 전임상 연구에서 필수적입니다. 이 원고에서는 NHP 눈에서 하반신 단층 RPE 이식편을 원활하게 전달할 수 있도록 전략이 제안됩니다. 수술 중 합병증의 더 나은 시각화를 위한 방법도 권장됩니다. 이러한 방법은 세포 치료제의 사용이 확대됨에 따라 계속 개선될 것으로 예상됩니다. 향후 방법 논문은 또한 접목의 다양한 구조적 및 기능적 측면을 평가하기 위한 포괄적인 조사 목록을 제안하는 것을 고려해야 합니다.
공개
Boris Stanzel은 이 연구에서 사용되는 계기(RPE 스크레이퍼)에 대한 미국 특허 9980851 보유하고 있습니다. C. 자이스 메디텍과 구더에서 보리스 스탠젤까지 연사 명예. 다른 저자들은 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 IAF-PP (HMBS 도메인) (OrBID): OculaR BIomaterials 및 장치, A * STAR, 싱가포르 (H17/01/a0/013), NUS 스타트업 보조금 NUHSRO/2016/100/SU/01, NUHS 임상 과학자 프로그램 (NCSP) 보조금 및 국가 연구 재단 경쟁 연구 프로그램, 싱가포르 (NRF-CRP21-2018-0008) X.S.에, 홍레옹은 G.E.H. 및 B.V.S.에 교수 기금을 부여. 우리는 NHP 수술 준비 및 동물 후속 조치에 지원을 제공하기 위한 번역 전 임상 모델 플랫폼(싱가포르 안과 연구소, 싱가포르)의 수의학 팀을 인정하고 싶습니다. 우리는 통합 수술 내 OCT 장치OPMI-Lumera 700에 대한 기술 지원을 위해 C. 자이스 메디텍 싱가포르의 질 테오와 동료들에게 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
참고문헌
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유