Method Article
Retinale Pigmentepitheltransplantation in einem nicht-menschlichen Primatenmodell für degenerative Netzhauterkrankungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Der nicht-menschliche Primat (NHP) ist aufgrund der anatomischen und genetischen Ähnlichkeiten ein ideales Modell für die Untersuchung der zellulären Therapeutika der menschlichen Netzhaut. Dieses Manuskript beschreibt eine Methode zur submakulären Transplantation von retinalen Pigmentepithelzellen im NHP-Auge und Strategien zur Verhinderung intraoperativer Komplikationen im Zusammenhang mit der Makulamanipulation.
Zusammenfassung
Die retinale Pigmentepitheltransplantation (RPE) ist vielversprechend für die Behandlung von vererbten und erworbenen degenerativen Erkrankungen der Netzhaut. Zu diesen Erkrankungen gehören Retinitis pigmentosa (RP) und fortgeschrittene Formen der altersbedingten Makuladegeneration (AMD), wie z. B. geografische Atrophie (GA). Zusammen machen diese Störungen einen signifikanten Anteil der derzeit nicht behandelbaren Blindheit weltweit aus. Diese ungedeckten medizinischen Bedürfnisse haben ein erhöhtes akademisches Interesse an der Entwicklung von Methoden des RPE-Ersatzes geweckt. Unter den Tiermodellen, die üblicherweise für präklinische Tests von Therapeutika verwendet werden, ist der nicht-menschliche Primat (NHP) das einzige Tiermodell, das eine Makula hat. Da es diese anatomische Ähnlichkeit mit dem menschlichen Auge teilt, ist das NHP-Auge ein wichtiges und geeignetes präklinisches Tiermodell für die Entwicklung von Arzneimitteln für neuartige Therapien (ATMPs) wie der RPE-Zelltherapie.
Dieses Manuskript beschreibt eine Methode zur submakulären Transplantation einer RPE-Monoschicht, kultiviert auf einem Polyethylenterephthalat (PET)-Zellträger unterhalb der Makula auf eine chirurgisch erzeugte RPE-Wunde in immunsupprimierten NHPs. Die Fovea - der zentrale avaskuläre Teil der Makula - ist der Ort der größten mechanischen Schwäche während der Transplantation. Foveal trauma tritt auf, wenn die anfängliche subretinale Flüssigkeitsinjektion eine übermäßige Kraft auf die Netzhaut erzeugt. Daher wird eine langsame Injektion unter Perfluorcarbon liquid (PFCL) Glaskörpertamponade mit einer subretinalen Injektionskanüle mit zwei Bohrungen bei niedrigem Augeninnendruck (IOD) empfohlen, um einen netztinalen Bleb zu erzeugen.
Eine Vorbehandlung mit einer intravitrealen Plasminogen-Injektion zur Freisetzung parafovealer RPE-Photorezeptor-Adhäsionen wird ebenfalls empfohlen. Diese kombinierten Strategien können die Wahrscheinlichkeit von Fovealrissen im Vergleich zu herkömmlichen Techniken verringern. Das NHP ist ein wichtiges Tiermodell in der präklinischen Phase der RPE-Zelltherapieentwicklung. Dieses Protokoll adressiert die technischen Herausforderungen, die mit der Verabreichung der RPE-Zelltherapie im NHP-Auge verbunden sind.
Einleitung
Die RPE-Transplantation ist vielversprechend für die Behandlung von erblichen und erworbenen degenerativen Netzhauterkrankungen. Zu diesen Erkrankungen gehören Retinitis pigmentosa (RP, Stäbchen-Zapfen-Dystrophie) und fortgeschrittene Formen der AMD wie GA. Insgesamt stellen diese Erkrankungen einen signifikanten Anteil der derzeit nicht behandelbaren Blindheit weltweit dar1,2. Die fortgeschrittenen Stadien der AMD werden in neovaskuläre AMD (nAMD) und GA eingeteilt. Während es wirksame Behandlungsmöglichkeiten für nAMD gibt, wie z.B. Anti-Vaskuläre Endothel-Wachstumsfaktor-Injektionen (Anti-VEGF), haben Patienten mit GA nur begrenzte Behandlungsmöglichkeiten. RP ist eine sehr heterogene Gruppe von vererbten Netzhauterkrankungen, die durch eine fortschreitende retinale Photorezeptordegeneration gekennzeichnet sind. Bei einigen Patienten befindet sich der ursächliche genetische Defekt innerhalb der RPE und nicht in den Photorezeptoren; Daher kann die RPE-Ersatztherapie eine alternative Strategie sein, wenn eine Gentherapie nicht durchführbar ist.
Es besteht ein erhebliches Interesse an der Entwicklung wirksamer Behandlungen für diese Erkrankungen. Insbesondere die RPE-Transplantation hat als potenzieller therapeutischer Ansatz an Zugkraft gewonnen3,4,5,6,7,8. Seit den ersten Berichten über RPE-Transplantationen in den 1980er Jahren9 hat sich das Feld um verschiedene RPE-Zellquellen, Lieferstrategien und experimentelle Modelle von Krankheit und Transplantation erweitert10,11,12,13,14. Unter den verschiedenen Tiermodellen hat nur das NHP eine "Makula lutea" mit einer "Fovea centralis", einer anatomischen Spezialisierung am hinteren Pol der Netzhaut, die mit dem Menschen geteilt wird. Die Fovea enthält eine sehr hohe Dichte an Kegel-Photorezeptoren, die ein hochauflösendes zentrales Sehen ermöglichen15. Das NHP hat auch eine ähnliche genomische und proteomische Zusammensetzung16 im Vergleich zum Menschen. Diese Ähnlichkeiten machen es zu einem wichtigen und geeigneten Tiermodell für die Untersuchung von Augenerkrankungen, die die menschliche Netzhaut betreffen17,18.
Dieses Manuskript beschreibt eine Methode zur submakulären Transplantation eines RPE-Xenotransplantats, unterstützt durch einen PET-Zellträger, in immunsupprimierte NHPs. Eine transvitreale Technik zur subretinalen RPE-Transplantation bei Kaninchen wurde in einem früheren Manuskript beschrieben19. Bei NHPs erfordert das Vorhandensein der Fovea jedoch während der intraoperativen Manipulation besondere Vorsicht20. Insbesondere besteht ein hohes Risiko für einen Fovealriss, wenn subretinale Flüssigkeitsinjektionsmethoden eine übermäßige Kraft auf die Netzhaut erzeugen20. Der Schwerpunkt dieses Manuskripts liegt daher auf Strategien zur Verringerung des Risikos eines unbeabsichtigten Fovealtraumas bei NHP.
Dazu gehören der Einsatz der präoperativen intravitrealen Plasminogeninjektion zur Freisetzung parafovealer Adhäsionen und die intraoperative chirurgische mikroskopintegrierte optische Kohärenztomographie (miOCT) zur Echtzeit-Visualisierung der fovealen Anatomie. Eine maßgeschneiderte 25/41 G Dual-Bore Subretinalkanüle mit intraokularer PFCL-Tamponade unter niedrigen IOD-Einstellungen wird vorgeschlagen, um einen kontrollierteren Prozess der Fovealablösung zu ermöglichen. Darüber hinaus wird vor der Implantation eine chirurgische Entfernung der nativen RPE empfohlen, um eine bessere Integration zwischen den transplantierten RPE-Zellen und den Wirtsphotorezeptoren zu ermöglichen. Schließlich wird ein peri- und postoperatives systemisches Immunsuppressionsprotokoll für NHP-Modelle beschrieben, um das Überleben des RPE-Xenotransplantats nach der Transplantation zu verbessern11,21.
Protokoll
HINWEIS: Alle Tierversuche wurden in Übereinstimmung mit der Association of Research in Vision and Ophthalmology (ARVO) for the Use of Animals in Ophthalmic and Vision Research durchgeführt. Die Ethikgenehmigung wurde vom Institutional Animal Care and Use Committee, SingHealth, Singapur, eingeholt. Die Tiere wurden im SingHealth Experimental Medicine Centre untergebracht, das von der Association for Assessment and Accreditation of Laboratory Animal Care (AAALAC) zugelassen ist. Diese Genehmigung unterstreicht, dass alle Tierversuche den Standards des National Advisory Committee for Laboratory Animal Research entsprechen, die von der Agri-Food and Veterinary Authority of Singapore festgelegt wurden. Das folgende experimentelle Protokoll wurde auf der Grundlage von Experimenten erstellt, die an 6 Augen von 6 Macaca fascicularis (4 männlich und 2 weiblich, 4 bis 6 Jahre alt, 2,8 bis 4,0 kg) durchgeführt wurden .
1. Immunsuppression im NHP-Modell erreichen
- Beginnen Sie die Immunsuppression 7 Tage vor der Operation und setzen Sie die Immunsuppression während der gesamten Nachbeobachtungszeit fort.
- Wägen Sie das NHP vor der Verabreichung einer systemischen Immunsuppression ab, um eine genaue Medikamentendosierung sicherzustellen. Das Tier wird zu Studienbeginn und danach wöchentlich gewogen.
- Verwenden Sie oralen Sirolimus, Doxycyclin und Minocyclin, um eine systemische Immunsuppression zu erreichen.
- Verabreichen Sie eine Aufsättigungsdosis von 2 mg oralem Sirolimus, gefolgt von einer täglichen Erhaltungsdosis von 1 mg. Erhalten Sie vor der Verabreichung einen Sirolimusspiegel im Blut und überwachen Sie diesen während der gesamten Nachbeobachtungszeit. Stellen Sie eine Konzentration von mindestens 5 μg/L für eine ausreichende Immunsuppression sicher.
HINWEIS: Die Sirolimus-Dosis ist nicht gewichtsangepasst. - Verabreichen Sie eine Dosis von 7,5 mg/kg oralem Doxycyclin pro Tag, zweimal täglich.
- Verabreichen Sie eine Dosis von 7,5 mg/kg oralem Minocyclin pro Tag, zweimal täglich.
- Verabreichen Sie eine Aufsättigungsdosis von 2 mg oralem Sirolimus, gefolgt von einer täglichen Erhaltungsdosis von 1 mg. Erhalten Sie vor der Verabreichung einen Sirolimusspiegel im Blut und überwachen Sie diesen während der gesamten Nachbeobachtungszeit. Stellen Sie eine Konzentration von mindestens 5 μg/L für eine ausreichende Immunsuppression sicher.
- Überwachen Sie während der Immunsuppression alle NHPs auf unerwünschte systemische Wirkungen. Suchen Sie nach signifikantem Körpergewichtsverlust (>10%), vermindertem Appetit und Wasserverbrauch, ungepflegtem Haarausfall und abnormalem Verhalten wie Aggression und Lethargie. Die Bewertungen werden an Tag 3, 14 und 1 Monat durchgeführt, gefolgt von monatlichen Bewertungen.
2. Instrumentensterilisation
- Spülen Sie die chirurgischen Instrumente mit destilliertem Wasser ab.
- Legen Sie die Instrumente in ein Ultraschallbad, das mit 500 ml destilliertem Wasser und 2 ml Instrumentendesinfektionsmittel gefüllt ist. Reinigen Sie die Instrumente mit der Sweep-Funktion des Ultraschallbades für 15 min.
- Entfernen Sie die Instrumente aus dem Ultraschallbad. Zweimal gründlich mit destilliertem Wasser für jeweils 5 min abspülen. Trocknen Sie die Instrumente nach dem Spülen an der Luft.
- Legen Sie die Instrumente in einen Instrumentenkasten. Autoklavieren Sie die Box mit der universellen Programmeinstellung (Sterilisation von Instrumenten bei 134 °C für 50 min: 30 min für Autoklavieren, 20 min für die Trocknung).
3. Herstellung von konservierungsmittelfreiem Triamcinolon (40 mg/ml)
- Ziehen Sie mit einer 1-ml-Spritze 1 ml Triamcinolon-Lösung (10 mg / ml) ab. Übertragen Sie es in ein konisches 15-ml-Röhrchen und mischen Sie es mit 4 ml steriler ausgewogener Salzlösung (BSS).
- Zentrifugieren Sie die Lösung bei 120 × g für 5 min. Stellen Sie sicher, dass sich alle Triamcinolonpartikel am Boden des konischen Rohrs befinden. Entsorgen Sie den Überstand (BSS) aus dem konischen Rohr.
- Resuspensieren Sie die Triamcinolon-Partikel mit 5 ml sterilem BSS im konischen Röhrchen. Zentrifugieren Sie die Lösung bei 120 × g für 5 min. Verwerfen Sie den Überstand erneut.
- Wiederholen Sie Schritt 3.3, um das Waschen der Triamcinolon-Partikel mit BSS (3x) abzuschließen.
- Suspendieren Sie die Triamcinolon-Partikel mit 0,25 ml sterilem BSS erneut, um eine Konzentration von 40 mg / ml zu erreichen.
- Aspirieren Sie das re-suspendierte Triamcinolon (40 mg/ml) mit einer neuen 1 ml Spritze. Befestigen Sie eine 25 G stumpfe Spitzennadel und halten Sie die Spritze mit der Triamcinolon-Lösung für die intraoperative Anwendung bereit.
4. Vorbehandlung von NHP-Augen mit intravitrealem Plasminogen (0,25 μg/μL)
- Eine Woche vor der Operation eine intravitreale Injektion (20 μL) von Affenplasminogen (0,25 μg/μL) verabreichen.
- Sedieren Sie das NHP vor dem Eingriff mit einer intramuskulären Injektion von Ketamin (10-20 mg/kg KG) und einer subkutanen Injektion von Atropin (0,05 mg/kg KG). Verabreichen Sie Tetracain-Augentropfen zur örtlichen Betäubung.
- Vor der intravitrealen Injektion desinfizieren Sie die periorbitale Region mit 10% Povidon-Jod. Desinfizieren Sie das Auge, indem Sie 5% Povidon-Jod an die Bindehautfornizen des NHP verabreichen. Stellen Sie sicher, dass die Lösung mindestens 1 min in den Vorderräumen verbleibt, bevor Sie sie gründlich mit sterilem BSS spülen.
- Verwenden Sie eine 250 μL Spritze, um das vorverdünnte Affenplasminogen (0,25 μg/μL) aus der Durchstechflasche abzusaugen. Befestigen Sie eine 30 G Nadel an der Spritze und halten Sie das Affenplasminogen für die intravitreale Verabreichung bereit.
- Verwenden Sie ein Paar Bremssättel, um die Injektionsstelle am Auge zu identifizieren. Verabreichen Sie die intravitreale Injektion 3 mm vom Limbus entfernt.
- Fahren Sie mit der Injektion fort, wobei die Nadel auf die Mitte des Globus gerichtet ist. Verwenden Sie nach dem Entfernen der Nadel von der Kugel einen Baumwollapplikatorstab, um die Injektionsstelle zu tamponieren und den Rückfluss des intraokularen Inhalts zu verhindern.
- Verabreichen Sie ein Gleitgel oder eine Salbe, um die sofortige postoperative Reizung der Augenoberfläche zu reduzieren.
5. Chirurgischer Tisch und Geräteaufbau
- Richten Sie ein steriles Feld ein. Wenn Sie sich im sterilen Bereich befinden, tragen Sie jederzeit chirurgische Peelings, Maske und Haarbedeckung.
- Bereiten Sie das konservierungsmittelfreie Triamcinolon (40 mg/ml) zur intraoperativen Visualisierung von Glaskörpern vor (siehe Abschnitt 3). Bereiten Sie das sterile BSS in einer 10-ml-Spritze und das Gleitmittel in einer 5-ml-Spritze vor. Legen Sie sie auf einen Vorhang.
- Halten Sie andere Instrumente auf einem Vorhang bereit, einschließlich 3-0 Seide, 7-0 Vicrylnähte, Baumwollapplikator-Sticks, gewickelte Verschlussstreifen und Kronleuchter-Endölluminationsfaserdraht.
- Verbinden Sie das Vitrektomie-Set, einschließlich des Hochgeschwindigkeits-Vitrektors, der Venturi-Kassette und des 25 G Kronleuchter-Endölluminators, mit steriler Technik mit dem Vitrektomiegerät.
- Öffnen Sie eine 500 ml BSS-Flasche in Augenqualität und schließen Sie sie gemäß den Anweisungen des Herstellers an die Venturi-Kassette an. Fahren Sie mit dem Vorbereiten des Systems fort.
- Schalten Sie das miOCT/Operationsmikroskop ein. Wählen Sie voreingestellte Konfigurationen des Operationsmikroskops für die Chirurgie und Beleuchtung des hinteren Segments. Geben Sie die Details des Verfahrens ein, einschließlich ID, Geschlecht, Lateralität des Tierauges und den Namen des Verfahrens.
- Montieren Sie ein berührungsloses, weitwinkliges 128-Grad-Fundusobjektiv.
- Befestigen Sie sterile Einweg-Handstückabdeckungen am Operationsmikroskop/miOCT. Stellen Sie die Position und den Fokus des Mikroskops mit dem Fußpedal ein. Fahren Sie mit der Operation fort.
6. Vorbereitung der Anästhesie und Positionierung des Tieres (vorzugsweise durchgeführt von einem Tierarztteam)
- Stellen Sie sicher, dass das NHP mindestens 8 Stunden vor der Einleitung der Anästhesie gefastet wird, um Aufstoßen und Erbrechen zu verhindern. Sedieren Sie das NHP vor der Einleitung der Anästhesie (siehe Schritt 4.2 für Sedierungsanweisungen).
- Tragen Sie 1% Tropicamid und 2,5% Phenylephrin-Augentropfen mindestens 3x mit 5-minütigen Intervallen auf, um eine Pupillenerweiterung zu erreichen.
- Verabreichen Sie 30 Minuten vor der Operation eine intramuskuläre Injektion von Buprenorphin (0,005-0,03 mg/kg KG), um eine Analgesie zu erreichen.
- Intubieren Sie das NHP mit einem Endotrachealtubus, normalerweise 3-5 mm groß. Stellen Sie beim Versuch der Intubation sicher, dass mehrere Größen verfügbar sind. Verwenden Sie die größte Größe, die durch den Kehlkopf geführt werden kann, ohne ein Trauma zu verursachen. Messen Sie das CO2 der Gezeiten, um eine angemessene Platzierung des Endotrachealtubus sicherzustellen.
- Geben Sie 2% Isofluorangas über den Endotrachealtubus ab, um eine Vollnarkose zu induzieren. Bestätigen Sie den Zustand der Vollnarkose (fehlende Reaktion auf Berührung), indem Sie die Reaktion des NHP auf umgebende Reize, einschließlich Geräusche und Berührungen, beurteilen. Verwenden Sie 0,5-2% Isofluorangas, um den Zustand der Vollnarkose aufrechtzuerhalten.
- Überwachen Sie kontinuierlich das NHP-Elektrokardiogramm, die Atemfrequenz, den Blutdruck und die Sauerstoffsättigung während der gesamten Operation.
- Positionieren Sie das NHP auf dem Operationstisch so, dass das Auge senkrecht zum Operationsmikroskop steht. Verabreichen Sie dem Auge ein Gleitgel oder eine Salbe, die nicht operiert wird, um die Reizung der Augenoberfläche während der Anästhesie zu reduzieren.
- Schneiden Sie die Wimpern mit einer Schere ab, um die Wahrscheinlichkeit von Infektionen zu verringern.
- Desinfizieren Sie die periorbitale Region mit 10% Povidon-Jod. Desinfizieren Sie das Auge, indem Sie 5% Povidon-Jod an die Bindehautfornizen des NHP verabreichen. Stellen Sie sicher, dass die Lösung mindestens 1 min in den Vorderräumen verbleibt, bevor Sie sie gründlich mit sterilem BSS spülen.
- Positionieren Sie einen sterilen Vorhang so, dass die vorgeschnittene Öffnung über das Auge zentriert ist, um sich einer Operation zu unterziehen. Bedecken Sie das Auge mit einem adhäsiven chirurgischen Einschnittvorhang.
- Führen Sie eine laterale Canthotomie am Auge durch, um sich einer Operation zu unterziehen.
- Führen Sie das Lieberman-Spekulum ein, um eine ausreichende Öffnung der Augenlider für die Visualisierung des Auges zu gewährleisten.
7. Vitrektomie
HINWEIS: Für den Zugang zum subretinalen Raum für die Abgabe des PET-Gerüst-RPE-Transplantats empfiehlt dieses Protokoll eine 4-Port (ventilierte) 25 G Vitrektomie, die mit einem standardmäßigen vitreoretinalen chirurgischen Setup und einer berührungslosen, weitwinkligen 128 ° -Funduslinse durchgeführt wird. Das Protokoll empfiehlt auch die Verwendung eines mit miOCT ausgestatteten Operationsmikroskops, um mehrere kritische chirurgische Schritte zu steuern, einschließlich der Induktion der Fovealablösung, der Implantation des RPE-Transplantats und der subretinalen Flüssigkeitsdrainage.
- Führen Sie eine 360° Bindehautperitomie durch, indem Sie die Bindehaut in der Nähe des Limbus mit einer Vannas-Schere einschneiden. Vergrößern Sie die Peritomie, indem Sie eine stumpfe Dissektion durchführen.
- Führen Sie mit einer 25 G mikrovitreoretinalen Klinge eine Sklerotomie bei 8 Uhr für das rechte Auge oder 4 Uhr für das linke Auge durch. Führen Sie die Sklerotomie 3 mm vom Limbus des Auges aus.
- Einsetzen und Nähen einer 25 G benutzerdefinierten Seitenportinfusionskanüle mit 7-0 Vicrylnaht. Nachdem Sie den intravitrealen Standort bestätigt haben, starten Sie die BSS-Infusion und stellen Sie das System so ein, dass es einen IOD von 20 mmHg aufrechterhält.
- Führen Sie mit einer 25 G Flachkopftrochar eine Sklerotomie bei 2 Uhr für das rechte Auge oder 10 Uhr für das linke Auge durch, wie in Schritt 7.2.
- Stecken Sie die 25 G Kronleuchterleuchte in die Flathead Trochar und sichern Sie sie mit Klebeband. Stellen Sie die Lichtquelle auf ca. 60% ein.
- Führen Sie eine weitere Sklerotomie, ähnlich wie Schritt 7.2, bei 10 Uhr für das rechte Auge oder 2 Uhr für das linke Auge durch. Platzieren Sie U-förmige Vicryl-7-0-Nähte um die Sklerotomie, ohne die Knoten zu binden. Führen Sie die Vitrektomie-Cutterspitze durch diese Sklerotomie ein.
- Beginnen Sie die Vitrektomie um die Eingangsöffnungen, gefolgt von einer kurzen Kernvitrektomie mit den folgenden Einstellungen: maximal 5000 Schnitte pro Minute, maximale Aspiration bei 400 mmHg.
- Injizieren Sie 20-50 μL Triamcinolon (40 mg / ml) für eine bessere Glaskörpervisualisierung.
- Induzieren Sie eine hintere Glaskörperablösung (PVD), indem Sie den Glaskörper von der Netzhaut trennen.
- Positionieren Sie den Vitrektor über der optischen Scheibe, um eine sanfte Induktion des PVD zu ermöglichen. Halten Sie den Vitrector nur beim Ansaugen bei der maximalen Einstellung von 400 mmHg ohne Schneiden.
- Verwenden Sie bei Bedarf eine intraokulare Pinzette von 25 G, um den Glaskörper am Bandscheibenrand zu manipulieren, um einen Riss im Glaskörperkortex zu erzeugen, um die Ablösung zu erleichtern.
HINWEIS: PVD gilt als erfolgreich, wenn Triamcinolonkristalle ungehindert über die Netzhautoberfläche gleiten.
- Öffnen Sie die hintere Zungenbeinmembran mit dem Cutter und entfernen Sie den abgelösten Glaskörperschürz bis zur Glaskörperbasis (am Netzhautäquator). Aspiraten Sie jedes verbleibende Triamcinolon auf der Netzhautoberfläche.
8. miOCT-geführte Fovealablösung
- Injizieren Sie 1-2 ml PFCL, um den hinteren Pol bis zur vorderen, mittelperipheren Netzhaut abzudecken.
- Betreten Sie das Auge mit einer subretinalen Injektionskanüle. Stellen Sie den IOD auf 0-4 mmHg an der Vitrektomiemaschine ein (stellen Sie ein perfekt wasserdichtes System sicher; bei Bedarf binden Sie Nähte um die Anschlüsse).
- Führen Sie entweder mit der 25/41 G kundenspezifischen subretinalen Injektionskanüle mit zwei Bohrungen oder der subretinalen 25/38 G Injektionskanüle, die an eine 250 μL-Spritze angeschlossen ist, vorsichtig eine subretinale Injektion von BSS durch, um eine lokalisierte Netzhautablösung zu induzieren. Sobald der Bleb gerade die Fovea überquert hat, stoppen Sie die Injektion. Erstelle ein zweites Bleb aus einer anderen Richtung. Verschmelzen Sie beide Blebs, um die Fovea vollständig zu lösen.
- Aktivieren Sie die miOCT-Funktion, um die Blebbildung zu visualisieren. Stellen Sie sicher, dass sich die Zeilen- und Würfelscans im HD-Modus befinden, mit den Einstellungen (512 x 128 Pixel, Scanbreite 4 mm), um ein Bild an der Fovea aufzunehmen. Beobachten Sie das miOCT-Bild für eine vollständige Ablösung der neuralen Netzhaut von der RPE-Schicht an der Fovea.
- Vergrößern Sie die Retinotomie auf 1,5 mm mit einer vertikalen 25 G Vitreoretinalschere, um den Zugang zum subretinalen Raum für die Transplantation zu ermöglichen.
9. Entfernung von nativem RPE
- Stellen Sie den IOP auf 50 mmHg am Vitrektomiegerät ein.
- Entfernen Sie die PFCL durch aktive Extrusion mit einer gebürsteten Silikonspitzenkanüle.
- Verlängern Sie die Sklerotomie mit einem 1,4 mm Inzisionsmesser, um den Eintritt eines 20 G-Instruments zu ermöglichen.
- Mit einem benutzerdefinierten erweiterbaren 20-G-Loop-Instrument schaben Sie die submakulare Host-RPE zum Entfernen ab. Schaben Sie einen Bereich, der mindestens 2 x 3 mm misst.
10. Laden des Schützen für die Lieferung der RPE-Zell-Monolayer-Transplantation
- Allgemeine Anweisungen zum Laden eines kugelförmigen Transplantats, das aus RPE-Kulturen auf PET-Zellträger geschnitten wurde, finden Sie in einer früheren Veröffentlichung22.
11. miOCT-geführte Transplantatimplantation und Positionseinstellung
- Führen Sie die Spitze des Shooter-Geräts bei einem IOD von 20 mmHg durch die Skleotomie ein. Injizieren Sie das Implantat in Richtung des subretinalen Raums über die retinotomiekante, die aus der Netzhautoberfläche erzeugt wird.
- Injizieren Sie das Implantat mit der Zellträgerseite, die der Bruch-Membran zugewandt ist, und der RPE-Xenograft-Seite, die den Photorezeptoren zugewandt ist.
- Aktivieren Sie die miOCT-Funktion, um die Implantatposition zu visualisieren. Stellen Sie sicher, dass das Implantat flach auf der Bruch-Membran im subretinalen Raum aufliegt, mit einer intakten darüber liegenden Netzhaut. Stellen Sie sicher, dass es sich in angemessener Entfernung von der erzeugten Retinotomie befindet und nicht auf die Retinotomiestelle einwirkt.
- Stellen Sie die Implantatposition mit der subretinalen Injektionskanüle oder einer 25 G gekrümmten Intraokularschere ein, um sicherzustellen, dass sie unter der Makula gut positioniert ist.
12. miOCT-geführte Drainage von subretinaler Flüssigkeit
- Führen Sie mit einer gebürsteten Silikonspitzenkanüle einen Flüssigkeits-Luft-Austausch und eine sorgfältige subretinale Flüssigkeitsdrainage durch. Versuchen Sie eine sanfte subretinale Flüssigkeitsaspiration aus der retinalen Ablösung der Brust und der Retinotomie-Kantenapposition.
- Aktivieren Sie die miOCT-Funktion für die Echtzeit-Visualisierung einer adäquaten subretinalen Flüssigkeitsdrainage, bis die Netzhaut wieder über dem Implantat befestigt ist.
13. Beenden des Vorgangs
- Schließen Sie die funktionierende Port-Sklerotomie mit der voreingestellten 7-0 Vicryl-Naht. Entfernen Sie den 25 G Kronleuchter und die 25 G Infusionskanüle. Schließen Sie diese Sklerotomien mit 7-0 Vicrylnähten.
- 2 mg in 0,05 ml intravitreal konservierungsmittelfreiem Triamcinolon (40 mg/ml) bei der 8-Uhr-Sklerotomie vor dem Nähen verabreichen.
- Tasten Sie das Auge ab, um sicherzustellen, dass der IOP im akzeptablen Bereich liegt. Spritzen Sie bei Bedarf gefilterte Luft (oder BSS) über eine 30 G Nadel ein.
- Nähen Sie die Bindehaut mit 7-0 Vicrylnähten und Kantotomie mit 5-0 Prolen (nach 10-14 Tagen entfernen).
14. Postoperative Tierpflege
- Positionieren Sie das NHP 1 h nach der Operation mit dem Gesicht nach unten. Lassen Sie das Tier nicht unbeaufsichtigt, bis das Bewusstsein wiedererlangt wurde. Stellen Sie sicher, dass ein Tierarzt und ein Tierpflegetechniker während des postoperativen Prozesses zur Beobachtung und Unterstützung zur Verfügung stehen.
- Wenden Sie topisches Antibiotikum (Tobramycin), Steroid (Dexamethason) Salbe und Homatropin Augentropfen zweimal täglich für 5 Tage postoperativ an.
- Verabreichen Sie eine weitere subkutane Buprenorphin-Injektion (0,005-0,03 mg/kg KG) 6 h nach der Operation zur adäquaten Schmerzkontrolle.
- Bringen Sie das NHP erst dann in die Gesellschaft anderer Tiere zurück, wenn es das Bewusstsein vollständig wiedererlangt hat.
- Führen Sie an Tag 3, 14 und Monat 1 nach dem Eingriff multimodale Bildgebungs-Follow-ups durch, gefolgt von monatlichen Untersuchungen. Führen Sie ERGs jeden Monat nach dem Eingriff durch. Entfernen Sie die 5-0 Prolennähte für die Kantotomie an Tag 14 gleichzeitig mit der Sedierungsperiode, die für die multimodale Bildgebung verwendet wird. Die restlichen Nähte sind resorbierbar, 7-0 Vicrylnähte, die nicht entfernt werden müssen.
15. Postoperative Überwachungsmethoden für die multimodale Bildgebung
- Beschleunigen Sie den NHP über Nacht. Sedieren Sie das NHP kurz vor der Bildgebung (siehe Schritt 4.2 für Medikament und Konzentration für die Sedierung). Wenn die Sedierung nicht ausreicht, um die Augenbewegung zu stoppen, sollten Sie die Verwendung einer Vollnarkose in Betracht ziehen.
- Tragen Sie vor der Bildgebung 1 % Tropicamid und 2,5 % Phenylephrin-Augentropfen auf, um eine Pupillenerweiterung zu erreichen (siehe Schritt 6.2).
- Führen Sie Autofluoreszenz (AF), Fundusfluorescein-Angiographie (FFA) und optische Kohärenztomographie (OCT) mit einem hochauflösenden OCT-Gerät mit einer 55°-Feldlinse und einer 30°-Feldlinse durch.
- Intravenöse Verabreichung von 10% Fluorescein (0,1 ml/kg KG) gegen FFA. Um ein Frühphasenbild zu erhalten, nehmen Sie ein Bild innerhalb von 30 s nach der Injektion auf. Für ein Spätphasenbild nehmen Sie ein Bild 5-10 Minuten nach der Injektion auf.
- Führen Sie Fundusfotografie mit einer Funduskamera zwischen der frühen und späten Phase der FFA durch.
16. Postoperative Überwachungsmethoden für Vollfeld-Elektroretinogramm-Studien (ERG)
- Beschleunigen Sie die NHPs über Nacht. Sedieren Sie das NHP vor ERG-Studien (siehe Schritt 4.2 für Medikament und Konzentration für die Sedierung). Führen Sie während der gesamten ERG-Aufzeichnungen die Sedierung bei Bedarf erneut durch.
- Separate multimodale Bildgebungs- und ERG-Aufnahmen mit einem Intervall von mindestens 2-3 Tagen.
- Stellen Sie nach der Sedierung sicher, dass das NHP 30 Minuten vor der ERG-Aufnahme dunkel angepasst ist.
- Positionieren Sie die subdermalen Nadelelektroden aus Edelstahl links und rechts an der lateralen Canthi (Referenzelektroden) und der Rückseite des NHP-Körpers (Masseelektrode). Platzieren Sie die ERG-Kontaktlinsenelektroden mit Vidisic-Gel auf der NHP-Hornhaut, um den Kontakt und die Haftung zu unterstützen.
- Alle ERG-Tests basieren auf den von der International Society for Clinical Electrophysiology of Vision (ISCEV)14 empfohlenen Humanprotokollen. Beginnen Sie mit der ERG-Aufnahme unter sotopischen Bedingungen und beginnen Sie mit den Dimmerblitzen. Befolgen Sie die ISCEV-Empfehlungen für empfohlene Interstimulusintervalle.
- Stellen Sie sicher, dass der NHP vor dem photopischen Test 10 Minuten lang lichtangepasst ist, und verwenden Sie erneut die Standard-ISCEV-Empfehlungen für die Hintergrundstärke.
17. Euthanasie von NHP
- Um das NHP zur Enukleation einzuschläfern, verabreichen Sie intravenöses Natriumpentobarbital (75 mg /kg), wie vom Panel on Euthanasia der American Veterinary Medical Association empfohlen.
Ergebnisse
Die multimodalen Bildgebungsmodalitäten (Fundusfotografie, Fundus-Autofluoreszenz-Bildgebung (FAF), Fundus-Fluorescein-Angiographie (FFA)-Frühphase und Spätphase sowie optische Kohärenztomographie (OCT)) heben die Merkmale einer erfolgreichen submakularen RPE-Transplantat hervor (Abbildung 1). Fundusfotografie zeigt die Positionierung des RPE-Transplantats an der Fovea ohne Migration im Laufe der Zeit. Die FAF-Bildgebung zeigt minimale Veränderungen in der Hyper-Autofluoreszenz (demonstriert durch weiße, hochintensive Bereiche), die das RPE-Transplantat überlappen. Früh- und Spätphasen-FFA zeigen keine offensichtliche Leckage (nachgewiesen durch weiße, hochintensive Bereiche, die sich mit der Zeit vergrößern) um das RPE-Transplantat herum. Erste Bilder an Tag 3 zeigen einen Fensterdefekt aufgrund der Entfernung von nativem RPE vor der Transplantatimplantation. Makula-OCT-Bilder zeigen die Erhaltung der äußeren Netzhautschichten (insbesondere der Photorezeptorschicht) über dem RPE-Transplantat im Laufe der Zeit. Die Hämatoxylin- und Eosinfärbung zeigt intakte Netzhautschichten ohne Anzeichen von Mikrotearen. Die Erhaltung der äußeren Kernschicht über den Peripherien des Transplantats deutet darauf hin, dass die RPE-Zellen ihre physiologischen Funktionen zur Aufrechterhaltung der Gesundheit des Photorezeptors erfüllen.
Die intraokularen und externen Ansichten der 25/41 G Dual-Bore-Kanüle zeigen den Mechanismus, durch den der IOD während der subretinalen Injektion gesteuert wird (Abbildung 2). BSS tritt während der subretinalen Flüssigkeitsinjektion über die zentrale längere Kanüle in den subretinalen Raum ein. Signifikante Erhöhungen des Augeninnendrucks führen dazu, dass das BSS in der Glaskörperhöhle das Auge über die größere Metallbohrung der Kanüle verlässt. BSS reist dann entlang der Kanüle und wird schließlich aus dem Ausgangshafen in der Nähe des Kanülenhubs ausgestoßen. Um zu beurteilen, ob die Kanüle wie erwartet funktioniert, stellen Sie sicher, dass Flüssigkeit aus dem Ausgangsanschluss in der Nähe des Kanülenhubs fließt.
Die miOCT ermöglicht die Visualisierung der Bleb-Dimensionen und eines möglichen Fovealrisses intraoperativ während der Fovealablösung (Abbildung 3). Abbildung 3A1-A3 zeigt einen Fall von Bleb mit einem Fovealriss. In Abbildung 3A1 ist die untere Blase zwar unter dem Operationsmikroskop sichtbar, die Visualisierung des Risses jedoch schwierig. Abbildung 3A2 zeigt den Längsschnitt eines Bleb ohne Risse. Abbildung 3A3 zeigt einen Fovealriss bei der Beurteilung des vertikalen Abschnitts der Bleb. Abbildung 3B1-B3 zeigt einen erfolgreich erzeugten Bleb ohne das Vorhandensein von Tränen.
Das Fehlen einer signifikanten Verschlechterung der ERG-Wellenformen deutet darauf hin, dass die globale Funktion sowohl der Stäbchen- als auch der Zapfen-Photorezeptoren mit subretinalen RPE-Xenotransplantaten aufrechterhalten wird (Abbildung 4). Die ERG-Wellenformen zeigen die Gesamtfunktion der Netzhaut. Insbesondere sollte auf die A-Wellen geachtet werden, um einen Verlust der Photorezeptorfunktion zu bestimmen.

Abbildung 1: Postoperative In-vivo-Analyse mit multimodaler Bildgebung. (A) In-vivo-Bildgebung der submakulären RPE-Transplantattransplantation des linken Auges (gelb auf Fundusfotografie) auf verschiedenen Bildgebungsmodalitäten (von links nach rechts Spalten: Fundusfotografie, Autofluoreszenz, Fundusfluorescein-Angiographie-Frühphase, Fundusfluorescein-Angiographie-Spätphase, optische Kohärenztomographie) für Zeiträume bis zu 3 Monaten (obere bis untere Reihen: Tage 3, 14; Monate 1, 3). Das Sternchen auf dem Fundusfoto zeigt den Ort der Retinotomie an; der weiß gestrichelte Pfeil zeigt die Richtung des Zeilenscans an. Die gelb gezeichnete Form auf der Fundus-Autofluoreszenz-Bildgebung hebt den Ort des Transplantats hervor. Die weißen Dreiecke auf den OCT-Bildern zeigen die jeweiligen seitlichen Ränder des Transplantats an (gemäß dem Zeilenscan auf dem Farbfundusbild). (B) Hämatoxylin- und Eosinfärbung des Transplantats unter atrophischer Fovea (aufgrund eines intraoperativen Risses) mit markierten Schichten. Maßstabsbalken = 1 mm in A (Autofluoreszenz- und FA-Bilder), 200 μm in A (OCT-Bilder) und 100 μm in B. Abkürzungen: FA = Fundusangiographie; OCT = optische Kohärenztomographie; RGC = retinale Ganglienzellschicht; INL = innere Kernschicht; ONL = äußere Kernschicht; RPE = retinales Pigmentepithel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
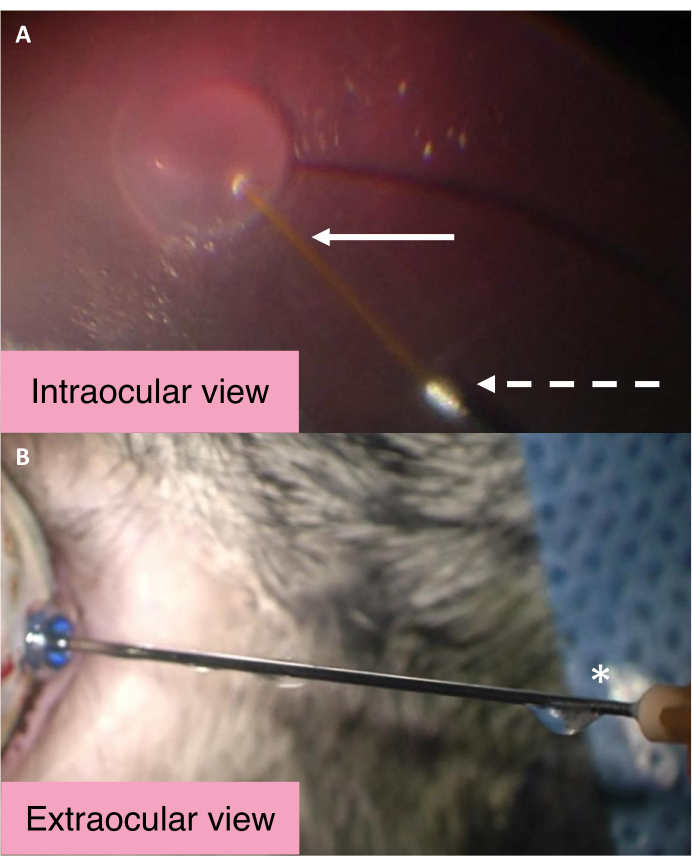
Abbildung 2: Intraokulare und externe Ansichten der 25/41 G Doppelrohrkanüle. (A) Intraokulare Ansicht der 25/41 G Doppelrohrkanüle während der subretinalen Blebbildung. Der weiße Pfeil zeigt auf die längere zentrale Kanüle zur subretinalen Injektion. Der gestrichelte Pfeil zeigt auf die Öffnung der Austrittskanüle, durch die das BSS geht, um das Auge zu verlassen. (B) Außenansicht der Doppelrohrkanüle 25/41 G. Das Sternchen markiert den Ausgangsanschluss in der Nähe des Kanülenknotens, aus dem das intraokulare BSS abgelassen wird. Abkürzung: BSS = Balanced Salt Solution. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
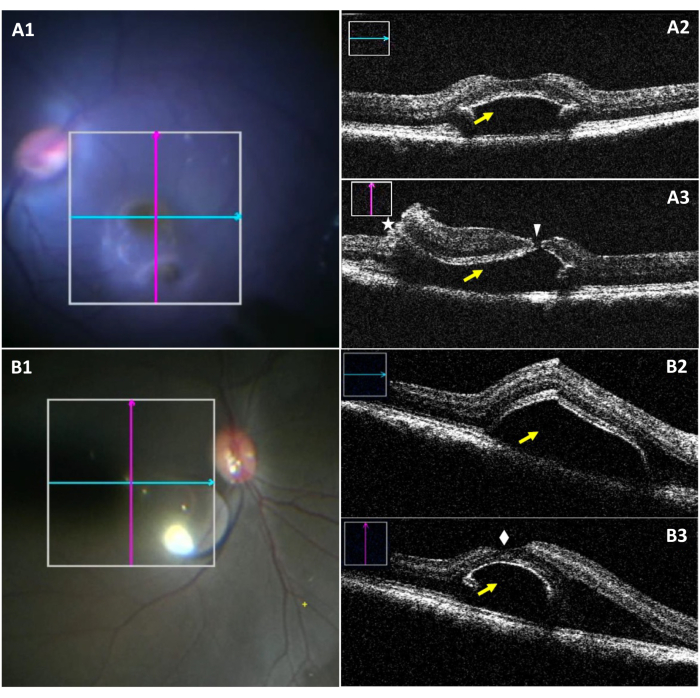
Abbildung 3: Intraoperative Mikroskopbilder und miOCT-Bilder von subretinalen Bleb, die durch einen Fovealriss kompliziert sind. (A1) Ein intraoperatives Mikroskopbild, das die Position von longitudinalen (blau) und transversalen (rot) Scans in einem Bleb mit einem Fovealriss zeigt. (A2) Longitudinaler miOCT-Scan mit einem subretinalen Bleb an der Fovealregion (gelber Pfeil). (A3) Transversaler miOCT-Scan, der einen fovealen Riss (weiße Pfeilspitze) zusammen mit einer Retinotomie (Sternchen und einen subretinalen Bleb (gelber Pfeil) erfasst. (B1) Ein intraoperatives mikroskopisches Bild, das die Position von longitudinalen (blau) und transversalen (rot) Scans in einem erfolgreich gebildeten Bleb zeigt. (B2) Longitudinaler miOCT-Scan mit einem subretinalen Bleb an der Fovealregion (gelber Pfeil). (B3) Transversaler miOCT-Scan, der einen erfolgreich erzeugten subretinalen Bleb mit einem intakten Fovea superior (weißer Diamant) zeigt. Abkürzung: miOCT = mikroskopintegrierte optische Kohärenztomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
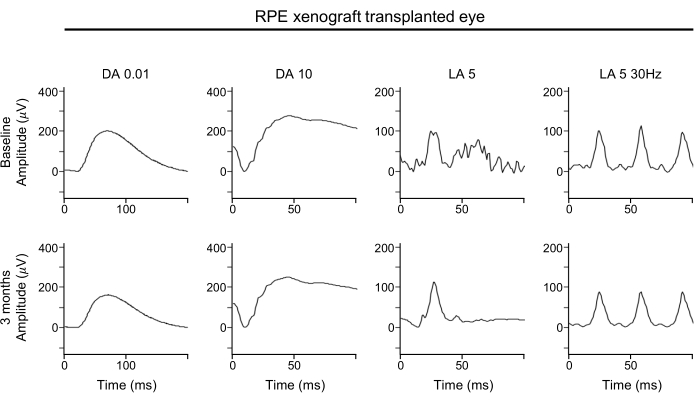
Abbildung 4: ERG des RPE-Xenotransplantat-transplantierten Auges. Für die funktionelle Beurteilung der Netzhaut zeigen Vollfeld-ERG-Beurteilungen des RPE-xenografierten Auges, die zu Studienbeginn (obere Reihe) und 3 Monate nach der Transplantation (untere Reihe) durchgeführt werden, keine signifikante Wirkung der RPE-Xenotransplantattransplantation auf Reaktionsamplituden, Timing oder Wellenform unter dunkel angepassten oder lichtangepassten Bedingungen. Abkürzungen: RPE = retinales Pigmentepithel; ERG = Elektroretinogramm; DA = dunkel angepasst; LA = lichtangepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es gibt zwei Hauptansätze, die für die submakuläre RPE-Transplantation evaluiert werden - die Injektion einer RPE-Suspension und die Transplantation eines monoschichtigen RPE-Transplantats. Ein detaillierter Vergleich zwischen den beiden Methoden würde den Rahmen dieses Manuskripts sprengen. Die Transplantation eines monoschichtigen RPE-Transplantats kann jedoch vorteilhaft sein, da die RPE-Zellen in einer Monoschicht besser organisiert sind als in einer Suspension. RPE-Zellen im Transplantat sind in einer konfluenten Monoschicht organisiert, die der Organisation der physiologischen RPE-Zellschicht ähnelt und es den transplantierten RPE-Zellen ermöglicht, ihre physiologischen Funktionen auszuführen. Dies ermöglicht präzisere Dosierparameter im Vergleich zu Zellsuspensionen, was für regulatorische Arbeiten und industrielles Scale-up von hoher Relevanz ist.
Die Abgabe des RPE-Pflastertransplantats in den subretinalen Raum erfordert eine sorgfältige Manipulation der Makula und eine genaue Einführung des Transplantats in den subretinalen Raum. Technologische Fortschritte in der Mikrochirurgie, wie miOCT, und ein besseres Verständnis der intraoperativen retinalen Gewebedynamik haben die Lernkurve dieses Verfahrens verkürzt. In dieser Diskussion werden die Gründe für die folgenden Aspekte erläutert: i) präoperative Plasminogeninjektion; ii) die Verwendung von intraoperativem miOCT; iii) die Verwendung einer kundenspezifischen 41 G Doppelrohrkanüle, niedrige IOD-Einstellungen und PFCL für die subretinale Bleb-Erstellung; iv) Abkratzen der nativen RPE-Zellschicht vor der Transplantation; v) die Verwendung von Sirolimus, Triamcinolon, Doxycyclin und Minocyclin zur Verringerung der immunogenen Transplantatabstoßung.
Präoperative Plasminogen-Injektionen setzen parafoveale retinale Adhäsionen frei
In den ersten Experimenten war es eine Herausforderung, die Fovea mit einer einzigen Flüssigkeitswelle zu lösen. Bei der Beurteilung mit miOCT zeigten die Bilder das Vorhandensein von parafovealen äußeren netztinalen Adhäsionen an der nativen RPE zusammen mit Hinweisen auf ein intraretinales Trauma20. Diese Adhäsionen könnten zu einer vertikalen Ausdehnung des Bleb geführt haben, anstatt dass sich die subretinale Flüssigkeitswelle über die Netzhautkontur ausbreitet, was zu einem Fovealtrauma führte. Plasminogen ist die inaktive Vorstufe von Plasmin, einer Protease, die auf Fibronektin und Laminin abzielt. Ocriplasmin ist eine biotechnologisch hergestellte Variante des menschlichen Plasmins, die von der Food and Drug Administration (FDA) und der Europäischen Arzneimittel-Agentur (EMA) für die Behandlung der symptomatischen vitreomakulären Traktion mit oder ohne begleitendes Makulaloch zugelassen ist. Berichte nach der Zulassung über die Entwicklung eines zystoten Makulaödems nach der Injektion von Ocriplasmin deuten jedoch auf eine umfassendere Wirkung des Enzyms auf die Netzhaut hin23.
Obwohl die genauen Mechanismen nicht identifiziert wurden, wurde vermutet, dass Plasmin die retinale Adhäsion durch den Abbau der Interphotorezeptormatrixelemente, die für die Photorezeptor-RPE-Adhäsion verantwortlich sind, schwächen könnte24. In diesem Protokoll wurden NHP-Augen 1 Woche vor der Operation mit intravitrealem Plasminogen behandelt, um die parafovealen äußeren netztinalen Adhäsionen freizusetzen. Unter der Annahme, dass die Photorezeptor-RPE-Adhäsion geschwächt ist, ist eine geringere Kraft erforderlich, um die neurosensorische Netzhaut zu lösen, einschließlich des distalen parafovealen Rings, der typischerweise der subretinalen Flüssigkeitswelle widersteht20. Daher führt die Kraft, die während der Retinalablösung verabreicht wird, zur Ausdehnung der Blase über die Netzhautkontur, anstatt die Netzhaut tangential zu dehnen. Dies reduziert das Risiko von Fovealrissen. Es sollte jedoch beachtet werden, dass die Wirkung von Plasminogen auf das langfristige Überleben von Transplantaten in diesem Protokoll nicht untersucht wurde. Zukünftige Studien sollten versuchen, diesen Effekt zu bestimmen.
miOCT bietet anatomisches Feedback zur Steuerung der subretinalen Blebbildung, der Transplantatimplantation und der subretinalen Flüssigkeitsdrainage
Die intraoperative, atraumatische Manipulation der Makula ist der Schlüssel zu guten Transplantationsergebnissen. Mikrostrukturelle Veränderungen der Makula im Zusammenhang mit der Manipulation sind jedoch auf dem Operationsmikroskop möglicherweise nicht immer offensichtlich. Bei solchen Verfahren ist die miOCT ein wichtiges Werkzeug, das eine dreidimensionale, intraoperative Rückmeldung der Makulastruktur in Echtzeit liefert. miOCT ist besonders nützlich bei den Schritten fovealer Ablösung, Transplantatimplantation und Drainage der subretinalen Flüssigkeit unter Verwendung eines Flüssigkeits-Luft-Austauschs. Während der Fovealablösung kann miOCT die vertikalen und horizontalen Abmessungen des Bleb bestimmen. Foveale Mikroteare, die auf dem Operationsmikroskop möglicherweise nicht eindeutig sichtbar sind, können durch miOCT bestätigt werden (Abbildung 3). Während der Implantation des Transplantats zeigen miOCT-Bilder die Lage des Transplantats oder die Nähe zur Fovea durch die oft weniger transparente, abgelöste Netzhaut. miOCT kann auch mögliche Bereiche der retinalen Adhäsion während eines schwierigen Transplantationsprozesses hervorheben25. Schließlich kann miOCT im subretinalen Flüssigkeitsdrainageprozess die subretinale Flüssigkeitsdrainage zuverlässig steuern, bis ein vollständiger Retina-RPE-Transplantatkontakt erreicht ist.
Die Kombination aus einer Dual-Bore-Kanüle, niedrigen IOD-Einstellungen und PFCL-Glaskörpertamponade reduziert synergistisch das Makulatrauma während der subretinalen Blebbildung
Tangentiale Netzhautdehnung und Flüssigkeitsturbulenzen können während der subretinalen BSS-Injektion zur Fovealablösung auftreten, die zu unerwünschten Fovealrissen führt. Um diesen Phänomenen entgegenzuwirken, haben sich Faktoren wie die relative Position und der Abstand vom Fovealzentrum, in dem die Injektion eingeleitet wird, Das Injektionsvolumen und die Injektionsgeschwindigkeit, die Glaskörpertamponade, die Wahl der subretinalen Instrumentierung und der IOD als relevant erwiesen20,26,27. Der subretinale Bleb für die Fovealablösung sollte sich an einem Ort befinden, der ausreichend von der Fovea entfernt ist, da die Netzhautdehnung an der Injektionsstelle der Bleb am höchsten sein kann27. Der IOD sollte auch während der gesamten Entstehung des subretinalen Bleb niedrig gehalten werden. Wenn der IOD des Auges hoch ist, wird eine höhere vertikale Zunahme der Bleb-Größe beobachtet als eine Ausdehnung entlang der Kontur der Netzhaut, während blebs bei niedrigeren Drücken flacher sind20. Obwohl eine intravitreale Injektion von 50 μL den IOD beim Menschen effektiv verdoppeln wird28, wird der IOD-Anstieg während der subretinalen Injektion angesichts der kürzeren Augenlänge bei NHPs wahrscheinlich höher und schneller sein als beim Menschen. Während sich die meisten Vitrektomiegeräte an die IOD-Fluktuation anpassen, ist die Anpassung kein gleichzeitiger, sondern ein reaktiver Prozess, der auftritt, wenn die subretinale Injektion fortschreitet. Je höher also der IOD, desto höher ist das Risiko einer Netzhautüberdehnung und eines daraus resultierenden Fovealtraumas. Daher ist es wichtig, während der subretinalen Injektion einen stabil niedrigen IOD aufrechtzuerhalten.
Für die subretinale Injektion wird eine handelsübliche 20/41 G (DORC) oder eine maßgefertigte 25/41 G Dual-Bore Subretinalkanüle empfohlen. Die Kanüle ermöglicht es Flüssigkeit, die Glaskörperhöhle im Austausch für BSS zu verlassen, das in den subretinalen Raum injiziert wird. Dies gewährleistet die "gleichzeitige" Regulierung des IOD während der subretinalen Injektion. Ein Schema der Doppelrohrkanüle ist in Abbildung 2 zu sehen. Schließlich wird PFCL verwendet, um das Risiko von Fovealrissen zu reduzieren20,26,27. Da PFCLs, wie Octalin, ein höheres spezifisches Gewicht haben, üben sie während der Fovealablösung eine Abwärtskraft auf die Netzhaut aus29. Dies stabilisiert den Fovealabsorptions-Bleb-Erstellungsprozess weiter und verbessert die Ausdehnung der Bleb entlang der Netzhautkontur. Diese Technik wurde erfolgreich für die subretinale Injektion von rtPA bei massiven submakulären Blutungen aufgrund von nAMD30 eingesetzt.
Die Entfernung von nativem RPE vor der Transplantation ermöglicht die Wiederherstellung des RPE-Photorezeptorkomplexes
Wirts-RPE sollte vor der Transplantattransplantation entfernt werden. Dies liegt daran, dass die Wiederherstellung des RPE-Photorezeptorkomplexes erforderlich ist, damit das RPE-Transplantat seine physiologischen Funktionen zur Unterstützung der Photorezeptoren erfüllen kann21. Die Host-RPE kann, wenn sie nicht entfernt wird, als mechanische Barriere fungieren, die die Wiederherstellung dieses Komplexes verhindert. Es kann entweder durch die Verabreichung von RPE-toxischen Chemikalien oder durch physikalische Entfernungsmittel entfernt werden. Chemische Entfernungsmethoden umfassen die systemische oder subretinale Verabreichung von Natriumjodat31,32. Da Natriumjodat bei Verabreichung eine weit verbreitete Degeneration von Photorezeptoren, RPE-Zellen und Choriocapillaris verursacht, schließt seine netztinale und systemische Toxizität seine Verwendung für Studien am Menschen aus32,33. Daher werden physikalische intraoperative Techniken bevorzugt. Verschiedene physikalische Methoden wurden konzeptualisiert. Bei physikalischen Methoden ist es entscheidend, dass die Bruch-Membran unbeschädigt bleibt. Viele In-vitro-Studien haben die Abhängigkeit des RPE-Transplantatüberlebens von einer intakten Bruch-Membran gezeigt34,35,36.
Versuche eines hydraulischen Debridements waren mit Brüchen in der Bruch-Membran, einer erhöhten Rate der epiretinalen Membranentwicklung und einer proliferativen Vitreoretinopathie verbunden, was zu einer traktionalen Netzhautablösung führte37. Ein diamantbestaubter Spatel, der für das RPE-Debridement vorgeschlagen wurde, führte ebenfalls zu Brüchen in der Bruch-Membran, was zu einer zellulären Proliferation von der Aderhaut in den subretinalen Raum führte38. Interessanterweise könnte ein speziell angefertigtes ausziehbares Loop-Instrument die darüber liegende RPE unter Beibehaltung der Bruch-Membran in den Augen von Kaninchen und Schweinen entfernen11,39. Die Entfernung der zugrunde liegenden RPE ist auch nützlich, um Tiermodelle mit RPE und äußerer Netzhautatrophie zu etablieren, ähnlich der fortgeschrittenen atrophischen Form der AMD. Wenn ein fokaler Bereich von RPE aus der Makula entfernt wird, schließt sich die RPE-Wunde über die Hypertrophie der verbleibenden RPE-Zellen. Diese Wundheilungsreaktion ist jedoch mit einer Atrophie der äußeren Kernschicht verbunden40. Während die Erstellung eines Tiermodells den Rahmen dieses Manuskripts sprengen würde, kann ein ähnliches Verfahren ein Tiermodell eines fortgeschrittenen atrophischen AMD-Phänotyps für die Prüfung von RPE-abgeleiteten Zelltherapeutika erstellen.
Die Verwendung von Sirolimus, Triamcinolon, Doxycyclin und Minocyclin zur Verringerung der immunogenen Transplantatabstoßung
Es wird angenommen, dass der subretinale Raum eine immunprivilegierte Stelle ist, die durch eine intakte Blut-Netzhaut-Barriere und andere Faktoren aufrechterhalten wird41. In vielen Studien zur subretinalen Transplantation von Stammzellderivaten mit einer intakten Blut-Netzhaut-Schranke spielen Immunsuppressiva eine vernachlässigbare Rolle beim Überleben des Transplantats42. Es wird angenommen, dass die äußere Blut-Netzhaut-Barriere durch die native RPE-Schicht und die Tight Junctions zwischen den RPE-Zellen gebildet wird. Während die native RPE-Entfernung eine bessere Integration der transplantierten RPE- und Wirtsphotorezeptoren ermöglicht, wird die Blut-Netzhaut-Barriere dabei gestört, was die Wahrscheinlichkeit einer Immunabstoßung erhöht. Klassischerweise sind T-Zellen von zentraler Bedeutung für den Prozess der Transplantatabstoßung anderer Organe wie Niere und Leber43. Daher zielten die anfänglichen immunsuppressiven Therapien für die Transplantation von Netzhautgewebe darauf ab, diese adaptiven Immunantworten zu reduzieren.
Sirolimus, ein mechanistisches Ziel des Rapamycin-Inhibitors, und Tacrolimus, ein Calcineurin-Inhibitor, sind Beispiele für immunsuppressive Medikamente, die auf adaptive Immunantworten abzielen. Trotz ausreichender T-Zell-Suppression bleiben die Überlebensraten der Transplantate jedoch niedrig. Darüber hinaus ist bekannt, dass RPE-Zellen die T-Zell-Aktivierung durch die Freisetzung hemmender Faktoren unterdrücken und die Bildung von regulatorischen T-Zellen fördern44. Daher wird immer deutlicher, dass die adaptive Immunität möglicherweise nicht der einzige Beitrag zur Transplantatabstoßung ist42. Die subretinale Transplantation zellulärer Produkte kann zur Akkumulation und Aktivierung von Mikroglia führen45.
Mikroglia sind die Makrophagen der Netzhaut. Sie bestehen aus zwei Hauptpopulationen: 1) den perivaskulären Mikroglia des inneren retinalen Gefäßsystems und 2) den Mikroglia innerhalb des retinalen Gewebeparenchyms. Da Mikroglia Teil der angeborenen Immunantwort sind, können intravitreale Glukokortikoide wie Triamcinolon die zytokinvermittelte Proliferation unterdrücken46. Doxycyclin und Minocyclin können auch die Mikroglia-Aktivierung unterdrücken und sollten in Betracht gezogen werden47,48. Schließlich sind die Unterschiede in der Immunabstoßung von RPE-Allotransplantaten im Vergleich zu Xenotransplantaten unvollständig verstanden49. Zum Beispiel wurden Alloantikörper gegen induzierte pluripotente Stammzell-abgeleitete RPE-Zellen im Serum von In-vivo-Immunabstoßungsmodellen berichtet. Die Rolle dieser Antikörper und die Bedeutung der Antikörper-vermittelten Abstoßung für das Überleben des Transplantats bleibt jedoch unbekannt50. Daher wird ein Multidrug-Regime unter Verwendung von Sirolimus zur Unterdrückung der adaptiven Immunität und einer Kombination aus Triamcinolon, Doxycyclin und Minocyclin zur unterdrückung der angeborenen Immunität vorgeschlagen. Dieses Regime wurde erfolgreich bei Kaninchen mit guten Überlebensergebnissen bei Transplantaten und minimalen systemischen Wirkungen angewendet11.
Einschränkungen dieser Operationstechnik
Dieses Papier beschreibt eine mögliche chirurgische Methode, um ein RPE-Transplantatblatt in den subretinalen Raum von NHP zu liefern; Dies bedeutet jedoch nicht, dass dies der einzige optimierte Weg ist. Verschiedene Vitreo-Netzhautchirurgen können andere Präferenzen für Instrumentierung und Technik haben. Zum Beispiel kann dieses Implantationsgerätdesign nur flache Implantate liefern, die mit einem steiferen Zellträger unterstützt werden, und ist daher möglicherweise nicht für relativ flexible (oder gerollte) Implantate geeignet. RPE-Suspensionstransplantationen können einen Großteil dieser Technik weglassen. Dementsprechend müssen chirurgische Details basierend auf jeder Verabreichungsstrategie geändert werden.
Da das Interesse an zellulären Therapeutika zur Behandlung degenerativer Netzhauterkrankungen weiter zunimmt, wird das NHP-Tiermodell in präklinischen Studien für die Untersuchung der Faktoren, die das Überleben von RPE-Transplantaten beeinflussen, von entscheidender Bedeutung sein. In diesem Manuskript werden Strategien vorgeschlagen, um die reibungslosere Abgabe eines submakulären Monolayer-RPE-Transplantats im NHP-Auge zu ermöglichen. Methoden zur besseren Visualisierung intraoperativer Komplikationen werden ebenfalls empfohlen. Es wird erwartet, dass sich diese Methoden weiter verbessern werden, wenn der Einsatz von Zelltherapeutika zunimmt. Zukünftige Methodenpapiere sollten auch in Betracht ziehen, eine umfassende Liste von Untersuchungen vorzuschlagen, um verschiedene strukturelle und funktionelle Aspekte des Transplantats zu bewerten.
Offenlegungen
Boris Stanzel besitzt ein US-Patent 9980851 auf einem Instrument (RPE-Abstreifer), das in dieser Studie verwendet wird. Ehrenredner von C. Zeiss Meditec und Geuder bis Boris Stanzel. Die anderen Autoren haben keinen Interessenkonflikt zu erklären.
Danksagungen
Diese Studie wurde unterstützt von IAF-PP (HMBS Domain) (OrBID): OculaR BIomaterials and Device, A*STAR, Singapur (H17/01/a0/013), dem NUS Start-up Grant NUHSRO/2016/100/SU/01, NUHS Clinical Scientist Program (NCSP) Grant und National Research Foundation Competitive Research Programme, Singapur (NRF-CRP21-2018-0008) an X.S., Hong Leong Endowed Professorship Funds an G.E.H. und B.V.S. Wir möchten dem Veterinärteam der Translational Pre-Clinical Model Platform (Singapore Eye Research Institute, Singapur) für die Unterstützung bei der Vorbereitung von NHP-Operationen und der Tiernachsorge danken. Wir danken Jill Teo und den Kollegen von C. Zeiss Meditec Singapore für die technische Unterstützung des OPMI-Lumera 700 mit integriertem intraoperativem OCT-Gerät.
Materialien
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
Referenzen
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten