Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nekrotizan Enterokolit'in Yenidoğan BALB/c Fare Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Nekrotizan enterokolit (NEC), prematüre bebeklerde, özellikle çok düşük doğum ağırlıklı bebeklerde, yüksek mortalite ve belirsiz patogenez ile sıklıkla ortaya çıkan en şiddetli gastrointestinal (GI) hastalıktır. NEC'in nedeni inflamatuar immün düzenleyici sistem anormallikleri ile ilgili olabilir. Bir NEC hayvan modeli, NEC hastalığı bağışıklık araştırmaları için vazgeçilmez bir araçtır. NEC hayvan modelleri genellikle C57BL /6J yenidoğan fareleri kullanır; BALB/c yenidoğan fareleri nadiren kullanılır. İlgili çalışmalar, fareler enfekte olduğunda, BALB / c farelerinde C57BL / 6J farelere kıyasla Th2 hücre farklılaşmasının baskın olduğunu göstermiştir. Çalışmalar, NEC'in oluşumu ve gelişiminin T yardımcı tip 2 (Th2) hücrelerindeki artışla ilişkili olduğunu ve genellikle enfeksiyon eşlik ettiğini ileri sürmektedir. Bu nedenle, bu çalışmada neonatal BALB/c fareleri, NEC'li çocuklarda gözlemlenenlerle benzer klinik özelliklere ve bağırsak patolojik değişikliklere sahip bir NEC modeline neden olmak için kullanılmıştır. Bu hayvan modelinin NEC'deki Th2 hücre yanıtlarını incelemek için kullanılıp kullanılamayacağını belirlemek için daha fazla çalışma yapılması garanti edilir.
Özet
Nekrotizan enterokolit (NEC), prematüre bebeklerde, özellikle çok düşük doğum ağırlıklı bebeklerde, yüksek mortalite ve belirsiz patogenez ile sıklıkla ortaya çıkan en şiddetli gastrointestinal (GI) hastalıktır. NEC'in nedeni inflamatuar immün düzenleyici sistem anormallikleri ile ilgili olabilir. Bir NEC hayvan modeli, NEC hastalığı bağışıklık araştırmaları için vazgeçilmez bir araçtır. NEC hayvan modelleri genellikle C57BL /6J yenidoğan fareleri kullanır; BALB/c yenidoğan fareleri nadiren kullanılır. İlgili çalışmalar, fareler enfekte olduğunda, BALB / c farelerinde C57BL / 6J farelere kıyasla Th2 hücre farklılaşmasının baskın olduğunu göstermiştir. Çalışmalar, NEC'in oluşumu ve gelişiminin T yardımcı tip 2 (Th2) hücrelerindeki artışla ilişkili olduğunu ve genellikle enfeksiyon eşlik ettiğini ileri sürmektedir. Bu nedenle, bu çalışmada neonatal BALB/c fareleri, NEC'li çocuklarda gözlemlenenlerle benzer klinik özelliklere ve bağırsak patolojik değişikliklere sahip bir NEC modeline neden olmak için kullanılmıştır. Bu hayvan modelinin NEC'deki Th2 hücre yanıtlarını incelemek için kullanılıp kullanılamayacağını belirlemek için daha fazla çalışma yapılması garanti edilir.
Giriş
En şiddetli gastrointestinal (GI) hastalık olan nekrotizan enterokolit (NEC), prematüre bebeklerin çoğunda (%>90), özellikle de çok düşük doğum ağırlığına (VLBW) sahip bebeklerde görülür 1. VLBW bebeklerde hastalığın görülme sıklığı %10 ile %12 arasında değişmektedir ve NEC tanısı alan çocukların mortalitesi %20 ile %30 arasında 2,3'tür. NEC'in nedeni mukozal yaralanmalar, patojenik bakterilerin istilası ve bağırsak beslenmesi ile ilgili olabilir, bu da enflamatuar yanıtlara ve hassas konaklarda bağırsak yaralanmalarının indüksiyonuna yol açabilir3. NEC patogenez belirsizdir. İlgili araştırmalar, etkilenen bebeğin immün yanıtının anormal olduğunu ve genetik duyarlılık, mikrovasküler gerginlik ve bağırsak bakteri değişikliklerinin hastalıkta önemli roller oynayabileceğini göstermektedir3.
NEC hayvan modeli, NEC patogenezini araştırmak için vazgeçilmez bir araçtır. NEC modelleri için kullanılan hayvan türleri domuzlar, sıçanlar ve farelerdir. Bununla birlikte, uzun gebelik süresi, büyüme döngüleri ve yüksek maliyetler nedeniyle, son yıllarda domuzlar NEC modelleri için ilk tercih olmamıştır ve sıçanlar veya farelerle değiştirilmiştir4. Farklı fare suşlarının bağışıklık arka planında farklılıklar olduğu için5, farklı çalışmaların NEC hayvan modelleri oluşturmak için farklı fare suşları kullanması gerekir. BALB/c fareleri önemli bir özelliğe sahiptir; enfekte olduklarında veya dış hasarla başa olduklarında, farelerde enfeksiyon sırasında TH2 hücrelerinin polarizasyonu, diğer fare suşlarındakinden önemli ölçüde daha güçlüdür6,7,8. T yardımcı hücreleri NEC'in oluşumunda ve ilerlemesinde, özellikle TH2 hücrelerinin gelişiminde çok önemli bir rol oynar3,9,10,11. Bu nedenle, bu çalışmada T hücreleri üzerinde NEC hastalığı araştırmaları için yararlı olabilecek NEC modelini oluşturmak için BALB / c fareleri kullanılmıştır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu araştırma Guangzhou Kadın ve Çocuk Tıp Merkezi Tıbbi Etik Komitesi (NO. 174A01) ve Guangzhou Forevergen Biyobilim laboratuvarı Hayvan Merkezi Hayvan Etik Komitesi (IACUC-G160100) tarafından onaylanmıştır. Tüm hayvanlar belirli bir patojen içermeyen (SPF) ortamda aynı odada yetiştirildi ve deneyler geleneksel bir ortamda gerçekleştirildi. Üreme için kullanılan fareler 7-8 haftalıktı; NEC (n = 72) indüklemek için fareler 4. günde barajdan ayrılmış ve barajlar (n=14) orijinal kafeste tutularak kontrol (Cont.) grubu fareleri (n=24) emzirilmiştir.
1. Reaktiflerin ve cihazların hazırlanması
- BALB/c fareleri için süt ikamesini ilgili oranda hazırlayın (prematüre bebek sütü tozu: keçi sütü tozu = 2:1).
NOT: Formula milk12'nin son besin bileşimleri Tablo 1'de gösterilmiştir. - LPS çözeltisi (2,5 mg/mL)
- 4 mL sterilize edilmiş çift damıtılmış suda toplam 10 mg LPS toz çözün, iyice karıştırın ve aliquoting'den sonra -20 °C'de bir buzdolabında saklayın.
NOT: LPS çözeltisi, anında kullanım için 2-8 °C'de veya uzun süreli depolama için -20 °C'de karanlıkta saklanır.
- 4 mL sterilize edilmiş çift damıtılmış suda toplam 10 mg LPS toz çözün, iyice karıştırın ve aliquoting'den sonra -20 °C'de bir buzdolabında saklayın.
2. Yenidoğan BALB/c farelerinde nekrotizan enterokolit indükle
- Yenidoğan fareleri besleyin.
- Yenidoğan fareleri, 0-4.
- 4. Gün gecesi (yenidoğan fareleri 2,5-3 g ağırlığındayken), NEC grubundaki yenidoğan farelerini NEC'i indüklemek için barajdan ayırın, bir hayvan inkübatöründe tutun ve formülle besleyin. Ancak, Cont. grubunun barajda kalmasına ve beslenmesine izin verilir.
NOT: Barajdan ayrılan yenidoğan fareleri, zayıf vücut ısısı düzenlemeleri nedeniyle bir inkübatörde yetiştirilmelidir.
- Gavage tüpünü % 75 alkol kaplarına 1-2 dakika bekleterek hazırlayın ve temiz, çift damıtılmış suda iki kez yıkayın.
NOT: Fareler arasında çapraz kontaminasyonu önlemek için, yukarıdaki işlem her fareyi besledikten sonra yapılmalıdır. - NEC modelini teşvik edin.
- Yenidoğan farelerini 4.
- Fareleri LPS (bir seferde 20-30 μL) ile yapıştırın ve 5. günde (bir seferde 40-50 μL) formülle besleyin.
- 5. günden itibaren, fareleri 5 gün boyunca günde iki kez hipoksi-reoksijenasyon-soğuk şok döngüsüne tabi edin. Fareleri 90 s için% 5 O2'de bir hipoksi cihazına yerleştirin ve 3 dakika boyunca reoksijene edin; bu işlemi beş kez tekrarlayın. Daha sonra, fareleri 15 dakika boyunca 4 ° C'lik bir ortama yerleştirin ve ardından bir inkübatöre aktarın. İndüksiyon işlemi için Şekil 1A,B'ye bakın.
NOT: Hipoksi-reoksijenasyon-soğuk stimülasyon döngüsü sabah bir kez ve öğleden sonra bir kez gerçekleştirildi. Kapta % 95 N2 ile% 5 O2 karışımı hazırlandı ve konsantrasyon bir oksijen dedektörü ile ölçüldü.
- Tüm fareleri yakından gözlemleyin, her gün tartın, indüksiyon döneminde farelerin hayatta kalmasını kaydedin ve dışkı özelliklerini kaydedin (yapışkan dışkı / kanlı dışkı ile veya olmadan).
NOT: Kurulan NEC modeli 5 gün sürer. - 10. gün veya daha önce, fareler NEC semptomları gösterdiğinde (ileus, hematochezia, ishal)13, fareleri izofluran ile inhalasyon anestezisi ile ötenazi edin, sonra hemen bağırsak dokusunu toplayın. Kendiliğinden ölen farelerden doku toplamayın.
NOT: Bu çalışmada, fare öthenazisinin bitiş noktası, fare tüm vücudun hematochezia ve siyanoz gösterdiğinde uyarlanmıştır.
3. Fareyi gavage
- Mide tüpünü sağ elinde tutarak fare kafasını sabitle. Mide tüpünü farenin ağzının sol köşesinden yerleştirin.
NOT: Kafa, farenin kafasındaki işaret parmağıyla sabitlendi ve farenin çalışma sırasında öne doğru eğilmesini ve mide tüpünün takılmasını etkilemesini önlemek için hafifçe geriye ve aşağıya bastırıldı. - Tüpü yavaşça ağzın ortasına hareket ettirin. Tüpü yaklaşık 2-3 cm yerleştirdikten sonra, sindirim sistemine 40-50 μL formül veya 20-30 μL LPS itin. Gavage için Şekil 2A,B'ye bakın.
NOT: Normal şartlarda mide tüpü sindirim sistemine sorunsuz bir şekilde yerleştirilir. Fare güçlü bir kusma refleksine sahipse, mide tüpü yanlışlıkla nefes borusuna yerleştirilmiştir. Mide tüpü yavaşça çekilmeli ve farenin tekrar gavage denemeden önce bir süre dinlenmesine izin verilmelidir. Ek olarak, gavage prosedürü farelerin ötanazisinden önce NEC modelini teşvik etmek için kullanılır.
4. Hematoksilin ve eozin (H&E) lekelenmesi için taze bağırsak dokusu örnekleri toplayın
- Fareden taze ileum dokusunu 24 saat boyunca% 10 formalin içine daldırin.
- Dokuları parafin içine katıştırın ve 4 μm bölümlere dilimleyin.
- Ksilendeki bölümleri ayrıştırın ve mutlak etanol, % 95 etanol,% 80 etanol, % 70 etanol ve damıtılmış suda art arda yeniden sulandırarak her adımda 5 dakika bekletin. Bölümleri hematoksilin çözeltisi ile 5 dakika boyunca lekelendirin ve 5 s için% 75 alkolde% 1 hidroklorik asitte ayırt edin. Son olarak, onları 1 dakika boyunca eosin çözeltisi ile lekelayın.
NOT: Hematoksilin çözeltisi ile lekelendikten sonra, aşırı bağlı hematoksilin çözeltisi ve sitoplazmik hematoksilin boyasını çıkarmak için etanolde% 1 hidroklorik asit ile ayırt edilmelidir. % 1 hidroklorik asit konsantrasyonu bağırsak dokusu için uygundur. - 40x büyütmede bağırsak dokusunun histopatolojisini inceleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
BALB/c fare NEC modeli formül besleme, LPS besleme, hipoksi ve soğuk stimülasyon ile indüklendi. İndüksiyon döneminde, fareler bağırsak patolojisi, dışkı özellikleri, vücut ağırlığı değişiklikleri ve günlük sağkalım için gözlendi. NEC indüksiyonu sırasında ince bağırsağın temsili görüntüleri; resimdeki sayılar 0 (normal epitel) ile 4 (en şiddetli) arasında bağırsak patolojisi skorunu temsil eder (Şekil 3A). Bağırsak patolojisi skoru NEC grubunda K...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
NEC, özellikle prematüre bebeklerde görülme sıklığı ve mortalitesi yüksek olan yenidoğanlarda en sık görülen gastrointestinal sistem acil durumudur1,2,3. Bununla birlikte, patogenez hala belirsizdir. Şu anda mukozal hasar, patojen istilası ve enteral beslemenin NEC3 için yüksek riskli faktörler olduğuna inanılmaktadır. Bugüne kadar, NEC modeli için kullanılan hayvanlar çoğunlukla...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Yazarlar, klinik örneği sağladığı için Guangzhou Kadın ve Çocuk Tıp Merkezi Klinik Biyolojik Kaynak Bankası'na ve fare sağladığı için Guangzhou Forevergen Biyobilimler Laboratuvarı Hayvan Merkezi'ne teşekkür ediyor. Bu araştırma, Çin Ulusal Doğa Bilimleri Vakfı hibe 81770510 (R.Z.) tarafından desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
Referanslar
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035(2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776(2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494(2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794(2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
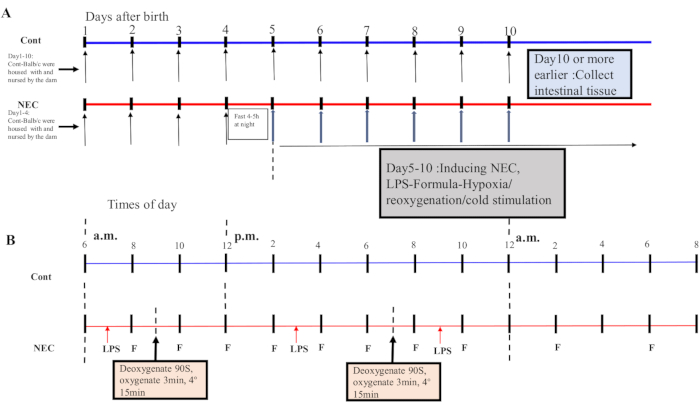
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır