Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein neonatales BALB/c-Mausmodell der nekrotisierenden Enterokolitis
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Nekrotisierende Enterokolitis (NEC) ist die schwerste gastrointestinale (GI) Erkrankung, die häufig bei Frühgeborenen auftritt, insbesondere bei Säuglingen mit sehr niedrigem Geburtsgewicht, mit hoher Mortalität und unklarer Pathogenese. Die Ursache von NEC kann mit entzündlichen Anomalien des Immunregulationssystems zusammenhängen. Ein NEC-Tiermodell ist ein unverzichtbares Werkzeug für die Immunforschung von NEC-Erkrankungen. NEC-Tiermodelle verwenden normalerweise C57BL/6J-Neugeborenenmäuse; BALB/c neonatale Mäuse werden selten verwendet. Verwandte Studien haben gezeigt, dass bei einer Infektion von Mäusen die Th2-Zelldifferenzierung bei BALB/c-Mäusen im Vergleich zu C57BL/6J-Mäusen vorherrscht. Studien haben gezeigt, dass das Auftreten und die Entwicklung von NEC mit einem Anstieg der T-Helfer-Typ-2-Zellen (Th2) verbunden sind und im Allgemeinen von einer Infektion begleitet werden. Daher verwendete diese Studie neonatale BALB/c-Mäuse, um ein NEC-Modell mit ähnlichen klinischen Merkmalen und intestinalen pathologischen Veränderungen zu induzieren, wie sie bei Kindern mit NEC beobachtet wurden. Weitere Studien sind gerechtfertigt, um festzustellen, ob dieses Tiermodell verwendet werden könnte, um Th2-Zellantworten in NEC zu untersuchen.
Zusammenfassung
Nekrotisierende Enterokolitis (NEC) ist die schwerste gastrointestinale (GI) Erkrankung, die häufig bei Frühgeborenen auftritt, insbesondere bei Säuglingen mit sehr niedrigem Geburtsgewicht, mit hoher Mortalität und unklarer Pathogenese. Die Ursache von NEC kann mit entzündlichen Anomalien des Immunregulationssystems zusammenhängen. Ein NEC-Tiermodell ist ein unverzichtbares Werkzeug für die Immunforschung von NEC-Erkrankungen. NEC-Tiermodelle verwenden normalerweise C57BL/6J-Neugeborenenmäuse; BALB/c neonatale Mäuse werden selten verwendet. Verwandte Studien haben gezeigt, dass bei einer Infektion von Mäusen die Th2-Zelldifferenzierung bei BALB/c-Mäusen im Vergleich zu C57BL/6J-Mäusen vorherrscht. Studien haben gezeigt, dass das Auftreten und die Entwicklung von NEC mit einem Anstieg der T-Helfer-Typ-2-Zellen (Th2) verbunden sind und im Allgemeinen von einer Infektion begleitet werden. Daher verwendete diese Studie neonatale BALB/c-Mäuse, um ein NEC-Modell mit ähnlichen klinischen Merkmalen und intestinalen pathologischen Veränderungen zu induzieren, wie sie bei Kindern mit NEC beobachtet wurden. Weitere Studien sind gerechtfertigt, um festzustellen, ob dieses Tiermodell verwendet werden könnte, um Th2-Zellantworten in NEC zu untersuchen.
Einleitung
Nekrotisierende Enterokolitis (NEC), die schwerste gastrointestinale (GI) Erkrankung, tritt bei den meisten Frühgeborenen (>90%) auf, insbesondere bei Solchen mit sehr niedrigem Geburtsgewicht (VLBW)1. Bei VLBW-Säuglingen liegt die Inzidenz der Krankheit zwischen 10% und 12%, und die Mortalität von Kindern, bei denen NEC diagnostiziert wurde, liegt zwischen 20% und 30% 2,3. Die Ursache von NEC kann mit Schleimhautverletzungen, dem Eindringen pathogener Bakterien und der Darmfütterung zusammenhängen, die bei anfälligen Wirten zu Entzündungsreaktionen und der Induktion von Darmverletzungen führen können3. Die Pathogenese von NEC ist unklar. Relevante Untersuchungen zeigen, dass die Immunantwort des betroffenen Säuglings abnormal ist und genetische Anfälligkeit, mikrovaskuläre Spannung und bakterielle Veränderungen des Darms eine wichtige Rolle bei der Krankheit spielen können3.
Das NEC-Tiermodell ist ein unverzichtbares Werkzeug für die Erforschung der Pathogenese von NEC. Die Tierarten, die für NEC-Modelle verwendet werden, sind Schweine, Ratten und Mäuse. Aufgrund der langen Tragzeit, der Wachstumszyklen und der hohen Kosten waren Schweine in den letzten Jahren jedoch nicht die erste Wahl für NEC-Modelle und wurden durch Ratten oder Mäuse ersetzt4. Da es Unterschiede im Immunhintergrund verschiedener Mausstämme5 gibt, müssen verschiedene Studien verschiedene Mäusestämme verwenden, um NEC-Tiermodelle zu erstellen. BALB/c-Mäuse haben eine wichtige Eigenschaft; Wenn sie infiziert sind oder mit äußeren Schäden fertig werden, ist die Polarisation von TH2-Zellen während der Infektion bei Mäusen signifikant stärker als bei anderen Mäusestämmen6,7,8. T-Helferzellen spielen eine entscheidende Rolle beim Auftreten und Fortschreiten von NEC, insbesondere bei der Entwicklung von TH2-Zellen3,9,10,11. Daher verwendete diese Studie BALB / c-Mäuse, um das NEC-Modell zu etablieren, das für die NEC-Krankheitsforschung an T-Zellen hilfreich sein könnte.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Diese Forschung wurde vom Medical Ethics Committee des Guangzhou Women and Children's Medical Center (Nr. 174A01) und dem Animal Ethical Committee des Guangzhou Forevergen Biosciences Laboratory Animal Center (IACUC-G160100) genehmigt. Alle Tiere wurden im selben Raum in einer spezifischen pathogenfreien Umgebung (SPF) gezüchtet und Experimente wurden in einer konventionellen Umgebung durchgeführt. Die zur Zucht verwendeten Mäuse waren 7-8 Wochen alt; die Mäuse zur Induktion von NEC (n = 72) wurden am Tag 4 vom Muttertier getrennt, und die Muttertiere(n=14) wurden im ursprünglichen Käfig gehalten und die Mäuse der Kontrollgruppe (Fortsetzung) (n=24) gepflegt.
1. Herstellung von Reagenzien und Produkten
- Bereiten Sie den Milchersatz für die BALB/c-Mäuse im entsprechenden Verhältnis vor (Frühgeborenenmilchpulver: Ziegenmilchpulver = 2:1).
ANMERKUNG: Die endgültigen Nährstoffzusammensetzungen der Formel Milch12 sind in Tabelle 1 aufgeführt. - LPS-Lösung (2,5 mg/ml)
- Insgesamt 10 mg LPS-Pulver in 4 ml sterilisiertem doppelt destilliertem Wasser auflösen, gut mischen und nach Aliquotierung bei -20 °C im Kühlschrank aufbewahren.
HINWEIS: Die LPS-Lösung wird im Dunkeln bei 2-8 °C zur sofortigen Anwendung oder bei -20 °C zur Langzeitlagerung gelagert.
- Insgesamt 10 mg LPS-Pulver in 4 ml sterilisiertem doppelt destilliertem Wasser auflösen, gut mischen und nach Aliquotierung bei -20 °C im Kühlschrank aufbewahren.
2. Nekrotisierende Enterokolitis bei neonatalen BALB/c-Mäusen induzieren
- Füttern Sie die neonatalen Mäuse.
- Halten Sie die neugeborenen Mäuse im selben Käfig wie die Mutter, die an den Tagen 0-4 von der Mutter gestillt wird.
- Trennen Sie in der Nacht von Tag 4 (wenn die neonatalen Mäuse 2,5-3 g wiegen) die neonatalen Mäuse in der NEC-Gruppe vom Muttertier, um NEC zu induzieren, halten Sie sie in einem tierischen Inkubator und füttern Sie sie mit Formel. Die Cont.-Gruppe darf jedoch beim Damm bleiben und von ihm gefüttert werden.
HINWEIS: Neugeborene Mäuse, die vom Muttertier getrennt sind, müssen aufgrund ihrer schwachen Körpertemperaturregulation in einem Inkubator aufgezogen werden.
- Bereiten Sie das Gavage-Röhrchen vor, indem Sie es in 75% Alkoholbehältern für 1-2 min einweichen und zweimal in sauberem, doppelt destilliertem Wasser waschen.
HINWEIS: Um eine Kreuzkontamination zwischen den Mäusen zu vermeiden, muss der obige Vorgang nach der Fütterung jeder Maus durchgeführt werden. - Induzieren Sie das NEC-Modell.
- Nehmen Sie die neugeborenen Mäuse an Tag 4 vom Damm und fasten Sie sie für eine Nacht.
- Die Mäuse mit LPS (20-30 μL auf einmal) füttern und sie am Tag 5 mit Formel füttern (40-50 μL auf einmal).
- Ab Tag 5 unterziehen Sie die Mäuse zweimal täglich für 5 Tage einem Hypoxie-Sauerstoff-Kälte-Schock-Zyklus. Legen Sie die Mäuse in ein Hypoxie-Gerät bei 5% O2 für 90 s und reoxygenieren Sie sie für 3 min; Wiederholen Sie diesen Vorgang fünfmal. Als nächstes legen Sie die Mäuse für 15 minuten in eine 4 °C-Umgebung und geben sie dann in einen Inkubator. Siehe Abbildung 1A,B für den Induktionsprozess.
HINWEIS: Ein Zyklus von Hypoxie-Sauerstoff-Kältestimulation wurde einmal am Morgen und einmal am Nachmittag durchgeführt. Im Behälter wurde eine Mischung aus 5% O2 mit 95% N2 hergestellt und die Konzentration mit einem Sauerstoffdetektor gemessen.
- Beobachten Sie alle Mäuse genau, wiegen Sie sie jeden Tag, zeichnen Sie das Überleben der Mäuse während der Induktionsphase auf und zeichnen Sie die Stuhlmerkmale auf (mit oder ohne klebrigen Stuhl / blutigen Stuhl).
HINWEIS: Das etablierte NEC-Modell hat eine Lebensdauer von 5 Tagen. - An Tag 10 oder früher, wenn die Mäuse NEC-Symptome zeigen (Ileus, Hämatochezie, Durchfall)13, euthanasieren Sie die Mäuse durch Inhalationsanästhesie mit Isofluran und sammeln Sie dann sofort das Darmgewebe. Sammeln Sie kein Gewebe von den Mäusen, die spontan gestorben sind.
HINWEIS: In dieser Studie wurde der Endpunkt der Mauseuthenasie angepasst, wenn die Maus Hämatocheziose und Zyanose des ganzen Körpers zeigte.
3. Saugen Sie die Maus
- Fixieren Sie den Mauskopf und halten Sie den Magenschlauch in der rechten Hand. Führen Sie den Magenschlauch aus dem linken Mundwinkel der Maus ein.
HINWEIS: Der Kopf wurde mit dem Zeigefinger am Kopf der Maus befestigt und vorsichtig nach hinten und unten gedrückt, um zu verhindern, dass sich die Maus während der Operation nach vorne beugt und das Einführen des Magenschlauchs beeinträchtigt. - Bewegen Sie die Röhre langsam in die Mitte des Mundes. Nachdem Sie das Röhrchen ca. 2-3 cm eingeführt haben, drücken Sie 40-50 μL Formel oder 20-30 μL LPS in den Verdauungstrakt. Siehe Abbildung 2A,B für die Gavage.
HINWEIS: Unter normalen Umständen wird die Magensonde sanft in den Verdauungstrakt eingeführt. Wenn die Maus einen starken Erbrechensreflex hat, wurde die Magensonde versehentlich in die Luftröhre eingeführt. Die Magensonde muss vorsichtig herausgezogen werden und die Maus muss eine Weile ruhen lassen, bevor sie erneut versucht, zu fressen. Darüber hinaus wird das Gavage-Verfahren verwendet, um das Modell des NEC vor der Euthanasie von Mäusen zu induzieren.
4. Sammeln Sie frische Darmgewebeproben für die Hämatoxylin- und Eosin (H & E) -Färbung
- Tauchen Sie das frische Ileumgewebe der Maus für 24 h in 10% Formalin ein.
- Betten Sie die Gewebe in Paraffin ein und schneiden Sie sie in 4 μm Abschnitte.
- Entparaffinisieren Sie die Abschnitte in Xylol und rehydrieren Sie sie nacheinander in absolutem Ethanol, 95% Ethanol, 80% Ethanol, 70% Ethanol und destilliertem Wasser, wobei sie in jedem Schritt 5 min einweichen. Färben Sie die Abschnitte mit Hämatoxylinlösung für 5 min und differenzieren Sie sie in 1% Salzsäure in 75% Alkohol für 5 s. Zum Schluss färben Sie sie mit Eosinlösung für 1 min.
HINWEIS: Nach der Färbung mit Hämatoxylinlösung muss es mit 1% Salzsäure in Ethanol unterschieden werden, um übermäßig gebundene Hämatoxylinlösung und zytoplasmatischen Hämatoxylinfarbstoff zu entfernen. Die Konzentration von 1% Salzsäure ist für darmgewebe geeignet. - Untersuchen Sie die Histopathologie des Darmgewebes bei 40-facher Vergrößerung.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Das BALB/c-Maus-NEC-Modell wurde durch Formelfütterung, LPS-Fütterung, Hypoxie und Kältestimulation induziert. Während der Induktionsphase wurden die Mäuse auf Darmpathologie, Stuhlmerkmale, Körpergewichtsveränderungen und tägliches Überleben beobachtet. Repräsentative Bilder des Dünndarms während der NEC-Induktion; Die Zahlen im Bild stellen den Darmpathologie-Score von 0 (normales Epithel) bis 4 (am schwersten) dar (Abbildung 3A). Der intestinale Pathologie-Score war in der NEC...
Access restricted. Please log in or start a trial to view this content.
Diskussion
NEC ist der häufigste Notfall im Magen-Darm-System für Neugeborene mit einer hohen Inzidenz und Mortalität, insbesondere bei Frühgeborenen1,2,3. Seine Pathogenese ist jedoch noch unklar. Es wird derzeit angenommen, dass Schleimhautschäden, Erregerinvasion und enterale Fütterung Hochrisikofaktoren für NEC3 sind. Bis heute sind die Tiere, die für das NEC-Modell verwendet werden, hauptsächlich Schwe...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken der Clinical Biological Resource Bank des Guangzhou Women and Children's Medical Center für die Bereitstellung der klinischen Probe und dem Guangzhou Forevergen Biosciences Laboratory Animal Center für die Bereitstellung von Mäusen. Diese Forschung wurde durch das Stipendium der National Natural Science Foundation of China 81770510 (R.Z.) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
Referenzen
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035(2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776(2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494(2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794(2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
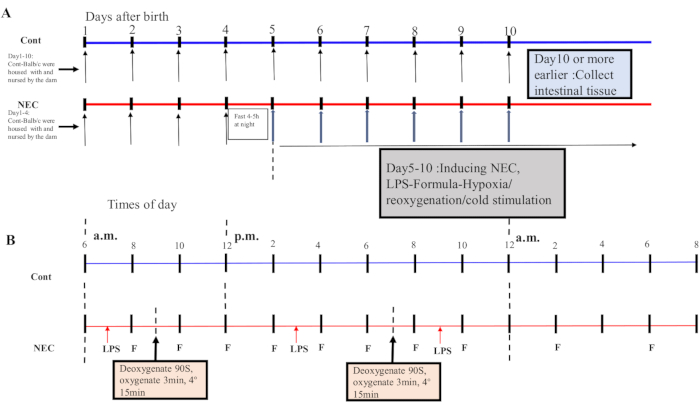
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten